La diabetes gestacional (DG), con una prevalencia de un 9%, se asocia a una elevada morbilidad materna y perinatal. El diagnóstico y el tratamiento precoz de la hiperglucemia materna reducen el riesgo de macrosomía fetal y sus complicaciones intraparto. En el primer trimestre se puede identificar factores de riesgo de DG de la historia materna (edad, obesidad, macrosomía o DG en gestaciones previas, antecedente familiar de diabetes), marcadores bioquímicos (adiponectina, sex hormone-binding globuline y otros) y marcadores biofísicos (arteriografía, adiposidad visceral). Entre los factores de riesgo de macrosomía destacan la obesidad y la diabetes en la historia materna, pregnancy associated plasma protein-A y fracción libre de la subunidad beta de la gonadotropina coriónica humana como marcadores bioquímicos y la translucencia nucal y Doppler de arterias uterinas como marcadores biofísicos. Combinando los marcadores mediante modelos de predicción, y con una tasa de falsos positivos del 10%, se puede alcanzar una tasa de detección del 65 y el 35% para DG y macrosomía, respectivamente.
Gestational diabetes (GD), which has a prevalence of 9%, is associated with high maternal and perinatal morbidity. Early diagnosis and treatment of maternal hyperglycemia reduce the risk of macrosomia and the associated intrapartum complications. Risk factors for GD can be identified in the first trimester from maternal history (age, obesity, previous macrosomia or GD, family history of diabetes), biochemical markers (adiponectin, sex hormone-binding globuline and others), and biophysical markers (arteriography, visceral adiposity). Risk factors for macrosomia include obesity and diabetes in the maternal history, pregnancy associated plasma protein-A and free β subunit of human chorionic gonadotropin as biochemical markers, and nuchal translucency and uterine artery Doppler as biophysical markers. Prediction models combining maternal history, biochemical and biophysical markers can achieve a detection rate of 65% and 35% for GD and macrosomia, respectively, with a false positive rate of 10%.
La prevalencia de la diabetes gestacional (DG) varía en función de los criterios utilizados para su cribado y diagnóstico, la población estudiada, la raza, la edad y el índice de masa corporal (IMC). En los países con economía avanzada, oscila entre un 1,7 y un 11,6%1, y en España se sitúa alrededor de un 9%2.
La DG se asocia a una alta morbilidad a corto y largo plazo, tanto para la madre como para el recién nacido.
Las mujeres con DG tienen un mayor riesgo de preeclampsia durante el embarazo y una mayor tasa de cesárea3. Entre las complicaciones maternas a largo plazo, se ha descrito una asociación con diabetes mellitus tipo 2, hipertensión, obesidad y síndrome metabólico4.
Durante la gestación, una de las complicaciones más graves y frecuentes de la diabetes es el excesivo crecimiento fetal y las complicaciones derivadas de este. Como consecuencia de la hiperglucemia materna, el feto está expuesto a unos niveles elevados de glucosa, que intenta compensar mediante un aumento de secreción de insulina. El crecimiento fetal excesivo provocado por la hiperinsulinemia da lugar a fetos macrosómicos y un mayor riesgo de distocia de hombros, lesión del plexo braquial y asfixia perinatal5. Entre las complicaciones neonatales, se encuentran el síndrome de distrés respiratorio, hipoglucemia e ictericia4. Como efectos a largo plazo, en estos niños se ha observado una mayor prevalencia de obesidad, síndrome metabólico6 y diabetes mellitus tipo 24,7.
El tratamiento mediante dieta de la DG reduce las complicaciones derivadas de esta, principalmente la macrosomía y la distocia de hombros8. En 2005, en un ensayo clínico que aleatorizó a 490 mujeres9, encontró una reducción de un 67% en el número de complicaciones serias perinatales (muerte, distocia de hombros, fractura ósea, parálisis nerviosa) (RR 0,33, p=0,01). En el 2009, otro ensayo clínico que aleatorizó a 958 mujeres con DG mostró una reducción significativa de un 59% en el número de fetos con peso por encima de 4.000g, del 51% de fetos grandes para la edad gestacional, del 21% en la tasa de cesáreas y del 63% en la distocia de hombros10. Asimismo, disminuyó un 54% el diagnóstico de preeclampsia en gestantes con DG.
Las complicaciones perinatales no solo se asocian a gestantes con el diagnóstico establecido de DG, también ocurren asociadas a otros estados de hiperglucemia11. Cuando los niveles de glucemia no alcanzan el umbral establecido para el diagnóstico de DG, como cuando existe un resultado anormal en el test a la hora de sobrecarga de 50g de glucosa, con un test normal de sobrecarga con 100g de glucosa, existe un mayor riesgo de macrosomía, distocia de hombros y cesárea12. En este grupo de mujeres, un tratamiento mediante dieta reduce significativamente la prevalencia de macrosomía respecto a aquellos sin tratamiento13,14.
Ante la evidencia de que la hiperglucemia, a niveles menores de lo que hoy en día se considera una DG, representa un riesgo para el feto, muchos autores, y algunas sociedades, proponen estrategias más agresivas en el cribado y el diagnóstico de la DG, que van desde modificar los métodos de cribado hasta adelantar el cribado y el tratamiento al primer trimestre.
Estrategias de cribado y diagnósticoExisten diferente estrategias para el cribado y el diagnóstico de la DG, y durante años ha habido una falta de uniformidad internacional, habiendo discrepancias en la población cribada (universal vs. alto riesgo), la edad gestacional del cribado, el tipo de test y los puntos de corte de glucemia empleados15. La estrategia utilizada en España y otros países desde hace más de 20 años ha sido la llamada estrategia de 2 pasos, en la que se hace un primer test a la hora de la ingesta de 50g de glucosa (test de O'Sullivan) y, en caso de un resultado positivo (≥ 140mg/dl), se administra una sobrecarga oral de glucosa de 100g y determinación de glucemias basal, a la hora, 2 y 3 h. Este test es realizado entre la semana 24 y 28, salvo en aquellas pacientes de riesgo en las que se realiza, adicionalmente, en el primer trimestre16.
Algunas asociaciones, como la International Association of Diabetes and Pregnancy Study Groups (IADPSG)17, la American Diabetes Association18 y la Organización Mundial de la Salud19 han abogado por un cribado de un solo paso (sobrecarga de 75g de glucosa) y con puntos de corte de glucemia más bajos, apoyándose, por un lado, en los hallazgos del estudio Hyperglycaemia and Adverse Pregnancy Outcome (HAPO)3 y, por otro, en los trabajos de Crowther y de Landon, los cuales, utilizando puntos de corte de glucemia más bajos, demostraron una asociación con resultados perinatales adversos3 y una mejora en los mismos cuando estas mujeres recibieron tratamiento9,10. Esta medida ha sido criticada por asociaciones, como el National Institute of Health20 o el American College of Obstetricians and Gynecologist21, y otros autores22, exponiendo, en primer lugar, una falta de evidencia en la mejora de resultados perinatales con estos criterios diagnósticos y, en segundo lugar, que estos criterios darían lugar a un aumento en el número de casos de DG diagnosticados, para lo cual se debería estar preparado y asumir las implicaciones sobre los sistemas públicos de salud, la práctica médica y el impacto económico23.
En un estudio prospectivo reciente en el que se comparó la prevalencia de DG y los resultados perinatales en una cohorte a la que se aplicó los criterios de la IADPSG, con una cohorte histórica a la que se había aplicado una política de cribado de 2 pasos, ha mostrado un aumento de la prevalencia de DG, con una mejora en los resultados perinatales, incluyendo macrosomía, tasa de cesáreas, tasa de prematuridad y de hipertensión gestacional, siendo coste efectivo24.
Predicción de macrosomíaEl objetivo del cribado de DG es evitar o reducir las complicaciones desarrolladas durante el embarazo, más que evitar las consecuencias a largo plazo. Sin embargo, no solo la diabetes se asocia a fetos macrosómicos, también la obesidad materna es un factor de riesgo independiente. En un estudio multicéntrico español con más de 9.000 gestantes, un 23% de las macrosomías fueron atribuibles a la obesidad materna cuando el IMC era superior a 26kg/m2, mientras que tan solo un 4% eran atribuibles a la DG25. Además, la obesidad materna tiene un efecto sinérgico con la DG para la macrosomía26.
Cribado en el primer trimestreHistoria clínicaLa identificación precoz de la DG y una intervención podrían resultar beneficiosas tanto para el feto como para la madre. Por este motivo, algunas sociedades recomiendan realizar un cribado de DG en la primera visita de embarazo en mujeres de alto riesgo16,27. Entre los factores de riesgo de DG descritos en la literatura se encuentran la edad materna, la obesidad, el antecedente de feto macrosómico, la DG previa, un familiar de primer grado diabético o la pertenencia a grupo étnico con alta prevalencia de diabetes.
En la práctica clínica, existen diferentes estrategias para aplicar los factores de riesgo. Una de ellas consiste en describir factores de riesgo y realizar un test diagnóstico de DG en la primera visita de embarazo a aquellas mujeres que presenten alguno de estos factores, que son clasificadas como gestantes de alto riesgo. Esta estrategia ha sido adoptada en varias guías clínicas16,27. El inconveniente de este método es que la suma de estos factores, o la incorporación de nuevos factores de riesgo, aumenta el porcentaje de falsos positivos o de mujeres clasificadas como alto riesgo.
Otra estrategia es utilizar un sistema de «score» o puntuación, donde a cada factor de riesgo se le asigna una puntuación, y se considera de alto riesgo a aquellas mujeres que superen un punto de corte en la puntuación28,29. Este método puede alcanzar una tasa de detección del 68%, con una tasa de falsos positivos del 29%30.
Y una tercera estrategia, similar a la anterior, es mediante un modelo de predicción, donde a cada factor de riesgo se le asigna un peso específico y se calcula la probabilidad de que una mujer desarrolle una DG, de forma similar al cálculo de riesgo para síndrome de Down. Aquellas con una probabilidad superior a un punto de corte establecido con anterioridad se consideran como alto riesgo31.
Tanto en el modelo de score como en el de predicción, las mujeres de alto riesgo serían sometidas a pruebas diagnósticas de DG, que se pueden realizar de forma precoz, pero disminuye considerablemente el número de mujeres consideradas como alto riesgo. Así, mediante un modelo de predicción, utilizando como punto de corte un riesgo del 2%, la tasa de detección para DG sería de un 75%, con una tasa de falsos positivos (TFP) de un 42%, y para un riesgo de un 4% la tasa de detección sería del 46% y la TFP, un 12%. Los puntos de corte se pueden modificar arbitrariamente31.
Entre los factores de riesgo de la historia materna para la macrosomía fetal, además de a la obesidad y la DG, se incluyen la edad materna, la paridad, el antecedente de macrosomía y la diabetes mellitus preexistente32,33.
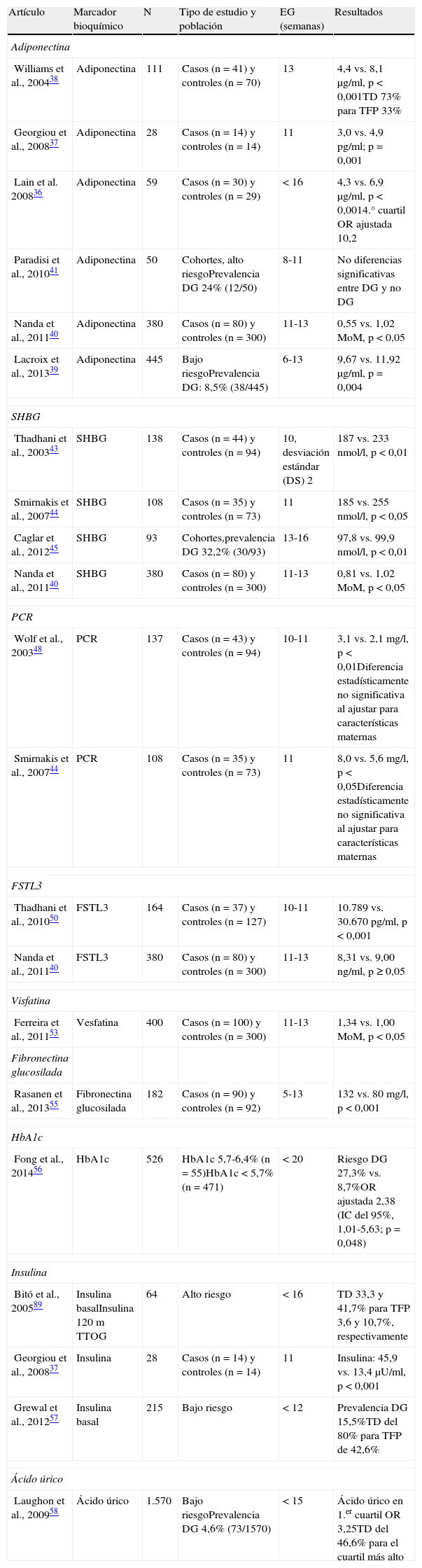
Marcadores bioquímicosEn los últimos años, se han estudiado múltiples marcadores bioquímicos para la predicción de DG y de macrosomía fetal (tabla 1).
Resumen de los estudios publicados sobre marcadores bioquímicos de diabetes gestacional del primer trimestre
| Artículo | Marcador bioquímico | N | Tipo de estudio y población | EG (semanas) | Resultados |
| Adiponectina | |||||
| Williams et al., 200438 | Adiponectina | 111 | Casos (n=41) y controles (n=70) | 13 | 4,4 vs. 8,1μg/ml, p < 0,001TD 73% para TFP 33% |
| Georgiou et al., 200837 | Adiponectina | 28 | Casos (n=14) y controles (n=14) | 11 | 3,0 vs. 4,9 pg/ml; p=0,001 |
| Lain et al. 200836 | Adiponectina | 59 | Casos (n=30) y controles (n=29) | < 16 | 4,3 vs. 6,9μg/ml, p < 0,0014.° cuartil OR ajustada 10,2 |
| Paradisi et al., 201041 | Adiponectina | 50 | Cohortes, alto riesgoPrevalencia DG 24% (12/50) | 8-11 | No diferencias significativas entre DG y no DG |
| Nanda et al., 201140 | Adiponectina | 380 | Casos (n=80) y controles (n=300) | 11-13 | 0,55 vs. 1,02 MoM, p<0,05 |
| Lacroix et al., 201339 | Adiponectina | 445 | Bajo riesgoPrevalencia DG: 8,5% (38/445) | 6-13 | 9,67 vs. 11,92μg/ml, p=0,004 |
| SHBG | |||||
| Thadhani et al., 200343 | SHBG | 138 | Casos (n=44) y controles (n=94) | 10, desviación estándar (DS) 2 | 187 vs. 233 nmol/l, p<0,01 |
| Smirnakis et al., 200744 | SHBG | 108 | Casos (n=35) y controles (n=73) | 11 | 185 vs. 255 nmol/l, p<0,05 |
| Caglar et al., 201245 | SHBG | 93 | Cohortes,prevalencia DG 32,2% (30/93) | 13-16 | 97,8 vs. 99,9 nmol/l, p<0,01 |
| Nanda et al., 201140 | SHBG | 380 | Casos (n=80) y controles (n=300) | 11-13 | 0,81 vs. 1,02 MoM, p<0,05 |
| PCR | |||||
| Wolf et al., 200348 | PCR | 137 | Casos (n=43) y controles (n=94) | 10-11 | 3,1 vs. 2,1 mg/l, p < 0,01Diferencia estadísticamente no significativa al ajustar para características maternas |
| Smirnakis et al., 200744 | PCR | 108 | Casos (n=35) y controles (n=73) | 11 | 8,0 vs. 5,6 mg/l, p < 0,05Diferencia estadísticamente no significativa al ajustar para características maternas |
| FSTL3 | |||||
| Thadhani et al., 201050 | FSTL3 | 164 | Casos (n=37) y controles (n=127) | 10-11 | 10.789 vs. 30.670 pg/ml, p < 0,001 |
| Nanda et al., 201140 | FSTL3 | 380 | Casos (n=80) y controles (n=300) | 11-13 | 8,31 vs. 9,00 ng/ml, p ≥ 0,05 |
| Visfatina | |||||
| Ferreira et al., 201153 | Vesfatina | 400 | Casos (n=100) y controles (n=300) | 11-13 | 1,34 vs. 1,00 MoM, p < 0,05 |
| Fibronectina glucosilada | |||||
| Rasanen et al., 201355 | Fibronectina glucosilada | 182 | Casos (n=90) y controles (n=92) | 5-13 | 132 vs. 80 mg/l, p < 0,001 |
| HbA1c | |||||
| Fong et al., 201456 | HbA1c | 526 | HbA1c 5,7-6,4% (n=55)HbA1c < 5,7% (n=471) | < 20 | Riesgo DG 27,3% vs. 8,7%OR ajustada 2,38 (IC del 95%, 1,01-5,63; p=0,048) |
| Insulina | |||||
| Bitó et al., 200589 | Insulina basalInsulina 120 m TTOG | 64 | Alto riesgo | < 16 | TD 33,3 y 41,7% para TFP 3,6 y 10,7%, respectivamente |
| Georgiou et al., 200837 | Insulina | 28 | Casos (n=14) y controles (n=14) | 11 | Insulina: 45,9 vs. 13,4μU/ml, p < 0,001 |
| Grewal et al., 201257 | Insulina basal | 215 | Bajo riesgo | < 12 | Prevalencia DG 15,5%TD del 80% para TFP de 42,6% |
| Ácido úrico | |||||
| Laughon et al., 200958 | Ácido úrico | 1.570 | Bajo riesgoPrevalencia DG 4,6% (73/1570) | < 15 | Ácido úrico en 1.er cuartil OR 3,25TD del 46,6% para el cuartil más alto |
DG: diabetes gestacional; FSTL3: follistatin-like-3; HbA1c: hemoglobina glucosilada; IC: intervalo de confianza; MoM: múltiplos de la mediana; OR: odds ratio; PCR: proteína C reactiva; SHBG: sex hormone-binding globuline; TD: tasa de detección; TFP: tasa de falsos positivos.
La adiponectina es una proteína con propiedades antiinflamatorias y antiaterogénicas, y sensibilizante de la insulina, y que muestra niveles bajos en individuos con diabetes tipo 234 y mujeres con ovarios poliquísticos35. Además, en sujetos sanos la concentración baja de adiponectina es un factor de riesgo de diabetes tipo 2. En el primer trimestre de gestación, también numerosos estudios han encontrado una asociación entre niveles bajos de adiponectina en gestaciones que posteriormente van a desarrollar DG36–41 o fetos macrosómicos42.
Hay una asociación entre los niveles bajos de sex hormone-binding globuline (SHBG) en el primer trimestre y el riesgo de desarrollar DG40,43–45. Este efecto es, además, independiente de otras características físicas maternas que pueden afectar a los niveles de SHBG, como la edad, el peso, la raza o el tabaquismo, y de otras hormonas que también pueden influir, como la testosterona y el estradiol. Los niveles de SHBG se correlacionan inversamente con la tolerancia a la glucosa, los niveles de insulina y la resistencia a la insulina, y los niveles bajos de SHBG se asocian con el desarrollo de la diabetes tipo 243. Además, una de las ventajas de la SHBG como marcador es que carece de variación diurna, y se puede determinar sin ayuno previo.
La proteína C reactiva (PCR) es un indicador de inflamación sistémica, cuyos niveles se encuentran aumentados en individuos con diabetes tipo 246 y mujeres con ovarios poliquísticos47. La PCR es más alta en primer trimestre de embarazo en aquellas mujeres que van a desarrollar una DG; sin embargo, las diferencias dejan de ser estadísticamente significativas al incluir en un modelo de predicción características maternas que incluyan el IMC, sugiriendo que esta elevación podría ser mediada, en parte, por el aumento del IMC44,48.
La follistatin-like-3 (FSTL3) es una proteína que desempeña un importante papel en la homeostasis de la glucosa49. Aunque en 2010 Thadhani et al. demostraron concentraciones más bajas en primer trimestre en mujeres que desarrollaron DG50; estos resultados no han podido ser reproducidos en estudios posteriores40.
Se han encontrado niveles altos de visfatina en estados de resistencia a la insulina, incluyendo la obesidad y la diabetes mellitus51. Durante el embarazo, la concentración de visfatina es más alta en gestantes a término con DG o con fetos grandes para la edad gestacional52. En primer trimestre también parece haber una mayor concentración de visfatina en mujeres que van a desarrollar una DG53.
En gestaciones con DG se ha descrito una alteración en la secreción de glucoproteínas54. En el primer trimestre de embarazo, la concentración de fibronectina glucosilada es más alta en mujeres que van a presentar una DG, incluso después de ajustar para factores de la historia clínica materna55.
La hemoglobina glucosilada (HbA1c) es una forma de hemoglobina que refleja los niveles plasmáticos de glucosa en un periodo prolongado y suele utilizarse tanto en el cribado de diabetes como en la valoración del control glucémico en pacientes diabéticos. En un estudio de cohortes, niveles elevados de HbA1c (entre el 5,7 y el 6,4%) en el primer trimestre duplicaban el riesgo de desarrollar DG (OR ajustada 2,4) respecto a aquellas mujeres con niveles de HbA1c < 5,7, aunque no se observó una asociación con macrosomía fetal u otros resultados adversos perinatales56.
Hay evidencia de que la hiperinsulinemia del primer trimestre precede a la hiperglucemia del segundo trimestre37,57.
El ácido úrico está, a su vez, aumentado en mujeres que desarrollan DG58.
Otros marcadores bioquímicos estudiados, como la leptina, la resistina, las citocinas, la nitrotirosina, el hidroperóxido lipídico, la 25-hidroxivitamina D y el hierro, no parecen estar alterados en estadios precoces del embarazo en mujeres que van a desarrollar DG36,37,59–61.
Entre los marcadores bioquímicos del cribado de trisomía 21, la concentración de pregnancy associated plasma protein-A (PAPP-A) es más baja en mujeres diabéticas y, por tanto, debe ajustarse para el factor de diabetes materna al calcular los múltiplos de la mediana62–64. Además, la PAPP-A se puede utilizar como marcador de DG en el primer trimestre, puesto que se han encontrado niveles más bajos de esta hormona en el primer trimestre en mujeres que posteriormente desarrollen DG64–68, incluso algunos datos encuentran niveles más bajos en aquellas que van a necesitar tratamiento con insulina69, aunque este dato no parece muy consistente70. En cuanto a la fracción libre de la subunidad beta de la gonadotropina coriónica humana (β-hCG), los resultados son más controvertidos; algunos autores encuentran diferencias entre gestaciones que van a desarrollar DG y las que no67, mientras que otros autores no las encuentran64,68.
Sin embargo, en fetos macrosómicos los niveles de PAPP-A en el primer trimestre son más altos que en fetos con un peso adecuado para la edad gestacional33,71–73.
En mujeres afectadas de diabetes mellitus tipo 1 y tipo 2, se ha observado que aquellas que van a tener fetos macrosómicos presentan niveles normales PAPP-A, PlGF, PP13 y ADAM12, a las 11-13 semanas, y las que tenían fetos con peso adecuado para la edad gestacional presentaban niveles más bajos de estos marcadores74.
Marcadores biofísicosEntre los marcadores biofísicos, se han descrito algunos marcadores fetales, como la longitud cráneo caudal (LCC), la translucencia nucal (TN) y el volumen placentario, y otros maternos, como la adiposidad visceral materna, el Doppler de arterias uterinas o la arteriografía.
La LCC mayor a la esperada por edad gestacional se ha asociado a fetos macrosómicos33,75,76.
La medida de la TN no parece asociarse al posterior desarrollo de DG68,77. Sin embargo, en fetos macrosómicos, la TN en el primer trimestre era mayor que en fetos con peso adecuado para la edad gestacional71–73,75,76.
El volumen placentario en el primer trimestre, adquiriendo las imágenes mediante técnicas de 3D y con posterior análisis con Virtual Organ Computer-Aided Analysis (VOCAL), ha mostrado una relación con las alteraciones del crecimiento fetal78, y los fetos con un tamaño grande para la edad gestacional tienen un mayor volumen placentario a las 11-13 semanas en comparación con los fetos con peso adecuado79. También se ha observado una asociación entre el volumen placentario y la hormona placentaria PAPP-A, lo que indica un aumento no solo de tamaño, sino también de la función placentaria. Sin embargo, el algoritmo de predicción de macrosomía mediante historia clínica y hormonas placentarias no mejora al añadir el volumen placentario, lo que, unido al tiempo que requiere para analizar el volumen placentario, hace que sea un marcador poco operativo en la práctica diaria.
El Doppler de arterias uterinas es un marcador biofísico utilizado en el cribado de preeclampsia y crecimiento intrauterino restringido80. En un estudio con más de 62.000 pacientes, Syngelaki et al. compararon el índice de pulsatilidad (IP) medio de las arterias uterinas a las 11-13 semanas entre mujeres que desarrollaron DG y las que no, y no encontraron diferencias significativas81. Sin embargo, en gestaciones con fetos macrosómicos, el IP medio de arterias uterinas a las 11-13 semanas es más bajo que en gestaciones con fetos con peso adecuado para la edad gestacional72,73.
La adiposidad visceral abdominal, medida mediante ecografía, se asocia a una mayor resistencia a la insulina y a diabetes mellitus. En el primer trimestre de embarazo, la adiposidad visceral, y no la adiposidad subcutánea, se asocia a una intolerancia glucídica a la sobrecarga de 50g de glucosa, y así, una adiposidad en el cuartil más alto se asocia a una OR de 1782.
En gestantes afectadas de DG o con diabetes mellitus tipo 2 se ha descrito una mayor rigidez arterial sistémica en el tercer trimestre, medido mediante el análisis de la onda de pulso y medición del índice de aumento (AIx), y la velocidad de la onda de pulso (pulsed wave velocity [PWV])83,84. Pero algunos de estos cambios podrían también preceder al diagnóstico de la DG, puesto que en mujeres que van a desarrollar DG se han encontrado niveles más altos de PWV y presión aórtica sistólica central a las 11-13 semanas, mientras que no se han encontrado diferencias significativas en el AIx85.
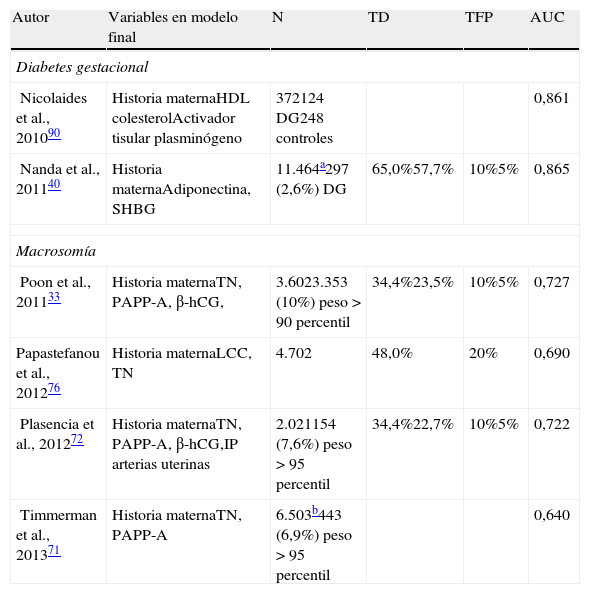
Modelos de predicciónNumerosos estudios han utilizado la capacidad predictiva de la historia clínica y los marcadores bioquímicos y biofísicos combinando toda la información en modelos de predicción tanto para DG como para macrosomía (tabla 2). Estos modelos serían similares a los empleados en el cribado de síndrome de Down a las 11-13 semanas, en el que se combinan factores de la historia clínica materna (edad materna), factores bioquímicos (PAPP-A y β-hCG libre) y factores biofísicos (TN, hueso nasal, Doppler de ductus venoso y regurgitación tricuspídea).
Estudios publicados sobre modelos de predicción de diabetes gestacional y macrosomía fetal mediante combinación de la historia clínica materna, marcadores bioquímicos y marcadores biofísicos
| Autor | Variables en modelo final | N | TD | TFP | AUC |
| Diabetes gestacional | |||||
| Nicolaides et al., 201090 | Historia maternaHDL colesterolActivador tisular plasminógeno | 372124 DG248 controles | 0,861 | ||
| Nanda et al., 201140 | Historia maternaAdiponectina, SHBG | 11.464a297 (2,6%) DG | 65,0%57,7% | 10%5% | 0,865 |
| Macrosomía | |||||
| Poon et al., 201133 | Historia maternaTN, PAPP-A, β-hCG, | 3.6023.353 (10%) peso > 90 percentil | 34,4%23,5% | 10%5% | 0,727 |
| Papastefanou et al., 201276 | Historia maternaLCC, TN | 4.702 | 48,0% | 20% | 0,690 |
| Plasencia et al., 201272 | Historia maternaTN, PAPP-A, β-hCG,IP arterias uterinas | 2.021154 (7,6%) peso > 95 percentil | 34,4%22,7% | 10%5% | 0,722 |
| Timmerman et al., 201371 | Historia maternaTN, PAPP-A | 6.503b443 (6,9%) peso > 95 percentil | 0,640 | ||
β-hCG: fracción libre de la subunidad beta de la gonadotropina coriónica humana; DG: diabetes gestacional; IP: índice de pulsatilidad; LCC: longitud cráneo-caudal; PAPP-A: pregnancy associated plasma protein-A; SHBG: sex hormone-binding globuline; TN: translucencia nucal.
Los modelos de predicción tienen la ventaja de que permiten: 1) asignar un peso individual a cada una de las variables predictoras; 2) calcular un riesgo individualizado para cada paciente, y 3) elegir arbitrariamente a cada centro u organismo público un punto de corte, para el cual habrá una tasa de detección y una tasa de falsos positivos, a partir del cual considerar a la gestante como cribado positivo y tomar las medidas pertinentes. El punto de corte dependerá de los beneficios que se esperan obtener con este cribado, así como de los medios disponibles para asumir los cuidados o pruebas adicionales que precisen estas pacientes.
Los modelos de predicción de DG incluyen factores de la historia clínica materna, como la edad materna, IMC, raza, antecedente de DG, antecedente de feto macrosómico, y marcadores bioquímicos, como la adiponectina y la SHBG, logrando una tasa de detección del 65 y el 58% para tasa de falsos positivos del 10 y el 5%, respectivamente40.
Los modelos de predicción de macrosomía incluyen factores de la historia clínica materna, como edad, peso, talla, raza, antecedente de feto macrosómico, tabaquismo, diabetes mellitus e hipertensión crónica, marcadores biofísicos como la TN y el IP medio de arterias uterinas, y marcadores bioquímicos como la PAPP-A y la β-hCG libre en sangre materna, obteniendo tasas de detección alrededor de un 35 y un 20% para tasas de falsos positivos del 10 y el 5%, respectivamente33,71–73,76.
Cribado y diagnóstico en el primer trimestre: ¿mismos criterios diagnósticos?En el cribado de DG que se lleva a cabo de forma rutinaria entre las 24 y 28 semanas, por un lado, se intenta posponer el diagnóstico para tener una mayor capacidad de detección de la DG, debido a que el efecto diabetógeno del embarazo aumenta con la edad gestacional y, por otro lado, se intenta establecer un diagnóstico precoz para intentar adelantar las medidas terapéuticas y evitar o reducir los efectos adversos sobre el feto y la madre.
Una alternativa sería trasladar el diagnóstico de la diabetes al primer trimestre, donde los puntos de corte, arbitrariamente definidos para diagnosticar la DG, tanto en el test de cribado como en la sobrecarga de glucosa, se deberían adaptar al primer trimestre, donde el efecto diabetógeno del embarazo es menor, pero ya evidente86,87. Así, en el test de cribado, con 50g de glucosa, un punto de corte de 130mg/dl en el primer trimestre tendría una tasa de detección y falsos positivos similar al punto de corte de 140 en el segundo trimestre. Sin embargo, en la sobrecarga oral de glucosa, con 100g de glucosa, unos puntos de corte de 161, 128 y 107mg/dl a la 1, 2 y 3 h, respectivamente, en el primer trimestre, se detectarían un 74% de las DG, con una tasa de falsos positivos de un 27%88.
ConclusiónEn conclusión, la valoración de la mujer gestante a las 11-13 semanas permite iniciar el proceso de cribado de DG y de macrosomía fetal. Para ello, se pueden combinar datos de la historia clínica materna, marcadores biofísicos y marcadores bioquímicos. Aunque con los modelos actuales la tasa de detección es baja, estos modelos suponen la base para futuros modelos en los que la incorporación de nuevos marcadores pueda mejorar la eficacia del cribado. Por otro lado, también está por determinar el beneficio materno y perinatal de identificar y tratar precozmente a las mujeres con alto riesgo de desarrollar tanto una DG como una macrosomía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.