Vale la pena señalar que la incidencia de nacimiento prematuro espontáneo (NPE) no ha experimentado cambios debido al mayor número de neonatos en edad gestacional muy temprana, con peso extremadamente bajo al nacer y en los límites de viabilidad que actualmente estamos incluyendo en nuestras estadísticas, situación que no se había producido nunca en las estadísticas previas. La mejora de los cuidados intensivos neonatales está incrementando también la tendencia hacia el parto prematuro electivo e indicar, por último, que el parto a término no constituye per se un buen indicador del resultado final si tenemos en cuenta que cada día de retraso entre las semanas 22 y 28 de gestación aumenta la supervivencia en un 3%, sin necesidad de llegar a término. Por otra parte, el mito de que los tocolíticos funcionan únicamente 48h surge de la interpretación errónea de un metaanálisis de fármacos betaagonistas, según el cual el período de 48h fue el único hallazgo sistemático encontrado en los 16 artículos examinados a efectos comparativos. Sin embargo, son muchos los tocolíticos que han demostrado ejercer sus efectos más allá de las 48h. Respecto al argumento de que ningún tocolítico ha conseguido disminuir la incidencia de morbimortalidad perinatal, hay que señalar que ninguno de los estudios realizados hasta ahora con tocolíticos estuvieron dotados de la potencia estadística (tamaño muestral) suficiente para poder demostrar ese beneficio.
DIAGNÓSTICO DE PARTO PREMATURO ESPONTÁNEOAnte la sospecha de parto prematuro espontáneo (PPE), se volverá a comprobar con exactitud la fecha prevista para el ingreso dado que disponer del mejor cálculo ayudará a decidir si se debe intervenir o no. El diagnóstico clínico de PPE deberá establecerse sobre la base de:
- 1.
Presencia de contracciones dolorosas y palpables con una duración no superior a 30s, a un ritmo de al menos 4 contracciones cada 20min.
- 2.
Indicios de cambio de posición, consistencia, longitud o dilatación del cuello del útero.
La ecografía transvaginal es una técnica más sensible que el tacto vaginal y la ecografía transabdominal para detectar el acortamiento del conducto cervical (cuello uterino) y el riesgo de NPE.
La determinación de fibronectina fetal (fFN) puede complementar la evaluación clínica. La disponibilidad de la prueba frente a fFN se ha asociado a un menor número de ingresos, menos días de estancia en el hospital y reducción del gasto hospitalario total derivado del manejo del PPE.
La prueba de fFN junto a la realización de ecografía para determinar la longitud del cuello uterino puede ser útil para identificar los casos de alto riesgo de parto prematuro. Pero su utilidad clínica podría residir sobre todo en su valor predictivo negativo, dada la ausencia de opciones terapéuticas eficaces para prevenir el NPE. Teniendo en cuenta el excelente valor predictivo negativo de estas evaluaciones (es decir, cuando la prueba de fibronectina es negativa y la ecografía transvaginal indica una longitud del cuello uterino > 2,5cm), recomendamos retener la terapia tocolítica si la prueba de fibronectina fetal o la ecografía transvaginal indican un bajo grado de riesgo de NPE.
La mujer embarazada acostumbra a percibir las contracciones uterinas como una prueba inminente de PPE. La mayoría acude al hospital para evaluación, más de la mitad serán ingresadas y tratadas y recibirán el alta unos días después sin haber dado a luz. El uso de marcadores bioquímicos y la evaluación ecográfica permiten identificar la mayoría de los casos en los que no existe amenaza de parto prematuro.
La evaluación normalizada y la presentación de pacientes con signos y síntomas de parto prematuro permitirá: a) intervenir a su debido tiempo en caso de amenaza de parto prematuro; b) mantener la seguridad maternofetal; c) disminuir la necesidad de hospitalización reservando el ingreso únicamente para los casos de mayor riesgo de parto prematuro, y d) promover el traslado de embarazadas con amenaza de parto prematuro, para recibir un nivel de atención más elevado y adecuado.
El documento o la herramienta de evaluación del parto prematuro de la Fundación March of Dimes, refrendado por la Sociedad Americana de Medicina Materno-Fetal en 2005, ilustra la metodología clínica desarrollada para determinar la disposición óptima de embarazadas con signos y síntomas de parto prematuro. Los dos objetivos de este documento de evaluación fueron: 1) que las recomendaciones estuvieran basadas en datos científicos, y 2) que la información pudiera utilizarse eficazmente en todos los niveles de servicios que prestan asistencia a pacientes en trabajo de parto prematuro. Como tal, el citado documento incluye dos algoritmos: uno utiliza la prueba de fFN, además de la evaluación clínica; el otro va destinado a un subgrupo de centros que pueden acceder regularmente a servicios fiables de ecografía transvaginal. Ambos algoritmos proporcionan el mismo resultado: determinación de la disposición óptima de embarazadas con signos y síntomas de parto prematuro. Este documento puede obtenerse en la siguiente dirección: www.marchofdimes.com.
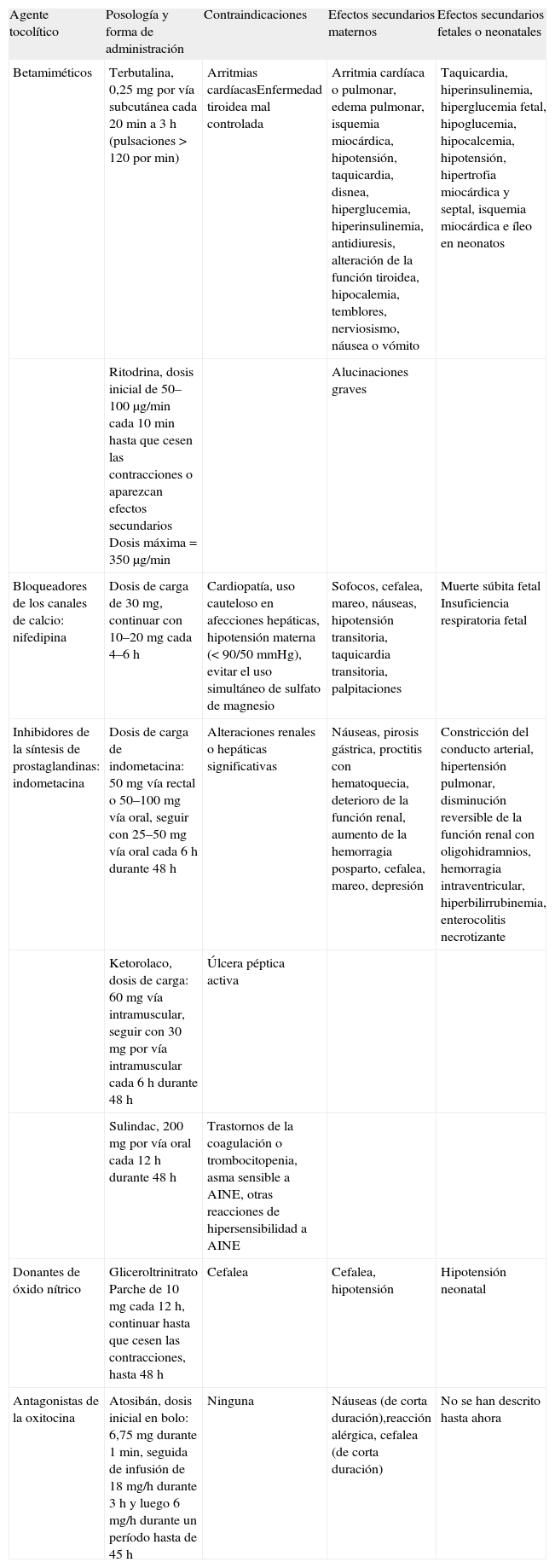
MANEJO Y TRATAMIENTO DEL PARTO PREMATURO ESPONTÁNEOTratamiento con tocolíticos (véase también la tabla 1). Se ha postulado que los efectos producidos por una gran variedad de agentes inhiben las contracciones uterinas. Entre ellos figuran los betaagonistas, los bloqueadores de los canales de calcio, inhibidores de la síntesis de las prostaglandinas, donantes de óxido nítrico y antagonistas de los receptores de oxitocina. Aunque se dispone de poca información fidedigna sobre las prácticas clínicas actuales, el clorhidrato de ritodrina, un betaagonista, continúa siendo probablemente el agente más utilizado en Europa.
Agentes tocolíticos para el manejo del parto prematuro
| Agente tocolítico | Posología y forma de administración | Contraindicaciones | Efectos secundarios maternos | Efectos secundarios fetales o neonatales |
| Betamiméticos | Terbutalina, 0,25mg por vía subcutánea cada 20min a 3h (pulsaciones > 120 por min) | Arritmias cardíacasEnfermedad tiroidea mal controlada | Arritmia cardíaca o pulmonar, edema pulmonar, isquemia miocárdica, hipotensión, taquicardia, disnea, hiperglucemia, hiperinsulinemia, antidiuresis, alteración de la función tiroidea, hipocalemia, temblores, nerviosismo, náusea o vómito | Taquicardia, hiperinsulinemia, hiperglucemia fetal, hipoglucemia, hipocalcemia, hipotensión, hipertrofia miocárdica y septal, isquemia miocárdica e íleo en neonatos |
| Ritodrina, dosis inicial de 50–100μg/min cada 10min hasta que cesen las contracciones o aparezcan efectos secundarios Dosis máxima = 350μg/min | Alucinaciones graves | |||
| Bloqueadores de los canales de calcio: nifedipina | Dosis de carga de 30mg, continuar con 10–20mg cada 4–6h | Cardiopatía, uso cauteloso en afecciones hepáticas, hipotensión materna (< 90/50mmHg), evitar el uso simultáneo de sulfato de magnesio | Sofocos, cefalea, mareo, náuseas, hipotensión transitoria, taquicardia transitoria, palpitaciones | Muerte súbita fetal Insuficiencia respiratoria fetal |
| Inhibidores de la síntesis de prostaglandinas: indometacina | Dosis de carga de indometacina: 50mg vía rectal o 50–100mg vía oral, seguir con 25–50mg vía oral cada 6h durante 48h | Alteraciones renales o hepáticas significativas | Náuseas, pirosis gástrica, proctitis con hematoquecia, deterioro de la función renal, aumento de la hemorragia posparto, cefalea, mareo, depresión | Constricción del conducto arterial, hipertensión pulmonar, disminución reversible de la función renal con oligohidramnios, hemorragia intraventricular, hiperbilirrubinemia, enterocolitis necrotizante |
| Ketorolaco, dosis de carga: 60mg vía intramuscular, seguir con 30mg por vía intramuscular cada 6h durante 48h | Úlcera péptica activa | |||
| Sulindac, 200mg por vía oral cada 12h durante 48h | Trastornos de la coagulación o trombocitopenia, asma sensible a AINE, otras reacciones de hipersensibilidad a AINE | |||
| Donantes de óxido nítrico | Gliceroltrinitrato Parche de 10mg cada 12h, continuar hasta que cesen las contracciones, hasta 48h | Cefalea | Cefalea, hipotensión | Hipotensión neonatal |
| Antagonistas de la oxitocina | Atosibán, dosis inicial en bolo: 6,75mg durante 1min, seguida de infusión de 18mg/h durante 3h y luego 6mg/h durante un período hasta de 45h | Ninguna | Náuseas (de corta duración),reacción alérgica, cefalea (de corta duración) | No se han descrito hasta ahora |
AINE: antiinflamatorios no esteroideos.
El objetivo prioritario de la terapia tocolítica es demorar el parto para permitir la administración prenatal de un ciclo completo de glucocorticoides, con el fin de disminuir principalmente la incidencia y la gravedad del síndrome de insuficiencia respiratoria y posibilitar el traslado in útero a una unidad de cuidados intensivos neonatales.
El objetivo secundario de la terapia tocolítica es demorar el parto para disminuir la morbimortalidad perinatal asociada con la prematuridad. Aunque no se dispone de un análisis completo en términos de comparación de costes, este tipo de análisis debería tener en cuenta el coste de administración de cada medicamento frente a sus beneficios o efectos adversos, sobre todo los asociados al NPE, así como el ahorro de costes en asistencia obstétrica y la comparación de los presupuestos para obstetricia y uso de tocolíticos de los distintos hospitales.
El atosibán representa un avance entre los tocolíticos actualmente disponibles y se deberá considerar como agente de primera línea para el manejo del PPE.
El atosibán está autorizado en Europa para el tratamiento del parto prematuro espontáneo. Su posología y la forma de administración recomendadas incluye un esquema de 3 pasos (véase tabla 1). La duración del tratamiento no debe superar 48h y la dosis total administrada durante un ciclo completo no debe sobrepasar de 330mg, preferentemente. En edad gestacional con o sin rotura prematura de las membranas antes de término, se puede prolongar el tratamiento con atosibán algunos días más sin que se presenten efectos secundarios significativos.
El riesgo de acontecimientos adversos asociados a los betaagonistas en el manejo del PPE requiere una estrecha vigilancia de la madre en una unidad de cuidados especiales (tabla 2).
Pautas de vigilancia recomendadas en la administración de betaagonistas
Vigilancia
|
Royal College of Obstetricians and Gynecologists. Clinical Green Top Guidelines. Tocolytic Drugs for Women in Preterm Labor (1B), octubre de 2002. Disponible en: http://www.rcog.org.uk/guidelines/tocolytics.htlm
Los efectos adversos comunes de los betaagonistas, frente a la ausencia de tratamiento o placebo, incluyen palpitaciones (68% con betaagonistas frente al 5% en los controles), temblores (el 39 frente al 4%), náuseas (el 20 frente al 12%), cefalea (el 23 frente al 6%) y dolor torácico (el 10 frente al 1%). Se han descrito efectos adversos graves e inusuales y potencialmente mortales tras el tratamiento con betaagonistas, y algunos casos de muerte materna asociados a estos fármacos. La aparición de edema pulmonar es una complicación ampliamente documentada, habitualmente asociada a la hidratación intravenosa intensiva. Una revisión sistemática identificó un caso de edema pulmonar en una muestra de 850 mujeres (1/425 tratadas con betaagonistas frente a 0/427 tratadas con placebo). Con los demás tocolíticos (sulfato de magnesio, indometacina y atosibán), se han comunicado menos tipos de efectos adversos y también con menor frecuencia. Con atosibán, la aparición de náuseas (el 11% con atosibán frente al 5% con placebo) es el único efecto adverso documentado de corta duración (alrededor de 1min) durante la administración de la inyección en bolo. En este mismo estudio no se observó un aumento de vómitos (el 3% con atosibán frente al 4% con placebo), cefalea (el 5 frente al 7%), dolor torácico (el 1 frente al 4%) o disnea (el 0,4 frente al 3%).
Entre la terapia tocolítica pendiente de autorización, los bloqueadores de los canales de calcio, como nifedipina y nicardipina, inhiben la entrada de los iones de calcio en las células del miometrio y la disminución de calcio intracelular reduce la actividad miometrial. Revisiones bibliográficas recientes sobre el uso de nicardipina o nifedipina sugieren que los perfiles de seguridad de estos fármacos no están debidamente establecidos y que se deberá ser cauteloso al considerar su uso. En particular, diversos estudios publicados describen acontecimientos adversos pulmonares y cardiovasculares de carácter grave para la madre. Se ha recomendado el uso de nicardipina únicamente en el ámbito de ensayos clínicos. Los efectos secundarios maternos documentados incluyen: vértigo, desvanecimiento, cefalea, sofocos, náuseas e hipotensión transitoria. Debe evitarse el uso concomitante de sulfato de magnesio y nifedipina dado que se han descrito casos de hipocalcemia sintomática, bloqueo neuromuscular y toxicidad cardíaca, incluidos casos de muerte materna. Se ha registrado también un número creciente de acontecimientos adversos maternofetales con el uso de nifedipina, en particular en embarazos gemelares. Se ha descrito además un caso de infarto de miocardio en una mujer de 29 años tratada con nifedipina inmediatamente después del tratamiento por vía intravenosa con ritodrina. Los datos sobre nifedipina en el tratamiento provienen en su mayoría de un limitado número de estudios de mala calidad y reducido tamaño muestral, propiciados por investigadores. Una revisión sistemática ha permitido identificar graves problemas metodológicos y de abordaje, por lo que dada su falta de calidad, estos estudios no deberán ser un referente en la práctica clínica.
El sulfato de magnesio es ineficaz para retrasar el parto o prevenir el NPE tras la amenaza de parto prematuro. Su uso se asocia a un aumento de mortalidad neonatal. El sulfato de magnesio es un fármaco popular para tocólisis en los EE.UU. y algunos otros países, pero en Europa su uso es muy poco frecuente y no se recomienda en la indicación de tocólisis.
La indometacina y otros inhibidores de la síntesis de prostaglandinas son efectivos para demorar el parto prematuro e incrementar el peso de nacimiento; disminuyendo la estancia en la unidad de cuidados intensivos neonatales y los intervalos de ventilación mecánica. Sin embargo, existen datos contradictorios indicando también que la indometacina no prolonga el período de gestación y se produce el nacimiento antes de término. Los efectos adversos potenciales para el feto incluyen: cierre prematuro del conducto arterial, enterocolitis necrosante, síndrome de insuficiencia respiratoria y displasia broncopulmonar, además de un aumento potencial del riesgo asociado al desarrollo de leucomalacia periventricular (con una dosis diaria de 200mg).
Los donantes de óxido nítrico (trinitrato de glicerol o isosorbida) han demostrado ejercer efectos tocolíticos. Los principales efectos secundarios maternos son cefalea e hipotensión. Su uso continúa siendo limitado por problemas de incumplimiento terapéutico.
Si se plantea el uso de un agente tocolítico, la ritodrina no parece ya la mejor elección. Alternativas terapéuticas como atosibán parecen tener una eficacia similar al conseguir demorar el parto hasta 7 días y asociarse a menos efectos adversos maternofetales.
TRATAMIENTO DE MANTENIMIENTO TRAS LA AMENAZA DE PARTO PREMATURONo se recomienda la tocólisis de mantenimiento en la práctica habitual.
Las revisiones sistemáticas efectuadas no han aportado datos suficientemente sólidos de que los betaagonistas orales, o cualquier otra terapia de mantenimiento, puedan prevenir o no el nacimiento prematuro espontáneo y sus consecuencias posteriores. Hay que indicar además que, aunque en un ensayo comparativo frente a placebo el betaagonista terbutalina por vía subcutánea retrasó el siguiente episodio de amenaza de parto, los datos obtenidos son insuficientes para extraer conclusiones sólidas sobre los efectos asociados a otros resultados más sustanciales. Por tanto, la información disponible es insuficiente para determinar si la tocólisis de mantenimiento sería o no beneficiosa tras un episodio de parto prematuro espontáneo por lo que no se puede recomendar la terapia de mantenimiento en la práctica clínica habitual.
ADMINISTRACIÓN DE GLUCOCORTICOIDES ANTES DEL PARTOLa prolongación de la gestación con tocolíticos permite administrar glucocorticoides antes del parto para disminuir la incidencia y la gravedad del síndrome de insuficiencia respiratoria, reduciendo por ende la morbimortalidad neonatal.
La administración de un ciclo único de glucocorticoides a mujeres con riesgo de parto prematuro en un período de 7 días, deberá efectuarse entre las semanas 24 y 34 de gestación.
Un metaanálisis de 18 ensayos aleatorizados demuestra que el uso prenatal de glucocorticoides disminuye significativamente la aparición del síndrome de insuficiencia respiratoria (cociente de posibilidades [CP] = 0,53; intervalo de confianza [IC] del 95%, 0,44-0,63) y la mortalidad neonatal (CP = 0,6; IC del 95%, 0,48-0,75). Se constató también una disminución significativa de hemorragia intraventricular (HIV) diagnosticada en el examen de autopsia (CP = 0,29; IC del 95%, 0,14-0,61) y mediante ecografía (CP = 0,48; IC del 95%, 0,32-0,72). Un único ciclo de glucocorticoides antes del parto puede disminuir también el desarrollo de leucomalacia periventricular (LPV) y parálisis cerebral.
La betametasona y la dexametasona son los glucocorticoides más utilizados en la profilaxis prenatal, pero no existen estudios aleatorizados y controlados que comparen la eficacia de estos agentes. Aunque la betametasona parece afectar de manera más pronunciada que la dexametasona a la variabilidad de la frecuencia cardíaca fetal y los movimientos fetales, ambos fármacos ofrecen, al parecer, varias ventajas.
La pauta de tratamiento que se debe seguir es de 2 dosis de 12mg de betametasona por vía intramuscular con un intervalo de 24h, o 4 dosis de 6mg de dexametasona por vía intramuscular con un intervalo de 12h. Hay que señalar la modificación significativa de las variables fetales biofísicas, registradas mediante cardiotocografía y examen ecográfico, a causa de la administración de corticoides, especialmente con betametasona, por lo que las madres serán informadas de que los movimientos fetales disminuirán en las 48h posteriores a la inyección del medicamento. En el caso de PPE inminente, la administración de betametasona (12mg con un intervalo de 12h) mostró los mismos efectos beneficiosos.
PAUTAS CLAVE- –
La administración prenatal de un único ciclo de glucocorticoides es el tratamiento más importante que los tocólogos pueden administrar entre las semanas 24 y 34 de gestación a mujeres con riesgo de parto prematuro, para prevenir lesiones cerebrales y aumentar la supervivencia.
- –
En base a los ensayos clínicos observacionales y los estudios con animales, se utilizará preferentemente betametasona en lugar de dexametasona.
- –
Debe evitarse la administración de ciclos múltiples de corticoides.
- –
No existen indicios directos de que el tratamiento tocolítico per se pueda afectar al riesgo de lesión cerebral perinatal o el resultado neurológico adverso.
En la mayoría de las unidades se llevarán a cabo los siguientes controles rutinarios:
- 1.
Hemograma completo y grupo sanguíneo, reserva de muestras de suero para análisis posterior.
- 2.
Muestra de orina recogida a mitad de la micción, para prueba de bacteriuria.
- 3.
Hisopado vaginal alto e hisopado rectal para examen microscópico del cultivo y pruebas de sensibilidad.
- 4.
Hisopado vaginal bajo e hisopado rectal para cultivo en placas de Agar granada o medio de cultivo selectivo para detección de estreptococos del grupo B.
En presencia de rotura prematura de membranas pretérmino (RPMP), el estudio ORACLE mostró el efecto beneficioso del tratamiento profiláctico con eritromicina pero no con amoxicilina-ácido clavulánico (co-amoxiclav). Estos dos antibióticos fueron los únicos sometidos a un ensayo en el estudio ORACLE. La eritromicina carece de actividad frente a microorganismos anaeróbicos, estreptococos del grupo B (EGB) y numerosos microorganismos asociados a vaginosis bacteriana. De manera análoga, aunque co-amoxiclav posee actividad frente a microorganismos anaerobios y es un antibiótico de amplio espectro, carece de actividad frente a los microorganismos más molestos, como Mycoplasma hominis, asociados a vaginosis bacteriana. Para la quimioprofilaxis intraparto cuando existe colonización por EGB, se debe administrar penicilina por vía intravenosa en un período de 4h. En caso de alergia a la penicilina, se recomienda la combinación de eritromicina y claritromicina o clindamicina. Sin embargo, la claritromicina y la clindamicina no fueron sometidas a evaluación en el estudio ORACLE.
Se ha propuesto la administración tópica de clorhexidina por vía vaginal (0,5%) en forma de gel o ducha vaginal, dado que constituye una alternativa válida a la antibioticoterapia parenteral para profilaxis o tratamiento de EGB.
En mujeres con RPMP, el uso de antibioticoterapia se ha asociado a una disminución estadísticamente significativa de corioamnionitis (CP = 0,57; IC del 95%, 0,37-0,86). La cifra de recién nacidos a las 48h (CP = 0,71; IC del 95%, 0,58-0,87) y 7 días después del procedimiento de aleatorización (CP = 0,80; IC del 95%, 0,71-0,90) experimentó un descenso, al igual que los siguientes marcadores de morbilidad neonatal: infección neonatal (CP = 0,68; IC del 95%, 0,53-0,87), uso de surfactantes (CP = 0,83; IC del 95%, 0,72-0,96), oxigenoterapia (CP = 0,88; IC del 95%, 0,81-0,96) y ecografía cerebral con resultados anómalos antes de recibir el alta hospitalaria (CP = 0,82; IC del 95%, 0,68-0,98) (este metaanálisis incluyó 12 ensayos clínicos y una muestra de 6.294 recién nacidos). La disminución de anomalías ecográficas cerebrales indica un efecto protector. Se recomienda el uso de antibioticoterapia en casos de RPMP.
MANEJO GLOBALUna vez establecido el diagnóstico, se recomienda informar de inmediato a los neonatólogos con facultad de decisión, para garantizar la disponibilidad de una cabina de cuidados intensivos neonatales o para que se tomen las medidas oportunas para el traslado in útero a un centro con unidad de cuidados intensivos.
Si no existen indicios claros de que la tocólisis puede mejorar el resultado después del parto prematuro, es aconsejable no utilizarla. Las mujeres con más probabilidades de beneficiarse de la tocólisis son las que se encuentran en edad gestacional muy temprana, las que necesitan traslado a un hospital con unidad de cuidados intensivos neonatales o las que todavía no han finalizado un ciclo completo de corticoides para fomentar el desarrollo de la madurez pulmonar del feto. En todas estas mujeres debe considerarse la tocólisis.
Si es posible, se realizará una ecografía para verificar viabilidad y morfología fetal, número de fetos, presentación fetal, colocación de la placenta, estimación del peso fetal e índice del líquido amniótico, dado que todos estos factores pueden influir en el manejo de la situación. Tras la consulta con un anestesista, se adoptarán las medidas necesarias para administrar la analgesia apropiada evitando, en lo posible, los opiáceos, para prevenir la depresión fetal del sistema nervioso central y la depresión respiratoria neonatal.
Si la intervención está contraindicada o es insatisfactoria, se debe individualizar la modalidad de nacimiento de un prematuro en función de la edad gestacional, la presentación fetal, el número de fetos y la presencia o ausencia de hallazgos cardíacos fetales poco tranquilizadores en la cardiotocografía.
INTERVENCIÓN CONTRAINDICADA EN EL MANEJO DEL PARTO PREMATURO ESPONTÁNEOAl considerar la intervención para prolongar la gestación, se debe tener en cuenta ciertas contraindicaciones absolutas y relativas para disminuir la morbimortalidad maternofetal.
Contraindicaciones absolutas son aquellas en las que la prolongación del embarazo está contraindicada per se, por ejemplo, en presencia de infección intrauterina clínicamente manifiesta, malformaciones congénitas letales del feto, preeclampsia fulminante con proteinuria o cualquier otra indicación maternofetal urgente para desencadenar el parto.
Contraindicaciones relativas son aquellas en las que existe un debate sobre los riesgos y beneficios de la intervención, como en el caso de hemorragia prenatal, rotura de membranas, patrón de frecuencia cardíaca fetal poco tranquilizador según la cardiotocografía, retraso del crecimiento intrauterino, diabetes insulinodependiente y embarazo múltiple.
No se debe administrar tocólisis en presencia de hemorragia prenatal importante, especialmente si existen signos y síntomas de desprendimiento placentario. Tras un sangrado leve por placenta previa, es aceptable el uso de tocolíticos dado que pueden contribuir a frenar las contracciones uterinas y la distensión subsiguiente puede separar adicionalmente la placenta y producir hemorragia.
En presencia de roturas de las membranas, raramente está indicada la tocólisis después de las 36 semanas de gestación. En una etapa gestacional anterior, se puede administrar tocólisis si existe una relación favorable riesgo/beneficio para la demora del parto, que permita administrar un ciclo completo de glucocorticoides o adoptar las medidas necesarias para el traslado de la embarazada a un centro con unidad de cuidados intensivos neonatales.
La tocólisis para demorar el parto de un prematuro está contraindicada si existe un patrón de frecuencia cardíaca fetal poco tranquilizador según la cardiotocografía, asociado con hemorragia significativa o signos de infección maternofetal.
El atosibán es un fármaco seguro en el tratamiento de mujeres con diabetes insulinodependiente bien controlada que presentan riesgo de parto prematuro espontáneo. Se requiere una estrecha vigilancia en caso de utilizar otros tocolíticos dado que los glucocorticoides y los tocolíticos pueden afectar probablemente al control diabético.
Los nacimientos gemelares y partos múltiples se asocian a una mayor expansión del volumen plasmático materno e hipertiroidismo secundario, en comparación con los embarazos únicos. Se sabe que los betaagonistas aumentan los valores de aldosterona y de renina en los embarazos gemelares, lo que puede aumentar el riesgo de edema pulmonar. Por tanto, el uso de betaagonistas está contraindicado en embarazos múltiples y se deberá administrar terapia tocolítica alternativa. Además, los bloqueadores de los canales de calcio potencian los efectos negativos sobre el equilibrio cardiovascular materno, sobre todo en embarazos múltiples, por lo que están contraindicados en estos casos.
Miembros del Grupo de Estudio de Medicina Perinatal sobre Nacimiento PrematuroA. Antsaklis (Greece), G. Breborowicz (Poland), P. Husslein (Austria), R. Lamont (UK), A. Mikhailov (Russia), S.C. Robson (UK), C. Sen (Turkey), H. Van Geijn (Netherlands) y Y. Ville (France).
De acuerdo con los autores y los editores, este artículo se publicó previamente en J Perinat Med. 2006;34:359-66.
Al final del artículo se relacionan los miembros de la Asociación Europea del Grupo de Estudio de Medicina Perinatal sobre Nacimiento Prematuro.