La hipertensión gestacional es una de las causas más importantes de morbimortalidad materna. La hipertensión crónica secundaria puede tener un origen renovascular y en la mayoría de los casos se debe a una displasia fibromuscular (DFM) de la arteria renal.
Se presenta el caso de una gestante con hipertensión severa desde el inicio del embarazo. La paciente respondió mal a los fármacos antihipertensivos, por lo que precisó varios ingresos hospitalarios, y terminó por desarrollar un síndrome de Hellp que requirió la finalización temprana de la gestación.
Se debe considerar esta etiología entre las causas de hipertensión secundaria, ya que su diagnóstico y manejo tempranos pueden mejorar mucho el pronóstico materno-fetal.
Hypertension during pregnancy is one of the most important causes of maternal and fetal morbimortality. Secondary hypertension can have a renovascular origin, which is mainly due to fibromuscular dysplasia.
We present the case of a patient with severe hypertension since the beginning of pregnancy. She presented resistence to medical treatment and required multiple hospital incomes, in the end she developed a Hellp syndrome and gestation had to be finished very early.
Renovascular hypertension has to be considered in secondary hypertension aetiology. Early diagnosis and treatment of this disease are critical in the prognosis of both mother and child.
El diagnóstico de hipertensión puede hacerse en el 5-8% todos los embarazos1. Es una de las causas más importantes de morbimortalidad materna. Causa 200.000 defunciones maternas cada año1 y, en determinadas regiones, como América Latina y el Caribe, es la principal causa de mortalidad materna2. La hipertensión primaria constituye el 90% de los casos de hipertensión crónica (HTC) durante la gestación3, mientras que el 10% es secundaria a un factor subyacente: patología renal (tubulointersticial, glomerulonefritis o patología renovascular), vascular (vasculitis, coartación de aorta) o endocrina (tirotoxicosis, feocromocitoma, hiperalosteronismo, síndrome de Cushing)3,4.
La preeclampsia es la forma más común de hipertensión en el embarazo, con una incidencia que oscila entre el 2 y el 7% en gestantes nulíparas sanas5. La preeclampsia sobreañadida a una HTC aparece hasta en el 25-34%6 de los casos, aunque puede llegar al 50% en pacientes con HTC severa7. La frecuencia y la gravedad de la enfermedad son mayores en pacientes con hipertensión crónica3, ya que suponen un factor de riesgo para el desarrollo de preeclampsia sobreañadida y de resultados maternos y perinatales desfavorables8,9.
Las mujeres con una preeclampsia sobreañadida tienen mayores tasas de prematuridad, crecimiento intrauterino retardado y un mayor índice de cesáreas10, así como mayor frecuencia de complicaciones neonatales: hemorragia neonatal intraventricular y muerte neonatal3. El riesgo de muerte perinatal está incrementado 3 o 4 veces respecto a la población general3. La HTC severa, además de la preeclampsia y el abruptio placentae, se asocia a un mayor número de complicaciones mortales maternas: edema pulmonar, encefalopatía hipertensiva, retinopatía, hemorragia cerebral, y fallo renal agudo11.
La hipertensión renovascular produce alrededor del 1-5% de todos los casos de hipertensión en adultos, y en más del 90% se debe a una arterioesclerosis de la arteria renal o a una displasia fibromuscular (DFM) de la arteria renal12. La DFM afecta a mujeres entre 15–50 años, es bilateral con frecuencia, y suele comprometer los dos tercios más distales de la arteria renal y sus ramas13.
CASO CLÍNICOPaciente primípara de 27 años, sin antecedentes de interés, con un control gestacional normal hasta las 17 semanas. En ese momento tiene un primer ingreso hospitalario por hipertensión arterial (HTA) (190/100) que se controla con tratamiento por vía intravenosa. A los 5 días del alta reingresa para normalizar de nuevo la presión arterial (PA). En ambas ocasiones todos los parámetros analíticos se mantienen dentro de la normalidad y no existe repercusión fetal. A las 23 semanas ingresó por PA descontrolada (220–110 mmHg) que requirió de nuevo tratamiento antihipertensivos por vía intravenosa. Se constató una biometría fetal 2 semanas menor a la edad gestacional. La paciente presentaba signos clínicos y en la eco-Doppler (ECO-D) de arterias renales compatibles con una estenosis de arterias renales (EAR).
A las 27 semanas ocurrió un último ingreso por crecimiento intrauterino retardado e HTA severa mal controlada, que requirió el ingreso de la paciente en la unidad de cuidados intensivos de maternidad. Desarrolló un síndrome de Hellp completo (clasificación de Tenessee), por lo que se decidió finalizar la gestación. Tras la maduración pulmonar fetal se realizó una cesárea; nació una niña de 490 g que fue trasladada a la unidad de cuidados intensivos neonatales. El recién nacido tuvo una evolución favorable.
Tras la cesárea, se controló la PA y se normalizaron las alteraciones analíticas. Se dio de alta a la paciente 6 días después.
DISCUSIÓNAnte la aparición de hipertensión por debajo de las 20 semanas de gestación, debe realizarse el diagnóstico diferencial de HTC secundaria. Tras el cribado clínico de otras causas de HTC secundaria, ha de descartarse la posibilidad de una EAR, sobre todo cuando aparece resistencia al tratamiento farmacológico.
DiagnósticoLa ECO-D es la prueba diagnóstica no invasiva de elección para la DFM, con una sensibilidad del 95% y una especificidad del 90% si se realiza por personal especializado14. Sin embargo, la valoración de arterias accesorias renales es deficiente (25%)15 y la tasa de fallo técnico oscila del 4 al 42% debido a obesidad severa, el exceso de gas intestinal o por la escasa colaboración de la paciente15.
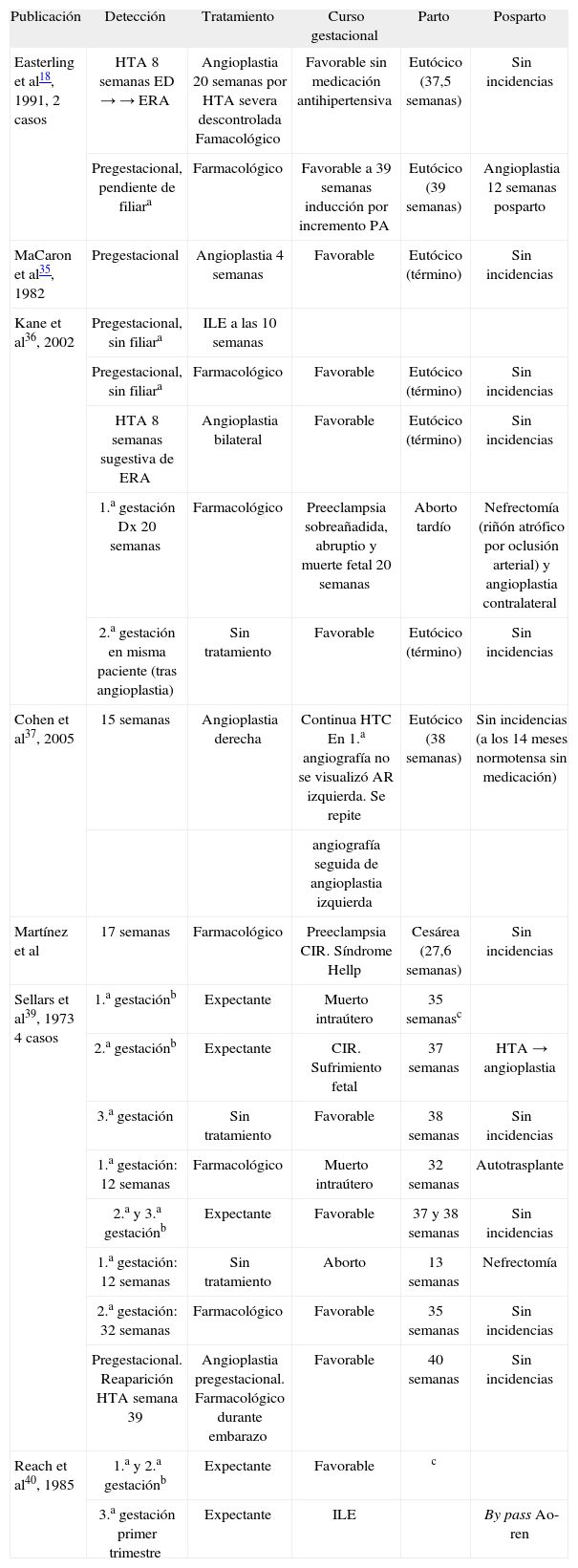
| Publicación | Detección | Tratamiento | Curso gestacional | Parto | Posparto |
| Easterling et al18, 1991, 2 casos | HTA 8 semanas ED → → ERA | Angioplastia 20 semanas por HTA severa descontrolada Famacológico | Favorable sin medicación antihipertensiva | Eutócico (37,5 semanas) | Sin incidencias |
| Pregestacional, pendiente de filiara | Farmacológico | Favorable a 39 semanas inducción por incremento PA | Eutócico (39 semanas) | Angioplastia 12 semanas posparto | |
| MaCaron et al35, 1982 | Pregestacional | Angioplastia 4 semanas | Favorable | Eutócico (término) | Sin incidencias |
| Kane et al36, 2002 | Pregestacional, sin filiara | ILE a las 10 semanas | |||
| Pregestacional, sin filiara | Farmacológico | Favorable | Eutócico (término) | Sin incidencias | |
| HTA 8 semanas sugestiva de ERA | Angioplastia bilateral | Favorable | Eutócico (término) | Sin incidencias | |
| 1.a gestación Dx 20 semanas | Farmacológico | Preeclampsia sobreañadida, abruptio y muerte fetal 20 semanas | Aborto tardío | Nefrectomía (riñón atrófico por oclusión arterial) y angioplastia contralateral | |
| 2.a gestación en misma paciente (tras angioplastia) | Sin tratamiento | Favorable | Eutócico (término) | Sin incidencias | |
| Cohen et al37, 2005 | 15 semanas | Angioplastia derecha | Continua HTC En 1.a angiografía no se visualizó AR izquierda. Se repite | Eutócico (38 semanas) | Sin incidencias (a los 14 meses normotensa sin medicación) |
| angiografía seguida de angioplastia izquierda | |||||
| Martínez et al | 17 semanas | Farmacológico | Preeclampsia CIR. Síndrome Hellp | Cesárea (27,6 semanas) | Sin incidencias |
| Sellars et al39, 1973 4 casos | 1.a gestaciónb | Expectante | Muerto intraútero | 35 semanasc | |
| 2.a gestaciónb | Expectante | CIR. Sufrimiento fetal | 37 semanas | HTA → angioplastia | |
| 3.a gestación | Sin tratamiento | Favorable | 38 semanas | Sin incidencias | |
| 1.a gestación: 12 semanas | Farmacológico | Muerto intraútero | 32 semanas | Autotrasplante | |
| 2.a y 3.a gestaciónb | Expectante | Favorable | 37 y 38 semanas | Sin incidencias | |
| 1.a gestación: 12 semanas | Sin tratamiento | Aborto | 13 semanas | Nefrectomía | |
| 2.a gestación: 32 semanas | Farmacológico | Favorable | 35 semanas | Sin incidencias | |
| Pregestacional. Reaparición HTA semana 39 | Angioplastia pregestacional. Farmacológico durante embarazo | Favorable | 40 semanas | Sin incidencias | |
| Reach et al40, 1985 | 1.a y 2.a gestaciónb | Expectante | Favorable | c | |
| 3.a gestación primer trimestre | Expectante | ILE | By pass Ao-ren |
HTA: hipertensión arterial; PA: presión arterial.
La resonancia magnética angiográfica (RMA) puede ayudar en el diagnóstico de DFM en la gestante. Se sitúa por delante de la ECO-D en algunos estudios: sensibilidad (S) y especificidad (E) del 90 y 86%, respectivamente, para la RMA y del 81 y el 87% para la ECO-D16, o S del 96,6% para la RMA frente al S 69% para la ECO-D con captopril17. La S para estenosis mayores del 50% es mayor con RMA (100%) que con ECO-D (79%), y el valor predictivo negativo en estenosis menores del 50% también es mayor con RMA (100%) que con ECO-D (90%)18. Otros autores consideran ambos métodos comparables, con una S y una E del 96 y el 86% para la RMA, y del 96 y el 89% para la ECO-D19, respectivamente. Incluso Vasbinder et al19 consideran que la RMA no es una técnica lo suficientemente sensible (S 62%) como para poder descartar una DFM.
La resolución de la RMA, incluso si se usa gadolinio, es menor que la de la angiografía con catéter, 1 mm frente a 200–300 μm21. Así, a pesar de las mejoras en las técnicas de imagen, la prueba diagnóstica de elección sigue siendo la angiografía13,21,22, pero la sospecha de una ERA no constituye en sí misma una indicación para la realización de una angiografía durante el embarazo4,23, y ha de quedar relegada hasta después del parto.
TratamientoLa angiografía transluminal percutánea (ATP) es el tratamiento de elección para la DFM24; es menos invasiva, tiene menor morbilidad y menor coste que la cirugía. Además si fracasa, permite la revascularización quirúgica25,26. La tasa de éxito inicial en la DFM es del 80-100%25,27,29,30. Los resultados a largo plazo muestran una tasa de curación media del 50% según el metaanálisis realizado por Ramsay et al29 y una mejora en el control de los valores de PA del 74-86%25,29,31. La tasa de reestenosis tras ATP oscila entre el 6,7 y el 27%29–32, y se produce de forma más frecuente en las ramas de la arteria renal32.
El síndrome de HELLP aparece en el 4-12% de las pacientes con preeclampsia33. En las pacientes con síndrome de Hellp completo el parto ha de producirse antes de 48 h34, sobre todo si se trata de un síndrome de Hellp de clase I (clasificación de Mississippi), ya que conlleva una mayor morbimortalidad materna11.
El control de la hipertensión severa permite prolongar la gestación y, por tanto, mejorar los parámetros perinatales3. Pero si el tratamiento médico fracasa y hay una hipertensión descontrolada, o se opta por la finalización de la gestación si el feto es viable, o se realiza una angiografía para filiar el diagnóstico, evaluar el grado de afectación y dilatar la arteria estenosada. Así, la revascularización hacia la mitad de la gestación puede mejorar tanto el pronóstico materno como fetal35. Durante la ATP debe monitorizarse al feto ya que puede aparecer una bradicardia fetal secundaria a hipotensión materna y bradicardia materna tras la dilatación arterial23.
En el caso que se presenta, a pesar de tratarse de una hipertensión severa descontrolada se decidió esperar hasta después del parto para realizar la angiografía y angioplastia. El feto desarrolló un CIR intenso y la madre un síndrome de Hellp. Estas complicaciones probablemente hubiesen disminuido con el control de la hipertensión materna tras la realización de una ATP.
CONCLUSIONESAnte una hipertensión crónica severa no filiada en una gestante se debe incluir la ERA en el diagnóstico diferencial. Como primera prueba diagnóstica no invasiva se sitúa la ECO-D de arterias renales, que puede complementarse con una RMA.
La prolongación de la gestación y el manejo expectante de una paciente hipertensa crónica severa mal controlada puede conllevar graves consecuencias materno-fetales. La ATP es una buena alternativa a la finalización de la gestación en pacientes con DFM de arterias renales.