INTRODUCCIÓN
El embarazo ectópico (EE) se define como todo embarazo implantado fuera de la cavidad endometrial. El 90% de las ocasiones éste se produce en la trompa.
La incidencia oscila entre el 1 y el 2,4% (2/100-200 nacidos vivos) con una tasa de mortalidad del 0,3-0,4%; es la primera causa de muerte materna durante el primer trimestre, y representa el 9% de las muertes maternas globales. La posibilidad de gestación heterotópica (combinación de embarazo intrauterino y extrauterino) es de 1 cada 27.000 gestaciones. Con fecundación in vitro (FIV) esta posibilidad se incrementa hasta 1/35-1/100.
La causa más frecuente de EE son los antecedentes de enfermedad inflamatoria pélvica. Otros factores de riesgo son los contraceptivos con gestágenos solos, dispositivos intrauterinos (DIU) (16% de los embarazos en usuarias fueron EE), endometriosis, postesterilización tubárica (tras coagulación tubárica laparoscópica el 51% de los embarazos ocurridos fueron EE), cirugía tubárica previa, inducción de la ovulación, FIV, consumo de tabaco, historia de infertilidad o esterilidad y aborto previo. Aparte de estos factores, las anomalías intrínsecas del cigoto también pueden tener relación con el EE. Hasta un tercio de los cigotos implantados ectópicamente tienen alteraciones cromosómicas.
El EE ocasiona una clara reducción del potencial reproductivo. Menos de un 50% de mujeres con antecedente de EE vuelven a concebir, de las cuales sólo el 30-50% darán a luz un feto vivo. El riesgo de repetición de EE es del 12-18%, más elevado en caso de la cirugía conservadora en mujeres con una sola trompa.
TIPOS DE EMBARAZO ECTÓPICO
Formas tubáricas. Supone el 98% de lo casos. Puede ser ampular (78%), ístmico (12%), infundibular (5%) e intramural o intersticial (2%).
Formas no tubáricas. Embarazo cervical (0,1%), ovárico (0,5%), abdominal (1,3%), cornual (3%) e intraligamentario (0,1%).
DIAGNÓSTICO
Clínico
La forma típica de presentación es dolor pélvico y/o sangrado vaginal. Habitualmente se presenta 4-8 semanas después de la última regla. La palpación abdominal y pélvica puede resultar dolorosa. Puede palparse una masa pélvica, la mayoría de las veces debida a un cuerpo lúteo ovárico, dado que el EE suele ser demasiado pequeño y blando para ser palpable. El dolor es el resultado de la distensión peritoneal sobre la trompa. Si el EE se accidenta, el dolor puede extenderse a todo el hemiabdomen inferior, y si el hemoperitoneo es importante puede aparecer omalgia, signos de irritación peritoneal y shock hipovolémico. Ocasionalmente, el cuadro puede iniciarse de esta última forma.
Ecográfico
La ecografía vaginal ha mejorado la sensibilidad y la especificidad diagnóstica presentada por la ecografía transabdominal, lo que permite realizar de forma precoz el diagnóstico.
El espectro de hallazgos ecográficos sugestivos de EE incluye los siguientes:
-- Anillo tubárico. Una estructura ecogénica en forma de anillo situada fuera del útero representa un EE precoz.
-- Masa extrauterina. La presencia de una masa anexial sobre una zona blanda palpable en la exploración sugiere el diagnóstico de EE.
-- EE intersticial. El EE intersticial se implanta en una zona altamente vascularizada del útero cerca de la inserción tubárica. Una excéntrica localización del saco gestacional sugiere el diagnóstico. Es importante evaluar la cantidad de miometrio que rodea el saco, ya que la presencia de más de 5 mm avala el diagnóstico.
-- Saco gestacional extrauterino vacío. La presencia de una masa extrauterina con un grueso anillo altamente ecogénico indica EE.
-- Hemosalpinx. Visualización de las trompas llenas de sangre o líquido libre.
-- EE roto. Líquido libre o coágulos en el fondo de saco o de cavidad libre.
-- En el 3,7% de los casos se podrá visualizar un embrión y actividad cardíaca. En el 10-20% de los EE puede visualizarse un seudosaco intraútero.
El Doppler aumenta la sensibilidad y la especificidad de la ecografía ayudando a diferenciar entre el seudosaco y el saco gestacional verdadero, facilita la visualización del latido cardíaco y permite distinguir entre el anillo trofoblástico y el cuerpo lúteo gravídico.
Biológico
Los marcadores biológicos más útiles en el diagnóstico del EE son la gonadotropina coriónica humana (HCG) beta y la progesterona.
-- Beta-HCG. La determinación seriada facilita diferenciar entre un embarazo incipiente, un aborto y un EE. La beta-HCG se duplica cada 48 h en un embarazo normal a partir del octavo día posconcepción. Si esta tasa se detecta en menor cantidad, sugiere EE. En los abortos la tasa suele disminuir progresivamente. De cualquier forma, con cifras iguales o superiores a 2.000 U/ml debe visualizarse el saco gestacional intrauterino en la ecografía transvaginal.
-- Progesterona. Unas determinaciones por debajo de 15-25 ng/ml son sugestivas de EE o aborto diferido.
El diagnóstico diferencial debe realizarse fundamentalmente con la rotura o torsión de quiste de ovario, cuerpo lúteo quístico, aborto, enfermedad pélvica inflamatoria, apendicitis, gastroenteritis y hemorragia disfuncional.
TRATAMIENTO
El EE puede tratarse mediante laparotomía, laparoscopia, médicamente y, de forma ocasional, sólo con observación. El tratamiento se adecuará a las condiciones clínicas y a los futuros deseo de fertilidad de la paciente.
El abordaje laparoscópico para el tratamiento del embarazo tubárico, en pacientes hemodinámicamente estables, es preferible mediante laparotomía. RECOMENDACIÓN DE GRADO A.
Técnicas laparoscópicas
Independientemente de la técnica realizada, se insertará una sonda de Foley antes de iniciar el procedimiento y un movilizador uterino. En primer lugar, se realizará una laparoscopia diagnóstica para confirmar el EE que servirá para decidir acerca de la radicalidad de la intervención. Habitualmente, suelen bastar 2 trocares, uno en cada fosa ilíaca, de 5 y 10 mm, además del umbilical para la óptica. Las técnicas posibles son:
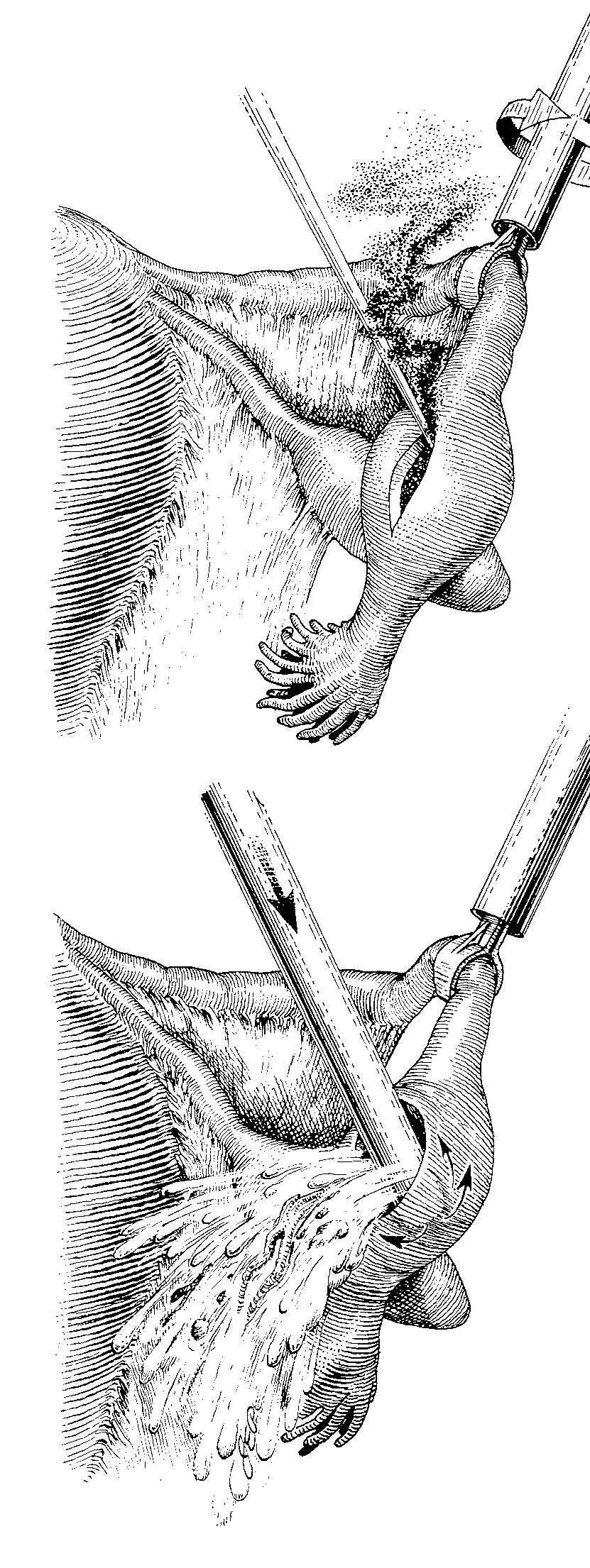
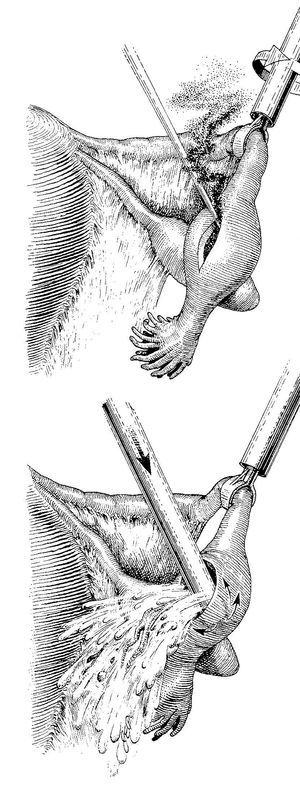
-- Salpingostomía (fig. 1):
Figura 1. Salpingostomía.
• Fijación de la trompa e incisión de 1-2 cm en el borde antimesentérico con bisturí, tijera o electrodo de aguja. Algunos autores recomiendan infiltrar el mesosalpinx con una solución de vasopresina (20 U en 50 ml) o de adrenalina (10 U en 50 ml).
• Inserción profunda del endoirrigador-aspirador en el interior a través de la incisión.
• Lavado-aspirado profuso y a presión, disecando y aspirando el EE y los coágulos y extracción.
• Hemostasia cuidadosa de los bordes de la incisión, dejándola abierta.
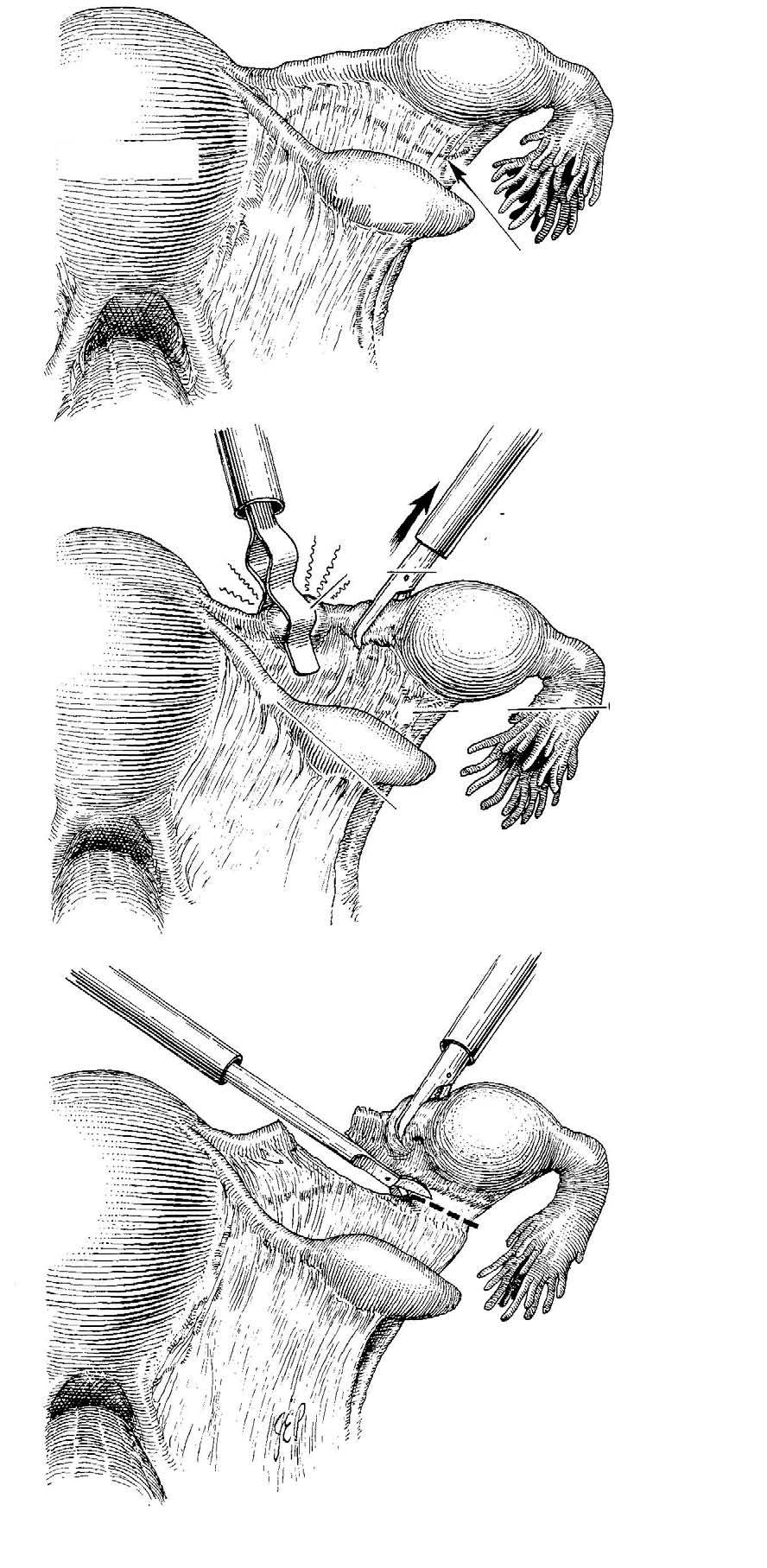
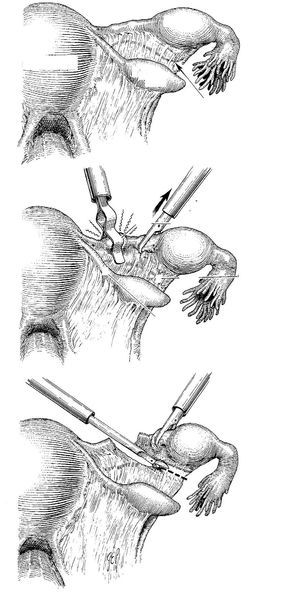
-- Salpingectomía (fig. 2):
Figura 2. Salpingectomía.
• Desecación de la trompa entre el útero y el EE usando coagulación bipolar.
• Pinzar y coagular la arteria tuboovárica preservando el ligamento útero-ovárico.
• Cortar por el tejido coagulado, más próximo a la trompa, repitiendo la maniobra hasta que la trompa esté completamente liberada.
-- Expresión fímbrica:
• Fijación de la fimbria y rotación para permitir la introducción del irrigador-aspirador.
• Lavado bajo presión y aspiración de coágulos y tejidos trofoblásticos.
-- Salpingectomía parcial:
• Coagulación bipolar de la trompa a ambos lados del EE.
• Sección en los lugares coagulados.
• Coagulación o aplicación de endo-loop en mesosalpinx y sección de éste.
• Extracción del EE.
La salpingectomía puede estar indicada en las siguientes situaciones:
-- EE roto.
-- No hay deseo de futura fertilidad.
-- EE por fallo de esterilización.
-- Cirugía tubárica reconstructiva previa.
-- Deseo de esterilización.
-- Hemorragia incoercible tras una salpingostomía.
-- EE situado en el extremo ciego distal después de una salpingectomía parcial.
-- EE persistente.
Tres estudios aleatorizados han comparado la cirugía abierta con la vía laparoscópica, y esta última resultaba más corta, con menos sangrado, más corta estancia y requería menos analgesia. Las técnicas de la vía abierta no difieren de las descritas para la vía laparoscópica salvo el abordaje. No hubo diferencias en cuanto a la tasa de permeabilidad tubárica y los embarazos intrauterinos fueron similares en ambos grupos, con una menor reincidencia de EE en el grupo laparoscópico. Por otro lado, la salpingostomía laparoscópica fue menos eficaz en la eliminación completa del EE que el abordaje laparotómico, hecho reflejado en unas tasas mayores de trofoblasto persistente. EVIDENCIA DE NIVEL Ia.
El tratamiento del EE en presencia de inestabilidad hemodinámica debe tratarse por el método más expeditivo. En la mayoría de los casos mediante laparotomía. RECOMENDACIÓN DE GRADO C.
Cirujanos experimentados pueden ser capaces de manejar laparoscópicamente de forma segura un hemoperitoneo importante. En cualquier caso, deberá recurrirse a la vía que con mayor rapidez asegure una hemostasia estable. En la mayoría de los centros ésta es la laparotomía. EVIDENCIA DE NIVEL IV.
En presencia de una trompa contralateral sana no hay evidencia clara de que la salpingostomía deba usarse preferentemente a la salpingectomía. RECOMENDACIÓN DE GRADO B.
Varias revisiones sistemáticas han estudiado las tasas reproductivas tras el tratamiento del EE mediante salpingostomía o salpingectomía. Sin embargo, no hay al respecto estudios controlados aleatorizados. Los datos disponibles muestran que o no hay diferencias en las tasas de gestaciones intrauterinas entre ambas técnicas o son ligeramente mayores para la salpingostomía. Sin embargo, este beneficio puede ser reducido, dado que la técnica conservadora entraña un mayor riesgo de hemorragia inmediata postoperatoria, de enfermedad trofoblástica persistente y posibilidad de un EE recurrente. EVIDENCIA DE NIVEL IIa.
La salpingostomía laparoscópica debe considerarse como tratamiento primario en el EE en presencia de enfermedad tubárica contralateral y deseo de fertilidad futura. RECOMENDACIÓN DE GRADO B.
Cuatro estudios de cohortes han estudiado las tasas de gestaciones tras EE tratados mediante salpingostomía laparoscópica frente a salpingectomía laparoscópica, en pacientes con trompa contralateral enferma, con mejores resultados gestacionales para la primera (el 49 frente al 27%). Las mujeres con una trompa contralateral dañada o ausente, a las que se realice una salpingectomía, precisarán obligatoriamente FIV para gestar, motivo suficiente para justificar una técnica conservadora, ya que resulta más favorable desde el punto de vista coste-efectivo. EVIDENCIA DE NIVEL IIa.
Aunque el tratamiento médico no es objeto de análisis en el presente protocolo, cabe señalar que debe de considerarse si concurren las siguientes circunstancias:
-- Estabilidad hemodinámica.
-- No hay evidencia de rotura o hemorragia intraabdominal significativa.
-- Trompa menor de 3-4 cm de diámetro.
-- Ausencia de actividad cardíaca en ecografía.
-- Valores de beta-HCG menores de 5.000 U/l.
-- No hay contraindicación para el uso del metotrexato.
-- Consentimiento informado.
-- Certeza de que se podrá realizar un adecuado seguimiento y control.
El tratamiento médico debe ser ofrecido a las mujeres que reúnan las condiciones adecuadas, y los servicios deben disponer del tratamiento y protocolos de seguimiento para el uso del metotrexato como tratamiento del EE. RECOMENDACIÓN DE GRADO B.
Muchos EE seguirán una evolución relativamente crónica y la combinación de ecografía transvaginal y la determinación seriada de beta-HCG permiten un diagnóstico fiable de EE sin tener que recurrir a la laparoscopia. Algunos estudios, con grupo control o no, han demostrado que en pacientes estables varios tratamientos médicos resultan tan eficaces como la cirugía. La dosis habitual de metotrexato aplicada por vía intramuscular más aceptada es de 50 mg/m2 (para la mayoría de las mujeres dosis entre 75 y 90 mg). Se determinarán los valores de beta-HCG los días 4 y 7 tras la inyección; si éstos no han descendido entre ambas determinaciones más del 15%, se administrará una segunda dosis. Ésta será necesaria en un 14% de los pacientes, y en un 10% será necesario recurrir al tratamiento quirúrgico. EVIDENCIA DE NIVEL IIa.
También puede aplicarse en inyección directa en la trompa mediante soporte ecográfico transvaginal en dosis de 50 mg disueltos en 1 ml de suero o dosis de 1 mg/kg/día durante 3-5 días, o 5 mg 3 veces al día durante 5 días. En todos los casos se tendrá presente la utilización de ácido polínico en previsión de toxicidad por el metotrexato.
Si se ofrece el tratamiento médico, la paciente recibirá una clara información (preferiblemente escrita) sobre la posibilidad futura de necesitar otro tratamiento y sobre sus efectos secundarios. La paciente debe ser capaz de acudir con facilidad al centro para su valoración durante todo el tiempo de seguimiento. RECOMENDACIÓN DE GRADO B.
Un 7% de los EE tratados médicamente presentarán rotura tubárica durante el período de seguimiento y cerca del 75% experimentará un dolor abdominal. Diferenciar éste entre el ocasionado por un aborto tubárico y la rotura del EE puede resultar difícil y, en ocasiones, será necesario ingresar a la paciente para su observación y control. Las pacientes evitarán el coito durante el seguimiento y realizarán anticoncepción efectiva durante los 3 meses siguientes al tratamiento por su posible efecto teratogénico. EVIDENCIA DE NIVEL IIa.
Las mejores candidatas para el tratamiento con metotrexato son las que presentan valores séricos de beta-HCG inferiores a 3.000 U/l y con síntomas mínimos. RECOMENDACIÓN DE GRADO B.
La mayoría de los estudios realizados de tratamiento con metotrexato en EE presentaban concentraciones séricas de beta-HCG inferiores a 5.000 U/l. Durante el período de control postratamiento la necesidad de dosis suplementarias y de tratamiento quirúrgico se incrementa con tasas más altas de beta-HCG. De igual forma, a masas anexiales más grandes más probabilidad de rotura, y la presencia de actividad cardíaca en el EE se asocia con una mayor tasa de fracasos y puede considerarse una contraindicación para el tratamiento médico del EE. EVIDENCIA DE NIVEL IIa.
El tratamiento médico ambulatorio del EE con una sola dosis de metotrexato está asociado con un significativo ahorro en los costes. RECOMENDACIÓN DE GRADO A.
Estudios aleatorizados han demostrado que el tratamiento médico supone un ahorro mayor del 50% que el generado por la cirugía laparoscópica. Sin embargo, este ahorro no se constató si los valores de beta-HCG eran superiores a 1.500 U/l debido a la mayor incidencia de repetición del tratamiento y de un prolongado seguimiento. EVIDENCIA DE NIVEL Ib.
La conducta expectante es una opción para mujeres clínicamente estables con síntomas mínimos y gestación de localización desconocida. RECOMENDACIÓN DE GRADO C.
Cuando los valores de beta-HCG están por debajo de 1.000 U/l (zona de discriminación) y no se evidencia embarazo intrauterino o extrauterino con la ecografía transvaginal, el embarazo se puede definir como de localización desconocida. Cinco estudios observacionales han mostrado que entre el 44 y el 69% de éstos se resuelven espontáneamente con un actitud expectante. En un 14-28% de los embarazos inicialmente de localización desconocida se diagnosticó posteriormente un EE. El tratamiento quirúrgico se realizó en el 23-29% de los casos de localización desconocida con actitud expectante. En estos casos se realizará una determinación seriada de la beta-HCG hasta que esta sea menor de 20 U/l. En todos los casos de conducta expectante se debe informar detalladamente a la paciente, preferentemente por escrito. EVIDENCIA DE NIVEL III.
La conducta expectante es una opción en pacientes asintomáticas clínicamente estables con diagnóstico ecográfico de EE y valores séricos de beta-HCG descendientes, inicialmente menores de 1.000 U/l. RECOMENDACIÓN DE GRADO C.
La mayoría de los estudios realizados, para aceptar una conducta expectante requieren masas anexiales menores a 4-5 cm y menos de 50-100 ml de líquido libre, y se precisó una disminución del 15% en las primeras 24 h de los valores iniciales de beta-HCG. El éxito de este tipo de conducta es más elevado (88%) si las tasas iniciales de beta-HCG son inferiores a 1.000 U/l. Durante el tiempo de seguimiento de determinará la beta-HCG 2 veces por semana y semanalmente se realizará una ecografía transvaginal hasta alcanzar valores inferiores a 20 U/l. EVIDENCIA DE NIVEL III.
Los casos de trofoblasto persistente (falta de descenso de los valores de beta-HCG), se asocian más a la realización de salpingostomía que de salpingectomía. Se presenta en el 8,1-8,3% de las salpingotomías laparoscópicas y en el 3,9-4,1% de las laparotómicas. Como factores de riesgo para ello se señalan unos valores preoperatorios de HCG superiores a 3.000 U/l, una rápida elevación preoperatoria de los valores de HCG y la presencia de un sangrado activo tubárico. Como tratamiento del trofoblasto persistente se ha utilizado metotrexato en dosis de 50 mg/m2 en lugar de repetir el tratamiento quirúrgico. Se ha propuesto el uso de metotrexato de forma profiláctica a la vez de la salpingostomía laparoscópica y un estudio aleatorizado señala una significativa reducción en el grupo tratado. EVIDENCIA DE NIVEL IV.
Las mujeres no sensibilizadas con Rh negativo con un EE sospechado o confirmado deben recibir inmunoglobulina anti-D.
Conducta expectante y tratamiento médico del embarazo ectópico
DECLARO
Que el Doctor/a
(nombre y 2 apellidos del facultativo que proporciona la información)
Me ha explicado que según los datos clínicos, ecográficos y analíticos se ha llegado a la conclusión de que padezco un embarazo ectópico. Dicho proceso consiste en la implantación de un embarazo fuera de su lugar natural, que es el útero (el lugar más frecuente de implantación ectópica son las trompas de Falopio, pero también puede ocurrir en el ovario, cuello y/o cuerno uterino y abdomen).
Esta situación puede comprometer mi salud y se plantean diferentes alternativas:
1. Conducta expectante (no intervención): se realiza, sobre todo, en los casos donde no se puede identificar la localización del embarazo (por ecografía) y la medición de la hormona del embarazo (beta-HCG) es baja y progresivamente decreciente (supone la extracción periódica de sangre para su análisis).
2. Tratamiento médico con metotrexato: consiste en la utilización de un fármaco denominado metotrexato que impide la proliferación de las células del embarazo. Se puede inyectar localmente (en la trompa enferma, puncionándola con control ecográfico, a través de la vagina) y de forma sistémica (inyección intramuscular). La pauta puede ser en una sola dosis o en dosis repetidas. Supone el seguimiento en días posteriores de la hormona del embarazo (beta HCG) en sangre materna, hasta objetivar su negativización (éxito del tratamiento).
3. En algunos casos, si la beta-HCG no disminuye o aumenta, se requieren nuevas dosis, o cirugía, ante una mala evolución (fracaso del tratamiento médico). Se estima que la tasa de éxito del tratamiento ronda el 75-90%, si se cumplen unos criterios de selección de pacientes candidatas a su uso (criterios clínicos, ecográficos y analíticos) y se evita su utilización en pacientes con contraindicaciones (inestabilidad hemodinámica, insuficiencia hepática...).
4. Los riesgos en las dosis utilizadas de metotrexato son muy bajos (inflamación de mucosas, náuseas, vómitos, bajada de glóbulos blancos, pérdida de cabello...)
5. Su uso supone la conservación de la trompa afectada, con un riesgo aproximado de repetir el embarazo ectópico del 15%. Es muy útil su empleo en los casos de embarazos ectópicos cervicales y cornuales (en el cuello o en un cuerno del útero) para evitar cirugías agresivas.
6. Por mi situación actual, el médico me ha explicado que pueden aumentar o aparecer riesgos o complicaciones como
En mi caso el tratamiento elegido ha sido
He comprendido las explicaciones que se me han facilitado en un lenguaje claro y sencillo y el facultativo que me ha atendido me ha permitido realizar todas las observaciones y me ha aclarado todas las dudas que le he planteado.
También comprendo que en cualquier momento y sin necesidad de dar ninguna explicación puedo revocar el consentimiento que ahora presto.
Por ello, manifiesto que estoy satisfecha con la información recibida y que comprendo el alcance y los riesgos del tratamiento.
Y en tales condiciones
CONSIENTO
Tratamiento quirúrgico del embarazo ectópico
DECLARO
Que el doctor/a
(nombre y 2 apellidos del facultativo que proporciona la información)
Me ha explicado que según los datos clínicos, ecográficos y analíticos se ha llegado a la conclusión de que padezco un embarazo ectópico. Dicho proceso consiste en la implantación de un embarazo fuera de su lugar natural, que es el útero (el lugar más frecuente de implantación ectópica son las trompas de Falopio, pero también puede ocurrir en el ovario, cuello y/o cuerno uterino y abdomen).
Esta situación puede comprometer mi salud y se plantean diferentes tratamientos:
1. Hay dos alternativas:
-- Apertura de la trompa y extracción del embarazo, conservando la trompa (tratamiento quirúrgico conservador).
-- Extirpación de la trompa dañada (tratamiento radical).
2. La decisión entre una forma u otra muchas veces sólo se podrá tomar en el transcurso de la cirugía al visualizar el estado de la trompa. La trompa deberá ser extirpada si se encuentra rota o en otras circunstancias de deterioro, adherencias, antecedente de otro ectópico en esa trompa, etc., por el alto riesgo de recidiva que conlleva su conservación. También servirá en la decisión el deseo de nuevos embarazos, así como la existencia de una sola trompa.
3. El riesgo de aparición de un nuevo embarazo ectópico tras la cirugía conservadora es aproximadamente de un 15%, aunque la extirpación de la trompa no evita la probabilidad de un nuevo embarazo ectópico en la otra trompa.
4. El tratamiento conservador requerirá un posterior seguimiento con beta-HCG en sangre materna hasta su negativización; si ésta no se produce o el ritmo de descenso no es el adecuado, se podrá recurrir al uso de metotrexato o, si fuera necesario, a una nueva cirugía.
5. La cirugía puede realizarse por laparoscopia o laparotomía. Ambas formas pueden tener complicaciones, como infecciones, hematomas, lesiones viscerales y vasculares, etc.
6. Complicaciones y/o riesgos y fracasos. Toda intervención quirúrgica, tanto por la propia técnica como por el estado de salud de cada paciente (diabetes, cardiopatías, hipertensión, anemia, obesidad, edad avanzada, etc.), lleva implícita una serie de posibles complicaciones comunes y otras potencialmente más importantes que podrían requerir tratamientos complementarios, tanto médicos como quirúrgicos, así como, excepcionalmente, un porcentaje mínimo de mortalidad.
Si en el momento del acto quirúrgico surgiera algún imprevisto, el equipo médico podrá modificar la técnica quirúrgica habitual o programada.
7. Por mi situación actual, el médico me ha explicado que pueden aumentar o aparecer riesgos o complicaciones como
8. Anestesia. La intervención precisa efectuarse bajo anestesia, que será valorada bajo la responsabilidad del servicio de anestesia.
9. Transfusiones. No se puede descartar a priori que en el transcurso de la intervención programada surja la necesidad de una transfusión sanguínea, que, en todo caso, se realizaría con las garantías debidas y por el personal facultativo cualificado para ello.
10. Anatomía patológica. La pieza o piezas extirpadas en la intervención se someterán a un estudio anatomopatológico posterior para obtener el diagnóstico definitivo, siendo la paciente y/o sus familiares o representante legal, en su caso, informados de los resultados del estudio.
He comprendido las explicaciones que se me han facilitado en un lenguaje claro y sencillo y el facultativo que me ha atendido me ha permitido realizar todas las observaciones y me ha aclarado todas las dudas que le he planteado.
También comprendo que en cualquier momento y sin necesidad de dar ninguna explicación puedo revocar el consentimiento que ahora presto.
Por ello, manifiesto que estoy satisfecha con la información recibida y que comprendo el alcance y los riesgos del tratamiento.
Y en tales condiciones
CONSIENTO
REVOCACIÓN
BIBLIOGRAFÍA GENERAL
Cano I. Cirugía endoscópica del embarazo éctopico. En: Comino R, Balagueró L, Del Pozo J, editores. Cirugía endoscópica en ginecología. Barcelona: Prous Science; 1998. p. 87-91.
Diamond MP. Ectopic pregnancy: linear salpingostomy. En: Soderstrom RM, editor. Operative laparoscopy. New York: Raven Press; 1993. p. 91-4.
Pessarrodona A, Borrás R, Cassadó J. Embarazo ectópico, concepto y clasificación. Estudio de sus diversas formas. En: Sociedad Española de Ginecología y Obstetricia, editor. Tratado de ginecología, obstetricia y medicina de la reproducción. Madrid: Panamericana; 2003. p. 559-63.
Royal College of Obstetricians and Gynaecologists. The management of tubal pregnancy. Guideline n.o 21. London: RCOG Press; 2004.
Sociedad Española de Ginecología y Obstetricia. Embarazo ectópico. Protocolos en Obstetricia n.o 8. Madrid: SEGO; 1998.