La embolia de líquido amniótico es una patología infrecuente y grave con una alta mortalidad. De fisiopatología compleja, la clínica consiste en dificultad respiratoria, confusión mental, fallo cardiaco progresivo y coagulación intravascular diseminada que conducen a la muerte o a graves secuelas neurológicas. Se describe el caso de una paciente de 39 años, gestante de 40 semanas, que ingresa en trabajo de parto y que, a los 40 min del parto instrumentado, presenta súbitamente un abundante sangrado genital, hipotensión persistente y progresiva, compromiso de su estado de consciencia y «shock». La sospecha, la reanimación inmediata y el manejo multidisciplinario de esta compleja situación modificaron el pronóstico del caso.
Amniotic fluid embolism is an uncommon and serious clinical syndrome that leads to high mortality. Its complex pathophysiology produces dyspnea, confusion, progressive heart failure and disseminated intravascular coagulation leading to death or severe neurologic sequelae. We report the case of a 39-year-old woman at 40 weeks of pregnancy who was admitted to hospital during labor. After 40minutes of instrumental delivery, the patient developed sudden, abundant genital bleeding, hypotension, progressive loss of consciousness and “shock”. Early suspicion, immediate resuscitation, and multidisciplinary management of this complex clinical situation modified the outcome of this case.
La embolia de líquido amniótico (EA) es una patología infrecuente con una alta mortalidad. De fisiopatología compleja, conduce a fallo cardiaco y a coagulación intravascular diseminada (CID); su inicio es abrupto y la clínica se caracteriza por disnea, hipoxemia e hipotensión, a las que sigue el colapso cardiopulmonar. La hemorragia y la coagulación intravascular diseminada son muy comunes y generalmente se presentan después de realizado o sospechado el diagnóstico.
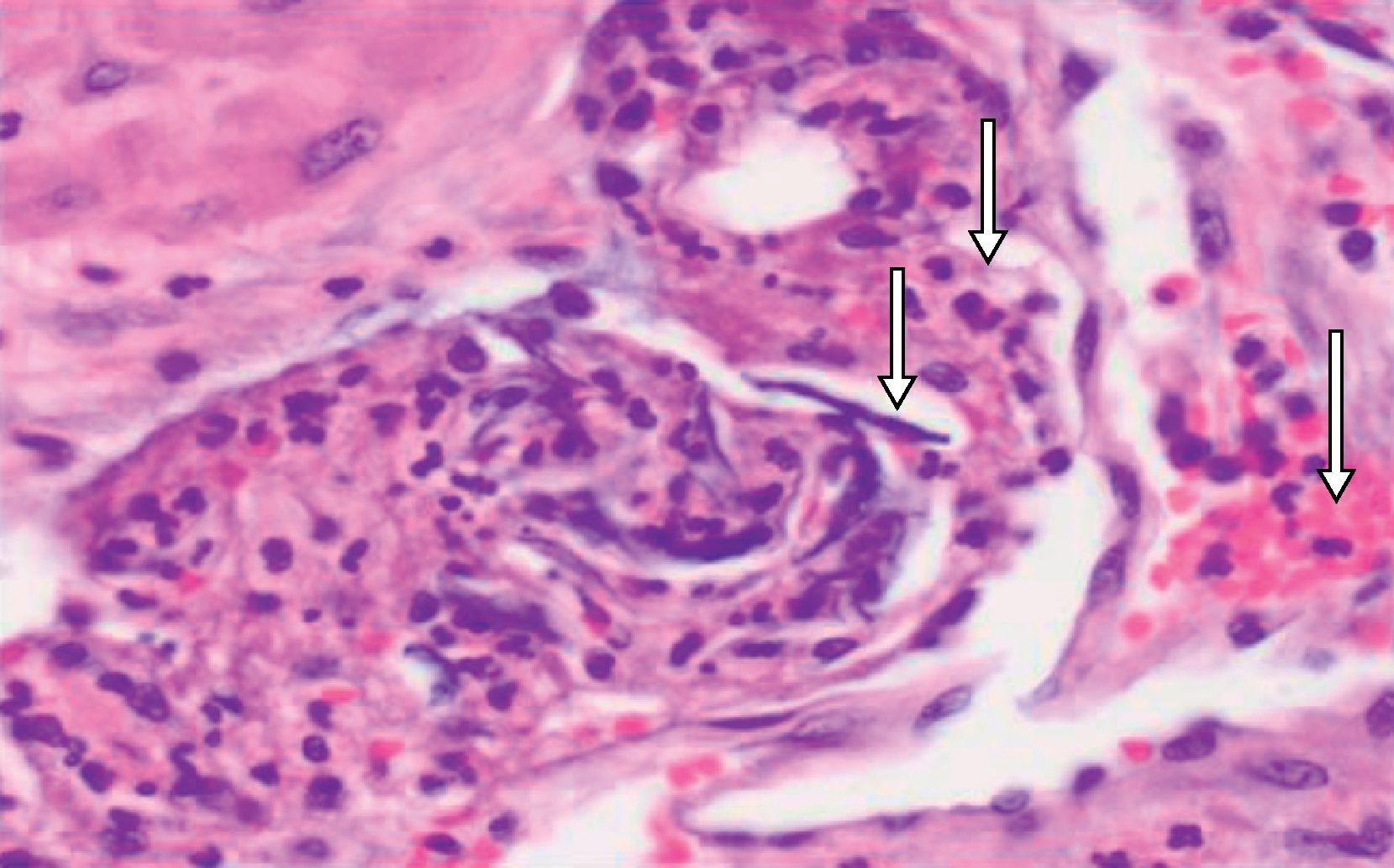
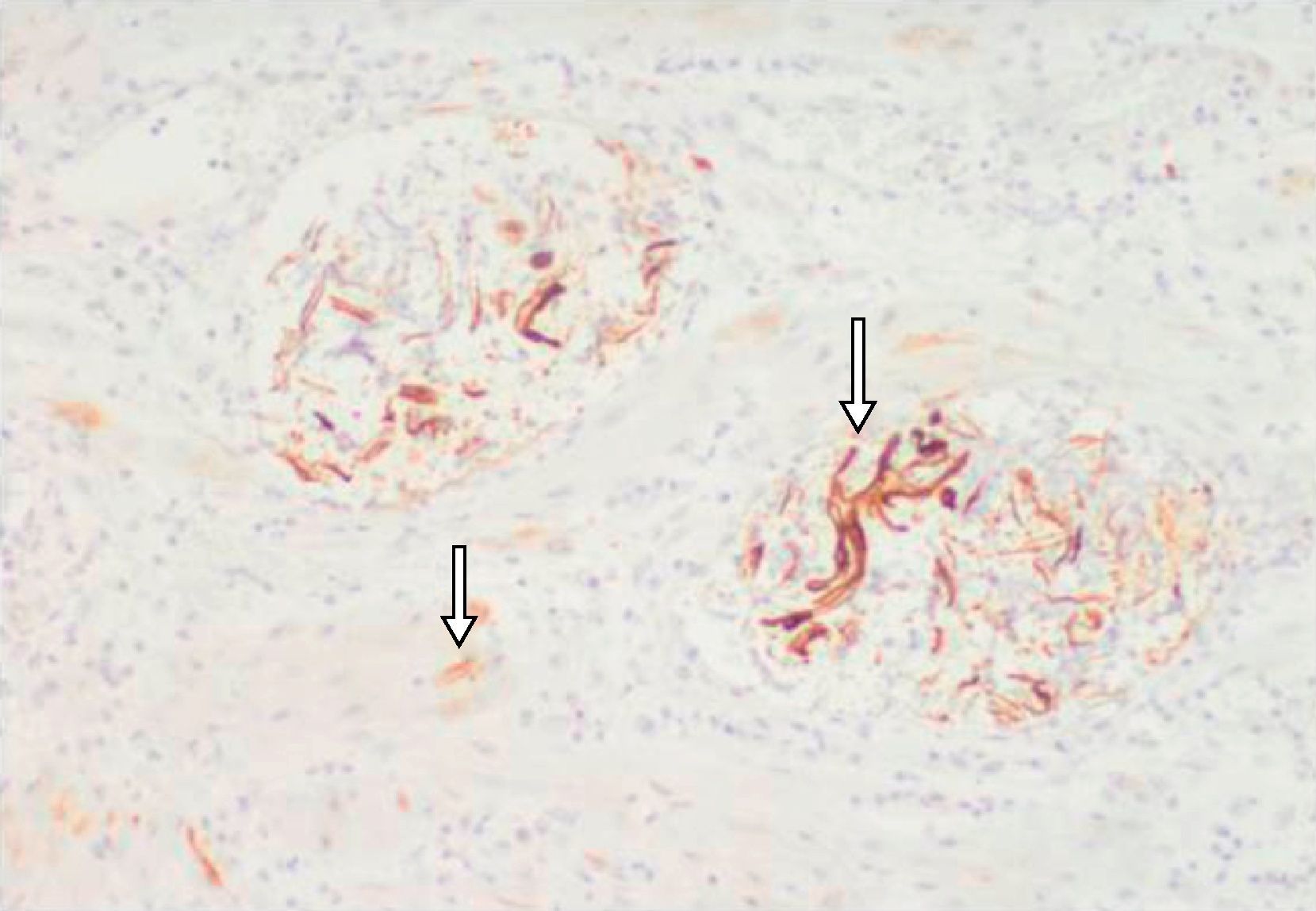
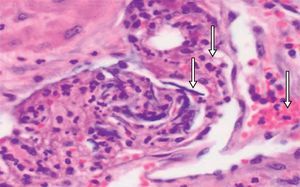
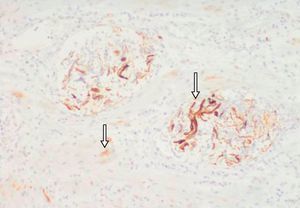
Descripción del casoPaciente de 39 años, gestante de 40 semanas, que ingresó a las 1:20 horas en trabajo de parto. Sus antecedentes eran TPAL 1.0.1.1, portadora de HBsAg, de un mioma uterino intramural y de un fibroadenoma de mama izquierda. La gestación actual fue mediante fertilización «in vitro» y siguió una evolución correcta donde solo destacó una infección urinaria por Streptococcus agalactiae en el segundo trimestre. Al ingresar, se inició la profilaxis de la transmisión vertical del estreptococo con penicilina sódica. La dilatación transcurrió sin incidencias: amniorrexis espontánea a las 2:20 horas con salida de líquido amniótico claro, anestesia epidural a las 4:30 horas y dilatación completa a las 6:00. A las 7:38, fórceps de Naegle por sospecha de pérdida de bienestar fetal y nacimiento de un niño de 4.140 g, con un Apgar de 9-9-10 y pH de cordón de 7,25 (arteria umbilical) y de 7,31 (vena umbilical). Se suturó un desgarro vaginal posterior de primer grado. A las 8:20 horas (a los 40 min del parto) la paciente presentó sangrado vaginal abundante, acompañado de lipotimia e hipotensión arterial (sistólica de 51mmHg y diastólica de 32mmHg). Se administró Voluven® 6%, se aumentó la perfusión de oxitocina por vía intravenosa, se administraron 0,2mg de Methergyn® por vía intramuscular y se realizó una exploración del canal del parto que no objetivó lesiones; simultáneamente, se avisó al anestesiólogo de guardia presencial. Se constató atonía uterina y, para descartar la retención de restos placentarios, se desestimó, por la urgencia y el cariz de la clínica que acontecía, la exploración ecográfica y se realizó un legrado uterino bajo sedación con el que se obtuvieron escasos restos de membranas. Al persistir la atonía, se inició tratamiento con Hemabate® (2 dosis por vía intramuscular) y se consiguió una ligera disminución del sangrado. Tras la segunda dosis, la paciente entró en «shock» hemodinámico y se inició transfusión (a las 8:50 horas) del primer concentrado de hematíes; simultáneamente, se decidió la intubación orotraqueal, se trasladó al quirófano para resolver el cuadro clínico y se solicitaron urgentemente plaquetas al Banco de Sangre y Tejidos de Barcelona. Se decidió realizar una histerectomía, que se desarrolló sin incidencias hasta el cierre de la cúpula vaginal: se observó sangrado activo anexial bilateral de la cúpula vaginal y del peritoneo visceral y la primera analítica sanguínea, realizada después de la transfusión de 5 concentrados de hematíes y de 2 bolsas de plasma cuando la paciente ya estaba en el quirófano, confirmó una CID con anemia grave y acidosis metabólica (tabla 1). La paciente no tenía antecedentes clínicos para sospechar una coagulopatía previa y las pruebas de hemostasia del análisis de seguimiento del tercer trimestre del embarazo habían sido normales. Para el control de la hemorragia se realizaron también una anexectomía izquierda y una salpingectomía derecha; se colocaron puntos hemostáticos en la cúpula vaginal y se realizó la electrocoagulación de puntos sangrantes en peritoneo visceral. Al no obtener un control definitivo del sangrado en la cúpula vaginal y el peritoneo vesicouterino, se utilizó Tachosil® (3 unidades), logrando un control de la hemostasia. Se colocó un drenaje (Redón 14) y se cerró la pared abdominal. Durante la intervención se previno la hipotermia con manta térmica e, incluido el postoperatorio inmediato, se administraron 5 concentrados de hematíes. Se trasladó la paciente a la UCI, donde se mantuvieron las medidas de soporte hemodinámico. A las 6 horas post histerectomía, presentó hipotensión y taquicardia progresivas, que requirieron dosis crecientes de noradrenalina, la exploración física objetivó una importante distensión abdominal y por ecografía abdominal se sospechó hemoperitoneo masivo. La paciente fue reintervenida a las 20:00 horas por un equipo multidisciplinario (de los servicios de Ginecología, Cirugía General y Cirugía Vascular). Se confirmó el diagnóstico ecográfico de hemoperitoneo masivo (con aproximadamente 2.000 cc) y se encontraron hematoma retroperitoneal de predominio izquierdo que infiltraba mesosigma, hematoma de pared abdominal izquierda y sangrado activo de cúpula vaginal. Se drenó el hematoma retroperitoneal, se reforzó la ligadura de infundíbulo pélvico y se suturó un vaso sangrante de la cúpula vaginal. Para conseguir el correcto control hemostático de la cúpula vaginal, se utilizó nuevamente Tachosil®. Se dejó un drenaje de Saratoga y se reforzó la pared abdominal con Ventrofil®. Durante las primeras 48 h, la paciente requirió un total de 26 concentrados de hematíes, 4 «pool» de plaquetas (los 2 primeros fueron administrados después de la primera intervención quirúrgica, cuando la paciente ya estaba en la UCI), 12 unidades de plasma, 5g de fibrinógeno y 2 dosis de 5mg de factor VIIa r (también administradas en las primeras horas de su ingreso en la UCI), y se consiguió la estabilización hemodinámica y de los parámetros hematológicos. La paciente presentó una evolución favorable: se extubó al quinto día de la intervención y se trasladó a planta 2 días más tarde. El estudio anatomopatológico de la pieza de histerectomía confirmó una embolia de líquido amniótico (figs. 1 y 2). Con el diagnóstico de EA y para completar el estudio clínico, la paciente fue valorada por el servicio de Neurología. La exploración neurológica y la TC cerebral se informaron como normales y la paciente fue dada de alta a los 20 días del ingreso por parto.
Resultados del laboratorio (10:00 horas)
| Parámetro | Valor |
| Hematocrito | 20,1 |
| Hemoglobina | 6,8 |
| Leucocitos | 19.200 |
| Neutrófilos | 59,0% |
| Bandas | 18,0% |
| Linfocitos | 8,0% |
| Monocitos | 8,0% |
| Metamielocitos | 6,0% |
| Mielocitos | 1,0% |
| Plaquetas | 49.000 |
| Índice de protrombina | No detectable |
| INR | No detectable |
| Tromboplastina parcial | No detectable |
| pH | 6,97 |
| pCO2 | 38,0 |
| CO2 total | 9,9 |
| Bicarbonato | 8,7 |
| Exceso de bases | 23,11 |
La EA es una de las causas de muerte repentina en obstetricia. Su incidencia en la literatura varía de 1:8.000 a 1:80.000 partos1. El 70% de los casos de EA tiene lugar durante el trabajo de parto, el 11% después del parto por vía vaginal y el 19% durante una cesárea. La mortalidad materna varía según las series entre el 26 y 61% y, más del 50% de las pacientes que mueren, lo hacen durante la primera hora de instauración del cuadro2. Entre un 6 y un 15% de las supervivientes desarrollan daño neurológico permanente. La supervivencia neonatal es de un 79% y cerca del 50% de estos son neurológicamente sanos. Se describe un 18% de encefalopatía hipóxico-isquémica y un 6% de parálisis cerebral3.
La EA fue descrita por Meyer en 1926, reafirmada por Steiner y Lushbaugh en 1941 y posteriormente por Liban y Raz, quienes verificaron la presencia de células escamosas de posible origen fetal en órganos maternos en mujeres que presentaron cianosis, hipotensión y coagulopatía en el posparto. En 1993, Benson4 propone una nueva descripción fisiopatológica y, posteriormente reforzado por Clark5, se crea la denominación de síndrome anafilactoide del embarazo debido a que se desencadena una respuesta inmunitaria similar a la observada en el «shock» anafiláctico. En ciertas condiciones, cuando el líquido amniótico o componentes fetales entran en contacto con la circulación materna, algunos mediadores internos (prostaglandinas, leucotrienos e histamina) se liberan y se genera una respuesta materna patológica consistente en hipoxia, inestabilidad hemodinámica y/o CID. Estos 3 elementos pueden o no ocurrir de manera uniforme en las pacientes y alguno de ellos ser predominante del cuadro o incluso estar ausente3. Los factores que se asocian a EA son la rotura alta de la bolsa amniótica, el desprendimiento precoz de placenta normoinserta, las maniobras intrauterinas, el parto instrumentado, la cesárea, la hiperdinamia uterina, el empleo de catéteres para amnioinfusión, el aborto inducido y la muerte fetal anteparto6–8. La presentación más común consiste en disnea de inicio repentino, palidez, alteración de la consciencia, hipotensión severa, depresión cardiovascular y «shock», pudiendo conducir al paro cardiaco y a la muerte. Otros síntomas presentes son fiebre, náusea, vómitos, cefalea y signos de pérdida de bienestar fetal. El origen de esta secuencia de acontecimientos sería la exposición de los alvéolos pulmonares a un fluido inmunológicamente activo, como es el líquido amniótico, que presenta tromboxano y ácido araquidónico capaces de producir espasmo vascular pulmonar severo, cambios en la circulación capilar, depresión miocárdica, hipotensión, edema pulmonar secundario a insuficiencia ventricular izquierda y «shock»3.
En 1999, Shechtman et al.9 demostraron, mediante la realización de ecocardiografía transesofágica durante los primeros 30 min de instaurado el cuadro agudo en pacientes con EA, hipertensión pulmonar severa, insuficiencia ventricular derecha aguda con desviación hacia la izquierda de los tabiques interauricular e interventricular y regurgitación grave de la válvula tricúspide. La insuficiencia ventricular izquierda era secundaria a la alteración de llenado del ventrículo izquierdo, a causa de un ventrículo derecho dilatado y una desviación del tabique interventricular. Estos hallazgos sugieren que la vasoconstricción pulmonar y el aumento de la resistencia vascular pulmonar son los principales mecanismos responsables del colapso cardiovascular producido. Es importante destacar que la mayoría de los estudios que demuestran insuficiencia ventricular izquierda como la principal alteración hemodinámica asociada a EA la observaron más de una hora después de la aparición de signos clínicos3. En conclusión, la evidencia actualmente disponible sugiere que la respuesta hemodinámica a la EA es bifásica, con un aumento inicial en la resistencia vascular pulmonar e insuficiencia ventricular derecha, seguida de fallo ventricular izquierdo. La hipoxemia se explicaría por graves desequilibrios en la relación ventilación-perfusión debido a la intensa vasoconstricción pulmonar, que se produce durante la fase inicial. Aunque el mecanismo preciso para inducir CID en la EA sigue sin estar claro, probablemente es multifactorial. In vitro, el líquido amniótico disminuye el tiempo de coagulación, produce un «thromboplastin-like effect», induciendo agregación plaquetaria y activación de la cascada del complemento3,10. La hipótesis actual es que, en la EA, la presencia de factor tisular en el líquido amniótico activaría la vía extrínseca al unirse con el factor VII, provocando coagulación por activación del factor X y el subsiguiente desarrollo de coagulopatía de consumo11. La activación de la cascada de la coagulación a nivel de los vasos pulmonares generaría microtrombosis vascular, provocando vasoconstricción. Recientemente, se ha propuesto que la CID sería secundaria a la activación del complemento en lugar de la introducción directa de procoagulantes en la circulación materna. Existe controversia acerca de si la hemorragia se debe a una coagulopatía de consumo o a una fibrinólisis masiva. Harnett et al.12, mediante el análisis de tromboelastografía, demostraron que la adición de líquido amniótico a la sangre de mujeres embarazadas provoca un estado de hipercoagulabilidad relacionado con la actividad procoagulante del líquido amniótico y una mayor activación de las plaquetas, pero no encontraron evidencias de fibrinólisis, lo que sugiere que la principal causa de la hemorragia en la EA es la coagulopatía de consumo. En el territorio pulmonar los cambios patológicos graves suelen ser inespecíficos y pueden incluir edema pulmonar, atelectasia, congestión pulmonar, enfisema y trombosis. Habitualmente, no hay trombos visibles en las arterias pulmonares principales, corazón u otros sitios. Tradicionalmente el diagnóstico suele basarse en la demostración de la presencia de elementos fetales, presuntamente provenientes del líquido amniótico, dentro de los vasos pulmonares. Apoyan el diagnóstico la presencia de componentes fetales en los capilares del cuello del útero, segmento inferior uterino, riñones, corazón, hígado, bazo, glándulas suprarrenales, páncreas y encéfalo. Sin embargo, la visión actual es que la EA se trata de un síndrome clínico, por lo que su diagnóstico depende de la presentación clínica más que de una exploración histopatológica.
El tratamiento es fundamentalmente de soporte, dirigido a mantener niveles adecuados de oxigenación, gasto cardiaco, presión arterial y corrección de la coagulopatía13. Se debe efectuar en una unidad de cuidados intensivos, intentando mantener una PaO2 de al menos 60mmHg, una adecuada perfusión tisular valorable con una diuresis de al menos 0,5ml/kg/h o mayor de 25ml/h14,15. La administración de productos sanguíneos se considera de primera línea para la corrección de la coagulopatía. La utilización de crioprecipitado es especialmente útil, ya que repone factores de coagulación y además, al contener fibronectina, facilitaría la eliminación de restos celulares y de líquido amniótico de la sangre a través del sistema monocitos/macrófagos. Recientemente, se ha utilizado el factor VIIa recombinante en obstetricia pese a no tener esta indicación en la ficha técnica de comercialización: su uso compasivo se ha justificado en mujeres que no responden al reemplazo de productos sanguíneos convencionales16,17.
El sangrado uterino posparto se controla habitualmente con masaje uterino y uso de oxitocina IV y, si persiste, se debe realizar revisión del canal del parto para descartar restos placentarios o membranas y corregir eventuales laceraciones de cuello o cuerpo uterino. En caso de persistir la hemorragia, el protocolo de hemorragia posparto incluye el uso de oxitocina IV, metilergometrina IM, carboprost trometamina (Hemabate®) IM, balón intrauterino, suturas de compresión y la histerectomía en caso de persistencia de hemorragia18.
El pronóstico ha mejorado notablemente gracias a un diagnostico precoz y un tratamiento rápido y agresivo realizado por un equipo multidisciplinario dado que no existe estrategia de prevención de la EA. Solo la observación constante, el control adecuado con pulsioximetría, la monitorización cardiaca permanente y, de ser posible, la capnografía pueden ayudar a su detección precoz y a la inmediata aplicación de las medidas que nos permitan salvar a la paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.