Evaluar los resultados a medio plazo y la satisfacción de las pacientes después de la embolización de las arterias uterinas en mujeres con miomas uterinos sintomáticos, así como la seguridad del tratamiento.
Material y métodosEstudio prospectivo que incluye 90 casos tratados en el Hospital de Sabadell, entre diciembre del 2002 y octubre del 2006.
La recogida de datos se realizó mediante un cuestionario introducido posteriormente en una base de datos específica; el análisis estadístico se realizó con el programa SPSS 15.0.
Todas las pacientes tuvieron un seguimiento de 2 años después del procedimiento a nivel clínico, analítico y mediante técnicas de imagen.
Los síntomas fueron valorados como desaparición o mejoría, sin cambios o empeoramiento. Los efectos adversos se anotaron según la clasificación de la Sociedad de Radiología Intervencionista. También se recogió la satisfacción de las mujeres embolizadas.
Se consideró un fracaso de la técnica la necesidad de histerectomía o la persistencia de clínica.
ResultadosLa mejoría de los síntomas a los 2 años fue del 90,7%. En 4 casos se practicó una segunda embolización y en 6 casos se realizó una histerectomía.
A los 6 meses, el 92,8 % de los miomas mostraban una vascularización nula o escasa. A los 2 años, la disminución media en el volumen del mioma dominante fue del 76,3%.
El porcentaje de complicaciones mayores fue del 12,7%.
La satisfacción por el procedimiento fue del 90,2%.
ConclusionesLa embolización de las arterias uterinas en mujeres con miomas uterinos sintomáticos es un tratamiento efectivo con una buena aceptación de las pacientes después de un seguimiento a medio plazo.
To evaluate the mid-term outcomes and patient satisfaction following UAE in women with symptomatic leiomyomata, as well as to assess safety treatment.
Material and methodsProspective study of 90 patients from Sabadell Hospital between December 2002 and October 2006.
Data were collected using a questionnaire and was later introduced in a specific database. Statistical analysis of data was carried out using SPSS 15.0.
All patients went on a 2-year follow-up after UAE, including clinical, laboratory and diagnostic imaging examinations.
Symptoms were scored as successful, improvement, unchanged or worsened. Adverse events were noted following the Society of Interventional Radiology's classification. Patients were also asked about their satisfaction.
The need of an eventual hysterectomy or the persistence of symptoms was considered to be a treatment failure.
ResultsThe improvement of symptoms occurred in 90,7% of all the embolized women. We had to perform a second embolization in 4 cases, and a hysterectomy in 6 cases.
6 months later, null vascularisation or hypovascularisation of the myoma was observed in 92.8% of women. Over two years, the average volume reduction of the dominant myoma was 76.3%.
The rate of major complications was 12.7%. Patient satisfaction for the procedure was 90.2%.
ConclusionsUterine artery embolization is an effective treatment for women with symptomatic uterine leiomyomata, being well accepted by the patients in the mid-term follow-up.
Los miomas uterinos son los tumores benignos más frecuentes en mujeres en edad reproductiva, con una prevalencia que oscila entre el 20 y el 40%. El 10-20% de ellos puede originar síntomas como pérdidas sanguíneas, dolor, alteraciones urinarias y/o problemas compresivos. El tratamiento tradicional consiste en la cirugía, ya sea miomectomía o histerectomía.
Una de las nuevas alternativas terapéuticas no quirúrgicas para tratar los miomas uterinos sintomáticos es la embolización de las arterias uterinas (EAU).
Descrita por primera vez en 1995 por Ravina et al1, tiene su precedente en 1991, cuando cita la utilidad de la técnica en la embolización uterina previa a la cirugía del mioma para disminuir su sangrado. Desde entonces, se han publicado numerosas series en Europa2,3 y EE. UU.4, pero escasas en nuestro país5,6, con menor número de casos y tiempo medio de seguimiento.
Además, existen trabajos publicados que analizan no sólo el resultado del procedimiento en términos de eficacia, sino también en términos de satisfacción7,8.
El objetivo de este trabajo es evaluar a medio plazo (2 años), en términos clínicos, analíticos y radiológicos, la eficacia de la EAU para el tratamiento de miomas sintomáticos en nuestras 90 primeras pacientes, así como la seguridad del procedimiento. También se ha evaluado la satisfacción de las pacientes y el tiempo de reincorporación a su vida normal.
MATERIAL Y MÉTODOSEntre diciembre de 2002 y octubre de 2006 se trató mediante EAU a 90 pacientes consecutivas, sin deseo genésico, con miomas uterinos sintomáticos.
Se las incluyó tras aceptación de un consentimiento informado, donde se explicaban el procedimiento, las ventajas, las complicaciones y las posibilidades de éxito.
Antes de la embolización, todas las pacientes fueron evaluadas conjuntamente por el ginecólogo y el radiólogo.
Los criterios de inclusión fueron: la presencia de miomas uterinos sintomáticos (hiperpolimenorrea, dolor, sintomatología urinaria y/o efecto masa) únicos o múltiples, con un tamaño del mioma dominante no>15 cm. No se excluyó explícitamente a las pacientes con adenomiosis asociada, diagnosticada por resonancia magnética (RM) siguiendo los criterios descritos por Siskin et al9.
Se excluyeron los miomas calcificados, los subserosos pediculados, los submucosos resecables por histeroscopia, la presencia exclusivamente de adenomiosis, la sospecha de malignidad, la dificultad de control posterior y la menopausia.
También fueron criterios de exclusión, siguiendo las recomendaciones de la ACOG10: infección activa genitourinaria, inmunodepresión, enfermedad vascular severa que limitara el acceso, alergia al contraste yodado y función renal alterada.
A todas las pacientes se les practicó una ecografía transvaginal, una RM y una angio-RM para determinar el tamaño, el número de miomas y el volumen del mioma dominante, así como un mapa angiográfico anatómico. El volumen del mioma dominante, antes y después del procedimiento, se calculó usando la fórmula del elipsoide (d1×d2×d3×0,5233) cm3[11].
Se practicó una biopsia de endometrio previa al procedimiento para excluir trastornos funcionales y una analítica en el mes anterior al tratamiento para determinar hemograma, hierro y ferritina. A partir del segundo año de reclutamiento, se determinaron hormona foliculostimulante (FSH), hormona luteinizante (LH) y el 170β-estradiol basal.
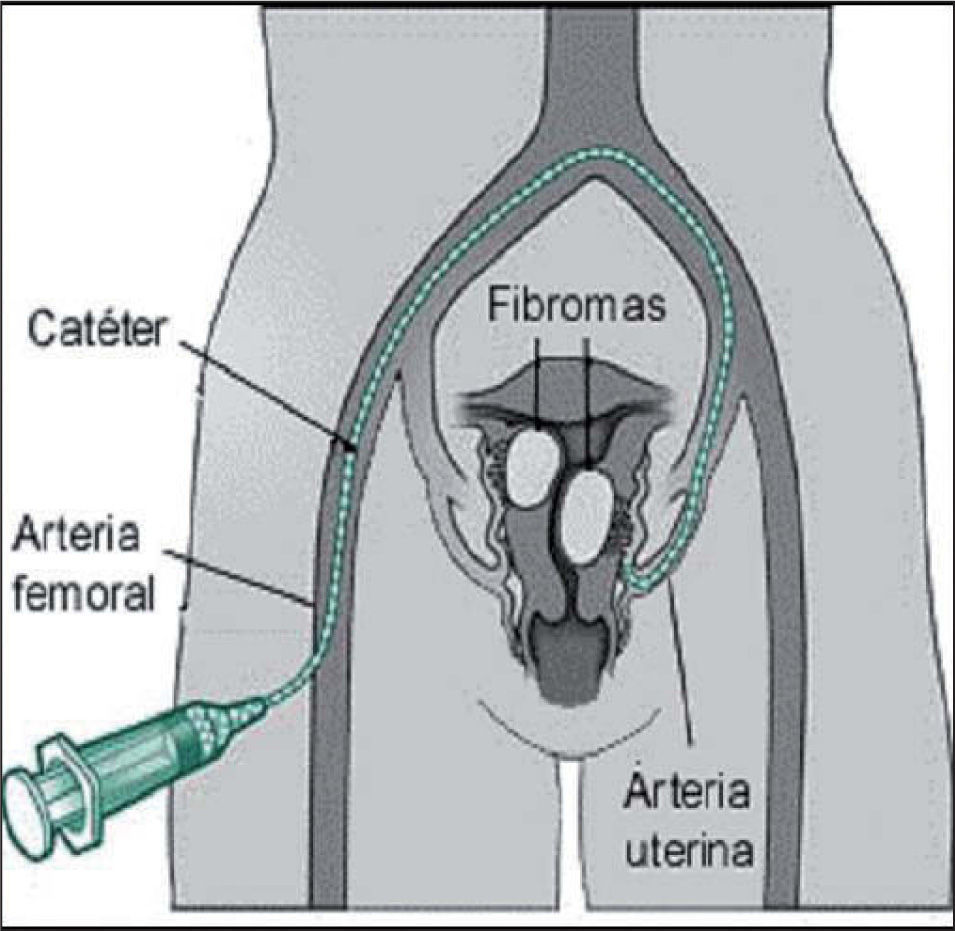
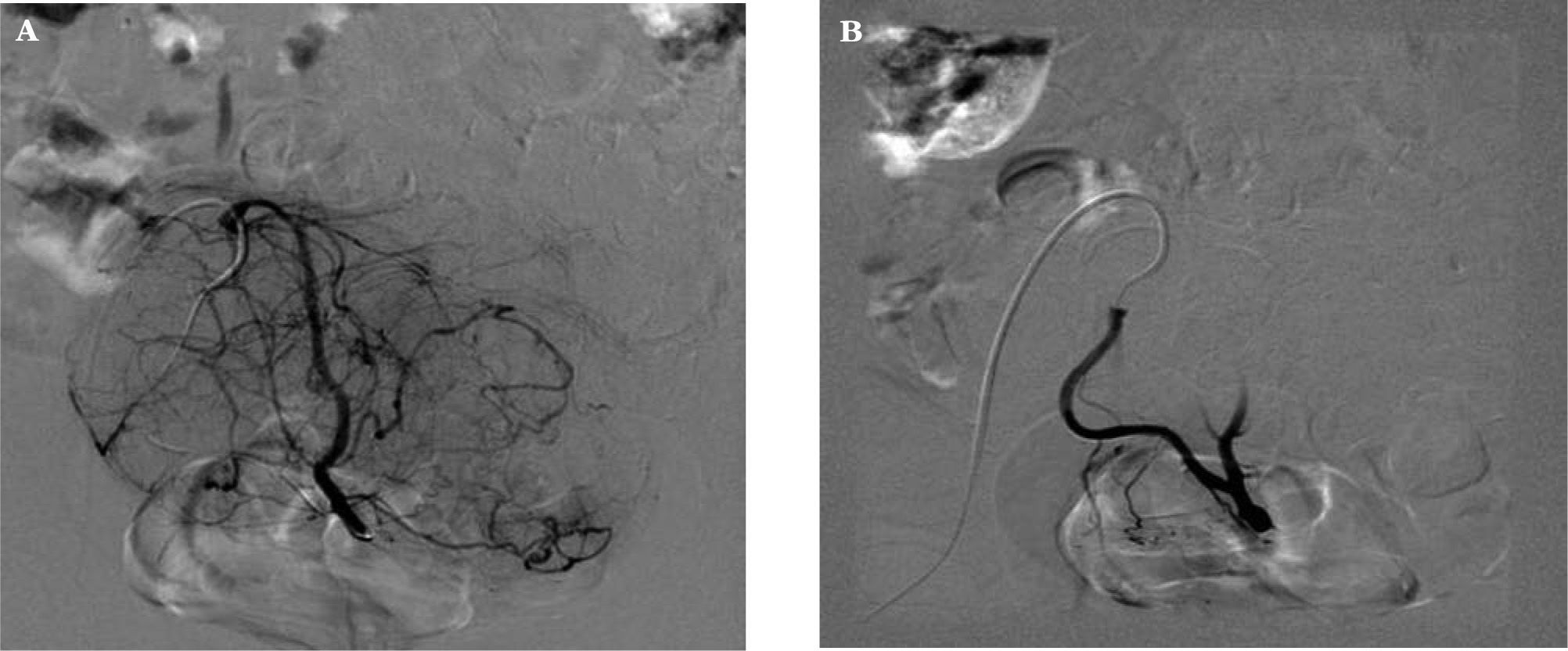
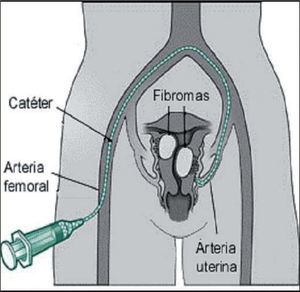
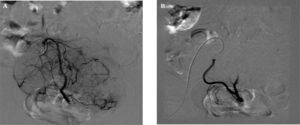
Procedimiento (figs. 1, 2A y 2B)Consiste en la cateterización bilateral supraselectiva, bajo control radiológico, de las dos arterias uterinas y la posterior inyección de partículas esféricas calibradas Embospheres® o Espherical PVA Embozene® de material inerte y tamaño entre 500 y 900 micras, en función del calibre de las arterias uterinas, que bloquean el flujo arterial llevando a la isquemia, necrosis y atrofia de los núcleos miomatosos.
La finalidad de esta embolización con partículas calibradas es llegar a ocluir de forma selectiva las ramas arteriales que conforman el pedículo vascular de los miomas sin producir oclusión de las ramas arteriales del endometrio, que ocasionarían isquemia. Esto se consigue mediante la utilización de partículas de tamaño>500 micras.
Se inicia el procedimiento con la cateterización femoral derecha con un catéter de 5F y bajo visión angiográfica se desplaza este catéter hasta la porción media de las arterias uterinas, intentando preservar la salida de la arteria cervicovaginal.
Para conseguir una adecuada respuesta terapéutica, se requiere la cateterización bilateral de las arterias uterinas.
La técnica se practica mediante anestesia peridural con sedación ligera, o bomba de elastómeros endovenosa durante 48 h, a razón de 2 ml/h, que contiene 50 mg de cloruro mórfico, 24 mg de ondansetrón y 300 mg de dexketoprofeno. El ingreso es de 24 a 48 h.
La duración media del procedimiento varía entre 45 y 130 min, y la radiación media ionizante recibida por paciente es de unos 22 cGY.
La analgesia utilizada después de la EAU consiste en la aplicación de una bomba de anestesia peridural con anestésicos locales (bupivacaína 0,125% 10 ml/h) o la bomba de elastómeros por vía endovenosa, descrita previamente durante el ingreso y el tratamiento ambulatorio durante una semana, con una pauta combinada inicial oral de diclofenaco 50 mg/8 h y paracetamol 1 g/8 h con tramadol 50 mg/8 h de rescate. Posteriormente, esta pauta se ha modificado a dexketoprofeno 25 mg/8 h y paracetamol-codeína 650 mg/30 mg/8 h asociado a omeprazol 20 mg/24 h y tramadol 50 mg/8 h de rescate.
Recogida de datosLos datos fueron recogidos de forma prospectiva para todas las pacientes. Se creó una base de datos específica en Access y, posteriormente, el análisis estadístico se realizó con SPSS 15.0.
Las variables descriptivas recogidas antes de la embolización fueron la edad, la paridad, el número de miomas y su localización, el volumen del mioma predominante y la sintomatología clínica.
Se hizo un seguimiento de las pacientes en consultas externas de ginecología al mes, entre los 3 y 6 meses, al año y a los dos años del tratamiento, acudiendo a urgencias antes si era necesario.
La eficacia de la EAU se valoró clínicamente, analíticamente y mediante técnicas de imagen. En la clínica se interrogó respecto a cambios en la sintomatología, registrados como desaparición o mejoría, sin cambios o empeoramiento.
En los análisis se practicaron determinaciones en cada control de hemograma completo, hierro y ferritina. Se definió como anemia valores de hemoglobina<12 g/dl y como anemia severa valores<10 g/dl.
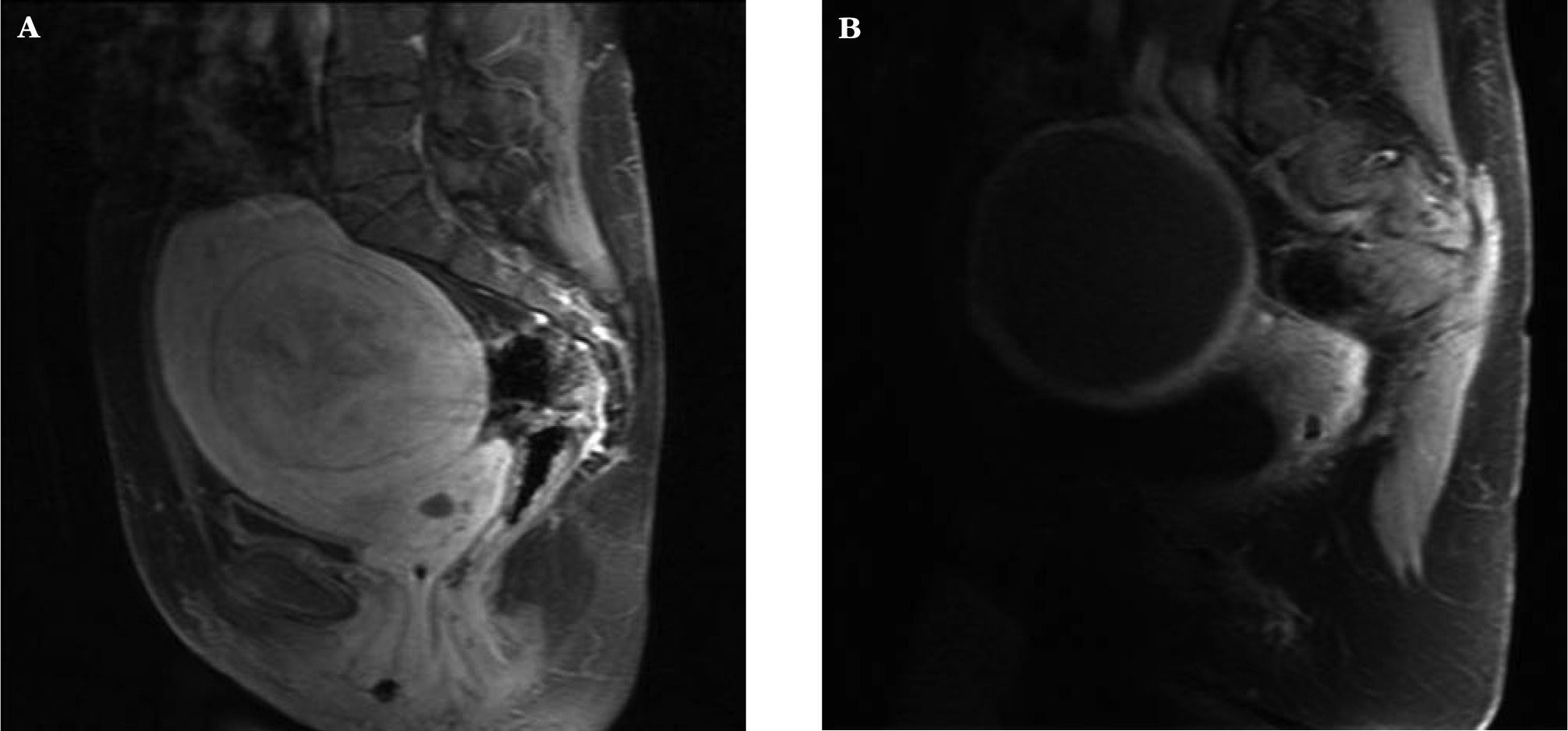
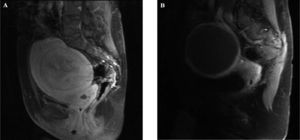
En el estudio radiológico, mediante RM y ecografía con potenciador de señal, se realizó la medición del volumen del mioma predominante y grado de vascularización existente (fig. 3A y B).
Se consideró un fracaso del procedimiento la necesidad de histerectomía o la persistencia de clínica a pesar de una buena embolización confirmada por radiología.
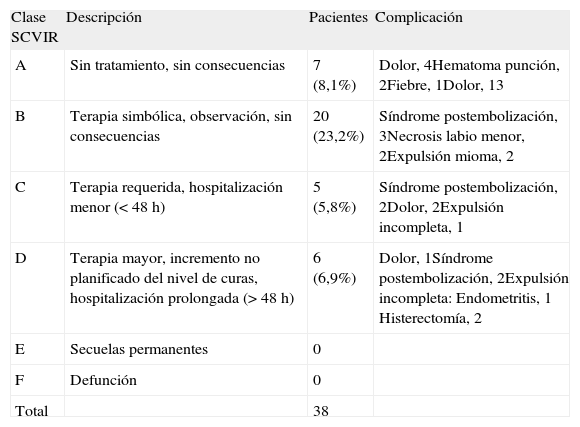
En cuanto a la seguridad de la EAU, se analizaron las complicaciones y se anotaron los efectos adversos siguiendo las definiciones creadas por la Sociedad de Radiología Intervencionista (SIR12,13), incluidas en la tabla 1. El sistema de la SIR se desarrolló para permitir la clasificación estandarizada de su severidad basada en el nivel de cuidados requeridos, las intervenciones necesarias y el resultado final. Se utiliza en los procedimientos radiológicos intervencionistas.
Complicaciones de la EAU según la clasificación de la SIR
| Clase SCVIR | Descripción | Pacientes | Complicación |
| A | Sin tratamiento, sin consecuencias | 7 (8,1%) | Dolor, 4Hematoma punción, 2Fiebre, 1Dolor, 13 |
| B | Terapia simbólica, observación, sin consecuencias | 20 (23,2%) | Síndrome postembolización, 3Necrosis labio menor, 2Expulsión mioma, 2 |
| C | Terapia requerida, hospitalización menor (< 48 h) | 5 (5,8%) | Síndrome postembolización, 2Dolor, 2Expulsión incompleta, 1 |
| D | Terapia mayor, incremento no planificado del nivel de curas, hospitalización prolongada (> 48 h) | 6 (6,9%) | Dolor, 1Síndrome postembolización, 2Expulsión incompleta:Endometritis, 1Histerectomía, 2 |
| E | Secuelas permanentes | 0 | |
| F | Defunción | 0 | |
| Total | 38 |
EAU: embolización de las arterias uterinas; SIR: Sociedad de Radiología Intervencionista
Se anotaron los casos de endometritis y/o infección pélvica, dolor, síndrome postembolización (descrito por Worthington-Kirsch7, y caracterizado por fiebre, dolor y leucocitosis) y expulsión del mioma.
Se recogió a las pacientes con menopausia posterior, definida por amenorrea de más de 6 meses, y sintomatología climatérica, definida por la escala de Kuperman modificada14.
Finalmente, se valoró la función ovárica mediante la determinación de FSH, LH y 170-estradiol a los 6 meses del tratamiento.
La satisfacción de las pacientes se siguió en cada control formulando la siguiente pregunta: «¿Se volvería a hacer el procedimiento?». También se interrogó sobre el tiempo de reincorporación a la vida normal.
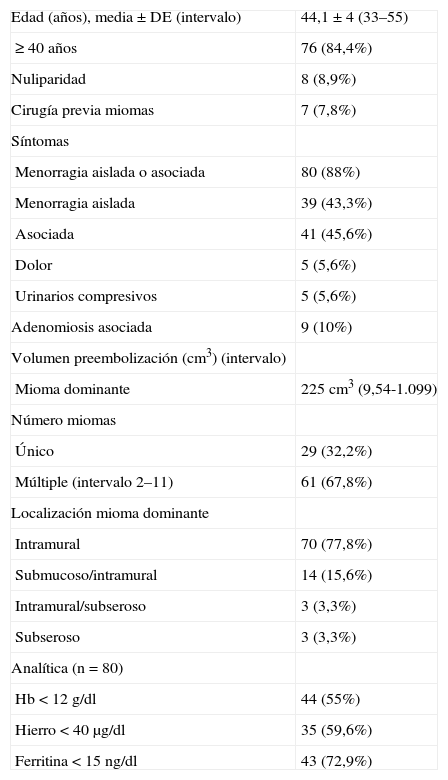
RESULTADOSCaracterísticas de las pacientes y clínica previa a la EAU (tabla 2)La edad media±desviación estándar de las pacientes fue de 44,1±4 años, con un intervalo de 33 a 55 años. El 84,4% de ellas tenía una edad≥40 años. El 8,9% eran nulíparas y el 7,8% de los casos tenía cirugía previa de los miomas.
Población de estudio. Características de las 90 pacientes
| Edad (años), media±DE (intervalo) | 44,1±4 (33–55) |
| ≥ 40 años | 76 (84,4%) |
| Nuliparidad | 8 (8,9%) |
| Cirugía previa miomas | 7 (7,8%) |
| Síntomas | |
| Menorragia aislada o asociada | 80 (88%) |
| Menorragia aislada | 39 (43,3%) |
| Asociada | 41 (45,6%) |
| Dolor | 5 (5,6%) |
| Urinarios compresivos | 5 (5,6%) |
| Adenomiosis asociada | 9 (10%) |
| Volumen preembolización (cm3) (intervalo) | |
| Mioma dominante | 225 cm3 (9,54-1.099) |
| Número miomas | |
| Único | 29 (32,2%) |
| Múltiple (intervalo 2–11) | 61 (67,8%) |
| Localización mioma dominante | |
| Intramural | 70 (77,8%) |
| Submucoso/intramural | 14 (15,6%) |
| Intramural/subseroso | 3 (3,3%) |
| Subseroso | 3 (3,3%) |
| Analítica (n=80) | |
| Hb<12 g/dl | 44 (55%) |
| Hierro<40 μg/dl | 35 (59,6%) |
| Ferritina<15 ng/dl | 43 (72,9%) |
DE: desviación estándar; Hb: hemoglobina.
El 32,2% presentaba un mioma único, mientras que el resto presentaba dos o más miomas uterinos (intervalo de 2 a 11). El mioma predominante fue intramural en el 77,8%, en un 15,6% submucoso-intramural, el 3,3% subseroso y un 3,3% intramural/subseroso.
El volumen medio del mioma dominante preembolización era de 225±197 cm3, con un intervalo de 9,54 a 1.099 cm3. Se diagnosticó adenomiosis asociada en un 10% de los casos.
En cuanto a la clínica, 80 (88,8%) pacientes presentaban menorragia aislada (39 casos) o asociada a síntomas urinarios o álgidos; 5 (5,6%) mujeres presentaban solo sintomatología urinaria compresiva y los restantes 5 (5,6%) casos, clínica de dolor.
De los 80 casos con clínica de menorragia, el 55% tenía una analítica con anemia; de estos, el 32,5% tenía anemia severa. El 59,6% tenía valores de sideremia<40 μg/dl; los niveles de ferritina eran<15 ng/dl en el 72,9%.
El nivel medio de FSH pre-EAU en las 53 pacientes en las que se determinó fue de 10,4±8,6 U/l (intervalo 2–40).
Seguimiento clínicoLa duración media del ingreso fue de 1,3 días (intervalo1-4), y para el 77,8% fue de un solo día.
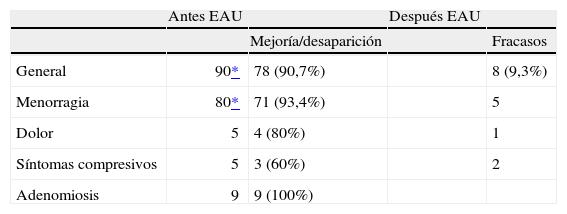
En la tabla 3 se muestran los síntomas de las pacientes antes de la embolización y a los 2 años del procedimiento. Cuatro casos se perdieron para el seguimiento.
En 4 casos se realizó una segunda embolización y en 7, una histeroscopia quirúrgica para completar el procedimiento.
En términos generales, a los 24 meses 78 (90,7%) pacientes estaban asintomáticas o experimentaron mejoría de su clínica.
Cuando la clínica principal fue el sangrado (n=80), la mejoría o desaparición del síntoma fue del 93,4%.
En el caso de las algias (n=5), el éxito ocurrió en el 80% de los casos. Cuando la clínica fue patología urinaria compresiva (n=5), esta mejoría se produjo en el 60%.
Todas las pacientes con adenomiosis asociada presentaron mejoría.
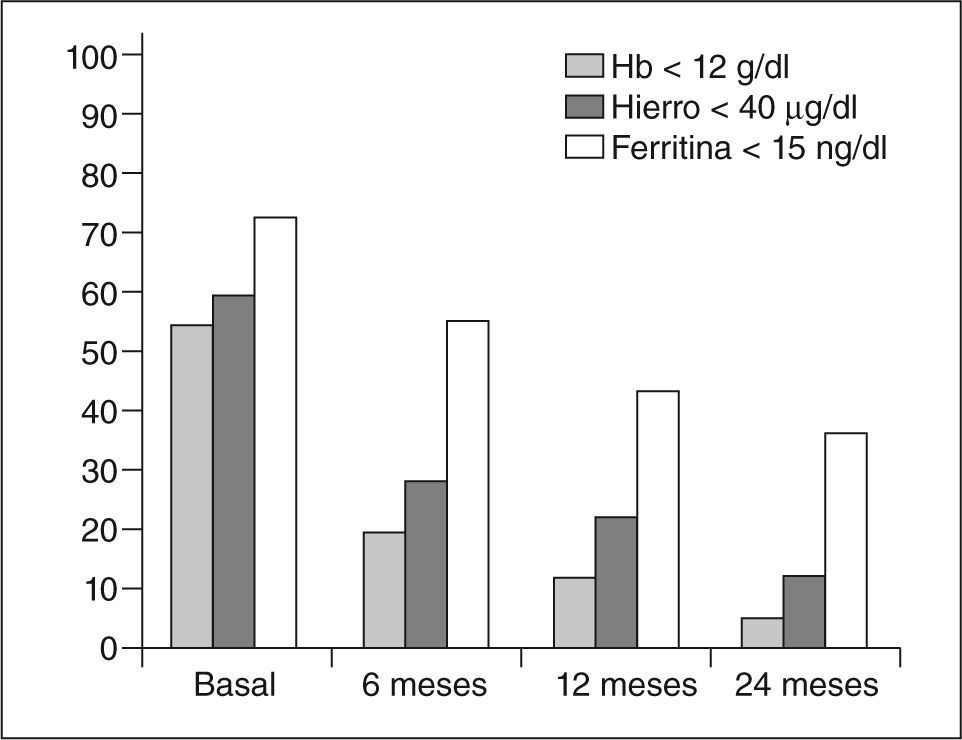
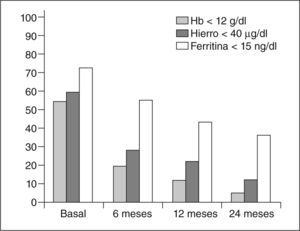
Seguimiento analítico (fig. 4)Un 19,5% de las pacientes presentaban anemia a los 6 meses de la embolización, al año un 11,9% y únicamente el 5% a los 2 años seguía presentando anemia. La incidencia de anemia grave fue del 1,7% a los 2 años.
Los valores de hierro permanecían bajos a los 6 meses en un 27,5% de los casos, en un 21,7% a los 12 meses y sólo en un 12,1% a los 2 años.
Los valores de ferritina fueron inferiores a la normalidad en el 55,3% a los 6 meses, en un 43,3% a los 12 meses y en un 36,8% a los 2 años.
Globalmente, se objetivó un incremento medio de la concentración de hemoglobina de 2,2±17,11 g/dl, de 39,8±41,5 μMg/dl en los valor de hierro y de 23,05±45,9 ng/dl en la concentración de ferritina a los 2 años del procedimiento.
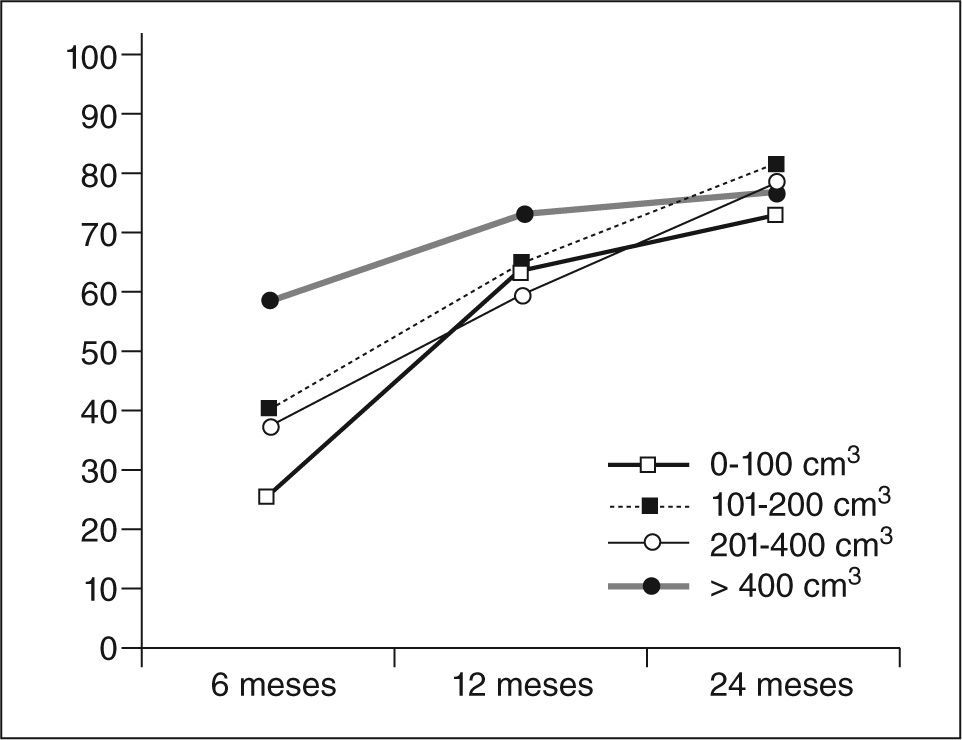
Seguimiento por técnicas de imagen (fig. 5)La cateterización bilateral de las dos arterias uterinas fue exitosa en un 98,9%. Fue unilateral en un caso debido a vasospasmo de la arteria uterina izquierda y variación anatómica de la arteria ovárica.
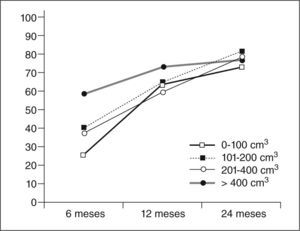
La reducción media del volumen del mioma dominante a los 24 meses fue del 76,3±21%, con un intervalo del 19,6 al 99,7%. En 4 casos el mioma ya no se visualizó mediante técnicas de imagen. En el control a los 6 meses se observó una reducción media del volumen del 37,4±39% y a los 12 meses del 63,3±29%.
En la reducción apreciada a los 6 meses, se comprobó que los miomas más grandes presentaron una reducción de volumen superior que las observadas para los de menor tamaño. Sin embargo, a los 2 años estas diferencias no se observaron (miomas de 0–100 cm3, reducían un promedio del 72%; de 101200 cm3 un 80%; entre 201–400 cm3 un 77%, y más de 400 cm3 un 76%).
En cuanto a la vascularización del mioma, a los 6 meses únicamente en 6 (7,2%) casos se observó una persistencia de la misma. De estos, en 4 se requirió una segunda embolización; 3 de ellos evolucionaron favorablemente. En los 2 restantes, se practicó en uno histerectomía y en otro conducta expectante, dada la mejoría de los síntomas.
Complicaciones (tabla 1)Siguiendo la clasificación de la SIR12,13, entre las complicaciones menores, sin ingreso hospitalario (clase A-B) hubo 2 hematomas del punto de punción femoral y un caso de fiebre resuelta espontáneamente (clase A).
De la clase B hubo 3 síndromes postembolización, 2 expulsiones del mioma y 2 casos de necrosis de labios menores, con resolución ad integrum a los 15 y 45 días. El resto de las complicaciones corresponden a consultas por dolor.
Presentaron complicaciones con ingreso hospitalario 11 pacientes (12,7%) (5 clase C y 6 clase D):
- -
Clase C: un caso corresponde a una expulsión incompleta del mioma que requirió legrado posterior; 2 pacientes reingresaron por dolor que precisó analgesia por vía intravenosa y 2 pacientes por síndrome postembolización. Todas evolucionaron favorablemente.
- -
Clase D: una paciente con dolor ingresó más de 48 h. Dos mujeres tuvieron un síndrome postembolización y 3 casos presentaron expulsión incompleta de mioma, evolucionando una de ellas satisfactoriamente con tratamiento antibiótico y las otras 2 requirieron histerectomía por persistencia de clínica infecciosa (fiebre y leucorrea).
No se ha producido ninguna complicación de la clase E o F.
Expulsión del miomaIndependientemente de la clase a la que pertenecían según criterios SIR12,13, la expulsión total o parcial del mioma sucedió en un total de 6 (7%) pacientes; dos de ellas requirieron histerectomía, como hemos mencionado anteriormente. Los miomas eran de 150 mm de diámetro máximo.
El diámetro máximo pre-EAU del resto de los miomas expulsados osciló entre 40 y 118 mm. El período de expulsión fue entre 15 días y 3 meses post-EAU.
Amenorrea transitoria y menopausiaEl porcentaje de amenorreas transitorias (período de amenorrea<6 meses) fue del 4,6% (4 casos) y el de menopausia después de la EAU del 9,3% (8 casos) a los 2 años para todo el grupo de pacientes embolizadas.
La media±desviación estándar de edad en las pacientes con menopausia fue de 44,9±5,6 años (intervalo 39–55), con una edad<45 años 4 casos e>45 años en los 4 restantes. Tres de las 4 pacientes menores de 45 años presentaban antecedentes de cirugía ovárica, y se demostró permeabilidad de la arteria ovárica restante después de la embolización.
En las pacientes con determinación hormonal, la media de los valores de FSH post-EAU fue de 17,3±22,9 U/l (intervalo 2–12). El incremento medio en los valores de FSH fue de 7,5±23,5 U/l (intervalo −34 a 100). Estos incrementos fueron superiores a 4 U/l en el 39.5%.
No encontramos incrementos superiores de FSH analizados por grupos de edad (menores y mayores de 45 años).
FracasosEl fracaso del procedimiento se produjo en 8 (9,3%) casos, practicando un total de 6 histerectomías (7%). De estas, dos se realizaron por las complicaciones ya comentadas y 4 por persistencia de la clínica. En los otros 2 casos se adoptó una conducta expectante.
En ningún caso de histerectomía el estudio histológico informó de adenomiosis asociada.
Satisfacción por el procedimientoLa satisfacción por el procedimiento fue del 90,2% a los 2 años.
La incorporación a la vida normal de las pacientes osciló entre 3 y 30 días, con una media fue de 10,5 días, y las mujeres reanudaron su actividad normal a los 15 días el 91% de los casos.
DISCUSIÓNEn nuestro estudio constatamos que el 90,7 % de las pacientes están asintomáticas o experimentan una gran mejoría a los 2 años de la EAU. Estos resultados son similares a los de la bibliografía disponible2-5,15-17 y coinciden con la mejoría de los síntomas experimentados después de la cirugía, ya sea miomectomía o histerectomía, en las series aleatorizadas publicadas al respecto18-25. El porcentaje de mejoría más alto después la EAU se ha producido en las pacientes que presentan clínica de menorragia, en las que alcanza el 93,4%, y el parámetro analítico que mejor se relaciona con esta mejoría ha sido la hemoglobina, con un incremento medio de 2,2 g/dl, similar al descrito por Pron et al15.
El tiempo de hospitalización fue de 1,3 días de media, menor que en la histerectomía, con una media 5,7 días, o la miomectomía, con 4,7 días de media en nuestro servicio.
En nuestra sistemática de trabajo, el uso de la RM nos permite calcular el volumen uterino total, el volumen del mioma dominante y descartar la presencia de patologías asociadas y/o adenomiosis9,20.
La reducción media del volumen del mioma dominante objetivada por RM fue del 76,3% a los 2 años, cifra algo superior a la publicada por Walker y Pelage2, del 67% utilizando ultrasonografía y RM.
El uso reciente de la ecografía con potenciador de señal nos ha permitido comparar los resultados pre y postembolización antes de que se aprecie una disminución significativa del volumen medio del mioma dominante26. En el 92,8 % de los casos objetivamos nula o hipovascularización del mioma a los 6 meses.
A pesar de que el número de complicaciones mayores en nuestra serie, según el sistema clasificatorio de la SIR, puede parecer alto (12,7%), incluye a todas las pacientes que han sido hospitalizadas, aunque el tratamiento haya sido simplemente anal gésico, y es congruente con el porcentaje citado en otras series4,17,21,22.
Un número elevado de estos casos (20/90) presentó dolor tras el procedimiento. De estos, únicamente 3 fueron hospitalizados. La pauta domiciliaria se modificó por la clínica del dolor debido a este número de visitas a urgencias. Se insistió en el cumplimiento estricto de la pauta analgésica prescrita, tal como señalan algunos autores27. Con la adaptación de la medicación ambulatoria ya descrita previamente en la metodología, el porcentaje de visitas a urgencias por este motivo disminuyó del 31,1% en las primeras 45 pacientes al 11,1% en las 45 siguientes.
El síndrome postembolización7 se ha descrito hasta en el 40% de los casos post-EAU. Suele ser de corta duración y el tratamiento es sintomático. En nuestra serie, la incidencia fue del 7,7% y todas las pacientes evolucionaron favorablemente.
En nuestro estudio, la expulsión del mioma se ha producido en 6 casos, con restitución de la pared endometrial comprobada por histeroscopia posterior en 4 de ellos. Esta complicación relativamente común2,13,28 se ha descrito hasta un 10% de los casos y es una de las consecuencias de efecto más tardío. Algunos de estos miomas pueden no pasar espontáneamente el cérvix uterino, pero pueden identificarse mediante exploración física y el uso de RM. En estos casos, el tratamiento se completa mediante legrado y/o resección histeroscópica13.
Hemos tenido 2 casos de histerectomía (2,2%) por infección persistente, que corresponden a las descritas por expulsión incompleta del mioma. Esta es la complicación más grave de la EAU; en nuestra serie la incidencia de dicha complicación fue superior a la mencionada en la literatura científica, que oscila del 0,4 al 1,7%2,29.
En los siguientes 60 procedimientos realizados posteriormente, la incidencia de dicha complicación fue del 1,3% (2/147) y se sitúa en una tasa dentro del rango descrito, por lo que no podemos descartar que el período de aprendizaje haya tenido cierta influencia sobre esta variable.
Mención aparte merece el análisis de la función menstrual después de la EAU y el impacto del procedimiento sobre la reserva ovárica. En nuestra serie, el porcentaje de amenorrea transitoria fue del 4,4% y el de menopausia del 9,3%, similar a otros trabajos publicados15,30, y no se han encontrado diferencias por grupos de edad.
Desde el primer caso publicado por Bradley et al31, en 1998, numerosos estudios han observado amenorrea post-EAU del 2 hasta el 15% y puede ser transitoria por hipoperfusión uterina o permanente (menopausia), hecho raro en menores de 40 años y más frecuente a partir de los 45 años30-34. Esta complicación podría explicarse por el paso de partículas a través de las anastomosis entre vasos uterinos y ováricos causando hipoxia y daño ovárico30,34, o bien por atrofia endometrial permanente35. El porcentaje superior de amenorrea en mujeres mayores sugiere que pequeños cambios en la vascularización ovárica originarían disfunción en ovarios con mínima función residual, de forma similar a los que ocurren después de la histerectomía tal y como describen la serie publicada por el grupo EMMY32.
Uno de los problemas potenciales de la EAU es el riesgo de fallo ovárico prematuro en mujeres premenopáusicas. En la literatura científica hay pocos trabajos al respecto30,32-35.
En nuestro estudio, hemos intentado valorar el efecto de la EAU sobre la reserva ovárica determinando los valores de FSH. Aunque nuestros resultados son limitados por el escaso número de pacientes (n=53) con determinaciones pre y post-EAU, por la falta de un grupo control, y por la edad media de las pacientes (44,1 años), hemos encontrado un incremento de 7,5 U/l para todo el grupo; 43 de estos 53 casos tenían unos valores de FSH<15 U/l y en estos el incremento fue de más de 4 U/l en 17 (39,5%), lo que podría sugerir un impacto del procedimiento sobre la función ovárica, igual que describen otras series, como la de Tulandi33 y el mismo grupo EMMY32. Otros autores, sin embargo, no encuentran diferencias en los incrementos de FSH en las mujeres más jóvenes, y sólo las encuentran para estos incrementos en las mujeres en rango perimenopáusico30, en las que es conocida una mayor variabilidad interciclo en los valores basales de FSH cuando esta es>15 U/l36,37.
De acuerdo con nuestros resultados, parece aconsejable la realización de la determinación de FSH antes y después del procedimiento, así como un mapa angiográfico preembolización34 para valorar la presencia de anastomosis ováricas.
La amenorrea, entendida como complicación o éxito de la EAU, depende de cuál sea el objetivo del tratamiento. Para mujeres sin deseo de fertilidad futura, esta complicación podría no ser tal, pero sí para mujeres más jóvenes.
Por ello, la mayoría de autores concluyen que la EAU no parece estar indicada en la actualidad en pacientes con deseo genésico18.
El porcentaje de fracasos del procedimiento que en nuestra serie ha sido del 8,9% a los 2 años, y las 6 histerectomías realizadas hasta el momento son similares al porcentaje mencionado en series más amplias2,8,20, que oscila del 5 al 25%.
Los únicos factores predictivos aceptados del fracaso del procedimiento en los diferentes trabajos publicados son la presencia de anastomosis con la arteria ovárica y la embolización unilateral18,38,39.
De los 6 casos de fracaso, excluidos los dos de histerectomía urgente, hemos encontrado estos factores solamente en dos de ellos. En uno se había demostrado la presencia de estas anastomosis y en el otro, la embolización fue unilateral.
La satisfacción por el procedimiento es muy elevada (90,2%) y, a pesar del fracaso, la mayoría de pacientes volverían a someterse a éste. Estos resultados coinciden con los de la literatura científica2,4,15,21-25.
La media de reincorporación a la vida normal fue de 10,5 días, lo que coincide con la mayoría de series y es menor que para la cirugía7,8,15,23.
CONCLUSIONESLa embolización de las arterias uterinas, en nuestra experiencia, se ha demostrado como una técnica eficaz, con mejoría y/o curación de los síntomas en el 90,7% de los casos y una reducción del volumen del mioma dominante del 76,3% a los 2 años.
Es una técnica segura, mínimamente invasiva, con complicaciones leves (principalmente el dolor, si bien es controlable), con corto ingreso hospitalario, muy bien aceptada por la paciente y rápida incorporación a la vida normal.
Por ello, y después de un seguimiento de 2 años, creemos que es una buena alternativa a la cirugía en el tratamiento de los miomas uterinos sintomáticos en pacientes sin deseo genésico.