Analizar la efectividad y seguridad del nifedipino en gestantes con amenaza de parto prematuro (APP).
Sujetos y métodosEstudio observacional prospectivo de abril de 2003 a diciembre de 2004 y retrospectivo de enero a diciembre de 2008. Se incluyeron 106 gestantes a las que se aplicó el protocolo de APP del hospital. Se excluyeron 33 por diferentes motivos, principalmente falsos diagnósticos de APP.
ResultadosLa prolongación del parto fue superior a 48h en el 56,2% (IC 95%: 44,8-67,5) y se administraron 2 dosis de betametasona en el 69,9% (IC 95%: 59,3-80,4). La incidencia de reacciones adversas maternas fue del 29,4% (IC 95%:7,8-51,2), principalmente hipotensión leve. De los 99 recién nacidos hubo 10 fallecimientos, principalmente por complicaciones infecciosas y bajo peso, y hubo un caso de encefalopatía hipóxico-isquémica.
ConclusionesLa tocólisis con nifedipino es efectiva y segura si se respetan las precauciones de uso de forma estricta, registrando una baja incidencia de efectos adversos maternos y fetales.
To determine the effectiveness and safety of nifedipine as a tocolytic agent in pregnant women with preterm labor (PL).
Subjects and methodsWe performed a prospective observational study (April 2003 - December 2004) and a retrospective study (January- December 2008). A total of 106 pregnant women were included and the hospital PL protocol was applied. Thirty-three patients were excluded for different reasons, mainly because of a false PL diagnosis.
ResultsPregnancy was prolonged by more than 48hours in 56.2% [95% CI: 44.8-67.5] and 2 doses of betametasone were administered in 69.9% [95% CI: 59.3-80.4]. The incidence of maternal adverse reactions was 29.4% (95% CI: 7.8-51.2), mainly mild hypotension. Of the 99 newborns, 10 died, mainly because of infectious complications and low birthweight and there was one case of hypoxic-ischemic encephalopathy.
ConclusionsTocolysis with nifedipine is safe and effective if precautions for use are strictly respected. In this study, there was a low incidence of maternal and fetal adverse effects.
La incidencia de parto prematuro (PP) ha permanecido inmutable durante las 2 últimas décadas, a pesar de los avances perinatales. En 2011 la tasa de parto pretérmino en el mundo fue del 11%, con un rango del 5% (regiones de Europa) al 18% (regiones de África)1 y en España del 6,70%2. En 2013 en el Hospital Universitario Son Espases (antes Son Dureta), de Palma de Mallorca, centro de referencia de la Comunidad Autónoma de Baleares, la tasa de PP ha sido del 11,8%.
El diagnóstico del PP está basado en criterios clínicos de contracciones uterinas regulares y dolorosas acompañadas de dilatación cervical y borramiento del cérvix3,4. La medida de la longitud del cérvix ayuda a apoyar o a excluir el diagnóstico de amenaza de parto prematuro (APP), siendo una valoración clave para evitar la administración indiscriminada de tocolíticos3,5. El 50% de las pacientes hospitalizadas por APP tienen el parto a término3,5.
El principal objetivo del tratamiento de la APP es retrasar el parto al menos 48h para poder administrar corticoides a la madre y conseguir una mejoría en los resultados perinatales4-7.
El nifedipino es un fármaco bloqueante de los canales del calcio que ha demostrado ser útil en la inhibición del PP. Su mecanismo de acción consiste en bloquear directamente el flujo de iones de calcio a través de la membrana celular. Es el único tocolítico que ha demostrado disminución de la morbimortalidad neonatal, buen perfil de seguridad, administración oral y coste inferior a otros tocolíticos8–10.
El Hospital Universitario Son Espases dispone desde el 2003 de un protocolo de atención a la APP aprobado por la Comisión de Farmacia y Terapéutica, que contempla nifedipino como tocolítico de elección en la APP11, con indicación no contemplada en la ficha técnica12 y necesidad de la obtención del consentimiento informado de la paciente. Este protocolo se ha ido actualizando periódicamente13, incluyendo en 2014 estrategias preventivas (cerclaje, progesterona vaginal y pesario cervical) para la prevención del PP.
Recientemente una especialidad de nifedipino ha sido formalmente aprobada por la Agencia Española del Medicamento y Productos Sanitarios con la indicación de APP14.
La experiencia en el tratamiento de la APP con nifedipino en el Hospital Universitario Son Espases aporta datos sobre de efectividad y efectos adversos maternos y neonatales15,16.
Material y métodosEstudio observacional prospectivo en un primer periodo y estudio observacional retrospectivo en un segundo periodo.
Desde de abril de 2003 a diciembre de 2004 la población a estudio incluyó a todas las gestantes con APP que fueron elegibles según el protocolo de APP del hospital, y a las cuales se administró al menos la primera dosis de nifedipino, y fueron seguidas conjuntamente con sus RN hasta un mes después del parto.
En un segundo periodo la población a estudio incluyó a todas las gestantes diagnosticadas de APP según el protocolo del hospital y a las cuales se administró tocólisis con nifedipino durante enero a diciembre 2008. Los datos de esta población fueron obtenidos mediante revisión de la historia clínica e informe de alta de las madres y de los RN.
Los criterios de inclusión son pacientes entre las 24 y 34 semanas de gestación y con diagnóstico de APP, según los criterios de la American College of Obstetricians and Gynecologists17,18: 4 contracciones regulares o más durante 20min objetivadas mediante registro cardiotocográfico junto con cambios cervicales documentados. Los cambios cervicales son: dilatación de 1-2cm, borramiento cervical de al menos un 80% y, en caso de dudas, longitud del cérvix<25mm mediante ecografía transvaginal. La edad gestacional se calculó a partir de la fecha de la última regla o de la longitud cráneo-caudal en una ecografía realizada en el primer trimestre de la gestación si existía una diferencia en el cálculo de la fecha probable de parto superior o igual a 7 días. Los principales criterios de exclusión de la madre gestante para la administración de nifedipino fueron tratamiento previo con otro tocolítico diferente al del protocolo, tensión arterial (TA)≤95/50mmHg, registro cardiotocográfico no reactivo y sospecha de corioamnionitis.
La administración del tratamiento a la madre fue realizado por un ginecólogo. La dosis inicial de nifedipino fue de 30mg, posteriormente una dosis de mantenimiento de 20mg cada 4-6-8h durante 2 días. Se emplearon cápsulas de 10mg de liberación normal (Adalat®) y administración oral (no sublingual). El tratamiento se suspendió después de 24-48h tras la administración de la segunda dosis de corticosteroides.
Como variables principales de eficacia se considera la prolongación de la gestación de al menos 48h y la administración de las 2 dosis de betametasona contempladas en el protocolo. Se consideró fracaso inicial de la tocólisis con nifedipino cuando a las 2h de administrar la dosis de inicio persistía una dinámica uterina de mayor intensidad y frecuencia que al inicio, acompañada de una modificación cervical. Igualmente se consideró fracaso o no respuesta adecuada cuando el parto se produjo antes de 24h y solo fue posible administrar una dosis de betametasona. No se realizaron tratamientos de mantenimiento ni repetición de ciclos de tratamiento, dado que no está contrastada su utilidad. Cuando la paciente venía de otro centro con otra tocólisis iniciada se continuó con la misma sin cambiar a nifedipino, por el riesgo potencial asociado a la acumulación de 2 tocolíticos y sus posibles efectos secundarios.
Se llevó a cabo un registro de los siguientes datos: diagnóstico de APP, semanas de gestación y duración de la prolongación del embarazo, datos clínicos, dosis de nifedipino y de betametasona recibidos. Se realizó un registro de efectos secundarios maternos y fetales. En el primer periodo de estudio el análisis de acontecimiento adversos se centró en los casos de los RN fallecidos. En el segundo periodo se realizó además un registro sistemático de los acontecimientos adversos, tanto en la madre como en el RN. Se presentan los resultados de efectividad y de seguridad de forma descriptiva. Las variables cuantitativas se expresan como media±desviación típica y las cualitativas como valor absoluto, porcentaje e IC 95%.
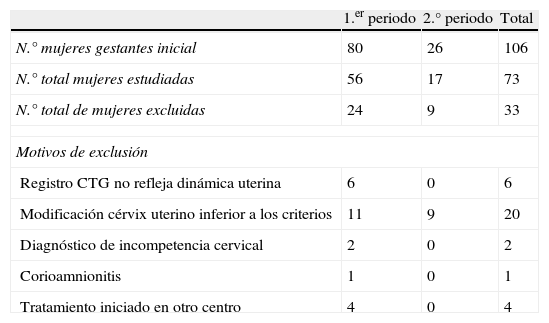
ResultadosSe incluyeron 80 mujeres del primer periodo de estudio y 26 del segundo. En total 106 gestantes de las que se excluyen 33 por diferentes motivos, siendo el más frecuente, con 20 casos (18,9%), el no cumplir los criterios objetivos de amenaza de parto. El estudio se realiza sobre las 73 mujeres gestantes que cumplieron los criterios (tabla 1).
Mujeres excluidas del estudio y motivo de la exclusión
| 1.er periodo | 2.° periodo | Total | |
| N.° mujeres gestantes inicial | 80 | 26 | 106 |
| N.° total mujeres estudiadas | 56 | 17 | 73 |
| N.° total de mujeres excluidas | 24 | 9 | 33 |
| Motivos de exclusión | |||
| Registro CTG no refleja dinámica uterina | 6 | 0 | 6 |
| Modificación cérvix uterino inferior a los criterios | 11 | 9 | 20 |
| Diagnóstico de incompetencia cervical | 2 | 0 | 2 |
| Corioamnionitis | 1 | 0 | 1 |
| Tratamiento iniciado en otro centro | 4 | 0 | 4 |
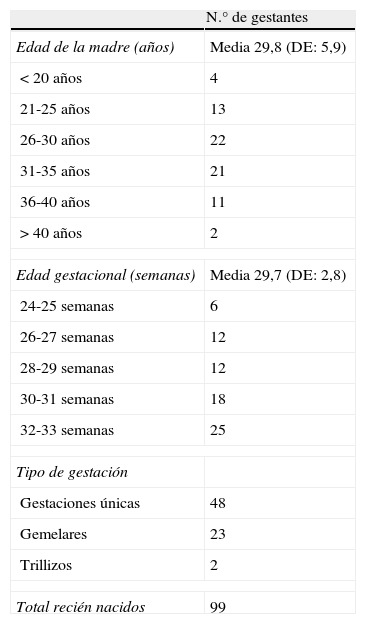
La edad media de las mujeres fue de 29,8 (DE 5,9) años y la edad gestacional media en el momento de presentarse la APP fue de 29,7 (DE 2,8) semanas. Se presentaron 48 gestaciones únicas, 23 gemelares y 2 triples. El total de RN fue de 99 (tabla 2).
Características de las mujeres y tipo de parto incluidos en el estudio (n: 73)
| N.° de gestantes | |
| Edad de la madre (años) | Media 29,8 (DE: 5,9) |
| <20 años | 4 |
| 21-25 años | 13 |
| 26-30 años | 22 |
| 31-35 años | 21 |
| 36-40 años | 11 |
| >40 años | 2 |
| Edad gestacional (semanas) | Media 29,7 (DE: 2,8) |
| 24-25 semanas | 6 |
| 26-27 semanas | 12 |
| 28-29 semanas | 12 |
| 30-31 semanas | 18 |
| 32-33 semanas | 25 |
| Tipo de gestación | |
| Gestaciones únicas | 48 |
| Gemelares | 23 |
| Trillizos | 2 |
| Total recién nacidos | 99 |
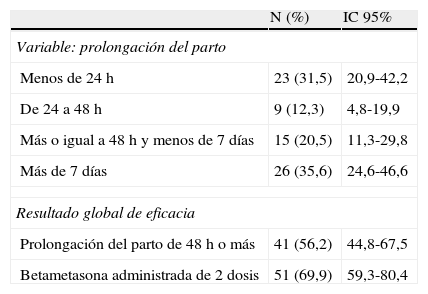
El parto se produjo antes de 24h en 23 ocasiones, entre las 24 y las 48h en 9, después de las 48h en 15 y más de una semana después de iniciar el tratamiento en 26 casos. La prolongación del parto más allá de las 48h se produjo en 41 casos, es decir, un 56,2% (IC 95%: 44,8-67,5). En 51 casos (69,9% [IC 95%:59,3-80,4]) se administraron las 2 dosis de betametasona (tabla 3).
Resultados de eficacia (n: 73)
| N (%) | IC 95% | |
| Variable: prolongación del parto | ||
| Menos de 24h | 23 (31,5) | 20,9-42,2 |
| De 24 a 48h | 9 (12,3) | 4,8-19,9 |
| Más o igual a 48h y menos de 7 días | 15 (20,5) | 11,3-29,8 |
| Más de 7 días | 26 (35,6) | 24,6-46,6 |
| Resultado global de eficacia | ||
| Prolongación del parto de 48h o más | 41 (56,2) | 44,8-67,5 |
| Betametasona administrada de 2 dosis | 51 (69,9) | 59,3-80,4 |
Durante el primer periodo del estudio los acontecimientos adversos maternos identificados fueron: 3 episodios de hipotensión leve en las madres al observarse una cifra de TA<90/50mmHg. En una de ellas se había administrado la segunda dosis de nifedipino antes del plazo de tiempo mínimo previsto (<4h.)
Entre los 76 RN durante el primer periodo del estudio se registró un caso de mortalidad infantil (>1 mes) y 8 casos de muerte neonatal (10,5%), 2 en el periodo neonatal precoz (<7 días) y 6 en el periodo neonatal tardío (7-27 días): 4 tuvieron un peso al nacimiento menor de 750g y 24 semanas de edad gestacional, otro pesó 825g al nacer y 27 semanas de edad gestacional y el último caso correspondió a un RN de 1.625g y 31 semanas de edad gestacional, que falleció por sepsis y la madre tuvo un cuadro séptico debido a una apendicitis perforada.
La causa definitiva de muerte neonatal fue debida a complicaciones infecciosas en 6 casos (la mayoría sepsis nosocomial por estancia prolongada en la UCI), hemorragia intraventricular en 2 casos y enterocolitis necrosante en un caso (tabla 4).
Mortalidad de los recién nacidos
| Caso | Edad gesta cional (semanas) | Peso al nacer (g) | Emba razo | Necropsia | Causa de muerte | Factores concomitantes |
| Periodo 1 (n=9) | ||||||
| Neonatal precoz (≤6 días) | ||||||
| 1 | 24 | 680 | Único | Sí | Neumonía intrauterina | Bolsa íntegra |
| 2 | 24 | 640 | Gemelar | Noa | Sepsis por E. coli | Rotura prematura de la bolsa, FIV, cerclaje,diabetes gestacional, hermano del n.° 9 |
| Neonatal tardía (7-27 días) | ||||||
| 3 | 27 | 825 | Trillizos | Sí | Sepsis nosocomialb | Rotura prematura de la bolsa, FIV, hermano de n.° 8 (tercero vive sano) |
| 4 | 24 | 675 | Gemelar | Sí | Sepsis nosocomialb | Hermano del n° 5 |
| 5 | 24 | 615 | Sí | Sepsis nosocomialb | ||
| 6 | 31 | 1.665 | Único | Sí | enterocolitis necrosante grave | Hemorragia intraventricular iii, sepsis por E. coli, apendicitis materna complicada (peritonitis) que precisó cirugía durante la gestación |
| 7 | 24 | 700 | Único | Noa | Hemorragia intraventricular iii/iv | Sin rotura de membranas, corioamnionitis aguda y villitis incipiente, parto 3h después de la 1.ª dosis de nifedipina |
| Infantil (≥28 días) | ||||||
| 8 | 27 | 680 | Trillizos | Noa | Sepsis nosocomialb | Rotura prematura de la bolsa, FIV, hermano de n.°3 (tercero vive sano) |
| No clasificable (por peso<500 g) | ||||||
| 9 | 24 | 495 | Gemelar | Noa | – | <500g, rotura prematura de la bolsa, FIV, cerclaje, diabetes gestacional, hermano n.° 2 |
| Periodo 2 (n=1) | ||||||
| 10 | 25+5 | 730 | Único | Sí | Encefalopatía hipóxico-isquémica/infartos bilaterales de los colículos superiores de la sustancia gris, asociados a períodos severos de hipotensión | Placenta: coriamnionitis aguda. Madre primigesta, esterilidad, con cerclaje por IC (día 9)Tratamiento de APP:Día 1:16:45h: 30 mg nifedipino oral + 12 mg betametasona.19:30h: 2 amp. buscapina compositum (EV)20:35h: TA 91/4220:45h: TA 101/58 20mg nifedipinoDía 2:01:00h: TA 99/4402:45h: TA 99/49 20mg nifedipino08:45h: TA 100/49 20mg nifedipino14:45h: 20mg nifedipino16:45h: TA 100/50 12 mg betametasona IMDía 4: parto espontáneo. APGAR 1-4/pHAU=6,47 |
FIV: fecundación in vitro.
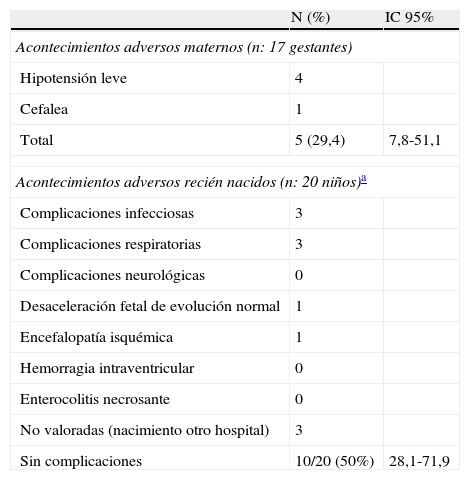
En el segundo periodo del estudio la incidencia de reacciones adversas maternas fue del 29,4% (IC 95%: 7,8-51,2), que corresponden a 4 casos de hipotensión leve y uno de cefalea. Entre los 20 RN valorados en este periodo la evolución fue normal en el 50% (IC 95%: 28,1-71,9). Los acontecimientos adversos que presentaron fueron 3 casos de complicaciones respiratorias y 3 de tipo infeccioso. Se presentó un caso de desaceleración fetal con evolución normal y una muerte neonatal tardía (9 días de vida) en un RN de 25 semanas y 730g de peso al nacimiento, por encefalopatía hipóxico-isquémica (tabla 5). En este caso la gestante recibió también durante el tratamiento con nifedipino 2 ampollas de metamizol+escopolamina vía intravenosa (Buscapina compositum®), y aunque las cifras de TA registradas estuvieron al límite del protocolo y la gestante no tuvo clínica de hipotensión, no se puede descartar que nifedipino haya contribuido a la reacción adversa (tabla 4).
Resultados de seguridad
| N (%) | IC 95% | |
| Acontecimientos adversos maternos (n: 17 gestantes) | ||
| Hipotensión leve | 4 | |
| Cefalea | 1 | |
| Total | 5 (29,4) | 7,8-51,1 |
| Acontecimientos adversos recién nacidos (n: 20 niños)a | ||
| Complicaciones infecciosas | 3 | |
| Complicaciones respiratorias | 3 | |
| Complicaciones neurológicas | 0 | |
| Desaceleración fetal de evolución normal | 1 | |
| Encefalopatía isquémica | 1 | |
| Hemorragia intraventricular | 0 | |
| Enterocolitis necrosante | 0 | |
| No valoradas (nacimiento otro hospital) | 3 | |
| Sin complicaciones | 10/20 (50%) | 28,1-71,9 |
Para el tratamiento de la APP se han propuesto 4 grupos terapéuticos que han mostrado eficacia19–22: betamiméticos (ritodrine), antagonistas de los canales de calcio (nifedipino), antagonistas de la oxitocina (atosiban) e inhibidores de las prostaglandinas (indometacina). Hasta el momento la Food and Drug Administration (FDA) solo ha autorizado con esta indicación la utilización de betamiméticos, si bien en la bibliografía americana e internacional se constata una amplia utilización del nifedipino9,10,23,24. En Europa ni la indometacina ni el nifedipino contemplan esta indicación en su ficha técnica; debido a este hecho la indicación de nifedipino en APP ha sido off label. Ello ha contribuido a la amplia variabilidad clínica que se presenta en el manejo de la APP; así en EE. UU. (no está autorizado el nifedipino, ni el atosiban) predomina el uso de sulfato de magnesio, nifedipino e indometacina, por ese orden23. En Europa (con atosiban y betamiméticos autorizados, pero no el nifedipino) varía entre Francia25, en la que bloqueantes de los canales del calcio ocupan el primer lugar (53,7%), seguidos de los betamiméticos (34,7%) y atosiban (8,8%), y España, en donde solo utilizan los bloqueantes de los canales del calcio el 2,9%26. Un quinto principio activo, el sulfato de magnesio, no ha demostrado su utilidad en la APP27.
La efectividad de nifedipino en nuestra serie se refleja en aproximadamente un 56% de gestantes que prolongan el parto más de 48h y un 36% más de 7 días. En la revisión sistemática de King9 se consigue aplazar el parto más de 48h en el 81% y más de 7 días en el 69%. En la de Conde-Agudelo10 en el 79 y 63%, respectivamente. Los resultados de nuestro estudio parecen inferiores. Creemos que una de las razones principales ha sido los estrictos criterios de exclusión seguidos en relación con los falsos diagnósticos de APP, que se ha detectado en el 19% de las gestantes a las que inicialmente se administró nifedipino. Ello coincide con otras apreciaciones6,7 que señalan que aproximadamente un 20% de las supuestas APP no son tales, y por tanto el tratamiento es innecesario, y al valorar los resultados de un tratamiento tocolítico siempre debe tenerse en cuenta la posibilidad de un sobrediagnóstico que conducirá a un éxito del tratamiento de un problema que en realidad no existía. Por otro lado, en casi un 70% de las gestantes de nuestra serie se han podido administrar las 2 dosis de betamentasona, y por tanto se ha contribuido a la maduración pulmonar fetal, principal objetivo de la prolongación del parto.
En cuanto a la seguridad sobre la madre, cabe mencionar 4 casos de hipotensión leve y un caso de cefalea en el registro del segundo periodo de estudio. La hipotensión se ha presentado en aproximadamente un caso de cada 4 gestantes a las que se administra nifedipino, a pesar que este solo se pauta si la TA es≥95/50mmHg. En una revisión de 7 estudios recientes28–34 los rangos de reacciones adversas maternas detectadas con mayor frecuencia, además de la hipotensión leve (6-32%) son: rubor (2-32%), cefalea (1-21%), palpitaciones (1-20%), taquicardia (3-15%), náuseas (0-9%) y vómitos (0-4%). La revisión sistemática y metaanálisis de Khan24 sobre seguridad de nifedipino registra 16 estudios controlados (ensayos clínicos, estudios observacionales y otros) y encuentra que la incidencia de hipotensión es del 39% cuando la dosis diaria de nifedipino es superior a 60mg, y de tan solo un 5% cuando la dosis es menor de 60mg. Por ello, en la actualización del protocolo clínico de APP de 201213 la dosis recomendada de nifedipino se disminuyó: dosis inicial 20mg y seguir con 10mg cada 6 a 8h durante 24h.
En APP con la utilización de nifedipino se han descrito casos de edema agudo de pulmón, infarto agudo de miocardio, hipoxia, fibrilación auricular y disnea8. Estos efectos adversos se han dado cuando se habían obviado algunas de las precauciones de uso del nifedipino que se describen en las publicaciones y que recoge nuestro protocolo de APP: criterios estrictos de indicación de la tocólisis, administración vía oral no sublingual, respetar la dosis y la posología recomendadas, vigilancia de la TA y de la frecuencia cardiaca, registro cardiotocográfico 1h después de la primera dosis de nifedipino y mantener o repetir según la evolución de la dinámica uterina y siempre a las 24h. No asociar a fármacos vasoactivos: ritodrine, sulfato de magnesio ni atosiban; no prescribir en caso de cardiopatía, hipertiroidismo, hipertensión arterial, hipotensión (<95/50mmHg) y precaución en embarazos múltiples. En nuestra serie no ha ocurrido ninguno de estos efectos adversos.
En cuanto a los efectos en el RN, en la revisión de Conde-Agudelo10 nifedipino muestra unas tasas de presentación del distrés respiratorio del 10,9%, enterocolitis necrosante 0,4%, hemorragia intraventricular 8,5% y admisión en UCIN del 26,6%. La revisión de Khan24 extraida de más de 5 estudios indica distrés respiratorio en un 16%, hemorragia intraventricular en un 2%, enterocolitis necrosante en un 2% y desaceleración fetal en un 1%. Nuestra serie tiene un número de pacientes limitado, pero sus resultados se encuentran dentro del rango y pueden considerarse similares a los de ambas revisiones sistemáticas.
Podemos concluir que en nuestro hospital se sigue el protocolo de APP con nifedipino como medicamento de elección, regulado por la normativa sobre indicaciones de medicamentos no contempladas en ficha técnica (RD 1015/09). La proporción de casos en que la gestación se prolongó más de 48h y se pudo administrar las 2 dosis de betametasona expresan un buen índice de efectividad. Las reacciones adversas sobre la madre fueron leves y se detectaron efectos sobre el RN en proporciones compatibles con la literatura. La mortalidad neonatal no se ha relacionado con la administración de nifedipino en ninguno de los casos, excepto en un caso de encefalopatía hipóxico-isquémica de un RN de 25 semanas de gestación, en la que no se puede descartar su contribución35 (tabla 4).
Si bien el nifedipino, debido a su efecto vasodilatador, se asocia a hipotensión, taquicardia, cefalea, rubor, edema y otros efectos adversos, se trata de un fármaco con un amplio margen terapéutico y contrastado en su utilización cardiológica. Se encuentran actualmente en marcha varios ensayos clínicos comparativos con nifedipino, con un número muy importante de pacientes36, cuyos resultados contribuirán al posicionamiento definitivo del mismo en los protocolos de APP. Cabe mencionar el reciente registro en España de una especialidad de nifedipino en forma de solución oral con indicación de APP14. Dicha especialidad presenta una absorción algo más rápida que las cápsulas, por lo que consideramos que deben extremarse las precauciones mencionadas (dosis diaria, límites de TA, contraindicaciones establecidas en el protocolo) con tal de evitar, en lo posible, los efectos secundarios. Ello, junto con un criterio estricto de indicación de la tocólisis, evitando su uso en falsas alarmas de PP, son los puntos esenciales para garantizar que la relación beneficio riesgo sea la más favorable para las gestantes y para los RN.
Responsabiliades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para recibir nifedipino en indicación no contemplada en ficha técnica.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónSin financiación.