Describir la evolución clínica y paraclínica de las pacientes embarazadas con enfermedad de Gaucher tipo 1.
Sujetos y métodosPacientes que ingresaron en el servicio de hematología con diagnóstico de enfermedad de Gaucher tipo 1 y embarazo.
ResultadosTodas las pacientes se clasificaron de alto riesgo. Se presentaron 9 embarazos en 4 pacientes; 7 venían recibiendo terapia de reemplazo enzimático cuando quedaron embarazadas y continuaron su aplicación, una lo suspendió 8 meses antes presentando agudización a nivel hematológico.
ConclusionesEl embarazo no debería contraindicarse en enfermedad estable. La terapia de reemplazo no debería interrumpirse, ni suspenderse, ya que disminuye las complicaciones.
To describe the clinical presentation and course in a group of pregnant women with Gaucher disease type 1.
Subjects and methodsPregnant women admitted to our hematology service with a medical diagnosis of Gaucher disease type 1.
ResultsAll patients were classified as high risk. We describe 9 pregnancies in 4 patients: 7 were on enzyme replacement therapy before the pregnancy and continued to receive this therapy throughout the pregnancy; 1 patient discontinued therapy 8 months previously and had a hematological exacerbation.
ConclusionsPregnancy should not be contraindicated in patients with stable disease. Enzyme replacement therapy should not be interrupted or suspended because it decreases complications.
La enfermedad de Gaucher (EG) se produce por un error en el metabolismo de la enzima lisosomal beta-glucosidasa, la cual induce el depósito de material glucolipídico no degradado en órganos ricos en células del sistema mononuclear macrófago, alterando el funcionamiento y produciendo el posterior daño1–4. El embarazo puede exacerbar la enfermedad existente o provocar la aparición de nuevas manifestaciones5–8. El uso de la terapia de reemplazo enzimático (TRE) ha demostrado reducir las complicaciones asociadas al embarazo, pero sin tener evidencia por ser una enfermedad de baja prevalencia5,6,8,9. Este estudio describe la evolución clínica, la paraclínica, las características demográficas, las comorbilidades, las complicaciones y el comportamiento de los parámetros de seguimiento antes y después del embarazo. Así mismo se determina si la TRE influyó en la disminución de las complicaciones.
MétodosDiseño del estudioReporte de casos, se incluyeron las pacientes embarazadas con diagnóstico de EG tipo 1 que tuvieron un seguimiento desde el año 2000 hasta junio de 2013 en un hospital docente asistencial. El estudio se desarrolla bajo principios éticos derivados de la declaración de Helsinki y bajo la normatividad colombiana regida por la resolución 8430 de 1993 del Ministerio de Salud. Se realizó un análisis de tipo descriptivo de la información. La base de datos se realizó en Excel® 2010. Se utilizaron frecuencias absolutas y relativas, medidas de tendencia central y de dispersión como métodos estadísticos utilizados para el análisis.
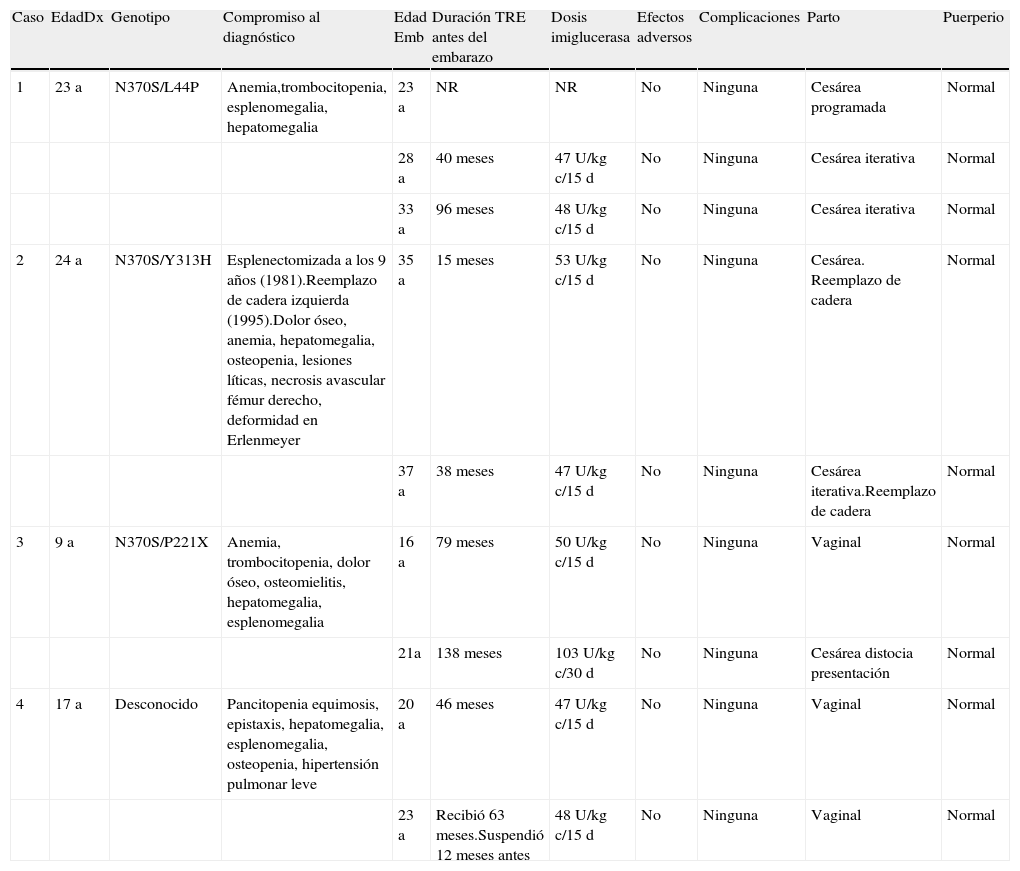
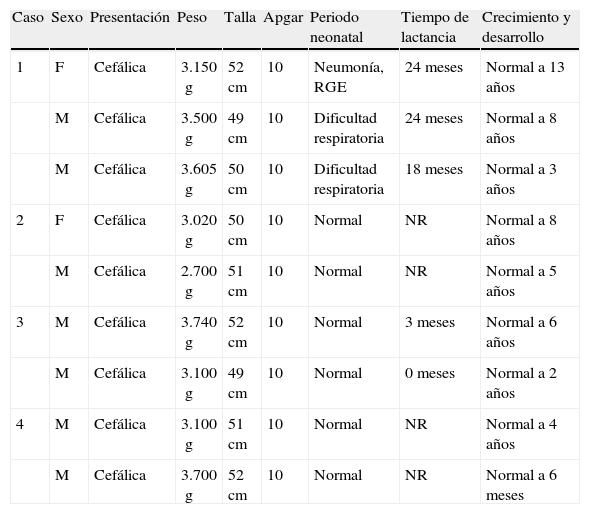
ResultadosSe documentaron 4 pacientes, todas de alto riesgo, de raza mestiza, y sin consanguinidad. Presentaron 9 embarazos, 7 recibieron TRE con imiglucerasa, los otros 2 no recibieron reemplazo. Cuatro recibieron consejería genética y fueros programados. Se realizó vigilancia estricta en conjunto con obstetricia de alto riesgo. El compromiso inicial y las características demográficas están reflejadas en la tabla 1. Las características del embarazo y del recién nacido figuran en las tablas 1 y 2. La respuesta al tratamiento se observa en la tabla 3. Una tenía hipotiroidismo controlado con el tratamiento. Ninguna desarrolló neoplasias.
Características demográficas
| Caso | EdadDx | Genotipo | Compromiso al diagnóstico | Edad Emb | Duración TRE antes del embarazo | Dosis imiglucerasa | Efectos adversos | Complicaciones | Parto | Puerperio |
| 1 | 23 a | N370S/L44P | Anemia,trombocitopenia, esplenomegalia, hepatomegalia | 23 a | NR | NR | No | Ninguna | Cesárea programada | Normal |
| 28 a | 40 meses | 47U/kg c/15 d | No | Ninguna | Cesárea iterativa | Normal | ||||
| 33 a | 96 meses | 48U/kg c/15 d | No | Ninguna | Cesárea iterativa | Normal | ||||
| 2 | 24 a | N370S/Y313H | Esplenectomizada a los 9 años (1981).Reemplazo de cadera izquierda (1995).Dolor óseo, anemia, hepatomegalia, osteopenia, lesiones líticas, necrosis avascular fémur derecho, deformidad en Erlenmeyer | 35 a | 15 meses | 53U/kg c/15 d | No | Ninguna | Cesárea. Reemplazo de cadera | Normal |
| 37 a | 38 meses | 47U/kg c/15 d | No | Ninguna | Cesárea iterativa.Reemplazo de cadera | Normal | ||||
| 3 | 9 a | N370S/P221X | Anemia, trombocitopenia, dolor óseo, osteomielitis, hepatomegalia, esplenomegalia | 16 a | 79 meses | 50U/kg c/15 d | No | Ninguna | Vaginal | Normal |
| 21a | 138 meses | 103U/kg c/30 d | No | Ninguna | Cesárea distocia presentación | Normal | ||||
| 4 | 17 a | Desconocido | Pancitopenia equimosis, epistaxis, hepatomegalia, esplenomegalia, osteopenia, hipertensión pulmonar leve | 20 a | 46 meses | 47U/kg c/15 d | No | Ninguna | Vaginal | Normal |
| 23 a | Recibió 63 meses.Suspendió 12 meses antes | 48U/kg c/15 d | No | Ninguna | Vaginal | Normal |
Dx: diagnóstico; Emb: embarazo; NR: no recibió; TRE: terapia de reemplazo enzimático.
Características del recién nacido
| Caso | Sexo | Presentación | Peso | Talla | Apgar | Periodo neonatal | Tiempo de lactancia | Crecimiento y desarrollo |
| 1 | F | Cefálica | 3.150g | 52cm | 10 | Neumonía, RGE | 24 meses | Normal a 13 años |
| M | Cefálica | 3.500g | 49cm | 10 | Dificultad respiratoria | 24 meses | Normal a 8 años | |
| M | Cefálica | 3.605g | 50cm | 10 | Dificultad respiratoria | 18 meses | Normal a 3 años | |
| 2 | F | Cefálica | 3.020g | 50cm | 10 | Normal | NR | Normal a 8 años |
| M | Cefálica | 2.700g | 51cm | 10 | Normal | NR | Normal a 5 años | |
| 3 | M | Cefálica | 3.740g | 52cm | 10 | Normal | 3 meses | Normal a 6 años |
| M | Cefálica | 3.100g | 49cm | 10 | Normal | 0 meses | Normal a 2 años | |
| 4 | M | Cefálica | 3.100g | 51cm | 10 | Normal | NR | Normal a 4 años |
| M | Cefálica | 3.700g | 52cm | 10 | Normal | NR | Normal a 6 meses |
F: femenino; M: masculino; NR: no reportado; RGE: reflujo gastroesofágico.
Respuesta a la terapia de reemplazo enzimático
| Caso | Objetivo terapéutico de TRE al año | Objetivo terapéutico de TRE a los 2 años | Objetivo terapéutico de TRE a los 5 años | Progresión posterior al embarazo | Respuesta antes del embarazo | Respuesta al año del nacimiento | |
| 1 | Óptima | Subóptima | Optima | 1 | Dolor óseo y crisis de dolor | Se diagnosticó en la semana 30 | Recibió TRE a los 26 meses del diagnóstico |
| 2 | No | Subóptima | Óptima | ||||
| 3 | No | Óptima | Óptima | ||||
| 2 | Óptima | Óptima | No determinadaAlcanzó objetivo a nivel de la hemoglobina, plaquetas. Estabilidad compromiso óseo.Faltó reporte imagenológico y bioquímico | 1 | No | Óptima | Óptima |
| 2 | No | Óptima | No determinada | ||||
| 3 | No determinada.Alcanzó objetivo a nivel de la hemoglobina, plaquetas. Aumento compromiso óseo.Faltó uniformidad de lectura imagenológica.Faltó reporte bioquímico | No determinada.Alcanzó objetivo a nivel de la hemoglobina, plaquetas. Aumento compromiso óseo.Faltó uniformidad de lectura imagenológica.Faltó reporte bioquímico | Óptima | 1 | No | Óptima | Óptima |
| 2 | No | Óptima | Óptima | ||||
| 4 | No determinada.Alcanzó objetivo a nivel plaquetario, óseo y bioquímico. No alcanzó objetivo en la hemoglobina.Falta uniformidad de lectura imagenológica | Óptima | Desconocida | 1 | No | Óptima | No determinada por no seguimiento |
| 2 | Desconocido | Enfermedad activa: pancitopenia, hepatomegalia, esplenomegalia | No determinada por no seguimiento |
TRE: terapia de reemplazo enzimático.
Paciente con antecedente de hermano con EG tipo 1. Remitida en el año 2000, con 30 semanas de embarazo para estudio de trombocitopenia (88.000plt/μl). Se realizó estudio de médula ósea observando células de Gaucher, en esa época existía limitación al acceso de la prueba, la cual se efectuó un año después. Parto por cesárea programada. Inició 26 meses después TRE, presentando obesidad como efecto secundario requiriendo ajuste de la dosis. En el año 2005 presentó su segundo embarazo sin complicaciones. El tercer embarazo fue en el 2010, requirió estudios genéticos por sospecha de malformaciones, las cuales fueron descartadas. Todos los recién nacidos presentaron problemas respiratorios, el primero neumonía asociada con vaginitis y los otros taquipnea transitoria del recién nacido, complicaciones no relacionadas con la enfermedad, si no con la vía del parto según concepto de obstetricia. Recibió bisfosfonato desde el año 2006 al 2007.
Paciente 2Valorada en el año 2003 por el servicio de hematología. Los síntomas y hallazgos físicos sugerían enfermedad de depósito, la cual fue confirmada con actividad de beta-glucosidasa en leucocitos. Inició TRE a los 33 años, con adecuada tolerancia. En el año 2005 y 2007 presentó su primero y segundo embarazo sin complicaciones.
Paciente 3Valorada en el año 1999 por el servicio de hematología. Por sospecha de osteomielitis fue intervenida quirúrgicamente documentando en patología células de Gaucher. Inició TRE con adecuada tolerancia. En el año 2006 y 2011 presenta su primero y segundo embarazo sin complicaciones.
Paciente 4En el año 2006 ingresa por epistaxis y equimosis. El hemograma mostraba pancitopenia y los estudios imagenológicos visceromegalias sugestivas de la enfermedad, estableciéndose el diagnóstico. Inició TRE con adecuada tolerancia. El primer embarazo fue en el año 2009, sin complicaciones. El segundo embarazo fue en el año 2012, ingresa en la semana 33, con controles prenatales inadecuados. Llevaba 12 meses sin tratamiento, ingresó con anemia, dolores óseos y visceromegalias indicando actividad clínica, por lo que se reinicia TRE. El parto fue a término y sin complicaciones. Recibió bisfosfonatos desde el año 2009 al 2010.
DiscusiónLa EG10 se produce por la infiltración de células ricas en material glucolipídico no degradado llevando a la aparición de síntomas que alteran la calidad y ponen en alto riesgo la vida de las personas1,2. Desde la introducción en el año 1991 de la TRE se dio un importante avance en el tratamiento, mejorando la calidad de vida, la cual se vio reflejada en las pacientes embarazadas, permitiéndoles tener gestaciones similares a la población general4,5,11–13. El embarazo representa una carga fisiológica adicional y significativa para las mujeres con EG5,7,9,14; esta puede exacerbar la enfermedad existente o llevar a la aparición de nuevas manifestaciones clínicas5,15. La anemia y la trombocitopenia pueden empeorar; la hepatoesplenomegalia interferir con el normal crecimiento del feto5,9,15; y la enfermedad ósea, incrementar el riesgo de crisis de dolor, osteonecrosis y fracturas5,9,16. Un mejor conocimiento de la enfermedad, de su forma transmisión, consejería genética, vigilancia obstétrica, posibilidades de diagnóstico antenatal y, la existencia de un tratamiento efectivo han modificado el manejo y seguimiento durante el embarazo2,4,11,17–19. En una revisión de la literatura realizada por 13 expertos que incluyeron 8 estudios, se describió un total de 398 embarazos con EG, de estos, 42 recibieron TRE. Encontraron una reducción en la incidencia del aborto (9,5 vs. 17,1%), de la hemorragia en el parto (4,9 vs. 32,2%), de la hemorragia en el posparto (1,6 vs. 6,4%), en los episodios de dolor óseo (3,8 vs. 14,1%), crisis de dolor (1,9 vs. 5,4%), visceromegalia (1,9 vs. 5,4%), y descenso en la hemoglobina (ninguno vs. 3,3%), que fueron mayores en las no tratadas, concluyendo que la TRE disminuye las complicaciones asociadas con el embarazo15. Las pacientes que presentamos en nuestro reporte fueron 4, con un total de 9 embarazos, en 3 con el genotipo N370S20,21. Siete embarazos continuaron la TRE con imiglucerasa, tolerándola adecuadamente, cursando con embarazos normales, sin progresión de la enfermedad y sin presentar complicaciones. Los 2 embarazos que no recibieron TRE tenían actividad de la enfermedad a nivel hematológico, visceral y óseo. Tres de los recién nacidos presentaron complicaciones respiratorias, uno asociado a neumonía y los otros 2 relacionados con la vía del parto. Todos presentaron peso normal, sin malformaciones y con adecuado neurodesarrollo hasta la fecha22.
La imiglucerasa es una medicación categorizada dentro del grupo farmacológico de las terapias enzimáticas, a pesar de estar categorizada en clase C15, se ha utilizado con seguridad durante el embarazo, demostrado un claro beneficio frente a la suspensión6,9,15, por lo tanto su uso debería continuarse de acuerdo a las normas internacionales4,5,11–13,19.
La lactancia no está contraindicada en las pacientes que están bajo TRE; los estudios han demostrado la desnaturalización de la medicación por las enzimas digestivas. Se deben tomar las medidas de vigilancia cuando hay lactancia mayor a 6 meses, dado que se ha observado desmineralización ósea que lleva a exacerbación de la enfermedad23,24, como se observó en uno de nuestros casos.
Por ser una enfermedad de alta complejidad debe ser manejada en centros con experiencia, y por un grupo multidisciplinario con el objetivo de disminuir la probabilidad de complicaciones que puedan afectar a la madre o al hijo5,11,13,16.
En conclusión, en los casos evaluados se muestran mujeres embarazadas con TRE previa por varios meses, con metas terapéuticas alcanzadas y estables. La mayoría de los embarazos fueron planeados, sin embrago las pacientes deben ser educadas para planear las gestaciones. En nuestro reporte la TRE fue bien tolerada, no suspendida, sin afectación fetal ni del desarrollo de los hijos, al igual que lo observado en las series publicadas, mostrando el beneficio de la terapia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónTrabajo financiado por recursos propios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimiento a mis profesores de hematología por el apoyo en la realización del trabajo de investigación, así mismo a mi asesora de metodología. Asociación Colombiana de Pacientes con Enfermedades de Depósito Lisosomal.