INTRODUCCIÓN
Aproximadamente el 23% de los cánceres ginecológicos es de origen ovárico, pero el 47% de todas las muertes por cáncer ginecológico del aparato genital femenino se produce en estas pacientes1,2. Representa el segundo proceso más frecuente en ginecología oncológica (tras el de endometrio, sin incluir el de mama) tanto en Europa como en Estados Unidos3,4, pero sigue siendo la primera causa de muerte, con un pronóstico de vida a los 5 años inferior al 20%. Esto se debe a la gran dificultad de un diagnóstico precoz, debido al carácter silente de este tipo de lesiones, por lo que el 65-70% de las pacientes se diagnostica en estadios avanzados3,5.
Globalmente, el carcinoma de ovario ocupa el quinto lugar entre todos los tipos de cáncer como causa de muerte entre las mujeres3.
A pesar de los avances en cirugía, quimioterapia y radioterapia, la supervivencia global en pacientes con cáncer de ovario no se ha modificado significativamente durante los últimos 20 años, incluso en estadios precoces4.
Los factores pronóstico en las pacientes con cáncer epitelial de ovario son útiles para facilitar las decisiones en el tratamiento y pueden proporcionar información para predecir los resultados de esta enfermedad. Los dos factores que tienen mayor significación en el pronóstico son: el estadio inicial según la clasificación de la Federación Internacional de Ginecología y Obstetricia (FIGO) y el tamaño de las lesiones tumorales tras la primera cirugía. El empleo de nuevos fármacos citostáticos, la combinación de los mismos y la aplicación de una cirugía basada en la historia natural y la biología tumoral podrían beneficiarse del conocimiento de los factores que ensombrecen el pronóstico, permitiendo la aplicación de terapias mucho más individualizadas y efectivas.
En este artículo mostramos nuestra experiencia del cáncer epitelial de ovario invasivo entre los años 1991 y 2001, estudiando la supervivencia y los factores pronóstico relacionados.
SUJETOS Y MÉTODO
Entre 1991 y 2001, en el área sanitaria de León, se diagnosticó a 236 pacientes de cáncer epitelial de ovario invasivo. En el estudio se incluyen todas las pacientes con confirmación histológica. Para el estudio de supervivencia eliminamos 15 pacientes, en las que no conocemos datos de seguimiento.
Se revisaron todas las historias clínicas de estas pacientes para obtener datos personales y demográficos (edad, fecha de nacimiento y lugar de residencia), datos clínicos (localización, histología, extensión, fecha del primer síntoma, fecha del diagnóstico, tratamiento, valores de los marcadores tumorales, otras neoplasias concomitantes e historia familiar de la enfermedad) y datos de seguimiento (fecha y estado de la paciente en el último control).
Estudio estadístico
Analizamos la supervivencia media, así como la supervivencia a 1, 2, 3, 4 y 5 años.
Se realizó un estudio univariante de la supervivencia global y según los distintos factores clínicos con pruebas de Kaplan-Meier, y se compararon las diferencias entre las curvas de supervivencia mediante la prueba log-rank. Las variables que resultaron significativas (p ≤ 0,05) en este estudio univariado se incluyeron en el análisis multivariante mediante el método de regresión múltiple de Cox; tras este estudio, las variables significativas se comportan como factores pronóstico de la enfermedad.
Para los cálculos estadísticos se utilizó el paquete informático SPSS+ para Windows (versión 11.0).
RESULTADOS
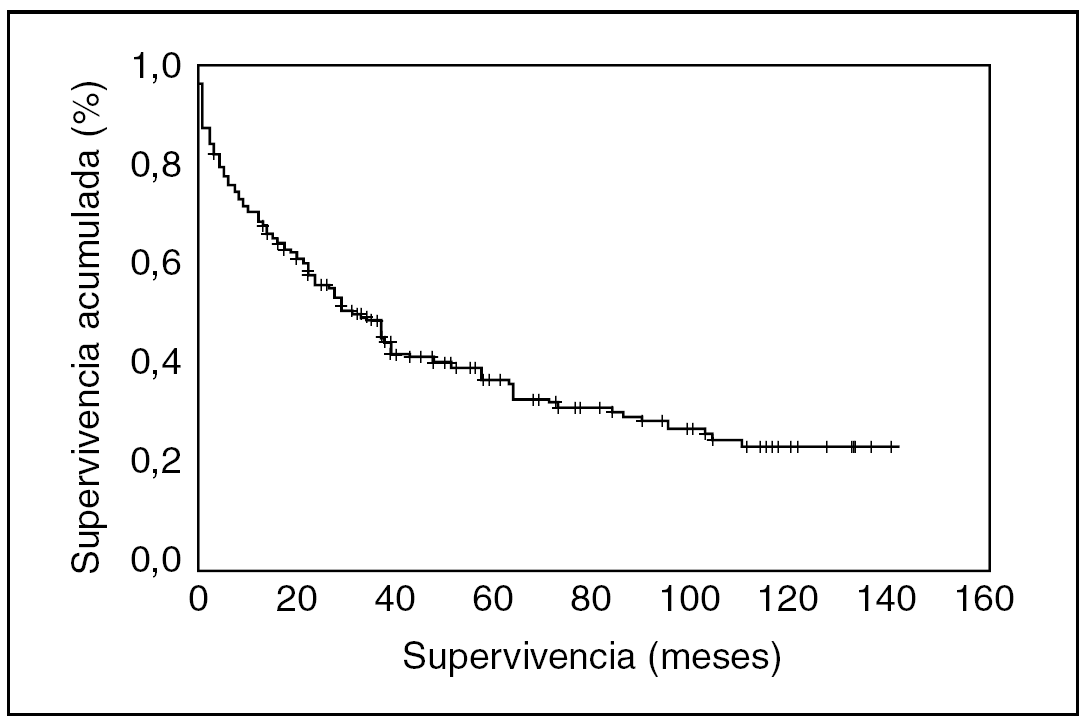
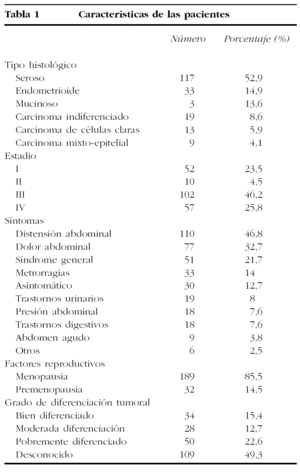
Las características de las pacientes se presentan en la tabla 1.
La edad media de las pacientes era de 65,4 ± 12,4 años, con una mínima de 24 y máxima de 94 años.
Los tipos histológicos, por orden de frecuencia, son el seroso (54,2%), el endometrioide (14,4%), el mucinoso (13,1%), el carcinoma indiferenciado (8,5%), el carcinoma de células claras (5,9%) y el carcinoma mixtoepitelial (3,8%).
La mayoría de las pacientes se diagnostican en estadios avanzados, con la siguiente distribución por estadios: I = 22,9%, II = 5,1%, III = 45,8% y IV = 26,3%.
El grado de diferenciación tumoral es conocido en 112 casos, entre los que el grado 1 corresponde al 14,4%, el grado 2, al 11,8%, y el grado 3, al 21,1%.
El síntoma que más frecuentemente referían era la distensión abdominal (45,2%). El 14,9% de las pacientes no tenían síntomas en el momento del diagnóstico.
El tiempo medio transcurrido entre el primer síntoma y el diagnóstico fue de 2,2 ± 3,9 meses.
El CA-125 aparece elevado en el 84,7% de nuestras pacientes, el CA-19,9, en el 26,7%, y el CEA, en el 8,2%.
La edad media de la menarquia fue de 13,1 ± 1,6 años, y la de la menopausia, de 49,7 ± 3,1 años.
El 85,5% de las pacientes eran menopáusicas en el momento del diagnóstico.
El 31,3% de las pacientes eran nulíparas. Entre las que habían tenido hijos, la media de hijos fue de 2,7.
De las 52 pacientes en estadio I de la FIGO, sólo se pudo realizar cirugía conservadora en 3 casos, todos ellos en estadio Ia de la FIGO y en edad reproductiva. En 2 de estos casos se completó la cirugía posteriormente. Al resto de las pacientes en este estadio se les realizó cirugía de estadificación completa.
Las 10 pacientes diagnosticadas en estadio II se sometieron a cirugía de estadificación completa.
En estadio III fueron diagnosticadas 102 pacientes; en 7 pacientes se realizó una laparotomía exploradora con toma de biopsias, pero tras en diagnóstico y aproximación del estadio por las pruebas complementarias, no se realizó ningún tipo de tratamiento, por decisión de la familia o por mal estado general de la paciente. El resto de las pacientes fueron sometidas a citorreducción: en 9 de ellas resultó óptima, en 68 subóptima y en 18 pacientes se realizó la cirugía tras recibir quimioterapia previa.
De las 57 pacientes diagnosticadas en estadio IV, en 33 pacientes, tras realizar laparotomía exploradora, se decidió realizar cuidados paliativos. No se consiguió citorreducción óptima en ningún caso, subóptima en 21 casos y en 4 pacientes se realizó la cirugía tras quimioterapia previa.
No recibieron ningún tipo de quimioterapia 82 pacientes (22 en estadio IaG1, en 22 pacientes el oncólogo la contraindicó por malas condiciones generales de la paciente y 47 pacientes, tras recibir la información adecuada, decidieron no administrarse ningún tipo de tratamiento complementario); del resto, 28 pacientes recibieron quimioterapia neoadyuvante y las demás adyuvante, de la que diferenciamos fundamentalmente entre los regímenes de platino asociados o no a paclitaxel, incluidas 57 y 54 pacientes, respectivamente.
El 31,7% presentó enfermedad recidivante. El 14,4% de las pacientes presentó más de una recurrencia y fueron tratadas con distintos regímenes de tratamiento que especificaremos más adelante.
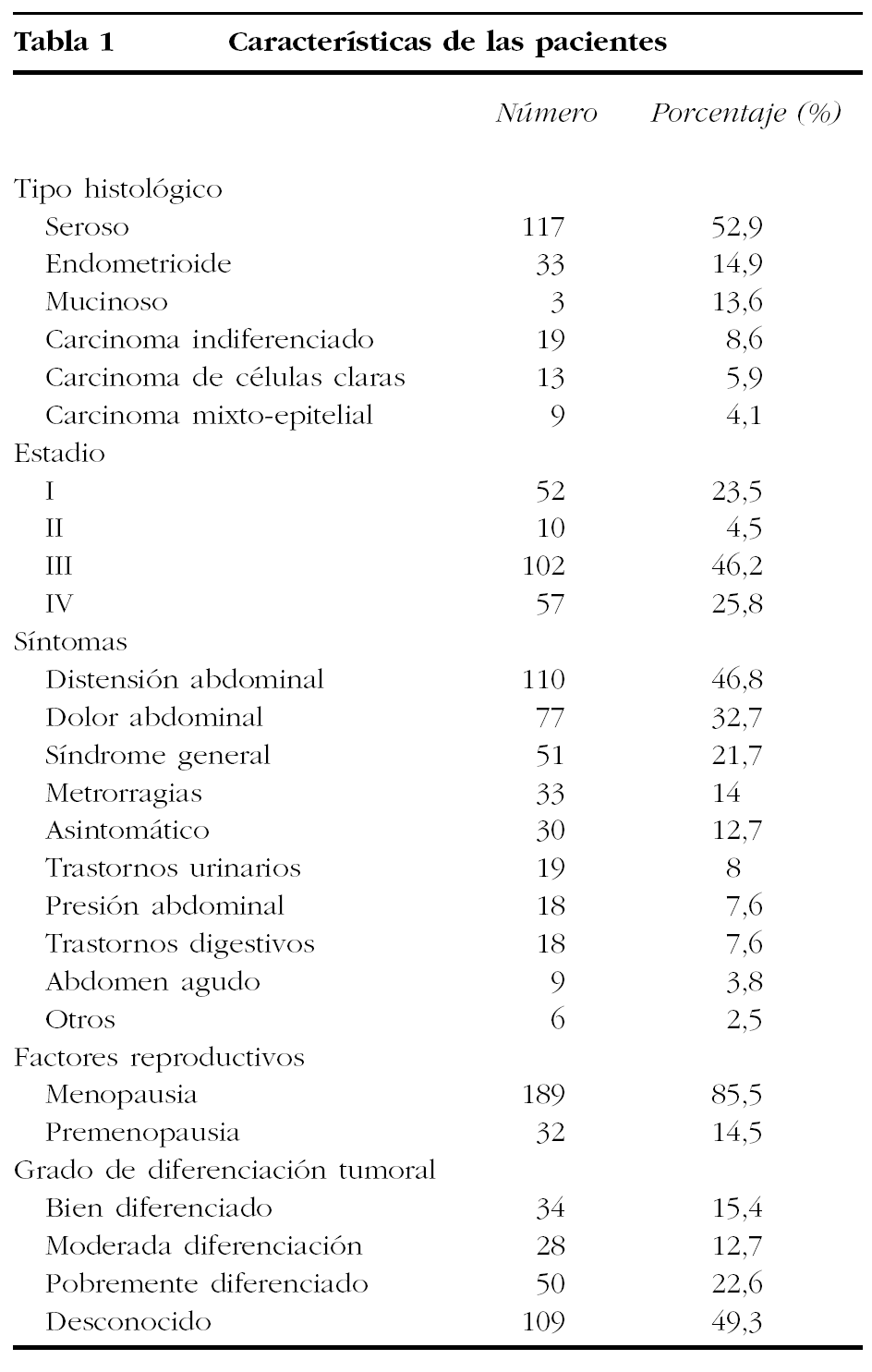
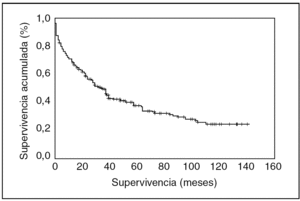
La supervivencia media para todos los casos durante el período 1991-2001 es de 57 meses; la supervivencia global por la enfermedad para todas las pacientes es del 35,7% después de un seguimiento de 140 meses, es decir, tras los 11 años del estudio aún viven 79 pacientes. La supervivencia a 1, 5 y 10 años fue del 69,1, 37,9 y 24,7%, respectivamente. La mediana de la supervivencia, que indica el tiempo en que nuestra población se reduce a la mitad, es de 35 meses (fig. 1).
Figura 1. Gráfico de supervivencia global del cáncer de ovario invasor. Área sanitaria de León. Período 1991-2001.
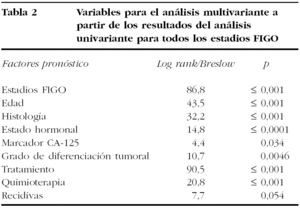
Globalmente, las variables que modifican la supervivencia de las pacientes para todos los estadios, según el análisis univariante en nuestro estudio, han sido: estadio FIGO, estratos de edad en el momento del diagnóstico, tipo histológico, estado hormonal, marcador sérico CA-125 elevado o normal, grado de diferenciación tumoral, tipo de cirugía primaria realizada, tipo de quimioterapia recibida y recidiva de la enfermedad, como se muestra en la tabla 2.
Dada la enorme importancia del estadio FIGO como factor pronóstico para la supervivencia, también se llevó a cabo el análisis univariante de las pacientes en estadios I y II y en estadios III y IV, separadamente.
Comprobamos al analizar aisladamente los estadios I y II de la FIGO que la única variable que modificaba el pronóstico era la recidiva de la enfermedad (p < 0,001). Por otro lado, analizando los estadios avanzados (FIGO III y IV); las variables que influían en el pronóstico en el estudio univariante fueron los estratos de edad, el tipo histológico, el estado hormonal, el marcador sérico CA-125, el tipo de cirugía primaria realizada, el tipo de quimioterapia recibida y la recidiva de la enfermedad.
En la tabla 2 se resumen los datos del análisis univariante que incluimos para el análisis multivariante.
En el análisis multivariante global se incluyen todas las variables en las que se han encontrado diferencias estadísticamente significativas en el análisis univariante.
Analizando todos los estadios, incluimos las variables significativas. Se excluyeron los tratamientos, ya que dependen directamente de los estadios de la enfermedad, y se incluyeron en el análisis de las variables por estadios. Se incluyen 107 casos, y las variables pronósticas independientes tras la aplicación de la regresión de Cox (tabla 3) fueron el estadio tumoral de la FIGO, la histología tumoral y la categoría de edad en el momento del diagnóstico.
En cuanto al estadio de la FIGO, tomando como referencia el estadio I se comprueba que la supervivencia de los estadios III y IV fue menor, con un riesgo relativo de 3,64 y 6,31, respectivamente.
Los tipos histológicos mucinoso y endometrioide muestran una supervivencia estadísticamente significativa superior a los serosos, con un riesgo relativo de 9,9 y 13,8, respectivamente. Los otros tipos histológicos no mostraron diferencias significativas respecto a los serosos.
Según aumenta la edad en el momento del diagnóstico, se aprecia una menor supervivencia, y esta diferencia es significativa cuando se plantea un punto de corte a los 30 años.
Además, se llevó a cabo un análisis multivariante para los casos diagnosticados en estadios avanzados (FIGO III y IV); los estadios iniciales no fueron analizados, ya que no se encontraron variables significativas en el análisis univariante (tabla 4). Los factores pronóstico independientes aplicando la regresión de Cox para un total de 57 casos diagnosticados en estadios avanzados fueron el tipo histológico y el tipo de cirugía realizada.
Los tipos histológicos mucinoso, mixto epitelial y de células claras tienen una supervivencia menor que los serosos, con un riesgo relativo de 14,9, 13,8 y 12,6, respectivamente, que alcanza la significación estadística.
Según el tipo de cirugía realizada, fueron variables pronósticas independientes la cirugía óptima y subóptima, que tuvieron una supervivencia mayor respecto a las pacientes inoperables, con un riesgo relativo de 31,2 y 15,1, respectivamente. Así pues, la cirugía que muestra una mayor supervivencia es la óptima.
DISCUSIÓN
La identificación de factores de riesgo y pronóstico en los estudios de cáncer de ovario es importante porque ayuda a conocer la historia natural de la enfermedad y proporciona a los investigadores datos para crear guías para la toma de decisiones en las estrategias de tratamiento.
De todos los factores que fueron estadísticamente significativos en el análisis univariante destacamos los que resultaron independientes tras el estudio multivariante, comportándose como factores pronóstico.
Las variables pronósticas significativas que aparecen en nuestro estudio para todos los estadios son el estadio FIGO, la histología tumoral y la edad de las pacientes en el momento del diagnóstico. Estos datos coinciden con otros estudios tanto nacionales como internacionales. Así, los datos de la FIGO indican como factores pronósticos independientes la edad, el tipo histológico, el grado de diferenciación tumoral, el estadio FIGO y el tratamiento adyuvante6. Los datos de la SEGO (Sociedad Española de Ginecología y Obstetricia) señalan como factores independientes la edad, el tipo histológico, el estadio FIGO y la existencia de enfermedad clínica al terminar la quimioterapia7.
El estadio FIGO posiblemente es el factor pronóstico más importante en el cáncer epitelial de ovario. Al analizar la bibliografía internacional se ha demostrado que el estadio FIGO es un factor pronóstico independiente en muchos estudios aplicando análisis multivariante8,9.
Varios estudios coinciden en afirmar el tipo histológico como un factor pronóstico independiente7,9, probablemente debido a que el cáncer epitelial de ovario no es una enfermedad homogénea, sino que cada tipo histológico es una enfermedad diferente. Es decir, cada tipo histológico probablemente tenga un desarrollo biológico diferente, de tal modo que no sólo su apariencia o desarrollo, sino también su quimiosensibilidad sea diferente. Los tumores endometrioides y de células claras se asocian con más frecuencia a endometriosis. Los tumores serosos no están asociados a endometriosis y, sin embargo, se diagnostican más frecuentemente en estadios avanzados. Los tumores mucinosos son de gran tamaño y aparecen en estadios muy precoces, pero cuando se encuentran en estadios avanzados, el tumor tiene un pronóstico desfavorable. Los tumores de células claras tienen peor pronóstico que otros tipos en estadios precoces, y los tumores endometrioides tienen una supervivencia mayor que los serosos. Por tanto, el cáncer epitelial de ovario no es una enfermedad homogénea. Por otro lado, aunque de un modo clásico se ha sugerido que todos los tumores epiteliales provienen de una misma célula del epitelio de superficie, este planteamiento comienza a ser controvertido10. En artículos recientes se proponen otras estructuras müllerianas secundarias como posible origen de los tumores epiteliales de ovario, como son el tejido paraovárico, los quistes paratubáricos, la rete ovari, la endosalpingosis, la endometriosis microscópica y la endomucinosis11.
Muchos estudios indican un bajo valor pronóstico del tipo histológico, probablemente debido a la parcialidad del análisis en muestras pequeñas y/o dificultades en el diagnóstico. Sin embargo, los carcinomas serosos, indiferenciados y de células claras tienen clásicamente una supervivencia menor12,13.
Como es lógico suponer, la edad es un factor pronóstico independiente; así, según aumenta la edad de las pacientes, aumenta el riesgo de fallecer por cáncer epitelial de ovario. Esto coincide con otros análisis multivariantes encontrados en la bibliografía internacional14,15.
Basado en un estudio con 2.000 pacientes, el Grupo de Oncología Ginecológica (GOG) estadounidense identifica la edad y el estado funcional de la paciente en el momento del diagnóstico como los más importantes factores pronóstico, junto con el volumen de enfermedad residual14. Considerando todos los estadios, las mujeres < 45 años en el diagnóstico tienen una supervivencia a 5 años del 67%, comparado con el 12% en pacientes > 80 años16.
Nuestro estudio muestra que el grado histológico está relacionado con el estadio FIGO. Así, el 52,9% de las pacientes con grado de diferenciación tumoral 1 pertenece al estadio I, mientras que el 56% de las pacientes con grado de diferenciación tumoral 3 pertenece a estadios avanzados. Otros estudios coinciden con el nuestro, y después de ajustar el grado de diferenciación tumoral con el tipo histológico y el estadio de la FIGO, no demuestra ser un factor pronóstico independiente en los análisis multivariantes15.
También es conocido que los valores del marcador CA-125 están relacionados con el estadio tumoral, con cifras mayores entre las pacientes en estadio diseminado19. Así, en nuestro estudio, el 61% de las pacientes en estadio I tiene un marcador normal, mientras que sólo un 10% en estadio IV; del mismo modo, sólo el 10% de las pacientes en estadio I tiene un valor > 2.000 U, mientras que en estadio diseminado son el 89%. Esto se explica porque, en nuestro estudio, el valor del marcador sérico CA-125 no es un factor pronóstico independiente.
El estado hormonal aparece como un factor de confusión, ya que está directamente relacionado con la edad de las pacientes en el momento del diagnóstico.
Por último, en el estudio univariante aparecen como significativos el tipo de cirugía y quimioterapia y las recidivas tras el tratamiento, que no son significativos tras el estudio multivariante, ya que estas variables están interrelacionadas entre ellas y al mismo tiempo dependen del estadio de la enfermedad en el momento del diagnóstico, que sí es un factor pronóstico independiente.
Correspondencia:
Dra. C. Fernández-Fernández.
Centro Ginecológico de León.
Marqueses de San Isidro, 11. 24004 León. España.
Correo electrónico: camino_fernandez_fernandez@hotmail.com
Fecha de recepción: 3/5/05
Aceptado para su publicación: 11/10/05