Comparar el flujo sanguíneo de la arteria hepática fetal en preeclámpticas severas y embarazadas normotensas sanas.
MétodoLa muestra fue de 30 preeclámpticas severas (grupo A) y 60 embarazadas normotensas sanas (grupo B) con embarazos simples de más de 30 semanas. Se midieron los índices de pulsatilidad y resistencia de las arterias uterinas, umbilical, cerebral media fetal y hepática fetal.
ResultadosNo se encontraron diferencias estadísticamente significativas en la edad materna y la edad gestacional (p=ns). Las pacientes del grupo A presentaron valores significativamente más altos del índice de pulsatilidad y resistencia de las arterias uterinas y la umbilical, pero presentaron valores más bajos de los índices de pulsatilidad y resistencia de la arteria cerebral media fetal, que las embarazadas del grupo B (p=0,0001). Las preeclámpticas severas presentaron valores del índice de pulsatilidad y resistencia de la arteria hepática fetal significativamente más altos comparados con las pacientes del grupo B (p=0,0001 y p=0,0021 respectivamente). El índice de pulsatilidad de la arteria hepática presentó una correlación significativa con el índice de pulsatilidad de los 3 vasos (p=0,0001). El índice de resistencia de la arteria hepática presentó correlación significativa con el índice de resistencia de la arteria umbilical y de la arteria cerebral media fetal (p=0,005 y p<0,0001 respectivamente).
ConclusiónLas preeclámpticas severas tienen alteraciones del flujo sanguíneo de la arteria hepática fetal al compararlo con las embarazadas normotensas sanas.
To compare blood flow in the hepatic artery in severely preeclamptic and healthy normotensive pregnant women.
MethodsThe sample was composed of 30 severely preeclamptic women (group A) and 60 healthy normotensive pregnant women (group B) with single pregnancies of more than 30 weeks’ gestation. The pulsatility and resistance indexes of the uterine, umbilical, fetal middle cerebral and fetal hepatic arteries were measured.
ResultsNo significant differences were found in maternal or gestational age (P=ns). Group A showed significantly higher values in the pulsatility and resistance indexes in the uterine and umbilical arteries with significantly lower values of both measurements in the fetal middle cerebral artery compared with group B (P=0.0001). Values of the pulsatility and resistance indexes of the fetal hepatic artery were significantly higher in group A than in group B (P=0.0001 and P=0.0021, respectively). The fetal hepatic artery pulsatility index was significantly correlated with the pulsatility index of the three vessels (P=0.0001). The fetal hepatic artery resistance index was correlated with the resistance index of the umbilical artery and the fetal middle cerebral artery (P=0.005 and P<0.0001, respectively).
ConclusionSeverely preeclamptic women have blood flow alterations in the fetal hepatic artery when compared with healthy normotensive pregnant women.
La preeclampsia continúa siendo una causa importante de morbilidad y mortalidad materna y perinatal. Las complicaciones maternas de la preeclampsia incluyen coagulopatía, insuficiencia renal y enfermedad cerebrovascular hemorrágica1,2. La disfunción endotelial provoca vasoconstricción generalizada, activación plaquetaria, trombosis y disminución del volumen plasmático, con posterior reducción del flujo sanguíneo a múltiples órganos3. El hallazgo principal fisiopatológico de la preeclampsia es la alteración de la vasodilatación de los vasos maternos, mediado por diferentes compuestos que se producen en el endotelio4.
Las mediciones de la velocidad de flujo sanguíneo en las arterias uterina y umbilical pueden revelar de forma exitosa la resistencia vascular de la placenta, la cual es predictiva para las complicaciones del embarazo5. En respuesta a la reducción de la perfusión placentaria y la hipoxia crónica, el feto redistribuye su flujo sanguíneo a órganos vitales como el cerebro, el corazón y las glándulas suprarrenales, un mecanismo para reservar el oxígeno para los órganos importantes6. Durante la hipoxia sostenida, se ha observado en modelos animales, que el flujo sanguíneo de riñón, hígado y pulmones se encuentra disminuidos en forma significativa7. Hallazgos parecidos se han realizado en fetos humanos, y en ausencia de restricción del crecimiento intrauterino del feto, utilizando la ecografía Doppler8–10.
El hígado tiene un papel preponderante en el crecimiento fetal, lo cual ha sido demostrado por estudios experimentales en los cuales se han demostrado el incremento de la perfusión hepática, produciendo una proliferación de los hepatocitos fetales11, mayor expresión de los factores de crecimiento similar a la insulina e incremento del peso fetal12. Un estudio en fetos humanos al final de embarazo sugiere que la composición corporal materna y la dieta pueden modificar la distribución del flujo sanguíneo al hígado fetal13.
Aunque la arteria hepática tiene una modesta contribución al flujo sanguíneo hepático, esta juega un importante papel para mantener la perfusión hepática posnatal14. La contribución de flujo sanguíneo de la arteria hepática a la circulación del hígado, según estudios animales, es menor del 10%15. Una reducción en la perfusión hepática portal produciría un incremento en las concentraciones de adenosina, lo cual produce una reducción instantánea de la impedancia arterial, aún durante la vasoconstricción esplácnica generalizada posterior a la hipovolemia16. No se conoce si este mecanismo opera durante la etapa prenatal, pero las mediciones Doppler en fetos con restricción del crecimiento intrauterino sugieren que puede existir una respuesta similar17. Sin embargo, existe poca información sobre las mediciones de la arteria hepática fetal en preeclámpticas.
El objetivo de la investigación fue comparar el flujo sanguíneo de la arteria hepática fetal en preeclámpticas severas y embarazadas normotensas sanas.
Pacientes y métodosLa muestra fue de 30 preeclámpticas severas y 60 embarazadas normotensas sanas, todas nulíparas, y con embarazos simples de más de 30 semanas, que acudieron a la emergencia obstétrica. Los controles fueron seleccionados pareados con las preeclámpticas por edad materna y edad gestacional. La investigación fue aprobada por el Comité de Ética e Investigación del hospital y se obtuvo consentimiento por escrito de todas las embarazadas. Se excluyeron las embarazadas con hipertensión crónica, sospecha de restricción del crecimiento intrauterino del feto (definido como circunferencia cefálica, circunferencia abdominal y longitud del fémur por debajo del percentil 10 de referencia con confirmación postnatal de un peso menor del percentil 10 de referencia), diabetes mellitus pre-gestacional o gestacional y enfermedades sistémicas crónicas. La preeclampsia severa se definió siempre que la presión arterial diastólica estuviera por encima de 110mmHg o una presión arterial sistólica de 160mmHg o más, junto con 3 cruces de proteinuria en un examen cualitativo o por lo menos 3g en una muestra de orina de 24h, presencia de cefalea, alteraciones visuales, dolor abdominal, oliguria (menos de 500ml/24h), hiperbilirrubinemia, elevación de las concentraciones séricas de creatinina (mayor de 1,0mg/dl), trombocitopenia (menos de 150.000mm3) y elevación de las concentraciones de las transaminasas después de las 20 semanas de gestación. La presión sanguínea se midió en posición sentada después de 15min de descanso.
Todas las preeclámpticas severas fueron hospitalizadas y se realizó la ecografía antes del uso de cualquier tratamiento. Se analizaron el flujo sanguíneo de las arterias uterinas, umbilical, cerebral media y hepática fetal. Se midieron los índices de pulsatilidad y resistencia de cada arteria. Las mediciones Doppler se realizaron utilizando el Ecógrafo Doppler Color General Electric Logiq® Pro 3 en tiempo real con un transductor abdominal de 3,5MHz en el siguiente orden: arteria uterina, umbilical, cerebral media fetal y hepática fetal. Todas las mediciones fueron realizadas con el feto en apnea y en ausencia de movimientos fetales. La evaluación de cada paciente se realizó por un mínimo de 20min dependiendo de la posición y los movimientos fetales y fueron realizadas por un solo investigador.
Las arterias uterinas fueron identificadas en una visualización longitudinal de las caras laterales del útero con la paciente reclinada. En esa posición demostró la bifurcación de la arteria ilíaca común. La medición se realizó en el punto donde la arteria uterina y la ilíaca externa parecen cruzarse. En ese punto se midieron los índices de pulsatilidad y resistencia de ambas arterias uterinas y se calculó el promedio de los 2 vasos.
Las mediciones Doppler de la arteria umbilical se calcularon con el promedio de 3 mediciones obtenidas de la porción libre flotante del cordón umbilical, teniendo en cuenta que la porción estudiada no se encontrara demasiado cerca del feto o la placenta. Para las mediciones de la arteria cerebral media fetal, se realizó una visión axial de la cabeza fetal al nivel de los pedúnculos cerebelosos y se visualizó el polígono de Willis realizándose las mediciones a 1cm del origen de la arteria cerebral media fetal. El ángulo entre la emisión de ondas ecográficos y la dirección del flujo sanguíneo fue siempre menor de 30°.
Para realizar las mediciones Doppler de la arteria hepática fetal se obtuvo una imagen axial del abdomen fetal, identificándose la arteria hepática común fetal desde su nacimiento en el eje celíaco. La ventana Doppler fue colocada en la rama izquierda de la arteria hepática cerca del ducto venoso. Se intentó tener un ángulo de insonación menor al 30° en todas las mediciones. Se utilizaron un mínimo de 3 mediciones consecutivas para calcular cada índice.
Los datos se muestran como promedio ± desviación estándar. Se comparó al grupo de las preeclámpticas severas con el grupo de las embarazadas normotensas sanas en cada una de las mediciones Doppler, en las cuales se utilizó la prueba t de Student para las muestras no relacionadas. Los coeficientes de correlación entre las determinaciones Doppler hepática fetal y el resto de las determinaciones en las otras arterias en las preeclámpticas severas se evaluaron usando la prueba de correlación de Pearson. Se consideró un p<0,05 como estadísticamente significativo.
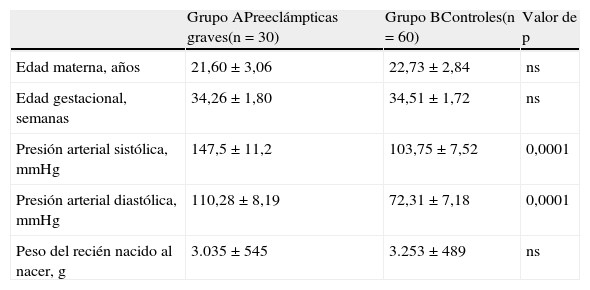
ResultadosEn la tabla 1 se muestran las características generales en ambos grupos de embarazadas. No se encontraron diferencias estadísticamente significativas en la edad materna y la edad gestacional (p=ns). Se encontraron diferencias estadísticamente significativas en los valores promedio de presión arterial sistólica, presión arterial diastólica y proteinuria entre el grupo de preeclámpticas y los controles normotensas sanos (p=0,0001), como era de esperar. Con respecto al peso de los recién nacidos al nacer, no se observaron diferencias entre los 2 grupos (3.035±545g para el grupo A comparado con 3.253±489g para el grupo B; p=ns). La edad gestacional al momento de realizar el diagnóstico en las pacientes del grupo A fue de 32,12±0,96 semanas de gestación.
Características generales
| Grupo APreeclámpticas graves(n=30) | Grupo BControles(n=60) | Valor de p | |
| Edad materna, años | 21,60±3,06 | 22,73±2,84 | ns |
| Edad gestacional, semanas | 34,26±1,80 | 34,51±1,72 | ns |
| Presión arterial sistólica, mmHg | 147,5±11,2 | 103,75±7,52 | 0,0001 |
| Presión arterial diastólica, mmHg | 110,28±8,19 | 72,31±7,18 | 0,0001 |
| Peso del recién nacido al nacer, g | 3.035±545 | 3.253±489 | ns |
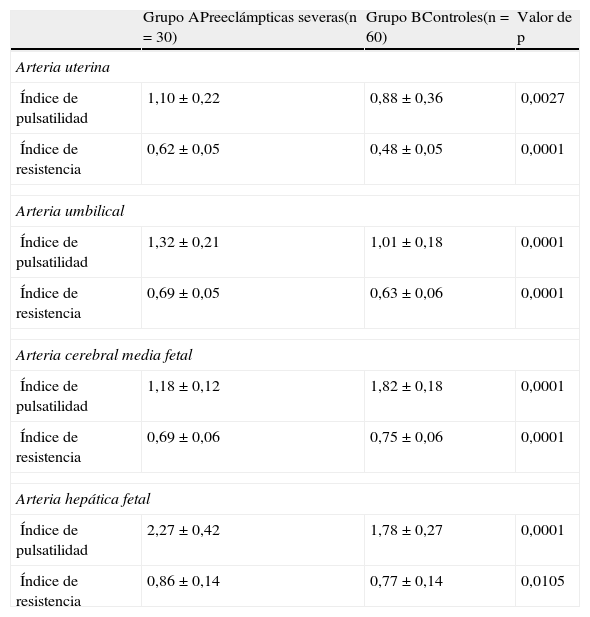
En la tabla 2 se muestran los valores de las mediciones Doppler de las arterias evaluadas. Se observó que las pacientes del grupo A presentaron valores significativamente más altos del índice de pulsatilidad y resistencia de las arterias uterinas (p=0,0009 y 0,0001 respectivamente) y la umbilical (p=0,0001 y 0,0003 respectivamente) que las pacientes del grupo B. Con respecto a la arteria cerebral media fetal, las preeclámpticas presentaron valores significativamente más bajos de los índices de pulsatilidad y resistencia de la arteria cerebral media fetal que las embarazadas del grupo B (p=0,0001).
Mediciones de ecografía Doppler de cada arteria
| Grupo APreeclámpticas severas(n=30) | Grupo BControles(n=60) | Valor de p | |
| Arteria uterina | |||
| Índice de pulsatilidad | 1,10±0,22 | 0,88±0,36 | 0,0027 |
| Índice de resistencia | 0,62±0,05 | 0,48±0,05 | 0,0001 |
| Arteria umbilical | |||
| Índice de pulsatilidad | 1,32±0,21 | 1,01±0,18 | 0,0001 |
| Índice de resistencia | 0,69±0,05 | 0,63±0,06 | 0,0001 |
| Arteria cerebral media fetal | |||
| Índice de pulsatilidad | 1,18±0,12 | 1,82±0,18 | 0,0001 |
| Índice de resistencia | 0,69±0,06 | 0,75±0,06 | 0,0001 |
| Arteria hepática fetal | |||
| Índice de pulsatilidad | 2,27±0,42 | 1,78±0,27 | 0,0001 |
| Índice de resistencia | 0,86±0,14 | 0,77±0,14 | 0,0105 |
Con respecto a la arteria hepática fetal (tabla 2), las pacientes del grupo A presentaron valores del índice de pulsatilidad significativamente más altos comparado con las embarazadas del grupo B (2,27±0,41 para las pacientes del grupo A comparado con 1,78±0,27 para las embarazadas del grupo B; p=0,0001). Igualmente las preeclámpticas presentaron valores del índice de resistencia significativamente más altos (0,85±0,13) comparado con las embarazadas controles sanas (0,77±0,14; p=0,0105).
El índice de pulsatilidad de la arteria hepática presentó una correlación positiva, moderada y significativa con el índice de pulsatilidad de la arteria uterina (r=0,562; p=0,0001) y con el índice de pulsatilidad de la arteria umbilical (r=0,503; p=0,0001) y negativa, moderada y significativa con el índice de pulsatilidad de la arteria cerebral media fetal (r=−0,540; p=0,0001). El índice de resistencia de la arteria hepática presentó una correlación positiva, leve y significativa con el índice de resistencia de la arteria umbilical (r=0,280; p=0,005) y negativa, leve y significativa con el índice de resistencia de la arteria cerebral media fetal (r=−0,282; p<0,0001).
DiscusiónLos resultados de la investigación demuestran que las preeclámpticas severas presentan alteración del flujo sanguíneo de la arteria hepática, demostrado por un aumento significativo del índice de pulsatilidad y resistencia, relacionado con las alteraciones de los índices de las arterias uterinas, umbilical y cerebral media.
La circulación hepática es compleja. El hígado es perfundido por la arteria hepática y una combinación de circulación portal-umbilical. Se estima que la contribución de la arteria hepática al flujo sanguíneo total es menos de 10% en las ovejas, después del nacimiento esta contribución llega hasta el 30%15,18. El hígado fetal se diferencia durante la gestación de ser un órgano esencialmente hematopoyético en el primer trimestre, incrementa su actividad durante el segundo trimestre19. Entre las 25 semanas de gestación y el nacimiento existen pocos cambios en la arquitectura vascular del hígado20. La velocidad sistólica pico tiene una cercana relación con el volumen sanguíneo de otras porciones del sistema arterial fetal21. Se considera que el incremento de la velocidad sanguínea arterial a partir de las 22 semanas puede reflejar una situación similar en el hígado.
Es conocido que la reducción del flujo de oxígeno abre el ducto venoso y desvía la sangre oxigenada que se dirigiría hacia el hígado al corazón. La apertura del ducto venoso podría afectar la resistencia vascular de la arteria hepática17. Además, la regulación neurológica y endocrina del lecho vascular hepático tiene un papel importante22. La vasculatura portal muestra una respuesta constrictora más pronunciada a la estimulación adrenérgica comparada con el ducto venoso23. Todo esto combinado hace que el sistema de distribución sea extremadamente sensible a la regulación activa y pasiva24.
La preeclampsia y en un menor grado la hipertensión durante el embarazo, es una enfermedad vascular que afecta tanto a la circulación materna como a la fetal. Del lado materno, una de las características más tempranas de la enfermedad es la infiltración deficiente de las arterias espirales por el trofoblasto25. Posteriormente, no se produce el incremento de 10 a 12 veces de la perfusión uterina, como se observa en el embarazo normal. Esto afecta el flujo de las arterias uterinas26. Del lado fetal, existe una pobre vascularización y hemorragias del estroma de las vellosidades terminales y endovasculitis hemorrágica10,27.
Las modificaciones observadas en la presente investigación en el índice de pulsatilidad y resistencia en la arteria hepática fetal de las preeclámpticas, y en ausencia de restricción de crecimiento intrauterino del feto, puede reflejar un mecanismo compensatorio para compensar la reducción de flujo sanguíneo hacia el hígado y para mantener la sangre dentro del órgano, como una medida de protección contra los cambios pasivos de la presión arterial central28. En experimentos animales, el sistema vascular fetal responde a la disminución del flujo úteroplacentario con una vasoconstricción generalizada con excepción de los vasos cerebrales, coronarios y hepáticos29. Esta investigación demostró que los índices de pulsatilidad y de resistencia de la arteria hepática fetal tienen una correlación en algunos casos moderada con las arterias uterina, umbilical y cerebral media fetal, sugiriendo que puede existir cierto grado de regulación dependiente a las alteraciones del flujo sanguíneo observadas en la preeclampsia.
Kilavuz et al.30 encontraron que la resistencia vascular de la arteria hepática fetal era menor en los fetos con restricción del crecimiento intrauterino que en los fetos normales. Esto podría ser explicado por qué el hígado es un órgano preferencial para el flujo sanguíneo arterial en el feto hipóxico. Los datos de la presente investigación en preeclámpticas contradicen los hallazgos de esa investigación. Al igual que lo reportado por Dubiel et al.17, los resultados de la presente investigación sugieren que, al observarse alteraciones de las arterias uterinas y umbilical, la resistencia vascular hepática tiende a aumentar, lo cual no apoya la hipótesis de protección hepática en todos los embarazos de alto riesgo, y en especial en la preeclampsia.
Los hallazgos de esta investigación, al igual que lo reportado por Dubiel et al.17, demostraron relacionarse en forma significativa con los elevados índices de resistencia en las arterias uterinas y umbilical. Pero a diferencia de esa investigación, los hallazgos de este estudio demostraron ser significativamente más altos que en las embarazadas normotensas. Se ha sugerido, que quizá la protección hepática está presente en las primeras etapas del compromiso fetal. Si el feto es afectado en forma más severa, se produce la apertura del ducto venoso y se puede observar un incremento de la resistencia de la arteria hepática9,12,17.
Se concluye, que las preeclámpticas severas tienen alteraciones del flujo sanguíneo de la arteria hepática fetal al compararlo con las embarazadas normotensas sanas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.