La persistencia del efecto protector sobre fracturas vertebrales (FV) de la terapia hormonal (TH) tras dejar el tratamiento es tema de debate. El objetivo del estudio es evaluar la incidencia de FV en un grupo de pacientes tratadas durante el período 1990-1995, comparado con otro que durante ese mismo periodo no recibió TH, tras 20 años de seguimiento.
Sujetos y métodosUn total de 177 pacientes fueron incluidas en un estudio prospectivo para evaluar el efecto de la TH en el metabolismo y densidad mineral ósea. Del total, transcurridos 20 años, se recupera a 49 pacientes: 32 tratadas durante una media de 5 años y 17 pertenecientes al grupo control. Se analizan datos clínicos, demográficos y radiológicos, evaluando incidencia de FV mediante el método semicuantitativo de Genant.
ResultadosSe observa un mayor índice de fracturas en el grupo que recibió TH, siendo estas diferencias estadísticamente significativas (p<0,05).
ConclusiónLa TH utilizada en los primeros años de la menopausia no presenta efecto protector ante FV a largo plazo tras abandonar el tratamiento.
The role of hormone replacement therapy in preventing spinal fracture after treatment cessation is controversial. The aim of this study was to assess the incidence of spinal fractures after 20 years of follow-up in patients treated between 1990 and 1995.
Subjects and methodsA total of 177 patients were included in a prospective study to evaluate the effect of hormone replacement therapy on bone metabolism and bone mineral density. After 20 years, 49 patients were successfully contacted: 32 were treated for a mean of 5 years and 17 belonged to the control group. We analyzed clinical and demographic data and performed a radiological evaluation to observe the incidence of fractures by Genant's semiquantitative method.
ResultsThe fracture rate was significantly higher in the group receiving hormone replacement therapy (P<.05).
ConclusionHormone replacement therapy administered at the beginning of menopause does not appear to have a protective effect against spinal fractures in the long term.
La osteoporosis es una enfermedad muy prevalente que aumenta con la edad, de forma que a los 80 años se considera que hasta un 70% de las mujeres presentan osteoporosis en cadera, columna lumbar o parte distal del antebrazo1. Se trata de una enfermedad que altera la arquitectura del hueso, disminuye su resistencia y predispone a un aumento de riesgo de padecer fracturas2. Otros factores, como el índice de masa corporal (IMC), influyen negativamente, aumentando el riesgo de osteoporosis3. Las fracturas vertebrales representan casi la mitad de todas las fracturas relacionadas con la osteoporosis2,4.
La utilidad de la terapia hormonal (TH) en la menopausia en el tratamiento de las fracturas vertebrales ha sido profundamente debatido a lo largo de los años5 debido a los posibles efectos secundarios6,7. Posteriormente, estos estudios han sido criticados por falta de consistencia y han aparecido otros trabajos que apoyan el uso de TH en los primeros años de la menopausia. Dichos estudios recomiendan tratar los síntomas relacionados con la menopausia y prevenir la osteoporosis en pacientes con alto riesgo de fracturas8 pero no recomiendan su uso prolongado, el inicio del tratamiento tras varios años de menopausia o su uso en pacientes con morbilidad asociada.
Actualmente, han aparecido otros puntos de controversia como el hecho de que algunos estudios han demostrado que, con el cese del tratamiento con TH, desaparece su efecto protector sobre la densidad mineral ósea y las fracturas a lo largo de los años9,10. Así, se pone en duda si la TH debe formar parte de la primera línea de tratamiento para la prevención de fracturas11–13.
Por lo tanto, el objetivo de nuestro estudio fue determinar la influencia de la TH en la prevención de fracturas vertebrales, valoradas por placas radiológicas, 20 años después de la suspensión del tratamiento.
Material y métodosDurante 1990 y 1991, un total de 177 mujeres formaron parte de un estudio aleatorizado prospectivo, con el objetivo de evaluar los efectos de la TH sobre el metabolismo óseo y la densidad mineral ósea14,15. Las pacientes menopáusicas (independientemente de si se trataba de una menopausia médica o quirúrgica) fueron reclutadas de la Unidad de Endocrinología Ginecológica del Hospital Clínic de Barcelona. El estudio fue aprobado por el Comité Ético del Hospital Clínic (1989).
Las pacientes fueron aleatorizadas, bien a recibir tratamiento hormonal oral con estrógenos conjugados a dosis de 0,625mg/día o transdérmico a dosis de 50 mcg/día, o bien fueron asignadas a un grupo control sin tratamiento. Todas las pacientes con menopausia espontánea, excepto las pertenecientes al grupo control, recibieron 5mg de acetato de medroxiprogesterona secuencialmente los 12 últimos días de cada ciclo en el caso de terapias cíclicas o 5mg/día en caso de terapias continuas. Todas ellas firmaron previamente el consentimiento informado.
Las pacientes fueros visitadas regularmente para comprobar sintomatología, efectos secundarios y adherencia al tratamiento. Tras 20 años de seguimiento, las pacientes se dividieron en 2 grupos: el grupo que había realizado TH con alguna de las pautas anteriormente descritas (grupo TH) y el grupo que no había realizado TH (grupo control). Se realizó una anamnesis detallada sobre datos clínicos, demográficos, exploración física y se realizaron radiografías anteroposteriores y laterales de columna dorsal y lumbar, llevadas a cabo por el Servicio de Radiodiagnóstico del mismo hospital, con el objetivo de determinar la incidencia de fracturas vertebrales observadas. Se incluyó columna dorsal desde D4 hasta D12 y columna lumbar en toda su extensión. Se midió la altura de los cuerpos vertebrales en 3 puntos: anterior, posterior y medio. El evaluador (CCB) desconocía en el momento de revisar las radiografías a qué grupo pertenecía cada paciente. Posteriormente, un segundo evaluador (MFP), también a ciegas, corroboró el diagnóstico inicial. Para el diagnóstico y clasificación de las fracturas vertebrales, se utilizó el método semicuantitativo de Genant16: grado i (≥20 y <25%), grado ii (≥25% y <40%) y grado iii (≥40%).
Los datos obtenidos fueron analizados mediante SPSS Statistics 20.0. Se realizó un análisis descriptivo y comparativo en función del tipo de variable y de su distribución (normal o no normal), utilizando la prueba estadística más apropiada para cada análisis: chi-cuadrado/F-Fisher para comparación de proporciones, t de Student/U-MannWhitney para comparación de medias y regresión logística para el análisis multivariante.
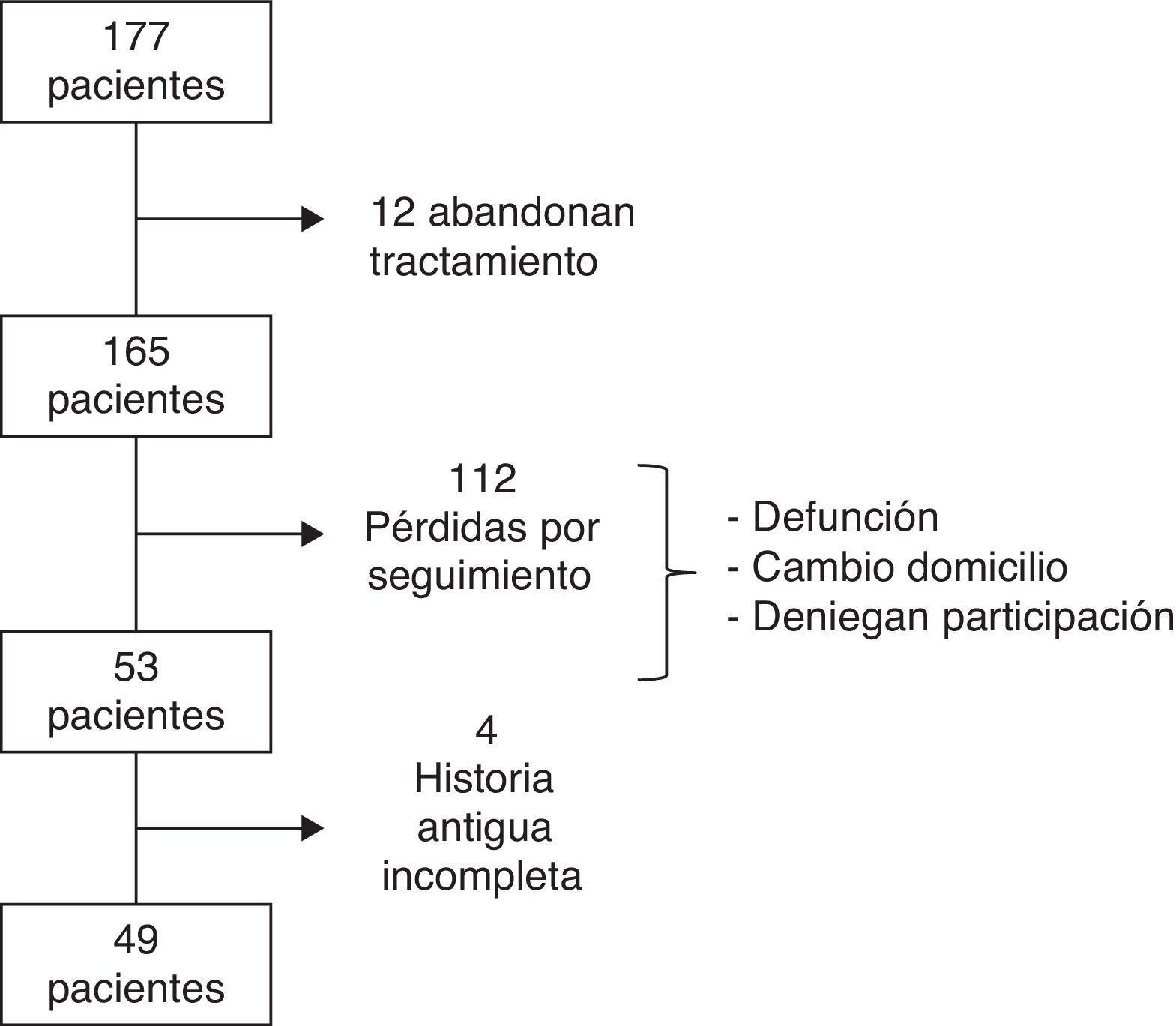
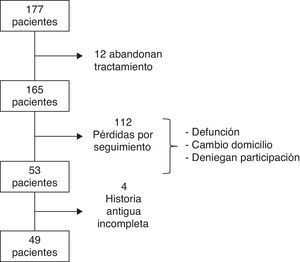
ResultadosEntre 1990 y 1991, se incluyó a un total de 177 pacientes, de las cuales 12 abandonaron el tratamiento. Los motivos por los cuales las pacientes no siguieron con la TH han sido detallados previamente17. Tras 21 años, se consiguió contactar con 49 de las 165 pacientes. Las causas de pérdida de seguimiento (n=116) incluyen: cambio de domicilio, defunción, negación a participar en el estudio o historia antigua incompleta (fig. 1). De las 49 pacientes incluidas, 32 (65,3%) recibieron TH durante una media de 5,5 (±2,96) años (grupo TH) mientras que las 17 (34,7%) restantes pertenecen al grupo control que no recibió tratamiento.
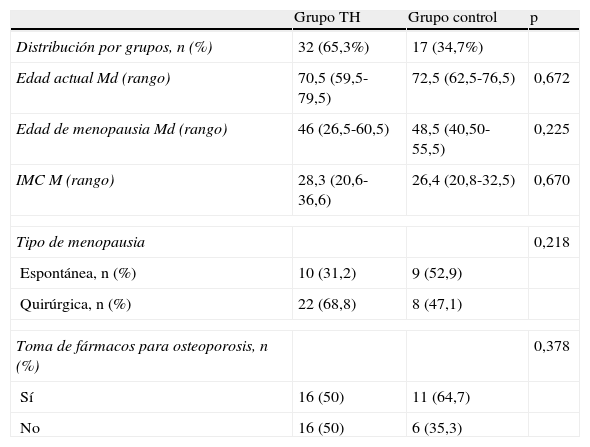
No existen diferencias estadísticamente significativas entre ambos grupos respecto a los datos clínicos y demográficos (tabla 1). Se realizó un análisis multivariante para descartar el efecto de las variables analizadas (edad actual, edad de la menopausia, IMC, tipo de menopausia, fármacos para el tratamiento de la osteoporosis) en el resultado final y ninguna mostró significación estadística.
Datos clínicos y demográficos por grupos
| Grupo TH | Grupo control | p | |
| Distribución por grupos, n (%) | 32 (65,3%) | 17 (34,7%) | |
| Edad actual Md (rango) | 70,5 (59,5-79,5) | 72,5 (62,5-76,5) | 0,672 |
| Edad de menopausia Md (rango) | 46 (26,5-60,5) | 48,5 (40,50-55,5) | 0,225 |
| IMC M (rango) | 28,3 (20,6-36,6) | 26,4 (20,8-32,5) | 0,670 |
| Tipo de menopausia | 0,218 | ||
| Espontánea, n (%) | 10 (31,2) | 9 (52,9) | |
| Quirúrgica, n (%) | 22 (68,8) | 8 (47,1) | |
| Toma de fármacos para osteoporosis, n (%) | 0,378 | ||
| Sí | 16 (50) | 11 (64,7) | |
| No | 16 (50) | 6 (35,3) | |
IMC: índice de masa corporal; M: media; Md: mediana; TH: terapia hormonal.
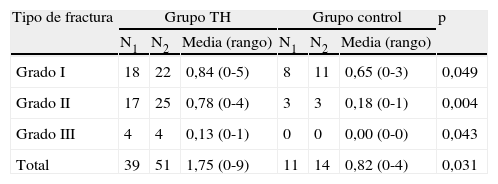
Cuando se analizó el índice de fracturas por grupos, se observó un índice mayor en el grupo que recibió TH, siendo estas diferencias estadísticamente significativas (p=0,03). Posteriormente, se analiza por subgrupos, según el grado de fractura, clasificada mediante el método semicuantitativo de Genant16, observando nuevamente un mayor índice en el grupo que recibió TH, siendo estadísticamente significativo en todos los subgrupos (p<0,05) (tabla 2).
Distribución de fracturas clasificadas según el método semicuantitativo de Genant, distribuidas por grupos14
| Tipo de fractura | Grupo TH | Grupo control | p | ||||
| N1 | N2 | Media (rango) | N1 | N2 | Media (rango) | ||
| Grado I | 18 | 22 | 0,84 (0-5) | 8 | 11 | 0,65 (0-3) | 0,049 |
| Grado II | 17 | 25 | 0,78 (0-4) | 3 | 3 | 0,18 (0-1) | 0,004 |
| Grado III | 4 | 4 | 0,13 (0-1) | 0 | 0 | 0,00 (0-0) | 0,043 |
| Total | 39 | 51 | 1,75 (0-9) | 11 | 14 | 0,82 (0-4) | 0,031 |
Media: media de fracturas por paciente; N1: número de pacientes con fracturas; N2: número total de fracturas.
El principal hallazgo de nuestro estudio es que la TH tras el cese del tratamiento, a largo plazo, no tiene efecto protector sobre la incidencia de fracturas vertebrales. Actualmente, no se recomienda el uso de manera aislada de TH en las principales guías clínicas con el fin exclusivo de prevención de la osteoporosis, ya que otros fármacos antirresortivos han demostrado eficacia, seguridad y tolerabilidad. Sin embargo, la TH está indicada en aquellas mujeres con sintomatología menopáusica persistente y que no toleran otros tratamientos. Los resultados observados en nuestro estudio sugieren la necesidad de administrar tratamientos complementarios para prevenir la osteoporosis en las mujeres que han recibido TH, una vez se ha interrumpido el tratamiento hormonal. A pesar de esto, la TH tiene muchos otros efectos beneficiosos, como se ha descrito en estudios previos5,8,18, por lo que supone un buen tratamiento para el control de la sintomatología menopáusica y la prevención de otros efectos adversos derivados de esta.
Numerosos estudios aleatorizados con relación al efecto de la TH sobre la osteoporosis, incluyendo el estudio WHI y el Postmenopausal Estrogen/Progestin Interventions (PEPI) han establecido que la pérdida de densidad ósea que acontece durante la menopausia se atenúa por el tratamiento estrogénico durante la menopausia temprana, resultando en un menor riesgo de fractura6,19. Por ejemplo, en el estudio publicado por Prince et al.20, se incluyó a 120 mujeres posmenopáusicas con densidad mineral ósea disminuida y fueron asignadas de manera aleatorizada a tratamiento con calcio, placebo o estrógenos. Se concluyó que, pese a que los suplementos de calcio reducen la pérdida ósea comparado con el placebo, los estrógenos fueron más efectivos que estos. Datos semejantes fueron obtenidos también en pacientes de nuestro entorno21.
Por lo que respecta al riesgo de fracturas osteoporóticas durante el tratamiento con TH, el metaanálisis realizado por Torgerson y Bell-Syer22 mostró una reducción significativa en el índice de fracturas no vertebrales y vertebrales en individuos con masa ósea normal, con osteopenia u osteoporosis. Algunas publicaciones anteriores ya habían sugerido un efecto protector de la TH sobre la pérdida de masa ósea y las FV23,24, independientemente del tipo de tratamiento utilizado. Un ejemplo es el estudio de cohortes prospectivo de Banks et al.25 en el que se incluyó a 138.737 mujeres posmenopáusicas. Se demostró que las usuarias de TH sustitutiva tenían un riesgo inferior para cualquier tipo de fractura comparadas con las no usuarias (RR: 0,62; IC 95%; 0,58-0,66). Este efecto protector se vio en diferentes tipos de tratamiento (estrógenos, la combinación de estrógenos y progesterona y diferentes dosis de estrógenos y progesterona), en las diferentes vías de administración (oral y transdérmica) y en diferentes patrones de administración (continua y cíclica).
Sin embargo, cuando nos centramos en los efectos protectores a largo plazo, una vez finalizado el tratamiento, encontramos algunos estudios que sugieren que el efecto protector de la TH se disipa rápidamente tras la interrupción del tratamiento9,10,26. Bea et al.27 incluyeron 2 grupos de pacientes: unas recibieron estrógenos y progestágenos (n=543) y se compararon con controles (n=471) y otras solo recibieron estrógenos (n=453) y se compararon con controles (n=474). Concluyeron que había una mejor preservación de la masa ósea en las pacientes en tratamiento comparadas con el grupo placebo a corto plazo (a los 3 años de estudio), pero no había diferencias entre ambos grupos a los 6 años de seguimiento ni en la masa ósea ni en el índice de fracturas. A pesar de ser un estudio con placebo y con tamaño muestral considerable, se trata de un estudio con menor seguimiento que el realizado en nuestro centro. Otro estudio similar es el publicado por Wu et al.28, que abarca un total de 104 mujeres, divididas en 2 grupos, uno con TH y otro sin tratamiento. Describieron una reducción significativa de FV en el grupo con TH, tras un seguimiento de 10 años, aunque no se trataba de un estudio aleatorizado.
Las limitaciones que podemos encontrar en nuestro estudio vienen como consecuencia del largo seguimiento que se ha realizado, implicando un bajo tamaño muestral. Además, otros factores modificables sutiles pueden pasar desapercibidos y modificar la evaluación de los resultados de los estudios realizados: obesidad, tiempo tras la menopausia, dieta, pérdida urinaria de calcio y concentración de hormonas sexuales, entre otros28.
En conclusión, existen escasos datos en la literatura del papel de la TH en la prevención de fracturas vertebrales a largo plazo. Nuestro estudio muestra que el uso de la TH no mejora la prevención de FV en pacientes menopáusicas a largo plazo, observando incluso un índice mayor, no significativo, de FV en las pacientes que recibieron tratamiento hace una media de 21 años. No obstante, no hay que olvidar los múltiples beneficios que esta terapia puede mostrar en la prevención de otro tipo de complicaciones secundarias a la menopausia.
Responsabilidades éticasProtección de personas y animales. Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.