Los síndromes talasémicos son trastornos hereditarios de la biosíntesis de la globina alfa o la beta. La disponibilidad reducida de globina disminuye la producción de tetrámeros de hemoglobina, lo que da lugar a hipocromía y microcitosis. Se produce una acumulación desequilibrada de subunidades alfa o beta porque las síntesis de las globinas no afectadas continúan a una velocidad normal. La acumulación desequilibrada de cadenas domina el fenotipo clínico. La gravedad clínica varía mucho, dependiendo del grado de trastorno de la síntesis de la globina afectada, de la síntesis alterada de otras cadenas de globina y de la herencia simultánea de otros alelos anormales de la globina. La incidencia de estos síndromes durante el embarazo en todas las razas es de uno en 300 a 500.
Thalassemia syndromes are inherited disorders of alpha- or beta-globin biosynthesis. The reduced availability of globin decreases the production of hemoglobin tetramers, giving rise to hypochromia and microcytosis. There is unbalanced accumulation of alpha or beta subunits because the synthesis of unaffected globins continues at a normal speed. This unbalanced accumulation dominates the clinical phenotype. The clinical severity varies widely, depending on the degree of disorder of the synthesis of the affected globin, the altered synthesis of other globin chains and simultaneous inheritance of other abnormal globin alleles. The incidence of these syndromes during pregnancy in all races is one in 300 to 500.
La disminución de síntesis de cadenas beta (betatalasemias) es más frecuente en el área mediterránea (y, por tanto, en nuestro medio), Oriente Próximo y África, mientras que la disminución de síntesis de cadenas alfa (alfatalasemias) es más frecuente en Asia.
Las talasemias beta son la consecuencia de alteraciones de la producción de cadenas de globina beta o estabilidad alterada de cadenas alfa. Los genes de la cadena beta se localizan en el cromosoma 11. Se han descrito más de 150 mutaciones en el gen que codifica para la globina beta. Casi todas son sustituciones de un solo nucleótido que producen defectos de transcripción o de traducción, empalme o modificación de ARN, o desviaciones de marco que dan por resultado hemoglobinas muy inestables.
En la talasemia beta, hay un decremento de la producción de cadena beta y el exceso de cadenas alfa se precipita para causar daño de la membrana celular, produciendo hemólisis, además de eritropoyesis ineficaz. El dato característico de las talasemias beta es una concentración alta de hemoglobina A2.
Según la gravedad clínica y la forma genética (la herencia es autosómica recesiva), se reconocen principalmente 3 tipos de betatalasemias: talasemia mayor (anemia de Cooley) o talasemia homocigota, talasemia beta intermedia y talasemia minor o rasgo talasémico (heterocigotos simples).
Caso clínicoPrimigesta de 30 años, de nacionalidad española. Grupo sanguíneo: 0+.
Antecedentes familiares: padres afectados de talasemia minor, hermano afectado de talasemia mayor.
Antecedentes personales: alérgica a tiomersal. Diagnosticada de talasemia mayor al año de edad (homocigota para la mutación IVS-I nt-6; 4 genes alfa). Seguida durante las 2 primeras décadas de su vida en el servicio de pediatría en conjunto con los servicios de hematología, cardiología, endocrinología, reumatología, radiología y oftalmología, no presenta ninguna alteración orgánica secundaria a su enfermedad. En régimen transfusional desde su primera infancia, para mantener hemoglobina >9-10g/dl, con sobrecarga férrica secundaria, por lo que ha recibido tratamiento quelante con desferroxamina subcutánea 2,5g/día en bomba de infusión 8-10 h y vitamina C (200mg/día por vía oral).
Antecedentes quirúrgicos: foliculitis vulvar en 2007. El resto, sin interés clínico.
Historia menstrual: menarquia: 12 años. Tipo: 2 d/28 días. FUR: 7 de marzo de 2009.
Antecedentes obstétricos: primigesta.
Antecedentes de la pareja: 34 años, GS: 0+. El resto, sin interés.
La paciente acude por primera vez a consultas de alto riesgo obstétrico, el 23 de abril de 2009, tras conseguir una gestación espontánea; gestante de aproximadamente 7 semanas. La paciente se encuentra asintomática, con un peso de 51,700 kg, talla: 1,55m, PA: 110/70. Se solicitan una analítica, una serología y una ecografía de primer trimestre y desde este momento es seguida junto con el servicio de hematología.
La paciente desea realizar cribado, que resulta de riesgo bajo. En la analítica del primer trimestre se objetiva una hemoglobina de 8,8g/dl y hematocrito del 26%, por lo que la paciente recibe transfusión de 2 concentrados de hematíes. La serología primer trimestre, negativa. Sigue tratamiento con ácido fólico y calcio.
En los sucesivos controles la paciente va ganando peso y, junto con el servicio de hematología, se decide someter a la paciente a transfusiones quincenales. La paciente, previo al embarazo, había seguido tratamiento con soporte transfusional de 2-3 CH cada 3-4 semanas y quelación de hierro con deferasirox (Exjade) desde marzo del año 2006, que suspendió en abril por la gestación.
En la ecografía del segundo trimestre se observa un feto único en cefálica, con desarrollo correcto, LA normal, sexo mujer y sin alteraciones estructurales fetales. Test de O¿Sullivan: 74mg/dl/86mg/dl.
En la ecografía del tercer trimestre se objetiva un feto único en podálica, con DBP: 78mm, CA: 260mm, LF: 56mm, placenta de borde izquierdo, LA normal, no abundante, PFE: 1.540g, IRU: 0,67, IRACM: 0,77 y arterias uterinas sin Notch postsistólico, por lo que se diagnostica de feto pequeño para la edad gestacional, pautando control en 2 semanas y valoración del crecimiento fetal.
En este último control se objetiva un feto único vivo y móvil, en podálica, DBP: 8,4cm, CA: 28,3cm, LF: 6cm, PFE: 1.950 g, IRU: 0,59 e IRACM: 0,73.
A partir de las 36 semanas de edad gestacional la paciente es controlada en consultas de FPF, presentando MFNE reactivos, con AT, no DIPS, V II. Adinamia. EF: cérvix posterior, formado y cerrado. Junto con el servicio de hematología se decide programar cesárea a las 38 semanas por presentación podálica el 3 de diciembre de 2009.
La última transfusión precesárea la recibió el día 17 de noviembre de 2009, con 9,8g/dl de Hb, por lo que hematología recomendó la siguiente transfusión sobre el día 8 de diciembre de 2009, aconsejando realizar hemograma antes de la cesárea para valorar transfusión.
El 3 de diciembre de 2009 a las 11:30h se obtuvo una recién nacida viva mujer, de 2.400 g y Apgar: 9/10, tras realizarse una cesárea que cursó sin incidencias.
Tras 4 días de evolución puerperal normal, con mejoría de los parámetros clínicos y analíticos, se decidió el alta hospitalaria.
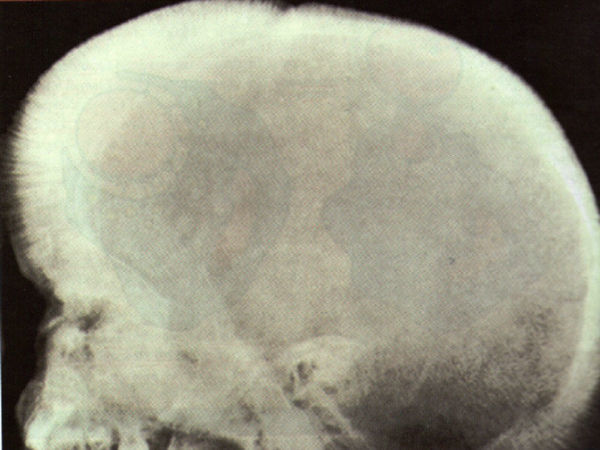
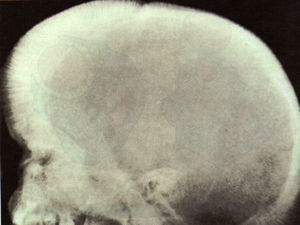
DiscusiónLa gran disminución de síntesis de la cadena beta ocasiona un descenso importante de síntesis de hemoglobina A1, con un aumento de la formación de hemoglobina A2 y hemoglobina F. La grave anemia ocasiona un aumento de eritropoyetina, que a su vez da lugar a una enorme hiperplasia de médula ósea, originando malformaciones óseas en el niño, como seudoquistes en manos y pies, y deformidad de cráneo, como cráneo en cepillo (fig. 1), alteración de la neumatización de los senos y mala colocación dentaria.
La disminución de la cadena beta origina un aumento de la hemoglobina fetal, que tiene mayor afinidad por el oxígeno, por lo que se produce una cesión defectuosa de oxígeno hacia los tejidos, provocando hipoxia tisular crónica, que incrementa la formación de eritropoyetina, produciendo más hiperplasia medular y un aumento en la absorción de hierro, con la consiguiente hemosiderosis secundaria.
Aparte de la anemia hemolítica, los pacientes presentan organomegalias (hepatoesplenomegalia). A consecuencia de la hemosiderosis, se producen anomalías en el funcionamiento del hígado, las glándulas endocrinas y, sobre todo, el corazón, causante del mal pronóstico de la enfermedad y la mortalidad de los niños.
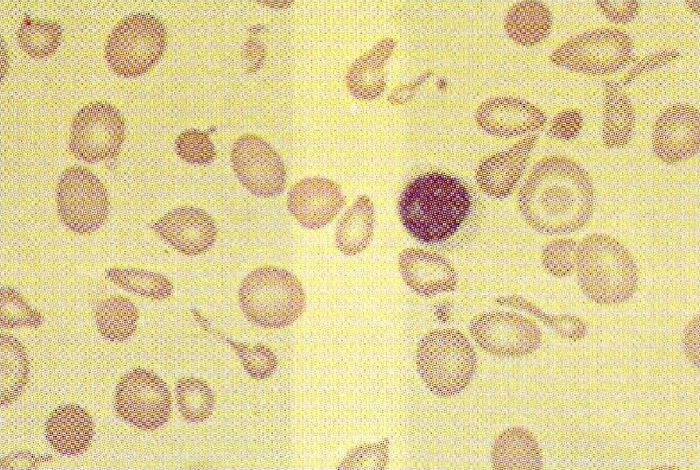
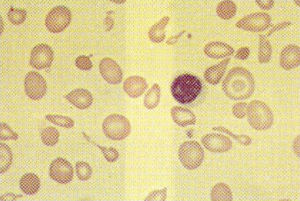
El diagnóstico se ha de sospechar en un enfermo con hemólisis congénita severa, microcitosis e hipocromía (fig. 2). La hemoglobina puede estar en cifras de 5g/dl, la bilirrubina sérica se encuentra elevada, la transferrina está saturada y la concentración sérica de hierro es alta. En la orina hay compuestos pirrólicos que le confieren un color pardo oscuro. Se confirma con electroforesis de hemoglobina, objetivándose descenso de hemoglobina A1 e incremento de hemoglobina A2 y hemoglobina F. El diagnóstico prenatal de talasemia beta, al usar muestreo de vellosidades coriónicas, puede llevarse a cabo de las 9 a las 13 semanas1. Este análisis puede resultar difícil y no siempre es exitoso. Las técnicas incluyen una combinación de análisis de endonucleasa de restricción específica para sitio, análisis de enlace de polimorfismo de fragmento de restricción, reacción en cadena de la polimerasa, y sondas de oligonucleótido. Además se han descrito la biopsia de blastómera antes de la implantación2-4, y la tipificación de antígeno leucocítico humano fetal5.
Ha de tenerse en cuenta que las alteraciones clínicas no aparecen en el recién nacido, sino a los 6-8 meses de vida, cuando presenta anemia grave y no muestra crecimiento del desarrollo, ya que es cuando la hemoglobina F tiene que ser suplida por la hemoglobina A1 del adulto, pero el déficit de cadenas beta impide su sustitución.
El tratamiento de elección, cuando sea posible, debe ser el trasplante alogénico de precursores hematopoyéticos, ya que es una enfermedad genética.
Si no se puede realizar trasplante, la esplenectomía mejora la sintomatología de la enfermedad.
Debido a la gravedad de la anemia, se aconseja realizar transfusiones sanguíneas. Las transfusiones evitan las malformaciones óseas, al disminuir el estímulo de la hiperplasia medular por la eritropoyetina. Deben administrarse con quelante del hierro, como la desferroxamina, para evitar la sobrecarga de hierro, comprobándose que el pronóstico mejora6,7. Un niño que ingresa en un programa de transfusión adecuado se desarrolla normalmente hasta el final del primer decenio, cuando quedan de manifiesto los efectos de la carga de hierro. Una mujer que sobrevive más allá de la niñez por lo general es estéril y la esperanza de vida incluso con transfusión está acortada. Antes de la estandarización de la quelación de hierro y de las transfusiones, el embarazo en mujeres con talasemia grave era raro. Aessopos8, Daskalakis9 y Kumar10, y sus respectivos colaboradores, informaron un total de 63 embarazos sin complicaciones graves. Todos estos investigadores recalcaron la necesidad de vigilancia intensiva y la exclusión de mujeres con miocardiopatía subyacente.
No hay fármacos que aumenten la formación de la cadena beta, pero se ha observado que los hematíes en los que existe mayor cantidad de hemoglobina fetal presentan una vida media más prolongada y la anemia mejora. Fármacos que incrementen la síntesis de cadenas gamma (y, por tanto, la hemoglobina fetal) son el butirato, la 5-azacitidina y la hidroxiurea11.
La expansión masiva de la médula ósea altera el crecimiento y el desarrollo. Los niños presentan facies característica de ardilla por hiperplasia de la médula ósea maxilar y abombamiento frontal, adelgazamiento y fracturas patológicas de los huesos largos y las vértebras por invasión cortical de elementos eritroides, y un profundo retraso del crecimiento.
La anemia hemolítica provoca hepatoesplenomegalia, úlceras en las piernas, cálculos biliares e insuficiencia cardiaca de gasto alto.
El consumo de recursos calóricos para el soporte de la eritropoyesis lleva a la inanición, la propensión a infecciones, la disfunción endocrina y en los casos más graves a la muerte en el transcurso del primer decenio de la vida.
Las transfusiones mejoran el suministro de oxígeno, inhibiendo la eritropoyesis ineficaz, y prolongan la vida, pero los efectos secundarios inevitables, en especial la sobrecarga de hierro, suelen revelarse mortales hacia los 30 años.
El único tratamiento curativo es el trasplante de médula ósea en la niñez. La esplenectomía se podría realizar cuando las necesidades anuales de transfusión aumentaran más del 50%.
Pueden resultar útiles los suplementos de ácido fólico.
Se recomienda la vacunación frente al neumococo, meningococo y virus de la hepatitis B, para anticipar una posible esplenectomía, al igual que una vigilancia estrecha de las infecciones, las úlceras en las piernas y la patología de la vía biliar12. Es necesaria una valoración endocrinológica temprana, buscando intolerancia a la glucosa, disfunción tiroidea y retraso puberal o de los caracteres sexuales secundarios. Muchos pacientes presentan carencias endocrinas como consecuencia de la sobrecarga de hierro.
PrevenciónEn la actualidad, se dispone en muchos lugares de un diagnóstico prenatal de los síndromes talasémicos. El diagnóstico del ADN se basa en la amplificación por PCR del ADN fetal, obtenido mediante amniocentesis o biopsia de las vellosidades coriónicas, seguido de hibridación con sondas de oligonucleótidos específicas de alelo. Las sondas se pueden diseñar para detectar de manera simultánea el conjunto de mutaciones que explican del 95 al 99% de las alfatalasemias o betatalasemias que se dan en un determinado grupo étnico.
De confirmarse la alteración homocigota, podría ser una enfermedad tratable in utero, provocando quimeras hematopoyéticas alogénicas en el periodo preinmunitario con stem cells que enraícen cepas hematopoyéticas normales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.