Ginecología
Estudio de la expresión del antígeno epitelial de membrana (EMA) como factor pronóstico del adenocarcinoma de endometrio
Study of epithelial membrane antigen expression as a prognostic factor in adenocarcinoma of the endometrium
M. Frasero
P. J. Coronado
J. A. Vidart
J. Puerta1
I. Cristóbal
M. A. Herraiz
M. Escudero
Departamento de Obstetricia y Ginecología
Hospital Clínico «San Carlos». Madrid
1 Departamento de Ciencias Morfológicas I. Facultad de Medicina. Universidad Complutense de Madrid
Correspondencia:
María Fasero Laiz
Dpto. de Obstetricia y Ginecología
Hospital Clínico «San Carlos»
Martín Lagos, s/n
28040 Madrid
Fecha de recepción: 8/2/99
Aceptado para publicación: 9/9/99
RESUMEN
Objetivo: Analizar la importancia pronóstica de la expresión del antígeno epitelial de membrana (EMA) en el adenocarcinoma de endometrio.
Material y métodos: Se estudiaron 93 pacientes con adenocarcinoma de endometrio. La expresión de EMA se realizó mediante técnicas inmunohistoquímicas en tejidos incluidos en parafina. Todos los carcinomas se estadificaron según los criterios de la FIGO. Se consideró sobreexpresión de EMA cuando existía inmunotinción en más del 66% de las células del total del tumor visualizado.
Resultados: La sobreexpresión del EMA se encontró en el 58,1% de los adenocarcinomas de endometrio. No se encontró asociación entre dicha sobreexpresión y el estadío de la FIGO, el tipo histológico, el grado de diferenciación, la invasión miometrial, la citología del lavado peritoneal, la afectación ganglionar y la extensión de la enfermedad fuera del cuerpo uterino. La sobreexpresión del EMA fue un factor predictivo independiente de menor supervivencia libre de enfermedad en el análisis multivariante.
Conclusiones: La sobreexpresión de EMA es un factor pronóstico independiente del adenocarcinoma de endometrio.
PALABRAS CLAVE
Antígeno epitelial de membrana; Inmunohistoquímica; Adenocarcinoma de endometrio; Marcadores tumorales.
SUMMARY
Objetive: To analyze the prognostic signification of epithelial membrane antigen (EMA) overexpression in the endometrial adenocarcinoma.
Material and methods: We studied 93 patients with endometrial adenocarcinoma. EMA inmunostaining was performed in paraffin-embedded specimens. All carcinomas were classified according to FIGO staging system. EMA overexpression was considered when more than 66% of the epithelial cells were stained.
Results: EMA overexpression was observed in the 58.1%. Association between EMA overexpression and classical prognostic factors of endometrial carcinoma was not found. EMA overexpression was an independent predictor of recurrence.
Conclusions: EMA overexpression was an independent prognostic factor of recurrence.
KEY WORDS
Epithelial membrane antigen; Immunohistochemical; Endometrial carcinoma; Tumoral markers.
INTRODUCCIÓN
El antígeno epitelial de membrana (EMA: Epithelial Membrane Antigen) se localiza en el glicocáliz de la célula y se corresponde con glicoproteínas de alto peso molecular (265-400 KD)(1).
Se ha observado que la tinción del EMA es heterogénea de célula a célula, lo que parece reflejar diferentes estadíos de la expresión del marcador en las células tumorales(2,3). Estudios inmunohistoquímicos en el adenocarcinoma endometrial han demostrado que la expresión de EMA es negativa o débil en endometrios normales y se hace más intensa cuando la célula endometrial se convierte en neoplásica(4,5). Esto se ha observado incluso en la misma muestra, en donde se evidencia una alta expresión en la zona tumoral y negativa en el endometrio no tumoral adyacente(4). Estos hallazgos han hecho pensar que el EMA parece ser útil como un marcador de diferenciación de los adenocarcinomas de endometrio; aunque puede expresarse también en el endometrio no tumoral, lo que hace que sea a priori un marcador poco selectivo de la célula cancerosa(6,7).
Se presenta un estudio que tiene como objetivo valorar el significado pronóstico de la expresión del EMA en el adenocarcinoma de endometrio y su relación con los factores pronóstico clásicos para dicho carcinoma.
MATERIAL Y MÉTODOS
Se realizó un estudio retrospectivo de 93 pacientes diagnosticadas de carcinoma de endometrio entre los años 1990-1996 en el Hospital Clínico «San Carlos». Todas las pacientes fueron sometidas a una histerectomía total con doble anexectomía y linfadenectomía pélvica selectiva. Previamente a la histerectomía se realizó un lavado peritoneal para el diagnóstico citológico de células malignas.
No se incluyeron en el estudio los carcinomas no epiteliales de útero, como son el caso de los tumores mesodermales mixtos y los sarcomas uterinos, así como los carcinomas secundarios de endometrio.
Ninguna paciente recibió tratamiento radioterápico ni quimioterápico preoperatorio. Se asoció tratamiento radioterápico (radioterapia externa en 20-25 ciclos con una dosis de 4.500 cGy con bomba de cobalto o fotones de 18 Mv y braquiterapia mediante colpostatos de Flechert cargados con Cs 137 hasta una dosis total de 6.000 cGy) a las pacientes con invasión miometrial y/o un grado de diferenciación moderado o escaso (G2-G3). Al resto de las pacientes, es decir, a aquellas en las que no presentaban invasión miometrial y tenían un carcinoma bien diferenciado (Ia G1), se les aplicó un tratamiento con acetato de megestrol con una dosis de 160 mg/día.
Los carcinomas fueron estadificados de acuerdo con los criterios establecidos por la FIGO.
Las muestras destinadas al estudio histopatológico e inmunohistoquímico fueron fijadas en formol tamponado al 10% inmediatamente después de su extracción. Estas muestras fueron seleccionadas por el propio patólogo que recogió las áreas más representativas de las lesiones. Tras la fijación las muestras se incluyeron en bloques de parafina y fueron cortadas entre cinco y siete micras. El estudio histopatológico se realizó por dos patólogos de forma independiente. Se analizó en cada muestra el tipo histológico del tumor, el grado de diferenciación, la invasión miometrial, la afectación de los ganglios obtenidos y la citología del líquido peritoneal.
Se hizo un seguimiento a todas las pacientes mínimo de un año. A dichas pacientes se les realizó una revisión cada tres meses durante el primer año y cada seis meses una vez pasado éste. Los controles incluían la realización de una analítica completa de sangre con estudio de marcadores tumorales, una radiografía de tórax, una ecografía abdómino-pélvica, una tomografía axial computerizada abdómino-pélvica y una citología vaginal.
Como anticuerpo primario se empleó un anticuerpo monoclonal antiEMA de la casa DAKO. Dicho anticuerpo es una inmunoglobulina obtenida contra proteínas de membrana de las células grasas de la leche humana que se obtiene en el ratón. La dilución empleada fue en TBS al 1/20. La técnica empleada para la marcación fue la de la avidina-biotina-peroxidasa.
La valoración de la tinción se realizó calculando el porcentaje de células marcadas respecto del total del tumor visualizado. Se consideró la tinción del ribete luminal para el estudio inmunohistoquímico y se interpretó como alta expresión o sobreexpresión del EMA cuando dicha tinción se vio en más del 66% de las células epiteliales.
Los cálculos matemáticos fueron realizados con el programa estadístico SPSS para Windows versión 8.0 con la colaboración de la Unidad Clínico-Epidemiológica del Hospital Clínico «San Carlos».
La relación entre la alta expresión del EMA con las variables pronóstico para el carcinoma de endometrio se midió mediante el test de la *2 o el exacto Fisher a dos colas si no se podía aplicar el primero. Se rechazó la hipótesis nula con un error a < 0,05. Se calcularon las curvas de Kaplan-Meier en el análisis de la supervivencia global y libre de enfermedad para los eventos muerte y recidiva tumoral, respectivamente. La comparación de las funciones de supervivencia de los distintos subgrupos se realizó mediante el test de Breslow. El análisis multivariante se realizó según el método de los riesgos proporcionales de Cox con el método de inclusión hacia atrás (backward), incluyendo las variables que obtuvieron una p < 0,05 en el análisis univariado y con una p de salida > 0,10. Se presentan los riesgos relativos (RR) con sus intervalos de confianza al 95% (IC95%). Con dicho método se calcularon las variables independientes predictivas de muerte y recidiva tumoral.
RESULTADOS
La edad media de las pacientes fue de 64,9 años (rango: 37-81 años). De las 93 pacientes estudiadas 12 presentaron recidiva de la enfermedad y 13 murieron. La mediana de seguimiento fue de 30 meses (rango intercuartílico: 18-58 meses).
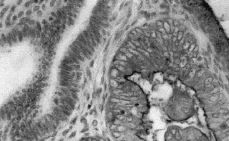
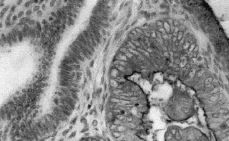
La inmunotinción del EMA se evidenció en el ribete luminal de las células epiteliales glandulares y en los productos de secreción encontrados en la luz. No se evidenció tinción del EMA en el miometrio ni en el estroma (Fig. 1). Se vio sobreexpresión del EMA en el 58,1% (54 casos) de los tumores estudiados.
Figura 1. Sobreexpresión de EMA en el adenocarcinoma endometrial. Se observa como la sobreexpresión del EMA aparece en el endometrio neoplásico (ribete luminal) y es negativa en el endometrio no tumoral adyacente.
Se relacionó la sobreexpresión del EMA con los distintos factores pronóstico clásicos para el adenocarcinoma de endometrio para evaluar la posible asociación entre la expresión del antígeno y dichos factores (tabla 1). La sobreexpresión del EMA fue mayor en los estadíos tardíos (64,7%) que en los precoces (56,6%), aunque estas diferencias no fueron estadísticamente significativas. La sobreexpresión del EMA fue del 53,4% en el tipo histológico endometrioide, del 83,3% en el tipo células claras, en el 50% en el adenoescamoso y del 75% en el seroso-papilar. La sobreexpresión del antígeno EMA fue más frecuente en los tipos histológicos más agresivos como son el seroso-papilar y el de células claras, aunque estas diferencias no fueron estadísticamente significativas (p = 0,224). Cuando se comparó la expresión en los tumores no endometroides frente a los endometroides se objetivó una mayor expresión del antígeno en los no endometroides (75% frente al 53,4%), aunque estas diferencias tampoco fueron estadísticamente significativas (p = 0,068). Similares resultados se obtuvieron cuando se comparó el tipo histológico células claras frente a los que no lo eran (83,3% frente a 54,3%; p = 0.052). La sobreexpresión del EMA fue mayor en los tumores peor diferenciados, encontrándose en el 54.8% de los tumores bien diferenciados, en el 56,6% de los moderadamente diferenciados y en el 77,8% de los pobremente diferenciados. Sin embargo, las diferencias encontradas no fueron estadísticamente significativas (p = 0,446). La sobreexpresión del EMA fue mayor en aquellos tumores que presentaban mayor invasión miometrial. Se observó en el 50,9% de los casos cuando la invasión era menor al 50% y en el 67,5% cuando la invasión era mayor del 50% del espesor. Las diferencias encontradas no fueron estadísticamente significativas (p = 0,082). Los casos con citología del lavado peritoneal positiva presentaron mayor sobreexpresión del EMA (80%) que cuando dicha citología fue negativa (55,4%). Las diferencias observadas no fueron estadísticamente significativas (p = 0,124). La sobreexpresión del EMA fue porcentualmente mayor en los casos con extensión de la enfermedad a cadenas linfoganglionares (57,1%) que cuando no se encontraron ganglios afectos (54,3%), pero las diferencias encontradas no fueron estadísticamente significativas (p = 0,6030). Se observó que en aquellos casos en los que existía extensión fuera del cuerpo uterino (afectación del cérvix, de trompas, ovarios, vagina, recto, vejiga, ganglios pélvicos, presencia de células malignas en la cavidad peritoneal y metástasis a distancia) la expresión del EMA fue mayor, ya que se presentó sobreexpresión en el 60,9% de los casos, mientras que cuando no existió extensión fuera del cuerpo uterino la expresión fue del 57,1%. Dichas diferencias no fueron estadísticamente significativas (p = 0,4750).
Tabla 1 Relación entre la alta expresión del EMA y los factores pronósticos en el adenocarcinoma de endometrio | |||
| N = 93 casos | Alta expresión EMA(%) | P | |
| Global | 58,1 | ||
| Estadío FIGO | |||
| I/II (precoces) | 56,6 | ||
| III/IV (avanzados) | 64,7 | 0,597 | |
| Histología | |||
| Endometrioides | 53,4 | ||
| Células claras | 83,3 | ||
| Seroso-papilar | 75 | ||
| Adenoescamoso | 50 | 0,224 | |
| Invasión miometrial | |||
| < 50% | 50,9 | ||
| > 50% | 67,5 | 0,082 | |
| Grado de diferenciación | |||
| G1 | 54,8 | ||
| G2 | 56,6 | ||
| G3 | 77,8 | 0,446 | |
| Lavado peritoneal | |||
| Positivo | 80 | ||
| Negativo | 55,4 | 0,124 | |
| Ganglios (N = 77) | |||
| Positivos | 57,1 | ||
| Negativos | 54,3 | 0,603 | |
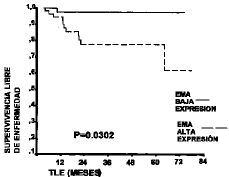
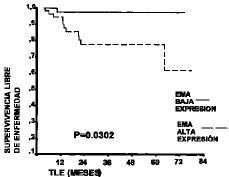
De las 12 pacientes que recidivaron, en 11 (91,7%) existió sobreexpresión de EMA. La supervivencia libre de enfermedad a los cinco años fue del 62% en los casos que presentaron sobreexpresión de EMA y del 97,3% en los que no la tuvieron. Se apreció como la supervivencia libre de enfermedad era significativamente menor (p = 0,0302) en los casos con sobreexpresión de EMA (Fig. 2). Esta menor supervivencia se apreció tanto en estadíos tardíos como precoces. Los casos en estadío precoz (I y II de la FIGO) tuvieron una supervivencia del 85,1% a los cinco años cuando presentaban sobreexpresión del EMA, frente al 100% cuando no existía. De igual manera, en los tumores en estadío avanzado (III y IV de la FIGO) los casos con sobreexpresión de EMA tuvieron una supervivencia a los cinco años menor (0%) que los que no la tenían (83,3%).
Figura 2. Curva de Kaplan-Meier de la supervivencia libre de enfermedad en 93 mujeres con adenocarcinoma de endometrio según la expresión de EMA.
Las variables que se asociaron significativamente con una menor supervivencia libre de enfermedad en el estudio univariado, además de la sobreexpresión del EMA, fueron el estadío avanzado (III-IV de la FIGO), el tipo histológico no endometrioide, los tumores pobremente diferenciados (G3) y la invasión miometrial profunda (tabla 2).
Tabla 2 Estudio univariante para la supervivencia libre de enfermedad de las variables pronóstico en el adenocarcinoma de endometrio | |||||
| Categorías | Porcentaje de supervivencia libre de enfermedad a los cinco años | p | |||
| EMA | Alta expresión | 62,01% | |||
| Baja expresión | 97,37% | 0,0302 | |||
| Vimentina | Baja expresión | 54,90% | |||
| Alta expresión | 87,72% | 0,4734 | |||
| Estadío | III-VI (tardíos) | 39,72% | |||
| I-II (precoces) | 91,11% | 0,0001 | |||
| Tipo histológico endometrioide | Sí | 82,22% | |||
| No | 54,90% | 0,0006 | |||
| Grado de diferenciación | G1 | 96,77% | |||
| G2 | 70,17% | ||||
| G3 | 58,33% | 0,0146 | |||
| Invasión miometrial | >= 50% | 61,49% | |||
| < 50% | 90,29% | 0,062 | |||
| Ganglios | Positivos | 38,10% | |||
| Negativos | 92,46% | 0,0009 | |||
| Lavado peritoneal | Positivo | 54,86% | |||
| Negativo | 79,18% | 0,0001 | |||
| Enf. fuera del cuerpo uterino | Sí | 45,31% | |||
| No | 90,54% | 0,0019 | |||
Al realizar el modelo multivariante de Cox se incluyeron las variables: sobreexpresión de EMA, estadío, grado de diferenciación, invasión miometrial y tipo histológico. No se incluyeron las variables afectación ganglionar, el lavado peritoneal y la enfermedad fuera del cuerpo uterino por estar éstas incluidas dentro del estadío. Tras el estudio multivariado se apreció que los factores predictivos independientes de menor supervivencia libre de enfermedad fueron el grado de diferenciación (RR: 5,40), el estadío avanzado (RR: 8,89) y la sobreexpresión EMA (RR: 14,26) (tabla 3).
Tabla 3 Estudio multivariante para la supervivencia libre de enfermedad de las variables pronóstico en 93 pacientes con adenocarcinoma de endometrio | ||||
| Categoría | RR (ajustado) | IC 95% | p | |
| EMA | Alta expresión | |||
| Baja expresión | 14,26 | 1,58-128,62 | 0,0178 | |
| Grado de diferenciación | G3 | |||
| G1-G2 | 5,40 | 1,29-22,66 | 0,0210 | |
| Estadío | III-IV (tardíos) | |||
| I-II (precoces) | 8,89 | 2,6-29,99 | 0,0004 | |
Cuando se realizó el estudio univariante para la supervivencia global, evaluando el evento muerte, la sobreexpresión de EMA no se asoció a una menor supervivencia (tabla 4).
Tabla 4 Estudio univariante para la supervivencia global de la expresión de EMA | |||
| Categorías | Porcentaje de supervivencia global | p | |
| EMA | Alta expresión | 74,23% | |
| Baja expresión | 86,52% | 0,3853 | |
DISCUSIÓN
El EMA se expresa mediante técnicas inmunohistoquímicas en el endometrio neoplásico, hiperplásico y normal en diferentes grados y de manera heterogénea. Distintos autores también han encontrado dicho tipo de expresión(8-14). La tinción que se obtiene de la marcación inmunohistoquímica con el anticuerpo anti-EMA suele ser tener una distribución en la membrana apical que acentúa la circuferencia luminal, con un mayor o menor grado de tinción citoplasmática. La secreción glandular también suele ser positiva para dicho marcador.
En este estudio se encontró sobreexpresión de EMA en el 58,1% los adenocarcinomas de endometrio, menor que en otro previamente publicado(10), que encuentra una expresión del 95%. Estas diferencias pueden ser debidas a que estos autores consideran cualquier expresión del antígeno (> 5% de las células) y no la sobreexpresión (> 66%).
Respecto a la localización de la tinción del EMA, Morse y Curran(5) la encuentran solamente en las glándulas endometriales, no encontrándola en el estroma, el músculo y los vasos, al igual que en esta serie. Otro de los hallazgos encontrados por Nakopoulou et al(10) que se pudo observar, es que hay un cambio de patrón de tinción en el endometrio normal adyacente a las áreas de carcinoma de endometrio. Estos autores observaron que en el endometrio normal próximo al carcinoma la expresión de EMA aumentaba, presentando un patrón de tinción similar al de la neoplasia. Este nuevo patrón que presenta el endometrio normal es una tinción de todo el epitelio, en contra de la tinción en la zona basal que aparece en un endometrio normal aislado. Estos hechos hacen pensar que puede aparecer un cambio antigénico previo al cambio morfológico de la célula neoplásica, siendo este cambio antigénico detectable utilizando el EMA.
En este estudio se relacionó la expresión de EMA con los factores pronósticos clásicos del adenocarcinoma de endometrio. A este respecto solamente existen referencias bibliográficas sobre factores pronósticos aislados(5,10). Nosotros no encontramos relación entre la sobreexpresión de EMA y el estadío tumoral, el tipo histológico, el grado de invasión miometrial, el grado de diferenciación, la presencia de enfermedad fuera del cuerpo uterino, la citología del lavado peritoneal o la presencia de infiltrado tumoral en los ganglios linfáticos. Porcentualmente la alta expresión de EMA fue mayor en los estadíos tardíos, en los tumores no endometroides, cuando la invasión era mayor del 50%, cuando el grado de diferenciación era G3, cuando había presencia de enfermedad fuera del cuerpo uterino, cuando la citología del lavado peritoneal era positiva y cuando los ganglios linfáticos tenían infiltración tumoral; sin embargo, no alcanzaron la significación estadística. Todo esto hace pensar que el EMA puede implicar una mayor agresividad del tumor, puesto que aparece sobreexpresado en los tumores con características más agresivas. Nakopoulou et al(10) solamente estudian el grado de diferenciación tumoral y el estadío de la FIGO y, como en nuestro estudio, tampoco encuentran relación entre estos factores pronóstico y la expresión de EMA. Sin embargo y contrariamente a lo anterior, Morse y Curran(5) encuentran que los tumores bien diferenciados tienen mayor expresión de EMA que los pobremente diferenciados. Estas discrepancias pueden ser debidas a que el tamaño muestral del estudio citado era muy pequeño, puesto que establece la conclusión con solamente nueve adenocarcinomas de endometrio en su serie. Este autor se apoya en otro estudio más amplio realizado por Sloane y Omerod(6) sobre el cáncer de mama, en el que encuentran que la expresión de EMA es significativamente mayor en los tumores bien diferenciados.
Otro de nuestros objetivos del estudio fue valorar si la sobreexpresión de EMA se comportaba como factor pronóstico. Sobre este aspecto encontramos que de las 12 pacientes que recidivaron, en 11 de ellas (91,7%) existía sobreexpresión de EMA y que la supervivencia libre de enfermedad a los cinco años era significativamente menor en los casos que con sobreexpresión del marcador. Esta menor supervivencia se apreció tanto en estadíos precoces como tardíos. Además, apoyando estos resultados en el estudio multivariante, encontramos que la sobreexpresión de EMA era un factor predictivo independiente de menor supervivencia libre de enfermedad. Según estos hallazgos se puede concluir que la recidiva de la enfermedad se relaciona con la sobreexpresión de EMA independientemente de las características histológicas del tumor. Estos hallazgos permitirían detectar antes la recidiva de la enfermedad y realizar tratamientos más agresivos en estadíos precoces con sobreexpresión de este marcador que nos ayuden a evitar una recidiva.
En resumen a pesar de la gran cantidad de factores pronóstico clásicos que se estudian en el adenocarcinoma de endometrio, las pacientes portadoras de este tipo de tumores continúan recicivando y muriendo de la enfermedad, por lo que la búsqueda de otros tipos de marcadores que ayuden a conocer el pronóstico de estas pacientes resulta interesante. En este estudio el antígeno epitelial de membrana se ha revelado como factor predictor independiente de recidiva de la enfermedad.
AGRADECIMIENTOS
Este estudio ha sido financiado por el Fondo de Investigaciones Sanitarias (FIS n.º 95/0415 y BAE n.º 97/5415).
BIBLIOGRAFIA
01 Ormerod MG, Steele K, Westwood JH, Mazzini MN. Epithelial membrane antigen: Partial purification assay and properties. Br J Cancer 1983;48:533-41.
02 Burchiel SW, Martín JC, Imai K, Ferrone S, Warner NL. Heterogenity of HLA-A,B,Ia-like and melanoma associated antigen expression by human melanoma cell lines analysed with monoclonal antibodies and flow-cytometry. Cancer Res 1982;42: 4110.
03 Kufe DW, Nadler L, Sargent L. Biological behavior of human breast carcinoma associated antigens expressed during cell proliferation. Cancer Res 1983;43:851-54.
04 Castro Sanchez M. Análisis inmunohistoquímico del desarrollo evolutivo del tracto genital femenino y su aplicación en el estudio de tumores epiteliales ováricos. [Tesis doctoral] Madrid: Facultad de Medicina; 1991.
05 Morse AR, Curran GJ. Distrubution of epithelial membrane antigen in normal and abnormal endometrial tissue. Brit J Obstet Gynecol 1985;92:1286-90.
06 Sloane JP, Omerod MG. Distribution of epithelial membrane antigen in normal, neoplastic tissues and its value in diagnostic tumor pathology. Cancer 1981;47:1786-91.
07 Pinkus GS, Kurtin PJ. Epithelial membrane antigen. A diagnostic discriminant in surgical pathology. Hum Pathol 1985;16: 929-33.
08 Moll R, Levy R, Czerbobilsky B, et al. Cytoqueratins of normal epithelia and some neoplasm of the female genital tract. Lab Invest 1983; 49: 599-603.
09 Dabbs DJ, Geisinger KR, Norris HT. Intermediate filaments in endometrial and endocervical carcinomas. The diagnostic utility of vimentin patterns. Am J Surg Pathol, 1986;10:568-76.
10 Nakopoulou L, Minaretzis D, Tsionou Ch, Mastrominas M. Value of inmunohistochemical demostration of several epithelial markers in hyperplastic and neoplastic endometrium. Gynecol Oncol 1990;37:346-53.
11 Dabbs DJ, Sturz K, Zaino RJ. The inmunohistochemical discrimination of endometrioid adenocarcinomas. Hum Pathol 1996;27:172-7.
12 Ferency A. The ultrastructural pathology of the uterus. En Biology of the uterus (Wynn RM, Ed.) Plenum; New York; 1977: 585-93.
13 Ormerod MG, Steele K, Westwood JH, Mazzini MN. Epithelial membrane antigen: Partial purification assay and properties. Br J Cancer 1983;48:533-41.
14 Coronado PJ, Vidart JA, Puerta J, Martín JC, Rodríguez R, Furio-Bacete V, Pelayo A, Cristóbal I, Herraiz MA, Escudero M. Expresión del antígeno epitelial de membrana y de la vimentina en el adenocarcinoma de endometrio. Prog Obstet Ginecol 1998;41:409-15.