Evaluar el potencial impacto epidemiológico, sanitario y económico de la introducción de una vacuna tetravalente en la carga de enfermedades asociadas a los tipos de virus del papiloma humano (VPH) 6, 11, 16 y 18 en España.
MétodosSe ha realizado una simulación a partir de un modelo matemático dinámico desarrollado para el Reino Unido, utilizando datos epidemiológicos y económicos específicos para España obtenidos de la literatura científica, de bases de datos y de estudios epidemiológicos previos. Se ha asumido que cualquier estrategia de vacunación se implementaría en combinación con los actuales programas de cribado y tratamiento de la enfermedad por el VPH. Se ha analizado la estrategia de vacunación sistemática de una cohorte de niñas de 11 años de edad, sola o en combinación con una vacunación no sistemática de adolescentes y mujeres de 12 a 24 años.
ResultadosA largo plazo, la vacunación reduciría un 86, un 85, un 79 y un 81% los casos de cancer de cuello de útero, las lesiones precancerosas CIN (neoplasia intraepitelial cervical) II/III, CIN I y las verrugas genitales asociados al VPH 6, 11, 16 y 18%, respectivamente. Globalmente, la vacunación disminuiría un 83,5% los costes totales asociados a las enfermedades por el VPH 6, 11, 16 y 18 a largo plazo. La vacunación no sistemática en mujeres de 12 a 24 años de edad sería la causa del 77% de los costes evitados en los primeros 10 años del programa de vacunación. A corto plazo, la mayoría de los casos y los costes evitados serían atribuibles a la prevención de los casos de lesiones asociadas a la infección por el VPH 6 y 11.
ConclusionesLa introducción de una vacuna tetravalente frente al VPH, en combinación con los actuales programas de cribado, reduciría significativamente el número de casos de cáncer de cuello de útero, de lesiones precancerosas y de verrugas genitales en España. La vacunación de las niñas y mujeres de 12 a 24 años no incluidas en los programas de vacunación sistemática permitiría una reducción mayor y a más corto plazo del número de casos de enfermedades asociadas al VPH.
To assess the potential epidemiologic and economic impact of vaccination with the human papillomavirus (HPV) quadrivalent (types 6/11/16/18) vaccine in Spain.
MethodsWe used a transmission dynamic model developed for the United Kingdom and applied to Spain by using Spanish-specific epidemiologic and economic data obtained from the literature, databases, and previous epidemiological studies. It was assumed that any vaccination strategy would be implemented in combination with current HPV screening and treatment programs. The strategy of routine vaccination of a cohort of 11-year-old girls was used, alone or in combination with catch-up vaccination in 12-24-year olds.
ResultsIn the long term, vaccination of girls and young women would reduce the incidence of cervical cancer by 86%, precancerous cervical intraepithelial neoplasia (CIN) II/III lesions by 85%, CIN I by 79% and genital warts by 81% related to HPV 6, 11, 16 and 18. Overall, vaccination would reduce the total cost related to HPV 6, 11, 16 and 18 infections by 83.5%. Catch-up vaccination of 12 to 24-year-old females would save 77% of the costs avoided in the first 10 years of the program. In the first few years of vaccination, most of the cases and costs avoided would be attributable to the prevention of HPV-6- and 11-related diseases.
ConclusionsImplementation of vaccination programs with the HPV quadrivalent vaccine, combined with current screening programs, would significantly reduce the number of cases of cervical cancer, precancerous lesions and genital warts in Spain. Vaccination of girls and women aged 12 to 24 years not included in routine vaccination programs would result in a greater and earlier reduction in the incidence of diseases related to HPV 6, 11, 16 and 18.
La infección por el virus de papiloma humano (VPH) se asocia a neoplasias intraepiteliales cervicales (CIN), de cáncer de cuello de útero, de ano, de pene, de vagina, de vulva, de cabeza y cuello, además de verrugas anogenitales y papilomatosis respiratoria recurrente1. La incidencia y mortalidad por cáncer de cuello de útero han disminuido significativamente en los países con programas poblacionales de detección precoz de esta enfermedad; sin embargo, sigue siendo el segundo cáncer más frecuente entre las mujeres jóvenes y una importante causa de mortalidad por cáncer en todo el mundo, con un número estimado de 493.000 nuevos casos y 274.000 muertes en 20022,3. En España, no existe un programa de cribado poblacional en el ámbito nacional y se registran 2.100 casos de cáncer de cuello de útero y 740 muertes anuales4. Los programas de prevención secundaria, desarrollados por las comunidades autónomas, han sido en su mayoría oportunistas y se han realizado dentro del contexto de la atención primaria5. Posiblemente por esta ausencia de programas poblacionales, en España no se ha observado una reducción significativa en el riesgo de cáncer de cuello de útero a lo largo del tiempo6.
La vacuna tetravalente frente al VPH fue aprobada en la Unión Europea para la prevención de lesiones cervicales de alto grado (CIN de grados II y III), carcinoma cervical, lesiones displásicas vulvares de alto grado (neoplasias intraepiteliales vulvares [VIN] de grados II y III) y verrugas genitales externas (condyloma acuminata) causalmente asociadas a los tipos de VPH 6, 11, 16 y 187.
En general, las potenciales estrategias para la implementación de programas de vacunación se basan en la predicción del impacto epidemiológico, sanitario y económico del programa8,9. Una metodología actualmente utilizada para estimar ese impacto y orientar decisiones políticas sobre la implementación de programas de vacunación son las proyecciones mediante modelos matemáticos10. En general, los modelos basados en el seguimiento de una cohorte han demostrado que la vacunación frente al VPH es altamente eficiente11 13. Estudios realizados mediante un modelo de cohorte para España demuestran que el coste por año de vida ganado (AVG) por la vacunación en una cohorte de niñas de 11 años de edad estaría entre 5.647 € y 8.657 €, y el coste por año de vida ajustado por calidad (AVAC) adicional ganado sería de 6.493 €, en todos los casos, muy por debajo del umbral de eficiencia establecido de 30.000 € por AVAC14 16. Recientemente se han utilizado en EE.UU. y el Reino Unido modelos dinámicos de transmisión y evaluación económica integrados, para evaluar la eficiencia de distintas estrategias de vacunación con la vacuna tetravalente frente al VPH17,18. Se ha analizado el impacto de la implementación de diferentes estrategias de vacunación con una vacuna tetravalente frente a los tipos de VPH 6, 11, 16 y 18 en España, mediante una simulación, basada en los resultados de este modelo dinámico para el Reino Unido18.
MÉTODOSSe ha utilizado un modelo matemático dinámico, adaptado al contexto del Reino Unido, como base para la evaluación del impacto sanitario de los programas de inmunización con una vacuna tetravalente frente al VPH en España18. Utilizando los resultados de este modelo se ha realizado una proyección del impacto epidemiológico y económico de distintas estrategias de vacunación con la vacuna tetravalente frente al VPH en España18. Los componentes del modelo que fueron modificados para su adaptación al Reino Unido incluyen las estrategias de cribado, tratamiento y vacunación, así como parámetros clínicos, conductuales (p. ej., conducta sexual) y económicos18. Los detalles de la estructura del modelo dinámico y las ecuaciones que utiliza se han publicado previamente17,18 (apéndice suplementario disponible en: www.cdc.gov/ncidod/EID/13/1/28-app.htm). La simulación para España se realizó desarrollando un modelo que utiliza datos sobre la carga epidemiológica y económica de la enfermedad asociada a los tipos de VPH 6, 11, 16 y 18 en España, obtenidos a partir de estudios previamente realizados. Posteriormente, se aplicó la proporción de reducción de enfermedad por VPH asociada a la vacunación, que se estimó a partir del modelo dinámico desarrollado para el Reino Unido18.
Estrategias de vacunación y cribadoSe ha asumido que la vacunación se implementaría en combinación con los programas de cribado y las prácticas de tratamiento de enfermedad actuales. Se ha utilizado como escenario base el cribado de cáncer de cuello de útero en el Reino Unido, que consiste en un programa poblacional, dirigido a mujeres de 25 a 64 años a las que se les realiza una citología con intervalos de 3 a 5 años y con una cobertura del 80%.
Se definió la estrategia de vacunación de referencia como la vacunación sistemática de una cohorte de niñas entre 11 y 14 años de edad, utilizándose la de 11 años de edad para el modelo (estrategia de referencia)19. Como no se conoce a priori la cobertura de un potencial programa de vacunación frente al VPH en este grupo de población, se asumió una cobertura del 80% en la cohorte de 11 años de edad. Esta cobertura se basa en la experiencia de otros programas de vacunación en adolescentes20. También se ha asumido que la cobertura aumentaría en progresión lineal desde el 0 hasta el 80% durante los primeros 5 años del programa y se mantendrá en el 80% posteriormente. Adicionalmente, se ha evaluado el impacto de una estrategia que incluya, además de la vacunación sistemática de la niñas de 11 años de edad, la vacunación “no sistemática” de niñas y mujeres de 12 a 24 años de edad. Para este grupo se ha asumido un programa temporal de vacunación durante un período de 5 años (al contrario que la vacunación sistemática de la cohorte de niñas de 11 años, que sería permanente) y que la cobertura aumentaría de forma lineal del 0 al 50% durante ese período de 5 años.
Parámetros sobre la vacuna tetravalente frente al virus del papiloma humanoSe ha considerado una eficacia del 95,2% frente a los CIN I-III y del 98,9% frente a las verrugas genitales, en ambos casos asociadas a los tipos de VPH 6, 11, 16 y 187. La eficacia de la vacuna frente a las infecciones incidentes por el VPH tipos 6, 11, 16 y 18 se ha considerado del 90%21. La vacuna no tiene efecto terapéutico. A partir de los datos de seguimiento a 5 años y de memoria inmunológica obtenidos en los ensayos clínicos de la vacuna tetravalente, se ha considerado una duración de por vida de la protección inferida por la vacuna22. También se ha asumido que el curso natural de la enfermedad no se modifica después de un fallo vacunal o una potencial pérdida de la inmunidad inducida por la vacuna.
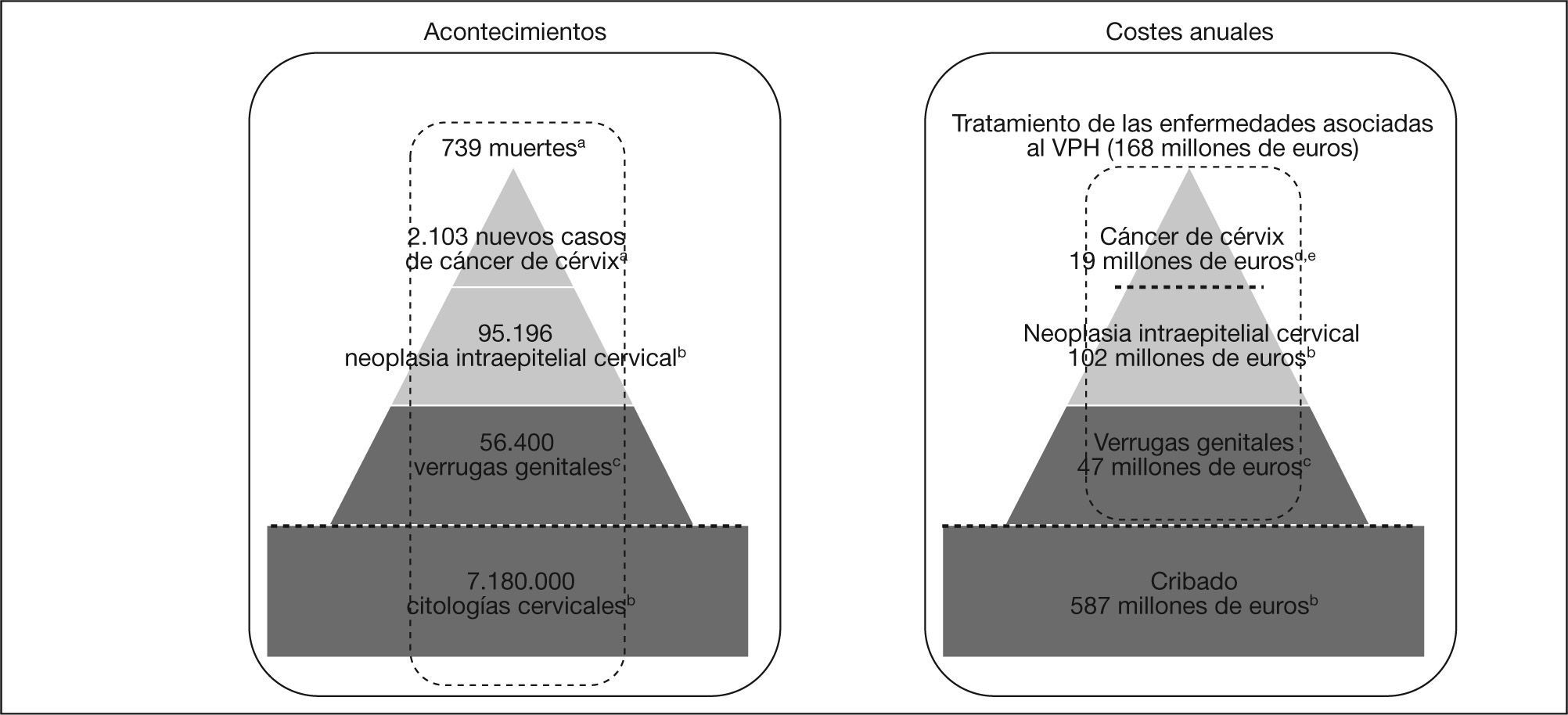
Parámetros sobre carga de enfermedad y fuentes de informaciónLos datos demográficos y epidemiológicos locales introducidos en la simulación se obtuvieron de la revisión bibliográfica, de bases de datos publicadas (por ej., INEbase) y de estudios epidemiológicos sobre carga de enfermedad por VPH en España23,24. En España se diagnostican cada año 2.103 casos nuevos de cáncer de cuello de útero, 95.196 casos de CIN de diferentes grados (I a III) y 56.400 casos de verrugas genitales4,23,24 (fig. 1).
Carga epidemiológica y económica del cribado y de las enfermedades asociadas al virus del papiloma humano (VPH) en España. aGLOBOCAN. 2007. bCastellsague X et al. Cervical cancer screening and management in Spain. ECC. 2007. cCastellsague X et al. Burden of genital warts in Spain. EUROGIN. 2007. dEstimación basada en: Gil A et al. Burden of cervical cancer requiring hospital treatment in Spain, 1999 2002 period. eDodesk J et al. Analyse economique des couts du cancer en France. INCA march 2007. Management and costs pf treating lung cancer patients in an university hospital. Dept. of Oncology, Zurich, Switzerland.
Los costes médicos directos del tratamiento de las enfermedades asociadas al VPH, desde la perspectiva del sistema sanitario, se han obtenido a partir de datos publicados y de estudios sobre carga de enfermedad por cáncer de cuello de útero, CIN y verrugas genitales en España14,15,23 25 (fig. 1). El análisis incluye únicamente los costes médicos directos, actualizados a los valores del año 2006. El coste global anual del diagnóstico y tratamiento de las enfermedades asociadas al VPH sería de 168 millones de euros, sin incluir el coste estimado del cribado (587 millones de euros) (fig. 1)23 27.
Tipos de resultados proporcionados por el modeloLos resultados epidemiológicos incluyen los casos de cáncer de cuello de útero invasor, CIN II/III, CIN I, y de verrugas genitales evitados por el programa de vacunación en un horizonte temporal. Los resultados económicos incluyen los costes totales evitados. Los costes totales incluyen el coste total del diagnóstico y tratamiento de los casos de cáncer invasor de cuello de útero, CIN o verrugas genitales.
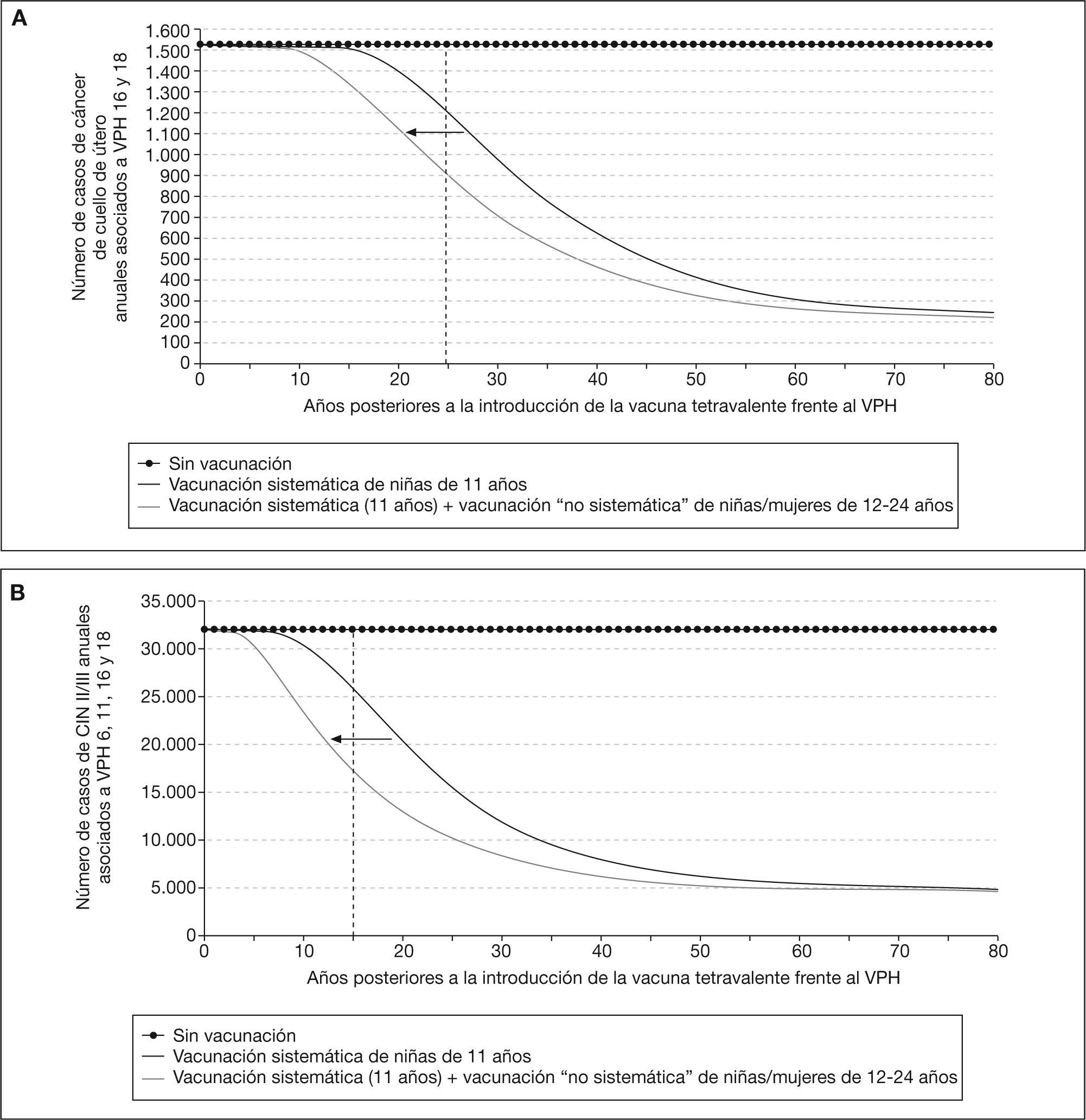
RESULTADOSImpacto sobre la carga de enfermedadLa figura 2A muestra el impacto de la vacunación en la frecuencia de cáncer de cuello de útero asociado a los tipos 16 y 18 del VPH a lo largo del tiempo. Se observa una reducción continua de los casos de cáncer, que se estabiliza en unos 200 casos anuales, aproximadamente a los 80 años del inicio de la vacunación. La vacunación sistemática de la cohorte de niñas de 11 años junto con la vacunación “no sistemática” de niñas y mujeres de 12 a 24 años de edad reduce un 86% los casos de cáncer de cuello de útero atribuibles a los tipos de VPH 16 y 18 a largo plazo, y un 42% a los 25 años del inicio de la vacunación. En los primeros 25 años después de la introducción de la vacuna (línea de referencia vertical en la fig. 2A), la estrategia de vacunación de referencia (una cohorte de niñas de 11 años) evitaría 1.798 casos de cáncer de cuello de útero atribuibles a los tipos 16 y 18. La vacunación adicional no sistemática (12 24 años) evitaría 3.169 casos más, (el 64% del total de casos evitados). El modelo muestra cómo la vacunación adicional no sistemática de niñas y mujeres de 12 a 24 años permitiría alcanzar 6 años antes la reducción de los casos de cáncer de cuello de útero obtenida con la vacunación únicamente de niñas de 11 años de edad.
A: impacto de las estrategias de vacunación en la frecuencia de cáncer de cuello de útero asociado al virus del papiloma humano (VPH) 16 y 18. B: impacto de las estrategias de vacunación en la frecuencia de neoplasia intraepitelial cervical (CIN) II-III asociada al VPH tipos 6, 11, 16 y 18. C: impacto de las estrategias de vacunación en la frecuencia de CIN I asociada a VPH tipos 6, 11, 16 y 18. D: impacto de las estrategias de vacunación en la frecuencia de verrugas genitales asociada al VPH 6 y 11.
Una dinámica similar se observa para la reducción en los casos de lesiones precancerosas CIN II/III, CIN I y verrugas genitales (fig. 2B-D). El modelo predice una reducción de la incidencia de lesiones precancerosas CIN II/III del 85% y de CIN I del 79% a largo plazo, y del 46 y el 64%, respectivamente, a los 15 años del inicio de la vacunación. En los primeros 15 años posteriores a la introducción de la vacuna (línea de referencia vertical en la fig. 2B), la estrategia de vacunación de referencia (una cohorte de niñas de 11 años) evitaría 23.532 casos de lesiones precancerosas CIN II/III atribuibles a los tipos de VPH 6, 11, 16 y 18. La vacunación no sistemática (12 24 años) evitaría 71.427 casos adicionales (el 75% del total de casos evitados) (fig. 2B). Igual que en el caso del cáncer de cuello de útero, añadir la vacunación no sistemática a los 12 24 años a la estrategia de referencia (niñas de 11 años) anticiparía la reducción de la incidencia de CIN II/III y CIN I en 6 años (fig. 2B y C).
La reducción de la incidencia de verrugas genitales asociadas al VPH tipos 6 y 11 sería del 53% al sexto año de implementación de la vacunación y del 81% a largo plazo (fig. 2D). A corto plazo (en los primeros 10 años después de la introducción de la vacuna), la estrategia de vacunación de referencia (una cohorte de niñas de 11 años) evitaría 58.495 casos de verrugas genitales atribuibles a los tipos del VHP 6 y 11. La vacunación adicional no sistemática (12 24 años) evitaría 154.459 casos adicionales, un 75% del total de casos evitados. Esta reducción se conseguiría 6 años antes si se vacunase además a las niñas y mujeres de 12 a 24 años de edad. En la figura 2D vemos que la incidencia de verrugas genitales aumentaría muy ligeramente a partir del año 19 del inicio de la vacunación, para luego volver a disminuir a partir del año 36 y, a continuación, alcanzar una situación de equilibrio de unos 10.000 casos anuales. El ligero incremento en el número de casos al inicio de la vacunación se debe a que la reducción del pool de susceptibles en la población no ha sido lo suficientemente grande para erradicar completamente la infección y la enfermedad. El pool de susceptibles finalmente alcanza un umbral crítico que resulta en un ligero y temporal aumento de la incidencia, para luego volver a disminuir. Este fenómeno de valores bajos de enfermedad seguidos de aumentos en la incidencia ha sido previamente descrito en poblaciones vacunadas con grados de cobertura próximas al nivel crítico necesario para la erradicación28,29.
El modelo indica que hasta un 90% de los casos de enfermedad evitados en los primeros 5 años estarían asociados a la infección por los tipos 6 y 11. La vacunación adicional no sistemática da lugar a una reducción mayor y a más corto plazo del número de casos comparada con la estrategia de vacunación sistemática de solamente una cohorte de niñas de 11 años de edad (fig. 2).
Impacto sobre los costesLa estrategia de vacunación sistemática de niñas de 11 años, una vez alcanzada la cobertura del 80% asumida para el modelo, supondría un coste anual de 44 millones de euros. El coste de la estrategia que incluya la vacunación no sistemática de niñas y mujeres de 12 a 24 años, además de la vacunación sistemática de niñas de 11 años, sería de 113 millones anuales durante el período de 5 años de duración de esta estrategia (considerando la financiación del 60% del coste de la vacuna por parte del sistema sanitario). Una vez alcanzado el estado estacionario, la vacunación evitaría un gasto de 90 millones de euros anuales.
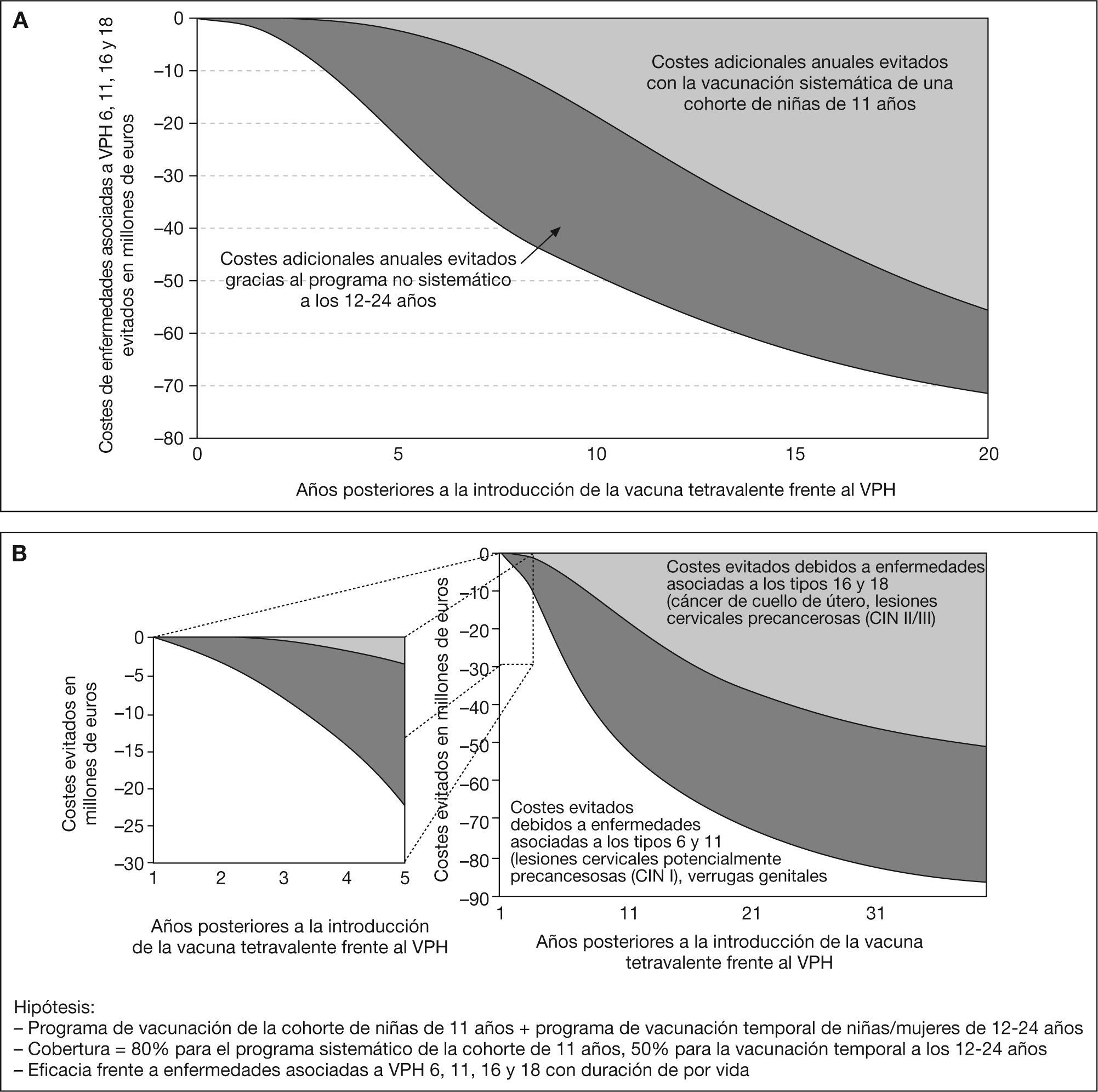
Globalmente, la vacunación reduciría en un 83,5% los costes totales asociados a las enfermedades por el VPH 6, 11, 16 y 18. En la figura 3A se muestran los costes totales evitados en los primeros 20 años de implementación de la vacunación. La vacunación no sistemática en mujeres de 12 24 años de edad sería responsable del 77% de los costes evitados en los primeros 10 años desde el inicio de la vacunación y 47% a los 20 años.
A: costes totales evitados mediante la prevención de enfermedades asociadas al virus del papiloma humano (VPH) en los primeros 20 años. B: costes evitados debidos a la prevención de enfermedades asociadas al VPH tipos 16 y 18 y costes evitados por la prevención de enfermedades asociadas al VPH 6 y 11.
En los primeros 5 años desde el inicio de la vacunación, el 88% de los costes evitados están asociados a la prevención de la infección por el VPH 6 y 11 (fig. 3B). En los primeros 20 años, la mayoría de los costes evitados (63%) siguen siendo atribuibles a la prevención de los casos de lesiones asociadas a la infección por el VPH 6 y 11, fundamentalmente las verrugas genitales, debido a su menor periodo de latencia30. Sin embargo, a largo plazo, la mayoría de los costes evitados mediante la vacunación se asocian a la prevención de las lesiones precancerosas CIN II/III y del cáncer de cuello de útero (fig. 3B).
DISCUSIÓNLos resultados del modelo muestran que, a largo plazo, la vacunación sistemática de una cohorte de niñas de 11 años reduciría considerablemente la incidencia de enfermedades asociadas a la infección por el VPH. La adición de la vacunación no sistemática de adolescentes y mujeres entre 12 y 24 años de edad con una cobertura relativamente baja (el 50% acumulado en 5 años), se asocia a una reducción más temprana y efectiva de la incidencia de estas enfermedades. También se observa que la prevención de las enfermedades asociadas a los tipos de VPH 6 y 11 es un importante factor en relación con el impacto global epidemiológico y económico de la vacunación, sobre todo a corto plazo, cuando el mayor impacto en la reducción de costes resulta fundamentalmente de la prevención de las verrugas genitales y de las lesiones CIN I.
Estos resultados completan el análisis previamente realizado mediante la utilización de modelos de cohorte. Los modelos de transmisión dinámicos se basan en una metodología diferente y tienen en cuenta tanto los beneficios directos de la vacunación como ciertos beneficios indirectos, como por ejemplo, los debidos a la inmunidad de grupo, que no se tienen en cuenta en los modelos de cohorte28,31,32. También presentan la ventaja de ser más apropiados para la evaluación de programas de vacunación dirigidos a poblaciones heterogéneas (p. ej., vacunación sistemática de niñas de 11 años, combinada con vacunación no sistemática de población de 12 24 años de edad).
Entre las limitaciones de este análisis hay que destacar que no se ha realizado una adaptación completa del modelo dinámico al contexto español. La adaptación completa hubiese requerido una serie de datos no disponibles actualmente para España, como por ejemplo datos sobre conductas sexuales, y que hubiera obligado a realizar un gran número de asunciones. La aplicación del modelo adaptado para el Reino Unido a los datos españoles es conservadora ya que el programa de cribado poblacional vigente en el Reino Unido garantiza una alta cobertura mantenida en el tiempo. Sin embargo, este tipo de programa poblacional no existe actualmente en España.
Otra de las limitaciones del modelo es que no se ha analizado una posible interacción entre la demanda de vacunación y la demanda del cribado de cáncer de cuello de útero. Es decir, se ha asumido que las mujeres en España tienen el mismo acceso a la atención sanitaria, ya sea para vacunación, cribado o tratamiento. Esta asunción podría sobrestimar los beneficios de la vacunación, en el caso de que las mujeres que tienen actualmente un acceso limitado al cribado tuviesen también menos probabilidades de ser vacunadas.
La modelización se ha limitado a evaluar el impacto de la vacunación en las enfermedades del cuello de útero y en las verrugas genitales. Sin embargo, la vacuna tetravalente también ha demostrado eficacia protectora frente a las lesiones precancerosas vulvares y vaginales. Además, no se ha considerado tampoco el impacto de la protección cruzada (protección frente a enfermedades asociadas a infección por tipos del VPH no incluidos en la vacuna) evidenciada en los ensayos clínicos de la vacuna y que supone un valor adicional de la vacunación33,34. La infección por el VPH también se ha asociado con la papilomatosis respiratoria recurrente y cánceres de ano, pene, vagina, vulva y de cabeza y cuello. A medida que las evidencias vayan estando disponibles, la cobertura del modelo puede ampliarse para incorporar los efectos potenciales de la vacunación frente a estas otras afecciones asociadas al VPH.
En conclusión, los resultados de este modelo demuestran que la vacunación de una cohorte de niñas preadolescentes con la vacuna tetravalente frente al VPH (tipos 6, 11, 16 y 18) reduciría significativamente los casos de cáncer de cuello de útero, las lesiones precancerosas y las verrugas genitales, así como los costes asociados a estas enfermedades. La adición de la vacunación no sistemática en adolescentes y mujeres hasta los 24 años no incluidas en el programa de vacunación sistemática permitiría una reducción mayor, y a más corto plazo, de las enfermedades y costes asociados a las infecciones por el VPH 6, 11, 16 y 18. Los beneficios clínicos observados en los primeros años después de la implementación de los progra mas de vacunación estarían fundamentalmente asociados a la prevención de las verrugas genitales asociadas a los tipos 6 y 11 del VPH.