Evaluar los resultados de la biopsia selectiva del ganglio centinela (GC) en mujeres con cáncer de mama tratadas en hospitales sin servicio de Medicina Nuclear.
Sujetos y métodosEl estudio incluyó 88 mujeres con cáncer de mama no avanzado tratadas en 2 hospitales comarcales entre febrero 2007 y julio 2010. El día previo a la cirugía se realizó una linfogammagrafía en el hospital especializado. Para la localización intraoperatoria del GC se utilizaron una sonda radiodetectora y una gammacámara manual.
ResultadosEl GC se localizó quirúrgicamente en 97,7% de pacientes. La media de ganglios linfáticos extraídos por cada procedimiento y equipo quirúrgico fue 2,1±1,4 y 2,5±1,2. En 27,2% de pacientes se practicó linfadenectomía axilar. Hubo un resultado falso negativo y un falso positivo.
ConclusionesLa implementación de la biopsia selectiva del GC en hospitales comarcales proporciona los mismos resultados que los obtenidos en el hospital supervisor.
To evaluate the results of sentinel lymph node (SLN) biopsy in women with breast cancer treated in hospitals without a nuclear medicine unit.
Subjects and methodsEighty-eight patients with early-stage breast cancer treated in two district hospitals between February 2007 and July 2010 were included. The day before surgery a lymphoscintigraphy was performed in the specialized hospital. Intraoperative localization of the SLN was accomplished by the combined use of a hand-held gamma probe and a manual gamma-camera.
ResultsSurgical localization of the SLN was successful in 97.7% of the patients. The mean number of lymph nodes excised by each procedure and each surgical team was 2.1±1.4 and 2.5±1.2. Axillary lymph node dissection was performed in 27.2% of the patients. There was one false-negative result and one false-positive result.
ConclusionThe implementation of SLN biopsy in district hospitals provides similar results to those obtained in the supervising hospital.
La biopsia selectiva del ganglio centinela (BSGC) es el procedimiento de elección para realizar una adecuada estadificación de los ganglios linfáticos axilares en pacientes con cáncer de mama no avanzado. La extirpación quirúrgica y el análisis histológico del primer ganglio linfático en la vía de drenaje del tumor proporcionan una elevada exactitud diagnóstica del estado ganglionar; por ello, la BSGC ha ganado amplia aceptación en la práctica clínica diaria1.
La línea de trabajo en nuestro servicio de Medicina Nuclear ha demostrado un especial interés por la utilización de las técnicas gammagráficas en el diagnóstico del cáncer de mama2,3. Nosotros venimos realizando la BSGC en cáncer de mama desde el año 1999; tras la fase previa de validación4, hemos mantenido la técnica como aplicación asistencial en tumores palpables y no palpables de mama5.
En los últimos años se ha generado un creciente interés por la implantación de la técnica en múltiples áreas geográficas6–10. La realización de la BSGC es un trabajo multidisciplinario que supone la colaboración de ginecólogos, oncólogos, médicos nucleares, radiólogos y anatomopatólogos. El objetivo común es alcanzar un estándar de calidad en todos los pasos del proceso que conduzca al óptimo cuidado del paciente11–12. Numerosos centros especializados realizan la BSGC en nuestro país13. Sin embargo, los resultados publicados por estos equipos no permiten diferenciar la procedencia de los pacientes; es decir, no se puede inferir cuales son los resultados obtenidos en los pacientes atendidos en el centro especializado y cuales los procedentes de pacientes de otros centros sanitarios de menor nivel14–17.
El propósito de nuestro trabajo ha sido evaluar los resultados de la implementación de la BSGC en 2 hospitales comarcales de nuestra Comunidad Autónoma que no disponen de un servicio de Medicina Nuclear en el propio centro.
Material y métodosÁmbito de estudioEl mapa sanitario de Cantabria está configurado en 4 áreas de salud (AS) y 42 zonas básicas de salud. En la zona oriental se localizan el AS I (Santander) y el AS II (Laredo); en la zona occidental está el AS III (Reinosa) y el AS IV (Torrelavega). La Comunidad Autónoma cuenta con 3 hospitales públicos que dan cobertura a las 4 AS: Hospital Universitario Marqués de Valdecilla, Santander (AS I), Hospital Comarcal de Laredo (AS II) y Hospital General Básico de Sierrallana, Torrelavega (AS III y AS IV).
El presente trabajo se basa en la actividad desarrollada en el Hospital Comarcal de Laredo (144 camas, cobertura de 90.273 habitantes, a 49 km de distancia de Santander) y en el Hospital General Básico de Sierrallana (276 camas, cobertura de 161.127 habitantes, a 26 km de distancia de Santander). En los 2 hospitales existen servicios de Ginecología con especialistas procedentes del Sistema Nacional de Salud y de amplia experiencia quirúrgica en el abordaje de la Ginecología Oncológica. Como centro de atención especializada de referencia intervino el Hospital Universitario Marqués de Valdecilla.
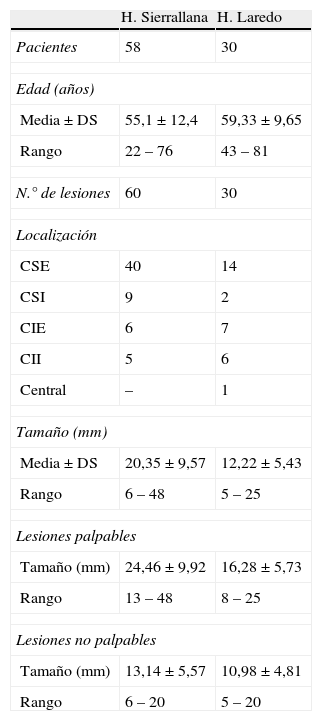
Selección de pacientesEl estudio incluyó 88 pacientes consecutivas con cáncer de mama entre febrero 2007 y julio 2010. Las características de la población aparecen reflejadas en la tabla 1. Las pacientes procedían del programa de detección precoz del cáncer de mama de la Comunidad Autónoma y de la consulta de Ginecología de los hospitales públicos del AS II, AS III y AS IV. Todas ellas tenían un diagnóstico histológico de cáncer de mama. Como criterios de inclusión para la realización de la BSGC se utilizaron los aprobados en el Consenso de la Sociedad Española de Senología y Patología Mamaria, Murcia 2006: tumores T1 o T2 menores de 5cm, con estado ganglionar negativo en axila y sin metástasis a distancia por los exámenes clínicos18. No se incluyeron pacientes con tumores mayores de 5cm, multicéntricos y con antecedentes de cirugía, linfadenectomía, radioterapia o quimioterapia. Todas las pacientes tenían una ecografía axilar como parte del estudio previo a la BSGC.
Características de la población estudiada en los 2 hospitales comarcales
| H. Sierrallana | H. Laredo | |
| Pacientes | 58 | 30 |
| Edad (años) | ||
| Media ± DS | 55,1±12,4 | 59,33±9,65 |
| Rango | 22 – 76 | 43 – 81 |
| N.° de lesiones | 60 | 30 |
| Localización | ||
| CSE | 40 | 14 |
| CSI | 9 | 2 |
| CIE | 6 | 7 |
| CII | 5 | 6 |
| Central | – | 1 |
| Tamaño (mm) | ||
| Media±DS | 20,35±9,57 | 12,22±5,43 |
| Rango | 6 – 48 | 5 – 25 |
| Lesiones palpables | ||
| Tamaño (mm) | 24,46±9,92 | 16,28±5,73 |
| Rango | 13 – 48 | 8 – 25 |
| Lesiones no palpables | ||
| Tamaño (mm) | 13,14±5,57 | 10,98±4,81 |
| Rango | 6 – 20 | 5 – 20 |
La selección de las pacientes se realizó en sesión clínico-oncológica de cada centro la semana previa a la fecha de la intervención quirúrgica y se consultó con el personal médico del servicio de Medicina Nuclear. En todo momento se intentó agrupar a 2 pacientes para que fueran operadas el mismo día, y siempre que ello no supusiera un retraso en la atención quirúrgica. Así mismo, se establecieron semanas alternas y días determinados de la semana para realizar la BSGC en cada uno de los centros. Los equipos médicos estaban formados por 4 ginecólogos, 4 especialistas en Medicina Nuclear, 2 radiológos y 2 anatomopatólogos. Los especialistas de Medicina Nuclear establecieron turnos rotatorios semestrales para que un solo médico nuclear pudiera realizar el desplazamiento al hospital comarcal y la técnica de la BSGC en el quirófano. Todas las pacientes recibieron una adecuada información, oral y escrita, por parte de los servicios de Ginecología y Medicina Nuclear acerca del procedimiento y del objetivo de la técnica y firmaron el correspondiente consentimiento informado.
Una vez hecha la selección de las pacientes, los servicios administrativos se interconectaron para transmitir la historia clínica, comunicar la fecha y la hora de inicio de la intervención de acuerdo con la programación quirúrgica y establecer la hora de citación en el servicio de Medicina Nuclear. Con estos datos se coordinó el traslado, en medio de transporte privado contratado por los servicios administrativos del hospital de atención especializada de referencia, de un médico nuclear y del equipo de radiodetección (sonda detectora y gammacámara manual), ajustando el horario al comienzo de la primera intervención quirúrgica (horario quirófano). Incluyendo los desplazamientos, la duración total de los 2 procedimientos de BSGC fue de 4-6 horas.
Estudio linfogammagráficoEl estudio linfogammagráfico se realizó en el servicio de Medicina Nuclear del AS I. El radiotrazador (99mTc-Nanocoloide, 111 MBq, volumen total 3ml) se administró el día previo a la cirugía mamaria mediante 4 inyecciones peritumorales o periareolares. Como no realizamos punción guíada por ecografía, la vía periareolar se reservó para las pacientes con tumores no palpables, tumores en el cuadrante supero-externo de la mama (para evitar posibles interferencias en la visualización del GC axilar) y cuando la palpación de la tumoración mamaria fue dificultosa para el médico nuclear. Tras la inyección del nanocoloide se aplicó un suave masaje sobre la zona de inyección.
En todos los casos se obtuvo una linfogammagrafía dinámica inmediatamente después de la inyección del radiotrazador y durante los 15 min siguientes. Se adquirieron imágenes de 45 segundos en matriz 64 x 64, en proyección anterior y con el brazo situado a 90° con respecto al eje de la paciente. A continuación se realizaron imágenes estáticas precoces (5 min/imagen en matriz 128 x 128) en proyecciones anterior, lateral y oblicua anterior 45°. A las 2-3 ho se adquirieron imágenes estáticas en las mismas proyecciones que las imágenes precoces.
En determinadas circunstancias (mamas grandes, obesidad) se adquirieron imágenes en proyecciones especiales con retracción manual de la mama, en decúbito prono o con la paciente sentada para conseguir una mejor visualización de los ganglios linfáticos. Así mismo, cuando no se alcanzó la visualización del GC en las imágenes tardías se procedió a una nueva inyección del radiotrazador en una localización mamaria diferente a la inyección inicial (subcutánea en la piel por encima de la lesión o periareolar si la inyección había sido peritumoral); tras la administración se obtuvieron imágenes estáticas. Para delimitar el contorno de la paciente se utilizó una fuente radiactiva de 57Co. No se aplicó técnica de SPECT/TAC.
Tras la identificación del o de los GC axilares e intramamarios se comprobó su situación con la sonda detectora y la gammacámara manual. La sonda detectora (Europrobe II, Eurorad, Francia) dispone de un cristal de CdTe y está diseñada para bajas energías (rango 20 – 170KeV) con una excelente resolución espacial; tiene una longitud 386mm, diámetro 10mm y peso 170 g. La sonda queda acoplada a un módulo de lectura en escala numérica (cuentas totales y cuentas por segundo) y en escala sonora. La gammacámara manual (Minicam II, Eurorad, Francia) tiene un detector de tecnología CdTe montado en una matriz 16x16 con un campo de visión de 40x40mm; puede trabajar en un rango de energías entre 30 y 200KeV, la resolución espacial teórica es 2,46mm y pesa 1kg. Se acopla a un módulo de visualización de 3 kg de peso y dimensiones 31x28x9cm; la pantalla de cristal líquido del módulo tiene un sistema de coordenadas que divide el campo en 4 cuadrantes, facilitando la ubicación espacial del GC. El conjunto del equipo de radiodetección se trasporta fácilmente en 2 maletas de tamaño mediano.
La localización del GC se marcó en la piel con un rotulador; se instruyó a la paciente para que conservara la marca cutánea hasta el día siguiente. No se realizó marcaje del drenaje linfático a la cadena mamaria interna porque no se contempló su abordaje quirúrgico. Ahora bien, el ginecólogo fue informado de este drenaje a efectos de las posibles implicaciones terapéuticas tras la cirugía. En algunas ocasiones esta información fue utilizada por el servicio de Oncología en colaboración con el servicio de Radioterapia para solicitarnos la realización de una exploración PET/TAC con 18F-FDG previa a la irradiación de la cadena mamaria interna. Finalizado el estudio linfogammagráfico, la paciente ingresó en el hospital de la correspondiente AS que había solicitado la exploración.
Análisis de las imágenesLas imágenes dinámicas y estáticas se analizaron visualmente. Se identificó como GC aquel ganglio con un canal linfático propio procedente del sitio de inyección; en el caso de no visualización del canal linfático se consideró GC el primer ganglio de aparición en un territorio linfático determinado. Los ganglios linfáticos que aparecieron en el segundo y tercer escalón de la cadena linfática se consideraron ganglios linfáticos secundarios (fig. 1).
En los 88 pacientes se realizaron 90 estudios linfogammagráficos, ya que 2 pacientes presentaron un cáncer bilateral de mama. El estudio linfogammagráfico demostró visualización del GC en 86 de los 88 pacientes; el estudio fue negativo en 2 pacientes incluso tras una nueva inyección del radiotrazador por otra vía mamaria.
Cirugía mamaria y biopsia selectiva del ganglio centinelaLa intervención quirúrgica se realizó en cada hospital comarcal al día siguiente del estudio linfogammagráfico. Antes de iniciar la cirugía, el médico nuclear comentó con el equipo quirúrgico las imágenes de la linfogammagrafía; así mismo, el médico nuclear y el ginecólogo encargado de la cirugía comprobaron las marcas cutáneas y el nivel de captación del GC con la sonda radiodetectora y la gammacámara manual para verificar su correcta posición que sirvieron como guía para realizar el abordaje quirúrgico. De acuerdo con los servicios de Ginecología no se contempló la detección combinada con azul de metileno.
La cirugía comenzó con la extirpación del GC. Se retiraron los ganglios linfáticos identificados como GC y todos los ganglios linfáticos con un número de cuentas superior al 10% de la actividad ganglionar máxima. También se extrajo cualquier ganglio linfático clínicamente sospechoso macroscópicamente aumentado independientemente del nivel de captación demostrado por la sonda radiodetectora. La cirugía del GC terminó con una palpación digital de todo el campo axilar.
El/los GC y los ganglios linfáticos resecados (palpables, secundarios) se enviaron para estudio histológico intraoperatorio (tinción con hematoxilina-eosina) y de forma diferida (inmunohistoquímica). A la espera del primer resultado histológico, se inició el abordaje quirúrgico del tumor mamario (tumerectomía o mastectomía). El análisis histológico de los ganglios extirpados se clasificó como negativo para metástasis, células tumorales aisladas (≤ 0,2mm), micrometástasis (> 0,2 y ≤ 2mm) y metástasis (> 2mm).
ResultadosLa localización del GC durante la cirugía se alcanzó en 86 de las 88 pacientes (tasa de detección del 97,7%). En total se extirparon 200 ganglios linfáticos; estos ganglios incluyeron GC, ganglios secundarios y ganglios palpables no captantes. Para valorar el grado de aprendizaje de los equipos quirúrgicos comprobamos la variación en el número de ganglios linfáticos extirpados por procedimiento a lo largo de todo el tiempo que ha sido evaluado en este trabajo. La media de ganglios extirpados por procedimiento y equipo quirúrgico fue de 2,15±1,37 en el Hospital de Sierrallana y 2,5±1,25 en el Hospital de Laredo. En las primeras 10 intervenciones, la media de ganglios linfáticos extirpados por cada equipo quirúrgico fue de 4,6±1,64 (rango 2-8 ganglios) y 3,7±1,06 (rango 2-6 ganglios); en las restantes intervenciones, la media de ganglios linfáticos extraídos fue de 1,6±0,57 (rango 1-4 ganglios) y 1,9±0,85 (rango 1-5 ganglios), respectivamente. En 21 pacientes se detectaron GC extraaxilares, 15 con migración a la cadena mamaria interna homolateral y 6 con detección de GC intramamario. No se recogieron datos sobre la duración media de la BSGC en cada centro comarcal.
La histología intraoperatoria del GC demostró metástasis en 14 pacientes y fue negativa para metástasis en 72 pacientes; en 1 paciente un GC intramamario fue una hiperplasia ductal atípica. En las 14 pacientes con GC metastásico, el estudio histológico diferido descubrió además micrometástasis en 1 ganglio linfático secundario. De las 72 pacientes con GC negativo, la histología diferida identificó micrometástasis en 6 pacientes y células tumorales aisladas en 3 pacientes. Además, se observaron metástasis en 1 ganglio linfático palpable con GC negativo (figs. 2 y 3).
El análisis histológico diferido final con inmunohistoquímica demostró afectación ganglionar en 24 de las 86 pacientes con localización operatoria del GC. De estas 24 pacientes, 22 fueron sometidas a linfadenectomía axilar que detectó metástasis en 10 pacientes y no metástasis en 12. Las 2 pacientes sin localización operatoria del GC, a pesar de un rastreo cuidadoso de la región axilar con la sonda y la gammacámara, fueron sometidas a linfadenectomía axilar identificándose metástasis extensa del sistema linfático. Por tanto, se practicó linfadenectomía axilar en 24 de las 88 pacientes intervenidas (27,2%).
DiscusiónA la vez que se han producido avances significativos en la detección precoz del cáncer de mama, el abordaje quirúrgico ha evolucionado hacia cirugías cada vez menos agresivas. En este contexto, la introducción de la BSGC ha evitado la realización de numerosas linfadenectomías innecesarias para la correcta estadificación de la axila. Este procedimiento proporciona una mayor calidad de vida a las pacientes con una menor morbilidad quirúrgica19,20. Además permite una estadificación más precisa de la axila que posibilita la detección de micrometástasis ya que, al extirparse un menor número de ganglios que en la linfadenectomía, se puede realizar un estudio histológico más exhaustivo de los mismos. Aunque no existe un protocolo estándar aceptado, las guías de procedimientos internacionales recomiendan la realización preoperatoria de un estudio linfogammagráfico que proporciona un preciso mapa del drenaje linfático del tumor, tanto del territorio axilar como del extra-axilar (en cadena mamaria interna, región supraclavicular o intramamario), ayuda a la planificación del acto quirúrgico y reduce el número de ganglios extraídos por procedimiento21.
Los datos publicados en la literatura revelan una gran variabilidad geográfica en la implantación quirúrgica de la técnica7–10,13. La falta de disponibilidad de un servicio de Medicina Nuclear en el propio hospital ha sido el principal argumento que se ha expuesto para no practicar esta técnica6,9. Otros factores que pueden intervenir en esta decisión de desestimar la posibilidad de la implementación de la técnica son el nivel de formación oncológica del cirujano, la necesidad de establecer una indispensable coordinación multidisciplinaria y la experiencia quirúrgica del equipo en la cirugía mamaria21,22.
En el presente estudio, la BSGC se realizó en los 2 hospitales comarcales con una programación de semanas alternas. En la actualidad realizamos 3-4 procedimientos de BSGC por semana en las AS II, AS III y AS IV, en días diferentes para evitar la atención de pacientes en los 2 hospitales a la vez. La aplicación de un protocolo de 2 días nos permite asumir este trabajo sin afectar a la labor asistencial diagnóstica del servicio de Medicina Nuclear. Inclusive, la disponibilidad de varios equipos de radiodetección proporciona la posibilidad de realizar la BSGC con otros servicios del centro de referencia al mismo tiempo que se trabaja en el hospital comarcal. Este es un punto importante de la implementación de la técnica fuera del centro especializado de referencia. La oferta de la técnica hacia hospitales que carecen de un servicio de Medicina Nuclear genera un incremento en la cartera de servicios de todos los centros que intervienen. Además, pone a disposición de la población sanitaria una técnica de diagnóstico y tratamiento de la misma manera que la tiene la población que es atendida en un centro de mayor nivel tecnológico. Ahora bien, esto no debe quedar enmascarado con el posible aumento de lista de espera en el centro de referencia.
En nuestra experiencia la implantación y sistematización de la técnica no ha hecho necesario un incremento en los recursos humanos del servicio de Medicina Nuclear ni en los servicios de Ginecología de los hospitales comarcales. El objetivo del trabajo no ha sido comparar la rentabilidad del tipo de estrategia asistencial que planteamos con la posible dotación de una unidad de diagnóstico en el centro comarcal. De rodas las maneras, parece razonable pensar que esta manera de actuación limita el coste del procedimiento de la BSGC que necesitaría, en otras circunstancias, de un servicio de Medicina Nuclear en el propio hospital comarcal. La disponibilidad humana y material, como aspecto positivo de la implementación de la técnica, debe estar en consonancia con una adecuada programación de las exploraciones que se realizan dentro y fuera del servicio de Medicina Nuclear.
A la hora de la implementación de la BSGC, tan importante es la experiencia del equipo quirúrgico como la del equipo de Medicina Nuclear. Los procedimientos de BSGC se realizaron por 4 médicos especialistas en Medicina Nuclear que habían participado en la fase de validación de la técnica. Por tanto, podemos considerar que el equipo estaba constituido por personas de elevada capacitación en la BSGC; de hecho, nuestro servicio de Medicina Nuclear realiza, en la práctica diaria, BSGC en otras neoplasias diferentes al cáncer de mama. Se ha recomendado que, antes de abandonar la linfadenectomía axilar a favor de la BSGC, cada cirujano y centro realice una fase de validación de como mínimo 20 procedimientos para documentar una aceptable tasa de localización del GC y minimizar los resultados falsos negativos23. En España, estos parámetros de validación han sido una tasa de identificación del GC ≥95% y una tasa de falsos negativos ≤5%. En la reunión de consenso, Murcia 2006 18 se planteó la progresiva sustitución de la fase de validación por un proceso de aprendizaje supervisado por un grupo de experiencia.
La aplicación de esta supervisión nos permitió la incorporación de la técnica en la práctica clínica de los hospitales comarcales sin seguir un riguroso proceso de validación. Antes de iniciar la cirugía, las imágenes del estudio linfogammagráfico fueron discutidas con el equipo quirúrgico y se realizó una medición de la actividad existente en el GC que facilitó una cirugía mínimamente invasiva. Asimismo, el médico nuclear colaboró activamente con el cirujano en la localización intraoperatoria del GC con la sonda radiodetectora y la gammacámara manual. La implementación de la BSGC en 2 hospitales comarcales de la Comunidad Autónoma produjo similares resultados a los obtenidos en el centro especializado. La tasa de localización quirúrgica del GC fue 97,7%; de las 88 mujeres estudiadas, 27,2% fueron sometidas a linfadenectomía axilar. La técnica tuvo un resultado falso negativo y un falso positivo en una hiperplasia ductal atípica.
La realización de la BSGC consolida la cirugía mínimamente invasiva axilar y la reducción del tiempo de ingreso hospitalario. Esto permite colaborar en programas de corta estancia en la cirugía del cáncer de mama y se reduce el coste global del proceso24,25. Por otro lado, el hecho de que la paciente reciba el alta a las 24 h de la cirugía favorece su recuperación y genera un menor número de molestias derivadas de la intervención quirúrgica26,27. Desde el punto de vista psicosocial, la implementación de la BSGC en un hospital comarcal permite mantener la atención médica de la paciente dentro de su medio sociofamiliar.
La colaboración entre el servicio de Medicina Nuclear del centro especializado y los servicios de Ginecología de los hospitales comarcales proporciona una estrategia de trabajo que conduce a la optimización de los recursos disponibles. El profesional que trabaja en el hospital comarcal puede hacer frente a la creciente demanda por parte de la población general para recibir el mejor de los conocimientos asistenciales. En otras palabras, con la implementación de la BSGC el ginecólogo participa tanto en el diagnóstico del cáncer de mama como en el tratamiento del mismo e incrementa su formación asistencial.
ConclusiónLa implementación de la biopsia selectiva del ganglio centinela en pacientes con cáncer de mama no avanzado tratadas en hospitales comarcales que no disponen de servicio de Medicina Nuclear incrementa la formación asistencial, mejora la cartera de servicios del centro y aproxima la atención del paciente a su medio socio-familiar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.