La vulvovaginitis candidiásica recurrente (VVCR) es una entidad presente en la práctica diaria en las consultas y en urgencias. Sus síntomas causan molestias crónicas que repercuten seriamente en la calidad de vida de la mujer, empujándola a buscar constantemente una solución que no siempre llega. El diagnóstico debe confirmarse siempre mediante cultivo y el tratamiento debe basarse en el uso de antifúngicos imidazoles, tópicos u orales, con un tratamiento inicial con triple terapia para eliminar los síntomas e intentar eliminar los reservorios; seguida de un tratamiento de mantenimiento durante 6 a 12 meses. Las opciones para la prevención de la VVCR son muy limitadas y, exceptuando la eliminación del agente causal, ninguna otra medida preventiva ha resultado eficaz. Presentamos esta actualización de la VVCR en un intento de ayudar al profesional y colaborar en mejorar la atención de la mujer afecta de VVCR.
Recurrent vulvovaginal candidiasis (RVVC) is a common infection in daily clinical and emergency practice. The symptoms of this infection cause distressing chronic conditions that seriously affect women's quality of life, prompting them to seek solutions that are sometimes hard to find. Diagnosis should always be confirmed by culture and treatment should be based on the use of topical or oral antifungal imidazoles. Triple therapy focused on symptom and reservoir elimination should initially be used, followed by maintenance therapy for 6 to 12 months. The options to prevent RVVC are highly limited and, except for elimination of the causative agent, no other preventive measures have been effective. We provide an updated review of RVVC in an attempt to aid health professionals and improve the care of women with this infection.
La vulvovaginitis candidiásica recurrente (VVCR) se define como la presencia de 4 o más episodios de vulvovaginitis candidiásica (VVC) en un año. Es una realidad clínica que está presente en las consultas de primaria, de ginecología y en las unidades de urgencias. La sintomatología de la VVC se hace insidiosa, pertinaz y episódica afectando substancialmente la calidad de vida de las mujeres. Las afectadas buscan de consulta en consulta, una solución que la mayoría de las veces no llega de forma clara.
Recientemente la Sociedad Española de Ginecología y Obstetricia (SEGO) ha editado un Documento de Consenso sobre infecciones vaginales por hongos1 en el que se analizan los conocimientos más actualizados referentes a la etiología, microbiología, etiopatogenia, etc. de las VVC y en el que también se aborda, de forma tangencial, el tema frecuente y desesperante de las recurrencias. De acuerdo con este documento, el problema de las VVCR reside en causas que alteran el ecosistema vulvovaginal o bien en una deficiencia inmunológica de la paciente.
En este documento se presenta una actualización dedicada exclusivamente a la VVCR buscando ayudar al profesional y colaborar para mejorar la atención a la salud de la mujer, cuando se halla afectada por esta enfermedad recurrente.
EpidemiologíaLa vulvovaginitis candidiásica (VVC) es un proceso muy común en las mujeres adultas, con un pico máximo de incidencia entre los 20 y 40 años. Se calcula que a los 25 años, el 50% de las mujeres habrá tenido al menos un episodio de VVC2,3 y que entre las mujeres premenopáusicas, el 75% habrá sufrido al menos un episodio de VVC y el 45% 2 episodios o más4. A su vez, se estima que el 5% de las mujeres con VVC acabará presentando una VVC recurrente (VVCR)5–7 y que el 5-8% de todas las mujeres adultas tendrá una VVCR8.
En la mayoría de casos de VVCR la responsable es la especie Candida albicans (C. albicans), un germen comensal que puede aislarse en la cavidad vaginal de entre un 2% y más de un 40% de las mujeres sanas asintomáticas (portadoras asintomáticas). También puede estar causada por otras especies de cándida no-albicans pero estos hongos son menos habituales.
Se han descrito algunos factores de riesgo para la VVCR, como es la presencia de uno o varios de los factores de riesgo habituales (diabetes mal controlada, antibióticos, niveles altos de estrógenos, estrés, esponjas vaginales, diafragmas, DIU,…) y la concurrencia de circunstancias que alteren el ecosistema vulvovaginal y/o depriman la respuesta inmune9–11.
También se ha hablado de la posibilidad de reinfección a partir de un reservorio en el que quedaría acantonada la cándida, como en el aparato digestivo o urinario o en dispositivos como un DIU12,13 o un anillo vaginal14. Aunque esta causa no ha sido totalmente demostrada15, es frecuente hallar la misma especie de cándida en las recurrencias que en episodios previos16 lo que iría a favor de un origen endógeno de la recurrencia. Por el contrario, el contagio a partir de una pareja sexual permanentemente infectada o colonizada no ha sido demostrada y, de hecho, el tratamiento de estas parejas no ha mostrado una mejoría evidente17,18.
En cuanto a la deficiencia inmunológica como origen de la VVCR, existe la posibilidad de que una respuesta inmunológica excesiva o escasa se encuentre como base en estos cuadros recurrentes8. Por un lado se ha descrito una deficiencia específica frente a la cándida, la llamada «tolerancia inmunológica de la vagina frente a la cándida», que le permitiría germinar y proliferar de forma incontrolada19. Sin embargo, también se ha argumentado que podría haber «una respuesta inmunológica exacerbada frente a la cándida»19, y de hecho, muchas de las pacientes con VVCR padecen atopia20 y hasta el 70% rinitis alérgica21. También se ha observado cierta predisposición a la candidiasis en mujeres en las que faltan los antígenos a y b del sistema Lewis22 y se han detectado polimorfismos en determinados genes y alteraciones de la inmunidad innata que podrían jugar un papel importante en la génesis de la VVCR23.
Se ha propuesto una hipótesis patogénica de la VVCR, según la cual partiendo de una predisposición genética y actuando factores del propio huésped y de su comportamiento, se llega a la colonización vaginal por la cándida, y a partir de ahí, bien de forma idiopática o también con el concurso de factores de la propia mujer y su comportamiento puede producirse la recurrencia (fig. 1).
Patogenia de las VVCR27.
Entre el 75-90% de las VVC son producidas por C. albicans. El resto de levaduras son las llamadas especies no-albicans, entre las que destaca Candida glabrata (anteriormente Torulopsis glabrata) en el 10-15% de casos, C. tropicalis más frecuente en algunas zonas cálidas, C. krusei, especie naturalmente resistente a los antifúngicos azólicos, y con menor frecuencia, C. kephyr, C. guillermondii u otras24.
El hecho de que C. albicans sea un comensal presente en diferentes mucosas (incluyendo la vagina, la cavidad orofaríngea y el recto) sin causar patología, condiciona su elevada prevalencia como agente causal de las micosis vaginales. Es un típico organismo oportunista que desarrolla sus capacidades patógenas cuando el sujeto presenta algún tipo de inmunosupresión o se produce la desaparición de las bacterias de la flora normal.
C. albicans se reproduce en ambiente aerobio o microaerófilo por gemación originando células hijas o blastoconidios de iguales características que las células madres. Entre los factores de patogenicidad propios de esta especie se encuentran: su termotolerancia y excelente desarrollo a 37°C, la propiedad de adherirse a receptores de células epiteliales de la vagina mediante proteínas (adhesinas) y su capacidad para producir gemaciones alargadas o seudohifas, con mayor poder invasivo25. Otros factores importantes son las proteinasas ácidas y otras enzimas tales como las lipasas y aspartil proteasas, que favorecen su poder invasivo y la protegen de la fagocitosis. Hay diversos componentes proteicos de C. albicans que actúan como antígenos produciendo fenómenos de hipersensibilidad inmediata, mediada por IgE y por células.
No se han hallado diferencias en cuanto a la capacidad de adhesividad de las levaduras al epitelio vaginal, entre la candidosis vaginal recurrente y crónica y la aguda, y se ha propuesto el concepto de reservorio de cándidas como fuente y origen de la VVCR. La posibilidad de discernir entre reinfección y recaída es muy difícil cuando la especie productora es la misma, pero el hecho de encontrar el mismo biotipo en la vagina después de un tratamiento antifúngico, hace suponer que la VVC puede tener un reservorio vaginal y que cada nuevo episodio de vaginitis corresponda a una reinfección endógena.
Manifestaciones clínicas de la vulvovaginitis candidiásica recurrenteLas manifestaciones clínicas de la VVCR son las mismas que las de un episodio aislado de VVC no complicada26. La sintomatología generalmente es menos severa pero causa molestias crónicas que repercuten seriamente en la calidad de vida de la mujer y sus relaciones de pareja.
El prurito vulvar es el síntoma más frecuente y aparece prácticamente en todos los casos (90%). La leucorrea no siempre está presente, y habitualmente es poco abundante (incluso algunas pacientes refieren sensación de sequedad). Otras molestias vulvovaginales como dolor, irritación, ardor vulvar, dolor y escozor al orinar y dispareunia son casi constantes27–29. El ardor vulvar es muy común, particularmente durante la micción (disuria vulvar). La dispareunia superficial puede ser intensa, particularmente en nulíparas, y puede progresar a una intolerancia total de la relación sexual lo que debe hacer sospechar en un síndrome de vestibulitis vulvar. La VVCR también puede ser responsable o desencadenante de vulvodinia localizada30. Es característico que los síntomas se intensifiquen en la semana previa al inicio de la menstruación, y mejoren con el inicio del sangrado10, así como que empeoren inmediatamente después de la relación sexual.
En la exploración los signos clínicos más habituales son el eritema de la mucosa vaginal y vulvar, el edema vulvar, especialmente en labios menores y clítoris, y el exudado vaginal abundante de color blanco-amarillento, espeso, grumoso, adherente y sin olor característico. Con frecuencia se observan placas blancas de aspecto grumoso y algodonoso recubriendo tanto la vagina como la vulva. El cuadro de vulvitis eritematosa puede extenderse hacia las regiones perineales e inguinales, en forma de placas eritematoso-escamosas, zonas de descamación seca con bordes geográficos o pueden presentar lesiones periféricas pápulo-pustulosas ocasionalmente con lesiones satélites. Con frecuencia aparecen excoriaciones (erosiones) y fisuras (grietas) producidas por el rascado y pueden aparecer fenómenos de liquenificación, especialmente en labios mayores.
A pesar de que todos los síntomas y signos son muy frecuentes en la VVCR, ninguno de ellos es patognomónico ni específico, por lo que el diagnóstico no debe basarse exclusivamente en la en la anamnesis y exploración física y siempre deben considerarse otras posibles etiologías, infecciosas y no infecciosas31–34. De hecho uno de los problemas más frecuentes en el manejo de la VVC, tanto aislada como recurrente, es la falta de diagnóstico correcto, pues hasta el 70% de las supuestas candidiasis vaginales, no son tales34.
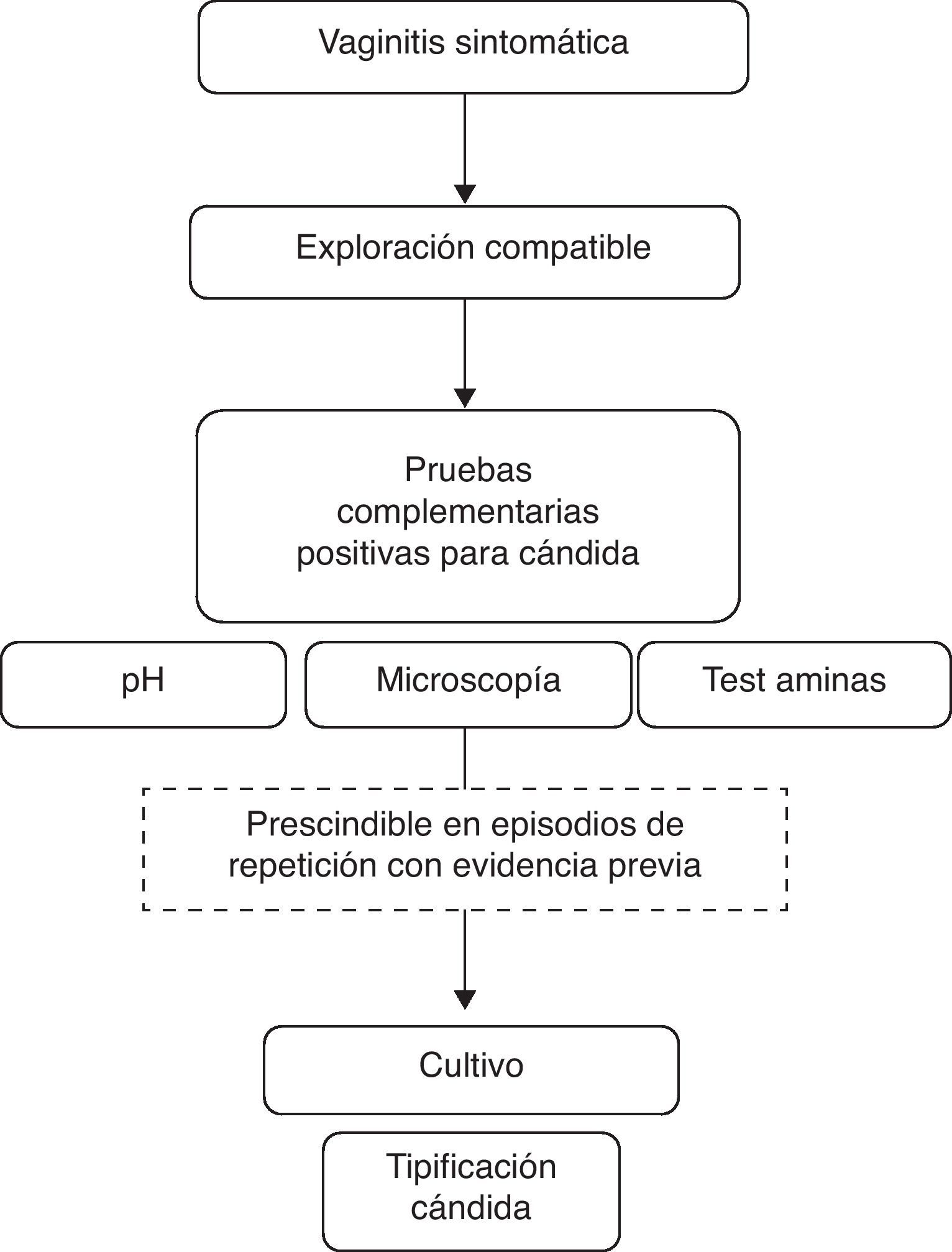
Diagnóstico de la vulvovaginitis candidiásica recurrenteLa mayoría de pacientes con síntomas de vaginitis pueden ser diagnosticadas de forma correcta en la misma consulta, con métodos tan sencillos y baratos como la medida del pH vaginal y el examen en fresco al microscopio.
La medición del pH de la secreción vaginal consiste en la aplicación de una tira de papel medidor de pH en la cara lateral de la vagina. El pH normal en vagina es ácido, entre 4,0 y 4,5, aunque en etapas de bajo nivel estrogénico, se considera normal un pH más cercano a 7. Los valores de pH superior a 4,7 son indicativos de vaginosis bacteriana, tricomoniasis o infección mixta y descartan vulvovaginitis candidiásica. Por el contrario, valores de pH inferiores a 4,5 serán compatibles con la infección candidiásica27.
El estudio de los exudados vaginales al microscopio permitirá el diagnóstico en aproximadamente el 50% de los casos. Se recomienda la toma de 2 muestras de exudado, una para visualización en fresco y otra para realizar el test de las aminas. La visualización en fresco de micelios o hifas será diagnóstico de infección por cándidas, mientras que la presencia de las llamadas «clue cells», células epiteliales con bordes oscurecidos, son indicativas de infección bacteriana y la presencia de tricomonas descarta infección por cándidas.
Para realizar el test de la aminas, se añadirá KOH al 10% a la segunda muestra de exudado. El KOH mejora la sensibilidad en el diagnóstico al microscopio al destruir los elementos celulares y facilitar la visualización de hifas (sensibilidad 65-85%)27 en caso de especies de C. albicans, o de esporas en racimos en infecciones por Candida glabrata. Si al preparar la muestra se desprende el olor a pescado característico (test de aminas positivo) será criterio diagnóstico de vaginosis bacteriana y descartará la VVC. Si en la visión al microscopio se observan muchos polimorfonucleares será sugestivo de una forma mixta de infección.
En las VVC simples, cuando la clínica, la exploración, la medición del pH vaginal y la valoración al microscopio son compatibles con el diagnóstico de candidiasis, se puede obviar la realización de un cultivo. Sin embargo, en todos los casos de clínica recurrente será preciso realizar siempre un cultivo, independientemente del resultado de las pruebas complementarias (fig. 2).
Algoritmo diagnóstico de las VVCR (adaptado de Sobel27).
El cultivo microbiológico de las muestras de exudado vaginal es una prueba muy valiosa para el diagnóstico de VVC ya que presenta una elevada sensibilidad y además permite valorar el número de colonias, el tipo de la cepa y la sensibilidad a los tratamientos8. Si se comprueba que la infección es debida a especies no albicans, como C. glabrata, C. tropicalis, C. krusei u otras, o bien por levaduras de otro género como Saccharomyces, el cultivo es especialmente relevante por la posibilidad de que sean resistentes a los antifúngicos azoles35.
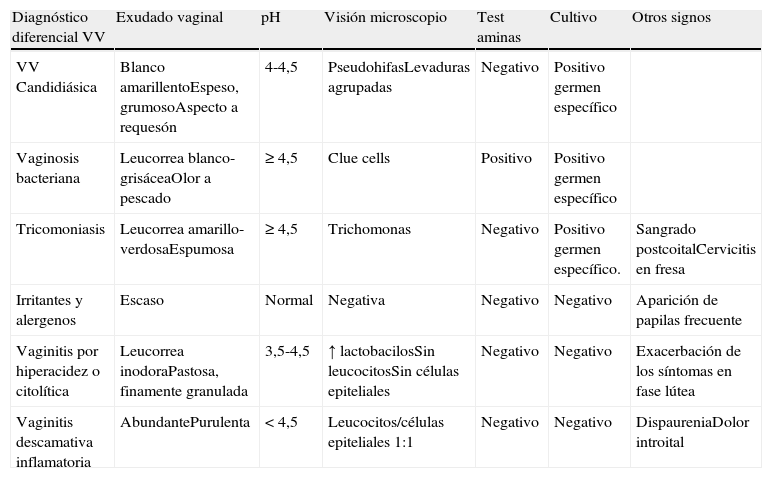
Se debe realizar el diagnóstico diferencial de las VVCR con otras vulvovaginitis recurrentes por causa infecciosa distinta de cándida (vaginosis bacteriana recurrente, tricomoniasis no diagnosticada, herpes genital recurrente) y por causas no infecciosas como las dermatitis y dermatosis (eczema, atopia, psoriasis, contacto), vaginitis atrófica, vaginitis citolítica, vaginitis descamativa inflamatoria, liquen, manifestaciones vulvares de las enfermedades del colágeno y leucorrea fisiológica (tabla 1).
Principales características de las distintas entidades que deben valorarse en el diagnóstico diferencial de las vulvovaginitis (VV)
| Diagnóstico diferencial VV | Exudado vaginal | pH | Visión microscopio | Test aminas | Cultivo | Otros signos |
| VV Candidiásica | Blanco amarillentoEspeso, grumosoAspecto a requesón | 4-4,5 | PseudohifasLevaduras agrupadas | Negativo | Positivo germen específico | |
| Vaginosis bacteriana | Leucorrea blanco-grisáceaOlor a pescado | ≥ 4,5 | Clue cells | Positivo | Positivo germen específico | |
| Tricomoniasis | Leucorrea amarillo-verdosaEspumosa | ≥ 4,5 | Trichomonas | Negativo | Positivo germen específico. | Sangrado postcoitalCervicitis en fresa |
| Irritantes y alergenos | Escaso | Normal | Negativa | Negativo | Negativo | Aparición de papilas frecuente |
| Vaginitis por hiperacidez o citolítica | Leucorrea inodoraPastosa, finamente granulada | 3,5-4,5 | ↑ lactobacilosSin leucocitosSin células epiteliales | Negativo | Negativo | Exacerbación de los síntomas en fase lútea |
| Vaginitis descamativa inflamatoria | AbundantePurulenta | < 4,5 | Leucocitos/células epiteliales 1:1 | Negativo | Negativo | DispaureniaDolor introital |
La estrategia terapéutica en las VVCR debe ser distinta de la utilizada en los episodios ocasionales. Debe basarse en la confirmación del diagnóstico mediante cultivo, la aplicación de un tratamiento específico inicial y de mantenimiento y la actuación sobre los posibles factores predisponentes. Los fármacos a utilizar serán los mismos que los empleados para los episodios de primoinfección o de infecciones ocasionales, teniendo en cuenta que en las VVCR el éxito del tratamiento requierirá aumentar su duración (tabla 2).
Estrategia farmacológica en las vulvovaginitis candidiásicas recurrentes
| Principios generales del tratamiento de las vulvaginitis candidiásicas recurrentes |
| • Los episodios agudos pueden ser tratados con los mismos fármacos que los utilizados en las formas aisladas o episódicas |
| • La duración de dichos tratamientos será más larga, hasta 1-2 semanas |
| • Para tratar adecuadamente no solo la presencia de cándidas en la vagina, sino también los posibles reservorios intestinal y cutáneo, se realizarán tratamientos combinados vaginales, orales y tópicos cutáneos |
| • La terapia de mantenimiento, de duración entre 6 y 12 meses, puede también ser realizada con imidazoles vaginales u orales y tópicos cutáneos |
| • El clotrimazol y el itraconazol son los fármacos de elección |
| - Parece fundamental el tratamiento asociado de la vulva como órgano de reservorio y para tratamiento sintomático |
Todos los fármacos utilizados en la actualidad en nuestro ámbito son imidazoles, que para el tratamiento de las VVCR tienen la desventaja de ser fungistáticos y no fungicidas8. No obstante, hay evidencia de que clotrimazol a dosis altas administradas de forma tópica a nivel vaginal actúa como fungicida.
Los imidazoles pueden ser administrados por vía tópica o local y también por vía oral. De los antifúngicos locales el más utilizado sigue siendo clotrimazol. Su eficacia terapéutica sobrepasa el 85%8 y es el patrón de referencia para los nuevos imidazoles que han ido apareciendo en el mercado. Entre los antifúngicos orales, actualmente no se aconseja el uso de ketoconazol por su hepatotoxicidad. En episodios aislados, los resultados terapéuticos son similares con ambas vías de administración, por lo que para su elección deberá tenerse en cuenta el deseo de la paciente, el tratamiento del posible reservorio intestinal36, los posibles efectos adversos de la terapia oral y las posibles interacciones con otros medicamentos.
Tratamiento inicialPara el tratamiento inicial, es preceptivo obtener la confirmación diagnóstica. Si la sintomatología aguda hace perentoria la necesidad de un tratamiento inmediato, este se iniciará tras la toma para cultivos, ya que muchos supuestos casos de VVCR son en realidad dermatitis de contacto37.
Cada episodio individual de VVCR responde habitualmente bien a los tratamientos de inducción con imidazoles orales o tópicos, si bien se debe prolongar su duración hasta que la paciente esté asintomática y se confirme la ausencia de cándidas en el exudado vaginal. Por vía tópica vaginal, el tratamiento inicial debe alargarse hasta 7-14 días: clotrimazol, 1óvulo de 100mg diario hasta 12 días o de 500mg semanal durante 2 semanas; Sertaconazol, un comprimido vaginal de 500mg semanal 2 dosis o fenticonazol, 1 óvulo vaginal de 200mg diario durante 10 días o un óvulo vaginal de 600mg durante 3 días. Por vía oral puede utilizarse fluconazol, un comprimido de 150mg cada 3 días hasta 3 dosis (días 1,4 y 7), o itraconazol 200mg (2 tabletas) al día durante 10 días (tabla 3). Aunque la respuesta inmediata suele ser similar entre ambos tipos de tratamientos, la evidencia reciente parece sugerir una menor tasa de recurrencias si se utilizan preparados por vía oral38. Estos actuarían sobre el reservorio intestinal y concretamente, Itraconazol, ha mostrado su efectividad frente a cepas de cándida resistentes a otros imidazoles, por lo que podría ser el imidazol oral de elección.
Tratamiento farmacológico inicial de las VVCR
| Tratamiento inicial de las VVCR | |
| Tratamiento tópico | |
| Clotrimazol | |
| • 1 óvulo vaginal 100 mg/día | 12 días |
| • 1 óvulo vaginal 500 mg/semana | 2 semanas |
| Sertaconazol | |
| • 1 comprimido vaginal 500 mg/semana | 2 semanas |
| Fenticonazol | |
| • 1 óvulo vaginal 200 mg/día | 10 días |
| • 1 óvulo vaginal 600 mg/día | 3 días |
| Tratamiento oral | |
| Fluconazol | |
| • Un comprimido 150mg v.o. cada 3 días | 3 dosis |
| Itraconazol | |
| • 200mg (2 tabletas) v.o./día | 10 días |
También debe considerarse el tratamiento de la zona vulvar, cuya afectación es prácticamente constante y puede contribuir a que la paciente siga presentando síntomas por recolonización de la vagina por cándidas procedentes de la región vulvar. La aplicación de tratamientos tópicos vaginales o las monodosis de triazoles orales no serán suficientes para eliminar las infecciones por cándidas en la piel, ya sea de la vulva, del periné o de zonas próximas. El tratamiento debe iniciarse con el lavado cuidadoso de la zona con jabones no ácidos, secado cuidadoso de la zona (muy importante) y aplicación del antifúngico en forma de crema 1-2 veces al día en la fase sintomática durante el período de tiempo recomendado.
Tratamiento de mantenimientoTeniendo en cuenta la dificultad en la erradicación completa de los hongos responsables, es importante recomendar un tratamiento de mantenimiento con una duración de entre 6 y 12 meses, ya que sin él la tasa de recurrencia clínica en los 3 meses siguientes es del 50%39.
Las pautas terapéuticas de mantenimiento incluyen regímenes semanales de clotrimazol 500mg, bisemanales de clotrimazol de 100mg o mensual de 500mg posmenstrual. También se utiliza fluconazol 150mg semanal por vía oral. Todo ello por un período de 6 a 12 meses40 (tabla 4). Actualmente se utiliza itraconazol oral a dosis de 200mg mensual, de preferencia al acabar el período menstrual, también durante 6 meses a un año27,41. A pesar de la continuidad de dichas pautas, alrededor del 30% de las pacientes presentará enfermedad recurrente una vez que finalicen el tratamiento. En caso de embarazo, la vía tópica vaginal será la de elección dada las repercusiones sistémicas de los imidazoles orales y su efecto teratógenico. Las pautas de administración posmenstrual se basan en la menor carga fúngica en este período, hecho que facilita la acción del fármaco. También hay que tener presente el tratamiento del posible reservorio cutáneo utilizando la vía tópica cutánea, una a 2 veces por semana hasta 6-12 meses en los casos rebeldes de VVCR.
Tratamiento farmacológico de mantenimiento de las VVCR
| Tratamiento de mantenimiento de las VVCR | |
| Tratamiento tópico | |
| Clotrimazol | |
| • 1 óvulo vaginal 500 mg/semana | 6-12 meses |
| • 1 óvulo vaginal 500 mg/postmenstrual | 6-12 meses |
| Sertaconazol | |
| • 1 comprimido vaginal 500 mg/semana | 6-12 meses |
| Fenticonazol | |
| • 1 óvulo vaginal 600 mg/semana | 6-12 meses |
| Tratamiento oral | |
| Fluconazol | |
| • 1 comprimido 150mg v.o. /semana | 6-12 meses |
| Itraconazol | |
| • 1 comprimido 100mg v.o. /día | > 6 meses |
| • 200mg (2 tabletas) v.o./posmenstrual | 6-12 meses |
| Ketoconazol | |
| • un comprimido 100mg v.o. /día | 6-12 meses |
Más de la mitad de las cepas de Candida glabrata no son sensibles a fluconazol y de ahí que sean de elección otros azoles orales como itraconazol. Como alternativa en los casos de recurrencia se recomienda la utilización diaria de cápsulas intravaginales de 600mg de ácido bórico durante 2 semanas y en casos rebeldes prolongar el tratamiento 2 veces por semana de 6 a 12 meses42. En casos excepcionales de multirresistencia puede contemplarse la aplicación vaginal de flucitosina, sola o combinada con la amfotericina B43. Las vaginitis por Candida krusei son resistentes a fluconazol y a flucitosina pero responden adecuadamente al tratamiento con ac. bórico y a los imidazoles modernos.
Estrategias futuras en el tratamiento de las vulvovaginitis candidiásicas recurrentesEl tratamiento de mantenimiento ha mostrado su utilidad para incrementar la calidad de vida de las pacientes afectas de VVCR pero no tanto para conseguir una auténtica curación, por lo que deberían considerarse otras estrategias y planteamientos terapéuticos44.
Actualmente se está trabajando en el papel que pueden tener los probióticos y el restablecimiento estricto de la flora vaginal en la lucha contra la VVCR. También se estudia la utilización tópica intravaginal de lecitinas recombinantes que se unen a la manosa, para aumentar los mecanismos naturales de defensa en la vagina45. Una nueva generación de triazoles como boriconazol podrían ejercer una acción supresora de mayor duración y distanciar su empleo46, pero tiene un elevado precio. Todavía no se dispone de vacunas anticandidiásicas para su uso clínico, aunque ya han mostrado su utilidad en animales de laboratorio47. Otros procesos a investigar para conocer y actuar de forma más adecuada frente a la VVCR son el estudio de la susceptibilidad genética del huésped, los mecanismos inmunitarios del epitelio vaginal contra la cándida y la misma dotación genética de las cándidas48. Está aún por ver el papel que pueden representar las llamadas terapias alternativas en el control de estas VVCR, aunque se debe tener muy presente la opinión de la propia paciente y sus preferencias en lo que se refiere a estas formas de tratamiento alternativo49.
Prevención de la vulvovaginitis candidiásica recurrenteLas opciones para la prevención de la VVCR son muy limitadas aunque claramente necesarias. Ante cualquier episodio aislado de VVC se deben valorar posibles medidas que ayuden a disminuir el riesgo de nuevos episodios. Las principales vías de actuación van dirigidas a mantener o reequilibrar la flora vaginal y reducir el impacto de los factores de riesgo de la VVCR. No obstante, exceptuando la eliminación del agente causal con el tratamiento profiláctico para evitar reinfecciones o recidivas, no existen evidencias científicas de la eficacia de ninguna otra medida preventiva.
Para mantener el equilibrio de la flora vaginal bacteriana, se ha propuesto el uso de probióticos50, organismos vivos incluido el lactobacillus, que podrían actuar contribuyendo al balance microbiano intestinal e inhibiendo el crecimiento de bacterias patógenas. Sin embargo, la disparidad de resultados en los estudios realizados hasta ahora ha generado muchas críticas.
Para reducir los factores de riesgo se ha señalado la conveniencia de utilizar ropa holgada, preferiblemente de algodón, para evitar que se modifiquen las condiciones de temperatura y humedad del entorno perineal que favorecerían el crecimiento de cándida9. También se ha propuesto el consumo de yogur como medida profiláctica aunque algunos datos publicados son contradictorios51,52. Otra medida sería reducir la ingesta de hidratos de carbono ya que los alimentos altamente calóricos con alto contenido en hidratos de carbono favorecen el crecimiento de cándida en el tracto intestinal y urinario, que actúan como reservorios y representan un factor de riesgo de VVCR. Aunque alguna publicación señala el beneficio obtenido en mujeres con VVCR a las que se recomienda una dieta baja en hidratos de carbono53, todavía no existe suficiente evidencia científica para establecer unas recomendaciones estrictas sobre la dieta. El tratamiento antifúngico de las parejas sexuales de mujeres con VVCR6 no está justificado en base a las evidencias científicas y solo debe establecerse tratamiento con antifúngicos tópicos cuando el propio compañero presente signos o síntomas de balanitis. Respecto a la higiene íntima, tanto el exceso como el defecto pueden alterar el equilibrio de la flora vaginal, por lo que se recomienda utilizar productos especialmente formulados para la zona vaginal que mantienen el pH adecuado evitando la proliferación de microorganismos patógenos.
Actualmente siguen en estudio otras estrategias que persiguen modificar la susceptibilidad de las mujeres con VVCR ante candida, como son la inmunoterapia con alergenos de C. albicans54, los antagonistas de los receptores de leucotrieno55 o los inhibidores de la recaptación de serotonina (sertralina)56, medidas que ofrecerían una nueva oportunidad de tratamiento a mujeres con intolerancia a la terapia de mantenimiento con azoles.
Situaciones especiales en las vulvovaginitis candidiásicas recurrentesExisten factores hormonales, metabólicos y iatrogénicos (antibióticos de amplio espectro, corticoides) que resultan relevantes en la etiopatogenia de la VVC/VVCR y, por lo tanto, determinadas situaciones clínicas en las que es esperable este tipo de infección recurrente. La cándida necesita carbono para su proliferación y, por ello, todas las situaciones que favorezcan modificaciones del pH vaginal normal y la presencia de Carbono serán factores favorecedores de la infección57.
EmbarazoDurante el embarazo la vagina es más susceptible a cualquier infección. Las tasas de colonización de la gestante por Candida spp descritas en las publicaciones son siempre superiores a las de la mujer no embarazada. Según una revisión publicada recientemente hasta un 28% de gestantes puede mostrar Candida spp en el flujo vaginal58. Como mecanismos patogenéticos se han descrito el incremento del nivel estrogénico que da lugar a un aumento de contenido en glucógeno en el medio vaginal, una mayor adhesividad de las células epiteliales vaginales y una potenciación de la formación de micelos por la presencia de receptores específicos para estrógenos en el citosol de las levaduras. Asimismo, la reducción de la inmunidad local facilita la colonización de la vagina y la posterior infección.
El tratamiento de la VVC durante el embarazo debe ser intensivo. La mujer gestante tiene una respuesta más lenta y un elevado riesgo recidiva, por lo que se debe tratar siempre para evitar, en última instancia, la afectación del feto en el canal del parto. En general, todos los preparados tópicos pueden ser utilizados durante la gestación, al contrario de los preparados orales o parenterales por el posible riesgo teratogénico. Actualmente los imidazoles tópicos (clotrimazol 1%) son los más utilizados. Se recomienda una duración de 1-2 semanas, aunque está comprobada la eficacia de una dosis única de clotrimazol preparto para reducir la colonización vaginal en un 10% y la infección neonatal en un 1-2%59.
DiabetesEl aumento de la prevalencia de candidiasis en mujeres diabéticas, sobre todo las mal controladas, sigue siendo motivo de controversia dado que los mecanismos de esta asociación no están bien definidos. Muchas publicaciones concluyen que la mujer diabética mal controlada tiende a tener más recidivas, más resistencia al tratamiento y más presencia de cándida no albicans tipo C. glabatra y C. tropicales41,60. Los potenciales factores etiopatogénicos son fundamentalmente el tipo de diabetes, su gravedad y el grado de control hidrocarbonado. Asimismo, parece que existe una fuerte asociación entre colonización por cándida en la mujer diabética y el uso de antibióticos, infecciones previas por chlamydia, tipo de diabetes y nivel de hemoglobina glucosilada, siendo más difusa su asociación con el comportamiento sexual.
AdolescenciaDurante la pubertad se inicia un incremento de estrógenos circulantes que permite, entre otros, la maduración del epitelio vaginal y la aparición de los lactobacilos de Döderlein (LBD) de la flora vaginal. La conversión del glucógeno a lactato por estos LBD y la aparición de H2O2 durante la exfoliación de células intermedias y superficiales del epitelio hacen que el pH vaginal disminuya de 6 hasta los 3,5-4. Si ese equilibrio se altera por cualquier motivo, los LBD decrecen, el pH aumenta y los microorganismos, que habitualmente están controlados, proliferan. Las tasas de prevalencia de colonización e infección por cándidas en adolescentes pueden variar mucho según las publicación60, pero no parece que la adolescencia por sí misma aumente la incidencia de VVC/VVCR sino que, en todo caso, está más relacionada con una mayor presencia de factores conocidos capaces de alterar la flora vaginal como infecciones externas (gardnerellas, cándidas, trichomonas,..), hábitos de higiene, uso de ropa inapropiada, embarazo, antibióticos, anticonceptivos con alto nivel estrogénico, etc. La colonización de cándida en adolescentes se considera tan frecuente o más que en las mujeres en edad sexual madura, pero en la práctica las vaginitis sintomáticas son menos habituales probablemente en relación a factores inmunológicos locales61.
MenopausiaEl bajo nivel estrogénico de las mujeres en la posmenopausia favorece, en principio, la reducción de células intermedias y superficiales que tienen mayor adherencia a las cándidas, alejando así la posibilidad de VVC. No obstante, hasta un tercio de las mujeres posmenopáusicas pueden tener vaginitis, muchas veces de tipo candidiásico, asociada a distintos factores de riesgo (otras infecciones vaginales, dermatitis alérgicas, etc.), diabetes, uso de antibióticos, tratamientos propios de esta edad, como la terapia hormonal sustitutiva o el tamoxifeno, e incluso el tipo de actividad sexual. Solo en un tercio de casos la vaginitis sintomática es de origen infeccioso, mientras que en 2 de cada 3 casos tiene su origen en el déficit de estrógenos, irritantes locales o alergenos y patologías dermatológicas.
InmunosupresiónLas situaciones de inmunosupresión congénita o adquirida, como la infección por VIH, las enfermedades sistémicas autoinmunes que precisan de corticoterapia, las dermatosis, etc. facilitan la colonización por cándida y la posterior vaginitis VVC/VVCR. Sin embargo, en la práctica clínica la inmunosupresión es una rara causa de VVC/VVCR y su búsqueda solo está indicada si hay otros datos que lo sugieran41.
FinanciaciónLa redacción de este manuscrito ha sido financiada por Bayer Healthcare.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.