Los tumores de músculo liso no siempre son fáciles de clasificar. Presentamos un caso de tumor de músculo liso de potencial maligno incierto que tras 16 meses de la cirugía ha metastatizado como un leiomiosarcoma retroperitoneal en la fosa obturatriz izquierda.
Uterine smooth-muscle tumors are not easy to classify. We report a case of uterine smooth-muscle tumor of uncertain malignant potential, which metastasized to retroperitoneal leiomyosarcoma in the left obturator cavity.
Los sarcomas uterinos son tumores de origen mesodérmico. Constituyen el 1% de todas las lesiones malignas ginecológicas y un 2-4% de las lesiones malignas del útero. Su incidencia es baja, pero su mortalidad es muy elevada por el comportamiento tan agresivo que presentan.
Microscópicamente, la mayoría de los leiomiosarcomas tienen criterios de malignidad, como hipercelularidad, necrosis coagulativa, mitosis abundantes (más de 10 mitosis por 10 CGA), y atipias mitóticas y celulares. Cuando estas características son claras, no existen dudas diagnósticas, pero a veces, cuando existe una atipia de menor grado, una menor actividad mitótica o una hipercelularidad no tan marcada, la clasificación puede ser más compleja.
Presentamos un caso de tumor de músculo liso de potencial maligno incierto que tras 16 meses de la cirugía ha metastatizado como un leiomiosarcoma retroperitoneal en la fosa obturatriz izquierda.
CASO CLÍNICOPaciente de 50 años, con hipermenorrea anemizante, diagnosticada de útero miomatoso que desplazaba la cavidad. En la ecografía se observó un mioma intramural de 8,2×7,2cm en el lado izquierdo. En contacto con el mioma, protusionando en la cavidad endometrial, se observó un área sólida de 2,6×2,5cm que sugería un pólipo endometrial. Se realizó una histerectomía sin anexectomía. El resultado anatomopatológico fue de tumor de músculo liso de potencial maligno incierto. Histológicamente, mostraba un límite con miometrio normal con áreas irregulares y existía alguna lengüeta que penetraba en el miometrio. El índice mitótico fue de 5 mitosis por 10 campos de gran aumento (CGA). El músculo liso no presentaba atipias. Existían áreas de hemorragia. El cérvix no tenía alteraciones significativas. Presentaba además un pólipo fibroepitelial, que se había referido en la ecografía. Se decidió realizar controles seriados clínicos y ecográficos cada 3–4 meses, que resultaron normales.
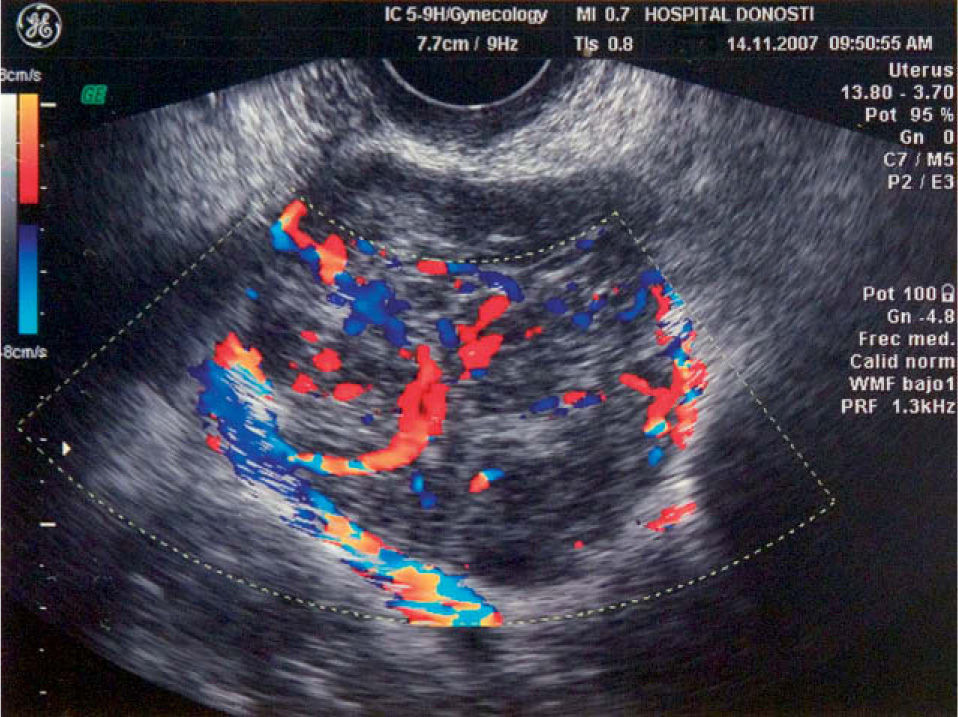
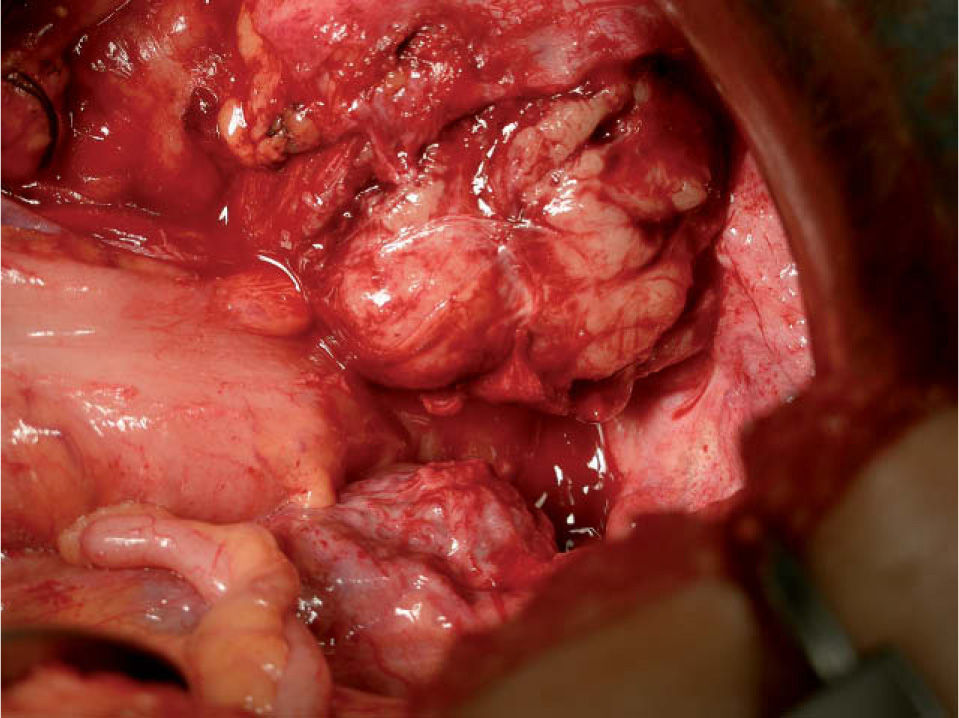
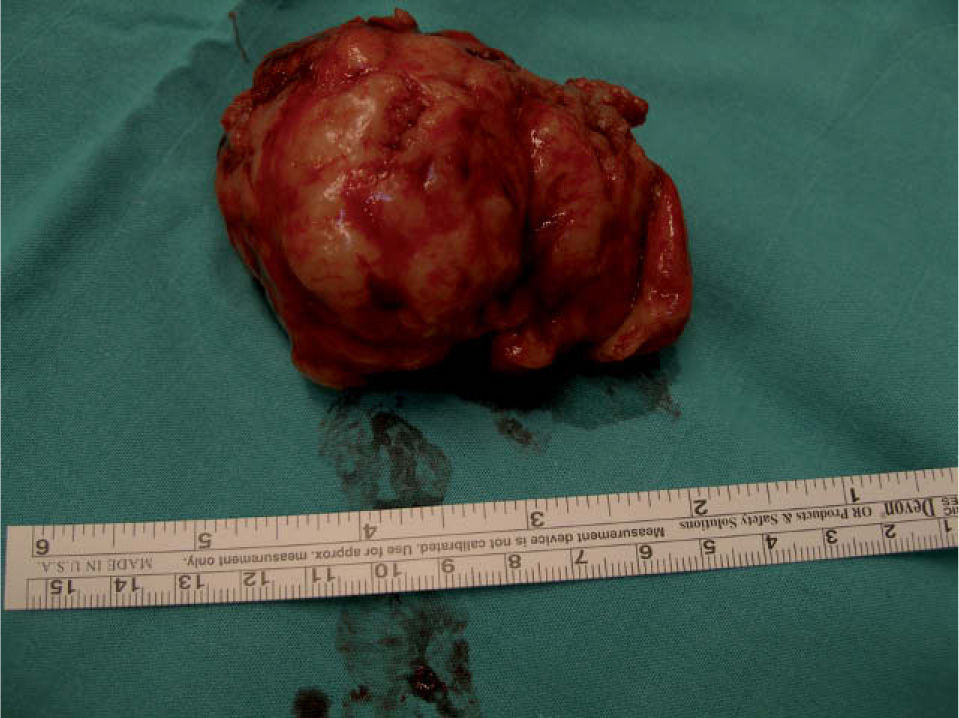
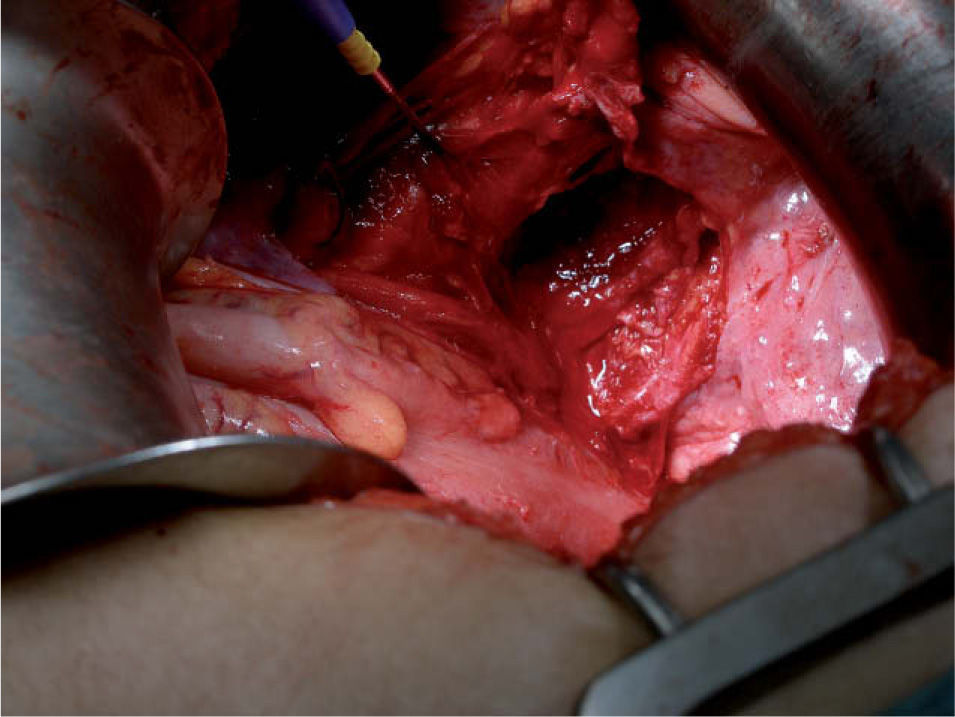
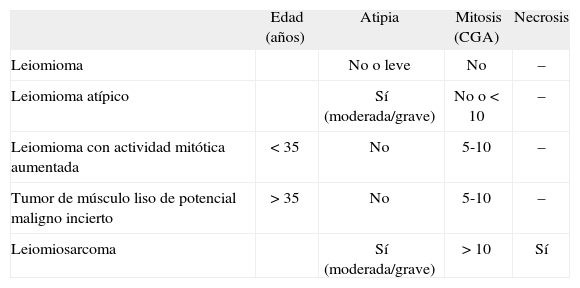
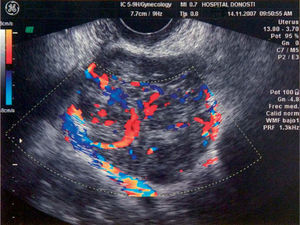
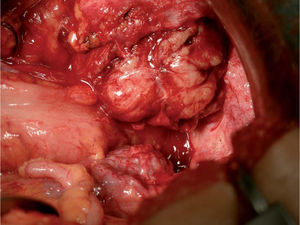
A los 16 meses, encontrándose la paciente asintomática, se observó por ecografía una imagen que parecía depender del ovario izquierdo, de 5,2×4,7cm, sólida y bien delimitada. Mediante Doppler se observó un mapa vascular abigarrado intratumoral, con flujos de baja e intermedia resistencia, que la hacía sospechosa (fig. 1). Se planteó realizar una biopsia de la lesión y tras, un estudio preoperatorio normal, se realizó una laparotomía media en la que se observó una masa retroperitoneal izquierda (fig. 2). Se realizaron lavados peritoneales, cepillado de ángulos diafragmáticos, se abrió el peritoneo y se observó una masa de 7–8cm en la fosa obturatriz izquierda, que desplazaba lateralmente los vasos ilíacos externos, y medialmente el uréter izquierdo. Se resecó la tumoración y se realizó una anexectomía bilateral. La revisión de la cavidad fue normal. Se trataba de una formación irregularmente nodular, de 8cm de diámetro máximo y de superficie externa lobulada (fig. 3), que se envió a anatomía patológica. El diagnóstico final es de leiomiosarcoma retroperitoneal con atipia moderada, necrosis y un índice mitótico de 14 mitosis por 10 CGA. Los ovarios no presentaban infiltración tumoral (fig. 4).
En el comité de oncología se decidió el uso de tratamiento quimioterápico con adriamicina e ifosfamida y el posterior tratamiento radioterápico.
DISCUSIÓNLos sarcomas uterinos son tumores de origen mesodérmico. Constituyen el 1% de todas las lesiones malignas ginecológicas y un 2-4% de las lesiones malignas del útero1. Su incidencia es baja, pero su mortalidad es muy elevada por el comportamiento tan agresivo que presentan.
El grupo de oncología ginecológica americano (GOG) adoptó una clasificación agrupando los sarcomas uterinos en cuatro grandes grupos histológicos, que por su sencillez facilita la labor del clínico2. En orden decreciente de frecuencia, los grupos son los siguientes: tumor mülleriano mixto (40-50%), leiomiosarcoma (25-36%), sarcoma del estroma endometrial (15%) y otros sarcomas uterinos (5%)1–3. Según estudios realizados en España y en Europa, los sarcomas más frecuentes son los leiomiosarcomas4,5.
Los leiomiosarcomas son tumores puros compuestos por un único tipo celular. Aparecen como grandes masas tumorales blanco-amarillentas, únicas, y exhiben áreas de hemorragia y necrosis6. Generalmente, no son tumores dependientes de hormonas y se estima que un 0,23% de los leiomiomas degeneran a sarcoma7,8.
La edad media de aparición es alrededor de los 50 años9, en cierto grado, más baja que aquélla en la que se manifiestan otros sarcomas uterinos. Esta lesión maligna carece de relación con la paridad. La clínica suele ser inespecífica y de duración media de 6 meses, y entre los síntomas que se pueden observar hemorragia, dolor o presión en la pelvis, e incluso la percepción de una tumoración pélvica9,10.
Microscópicamente, la mayoría de los leiomiosarcomas tienen criterios de malignidad, como la hipercelularidad, necrosis coagulativa, mitosis abundantes (más de 10 mitosis por 10 CGA), y atipias mitóticas y celulares7,11. Cuando estas características son claras, no existen dudas diagnósticas, pero a veces, cuando existe una atipia de menor grado, una menor actividad mitótica o una hipercelularidad no tan marcada, la clasificación puede ser más compleja. Son tumores con características más preocupantes que los leiomiomas benignos, pero que no cumplen los criterios histológicos de los leiomiosarcomas; su comportamiento también difiere de estos últimos12,13.
- –
Cuando no existe atipia o esta es leve, y además no existe necrosis, el tumor es un leiomioma. Sin embargo, si la atipia es moderada o severa sin necrosis, en ese caso sí se deben contar las mitosis. Si existen menos de 10 mitosis por 10 CGA nos encontramos ante un leiomioma atípico. Sin embargo, si se observan más de 10 mitosis por 10 CGA, es un leiomiosarcoma.
- –
Si existe una atipia moderada o severa y necrosis, la tumoración será un leiomiosarcoma, incluso sin tener en cuenta las mitosis.
Muchos autores creen que la actividad mitótica es el indicador único más fiable del potencial de malignidad, aunque el nivel exacto de la actividad requerida para ello no está tan claro8. La mayoría de los investigadores concuerda en que los tumores con menos de 5 mitosis por 10 CGA suelen comportarse de manera benigna, con una supervivencia del 98%, y que los que tienen más de 10 mitosis por 10 CGA son francamente malignos y tienen mal pronóstico, con una supervivencia del 15%. Los tumores con 5 a 10 mitosis/10 CGA son menos definidos a este respecto y muchos reaparecerán o harán una metástasis, con una supervivencia del 42%. Un estudio de gran tamaño de Stanford sugiere que el uso de la actividad mitótica, la atipia nuclear y la presencia de necrosis servirían para clasificar los tumores de músculo liso como de bajo y alto riesgo de malignización12.
Otros autores, sin embargo, usando los mismos criterios del estudio de Stanford, clasifican los tumores como entidades con nombre propio. Así, clasifican los leiomiomas con una actividad mitótica aumentada (más de 5 mitosis/10 CGA) y sin atipia celular como leiomiomas benignos, con actividad mitótica aumentada cuando aparecen en mujeres de menos de 35 años14. Estos tumores tienen, normalmente, un comportamiento benigno, están bien circunscritos y suelen ser pequeños. Si estos tumores aparecen en mujeres mayores de 35 años, se ha visto que el comportamiento es más impredecible y se designan como tumores de músculo liso de potencial maligno incierto, como es nuestro caso en la pieza de histerectomía8,15. Muchas de estas pacientes son tratadas con una histerectomía simple y tienen un mejor pronóstico que los leiomiosarcomas. Cuando los miomas tienen únicamente atipia celular, sin necrosis ni mitosis, se llaman leiomiomas atípicos y se consideran una variante de los miomas uterinos y presentan un alto porcentaje de curación con la cirugía13 (tabla 1).
Clasificación
| Edad (años) | Atipia | Mitosis (CGA) | Necrosis | |
| Leiomioma | No o leve | No | – | |
| Leiomioma atípico | Sí (moderada/grave) | No o<10 | – | |
| Leiomioma con actividad mitótica aumentada | < 35 | No | 5-10 | – |
| Tumor de músculo liso de potencial maligno incierto | > 35 | No | 5-10 | – |
| Leiomiosarcoma | Sí (moderada/grave) | > 10 | Sí |
CGA: campos de gran aumento.
La estadificación de los sarcomas es posquirúrgica y es la misma que la establecida por la FIGO para el carcinoma de endometrio10. Las metástasis linfáticas suelen ser de un 3-4% en los leiomiosarcomas2. La extensión por vía hematógena, en especial a los pulmones y el hígado, puede ocurrir en fases tempranas de la enfermedad. La persistencia y la recurrencia suelen ser frecuentes16. Por ello, se recomienda realizar un estudio torácico preoperatorio mediante tomografía computarizada si se dispone del diagnóstico previamente y, en caso contrario, realizarlo de forma posquirúrgica.
Para la estadificación se recomiendan la histerectomía y la doble anexectomía, los lavados peritoneales para el estudio citológico, la extirpación de ganglios palpables y la biopsia de cualquier área sospechosa10,17. La importancia de la linfadenectomía no está muy clara, porque aunque la afectación ganglionar ha demostrado tener significado pronóstico, no ha demostrado tener eficacia terapéutica: los resultados de las pacientes que se sometieron a linfadenectomía fueron comparables con los de las pacientes a quienes no se les practicó la escisión ganglionar18. Por ello, algunos autores únicamente recomiendan la disección ganglionar en las mujeres en las que, por la exploración clínica, se sospeche su afectación19.
La radioterapia adyuvante poscirugía parece conseguir un mejor control local de la enfermedad, aunque se desconoce su beneficio sobre la supervivencia. El uso de la quimioterapia neoadyuvante tiene, igualmente, un beneficio incierto.
En los estadios avanzados, se recomienda el uso de quimioterapia. No hay consenso sobre el mejor régimen de quimioterapia adyuvante. Según la literatura científica, los más utilizados son docetaxel y gemcitabina17. La mayoría de las metástasis ocurren en la pelvis, seguida de los pulmones y el abdomen. Las metástasis de cerebro y hueso no suelen ser comunes20.