La leucemia promielocítica aguda (LMA), también conocida como M3 de la clasificación French-American-British (FAB), se presenta en el 80% de los casos como síndrome hemorrágico grave que cuando aparece en estado de gestación, pone en peligro no solo la vida de la paciente sino también la del feto. Los resultados de estudios multicéntricos sugieren que el uso concomitante con ácido transretinoico (ATRA) e idarrubicina (IDA) constituye el tratamiento más efectivo para controlar los efectos antileucémicos. Presentamos el caso de una mujer de 32 años, en la semana 33 de gestación, con trastornos graves de coagulación por LMA, que ingresó en la unidad de cuidados intensivos con insuficiencia respiratoria por lesión pulmonar aguda. Mostramos el manejo terapéutico, la evolución inicial de la enfermedad dado lo inusual del caso y las implicaciones pronósticas del tratamiento durante la gestación.
Acute promyelocytic leukemia, also known as M3 in the French-American-British classification, presents as severe hemorrhagic syndrome in 80% of affected pregnant women, posing a lethal threat to both mother and fetus. The results of multicenter studies suggest that the most effective treatment consists of the concomitant use of all-trans retinoic acid plus idarubicin. We present the case of a 32-year-old woman at 33 weeks of pregnancy with severe coagulation abnormalities due to acute promyelocytic leukemia, who was admitted to the intensive care unit for respiratory insufficiency due to an acute pulmonary lesion. The interest of this case lies in its infrequency. We describe the therapeutic management and initial course of the disease, as well as the prognostic implications of treatment during pregnancy.
La leucemia promielocítica aguda (LMA) es un tipo de leucemia mieloide aguda con una presentación clínica y biológica diferente1. Se caracteriza por promielocitos malignos que presentan una traslocación entre los brazos largos de los cromosomas 15 y 17. Como consecuencia de esta traslocación se produce una fusión del gen situado en el locus 15q22 (gen PML) con el gen del ácido transretinoico (RARα)2. La expresión resultante (gen PML-RARα) produce una proteína híbrida con efectos de ruptura sobre los cuerpos nucleares, bloqueando el paso de maduración de promielocitos a mielocitos y evitando la diferenciación mieloide3. La presencia de receptores α-transretinoico en las proteínas híbridas explica que el uso de ácido transretinoico (ATRA) administrado terapéuticamente induzca el paso de promielocito a mielocito, ocasionando un gran número de remisiones4,5.
Se conocen dos variantes morfológicas de la LMA, la forma hipergranular presente en la mayoría de los casos y la microgranular presente solo en el 15-20% de los casos. Ambos tipos son fuertemente positivos a las tinciones con negro de Sudán y mieloperoxidasa3.
Una de las principales características clínicas es la presencia de síndrome hemorrágico grave hasta en el 80% de los pacientes6, históricamente relacionado con una coagulación intravascular diseminada aunque en la actualidad, dados los hallazgos de laboratorio, la diátesis hemorrágica apunta a un proceso de fibrinólisis y proteolisis inespecífico. A pesar de los avances en el tratamiento de los desórdenes en la coagulación, la hemorragia cerebral sigue siendo la primera causa de mortalidad durante la inducción3.
La incidencia en la presentación de LMA durante la gestación se ha estimado en 1 de cada 75.000 a 100.000 embarazos. La coexistencia de LMA y embarazo es muy rara y existen pocos casos publicados en la literatura médica7.
Caso clínicoMujer de 32 años, gestante de 33 semanas, que acude a Urgencias del hospital por cuadro de erupción cutánea tipo púrpura y gingivorragia, de escasa cuantía, de dos semanas de evolución. Tras practicar una primera analítica sanguínea, se evidencia plaquetopenia y leucopenia intensa. Se deriva a los Servicios de Ginecología y Hematología para estudio. Tras su ingreso se repite analítica sanguínea con resultado de leucocitos 1,17 x 109/l con 0,6 x 109/l neutrófilos y 0,4 x 109/l linfocitos, plaquetas 2 x 109/l, dímeros D 1.800 mcg/l, hemoglobina 9,9 gr/l, y tiempos de coagulación normales. Se realiza un frotis en sangre periférica en el que se aprecian células grandes indiferenciadas. Posteriormente se practica punción de médula ósea, ante la sospecha de LMA. Con tinción negro de Sudán se identifica patrón granular grosero que llega a ocupar el 100% del citoplasma, granulación azurófila y cuerpos de Auer múltiples en el 1% de los blastos. Tras estudio citogenético se aprecia reordenamiento PML/RARα en el 93% de la población nucleada medular, lo que confirma el diagnóstico de LMA con traslocación t(15;17) PML/RARα en la clasificación de la OMS.
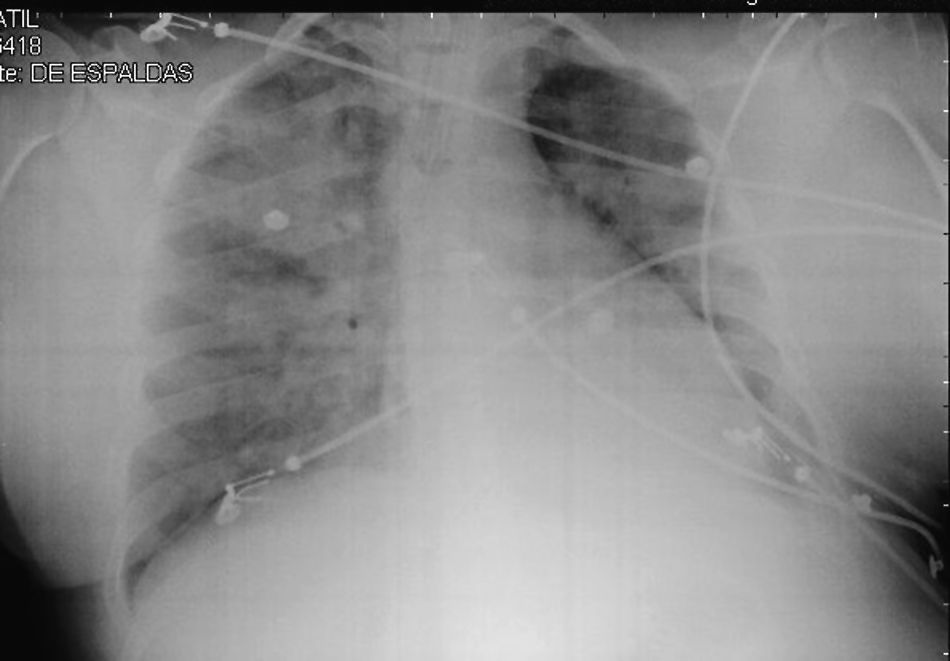
Dada su situación clínica y la alta probabilidad de trastornos hemorrágicos graves secundarios a la LMA, se inicia tratamiento con ATRA a 45mg/m2/día, seguido 24 horas más tarde con idarrubicina (IDA) a 12mg/m2/día. Se realiza transfusión de plaquetas. A las pocas horas del inicio de tratamiento, la paciente comienza con intensa sensación de disnea y taquipnea, acompañada de tos y desaturación de oxígeno (por pulsioximetría) hasta el 80% con oxígeno suplementario en mascarilla y fracción inspirada de oxígeno (fiO2) al 40%. Se realiza radiografía de tórax (fig. 1), en la que se observa patrón de edema alveolar diseminado bilateral. En ese momento se decide su ingreso en la unidad de cuidados intensivos (UCI).
Se practica de nuevo analítica sanguínea con resultado de leucocitos 2,34 x 109/l con neutrófilos 0,9 x 109/l, plaquetas 46 x 109/l, fibrinógeno 1,1g/l, dímeros D 2.700 mcg/l, Hb 6,6 gr/l. Se inicia tratamiento con dexametasona a 12mg/día.
La situación clínica de la paciente empeora de forma rápida y progresiva con gran dificultad respiratoria y caída de la presión parcial de oxígeno en sangre arterial (PaO2). Se inicia ventilación mecánica no invasiva hasta llegar a altos niveles de presión de final espiratorio (PEEP) de 10mmHg, a pesar de lo cual el índice PaO2/fiO2<200 con pH<7,30. Gran compromiso hemodinámico y fracaso en la mecánica ventilatoria obligan a intubación orotraqueal y ventilación mecánica invasiva (VMI). Dada la ausencia de semiología del origen cardiogénico del cuadro, se inician maniobras de reclutamiento alveolar con Vt bajos según el protocolo del ensayo clínico Acute Respiratory Distress Syndrome Network (ARDSnet)8, actualmente implementado en nuestra unidad, consiguiéndose mejoría de la saturación arterial de oxígeno (satO2) y subir el índice PaO2/fiO2 a 265. Hasta ese momento, mala situación clínica, hematuria franca y hematoma lingual y orofaríngeo, posiblemente secundarios a las maniobras de intubación orotraqueal. Transfundidas unidades de concentrados de hematíes y pool de plaquetas, se realiza ecografía abdominal y ante la sospecha de sufrimiento fetal, se decide practicar cesárea ístmica transversa, a pesar del riesgo de sangrado. Se extrae feto vivo de bajo peso y con cierta inmadurez pulmonar pero sin deformidades ni secuelas del tratamiento realizado hasta el momento. Reingresa la paciente en UCI en situación similar a la previa con hemorragia posquirúrgica. Durante las 36 horas siguientes la paciente se estabiliza clínicamente, con mejoría manifiesta en los parámetros analíticos y de intercambio gaseoso, pudiendo ser desconectada de respirador y retirado el soporte hemodinámico con aminas vasoactivas. A los 6 días de su ingreso fue dada de alta a la Unidad de Hematología para continuar el tratamiento de su enfermedad.
DiscusiónDesde el inicio del tratamiento con ATRA en la LMA9 hasta la actualidad, se ha avanzado mucho en el tratamiento de este tipo de leucemias. Estudios recientes, basados en regímenes con ATRA y antraciclinas, cifran una frecuencia de remisión completa entre el 90 y el 95%, con una supervivencia libre de enfermedad a los 5 años del 74%10. Sin embargo, en el caso de embarazo y LMA es complicada la decisión terapéutica por los efectos teratogénicos de la quimioterapia y el aumento de riesgo de infecciones por la mielosupresión de la madre, además del incremento en el riesgo de sangrado útero-vaginal11. A pesar de ello, la experiencia limitada en casos similares sugiere que el tratamiento con ATRA, solo o asociado a quimioterapia, constituye una razonable estrategia en el segundo o tercer trimestre de gestación12.
En esta paciente, la gestación en su tercer trimestre y la rápida evolución en el deterioro hematológico fueron suficiente motivo para iniciar tratamiento con ATRA e IDA. El deterioro rápido de la función respiratoria, con aparición de infiltrados pulmonares y grave compromiso de la oxigenación (PaO2/fiO2<200), a pesar de la ventilación mecánica no invasiva, nos hizo sospechar la existencia de un síndrome del ATRA, descrito como complicación característica del tratamiento de las LMA13, sin embargo nos inclinamos a pensar que se trataba de un síndrome de hiperpermeabilidad capilar, dada la ausencia de fiebre, la mejoría en la oxigenación tisular con las maniobras de reclutamiento pulmonar, la buena evolución posterior y la ausencia de leucocitosis, relacionada globalmente, como piensan algunos autores, como factor predictivo con el síndrome ATRA14. Ambos cuadros, posiblemente con mecanismo patogénico común, aunque desconocido, se relacionan con la liberación de citoquinas vasoactivas (interleucina 1, interleucina 6, interleucina 8 y factor de necrosis tumoral alfa) que producen aumento de la permeabilidad capilar por mecanismo de producción de óxido nítrico, como se ha sugerido14,15. No obstante, desde su ingreso se inició tratamiento esteroideo para cubrir la posibilidad de esta complicación16.
Dado el empeoramiento clínico abrupto, la decisión de practicar cesárea se tomó en base a la alta sospecha de sufrimiento fetal, a pesar de las posibilidades de sangrado quirúrgico pero con asumible riesgo, una vez conseguidas cifras de plaquetas de 45 x 109/l, INR 1,21 y fibrinógeno en 1,1g/l, con reposición de plaquetas, plasma y fibrinógeno.
La buena evolución clínica posterior se explica por el apoyo de soporte ventilatorio, hematológico y hemodinámico agresivo, la terminación del estado de gestación y el tratamiento temprano con ATRA e IDA, así como a la edad y ausencia de comorbilidad asociada, a diferencia de otros casos publicados17 con mal resultado, sobre todo por complicaciones hemorrágicas.
Aunque el resultado final ha sido en este caso niño nacido sin secuelas derivadas del tratamiento con ATRA e IDA para la LMA18, la decisión final sobre la cesárea debe tomarse en base al consentimiento informado, el conocimiento de las implicaciones médico-legales y la discusión interdisciplinar entre especialidades implicadas que ayuden a la mejor decisión en el proceso, coincidiendo con la opinión de otros autores en casos similares11.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.