INTRODUCCION
Las lesiones epiteliales preinvasoras se caracterizan por presentar atipia celular y tener la posibilidad de progresar a enfermedad invasora. En la vulva se ha descrito como tales, a lo largo del tiempo, una serie de entidades clinicopatológicas con una terminología variada, y a menudo confusa, cuya sistematización y clasificación no han sido fáciles. Actualmente se unifican dentro del concepto de neoplasia vulvar intra-epitelial (VIN)1. Su identificación y tratamiento tienen como objetivo la prevención secundaria del cáncer escamoso de la vulva. Las lesiones intraepiteliales de la vulva incluyen también dos entidades muy raras de tipo no escamoso, la enfermedad de Paget y el melanoma in situ. Aunque en ambas entidades se reconoce que en algunos casos existe una fase intraepitelial, y así se debe hacer constar, se aconseja clasificarlas junto con su correspondiente lesión maligna2.
La supervivencia a 5 años del carcinoma escamoso de la vulva está relacionada con el estadio clínico, y según los últimos datos publicados es del 86,5, del 67,7, del 40,3 y del 21,7% para los estadios I a IV, respectivamente3. A pesar de ser la vulva un órgano externo y fácilmente accesible, un 38,5% de los cánceres se diagnostican en estadios avanzados, cuando el cáncer se ha extendido ya por fuera de sus límites anatómicos1. En la vulva, los primeros trabajos para prevenir el cáncer invasor mediante la detección, diagnóstico y tratamiento del cáncer in situ datan de hace menos de 30 años4,5. Estos trabajos sentaron las bases para identificar y tratar las lesiones del epitelio vulvar que presentan atipia celular y coincidieron en calificar este cometido, específico del ginecólogo, como un reto. En este trabajo planteamos cómo debe afrontarse este reto, revisamos la bibliografía y presentamos nuestros propios resultados.
FRECUENCIA
La prevalencia o incidencia de la VIN en la población general no se conoce debido a la ausencia de programas organizados para su detección; sin embargo el número de casos diagnosticados ha experimentado un aumento en las últimas décadas. La primera comunicación de este hecho fue la del grupo de Woodruff en 19776. En el hospital Johns-Hopkins el diagnóstico de VIN en relación con el total de neoplasias ecamosas pasó del 18% en el período 1935-1950 al 33% en 1951-1965 y al 47% en 1966-1972; este aumento se atribuyó al establecimiento de un protocolo de diagnóstico, con el empleo liberal de la biopsia de vulva. En registros de cáncer también se ha observado este aumento, y en Dinamarca la VIN se diagnosticó, en un mismo período de 5 años, en 43 mujeres entre 1968 y 1972, y en 123 entre 1978 y 19827. En los EE.UU. la tasa de incidencia del carcinoma vulvar in situ casi se dobló entre 1973-1976 y 1985-1987, mientras que la tasa del carcinoma invasivo permaneció relativamente estable8. En un estudio de 9.302 pacientes con neoplasia primitiva de la vulva se ha comunicado una incidencia de VIN del 49%9. Una característica de estas pacientes era su procedencia de más de 1.000 hospitales con programas de control del cáncer, y en ellas se valoraba la eficacia del protocolo diagnóstico basado en la biopsia.
En los Annual Reports no aparece reseñado el carcinoma in situ de la vulva hasta el año 1985 en que se comunicaron 281 casos de carcinoma en estadio 0, lo que representa el 9,5% de las neoplasias de la vulva tratadas entre 1976 y 197810. En las ediciones sucesivas los casos de carcinoma in situ oscilan entre el 10 y el 16% de las neoplasias de la vulva11-15. La incidencia en España, entre 1970 y 1982, fue estudiada en un trabajo cooperativo en el que participaron 64 hospitales. De los 1.337 cánceres de vulva reunidos hubo 36 carcinomas in situ es decir el 2,6%16.
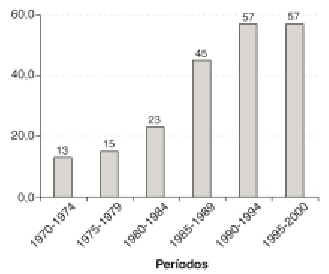
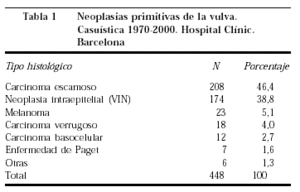
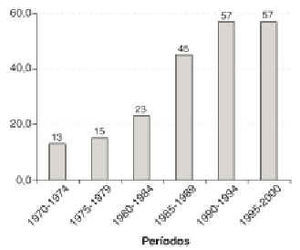
En nuestro hospital el carcinoma de vulva representa el 7% de los cánceres genitales y es el quinto en orden de frecuencia después de los cánceres de mama, cuerpo de útero, ovario y cuello de útero17. El 90% de las neoplasias de la vulva son del epitelio escamoso (intraepitelial, invasor y verrugoso) (tabla 1). La VIN representa el 38,8% del total de neoplasias vulvares y el 43,5% de las escamosas. Sin embargo, este porcentaje ha experimentado variaciones a lo largo de las 3 décadas analizadas, de 1970 a 2000 (fig. 1). Al principio la VIN era un diagnóstico poco frecuente, sólo el 13% de las neoplasias escamosas. La proporción de VIN ha ido aumentando a lo largo del estudio, siendo del 57% en los últimos 10 años18. Estos cambios, observados también por otros autores19,20, los atribuimos a dos hechos que ocurrieron hacia finales de los años setenta: a) introducción de un protocolo para el estudio de la enfermedad de la vulva, que incluía la pequeña biopsia de áreas anormales, y b) el gran incremento observado, en nuestro medio, de la infección por el virus del papiloma humano (VPH), lo que apoya la etiología viral del VIN.
Figura 1. Neoplasias vulvares escamosas. Relación intraepiteliales/invasoras (%).
HISTOLOGIA
Según la Sociedad Internacional para el Estudio de las Enfermedades Vulvovaginales (ISSVD) la VIN se caracteriza por la pérdida de maduración de las células epiteliales, asociada con hipercromasia y pleomorfismo nuclear, mitosis anormales y amontonamiento celular. Pueden estar presentes células disqueratósicas, corps ronds, hiperqueratosis, paraqueratosis e incontinencia pigmentaria1.
La VIN se clasifica en tres grados según el nivel de afectación del epitelio por las células anormales. Las lesiones planas con atipia coilocítica y mínima evidencia de proliferación se incluyen en la categoría de VIN I. Las VIN II y III pueden evidenciar aspectos muy heterogéneos, que se clasifican en tres tipos: a) condilomatoso; b) basaloide, y c) diferenciado. Se ha sugerido que los diferentes patrones morfológicos pueden reflejar distintas etiologías, los dos primeros se consideran relacionados con el VPH y el último no21. Un aspecto histológico importante para orientar el tratamiento es la profundidad que alcanza la lesión intraepitelial en relación con la frecuente afectación pilosebácea, por donde se extiende la VIN de forma táctica, semejante a la afectación de las glándulas cervicales por la CIN. Medida desde la superficie, en las áreas no pilosas la profundidad es de apenas 1 mm, pero alcanza hasta casi 4 mm en las áreas pilosas22,23.
EDAD
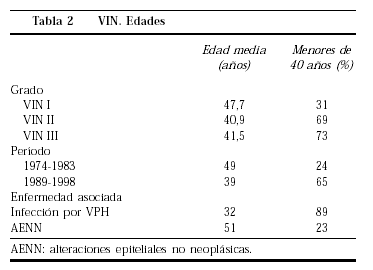
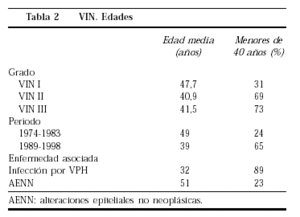
Al contrario de lo que es habitual en la CIN, no se observa un aumento de edad al progresar el grado de VIN. La edad media de las pacientes con VIN I (47,7 años) es mayor que la de las pacientes con VIN II o III, que tienen una edad media semejante (40,9 y 41,5 años) (tabla 2). Asimismo, el porcentaje de mujeres jóvenes, menores de 40 años, es semejante en las VIN II-III (69 y 73%) y mucho mayor que en la VIN I (31%)17.
En nuestra serie, la edad media de las pacientes diagnosticadas últimamente, de 1989 a 1998, es 10 años más joven que la de las diagnosticadas al principio del estudio, de 1974 a 1983, y el porcentaje de mujeres menores de 40 años pasó del 24% en el primer período al 65% en el último. La edad media de las mujeres con VIN asociado con VPH es menor que la de las mujeres con VIN no asociado a VPH (32 frente a 51 años). En las VIN asociadas a VPH un 89% son menores de 40 años, frente a un 23% en las asociadas a distrofias17. Varios autores19,20 han comunicado también esta disminución de la edad de presentación de la VIN III en las últimas décadas, pasando de 53 a 36 años, y al mismo tiempo se ha observado un aumento del cáncer escamoso de la vulva en edades jóvenes, por debajo de los 50 años19,20,24, especialmente en las mujeres inmunodeprimidas25, lo que apoya la naturaleza preinvasora de la VIN.
Estos datos hicieron sospechar la posibilidad de que las neoplasias de vulva tengan una etiología heterogénea, coexistiendo dos entidades distintas, una propia de las mujeres jóvenes asociada a VPH y otra en mujeres mayores asociada con alteraciones epiteliales no neoplásicas (AENN), del tipo liquen escleroso o hiperplasia de células escamosas. Los cánceres en mujeres jóvenes serían de tipo condilomatoso o basaloide y en más de dos tercios de ellos se observa VIN en el epitelio adyacente. La VIN sería su lesión precursora que aparece, de promedio, unos 10 años antes. El carcinoma diferenciado asociado con AENN se presenta en mujeres de 10 a 20 años mayores. Se debe considerar diversas variables clinicoepidemiológicas para clasificar la VIN según esté relacionada o no con VPH, como se indica en la tabla 3.
VPH EN LAS NEOPLASIAS VULVARES
En la última década, los estudios de hibridación molecular han demostrado la presencia de ADN de VPH entre el 60-90% de las VIN III17. El VPH se encuentra presente con más frecuencia en los cánceres de tipo condilomatoso o basaloide (50-85%) y es muy raro en los de tipo diferenciado queratinizante (4-22%)26-29. El tipo de VPH que con más frecuencia se asocia a neoplasia de vulva es el VPH-16.
Se ha cuantificado el aumento del riesgo de padecer una neoplasia vulvar asociada a VPH. En pacientes con condilomas el riesgo de VIN aumenta seis veces y el de carcinoma basaloide o condilomatoso 10, sin observarse aumento del carcinoma diferenciado. La presencia de VPH-16 aumenta asimismo el riesgo de padecer VIN III de 3,6 a 13,4 veces26,29,30.
COFACTORES ASOCIADOS
De los diversos cofactores estudiados en la bibliografía sólo el número de parejas sexuales y el tabaco evidenciaron diferencias significativas entre los tres tipos histológicos.
Tabaco
Las fumadoras tienen aumentado el riesgo de VIN y de cáncer de vulva, con riesgo relativo de 4,9 para VIN III y de 12,3 para el cáncer condilomatoso o basaloide. Contrariamente, en el cáncer queratinizante no se observa esta asociación26. El riesgo aumenta al aumentar el número de cigarrillos y es especialmente significativo en las mujeres que además tienen VPH-16, en las que el riesgo aumenta hasta 18,8 veces (intervalo de confianza [IC] del 95%, 11,9-29,8). El mecanismo por el que actuaría el tabaco sería doble, por una parte transformando las células inmortalizadas por el VPH-16 y por otro inhibiendo la apoptosis.
VIH e inmunosupresión
Tanto el VPH como el VIH son virus que se transmiten sexualmente y comparten muchos factores de riesgo semejantes. Las mujeres VIH positivas tienen un riesgo cinco veces mayor de infectarse por VPH. En las pacientes inmunodeprimidas, las neoplasias intraepiteliales del tracto genital demuestran una mayor tendencia a progresar y recidivar después del tratamiento. Esta evolución desfavorable está en relación con el grado de depresión inmunitaria31. Las pacientes gravemente inmunodeprimidas tienen riesgo de un avance rápido de la enfermedad preinvasora, incluso fulminante32. Contrariamente, las mujeres VIH positivas con normalidad del sistema inmunitario, ponen de manifiesto una evolución semejante al de las mujeres VIH negativas. Sin embargo, existe la posibilidad de que la eficacia de los tratamientos actuales para el VIH, al conseguir una larga supervivencia de las mujeres infectadas, permitiría que se manifestasen secuelas a largo plazo y en especial que aumentase el riesgo de transformación cancerosa de las infecciones por VPH33.
CLINICA Y DIAGNOSTICO
La VIN es, a menudo, asintomática. Si presenta síntomas, el prurito es el más frecuente. En la exploración el aspecto de la VIN es muy variable, y se distinguen lesiones maculares o papulares, de color blanco, rojo o pigmentado. Con frecuencia la aplicación de ácido acético al 5% en el epitelio vulvar ayuda a resaltar las características lesionales, especialmente en las lesiones asentadas en la mucosa del introito.
Para su diagnóstico es fundamental la sospecha del clínico y la práctica liberal de la biopsia, pues en la vulva, descartados los procesos inflamatorios y algunas dermatosis, es difícil establecer un diagnóstico exacto por el aspecto macroscópico de la lesión. El diagnóstico diferencial se ha de establecer en las lesiones blancas con el liquen escleroso o hiperplasia de células escamosas; en las lesiones pigmentadas con léntigo, melanosis, nevos, verrugas o angiomas, y en las lesiones rojas con liquen plano, psoriasis, vulvitis de células plasmáticas o la enfermedad de Paget.
Es frecuente una asociación entre VIN, en especial VIN III, y otras neoplasias del tracto genital. En una revisión de la bibliografía un 32,8% de las pacientes con VIN III tenían neoplasias sincrónicas o metacrónicas en otras localizaciones genitales, incluyendo cáncer invasor, y en nuestras pacientes con VIN III un 38,4% tenía CIN asociado17. Esta asociación ocurre con más frecuencia en mujeres jóvenes y está en relación con la infección por VPH y VIH, y con el hábito tabáquico.
INVASION OCULTA
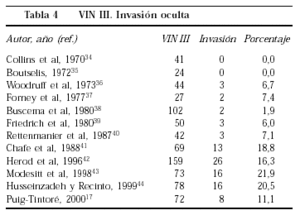
Descartar una posible invasión oculta es el diagnóstico más importante que se debe excluir en la VIN. La presencia de invasión oculta del estroma, cuando se ha diagnosticado VIN III por biopsia, fue nula en los primeros estudios publicados34,35; trabajos posteriores la encontraron entre el 2 y el 7%36-40, y los últimos la cifran entre el 16 y el 22%41-44 (tabla 4). En nuestra serie la observamos en el 11,1%17. Para descartar una posible invasión oculta se debe realizar un tratamiento exerético de la VIN, especialmente indicado en pacientes de edad avanzada o en las lesiones extensas, y obliga a practicar biopsias múltiples si se plantea un tratamiento destructivo.
Dada la importancia pronóstica que tiene la metástasis ganglionar en el cáncer de vulva, de aparición temprana y difícil de diagnosticar en la palpación, en las pacientes con invasión superior a 1 mm, procedemos al estudio del ganglio centinela45. Esta técnica, que permite dirigir con exactitud la disección ganglionar y diagnosticar las micrometástasis, se está demostrando muy efectiva en la vulva.
PROGRESION A CARCINOMA
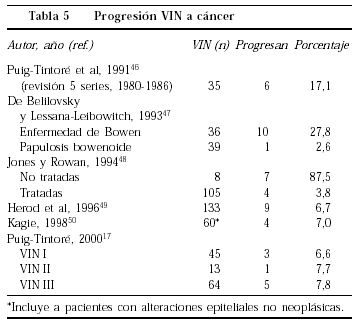
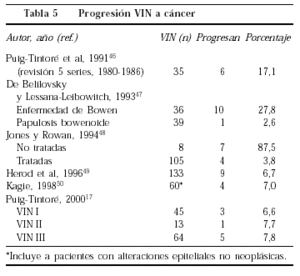
Es difícil conocer la historia natural de la VIN, y en especial su progresión a carcinoma, debido al escaso número de pacientes y a que la mayoría tendrá alguna forma de tratamiento. Hasta 1991 sólo había en la bibliografía un total de 35 pacientes en las que se siguió la evolución espontánea de la VIN III sin tratamiento, en seis (17,1%) se observó progresión a carcinoma46 (tabla 5). En la VIN III con características histológicas de enfermedad de Bowen la progresión es 10 veces mayor (27,8%) que en las pacientes con papulosis bowenoide (2,6%)47. El tratamiento no elimina por completo el riesgo de progresión, que ocurre en el 4% de las pacientes tratadas48. La mayoría de los trabajos recientes, que incluyen a pacientes tratadas y no tratadas, ofrecen cifras de progresión alrededor del 7%49,50. En nuestra casuística, la progresión a cáncer ha sido, asimismo, de un 7%17, semejante para los tres grados de VIN, observándola en pacientes mayores de 50 años (edad media, 64 años). La única paciente menor de 50 años era una trasplantada renal.
El tiempo de transición desde VIN III a carcinoma invasor parece ser largo, dado que existe una diferencia de 20 a 30 años entre la edad media de las mujeres con VIN III y las que tienen cáncer de vulva. Sin embargo, esta diferencia es menor si se considera sólo la diferencia de edad entre la VIN III y los carcinomas condilomatosos y basaloides que es sólo de 10 años26.
No existe una prueba para conocer cuál será el comportamiento de la VIN en un caso determinado, lo que tiene evidentes implicaciones al plantear el tratamiento. Sin embargo, se ha señalado una serie de criterios clínicos asociados con un aumento del riesgo de progresión a cáncer, como la edad avanzada, la inmunosupresión, el tabaco y las lesiones extensas o ulceradas.
TRATAMIENTO Y SEGUIMIENTO
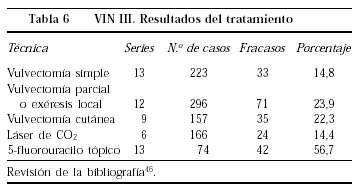
El tratamiento originalmente aconsejado para el carcinoma in situ de la vulva era la vulvectomía simple. Este proceder tiene un 15% de recurrencias46 (tabla 6) y es, sin duda, un tratamiento excesivo para una lesión intraepitelial. La VIN, además, se diagnostica cada vez con mayor frecuencia en mujeres jóvenes, en las que las secuelas físicas y psicológicas de un tratamiento tan radical lo hacen especialmente inaceptable, por ello el tratamiento ha experimentado una evolución hacia formas conservadoras.
La indicación de la conducta terapéutica en la VIN requiere experiencia clínica para descartar con seguridad una enfermedad invasora que puede pasar inadvertida o ser insuficientemente tratada, especialmente si se dispone de métodos ablativos de tratamiento (crioterapia o láser). Los tratamientos de elección son: a) extirpación local simple; b) vulvectomía cutánea parcial o total; c) crioterapia o vaporización con láser de CO2, y d) técnicas combinadas de exéresis y ablación (tabla 7).
Dada la posible regresión espontánea, algunos autores aconsejan un período de abstención terapéutica de 6 meses a un año. A nuestro juicio puede estar justificado en pacientes jóvenes bien seleccionadas en las que se asegure su seguimiento, en especial si están embarazadas o temporalmente inmunodeprimidas. Así ocurrió en 14 mujeres jóvenes con lesiones de VIN multifocales y pigmentadas asociadas con condilomas, de las que cuatro estaban embarazadas51. La regresión ocurrió entre los 3 y los 30 meses (media, 9,5 meses). En las pacientes mayores es obligada la exéresis lesional tanto por la elevada tasa de progresión como por la posible existencia de un carcinoma invasor junto con la lesión intraepitelial.
En mujeres con lesiones de VIN unifocales o multifocales aisladas, el tratamiento actual debe ser conservador, con exéresis locales simples, que permitan el estudio histológico para asegurar el diagnóstico, excluir un carcinoma inicialmente invasor u oculto y verificar que los márgenes de incisión están libres. La extirpación local, con un borde libre de enfermedad de 5 mm, y aproximación primaria del defecto es una técnica sencilla, y el resultado cosmético y funcional, bueno52. La elasticidad de la piel vulvar y de las mucosas permite la conservación de la función sexual y reproductiva. En una revisión de 12 series de la bibliografía, con 296 pacientes, el promedio de recurrencias fue del 23,9%46. Si los márgenes no están libres de enfermedad la tasa de recurrencia es lógicamente mayor, superior al 50%.
La vulvectomía cutánea fue introducida en 1968 por Rutledge y Sinclair53 y modificada por DiSaia y Rich54: está indicada en lesiones muy extensas que afectan a toda la vulva. Según la topografía de las lesiones se puede practicar una exéresis cutánea parcial, que puede combinarse con destrucción mediante vaporización con láser. En la vulvectomía cutánea se extirpa todo el grosor de la piel con los folículos pilosos y anejos cutáneos, respetando el tejido subcutáneo. El clítoris se conserva siempre, extirpando superficialmente cualquier lesión localizada en el prepucio o el glande. Originariamente se propuso realizar el cierre con injerto libre, pero en la mayoría de las lesiones asentadas en los labios es factible la aproximación de los bordes, con buen resultado. Una consideración especial merecen las lesiones asentadas en el periné y región perianal, en las que con frecuencia se ha de recurrir a técnicas de cirugía plástica. Las más empleadas son las plastias por desplazamiento y las plastias en LLL de Dufourmentel55. En una revisión de 9 series de la bibliografía46, con un total de 157 pacientes tratadas, el promedio de recurrencias de la vulvectomía cutánea fue del 22,3%. Posteriormente, en una serie de 21 pacientes no se observaron recurrencias de la neoplasia56.
El láser de CO2 se ha empleado ampliamente en el tratamiento de la VIN, ya que permite un tratamiento efectivo y no mutilante22,57. Sin embargo, por ser un método de tratamiento destructivo, precisa de una completa valoración previa. Todas las áreas sospechosas deben ser biopsiadas y si no se puede excluir la invasión se debe realizar una exéresis para estudio histológico. Si se excluye la invasión, el láser de CO2 permite la destrucción de toda el área de epitelio anormal en una profundidad adecuada. La profundidad que debe alcanzar la vaporización depende de la afección pilosebácea por la VIN, habitual en las áreas pilosas. En ellas la profundidad media + 3 desviaciones estándar (DE) es de 3,84 mm23, mientras que en las áreas no pilosas esta profundidad es de 0,76 mm22. En la actualidad, la vaporización con láser se aconseja en lesiones pequeñas localizadas en el introito y en lesiones extensas o multifocales, combinado con técnicas excisionales, para reducir al mínimo la morbilidad para la paciente58. En 6 series publicadas hasta 1991 con un total de 166 pacientes tratadas, las persistencias o recidivas ocurrireron en el 14,4%46. Trabajos más recientes ofrecen cifras semejantes de curación mediante exéresis local o láser57 o incluso mejores con la exéresis48,59. Las primeras series tendrían un seguimiento demasiado corto para evidenciar la recidiva, que se pone de manifiesto con seguimientos más prolongados59. La principal limitación de la ablación con láser es la imposibilidad del estudio histológico para descartar el 20% de posible invasión oculta que se ha señalado en los últimos trabajos publicados43,44.
Recientemente se ha comunicado que el imiquimod en crema al 5%, aplicada tópicamente por la paciente, ha demostrado ser eficaz para el tratamiento del carcinoma escamoso in situ de la piel o enfermedad de Bowen60,61, tanto en pacientes sin otra enfermedad como en pacientes con inmunodepresión iatrogénica postrasplante62 o con leucemia linfocítica crónica63, así como en el carcinoma cutáneo de células basales64. El imiquimod es un modificador de la respuesta inmunitaria, de eficacia probada para el tratamiento de las verrugas genitales, que estimula la producción de interferón alfa y otras citocinas. En la vulva se ha utilizado en series cortas de pacientes con VIN o papulosis bowenoide65-68. En cuatro casos de VIN III tratados con una pauta de tres aplicaciones por semana hasta la curación de las lesiones o por un máximo de 16 semanas, todas las lesiones se resolvieron65. En otra serie de 8 pacientes con VIN III, cuatro tuvieron una respuesta completa, dos una respuesta parcial, una progresó y otra lo abandonó por intolerancia. En este trabajo se evidenció un aumento de la actividad antiviral de la 2',5'-oligoadenil sintetasa como posible mecanismo de acción del imiquimod67. Estos resultados preliminares justifican seguir experimentando con este producto para reunir una mayor experiencia.
La terapia fotodinámica, basada en una destrucción selectiva de las células neoplásicas previamente expuestas a un agente fotosensibilizador (ácido 5-aminolevulínico), abre una vía distinta de tratamiento. Los primeros resultados preliminares dan unas cifras de curación de la VIN del 31, el 37, el 52 y el 73%, respectivamente69-72. Los mejores resultados parecen obtenerse en las VIN I y en las lesiones unifocales o bifocales de VIN II o III; por el contrario, las lesiones multifocales, especialmente si están pigmentadas o son hiperqueratósicas, son más difíciles de curar. En un caso resistente a otros tratamientos fue, asimismo, ineficaz73. Si se mejorasen estos resultados podría constituir una alternativa terapéutica en las neoplasias intraepiteliales del tracto genital inferior, pues permite mantener el aspecto normal de los tejidos, lo que constituye una innegable ventaja sobre los métodos ablativos de tratamiento, especialmente en la vulva.
La quimioterapia tópica con 5-fluorouracilo74,75 se ha abandonado por las dolorosas erosiones que pro-duce y la elevada cifra de fracasos, superior al 50%46. De otras terapéuticas propuestas para la VIN hay escasa experiencia. El primer estudio piloto para valorar el efecto del interferón sobre la VIN se realizó en 198576, posteriormente se ha probado en combinación con retinoides (isotretinoin). En dos casos de VIN III, si bien se apreció una regresión clínica, persistían las características histológicas de las lesiones77. El cidofovir, un preparado antiviral activo frente al VPH, que mejora los resultados de la exéresis quirúrgica de condilomas en pacientes VIH positivos78, ha demostrado ser eficaz en una paciente con VIN79. Con la aspiración ultrasónica80 hay, asimismo, muy poca experiencia.
El fracaso del tratamiento se relaciona principalmente con el grado de la VIN, la multifocalidad81, la afección de los bordes de resección43 y la inmunosupresión31. Las pacientes deben ser controladas a intervalos regulares durante toda la vida, y debe prestarse atención al cuello y a todo el tracto genital inferior, incluyendo las regiones perianal y anal. La recurrencia de VIN no comporta las implicaciones ominosas que tiene la recurrencia del cáncer y, por ello, si se diagnostica, puede tratarse de nuevo con facilidad, mediante tratamientos conservadores.
CONCLUSION
En la vulva, la sospecha del médico y la práctica liberal de la pequeña biopsia permiten diagnosticar la VIN y el cáncer microinvasivo, y prevenir así el cáncer invasor.