INTRODUCCIÓN
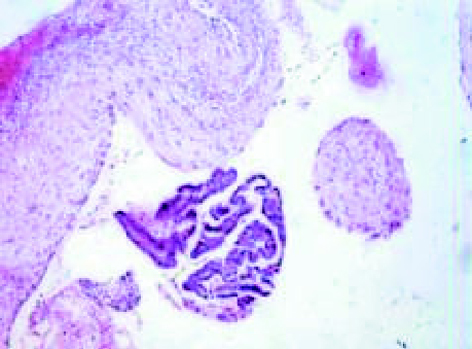
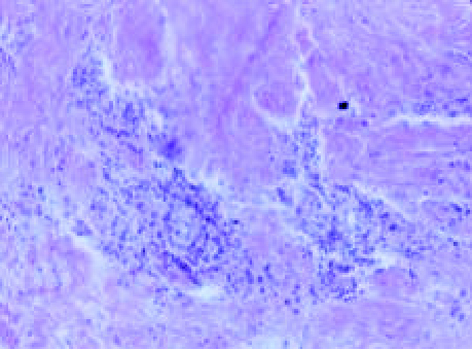
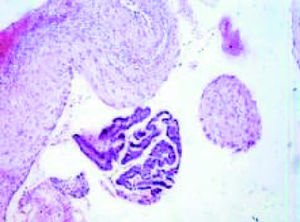
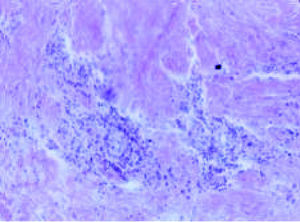
La endometriosis se define como la presencia de tejido endometrial, generalmente funcionante, fuera del útero, de forma localizada, dando lugar a quistes endometriósicos, o como implantes diseminados. Desde el punto de vista anatomopatológico es similar al endometrio eutópico, con presencia de glándulas y estroma endometrial, fibrosis y hemorragia, aunque lo que varía son las proporciones de cada uno. Un hallazgo frecuente en los estudios es la presencia de hemorragia intersticial y macrófagos cargados de hemosiderina (figs. 1 y 2)1.
Figuras 1 y 2.Estudio histológico que demuestra macrófagos con hemosiderina y restos hemáticos.
La edad más frecuente de diagnóstico es 25-35 años. La prevalencia es del 10-15% de la población general, y afecta al 30% de las mujeres sometidas a laparoscopia por infertilidad y al 50% por dolor pelviano2,3.
La endometriosis sistémica se define como la presencia de focos endometriósicos fuera de la pelvis. Su prevalencia es desconocida. Puede afectar a cualquier órgano, como el intestino, los uréteres, la vejiga, el riñón, el pulmón o el diafragma, casi cualquier parte del cuerpo, a excepción de uno: el único órgano en el que no se han encontrado nunca focos es en el bazo, dato que puede ser clave en la patogenia por sus importantes funciones inmunológicas3,4.
Durante varias décadas se han postulado diferentes teorías patogénicas, como la metaplasia celómica, el transporte directo por líquido peritoneal, la microembolización de tejido2, y también se ha implicado una inmunidad deficiente, tanto celular como humoral.
En la enfermedad torácica, que es el caso que nos ocupa, es más frecuente la afección pleural que la del parénquima, y también se ha observado una mayor prevalencia en el hemitórax derecho. Los síntomas son cíclicos, se presenta 24-48 h alrededor de la menstruación, lo que para algunos autores este dato es patognomónico1,5. Los síntomas más frecuentes son neumotórax catamenial, dolor torácico, disnea y hemoptisis. Además el 60-80% tiene asociada endometriosis pelviana.
CASO CLÍNICO
Paciente de 28 años, nuligesta. Como antecedentes personales presenta alergias a antibióticos, una prótesis mamaria por anisomastia a los 20 años y un episodio de neumotórax que se solucionó con tratamiento expectante.
Presenta dismenorrea desde la menarquia, que por entonces cedía con los analgésicos clásicos, pero cada vez necesitaba dosis crecientes. A los 24 años comienza tratamiento con anticonceptivos orales, aunque siguió precisando la asociación de analgésicos. Desde hace un año ya no se ve efectividad.
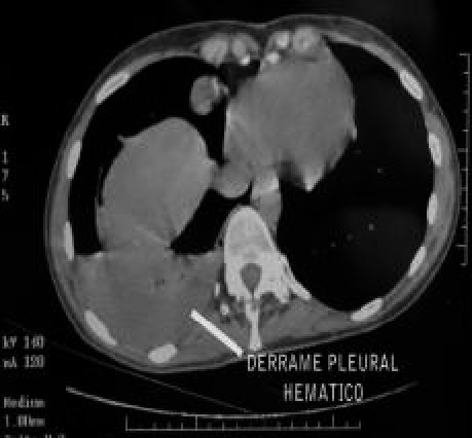
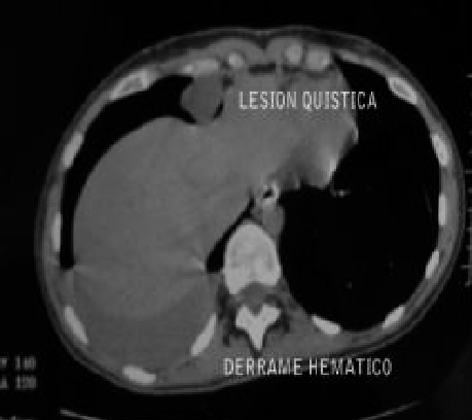
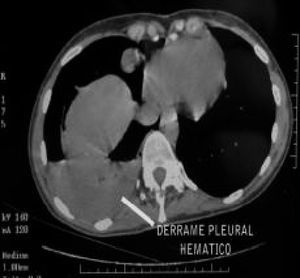
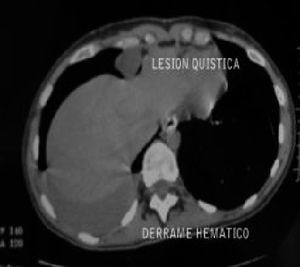
Acudió a urgencias de nuestro hospital con un cuadro de disnea y dolor torácico; se le practicó una radiografía de tórax y se descubrió un hidroneumotórax derecho. Se le realizó una tomografía axial computarizada (TAC) torácica de alta resolución, que informó de un moderado derrame de alta densidad (fig. 3) que podría ser hemático; en la cavidad pleural anterior, una lesión quística de baja densidad (fig. 4), que dado el contexto clínico podría corresponder a un endometrioma.
Figura 3.Derrame de alta densidad.
Figura 4. Lesión quística de baja densidad.
Durante la anamnesis descubrimos que ya había presentado episodios previos similares pero de menor intensidad, y todos relacionados con la menstruación. Al día siguiente del ingreso comenzaba con la menstruación. También había referido en ocasiones hematuria.
Sospechándose una endometriosis de base se realizó una ecografía ginecológica, que estaba dentro de los límites de la normalidad, y no se visualizaba ninguna masa anexial.
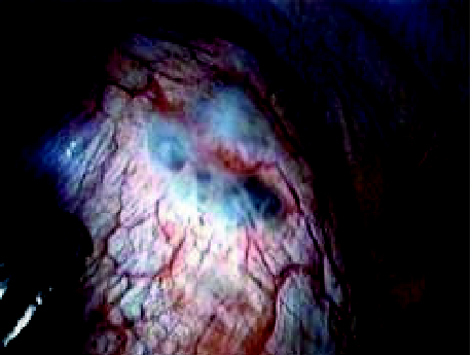
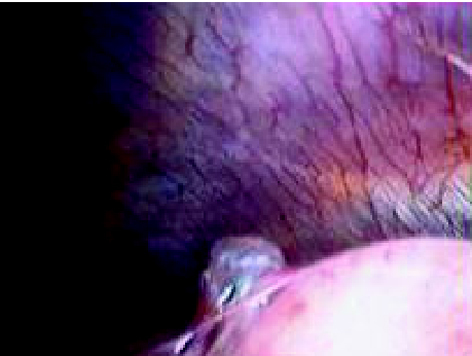
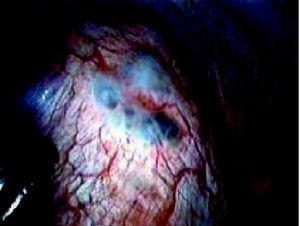
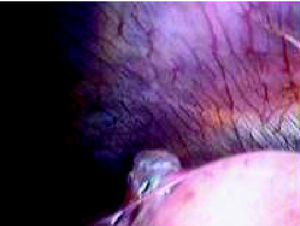
Dado que se trataba de un episodio recidivante de neumotórax se indicó cirugía; durante la videotoracoscopia se visualizaron implantes en pleura parietal, diafragma (fig. 5) y superficie pulmonar de aspecto endometrioide; orificios diafragmáticos, implantes en peritoneo visceral, y tumoración en seno cardiofrénico derecho de 5 x 3 cm con contenido "achocolatado". Igualmente se visualizó un bleb apical (fig. 6).
Figura 5.Implantes en superficie diafragmática.
Figura 6. Bleb apical.
El estudio anatomopatológico informó de depósitos de fibrina y reacción inflamatoria crónica, macrófagos alveolares con hemosiderina y restos hemáticos, sin poder confirmar la existencia de estroma ni epitelio endometrial.
Tres semanas más tarde inició tratamiento con análogos de GnRH y un mes más tarde se le añadió tibolona diaria para completar tratamiento add-back. A los 6 meses se suspendió el tratamiento. Durante dicho período, la sintomatología cedió espectacularmente, aunque acusó algún efecto secundario del tratamiento.
DISCUSIÓN
El tratamiento de la endometriosis pulmonar está encaminado, en primer lugar, a la resolución de la complicación: TET, pleurodesis, pleurectomía, resección, etc.; en segundo lugar, y puesto que se trata de una enfermedad sistémica, intentar controlarla, teniendo en cuenta variantes como la sintomatología, los deseos genésicos, la localización, el grado de extensión y la edad6.
Lo deseable es comenzar el tratamiento con la confirmación histológica, pero lo habitual es que domine la clínica.
El tratamiento más clásico ha sido la castración quirúrgica, si bien existen casos documentados de recidiva varios meses después1,7,8,9. Actualmente, siempre se asocia un tratamiento médico intentando prevenir dicha recidiva.
Más recientemente ha tomado fuerza el tratamiento conservador, como inductor a una situación de hipoestrogenemia que mantenga en inactividad esos focos ectópicos, si bien tiene el inconveniente de sus posibles efectos secundarios y su escaso efecto sobre los quistes endometriósicos.
Los anticonceptivos orales y progestinas (acetato de medroxiprogesterona 30 mg/día, acetato de noretrindrona 5 mg/día, 6 meses), que inhiben directamente el crecimiento de los implantes por decidualización y necrosis del tejido, son bastante eficaces para controlar el dolor10. El danazol (derivado de la testosterona) inhibe la secreción de gonadotropinas hipofisarias, el crecimiento directo del implante y las enzimas esteroidogénicas, permitiendo así un control moderado de la enfermedad. Los análogos de GnRH, empleados en la segunda fase del ciclo, inhiben la secreción de gonadotropinas hipofisarias, suprimiendo la producción de estrógenos ováricos5,6,11.
El efecto colateral de mayor relevancia es la situación de seudomenopausia, que implica la pérdida de masa ósea y calcio y, además, cuya recuperación no es del 100% tras la supresión del tratamiento7,10,12-14.
Para prevenir o disminuir dichos efectos secundarios, actualmente se puede asociar THS15 como la tibolona 2,5 mg/día, bisfosfonatos diarios o el mantenimiento de las concentraciones plasmáticas de E2 entre 30-50 pg/ml. Así, no sólo no disminuye la pérdida de masa ósea, sino que parece incrementarla, y además la recuperación de ésta es mayor y ocurre antes tras la supresión de la medicación5.
Con síntomas graves e incapacitantes, el tratamiento médico es prácticamente inútil y ha de asociarse a tratamiento quirúrgico, como la ooforectomía bilateral (manteniendo el tratamiento médico durante unos meses), si bien hay casos descritos de recidiva de la sintomatología incluso después de los tratamientos más radicales, como ya se comentó previamente.
En conclusión, a la hora de plantearnos el tratamiento de la endometriosis sistémica, de cualquier localización, éste ha de ser sobre todo sintomático. Debemos considerar que no vamos a curar la enfermedad, y evitar la mayor cantidad de efectos secundarios posibles, puesto que se trata de un tratamiento a largo plazo.
Actualmente, se están investigando 2 nuevas opciones terapéuticas, una basada en la dependencia estrogénica local y otra en la neutralización de la respuesta inmunológica local16.
Dentro del primer grupo tendríamos los inhibidores de la aromatasa (fadrozole, anastrozole) que impedirían la conversión local de andrógenos a estrógenos. La aromatasa se encuentra en grandes cantidades en el tejido endometriósico, y esta producción local puede influir en la persistencia y crecimiento de los focos, incluso después de una histerectomía con doble anexectomía. La mayor experiencia se tiene en animales; existen muy pocos casos en mujeres (posmenopáusicas con endometriosis). Del raloxifeno (SERM), empleado fundamentalmente en el tratamiento de la osteoporosis posmenopáusica, con efecto antiestrogénico en los tejidos del aparato reproductor, se tiene mayor experiencia en modelos animales, mientras que los resultados en las mujeres en edad reproductiva indican que necesitan una mayor supresión estrogénica, ya que no inhiben la ovulación16.
Dentro del segundo grupo estarían los inmunomoduladores (interleucina-12, interferón α-2b, loxoribine), basados en la teoría patogénica de la capacidad de las células endometriales de neutralizar la respuesta inmunológica local. El único con el que se tiene experiencia en humanos, es con INF-α17, que disminuye el tamaño y grado de la enfermedad. Y los antiinflamatorios, ya que se puede considerar una enfermedad inflamatoria por los valores elevados de citocinas y de factores de crecimiento en el líquido peritoneal, y el aumento del número de anticuerpos en las mujeres con endometriosis18. Dentro de este grupo, los fármacos implicados serían: diclofenaco, ibuprofeno, danazol (su acción inmunomoduladora parece ser secundaria a su capacidad de inducir un hipoestrogenismo), pentoxifilina (que parece útil en situaciones en las que el daño está producido por la acción inflamatoria de los macrófagos) y factor de necrosis tumoral bp-1 (que neutraliza el factor de necrosis tumoral alfa).