Comparar los resultados reproductivos en función del índice de masa corporal (IMC) en las pacientes sometidas a ciclos de FIV-ICSI.
Sujeto y métodosOchocientos sesenta y tres ciclos de FIV-ICSI sometidos a estimulación ovárica controlada con protocolo de antagonistas de la GnRH.
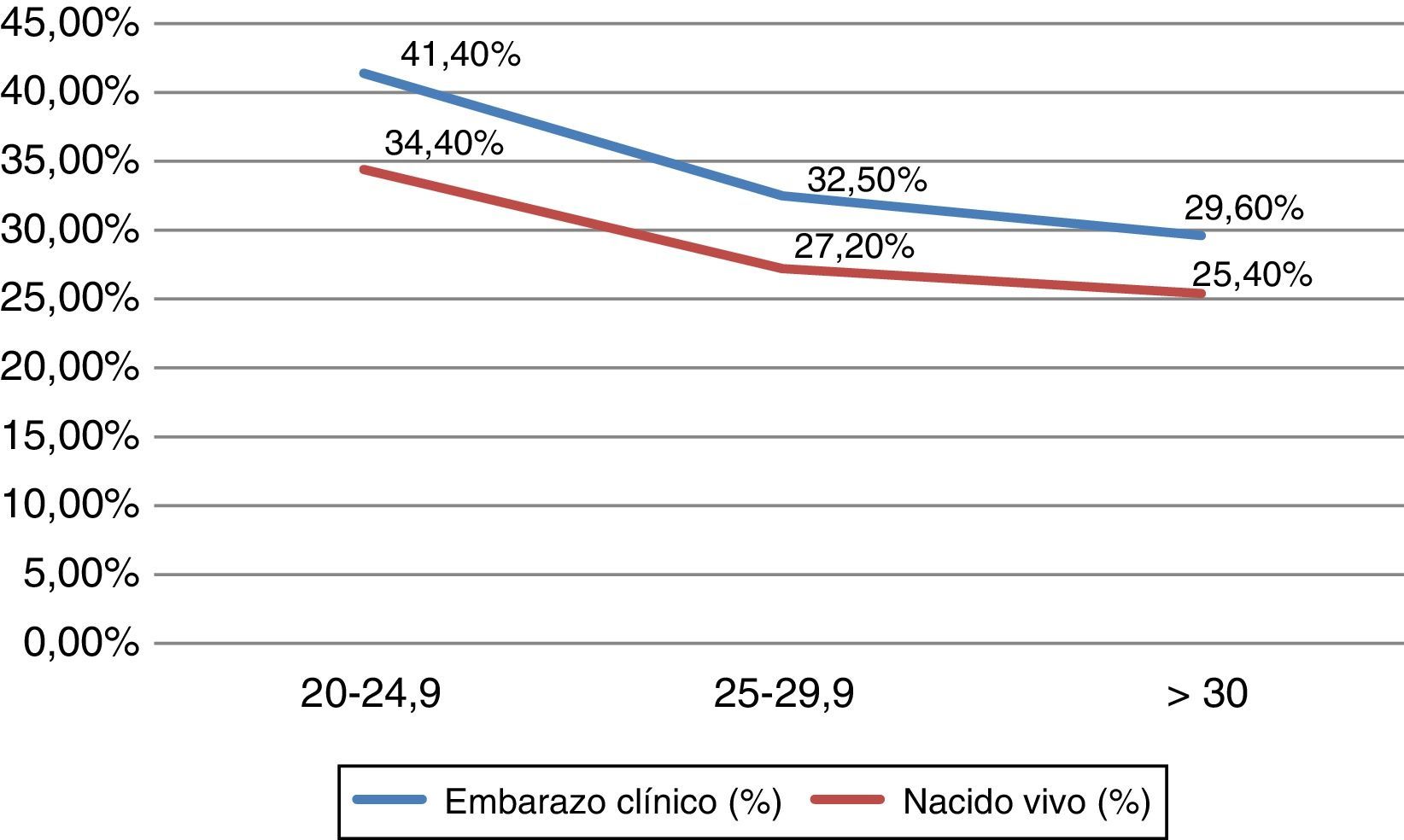
ResultadosSe encontraron diferencias en la edad media de las pacientes de los diferentes grupos, no clínicamente relevantes (± 1año). No se encontraron diferencias significativas en la duración de la estimulación, ni en la dosis total de gonadotropinas utilizadas entre los diferentes grupos. Sin embargo, hubo menor número de folículos seleccionados, ovocitos recuperados, ovocitos maduros y de embriones disponibles para transferir al incrementarse el IMC, siendo las diferencias estadísticamente significativas. En cuanto a los resultados reproductivos; la tasa de embarazo clínico y nacido vivo se reduce progresivamente a medida que aumenta el IMC, siendo las diferencias estadísticamente significativas (grupo i: 41,4%, grupo ii: 32,5%, grupo iii: 29,6%; p<0,05).
ConclusionesEl sobrepeso y la obesidad empeoran los resultados reproductivos en ciclos de FIV-ICSI, reduciéndose de forma significativa la tasa de embarazo clínico y nacido vivo a medida que aumenta el IMC.
To compare reproductive outcomes in our in vitro fertilization (IVF) program according to women's body mass index (BMI).
Subjects and methodsWe included a total of 863 IVF-intracytoplasmic sperm injection (ICSI) cycles with controlled ovarian stimulation with GnRH antagonists.
ResultsPatient age differed among the BMI groups but this difference was not clinically relevant (± 1 year). No significant differences were found among BMI groups in the duration of ovarian stimulation or in the total follicle-stimulating hormone dose used. However, there were significantly fewer selected follicles, retrieved oocytes, mature oocytes and transferred embryos at higher BMIs. Rates of pregnancy and live births were progressively and significantly reduced as BMI increased (group i: 41.4%, group i: 32.5%, group iii: 29.6%; P<.05).
ConclusionsFemale overweight and obesity impair IVF outcomes. Pregnancy and live birth rates were progressively reduced as BMI increased.
La obesidad es actualmente un problema de salud mundial y una epidemia con un impacto importante sobre la morbimortalidad por enfermedad cardiovascular, diabetes mellitus tipo 2, hipertensión, dislipidemia, apnea de sueño, enfermedades gastrointestinales y diversos tipos de cáncer (endometrio, mama, ovario y colorrectal)1. En EE. UU., Australia y muchos países europeos, más del 50% de la población adulta presenta sobrepeso (≥ 25 kg/m2), el 30% obesidad (≥ 30 kg/m2) y un 6% obesidad mórbida (≥ 35 kg/m2)2–5. En el campo de la reproducción, la obesidad se asocia a esterilidad6–8, subfertilidad (retraso en la concepción)9–11, aborto12–18, complicaciones obstétricas19–21 e incremento de la morbimortalidad perinatal22–25. El mecanismo implicado en los pobres resultados reproductivos de estas pacientes es complejo y probablemente multifactorial. La resistencia a la insulina, el hiperandrogenismo y la elevación de los niveles de leptina podrían estar implicados7,26.
La obesidad puede también empeorar el resultado de las técnicas de reproducción asistida (TRA) in vitro. Se requieren mayores dosis de gonadotropinas27-30, existe un deterioro significativo de la calidad ovocitaria y embrionaria12,20,27,30–34 y un incremento de la tasa de aborto12–18,21,28; sin embargo, otros autores no encuentran diferencias en estos parámetros en función del índice de masa corporal (IMC)13,35–37. También el desarrollo endometrial puede verse afectado negativamente por la obesidad15.
El objetivo del presente trabajo es comparar los resultados reproductivos en función del IMC en las pacientes sometidas a ciclos de fecundación in vitro (FIV), en la Unidad de Reproducción del Hospital General Universitario de Alicante.
MétodosEste estudio cuenta con la aprobación expresa del comité de ética y de ensayos clínicos del Hospital General Universitario de Alicante.
Población de estudioDe forma retrospectiva, se analizaron un total de 863 ciclos de FIV-ICSI en pacientes sometidas a estimulación ovárica controlada con protocolo de antagonistas de la GnRH, en la Unidad de Reproducción del Hospital General Universitario de Alicante desde enero del 2004 hasta diciembre del 2011. Sólo se incluyeron en el estudio ciclos con transferencia embrionaria (1 o 2 embriones). En cada paciente, previo al inicio de la estimulación ovárica, se obtuvo el IMC. Comparamos los resultados reproductivos (tasa de embarazo clínico, tasa de aborto y nacido vivo) en función del IMC (calculado como peso/altura2). Las pacientes fueron divididas en 3 grupos: grupo i: normopeso (IMC 20-24,9kg/m2) (n = 601; 67,30%); grupo ii: sobrepeso (IMC 25-29,9kg/m2) (n = 191; 22,13%), y grupo iii: obesidad (IMC ≥ 30kg/m2) (n = 71; 8,22%). Se excluyó a los pacientes con patología uterina (miomas submucosos o intramurales de más de 3cm, pólipos endometriales, adherencias o malformaciones uterinas congénitas), aborto de repetición o el factor masculino severo (< 5 millones espermatozoides/ml en eyaculado).
Protocolos de estimulación ováricaFueron seleccionados únicamente aquellos ciclos en los que en la estimulación ovárica controlada se utilizó un protocolo corto de antagonistas de la GnRH. Se excluyeron, por tanto, aquellos ciclos en los que se utilizaron otros protocolos.
En el protocolo corto con antagonistas, las pacientes, previo a la estimulación ovárica con FSH, recibieron tratamiento con anticonceptivos por vía oral (3mg de drospirenona con 0,03mg de etinilestradiol; Dretine® [Teva Pharma, Petaj Tikva, Israel] o Drosure® [Effik]). La estimulación ovárica se inició 5 días después de haber suspendido los anticonceptivos por vía oral. La dosis utilizada de antagonistas fue de 0,25mg (Cetrotide®, Merck-Serono, Darmstadt, Alemania) que se inició de forma variable los días 5 o 6 del ciclo.
En la estimulación ovárica controlada, se utilizaron tanto FSH recombinantes (Gonal-F® Serono; o Puregon®, Organon, Oss, Holanda) como gonadotropinas urinarias (Menopur®; Ferring, Ferring, Inglaterra) o LH recombinante (Luveris®; Serono). Las dosis de FSH y/o LH seleccionadas fueron elegidas teniendo en cuenta la edad de la paciente, el recuento de folículos antrales, la analítica hormonal basal y la respuesta a ciclos de estimulación previos (en aquellos casos en los que disponíamos de este dato). El primer control tras el inicio de la estimulación ovárica se realizó el quinto día, posteriormente los controles fueron cada 48 horas. La dosis de gonadotropinas se fue ajustando según el nivel de estradiol (E2) en sangre y la respuesta ovárica medida mediante ecografía transvaginal. La gonadotropina coriónica humana (Ovitrelle®; Serono) se administró de forma subcutánea cuando al menos 2 de los folículos estimulados tenían una medida igual o superior a 18mm. La punción ovárica se realizó a las 36 h de la administración de la gonadotropina coriónica humana.
La transferencia embrionaria se realizó en día 2 o 3 tras la punción ovocitaria, vía transvaginal bajo control ecográfico. Posteriormente, se pautó progesterona micronizada intravaginal (400mg /día; Progeffik®, Laboratorios Effik, o Utrogestan®, SEID) desde el día de la transferencia embrionaria hasta conocer el resultado del test de gestación.
SeguimientoTrece días después de la punción folicular, se cuantificó la BhCG en sangre, considerando como positivo un valor superior a 10 mU/ml. Tras una resultado positivo de BhCG, se realizaron 2 ecografías vía vaginal; la primera de ellas, en torno a las 5-6 semanas de gestación, para confirmar gestación intrauterina y número de sacos gestacionales, y la segunda en torno a la 7-8 semanas de gestación, para comprobar gestación evolutiva. La administración de progesterona micronizada por vía vaginal se mantuvo hasta finalizar el primer trimestre de gestación.
Análisis estadísticoEl análisis estadístico se realizó mediante el programa informático SPSS 15.0 (Chicago, EE. UU.). Los datos están expresados como media ± desviación estándar. Se utilizaron el test de la t de Student para las variables cuantitativas y el test de la chi al cuadrado para las cualitativas. Consideramos significación estadística un valor de p<0,05.
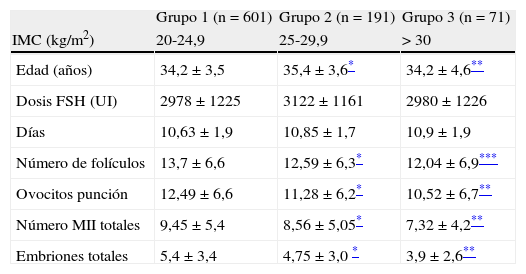
ResultadosEn la tabla 1 se analizan las características clínicas y los parámetros de respuesta ovárica a la estimulación en nuestras pacientes. Encontramos diferencias en la edad media de las pacientes de los diferentes grupos de IMC, aunque no fueron clínicamente relevantes (± 1año). No encontramos diferencias significativas ni en la duración de la estimulación, ni en la dosis total de gonadotropinas utilizadas entre los diferentes grupos; sin embargo, se recuperaron menos ovocitos, hubo menos ovocitos maduros y menor número de embriones disponibles para transferir al incrementarse el IMC, siendo las diferencias estadísticamente significativas. No se encontraron diferencias en la tasa de fecundación, el día de transferencia embrionaria o el número de embriones transferidos.
Características descriptivas del grupo de estudio (n = 863)
| Grupo 1 (n = 601) | Grupo 2 (n = 191) | Grupo 3 (n = 71) | |
| IMC (kg/m2) | 20-24,9 | 25-29,9 | > 30 |
| Edad (años) | 34,2 ± 3,5 | 35,4 ± 3,6* | 34,2 ± 4,6** |
| Dosis FSH (UI) | 2978 ± 1225 | 3122 ± 1161 | 2980 ± 1226 |
| Días | 10,63 ± 1,9 | 10,85 ± 1,7 | 10,9 ± 1,9 |
| Número de folículos | 13,7 ± 6,6 | 12,59 ± 6,3* | 12,04 ± 6,9*** |
| Ovocitos punción | 12,49 ± 6,6 | 11,28 ± 6,2* | 10,52 ± 6,7** |
| Número MII totales | 9,45 ± 5,4 | 8,56 ± 5,05* | 7,32 ± 4,2** |
| Embriones totales | 5,4 ± 3,4 | 4,75 ± 3,0 * | 3,9 ± 2,6** |
No encontramos diferencias entre los diferentes grupos de IMC en la tasa de ciclos cancelados por baja respuesta (el 2,8, el 1,8 y el 1,2%, respectivamente) o por no embriones (el 9,5, el 10,5 y el 11,1%, respectivamente). Únicamente analizamos los resultados de los ciclos con transferencia embrionaria.
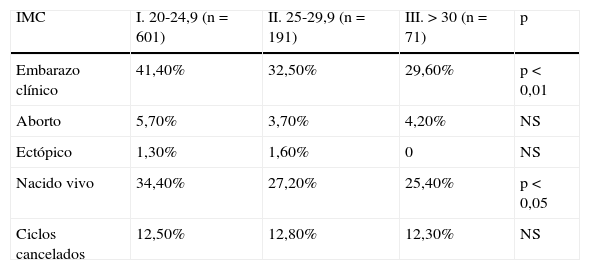
En la tabla 2 se analizan los resultados reproductivos entre los diferentes grupos de IMC. Encontramos que la tasa de embarazo clínico y nacido vivo, se reduce progresivamente a medida que aumenta el IMC, siendo las diferencias estadísticamente significativas (grupo i: 41,4%, grupo ii: 32,5%, grupo iii: 29,6%; p<0,05). La tasa de aborto fue en el grupo i: 5,70%, grupo ii: 3,70%, y finalmente, en el grupo iii: 4,20%. No encontramos, por tanto, diferencias estadísticamente significativas en la tasa de aborto clínico o embarazo ectópico entre los grupos de estudio.
Resultados reproductivos por grupos
| IMC | I. 20-24,9 (n = 601) | II. 25-29,9 (n = 191) | III. > 30 (n = 71) | p |
| Embarazo clínico | 41,40% | 32,50% | 29,60% | p < 0,01 |
| Aborto | 5,70% | 3,70% | 4,20% | NS |
| Ectópico | 1,30% | 1,60% | 0 | NS |
| Nacido vivo | 34,40% | 27,20% | 25,40% | p < 0,05 |
| Ciclos cancelados | 12,50% | 12,80% | 12,30% | NS |
NS: no significación estadística.
En la figura 1 se muestra gráficamente la disminución significativa en la tasa de embarazo clínico y nacido vivo al incrementarse el IMC.
DiscusiónNuestro estudio demuestra que el sobrepeso y la obesidad afectan negativamente a los resultados reproductivos en ciclos de FIV-ICSI. Las mujeres obesas presentan casi 3 veces más riesgo de esterilidad en ciclos naturales que las mujeres con peso normal38 y también tienen menos probabilidad de conseguir un embarazo con TRA27,39.
La afectación de la función ovárica y de los resultados reproductivos a consecuencia del exceso de peso parecen relacionarse con las anomalías endocrinas y metabólicas acompañantes, entre las que se han descrito: excesiva producción de estrógenos, alteración de la regulación del metabolismo esteroideo, reducción de la disponibilidad de GnRH, aumento de la actividad opioide y cambios en la secreción y la acción de la insulina y otras hormonas de regulación energética, como leptina, adiponectina, resistina y ghrelina28,40-43. Este perfil endocrino conduce a las 3 principales características fisiopatológicas por las que la obesidad afecta a la reproducción: el hiperinsulinismo, el hiperandrogenismo funcional y la anovulación28,40,42. Tales alteraciones pueden afectar al crecimiento folicular, el desarrollo embrionario y la implantación tanto en ciclos de concepción natural como asistida40,44,45. Así Fertilish et al.46 describieron que, por cada aumento en una unidad de IMC en mujeres obesas, la probabilidad de embarazo disminuía un 16% en FIV. De igual modo, cada reducción de una unidad en el IMC aumenta la posibilidad de embarazo en un 19%.
Se ha descrito que las mujeres obesas bajo estimulación ovárica controlada (EOC) para ciclos de FIV, debido a lo que denominan un estado de resistencia a gonadotropinas, requieren periodos más largos de estimulación ovárica, mayores dosis de gonadotropinas, mayores tasas de cancelación, disminución de la concentración intrafolicular de HCG, menores picos de E2 y menor recuperación ovocitaria4,28,33,44,47,48,. Recientemente, Bellver et al.16, en un amplio estudio unicéntrico, que incluyó 6.500 ciclos de FIV en mujeres obesas (≥ 30kg/m2), describen un incremento significativo en las dosis de gonadotropinas administradas durante la EOC, aunque sin diferencias en la duración de la estimulación, en el número de ovocitos recuperados u ovocitos maduros (metafase ii). Otros autores no encuentran estos efectos deletéreos de la obesidad en la respuesta a la estimulación ovárica en ciclos de FIV35-37. En nuestro trabajo, no encontramos diferencias significativas ni en la duración de la estimulación, ni en la dosis total de gonadotropinas utilizadas en ninguno de los 3 grupos de estudio. Sin embargo, o quizás por ello, sí encontramos diferencias en cuanto a parámetros de respuesta ovárica, como son el número de folículos estimulados, el número de ovocitos recuperados, el número de ovocitos maduros recuperados (MII) y el número de embriones disponibles para transferir, los cuales van disminuyendo a medida que va aumentando el IMC, al igual que encuentran otros autores20,28,32,33,50. Pese a todo, no hay consenso en la literatura, ya que otros estudios no encuentran esta asociación13,16,35; bien es cierto que en el nuestro solo utilizamos un protocolo de estimulación (antagonistas), mientras que el resto de estudios utilizan ambos protocolos (antagonistas y agonistas) y esto podría crear factores de confusión.
A pesar de encontrar una disminución del número de embriones disponibles para ser transferidos, no hallamos diferencias en el número de embriones transferidos y criopreservados finalmente, ni en la calidad de los mismos, según parámetros morfológicos de calidad ovocitaria y embrionaria. La valoración de la calidad embrionaria sobre la base solo de este tipo de criterios podría explicar, al menos en parte, las discrepancias entre los diferentes estudios y, por ello, sería deseable que se realizasen estudios analizando otros parámetros morfológicos, moleculares o metabólicos que sean más objetivables y, por tanto, con menor variabilidad interobservador.
En relación con los resultados reproductivos en pacientes obesas sometidas a ciclos de FIV, se han descrito tasas reducidas de recién nacidos vivos, debido a una combinación de bajas tasas de implantación y de gestación (no solo en ciclos de reproducción asistida, sino también en mujeres obesas tras inducción de la ovulación)16,35,50–53, altas tasas de abortos, tanto bioquímicos como clínicos, y mayor frecuencia de complicaciones durante la gestación53. En una reciente revisión sistemática sobre el efecto de la obesidad sobre las TRA, se concluyó que las tasas de gestación en mujeres sin sobrepeso (20-25kg/m2) eran significativamente mayores que en aquellas con sobrepeso (> 25kg/m2) u obesidad (> 30kg/m2)31. Igualmente, Bellver et al.16, en un amplio estudio sobre el impacto de la obesidad en los resultados de FIV, también encuentran que las tasas de implantación, embarazo y recién nacido vivo son significativamente menores en mujeres obesas; de hecho, las tasas de embarazo y nacido vivo se reducen progresivamente con cada unidad de IMC, con una odds ratio de 0,984 (IC del 95%, 0,972-0,997) y de 0,981 (IC del 95%, 0,967-0,995), respectivamente. En nuestro estudio, encontramos datos que concuerdan con estos autores, ya que la tasa de embarazo clínico y nacido vivo se reduce progresivamente a medida que aumenta el IMC, siendo las diferencias estadísticamente significativas (grupo i: 41,4%, grupo ii: 32,5%, grupo iii: 29,6%; p<0,05). Sin embargo, pese a estas evidencias sobre el efecto negativo de la obesidad sobre las tasas de gestación; otros autores no han encontrado ninguna asociación significativa entre el incremento del IMC y la posibilidad de gestación tras FIV28,30,36,49.
Se han descrito mayores tasas de aborto, tanto bioquímicos como clínicos, en mujeres obesas embarazadas, tanto si dicha gestación es espontánea17,54-56, como si es resultado de una inducción de la ovulación49,55,57 o de ciclos de FIV-ICSI12,13,28,52. En una revisión sistemática31 y un reciente metaanálisis34 respecto al efecto del IMC sobre el riesgo de aborto tras una gestación espontánea o tras TRA, encuentran que las mujeres con sobrepeso tenían mayores probabilidades de tener un aborto. Sin embargo, en otros estudios16, incluido el nuestro, no encontramos diferencias en la tasa de aborto clínico entre los grupos de IMC (normopeso, sobrepeso u obesidad). Winter et al.58 relacionaron el mayor riesgo de aborto precoz con la mala calidad embrionaria frecuentemente asociada12,50,59 más que con la obesidad en sí58.
Algunos autores apuntan a que los malos resultados reproductivos de las pacientes obesas sometidas a FIV podrían estar más relacionados con el endometrio (o ambiente uterino) que con el complejo ovocito-embrión. El mejor modelo humano para diferenciar ambos componentes es el modelo de donación ovocitaria, en el que ovocitos de mujeres sanas, jóvenes y no obesas, son donados a receptoras con diferente IMC. Algunos estudios recientes han evaluado las tasas de implantación, gestación y aborto tras donación ovocitaria respecto al IMC de la receptora14,15,60,61. En el estudio desarrollado por Bellver et al.15 (que es el que ha incluido un mayor tamaño muestral), se observó una tendencia no significativa hacia una menor tasa de implantación y gestación, y una mayor tasa de aborto y embarazo ectópico, conforme aumentaba el IMC. Otros 2 estudios recientes llegan a resultados similares62,63.
Por tanto, estos estudios parecen indicar que el endometrio, o su entorno, desempeñan un papel más importante de lo que se pensaba hasta el momento en los malos resultados reproductivos de las mujeres obesas. Sin embargo, otros no encontraron impacto de la obesidad sobre los resultados gestacionales60,61. Luke et al.64, en un reciente estudio con un gran tamaño muestral (45.163 ciclos con transferencia embrionaria), concluyen que la obesidad se asocia a una reducción significativa de las tasas de gestación cuando se utilizan ovocitos propios, pero no cuando se utilizan ovocitos de donante, lo cual, en contra de lo anteriormente expuesto, indica una peor calidad embrionaria en mujeres obesas.
Por lo tanto, existen discrepancias en la literatura médica actual respecto a la influencia de la obesidad en estos parámetros de calidad ovocitaria y embrionaria o el papel que desempeña el endometrio. Esto podría ser debido a diferencias metodológicas (los diferentes puntos de corte utilizados para definir la obesidad en los que en mucho casos aúnan mujeres con sobrepeso y obesas en el mismo grupo, al tipo de obesidad evaluada, etc.), al hecho de que sean retrospectivos y algunos de ellos multicéntricos, e incluso a diferencias en el patrón endocrino-metabólico de cada mujer, que puede variar entre pacientes pertenecientes al mismo grupo de IMC.
Podemos concluir, por tanto, que el sobrepeso y la obesidad afectan negativamente a los resultados reproductivos en ciclos de FIV-ICSI, reduciéndose de forma significativa la tasa de embarazo clínico y nacido vivo, a medida que aumenta el IMC. Para explicar estos hallazgos habría que investigar más sobre el papel que desempeñan los gametos, los embriones y el endometrio, el cual no está bien determinado. Aunque el hecho de no encontrar diferencias en la calidad ovocitaria ni embrionaria entre los diferentes grupos de IMC nos invita a pensar que la influencia del endometrio o su entorno podrían desempeñar un papel más importante de lo que se pensaba hasta el momento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.