INTRODUCCIÓN
La peritonitis meconial (PM) es una entidad poco frecuente (1/30.000-35.000 nacimientos). Se produce por una perforación intestinal con salida de meconio a la cavidad abdominal que ocasionará una peritonitis química estéril. Los hallazgos ecográficos dependerán del momento evolutivo del proceso y las calcificaciones abdominales son la clave diagnóstica; en muchas ocasiones son el único signo y en otras oportunidades se acompañan manifestaciones muy expresivas: ascitis fetal, dilatación intestinal, seudoquistes meconiales, polihidramnios, etc. El pronóstico dependerá de la causa subyacente y estarán involucradas las obstrucciones digestivas y las infecciones, pero en muchas ocasiones no será posible identificar la etiología.
Presentamos un caso de diagnóstico prenatal de PM en un recién nacido asintomático, en el que no fue posible determinar la causa de la perforación. El objetivo de este trabajo es revisar esta entidad, dada la discordancia en los criterios diagnósticos, la afección subyacente y el pronóstico perinatal en los diferentes casos que hemos encontrado al hacer una revisión bibliográfica.
CASO CLÍNICO
Gestante de 38 años, paridad: 1.0.1.1, que acude en la semana 36 por odinofagia y cuadro febril de 5 días de evolución, que no responde a tratamiento con penicilina. Sus antecedentes carecían de interés y la gestación había transcurrido con normalidad. Los controles analíticos y serológicos habían sido normales. Rechazó la amniocentesis. Las ecografías a las 12 y 20 semanas habían sido normales y en la de la semana 33 se observó un polihidramnios (índice de líquido amniótico [ILA] de 22 cm) sin otros hallazgos.
La ecografía realizada al ingreso mostraba un feto único, varón, en posición cefálica, con biometría en el percentil 75. Presentaba múltiples calcificaciones abdominales, difusas, peritoneales (respetaban el parénquima hepático y esplénico) que perfilaban el diafragma y afectaban al escroto fetal. También se identificó una imagen compatible con seudoquiste meconial. No había ascitis ni signos de dilatación intestinal. Se observó polihidramnios (ILA de 25 cm). La ecografía Doppler de las arterias umbilical y cerebral media y del ductus venoso fueron normales. La estimulación nerviosa transcutánea (TNS) fue reactiva. Se estableció el diagnóstico ecográfico de PM sin identificar causa subyacente.
La gestante permaneció afebril desde su ingreso. El hemograma, la bioquímica y la coagulación fueron normales. El exudado faríngeo y el urinocultivo fueron negativos. Las serologías frente al virus de la inmunodeficiencia humana (VIH), el lúes y TORCH fueron negativos, así como las serologías para el virus de Epstein-Barr, el parvovirus B19 y los virus de las hepatitis B y C. No había antecedentes familiares para fibrosis quística (FQ).
El polihidramnios permaneció estable y no hubo cambios en las imágenes abdominales. Las pruebas de bienestar fetal fueron normales. En la semana 38, con condiciones favorables, se indujo el parto, que fue vaginal, con ayuda en el expulsivo de una ventosa obstétrica. Nació un varón de 3.700 g, con Apgar de 9-10. El recién nacido ingresó en la unidad de neonatología; la exploración abdominal normal y el ritmo intestinal fueron normales. La radiografía de abdomen evidenció múltiples calcificaciones dispersas por todo el abdomen fetal que sugerían PM. La ecografía abdominal fue normal. Se hizo un cribado para FQ, que resultó negativo, con tripsina inmunorreactiva en suero de 37,9 ng/ml.
El recién nacido permaneció asintomático y fue dado de alta al tercer día. En el seguimiento a los 7 meses permanece asintomático.
DISCUSIÓN
La PM fue descrita por Morgagni en 1761 y los primeros casos de diagnóstico prenatal eran hallazgos incidentales en mujeres a las que se les hacía una radiopelvimetría por sospecha de macrosomía o malformaciones congénitas1. El primer caso de diagnóstico prenatal ecográfico de PM fue reportado por Brugman et al2 en 1979. La PM es el resultado del paso de meconio de la luz intestinal a la cavidad peritoneal, secundario a una perforación intestinal, que provoca una intensa reacción química y peritonitis estéril (la flora bacteriana gastrointestinal no se desarrolla hasta las primeras horas de vida, pero en el tercer mes de gestación se inicia la producción de meconio y alguno de sus componentes, como lipasas, ácidos y sales biliares, son particularmente irritantes)3.
No debe olvidarse que la PM es un proceso evolutivo y sus diferentes fases (que han sido bien tipificadas) suelen correlacionarse bien con los hallazgos ecográficos, de ahí la importancia de practicar ecografías seriadas en esta entidad1,4-7. En algunas ocasiones podemos tener el diagnóstico previo de obstrucción intestinal o ver las asas intestinales dilatadas en la misma exploración. Al producirse la perforación, la salida de meconio ocasiona un proceso inflamatorio exudativo en la cavidad peritoneal, que se traduce en la ecografía en ascitis fetal, que puede ser hiperecogénica, en ocasiones con masas de meconio libre flotando en ella. El polihidramnios suele ser un signo temprano de la disfunción intestinal y se ha atribuido a la dificultad de reabsorción del líquido amniótico debido al deficiente peristaltismo intestinal. La reacción inflamatoria estimula la formación de tejido fibroso que posteriormente se calcificará, y la fibrosis y las adherencias pueden sellar la perforación; en muchas ocasiones, el proceso se resuelve intrauterinamente y permite ver en esta fase la presencia de seudoquistes meconiales y las típicas calcificaciones peritoneales, que son el hallazgo más característico.
La perforación intestinal puede producirse por diversos mecanismos y puede haber múltiples causas implicadas (tabla 1)1,4,5,7,8. En la mayoría de las ocasiones la causa subyacente es la perforación secundaria a obstrucción intestinal por atresia (con preferencia por el íleon) y menos frecuente por íleo meconial asociado a FQ o por otros procesos digestivos: duplicación de colon9, invaginación10,11, etc. Cabe resaltar que no se reconocen causas en muchas ocasiones; para muchos autores las causas idiopáticas podrían representar más del 50% de todos los casos5,12-14 y podrían estar implicados procesos de disrupción vascular en el territorio mesentérico, o bien otras causas originadas por un evento desconocido que pasó inadvertido y no persistió en el tiempo por la cicatrización espontánea de la perforación7. La etiología infecciosa no aparece en las series más grandes y se cita en casos aislados: citomegalovirus15-17, rubéola18, hepatitis A y B19,20, parvovirus B1921, etc. También hay evidencia de que la PM puede asociarse con el consumo de cocaína22.
La prevalencia de PM es de 1/35.000 nacimientos y hace referencia a series posnatales, como citan Foster et al4 en 1987, que publican una serie de 7 casos y hacen una revisión de los 19 previamente comunicados. Esta misma cifra se encuentra en las citas más recientes, aunque podría ser mayor considerando que muchos casos son asintomáticos y no siempre se someten a investigación ecográfica de rutina.
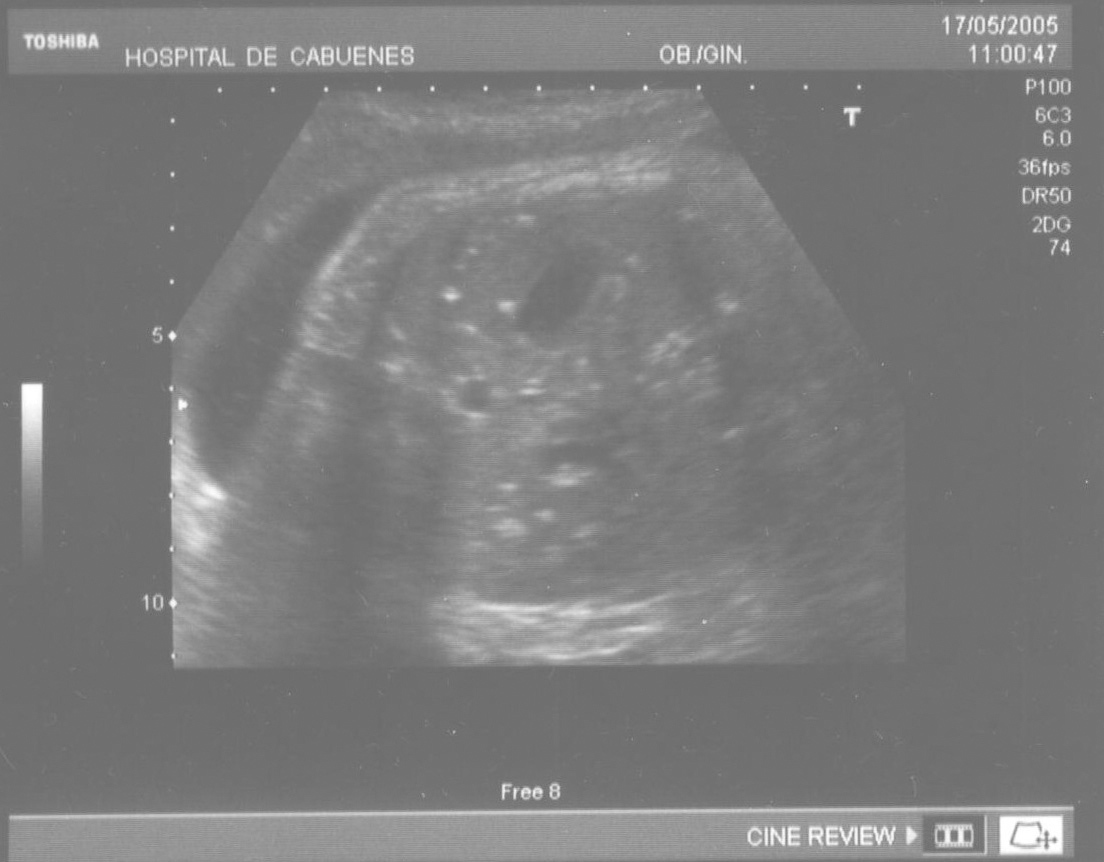
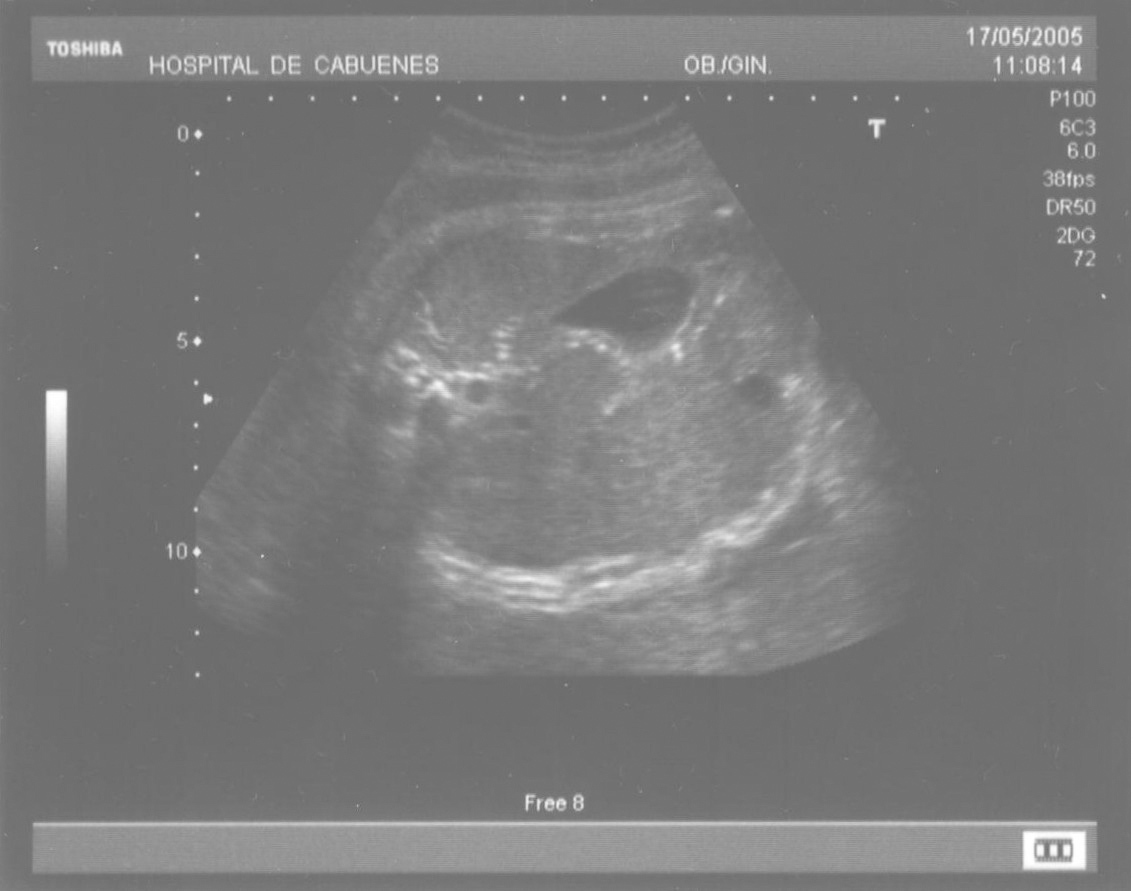
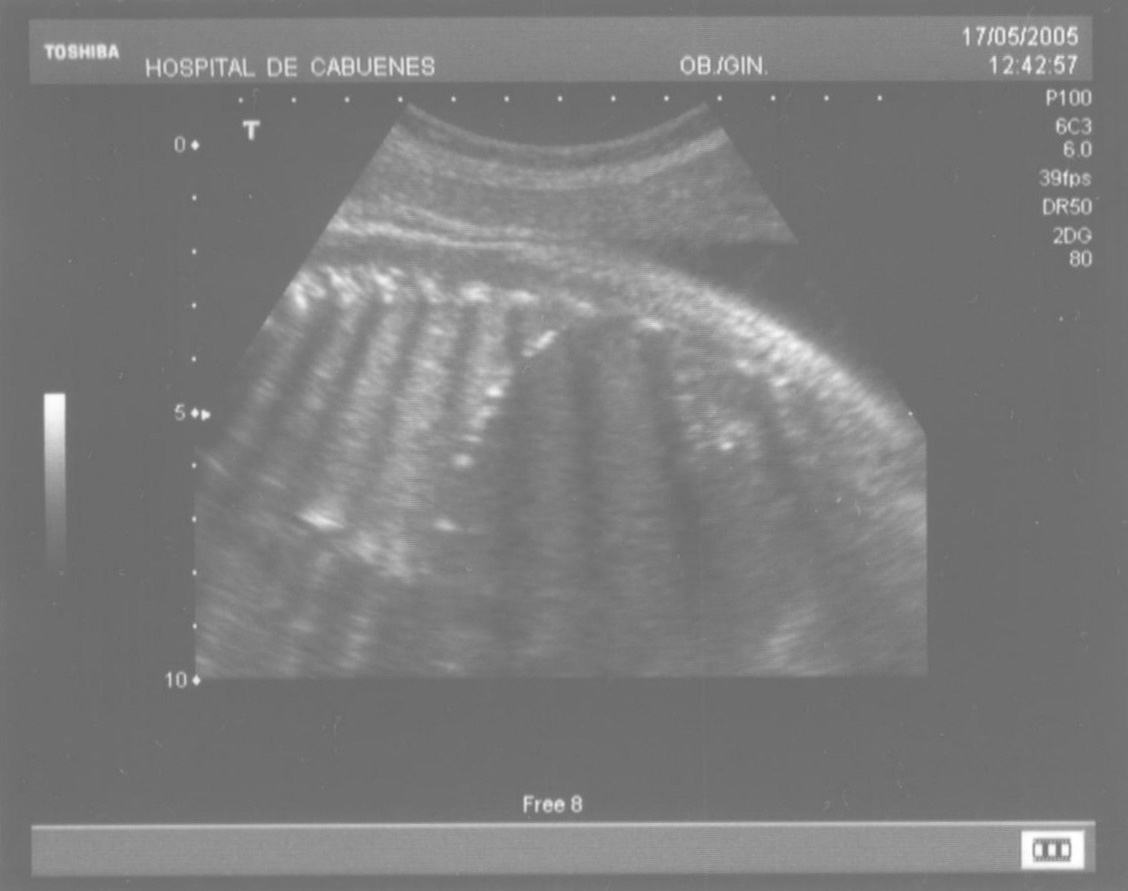
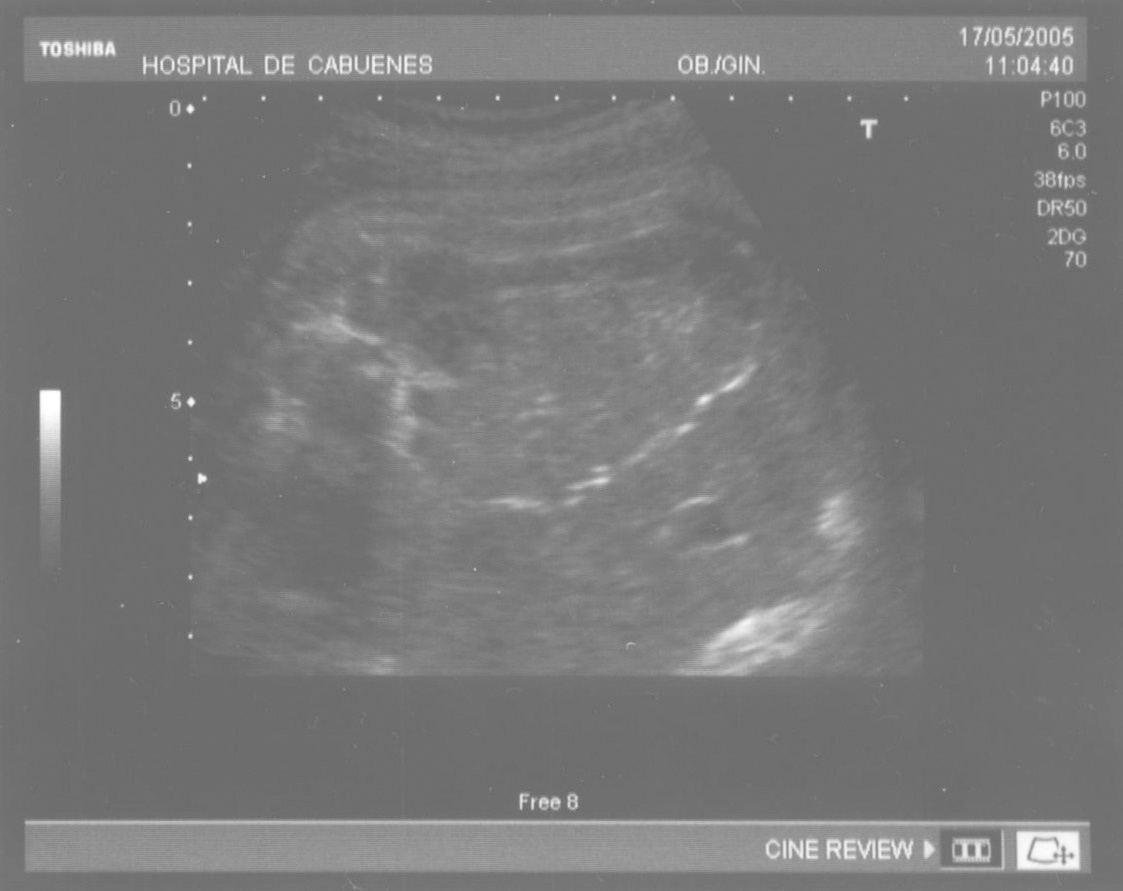
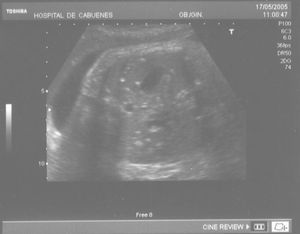
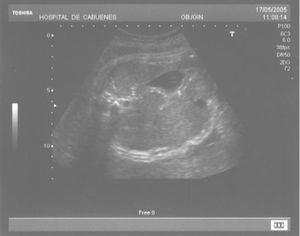
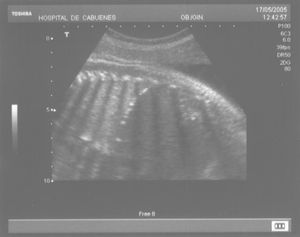
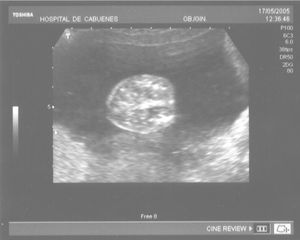
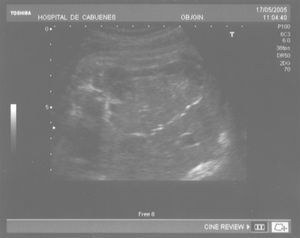
Las calcificaciones peritoneales son el hallazgo más consistente de PM y de hecho es la referencia en todas las series para establecer el diagnóstico posnatal en la radiografía simple de abdomen. Sin embargo, los criterios diagnósticos prenatales de PM no son uniformes y no se aplican de la misma manera por todos los autores. Las calcificaciones aparecen entre el 0-100% de los casos y en nuestra revisión, excluida la serie de Eckoldt et al8, en el 71,8%. Chan et al13 exigen como criterios para diagnóstico de PM la presencia de ascitis más dilatación de asas intestinales o calcificaciones. Sólo encuentran calcificaciones en 1/7 casos y argumentan que pueden pasar inadvertidas a los ultrasonidos. Eckoldt et al8, en una serie de 11 casos, no describen calcificaciones en ninguno y añaden: «no es común en nuestra institución practicar rayos X a la mujer gestante», e incluyen como diagnóstico prenatal de PM un caso con sólo ascitis, dos con ascitis e intestino ecogénico y dos con ascitis y polihidramnios, criterios que parecen insuficientes para establecer el diagnóstico de PM, aunque sea confirmado posnatalmente. Kamata et al23 sólo encuentran calcificaciones en 5/20 casos. Otros casos aislados comunicados tampoco encuentran calcificaciones1,10. El estudio de Dirkes et al14, citado en todas las comunicaciones por su clasificación de la PM en función del probable pronóstico neonatal, comunica calcificaciones en 9/9 casos y manifiestan: «el más frecuente y consistente hallazgo ecográfico, que es virtualmente patognomónico de PM, es la presencia de calcificaciones intraabdominales descartando su origen biliar, vascular, intraluminal, de órgano sólido o calcificación tumoral (...) la ascitis fetal aislada, la dilatación intestinal o el polihidramnios no son suficientes para el diagnóstico de PM». Chalubiski et al5 encuentran calcificaciones en algún momento del seguimiento prenatal en 8/9 casos y lo consideran el hallazgo más frecuente; Shyu et al12, en 16/17 casos; Tseng et al24, en 15/19 casos, y Foster et al4, en 6/7 casos y revisan los 19 casos comunicados previamente de diagnóstico prenatal de PM y encuentran calcificaciones o masas ecogénicas en 16/19 casos. Estroff et al6 comunican calcificaciones en 3/3 casos; éstas también están presentes en numerosos casos aislados1,3,7,25-27. Conviene tener presente que las calcificaciones abdominales encontradas en la PM son de localización peritoneal (extendidas por la superficie peritoneal) y deben distinguirse de las calcificaciones parenquimatosas, limitadas al parénquima hepático y, menos frecuentemente, al esplénico28. Aunque las calcificaciones peritoneales suelen ser más difusas, más numerosas y más groseras (como el caso que describimos; fig. 1) no debe obviarse este diagnóstico diferencial, de mayor importancia cuando la calcificación es el único hallazgo y de mayor dificultad cuando son escasas o se asocian con polihidramnios, pues en estas ocasiones no debemos pasar por alto la posibilidad de infección fetal u otras etiologías29. Además, debido al gran tamaño del hígado fetal, en ocasiones puede ser difícil localizar con precisión si las calcificaciones son peritoneales o hepáticas30. Sugieren una localización peritoneal: a) las calcificaciones que respetan el parénquima hepático y esplénico y se localizan en sus márgenes; b) la formación de láminas que «perfilan» el diafragma, y c) la localización en el escroto de un feto varón, que son particularmente diagnósticas de PM, debido a la conexión del saco escrotal con la cavidad peritoneal a través del proceso vaginal. Estos hallazgos estuvieron presentes en el caso que describimos (figs. 2, 3 y 4). Más raramente se localizan en el tórax por comunicación a través de los hiatos de la cava, la aorta o el esófago31. Debe tenerse presente la localización escrotal para establecer el seguimiento, pues no es inusual que en los primeros meses neonatales den lugar a masas o un escroto agudo que requieren intervención quirúrgica; la dificultad para orientar el diagnóstico es mayor cuando falta el antecedente de PM prenatal32-38.
Figura 1. Calcificaciones peritoneales difusas.
Figura 2. Calcificaciones que respetan el parénquima hepático y esplénico.
Figura 3. Calcificaciones formando «láminas» que perfilan el diafragma.
Figura 4. Calcificaciones escrotales.
La ascitis fetal, que marca la fase exudativa de la perforación intestinal, es, junto con las calcificaciones, el hallazgo más consistente de PM. No la encontramos en nuestro caso, probablemente porque nuestros hallazgos se corresponden con una fase evolutiva más tardía, pero diferentes autores la describen entre 11-100%; la media en nuestra revisión fue del 49%. Está presente en: 12/1712, 7/713, 6/118, 5/2023, 3/95, 1/914, 3/36, 4/7 y en 9/19 casos4. También se cita frecuentemente en series aisladas1,3,7,10,25,26. La ascitis, que puede ser hiperecogénica por las partículas de meconio en suspensión, suele ir en aumento inicialmente. Luego pueden aparecer masas hiperecogénicas, que son «conglomerados» de meconio (a veces con ascitis tabicada) y en fases más tardías, cuando la perforación intestinal se sella, la ascitis tiende a remitir o desaparecer. Pero en otras ocasiones no sigue esta secuencia típica y aumenta de tal modo que causa una distensión abdominal fetal grave, con elevación del diafragma y restricción del volumen pulmonar, que obligaría a realizar paracentesis evacuadoras prenatales para evitar hipoplasia pulmonar, hídrops y fallo respiratorio neonatal7,12,23,39. Aunque algunos autores incluyan en sus series la ascitis fetal como criterio aislado de PM, éste es insuficiente, pues puede encontrarse ascitis aislada en múltiples procesos diferentes de la PM: cromosomopatías (T-21, XO), infecciones (citomegalovirus, parvovirus B 19, lúes, toxoplasmosis y otras), hídrops precoz, ascitis urinaria, etc.29.
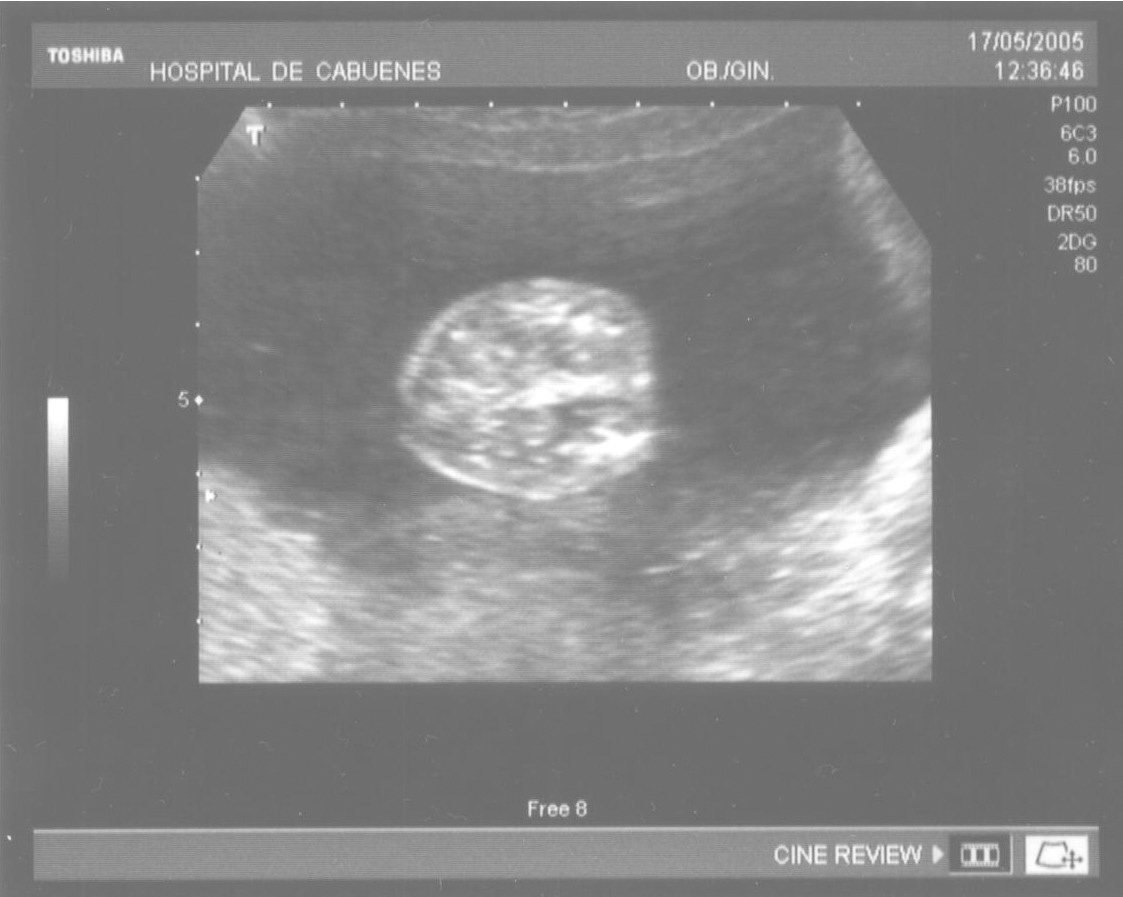
Los seudoquistes meconiales se forman a expensas del contenido intestinal derramado a la cavidad y que ha sido encapsulado por asas intestinales y tejido fibroso. Pueden adoptar diferentes morfologías, desde masas «sólidas», irregulares y de pared gruesa hasta cavidades quísticas con o sin elementos ecogénicos en suspensión. Pueden mostrar calcificaciones periféricas, incluso en su interior (fig. 5). Algunos autores no los diferencian de las hiperecogenicidades meconiales4,5. Su tamaño es variable y en ocasiones son tan voluminosos que obligan a su descompresión prenatal para evitar compresión sobre el tórax8,23. Su presencia en las diferentes series oscila entre el 14 y el 75%; en nuestra revisión es del 47%: 7/1712, 15/2023, 5/118, 2/914, 1/713 y 2/416 casos en series aisladas1,26.
Figura 5. Seudoquiste meconial.
La dilatación intestinal diagnosticada previamente o concomitante con la PM es un dato concluyente que apoya el origen digestivo de nuestros hallazgos, aunque no siempre permite establecer la causa: intrínseca (atresia, estenosis,) o extrínseca (mala rotación, vólvulos, duplicación, agangliosis, etc.). Una vez producida la perforación, la evolución de la dilatación intestinal es impredecible. En unos casos persistirá; en otros puede manifestarse como un intestino refringente y en otros desaparecerá. Se encuentra entre el 0-50%, y el 31,2% en esta revisión: 10/2023, 6/1712, 3/118, 4/914, 2/74, 0/95 y 0/713 casos.
El polihidramnios acompaña frecuentemente a la PM (11-71% y 34,4% en esta revisión) y parece estar en relación con una deficiente peristalsis intestinal. Puede resolverse espontáneamente según la evolución del proceso. Según los diferentes autores, está presente en: 7/2023, 4/1924, 2/78, 3/95, 1/914, 5/7 y 9/19 de los casos revisados4.
Aunque se comunicó la posibilidad de evolución a hídrops fetal, ésta es muy poco frecuente23,40.
La edad gestacional al diagnóstico se concentra en la segunda mitad de la gestación. Es raro el diagnóstico antes de la semana 20 (aunque hay casos comunicados12-14) pues la peristalsis intestinal, necesaria para expulsar el meconio a la cavidad abdominal, raramente comienza antes de ésta época1. La edad gestacional media al diagnóstico oscila entre las 27-32 semanas4,5,12-14,23,24.
En cuanto al tratamiento inicial, se hará una ecografía minuciosa en busca de anomalías asociadas que nos permitan orientar el diagnóstico hacia una etiología concreta y se valorará el estado de bien estar fetal (perfil biofísico, TNS, Doppler). Deben obtenerse serologías maternas de TORCH, lúes, parvovirus B19, VIH y hepatitis A, B y C. No hay acuerdo unánime sobre si debe realizarse de rutina un estudio de líquido amniótico o sangre fetal en busca de anomalías cromosómicas (no hay evidencia en las series publicadas), serologías infecciosas e investigación de las principales deleciones del gen de la FQ. Habitualmente, se hace el diagnóstico en edades gestacionales tardías y el reconocimiento de la FQ no alteraría el tratamiento; no obstante, en los casos precoces (además de la investigación parental) un diagnóstico positivo nos permite considerar una interrupción del embarazo1,7. Es fundamental un seguimiento con ecografías seriadas, que nos permitirá no sólo un adecuado control del proceso y sus posibles complicaciones, sino que además aportará más datos diagnósticos en la mayoría de las ocasiones. Estos estudios deben completarse con pruebas de bienestar fetal. Hay acuerdo en adoptar una conducta expectante4,5,7,12-14 sin intervención y esperar al inicio de parto espontáneo, que puede ser vaginal si no hay otras contraindicaciones. Debe adoptarse una conducta activa ante la aparición de complicaciones que puedan resultar en un compromiso materno-fetal: polihidramnios, ascitis masiva, seudoquistes meconiales grandes, deterioro fetal, etc. Dependiendo del tipo de complicación, de la condición fetal y la edad gestacional se planteará la evacuación de la ascitis o la punción de seudoquistes (evitará el compromiso respiratorio fetal y posible distocia), se descomprimirá un polihidramnios (evitará el compromiso respiratorio materno y prevendrá la prematuridad) o bien se planteará la extracción fetal, que será siempre en un centro terciario.
La edad gestacional al parto es prácticamente a término en todas las series: 37,413, 36,824, 36,412, 36,323 y 38,35 semanas.
El pronóstico, evidentemente, estará en relación directa con la causa subyacente. La historia natural de la PM posnatal está bien caracterizada y se asocia con una mortalidad alta (el 40-60%), con una incidencia de FQ del 15-40% y una necesidad de cirugía neonatal en más del 50% de los casos. Sin embargo, la historia natural de la PM diagnosticada prenatalmente permanece desconocida y no hay suficientes casos reportados para caracterizarla adecuadamente. No es adecuado, por tanto, hacer una extrapolación de diagnóstico posnatal a prenatal, pues ambos son muy diferentes14. Conviene, pues, hacer algunas consideraciones:
1. La mayoría de las series posnatales incluyen recién nacidos sintomáticos sin diagnóstico prenatal previo, pero no contemplan, por supuesto, los casos de PM que se resuelven intraútero y el recién nacido es asintomático (tanto con diagnóstico prenatal previo como sin él). La mortalidad reportada en series prenatales es del 1114, el 17,612, el 228, el 115, el 2023, el 10,524, el 013 y el 14%4, muy alejada de la referida en series posnatales: 40-60%2,41.
2. La incidencia de FQ en las series posnatales oscila entre el 15 y el 40%, lo cual ensombrecería el pronóstico si tenemos que extrapolarlo a cuando se hace un diagnóstico prenatal de PM: sin embargo, en las series prenatales no supera el 8%14. Casacia42 analiza el impacto de la FQ en 80 casos de obstrucción intestinal neonatal, de los que sólo el 37,5% tenía diagnóstico prenatal. De los 80 neonatos, 19 (24%) tenían FQ, en tanto que de los 30 casos de diagnóstico prenatal, la FQ se diagnosticó en 4 (13%). Conviene tener presente que esta serie analizó todos los casos de obstrucción intestinal: de ellos, 5 tenían diagnóstico prenatal de PM y ninguno tuvo FQ. La FQ es autosómica recesiva y se estima una incidencia de 1/2.500 caucasianos, 1/1.700 africanos y 1/5.000 orientales. El íleo meconial se asocia a la FQ en el 90% de los casos, pero sólo el 10-20% de los pacientes con FQ tienen asociado un íleo meconial. No debería confundirse el íleo meconial (frecuente en la FQ) con la PM, entidad en la que la FQ es una causa poco frecuente. La mayoría de los autores consultados no encuentra ningún caso de FQ en sus series4,5,12,14,23. Eckoldt et al8 menciona un 9% y Foster et al4, en una revisión de 19 casos, reporta un 10,5%.
3. En las series posnatales la obstrucción intestinal es una causa importante de PM; así, de 1.084 casos de PM posnatal2 se encontraba obstrucción intestinal en el 53%, lo que grava el pronóstico, requiere cirugía y aumentan la morbimortalidad. En las series de diagnóstico prenatal la necesidad de cirugía es muy dispar, desde el 0-100%: el 10023, el 90,98, el 76,412, el 66,64, el 57,113, el 22,214 y el 0%5. Estos resultados son muy contradictorios y probablemente se deban a los diferentes criterios de inclusión para el diagnóstico prenatal de PM, pues no se escapa que en una parte no despreciable de casos la perforación se resuelve intraútero y no se identifica la causa subyacente. Desafortunadamente el reducido número de casos comunicados no nos permite sacar demasiadas conclusiones. En muchas ocasiones en las que se sometió al feto a cirugía pudo encontrarse el lugar de la perforación, aunque no la causa subyacente, y en esto también existe disparidad: Kamata et al23 identifican la causa en 20/2023 casos y Eckoldt et al8 en 10/11 casos; sin embargo, el resto de los autores no identifica la causa de la perforación en 17/1712, 5/713, 7/914, 9/95 y 12/1924 casos.
Debido a la escasez y la diversidad de los resultados prenatales y a la dificultad de extrapolar un pronóstico basado en datos posnatales, algunos autores se han ocupado de intentar correlacionar los hallazgos ecográficos prenatales con la previsible evolución neonatal. Dirkes et al14, en 1995, clasifican la PM en 2 grandes grupos: PM simple (PMS) y PM compleja (PMC). En la PMS el único hallazgo prenatal son las calcificaciones abdominales y en la PMC, además de las calcificaciones, hay uno o más hallazgos de dilatación intestinal, ascitis, seudoquistes meconiales o polihidramnios. Sus 5 casos de PMS permanecieron asintomáticos y fueron dados de alta sin intervención (aunque ninguno fue cribado para FQ, todos permanecieron sanos, con una edad media de seguimiento de 15 meses). De los 4 casos de PMC, 2 estaban asintomáticos y no requirieron intervención (uno con una prueba frente a FQ negativa y en el otro no se hizo) y permanecían sanos a los 24 meses de edad. Los otros 2 precisaron cirugía, uno murió a los 19 meses de vida una tras trasplante hepático por complicaciones múltiples y el otro vive sano a los 24 meses (la prueba de detección de FQ fue negativa en ambos). Kamata et al23, en 2000, intentan también correlacionar los hallazgos intraútero y el pronóstico neonatal en su serie de 20 casos. Aunque, sorprendentemente, todos los casos de su serie requirieron tratamiento quirúrgico neonatal (18 tenían atresia intestinal y 2 obstrucción fecal del íleo distal), el pronóstico era diferente según su clasificación prenatal: tipo I: ascitis meconial masiva (5 casos); tipo II: seudoquistes gigantes (4 casos), y tipo III: calcificaciones y/o seudoquistes pequeños (11 casos). Se precisó reanimación cardiopulmonar al parto en 9 casos (5 tipo I y 4 tipo II); 4 recién nacidos murieron por fallo respiratorio y/o complicaciones postoperatorias (2 tipo I, 1 tipo II y 1 tipo III) y ninguno tenía FQ. Estos hallazgos ponen de manifiesto que los tipos I y II tienen un riesgo mucho mayor de mala evolución que los tipo III. Por ello, y teniendo en cuenta que los hallazgos prenatales pueden cambiar de I a II y a III, proponen que sean los hallazgos finales antes del parto los que puedan ser útiles para evaluar el pronóstico neonatal. La mala evolución de los tipos I y II se relaciona más con compresión diafragmática, que ocasionaría dificultad ventilatoria inmediata después del parto. La segunda razón era la observación del desarrollo de hídrops en 3 de sus 4 casos de tipo II. Estas 2 clasificaciones son las utilizadas por la mayoría de los autores, lo que apoya sus conclusiones. Aunque han demostrado ser útiles como orientación, es preciso disponer de más casuística en la que también pueda valorarse la influencia de la edad gestacional al parto, las paracentesis evacuadoras de las ascitis para prevenir fallo respiratorio neonatal y otras variables12.
El parto debe tener lugar en un centro terciario y se debe estar preparado para efectuar maniobras de reanimación cardiopulmonar. Tras una valoración clínica y una exploración abdominal del recién nacido, se debe solicitar una radiografía simple de abdomen en busca de signos de perforación y una ecografía abdominal. Si estas pruebas son negativas, en general, no se precisará de más estudios complementarios que una prueba para FQ. Si fueran positivas, se emprenderá el protocolo diagnóstico-terapéutico adecuado.
Correspondencia:
Dr. J.J. Arenas Ramírez.
Cabrales, 50 1.o D. 33201 Gijón. Asturias. España.
Correo electrónico: javarenas@sego.es
Fecha de aceptación: 5/12/2005.
Aceptado para su publicación: 1/9/2006.