Actualmente disponemos de diversas intervenciones que pueden reducir la incidencia de fracturas osteoporóticas, como son medidas higiénico-dietéticas, reducir el riesgo de caídas y tratamientos farmacológicos específicos.
El ranelato de estroncio es el único fármaco antiosteoporótico con un mecanismo de acción dual, ya que inhibe la resorción a la vez que estimula la formación ósea.
Los estudios realizados demuestran su capacidad para mejorar los parámetros de calidad ósea (microarquitectura), aumentar la densidad mineral ósea y reducir el riesgo de fracturas vertebrales y no vertebrales. Ha demostrado eficacia en mujeres osteopénicas y osteoporóticas, tanto con fracturas como sin ellas, y tanto en los primeros años después de la menopausia como en las mujeres mayores.
Existen datos de seguridad a 10 años en condiciones reales de administración, demostrando tener un adecuado perfil de seguridad y tolerancia.
El ranelato de estroncio, debido a su eficacia, seguridad y años de experiencia, es un tratamiento de primera elección para las mujeres con osteoporosis posmenopáusica y riesgo de fractura.
At present, several interventions are available to reduce the incidence of osteoporotic fractures, such as lifestyle modifications, reducing the risk of falls and specific pharmacological treatments.
Strontium ranelate is the only anti-osteoporotic drug with a dual mechanism of action, since it inhibits bone resorption while stimulating bone formation.
The studies performed to date have shown the ability of this drug to improve bone quality parameters (microarchitecture), increase bone mineral density and reduce the risk of vertebral and nonvertebral fractures. Strontium ranelate has demonstrated efficacy in osteopenic and osteoporotic women, with or without fractures, in the first few years after menopause and in older women.
Safety data are available for 10 years and under real conditions of administration, and demonstrate an adequate safety profile and tolerance.
Due to its efficacy, safety and years of use, strontium ranelate is a first choice treatment for women with postmenopausal osteoporosis and fracture risk.
La osteoporosis es una enfermedad que ya no es considerada como una parte inevitable del envejecimiento. Puede afectar a mujeres u hombres, aunque las mujeres posmenopáusicas presenten una mayor susceptibilidad debido a los efectos esqueléticos desfavorables que ejercen el déficit de estrógenos y el envejecimiento.
Los pacientes con osteoporosis tienen comprometida la resistencia ósea debido a una baja masa ósea y al deterioro de la microarquitectura del hueso y, en consecuencia, un mayor riesgo de fractura. La osteoporosis es la principal causa de fractura en mujeres posmenopáusicas1, por lo que representa un problema de salud importante y susceptible de prevención.
Se estima que la osteoporosis afecta al 35% de las mujeres españolas mayores de 50 años y hasta el 52% de las mayores de 70 años2. Asimismo, son atribuibles a la osteoporosis 1 de cada 5 fracturas en las mujeres mayores de 50 años3,4.
El riesgo de una mujer española de más de 50 años de padecer a lo largo de su vida una fractura de cadera puede situarse entre el 12 y el 16%5. La incidencia de fractura vertebral es, sin embargo, más difícil de determinar, ya que alrededor de un 60% de las mismas no son detectadas clínicamente6. En la atención hospitalaria española se constata que en más del 60% de los diagnósticos de fracturas vertebrales no concurren otras enfermedades crónicas relevantes y que la fractura vertebral se relaciona con un aumento en la mortalidad y la duración de la estancia hospitalaria7.
Actualmente, disponemos de diversas intervenciones que pueden reducir la incidencia de fracturas osteoporóticas, desde medidas para reducir el riesgo de caídas, a calcio y vitamina D y tratamientos farmacológicos específicos. Entre las diversas intervenciones farmacológicas de probada eficacia, distinguimos: a) fármacos antirresortivos (frenan el remodelado óseo) o anticatabólicos, como los bifosfonatos, SERMS, calcio y vitamina D y calcitonina, y b) fármacos osteoformadores o anabólicos, como la teriparatida (fragmento 1-34 de la parathormona [PTH)), o la PTH (1-84).
El ranelato de estroncio (RE) es el único fármaco con un mecanismo de acción dual, ya que inhibe la resorción a la vez que estimula la formación ósea.
Ranelato de estroncio: composiciónEl estroncio (Sr), de número atómico 38, es un elemento químico metálico, dúctil, maleable y químicamente reactivo, perteneciente al segundo grupo de la tabla periódica de Mendelèiev y es un metal alcalinotérreo. Fue aislado por Humphry Davy en 1808 y se encuentra en la naturaleza, fundamentalmente, como sulfato de Sr (celestina) o carbonato de Sr (estroncianita). Tiene la característica de emitir un color rojo brillante al arder en el aire, lo que ha supuesto su utilización industrial en trabajos de pirotecnia. Los isótopos Sr 85 y 90 son radiactivos.
El Sr, como el calcio y el magnesio, es un catión divalente que en los líquidos biológicos puede tener grados diferentes de unión a las proteínas del plasma8.
Tanto sodio, como plomo y Sr pueden sustituir al calcio en la posición que este ocupa en la hidroxiapatita9.
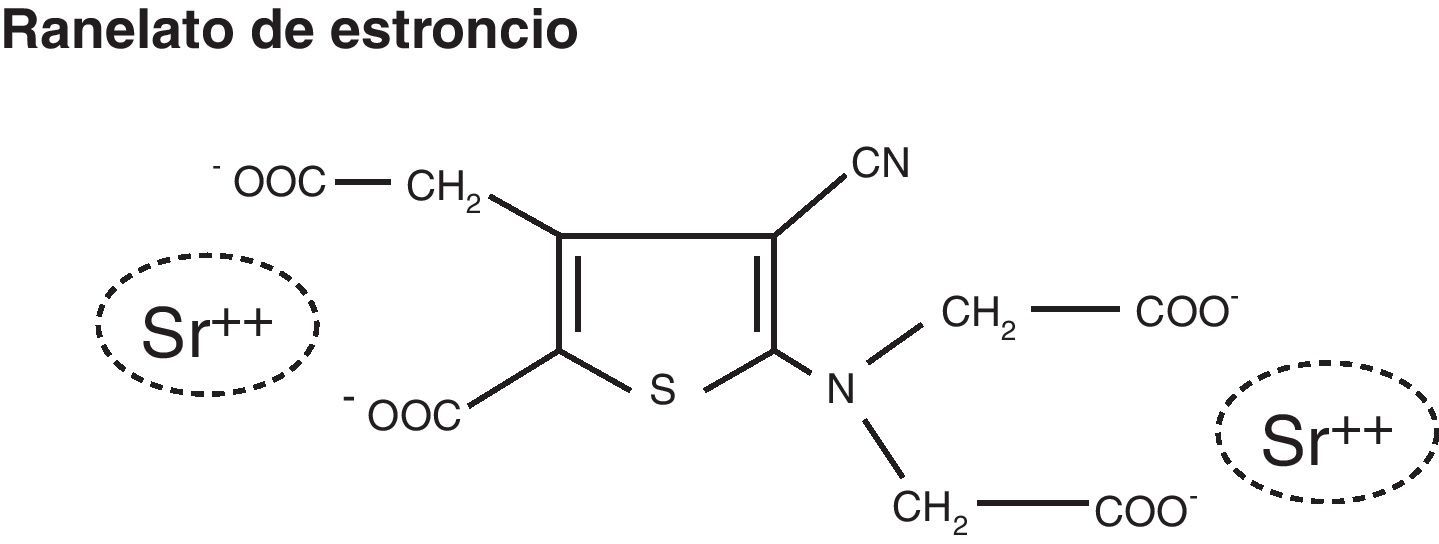
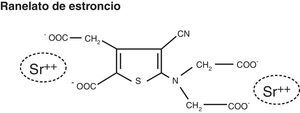
El RE es un compuesto con dos átomos no radiactivos y estables, en un medio orgánico que es el ácido ranélico (fig. 1). El nombre químico es sal biestroncica del 5-[bis (carboximetil)amino]-2 carboxi-4-ciano-3 ácido trifenilacético, con una masa molecular relativa de 513,49g/mol y con contenido del 34,1% de RE10.
Farmacocinética y mecanismo de acciónEn 199311 comenzó el desarrollo preclínico del RE, que incluyó numerosos estudios in vitro e in vivo con modelos experimentales y que permitieron el conocimiento de la farmacocinética de la sustancia y de su mecanismo de acción.
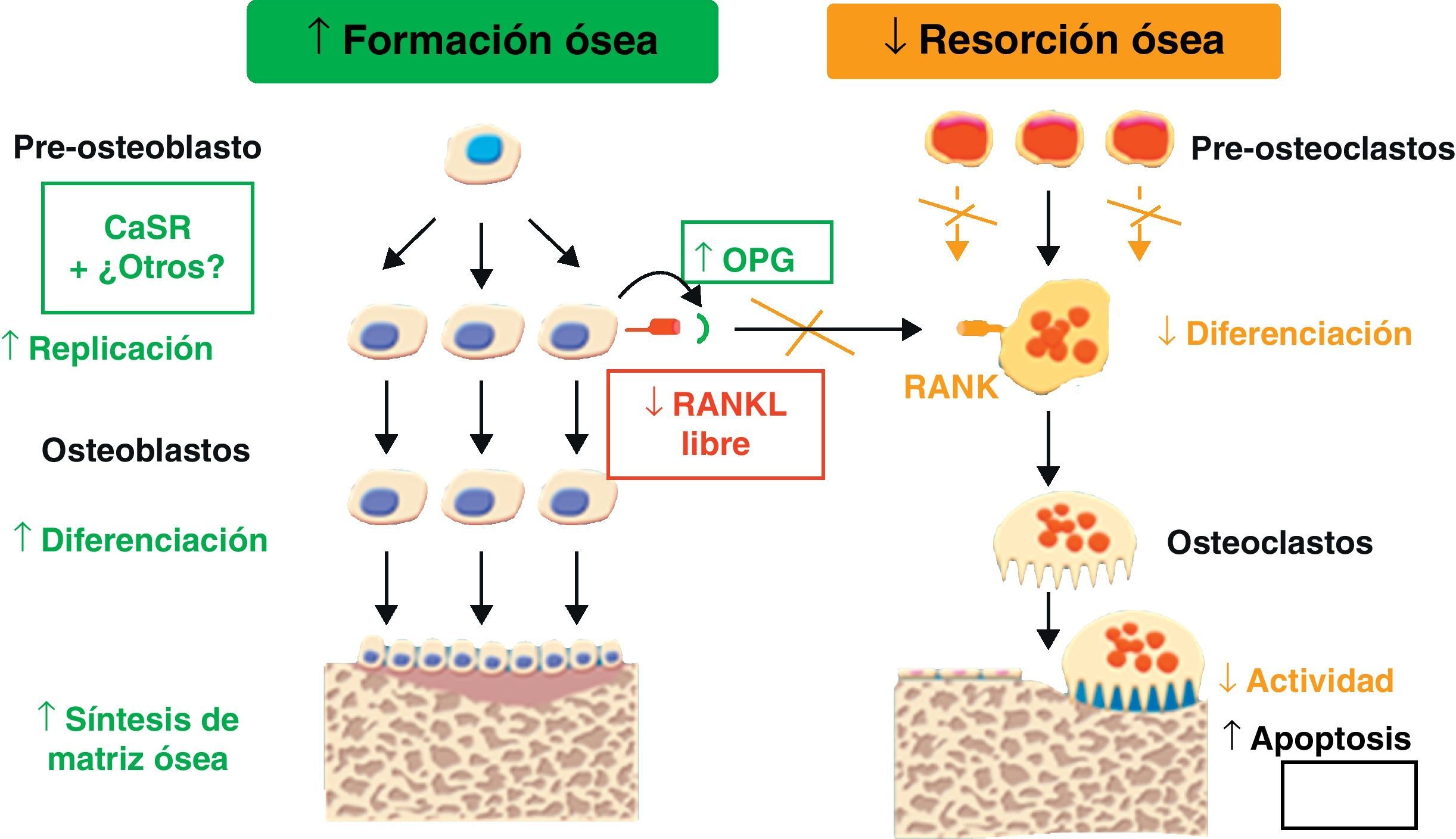
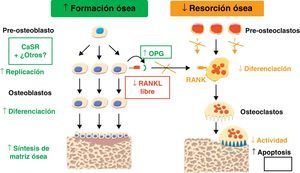
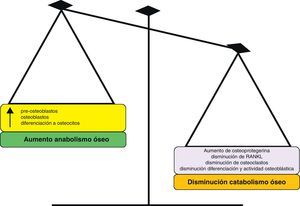
Estudios in vitro sobre la proliferación y resorciónEl RE ha demostrado ejercer un efecto positivo sobre la replicación de células osteoprogenitoras y preosteoblastos, a la par que incrementa la síntesis de proteínas colágenas y no colágenas en células de calota craneal y en osteoblastos maduros de rata12. El RE estimula también la diferenciación de precursores osteoblásticos a osteoblastos maduros capaces de intervenir en la mineralización ósea. Además, el RE favorece la diferenciación de osteoblastos humanos a osteocitos13 (figs. 2 y 3).
La inhibición de resorción ósea obtenida con RE se podría explicar a través de la inhibición, tanto de la diferenciación de osteoclastos como de su capacidad de resorción. En cultivos de osteoclastos de rata, el RE inhibe, de forma dosis dependiente, la expresión de anhidrasa carbónica II y el receptor de vitronectina14. Existen datos que indican que el RE también podría tener efecto estimulador de la producción de osteoprotegerina (OPG), conocido inhibidor de la osteoclastogénesis15 (figs. 2 y 3).
Comprobación en estudios en animalesEn ratas hembra normales, el RE incrementa la formación ósea y disminuye su resorción, obteniéndose como resultado un incremento de esta al mismo tiempo que una mineralización ósea conservada16. Además, tanto en ratones machos como en hembras normales, tratados con Sr durante periodos prolongados, se observa un incremento de los parámetros de formación y un descenso de los parámetros de resorción ósea17.
El Sr activa el calcium-sensing receptor (CaSR)18, receptor proteico sensible a los niveles extracelulares de calcio; a su vez, se ha demostrado que el CaSR está implicado en la replicación de preosteoblastos y osteoblastos inducida por RE16 (figs. 2 y 3).
El RE ha demostrado ser capaz de incrementar los niveles de OPG y a la vez de suprimir el RANKL (ligando de unión al receptor activador de NF-kB). Estos efectos positivos del RE se suprimen cuando se silencia parcialmente al CaSR, sugiriendo la importante implicación del CaSR en estas respuestas13 (figs. 2 y 3).
Farmacocinética y fase ILas propiedades farmacocinéticas han sido evaluadas en hombres y mujeres sanos19. El RE se disocia en el aparato gastrointestinal, dividiéndose en dos componentes: el Sr, que es el elemento activo sobre el metabolismo óseo, y el ácido ranélico, que no tiene actividad farmacológica20.
La absorción del Sr es dependiente de la dosis; sin embargo, el pico de la concentración plasmática (Cmáx) es menor de lo que correspondería proporcionalmente, probablemente debido, al igual que el calcio, a un proceso de saturación20.
Tras una ingesta de 2 g de RE, la biodisponibilidad absoluta de Sr es del 25% (19-27%)19. Esta biodisponibilidad se reduce a un 60-70% si se toma con calcio o comida, comparándolo con la administración tres horas después de haber comido19.
La máxima concentración de Sr se alcanza a las 3-5 h de la administración de una sola dosis de 2 g de RE19. El 25% se une a proteínas plasmáticas. El RE tiene una alta afinidad por el tejido óseo y se deposita preferentemente en el hueso recientemente formado20.
El Sr no se metaboliza y no inhibe el citocromo P45019. La eliminación del Sr es independiente del tiempo y de la dosis, teniendo una vida media efectiva de unas 60 h.
Los análisis farmacocinéticos han mostrado que la edad y el peso no afectan al aclaramiento del Sr, por lo que no se necesita ajustar la dosis19,20.
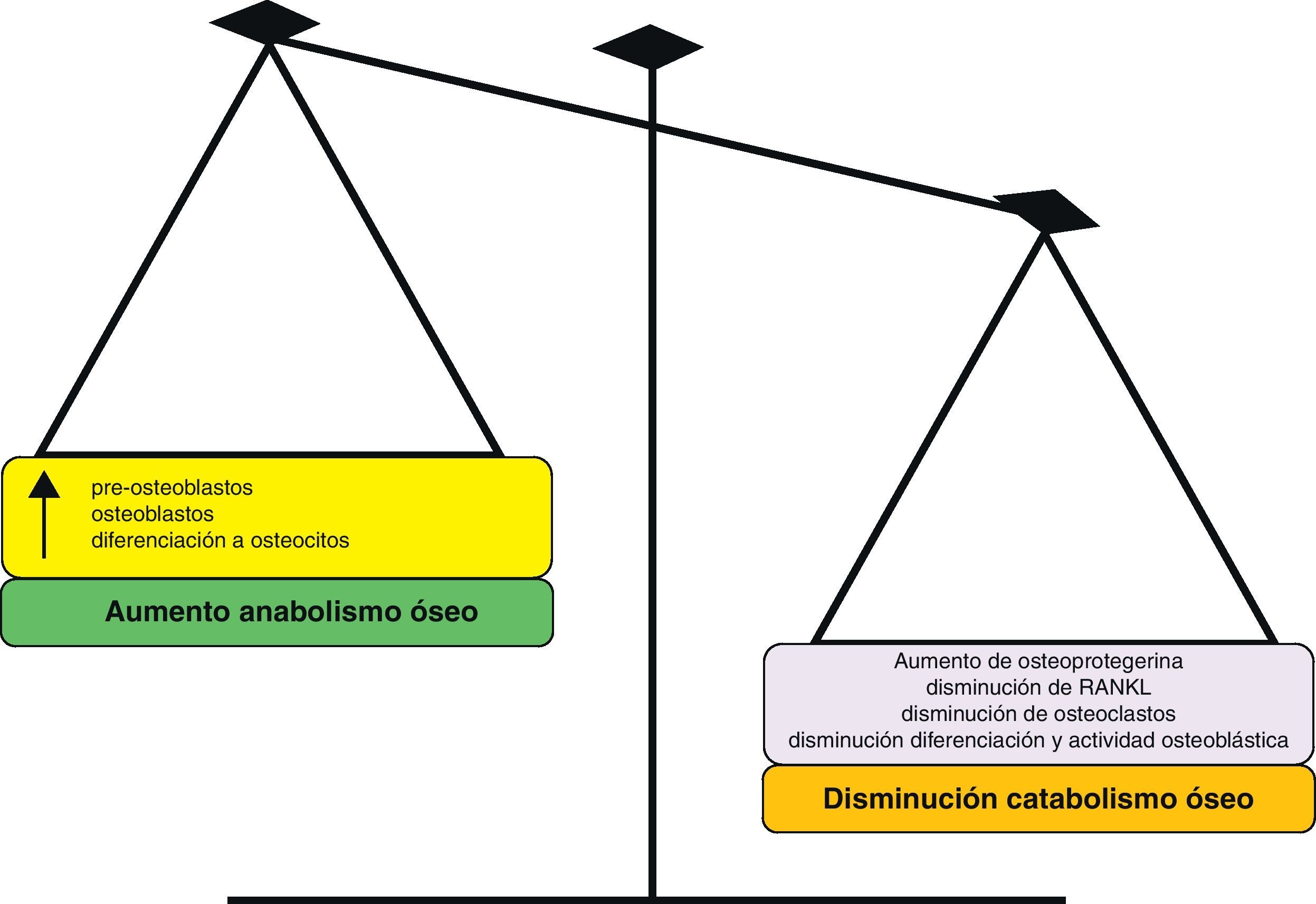
Eficacia clínicaEl RE es el primer tratamiento de la osteoporosis que aumenta la formación y reduce la resorción ósea de forma simultánea. Un mecanismo de acción dual innovador que se puede confirmar rápidamente en la clínica.
La dosis necesaria para el tratamiento y la prevención de la osteoporosis posmenopáusica fue evaluada en dos ensayos clínicos Fase II: PREVOS (Prevention of osteoporosis Study) y STRATOS (Strontium administration for treatment of osteoporosis)21. Ambos estudios fueron aleatorizados, doble ciego y controlados con placebo, y la conclusión fue que la dosis diaria de 2g era la de mejor eficacia y seguridad.
Estudios clínicos fase IIILa eficacia clínica se demostró en el ensayo clínico FIRST (Fracture internacional run in strontium trial), con un gran número de mujeres. De este ensayo fase III se realizaron dos estudios: SOTI (Spinal osteoporosis therapeutic intervention), que analizaba el efecto de prevención de fracturas vertebrales, y TROPOS (Treatment of peripheral osteoporosis), con el objetivo de estudiar la eficacia del Sr en las fracturas periféricas, no vertebrales.
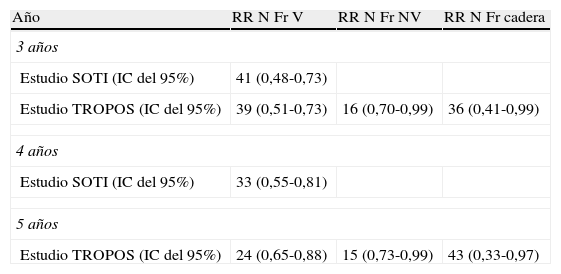
El ensayo SOTI22 incluía a 1.649 mujeres posmenopáusicas con al menos una fractura vertebral. El tratamiento de 2g diarios durante 3 años redujo significativamente (p<0,001) el riesgo de nueva fractura vertebral (tabla 1) en un 41% (RR:0,59; IC del 95%, 0,49-0,73). La incidencia de pacientes que presentaron una nueva fractura vertebral se redujo un 38% a los 3 años del tratamiento, con una reducción temprana del 52% al año.
Reducción (%) con RE vs placebo de nuevas fracturas vertebrales y no vertebrales de los estudios SOTI y TROPOS
| Año | RR N Fr V | RR N Fr NV | RR N Fr cadera |
| 3 años | |||
| Estudio SOTI (IC del 95%) | 41 (0,48-0,73) | ||
| Estudio TROPOS (IC del 95%) | 39 (0,51-0,73) | 16 (0,70-0,99) | 36 (0,41-0,99) |
| 4 años | |||
| Estudio SOTI (IC del 95%) | 33 (0,55-0,81) | ||
| 5 años | |||
| Estudio TROPOS (IC del 95%) | 24 (0,65-0,88) | 15 (0,73-0,99) | 43 (0,33-0,97) |
N Fr cadera: nuevas fracturas de cadera; N Fr NV: nuevas fracturas no vertebrales; N Fr V: nuevas fracturas vertebrales; RE: ranelato de estroncio; RR: riesgo relativo.
Grupo de alto riesgo, mujeres de más o igual de 74 años y con DMO en cuello de fémur≤–2,4.
Modificado de Ammann et al.16, Delannoy et al.17, Brown et al.18 y Servier. Summary of Product Characteristics19.
El estudio TROPOS23, también fase III, incluía a 5.091 mujeres posmenopáusicas. Este multicéntrico se llevó a cabo en 75 centros de Europa y Australia. El objetivo principal era evaluar la eficacia de 2g diarios de RE, por vía oral, durante 3 o más años, sobre nuevas fracturas vertebrales. El objetivo secundario era estudiar la densidad mineral ósea (DMO) del cuello de fémur. Las pacientes fueron incluidas en dos grupos paralelos (edad 76,8 ± 5 años, DMO cuello de fémur: 0,552g/cm2, 38,6% al menos con una fractura no vertebral en el momento de la inclusión). La duración media del tratamiento fue de 885 días ± 484. El resultado fue la reducción de la incidencia de nuevas fracturas no vertebrales en la población con intención de tratar (RR=0,84, IC del 95%, 0,71-0,99; p=0,04). También fue significativa la reducción del riesgo de un 33% en las pacientes que presentaron nueva fractura no vertebral, en sólo 18 meses de tratamiento (p<0,001). La reducción del riesgo de fractura de cadera (tabla 1) fue del 36% (0,41-0,99) (evidencia I-A).
Resultados a 5 añosTras el periodo inicial de 3 años, ampliaron el tiempo de seguimiento de sus pacientes hasta completar los 5 años. En el caso del estudio SOTI24, el método varió con respecto al inicial: hasta el cuarto año los pacientes continuaron tomando 2g de Sr o de placebo al día, según la aleatorización del inicio del estudio. Sin embargo, una vez finalizado el cuarto año, los sujetos en el grupo de RE fueron aleatorizados de nuevo para formar 2 subgrupos: uno que continuaría con el Sr (50% grupo RE/RE) y otro que pasaría a tomar placebo (50% grupo RE/placebo). Asimismo, todos los sujetos del grupo placebo pasaron a tomar RE (grupo placebo/RE).
Al final del periodo de estudio de 4 años, el riesgo de presentar una nueva fractura vertebral se redujo en un 33% en el grupo de RE con respecto al placebo (RR=0,67; IC del 95%, 0,55-0,81; p<0,001) (tabla 1).
En la ampliación del tiempo de seguimiento, en el estudio TROPOS se mantuvo el diseño sin modificaciones y se publicaron sus resultados a los 5 años25. Se incluyó en la ampliación a 4.935 pacientes, de los cuales 2.714 (53%) completaron los 5 años. Tras este tiempo, se observó una reducción del RR de presentar una nueva fractura no vertebral de un 15% (RR=0,85; IC del 95%, 0,73-0,99; p=0,032). La reducción del RR de tener una fractura de cadera en el subgrupo de alto riesgo fue de un 43% (RR=0,57; IC del 95%, 0,33-0,97). Aunque no es uno de los objetivos de TROPOS, se observó que el RR de padecer una nueva fractura vertebral disminuyó un 24% (RR=0,76; IC del 95%, 0,65-0,88; p<0,001) y, si tenemos en cuenta ambos tipos de fractura, en el grupo del RE disminuyó un 20% (RR=0,20; IC del 95%, 0,71-0,90; p<0,001) (tabla 1).
Resultados a 8 añosTras este periodo de 5 años, ambos estudios se fusionaron para continuar hasta completar un periodo total de 8 años26. Tras 3 años de estudio abierto de las pacientes provenientes de los estudios SOTI y TROPOS, se observa que el RE mantiene la prevención de nuevas fracturas vertebrales a los 8 años; así, la incidencia de nuevas fracturas vertebrales durante los años 6-8 no varió de las que hubo durante los años 1-3 (el 13,7 frente al 11,5% de las pacientes). Lo mismo se puede decir de las fracturas no vertebrales; durante los años 6-8 hubo un 12% de pacientes con fracturas no vertebrales, muy similar al 9,6% de pacientes que las tuvieron durante los años 1-326.
Resultados a 10 añosDurante la continuación del estudio SOTI y TROPOS a 10 años (n=233), la DMO lumbar aumentó de manera continua y significativa (p<0,05, hasta el 10.° año), presentando a los 10 años una variación relativa con respecto al momento basal del 34,5% ± 20,2%. En la cadera, la DMO aumentó significativamente hasta el séptimo año, con una variación con respecto a la basal del 11,7% ± 13,6%, y después se mantuvo estable.
Posteriormente, se comparó la incidencia de fracturas de la población tratada en los 5 años del estudio SOTI y TROPOS durante los 5 años de su extensión. Las incidencias acumulativas de fracturas vertebrales y no vertebrales (el 20,6 y el 13,7%), durante los 5 años de su extensión, no fueron estadísticamente diferentes de la incidencia acumulada de los 5 años del estudio original (el 18,5 y el 12,9%). Por otra parte, el RE ha demostrado seguridad y ser bien tolerado durante 10 años sin acontecimientos adversos27.
Eficacia del ranelato de estroncio en grupos concretos de pacientesDe todas las pacientes incluidas en los estudios de RE, se ha obtenido información más precisa agrupando a las pacientes por grupos de edad, situación de masa ósea, situación del recambio óseo basal y factores de riesgo asociados. El RE ha demostrado su eficacia en varios grupos de pacientes.
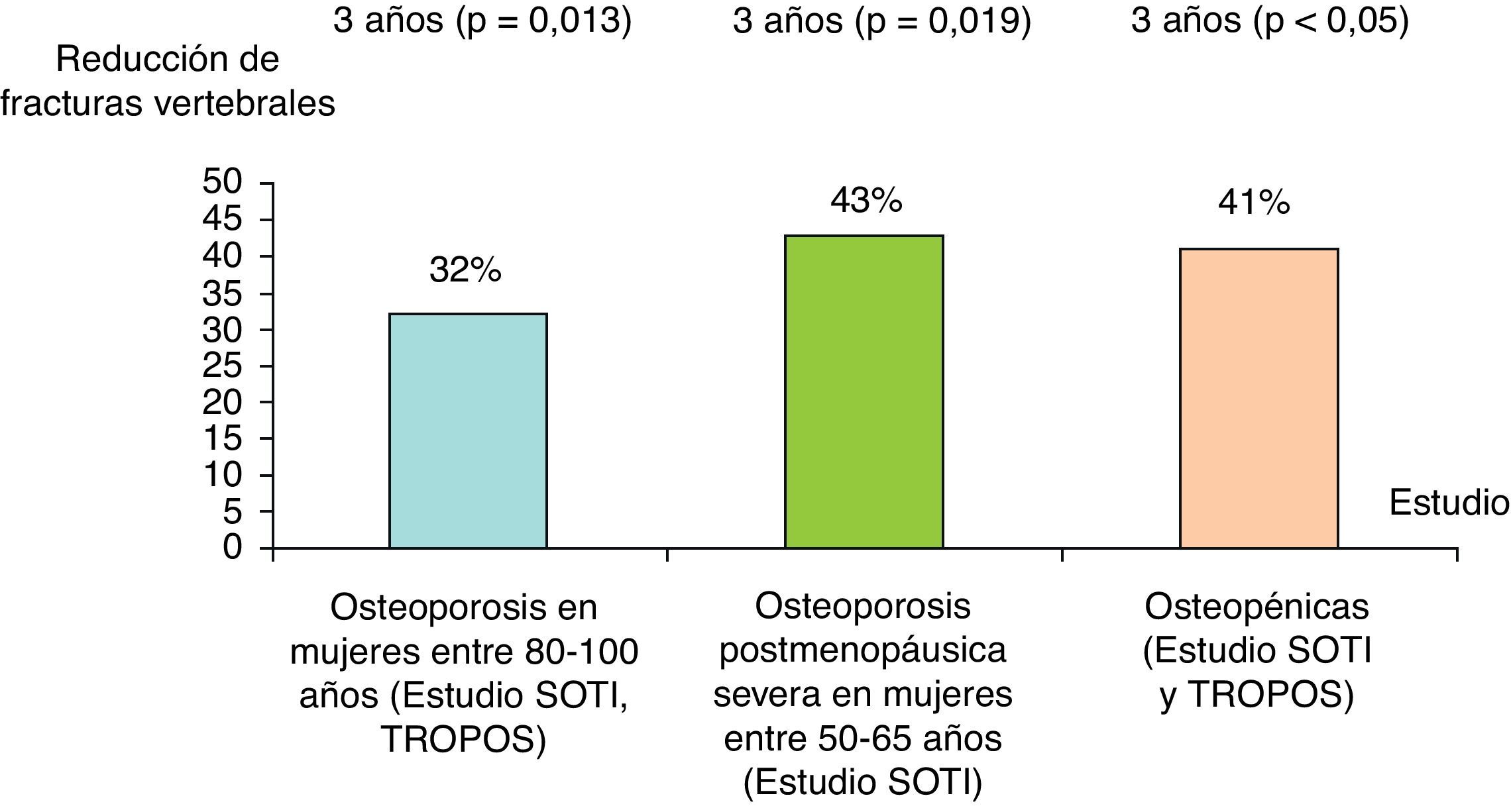
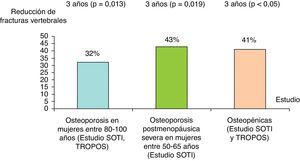
Eficacia del ranelato de estroncio en personas entre 80 y 100 años con osteoporosisSe ha realizado un estudio basado en un análisis posterior de los resultados de los estudios SOTI y TROPOS, que incluía a 1.488 mujeres entre 80 y 100 años, con seguimiento a 3 años28. En el análisis de intención para tratar, el RR de fracturas vertebrales, no vertebrales y clínicamente sintomáticas (vertebrales y no vertebrales) se redujo al año un 59% (p=0,002), 41% (p=0,027) y un 37% (p=0,012), respectivamente. Al final del tercer año, el RR de fractura vertebral, no vertebral y fracturas clínicas se redujo un 32% (p=0,013), 31% (p=0,011) y 22% (p=0,040), respectivamente. La medicación fue bien tolerada y el perfil de seguridad fue similar al de los pacientes jóvenes. Todo ello indica que incluso en las pacientes muy mayores el RE es eficaz (fig. 4).
Reducción en porcentaje con RE vs placebo de nuevas fracturas vertebrales de los estudios SOTI y/o SOTI y TROPOS en grupos concretos de pacientes21–23.
En un análisis posterior del estudio SOTI29, el RE fue efectivo en reducir el riesgo de fracturas vertebrales en un subgrupo de mujeres de edades entre 50-65 años, con osteoporosis postmenopáusica severa. El RR de una nueva fractura vertebral se redujo en un 43% en las pacientes que tomaban RE (n=168) comparado con el grupo placebo (n=185), a los 3 años (el 16,9 frente al 29,6%; RR=0,57; p=0,019) (fig. 4). Esta diferencia permaneció significativa a los 4 años (p=0,049). Además, el RE también mostró eficacia en la reducción de fracturas vertebrales clínicas, tanto a los 3 años (RR=0,46; p<0,05) como a los 4 años (RR=0,48; p<0,05).
Eficacia del ranelato de estroncio en pacientes osteopénicasDatos obtenidos del conjunto de los estudios SOTI y TROPOS30 mostraron que el RE era eficaz en reducir el riesgo de fracturas vertebrales en mujeres con osteopenia. En 1.166 mujeres con osteopenia a nivel de columna lumbar, fuera el que fuera el valor de DMO en cadera, se observó a los 3 años una reducción de un 41% de fracturas vertebrales en comparación con placebo (RR=0,59; p<0,05) (fig. 4). Además, fue también significativa la disminución, independientemente de si tuvieran fracturas vertebrales y no vertebrales (RR=0,62), o no tuvieran fracturas (RR=0,41; IC del 95%, 0,17-0,99). En pacientes con osteopenia en la columna lumbar y en la cadera (n=265) también se observó una reducción del 52% de las fracturas vertebrales (RR=0,48; p=0,034).
Finalmente, se observó una reducción del 72% de la primera fractura vertebral después de tres años, comparado con placebo (p=0,045), en un grupo de pacientes (n=176)31 procedentes de los estudios SOTI y TROPOS, sin fractura previa, y que presentaban osteopenia en columna lumbar y/o cadera, pero con uno o más factores de riesgo de fractura.
Relación del recambio óseo con la eficacia antrifracturaria del ranelato de estroncioPara comprobar la eficacia antifractura del RE de forma independiente de los niveles basales del recambio óseo, se han analizado datos conjuntos de los dos estudios, SOTI y TROPOS. Las pacientes fueron estratificadas en terciles, de acuerdo con los valores basales de dos marcadores bioquímicos del remodelado óseo: la fosfatasa alcalina ósea (b ALP, como marcador de formación ósea, n=4.995), y el telopéptido C-terminal en sangre (sCTX, como marcador de resorción ósea, n=4.891)32.
En el grupo placebo, el RR de fractura vertebral aumentó en relación con el nivel del tercil de los marcadores, siendo del 32 y el 24% para las pacientes en el tercil superior para b-ALP y CTX, respectivamente, comparados con las pacientes situadas en el tercil más inferior.
En el grupo de RE, la incidencia de fractura vertebral no era significativamente diferente entre los diferentes terciles. La reducción significativa de las fracturas vertebrales se observó en los tres terciles de ambos marcadores, con una reducción del RR de fractura del 31 al 47%, en relación al grupo placebo. La reducción del riesgo no difería entre los diferentes terciles (p=0,513 para b-ALP, p=0,290 para sCTX). Por ello, se puede concluir que la eficacia para reducir la fractura vertebral del RE es independiente de los valores basales de los marcadores del recambio óseo, apoyando la idea de que el RE ofrece beneficios clínicos a las mujeres osteoporóticas, independiente de su estado metabólico.
Influencia de los diferentes factores de riesgo en la eficacia antifracturaria del ranelato de estroncioSe ha analizado en los estudios de referencia la influencia de los diferentes factores de riesgo basales (edad, DMO basal, fracturas prevalentes, historia familiar de OP, índice de masa corporal [IMC) y hábito tabáquico) en la eficacia del tratamiento31.
La base ha sido la agrupación de los datos de los estudios SOTI y TROPOS (5.082 pacientes, 2.536 con RE y 2.546 recibiendo placebo, con una edad media de 74 años y seguidos durante 3 años).
La disminución del RR de fractura vertebral fue del 37% (p=0,003) en las mujeres menores de 70 años, del 42% (p<0,001) en las de entre 70-80 años, y del 32% (p=0,013) en las de más de 80 años, sin diferencia entre los tres grupos. El RR de fracturas vertebrales fue de 0,28 (0,07-0,99) en las mujeres con osteopenia, y de 0,61 (0,53-0,70) en caso de osteoporosis, y la DMO basal no fue un determinante de la eficacia.
La incidencia de fracturas vertebrales aumentó en el grupo placebo en relación al número de fracturas previas, pero esto no fue un determinante en la eficacia de RE. En 2.605 pacientes, el riesgo de presentar una primera fractura vertebral se redujo en un 48% (p<0,001)y el riesgo de padecer una segunda fractura vertebral descendió en un 45% (p<0,001). Asimismo, el riesgo de presentar más de dos fracturas vertebrales se redujo en un 33% (p<0,001). Los antecedentes familiares de osteoporosis, el IMC basal y el tabaquismo no fueron determinantes de la eficacia del RE, por lo que se puede concluir que la eficacia de RE en reducir las fracturas vertebrales en mujeres postmenopáusicas es independiente de los factores de riesgo basales para la OP.
Eficacia del ranelato de estroncio sobre la artrosis en pacientes osteoporóticasEn un análisis posterior de un conjunto de pacientes sin nuevas fracturas vertebrales o sin progresión de la fracturas preexistentes (n=1.105), procedentes de los estudios SOTI y TROPOS33, se observó una posible detección de la progresión de la artrosis en mujeres posmenopáusicas con osteoporosis y artrosis de columna. Después de 3 años de tratamiento, existió una clara mejoría en la artrosis y, como mínimo, de un grado de severidad en el grupo de RE frente al placebo (RR=0,58; IC del 95%, 0,42-0,79; p=0,0005), representando una mejoría de un 42%.
Analizando por otra parte la distancia del espacio interdiscal por radiografía, el grupo placebo claramente empeoró con respecto el grupo RE, siendo esta diferencia significativa (p=0,03), estando asimismo relacionado con el menor número de pacientes que tenían dolor de espalda durante el tratamiento en el grupo de RE (31,3%) que en el grupo placebo (41,8%), siendo esta diferencia también significativa (p=0,03). Esta ha sido la razón por la que se ha comenzado una nueva área de investigación, estando ya en proceso un ensayo clínico dirigido exclusivamente a ver la posible mejoría que el RE puede tener sobre la artrosis.
Eficacia y seguridad del ranelato de estroncio en el tratamiento de la osteoporosis del hombreSe ha realizado un estudio de 2 años de duración, doble ciego, aleatorizado, con RE vs placebo, con el objetivo principal de observar los cambios en la DMO de columna lumbar al año (estudio MALEO) (Male osteoporosis).
Al año se ha encontrado un aumento significativo de la DMO en columna lumbar de 5,3% + 0,75% (p<0,001) y en el cuello femoral del 2,9% + 0,62% (p<0,001), en el grupo de RE versus placebo. Los resultados al año con RE en hombres osteoporóticos han sido similares a los encontrados en mujeres osteoporóticas, por lo que la eficacia antifractura esperada es la misma. Los resultados de seguridad no han mostrado ningún evento adverso inesperado34.
Ranelato de estroncio y calidad óseaLa resistencia del hueso depende de dos factores: las propiedades materiales, es decir, la cantidad de mineral o masa ósea (densidad mineral ósea), y las propiedades estructurales, evaluadas con los nuevos parámetros de micro y macroarquitectura ósea.
Ranelato de estroncio: cantidad de masa óseaEl estudio SOTI demostró un aumento hasta del 8% (respecto al placebo) en la columna lumbar de mujeres con criterios de osteoporosis y más de 5 años de menopausia, al ser tratadas con 2g de RE durante 3 años, y el estudio TROPOS, publicó incrementos de más del 20% en columna lumbar de mujeres osteoporóticas entre 70 y 74 años25.
Los incrementos en la DMO parecen ser más discretos a nivel de cadera y cuello femoral (4,9% en el estudio PREVOS [Prevention of early postmenopausal bone loss by strontium ranelate]), aunque parece que la mejoría en la masa ósea se mantiene tras 5 años de cese del tratamiento25.
Varias publicaciones han analizado los datos de los estudios TROPOS y SOTI para demostrar la relación existente entre los cambios en la DMO y la incidencia de fractura en pacientes osteoporóticas tratadas con RE. Concluyen que cada punto porcentual de incremento de la DMO a nivel del cuello femoral y el fémur proximal, se asocia a una reducción significativa del 3 y el 2%, respectivamente, del riesgo de presentar nuevas fracturas vertebrales. En fracturas periféricas, cada incremento del 1% en la DMO en cuello femoral reduce un 7% el riesgo de nueva fractura de cadera en mujeres tratadas con RE durante 3 años. Por lo tanto, se puede concluir que la DMO es una buena herramienta para monitorizar la eficacia antifractura del RE.
Ranelato de estroncio y las propiedades estructurales del huesoExisten diversos estudios preclínicos que analizan el efecto del RE sobre los parámetros estructurales óseos. En ratas no ooforectomizadas, el RE aumentó el volumen óseo, sin incrementar el espesor del osteoide, lo que indica un efecto neutro sobre la mineralización. A su vez, el RE mostró un incremento en resistencia y biomecánica ósea a nivel vertebral y femoral16. Imitando el modelo de la mujer osteoporótica, en ratas ooforectomizadas el RE induce una preservación de la masa y la microarquitectura óseas. Estudios sobre la mineralización ósea se han realizado en monos y el RE se deposita en hueso cortical y trabecular de forma dependiente de la dosis y se distribuye uniformemente en el esqueleto óseo, tanto en fase de renovación como en fase estática.
Arlot et al., en análisis efectuados mediante microtomografía computarizada (μ-TC) de biopsias transiliacas, obtenidas tras 3 años de tratamiento con RE, encuentran cambios significativos en la microarquitectura trabecular, objetivándose en el grupo tratado un incremento del grosor cortical (DCTh: 18%) y en el número de trabéculas (DTbN: 14%), así como una separación intertrabecular significativamente menor (DTbSp: –18%), o lo que es lo mismo, una mayor conectividad trabecular. Estos cambios han sido apreciados previamente con la misma técnica por otros autores en biopsias aisladas de pacientes pertenecientes a ensayos clínicos aleatorizados doble ciego con RE35. Pero, además, la administración de este fármaco indujo un cambio significativo en la proporción entre formas trabeculares con forma de placa y con forma de varilla (DSMI: –22%), lo que indicaba claramente una mejora estructural y biomecánica del tejido trabecular.
Todos estos datos llevan a los autores a concluir que, el descenso en la tasa de fractura vertebral y no vertebral que experimentan las pacientes osteoporóticas tratadas con RE, está íntimamente relacionado con una mejora de las características microestructurales del hueso36.
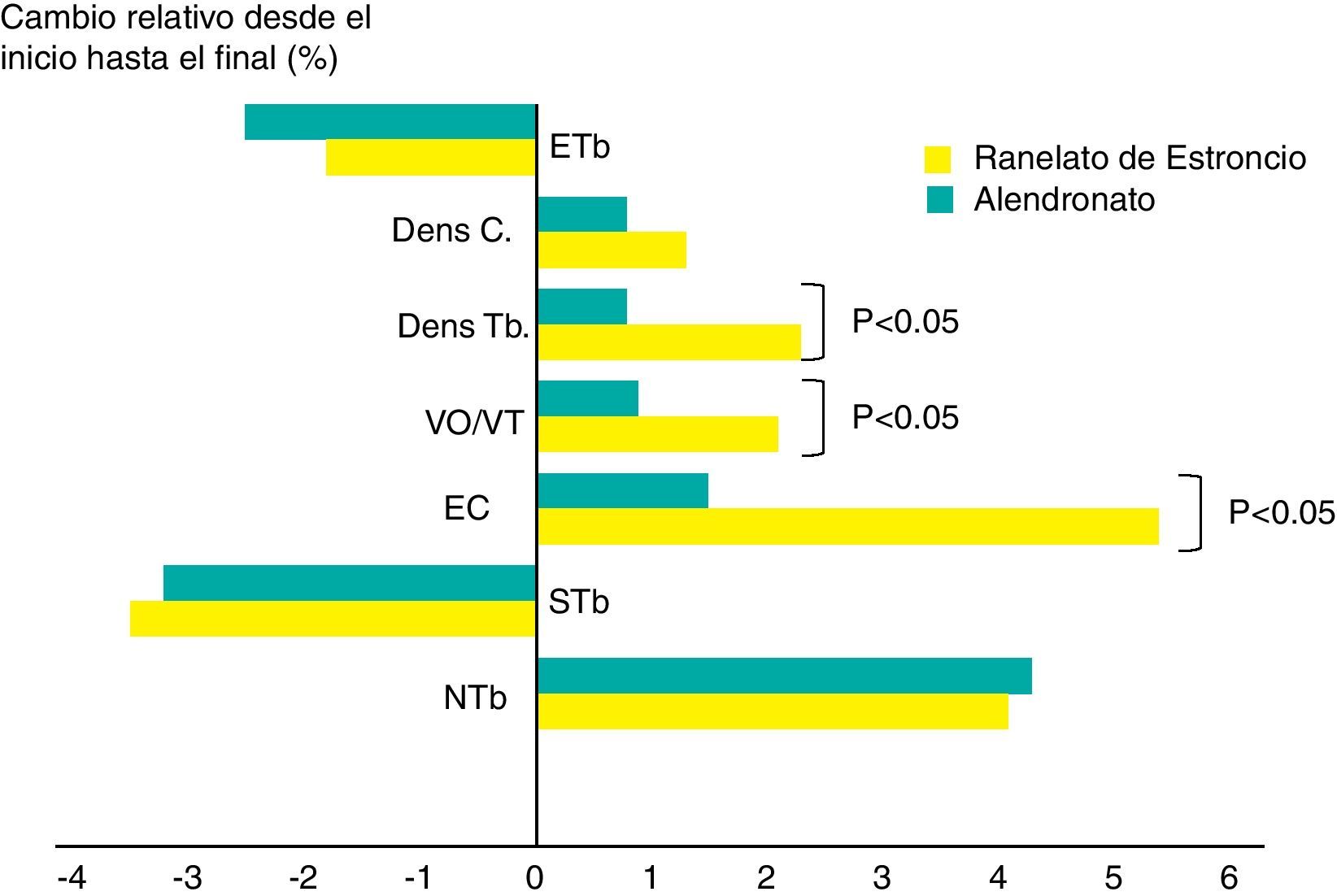
La nanoindentación ha demostrado que, a nivel de los nodos óseos trabeculares y corticales, el RE produce un aumento significativo de elasticidad, dureza y capacidad de disipar la energía de impacto recibida en las vértebras de las ratas16. El análisis histomorfométrico (2D) de biopsias óseas transiliacas, realizadas en las mujeres osteoporóticas de los estudios STRATOS, SOTI y TROPOS, demostró la seguridad del RE sobre el hueso, con una tasa de contenido mineral superior en el hueso trabecular y cortical, y con incrementos del 9 y el 10%, respectivamente, respecto a los controles. Recientemente, Briot et al. analizaron, mediante análisis estructural o de resistencia de la cadera (hip structural or strength analysis [HSA]), la extremidad proximal del fémur de 483 mujeres con osteoporosis posmenopáusica, todas ellas pertenecientes a la prolongación a 5 años del estudio TROPOS37. Los resultados mostraron que, tras 5 años de tratamiento con RE, el grosor cortical se mantuvo significativo. Y el análisis de las biopsias con micro-TC (3D), mostró un aumento del espesor cortical y del número de trabéculas en el grupo tratado con RE, así como menor espacio entre trabéculas, que permite mejor interconexión entre ellas. El tratamiento con RE se asoció a aumentos de la media del espesor cortical (EC, 5,3%), de la superficie cortical (4,9%) y de la densidad trabecular (2,1%) (todos los valores de p<0,001, excepto el de la superficie cortical: p=0,013). Con alendronato no se observaron cambios significativos.
Recientemente, se han presentado los resultados del mayor estudio histomorfométrico comparativo realizado hasta la fecha; un estudio internacional multicéntrico, doble ciego y controlado de 268 mujeres posmenopáusicas, a las que se les han realizado biopsias de cresta ilíaca en la basal a los 6 y a los 12 meses de recibir, o RE 2g/día, o alendronato 70 mg/semana. Las conclusiones señalan que la actividad osteformadora es mucho mayor y claramente significativa (p<0,001) en las pacientes tratadas con RE versus alendronato38.
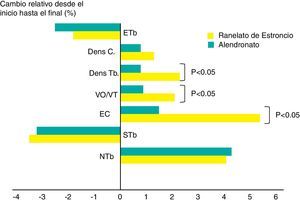
Rizzoli et al. concluyen que, dentro de las limitaciones metodológicas de la HR-pQCT (high resolution peripheral computerized tomography), por su posible sensibilidad a la atenuación de los rayos X de diferentes minerales, RE tuvo efectos mayores que alendronato en el espesor cortical de la tibia distal y en la densidad volumétrica trabecular (fig. 5)39.
Aumentos significativos del espesor cortical y del volumen y espesor trabecular tras 1 año de tratamiento con RE y relacionado con alendronato39. Dens C: densidad cortical; Dens Tb: densidad trabecular; EC: espesor cortical; ETb: espacio intertrabecular; NTb: número trabecular; STb: separación trabecular; VO/VT: volumen óseo/volumen trabecular.
En resumen, la principal característica del RE es su mecanismo de acción dual, como osteoformador y antirresortivo. Los estudios realizados demuestran su efecto incrementando la DMO, su poder antifractura, tanto a nivel vertebral como periférico, y su capacidad de mejorar los nuevos parámetros de calidad ósea (microarquitectura).
Por lo que podemos concluir que RE es un fármaco de acción dual capaz de disociar el remodelado óseo, reequilibrándolo hacia la formación de hueso, incrementando de forma significativa y precoz la DMO, mejorando la estructura del hueso trabecular y cortical y preservando la mineralización. De esta manera, RE, al mejorar significativamente las propiedades biomecánicas del hueso, disminuye de forma significativa el riesgo de fracturas en todas las localizaciones en la mujer con osteoporosis posmenopáusica.
Efectos adversos del ranelato de estroncioLos estudios SOTI y TROPOS22,23 incluyeron a 3.352 mujeres que recibieron tratamiento con RE, de las que 2.315 lo mantuvieron durante al menos 36 meses. Los efectos adversos detectados en estas pacientes no fueron diferentes de los observados en el grupo tratado con placebo y, en general, fueron moderados y transitorios. Los más frecuentes estuvieron relacionados con el aparato digestivo: náuseas (el 6,6 y el 4,3%, respectivamente) y diarrea (el 6,5 y el 4,6%, respectivamente). Ambos efectos adversos disminuyeron al cabo de los 3 primeros meses de tratamiento22,23.
En los pacientes mayores de 80 años, el efecto adverso más frecuente fue la cefalea, el 3,3% en el grupo con ranelato frente al 1,7% en el grupo control, con un intervalo IC del 95% de 0,1-3,3, seguido de los efectos adversos del aparato digestivo28.
Uno de los problemas controvertidos es la trombosis venosa. Aunque, por separado, en cada uno de lo estudios no se encontró aumento de enfermedad tromboembólica, en un análisis posterior de los datos agrupados se observó un incremento de esta. En un metanálisis de los estudios de referencia en fase 3, se encontró que, tras 5 años de tratamiento con RE, la incidencia anual de casos de enfermedad tromboembólica fue del 0,9 frente al 0,6% en el grupo placebo, con un RR de 1,4 (IC del 95%, 1,0-2,07). La causa de este efecto es desconocida y no tiene una explicación científica razonable. Como consecuencia, en la ficha técnica del producto se ha incluido la recomendación de que se tomen precauciones en las pacientes con riesgo incrementado de enfermedad tromboembólica, especialmente en caso de historia previa de tromboembolismo venoso. Recientemente se ha investigado este efecto en la clásica base de datos de investigación de Medicina General (General Practice Researche Database [GPRD]) del Reino Unido, donde se localizó a 1.754 pacientes en tratamiento con RE y los autores no encontraron que hubiera un aumento significativo de los episodios de trombosis venosa profunda40. En otro estudio con esta misma base de dato, GPRD, se observó un aumento del riesgo de presentar trombosis venosa profunda en mujeres con osteoporosis frente a las no osteoporóticas. La incidencia anual fue de 5,6 en las primeras frente al 3,2 por 1.000 en las segundas (RR=1,75; IC del 95%, 1,09-1,84). En las mujeres osteoporóticas no había diferencias entre aquellas que estaban tratadas con alendronato o RE y las no tratadas41.
Ha llamado la atención la descripción de unos pocos casos de síndrome de DRESS (drug rash with eosinophilia and systemic symptoms) en pacientes en tratamiento con RE. Se trata de una reacción de hipersensibilidad muy infrecuente que aparece a las 3-6 semanas de iniciar el tratamiento, consistente en fiebre, exantema, eosinofilia y afectación sistemática, como adenopatía, hepatitis, nefritis, etc.42,43. La European Medicines Agency ha valorado los datos y recomienda que los pacientes deban ser informados para que abandonen el tratamiento y busquen atención médica cuando aparezca un exantema. El exantema es una reacción adversa descrita tanto en los pacientes tratados como en los del grupo placebo y debe tenerse en cuenta que no todos los exantemas tienen suficientes manifestaciones y gravedad como para considerárseles como síndrome de DRESS.
Aunque no hay datos de pacientes con insuficiencia renal, se considera que el RE puede aumentar sus concentraciones en caso de disminución de la función renal y el consecuente descenso de su eliminación por el riñón. En esta situación, el Sr podría acumularse en exceso cuando el aclaramiento de creatinina sea inferior a 30ml/min44. Se desconoce por falta de información el efecto durante el embarazo, lactancia y en los niños.
Adhesión al ranelato de estroncioLos porcentajes de cumplimiento con los diferentes tratamientos de la osteoporosis oscilan entre un 50 y un 70%, según los distintos estudios y encuestas de sociedades científicas45.
Esta falta de adhesión conlleva repercusiones clínicas46, ya que las pacientes no cumplidoras presentan menor reducción de marcadores de remodelado óseo, una disminución de la DMO y consecuentemente aumento en el número de fracturas.
Entre los estudios realizados sobre la adhesión al RE destacamos el realizado por Beart et al.47, en su reciente publicación en Osteoporosis Internacional en 2010, sobre una población de 13.069 pacientes en un estudio de cohortes prospectivo observacional, en pacientes osteoporóticas no seleccionadas, donde estudiaron la seguridad y la persistencia con seguimiento a tres años. En él detallan la presencia de episodios de trombosis venosa profunda en 43 de los estudiados, que corresponde al 2.8/1.000, cifra más baja que la observada en el grupo que llevaba tratamiento con RE, estudio en fase II (7.9/1.000 pacientes/año) y con rango de 7,0/1.000 pacientes-año del grupo-control. No se registró ninguna reacción severa de hipersensibilidad. La persistencia de tratamiento con RE, calculada mediante el método de Kaplan-Meyer, resultó un 80% y un 70%, respectivamente, en los 12 y 14 meses después de la inclusión en el estudio.
Existen múltiples estudios sobre las preferencias de administración (posología) de los tratamientos médicos en la osteoporosis. Muchos de ellos evalúan, mediante encuestas telefónicas y otras técnicas, el grado de preferencia sobre las administraciones diarias, semanales, mensuales, y anuales, y, a decir verdad, las distintas pacientes tienen su preferencia a la hora de tomar un medicamento u otro, pero los distintos estudios no dejan clara cual es la preferencia real. En lo que todos los resultados coinciden es en que las pacientes eligen aquellos fármacos que interfieren lo menos posible en su vida y que mejor se adapte a sus necesidades, con independencia en muchos casos de la pauta de administración. En un estudio realizado por Rabenda et al.48, de reciente publicación, se valoró el impacto positivo sobre el grado de cumplimiento del RE y su efecto en el riesgo de fractura no vertebral en mujeres con osteoporosis. Este estudio fue un análisis post hoc de otros dos estudios internacionales en fase III, aleatorizados, con control placebo, doble ciego (The spinal osteoporosis therapeutic intervention and treatment of peripheral osteoporosis). Se llevó a cabo un estudio de casos-controles en el grupo tratado con RE. El cumplimiento fue cuantificado usando la tasa de uso de medicación (MPR [medication possession ratio]).
Como resultado de este estudio fueron identificados 285 casos de fracturas no vertebrales (de cadera=70, mayores no vertebrales=213), de los 1.425 controles. La significación MPR fue del 86,6% para los controles y del 82,6% para los casos con una significación estadística (p<0,001). Las mujeres cumplidoras con RE tuvieron una reducción del 38% de todas las fracturas no vertebrales, comparado con aquellas que no cumplieron (OR=0,62; IC del 95%, 0,47-0,81; p<0,001). Considerando solo las fracturas de cadera, el riesgo se redujo un 50% para aquellas pacientes cumplidoras, comparado con las pacientes no cumplidoras (OR=0,50; IC del 95%, 0,28-0,88; p<0,05). El análisis final puso de manifiesto la importancia de la buena cumplimentación del tratamiento, con el objetivo de reducir el riesgo de fracturas osteoporóticas. En particular, hubo una gran reducción en el riesgo de las fracturas no vertebrales y en fracturas de cadera al incrementarse el grado de cumplimiento.
Los profesionales desempeñan un papel importante a la hora de garantizar la adhesión de las pacientes al tratamiento de la osteoporosis49. El tratamiento debería personalizarse según las necesidades de la paciente; mientras que las dosis menos frecuentes pueden mejorar la adhesión, algunas pacientes puede que se adhieran mejor al tratamiento diario. Las pacientes tienen que conocer los requerimientos relacionados a la dosis y los efectos adversos, y estos temas deberían explicarse de nuevo durante cada visita al médico50. Para los pacientes que reciban una dosis menos frecuente se debe prestar atención en dirigir un sistema de pautas que ayuden al paciente a recordarlo. De manera alternativa, una llamada o una carta remitida por el sistema sanitario pueden servir tanto de recordatorio del tratamiento, como de una oportunidad para explicar de nuevo y concienciar sobre la necesidad de realizar correctamente el tratamiento.
Calidad de vida con ranelato de estroncioEn el estudio SOTI, la calidad de vida constituyó una variable secundaria, evaluada a través de dos cuestionarios: SF-36 y de QUALIOST®51 en condiciones basales y cada seis meses; el análisis principal se realizó tras un seguimiento de 3 años52.
La evolución de la puntuación general reveló una mejora de la calidad de vida (CV) en el grupo tratado con el RE y un deterioro en el del placebo (p=0,03). Esta mejoría de la CV del grupo de RE se confirmó por la evolución de las puntuaciones emocionales y físicas de este grupo, en comparación con el grupo placebo (p=0,04 y p=0,05, respectivamente), indicando efectos beneficiosos en la función emocional y física. Un mayor numero de pacientes con RE (+ 31%) estaban sin dolor lumbar a los 3 años del estudio comparado con placebo (p=0,005).
Existen datos del estudio SOTI a más largo plazo (4 años), donde se ha seguido a 1.250 pacientes24. La puntuación global del QUALIOST era más baja (indicando mejor CV) en el grupo tratado con RE que en el grupo placebo, y las diferencias entre los valores basales y finales fueron de –0,06 en el grupo de RE y de 1,92 en el grupo placebo (p=0,020).
Coste efectividad del ranelato de estroncioComparado con el no tratamiento, el RE es coste-efectivo con respecto a la calidad ajustada por años de vida (QALY), tanto desde un punto de vista social53, como para sistemas de salud pública54,55 o privada56. En Bélgica se ha comparado el concepto de coste-efectividad del RE con un bifosfonato como el residronato y el RE ha resultado ser más rentable que el residronato con respecto al coste por QALY en mujeres con osteoporosis postmenopáusica en edades por encima de los 75 años56.
En otro estudio se ha valorado el coste-efectividad de RE en Reino Unido, concluyendo que el RE es coste efectivo para el tratamiento de la osteoporosis establecida en mujeres mayores de 65 años. También se encontró coste-efectividad en la prevención y tratamiento de fracturas asociadas a osteoporosis en mujeres más jóvenes con factores de riesgo adicionales57.
Perfil del paciente usuario de ranelato de estroncioEl RE está indicado en el tratamiento de la osteoporosis en la mujer posmenopáusica para reducir el riesgo de fracturas vertebrales y no vertebrales. En principio, podría indicarse en todas aquellas mujeres con esta condición y en las que no exista contraindicación a su uso.
Al evaluar las características específicas y los efectos del producto, se podrían perfilar aquellas mujeres en las cuales cabe esperar un beneficio mayor. El RE ha demostrado eficacia en mujeres osteopénicas y osteoporóticas, tanto en los primeros años después de la menopausia, como en las muy mayores, por lo que su indicación podría situarse en torno a las mujeres con riesgo aumentado de fractura a cualquier edad de después de la menopausia. RE ha demostrado eficacia tanto si existía fractura vertebral como en ausencia de ella e independientemente del tipo y número de factores de riesgo basales (evidencia I-A).
En los ensayos clínicos, los efectos secundarios no fueron diferentes en el grupo con RE que en el grupo placebo, y en general fueron moderados y transitorios, por lo que otro grupo que podría beneficiarse son las pacientes con mala tolerancia a otros tratamientos.
La dosis recomendada de RE es de un sobre de 2g tomado una vez al día. La absorción de RE se reduce por la comida, la leche y sus derivados, disminuyéndose su biodisponibilidad en un 60-70%, por lo que debe tomarse tras disolver en agua, preferiblemente dos horas después de una comida y, debido a la lenta absorción, al tiempo de ir a la cama.
La administración en forma de suspensión en agua puede resultar más fácil que deglutir un fármaco en una formulación en comprimidos para algunas pacientes, sobre todo para las de edad avanzada.
No es preciso ajustar la dosis en función de la edad ni en las pacientes con función hepática alterada o función renal disminuida de manera leve o moderada (aclaramiento de creatinina entre 30-70ml/min). En casos de aclaramiento de creatinina inferiores a 30ml/min, no está indicada la administración de RE.
Las pacientes deben recibir suplementos de calcio y vitamina D si la ingesta dietética no es suficiente, e idealmente separados del momento de ingerir RE para no interferir en su absorción.
No se producen interacciones con fármacos de frecuente utilización, como antiinflamatorios no esteroideos, bloqueadores de la bomba de protones, diuréticos, digoxina, glucósidos cardiacos, vasodilatadores, bloqueadores de los canales del calcio, bloqueadores beta, antagonistas de la angiotensina II, anticoagulantes orales, antiagregantes plaquetarios, estatinas o benzodiacepinas.
En su composición no figura la lactosa como excipiente, por lo que puede ser utilizado en pacientes alérgicos a este disacárido.
Otras consideraciones que se deben tener en cuenta son que el RE tiene un adecuado perfil de seguridad y tolerancia, por lo que ayuda a un buen cumplimiento. Por ello, en los ensayos clínicos la tasa de abandono ha sido similar al placebo. Hay que tener en cuenta que debe discontinuarse si apareciera un signo de alergia, como cualquier otro tratamiento.
Ha sido evaluado el binomio coste-eficacia del RE y las conclusiones han sido que el uso de RE es más rentable, en términos de calidad ajustada a años de vida, que el placebo y que el residronato.
Por todo lo anterior, y debido a su eficacia, seguridad y años de experiencia, es considerado y consideramos que es un tratamiento de primera elección para las mujeres con osteoporosis posmenopáusica y riesgo de fractura.
ConclusiónLos estudios realizados con ranelato de estroncio demuestran su efecto incrementando la densidad mineral ósea, su poder antifractura, tanto a nivel vertebral como periférico, y su capacidad de mejorar los nuevos parámetros de calidad ósea (microarquitectura).
Conflicto de interesesJosé Luis Neyro ha recibido grants de MSD, Amgen, GSK, Lilly, Casen Fleet, Viñas, Astellas. Ha dado conferencias y realizado asesorías para Pfizer, Sanofi Pasteur MSD, GSK, AMGEN, Lilly, Casen Fleet, Servier.
Francesc Baró ha ejercido como advisory board para Amgen y MSD, además de pronunciar diferentes ponencias de formación continuada patrocinadas por Servier, Bayer Schering, Pfizer, Caseen-Fleet, Ferring, todos ellos con sede en España.
Dolores Juliá ha recibido apoyo para acudir a reuniones y congresos por parte de la Industria farmacéutica, ha participado como ponente en congresos nacionales y locales (2009-2010) por invitación de la organización de los mismos y en un curso de formación continuada en fitoterapia (2010). También ha recibido financiación para la elaboración de material docente para curso de formación continuada en fitoterapia por parte de la Industria farmacéutica (2009).
Santiago Palacios ha sido ponente o miembro del Comité de Expertos de Servier, Pfizer, Pierre Fabre, Bayer Schering Pharma, Lilly, Daiichi Sankyo, Roche, Warner Chilcott, Amgen, Arkopharma y Boehringer Ingelheim. También ha recibido becas de investigación y/o honorarios por consultoría de Pfizer, Servier, Lilly, Daiichi Sankyo, Amgen, Arkochim, Bayer Schering Pharma y Teva.