Caso de rotura uterina por placenta pércreta confirmado histológicamente a las 20 semanas de gestación y revisión bibliográfica de casos clínicos publicados de menos de 28 semanas.
We report a case of histologically-confirmed uterine rupture due to placenta percreta at 20 weeks of gestation. We provide a review of case reports of this event occurring at less than 28 weeks of pregnancy.
La rotura uterina por placenta pércreta es una complicación extremadamente rara en el segundo trimestre de gestación y difícilmente predecible, pero las consecuencias de la misma son habitualmente muy graves, requiriendo actitudes quirúrgicas agresivas que comprometen tanto la situación vital del feto y de la gestante, como su futuro genésico. Las razones son el gran compromiso hemodinámico secundario a la rotura uterina, que precisa de numerosas transfusiones para mantener la volemia. Las alteraciones derivadas de la hemorragia y los trastornos de la coagulación secundarios a la hipovolemia pueden tener como consecuencia, no ya la muerte fetal, sino, en ocasiones, la materna.
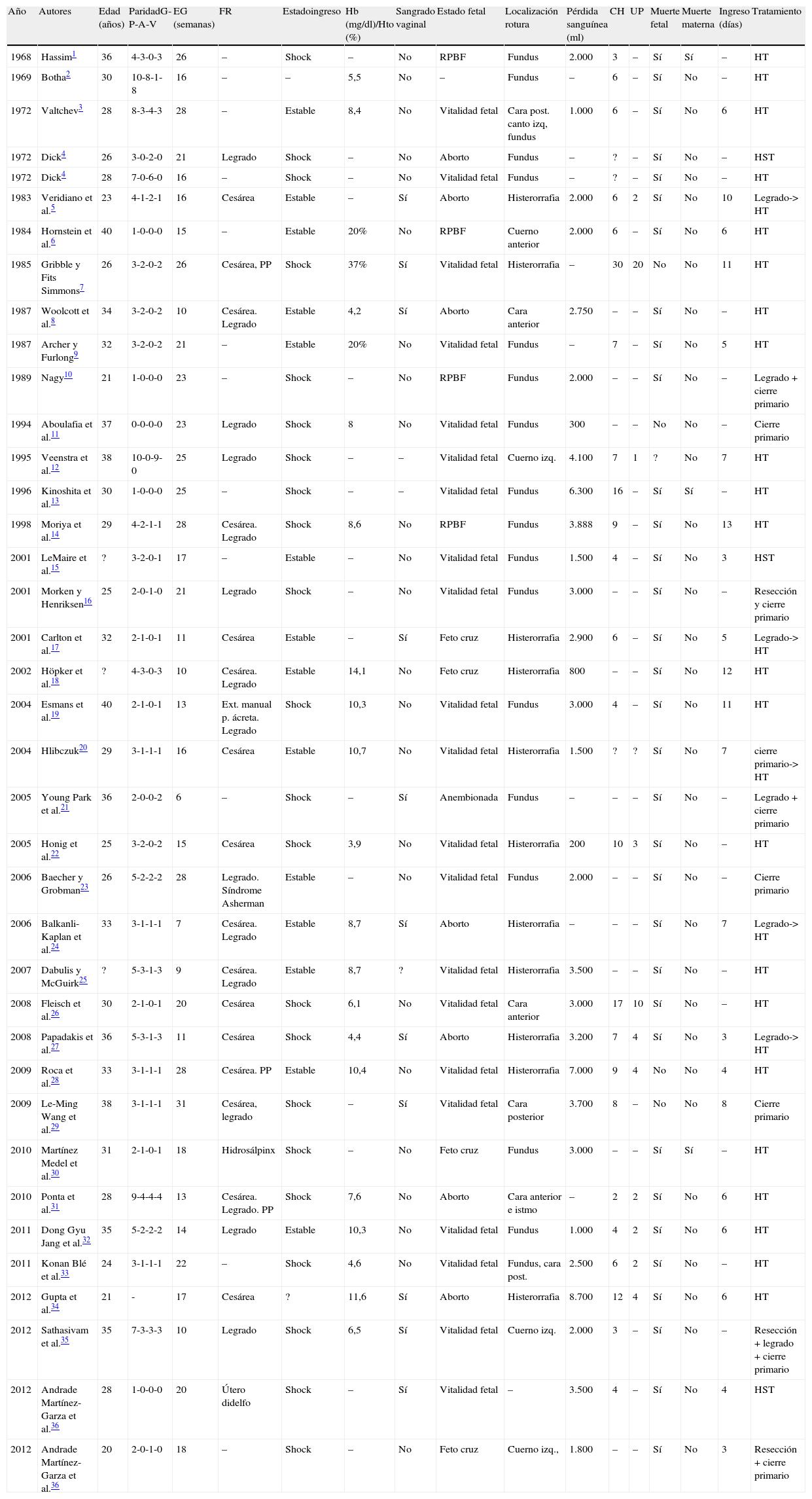
Revisión de la literaturaLos casos de placenta pércreta con resultado de rotura uterina por debajo de las 28 semanas son extremadamente excepcionales1–36. Usando las palabras clave «placenta pércreta», «primer trimestre», «segundo trimestre», «rotura uterina», «abdomen agudo» y «embarazo» para una búsqueda en MEDLINE desde 1966 hasta 2012, se obtuvieron 37 comunicaciones de casos de placenta pércreta durante el primer y el segundo trimestres, que resultaron en perforación uterina (tabla 1).
Casos publicados en la bibliografía
| Año | Autores | Edad (años) | ParidadG-P-A-V | EG (semanas) | FR | Estadoingreso | Hb (mg/dl)/Hto (%) | Sangrado vaginal | Estado fetal | Localización rotura | Pérdida sanguínea (ml) | CH | UP | Muerte fetal | Muerte materna | Ingreso (días) | Tratamiento |
| 1968 | Hassim1 | 36 | 4-3-0-3 | 26 | – | Shock | – | No | RPBF | Fundus | 2.000 | 3 | – | Sí | Sí | – | HT |
| 1969 | Botha2 | 30 | 10-8-1-8 | 16 | – | – | 5,5 | No | – | Fundus | – | 6 | – | Sí | No | – | HT |
| 1972 | Valtchev3 | 28 | 8-3-4-3 | 28 | – | Estable | 8,4 | No | Vitalidad fetal | Cara post. canto izq, fundus | 1.000 | 6 | – | Sí | No | 6 | HT |
| 1972 | Dick4 | 26 | 3-0-2-0 | 21 | Legrado | Shock | – | No | Aborto | Fundus | – | ? | – | Sí | No | – | HST |
| 1972 | Dick4 | 28 | 7-0-6-0 | 16 | – | Shock | – | No | Vitalidad fetal | Fundus | – | ? | – | Sí | No | – | HT |
| 1983 | Veridiano et al.5 | 23 | 4-1-2-1 | 16 | Cesárea | Estable | – | Sí | Aborto | Histerorrafia | 2.000 | 6 | 2 | Sí | No | 10 | Legrado-> HT |
| 1984 | Hornstein et al.6 | 40 | 1-0-0-0 | 15 | – | Estable | 20% | No | RPBF | Cuerno anterior | 2.000 | 6 | – | Sí | No | 6 | HT |
| 1985 | Gribble y Fits Simmons7 | 26 | 3-2-0-2 | 26 | Cesárea, PP | Shock | 37% | Sí | Vitalidad fetal | Histerorrafia | – | 30 | 20 | No | No | 11 | HT |
| 1987 | Woolcott et al.8 | 34 | 3-2-0-2 | 10 | Cesárea. Legrado | Estable | 4,2 | Sí | Aborto | Cara anterior | 2.750 | – | – | Sí | No | – | HT |
| 1987 | Archer y Furlong9 | 32 | 3-2-0-2 | 21 | – | Estable | 20% | No | Vitalidad fetal | Fundus | – | 7 | – | Sí | No | 5 | HT |
| 1989 | Nagy10 | 21 | 1-0-0-0 | 23 | – | Shock | – | No | RPBF | Fundus | 2.000 | – | – | Sí | No | – | Legrado + cierre primario |
| 1994 | Aboulafia et al.11 | 37 | 0-0-0-0 | 23 | Legrado | Shock | 8 | No | Vitalidad fetal | Fundus | 300 | – | – | No | No | – | Cierre primario |
| 1995 | Veenstra et al.12 | 38 | 10-0-9-0 | 25 | Legrado | Shock | – | – | Vitalidad fetal | Cuerno izq. | 4.100 | 7 | 1 | ? | No | 7 | HT |
| 1996 | Kinoshita et al.13 | 30 | 1-0-0-0 | 25 | – | Shock | – | – | Vitalidad fetal | Fundus | 6.300 | 16 | – | Sí | Sí | – | HT |
| 1998 | Moriya et al.14 | 29 | 4-2-1-1 | 28 | Cesárea. Legrado | Shock | 8,6 | No | RPBF | Fundus | 3.888 | 9 | – | Sí | No | 13 | HT |
| 2001 | LeMaire et al.15 | ? | 3-2-0-1 | 17 | – | Estable | – | No | Vitalidad fetal | Fundus | 1.500 | 4 | – | Sí | No | 3 | HST |
| 2001 | Morken y Henriksen16 | 25 | 2-0-1-0 | 21 | Legrado | Shock | – | No | Vitalidad fetal | Fundus | 3.000 | – | – | Sí | No | – | Resección y cierre primario |
| 2001 | Carlton et al.17 | 32 | 2-1-0-1 | 11 | Cesárea | Estable | – | Sí | Feto cruz | Histerorrafia | 2.900 | 6 | – | Sí | No | 5 | Legrado-> HT |
| 2002 | Höpker et al.18 | ? | 4-3-0-3 | 10 | Cesárea. Legrado | Estable | 14,1 | No | Feto cruz | Histerorrafia | 800 | – | – | Sí | No | 12 | HT |
| 2004 | Esmans et al.19 | 40 | 2-1-0-1 | 13 | Ext. manual p. ácreta. Legrado | Shock | 10,3 | No | Vitalidad fetal | Fundus | 3.000 | 4 | – | Sí | No | 11 | HT |
| 2004 | Hlibczuk20 | 29 | 3-1-1-1 | 16 | Cesárea | Estable | 10,7 | No | Vitalidad fetal | Histerorrafia | 1.500 | ? | ? | Sí | No | 7 | cierre primario-> HT |
| 2005 | Young Park et al.21 | 36 | 2-0-0-2 | 6 | – | Shock | – | Sí | Anembionada | Fundus | – | – | – | Sí | No | – | Legrado + cierre primario |
| 2005 | Honig et al.22 | 25 | 3-2-0-2 | 15 | Cesárea | Shock | 3,9 | No | Vitalidad fetal | Histerorrafia | 200 | 10 | 3 | Sí | No | – | HT |
| 2006 | Baecher y Grobman23 | 26 | 5-2-2-2 | 28 | Legrado. Síndrome Asherman | Estable | – | No | Vitalidad fetal | Fundus | 2.000 | – | – | Sí | No | – | Cierre primario |
| 2006 | Balkanli-Kaplan et al.24 | 33 | 3-1-1-1 | 7 | Cesárea. Legrado | Estable | 8,7 | Sí | Aborto | Histerorrafia | – | – | – | Sí | No | 7 | Legrado-> HT |
| 2007 | Dabulis y McGuirk25 | ? | 5-3-1-3 | 9 | Cesárea. Legrado | Estable | 8,7 | ? | Vitalidad fetal | Histerorrafia | 3.500 | – | – | Sí | No | – | HT |
| 2008 | Fleisch et al.26 | 30 | 2-1-0-1 | 20 | Cesárea | Shock | 6,1 | No | Vitalidad fetal | Cara anterior | 3.000 | 17 | 10 | Sí | No | – | HT |
| 2008 | Papadakis et al.27 | 36 | 5-3-1-3 | 11 | Cesárea | Shock | 4,4 | Sí | Aborto | Histerorrafia | 3.200 | 7 | 4 | Sí | No | 3 | Legrado-> HT |
| 2009 | Roca et al.28 | 33 | 3-1-1-1 | 28 | Cesárea. PP | Estable | 10,4 | No | Vitalidad fetal | Histerorrafia | 7.000 | 9 | 4 | No | No | 4 | HT |
| 2009 | Le-Ming Wang et al.29 | 38 | 3-1-1-1 | 31 | Cesárea, legrado | Shock | – | Sí | Vitalidad fetal | Cara posterior | 3.700 | 8 | – | No | No | 8 | Cierre primario |
| 2010 | Martínez Medel et al.30 | 31 | 2-1-0-1 | 18 | Hidrosálpinx | Shock | – | No | Feto cruz | Fundus | 3.000 | – | – | Sí | Sí | – | HT |
| 2010 | Ponta et al.31 | 28 | 9-4-4-4 | 13 | Cesárea. Legrado. PP | Shock | 7,6 | No | Aborto | Cara anterior e istmo | – | 2 | 2 | Sí | No | 6 | HT |
| 2011 | Dong Gyu Jang et al.32 | 35 | 5-2-2-2 | 14 | Legrado | Estable | 10,3 | No | Vitalidad fetal | Fundus | 1.000 | 4 | 2 | Sí | No | 6 | HT |
| 2011 | Konan Blé et al.33 | 24 | 3-1-1-1 | 22 | – | Shock | 4,6 | No | Vitalidad fetal | Fundus, cara post. | 2.500 | 6 | 2 | Sí | No | – | HT |
| 2012 | Gupta et al.34 | 21 | - | 17 | Cesárea | ? | 11,6 | Sí | Aborto | Histerorrafia | 8.700 | 12 | 4 | Sí | No | 6 | HT |
| 2012 | Sathasivam et al.35 | 35 | 7-3-3-3 | 10 | Legrado | Shock | 6,5 | Sí | Vitalidad fetal | Cuerno izq. | 2.000 | 3 | – | Sí | No | – | Resección + legrado + cierre primario |
| 2012 | Andrade Martínez-Garza et al.36 | 28 | 1-0-0-0 | 20 | Útero didelfo | Shock | – | Sí | Vitalidad fetal | – | 3.500 | 4 | – | Sí | No | 4 | HST |
| 2012 | Andrade Martínez-Garza et al.36 | 20 | 2-0-1-0 | 18 | – | Shock | – | No | Feto cruz | Cuerno izq., | 1.800 | – | – | Sí | No | 3 | Resección + cierre primario |
CH: concentrados de hematíes; EG: edad gestacional; FR: factores de riesgo; HST: histerectomía subtotal; HT: histerectomía total; G-P-A-V: gestaciones-partos-abortos-vivos; PP: placenta previa; RPBF: riesgo de pérdida de bienestar fetal; UP: unidades de plasma.
El mayor factor de riesgo12,30,32,33,37 es la presencia de placenta previa junto a cesárea anterior. Está establecido en un 11, un 40 y un 60% con una, 2 o 3 cesáreas anteriores, respectivamente37,38.
La presencia de placenta previa de forma aislada actúa como factor de riesgo independiente, no así la presencia de cicatrices uterinas previas37.
Entre los factores de riesgo definidos como menores, han sido descritos: edad materna > 40 años, multiparidad, evacuación manual de placenta, legrado evacuador, embarazos múltiples, endometritis, abortos de repetición, malformaciones uterinas, miomectomía y radiación pélvica37,39.
La edad media de las pacientes fue 29,6 años siendo solamente 2 de ellas mayores de 40 años. El 33% eran secundíparas y el 41%, multíparas. Diez casos correspondían al primer trimestre (< 14 semanas) y 26 entre las semanas 14 y la 28. En casi un tercio de los casos, no hubo presente ningún factor de riesgo; 3 pacientes presentaron concomitancia de cesárea anterior y placenta previa (factor de riesgo mayor); un 37,8% presentó un solo factor de riesgo menor y el 29,7% 2 o más, siendo el más frecuente el antecedente de cesárea anterior (n = 15), seguido del legrado evacuador (n = 13). La mayoría se encontraba con signos clínicos de shock al ingreso (56,7%, n = 21). Poco más de la mitad de los fetos eran viables al ingreso (n = 20), siendo la norma durante el proceso la pérdida fetal (89%). De entre los 3 fetos que sobrevivieron, en 2 casos se procedió a la extracción fetal mediante cesárea seguida de histerectomía obstétrica; ambos se encontraban por encima del límite de la viabilidad fetal (26 y 28 semanas de gestación).
Cabe destacar el caso publicado por Aboulafia et al.11, donde se procedió al cierre primario del defecto de la pared en un intento de prolongar la gestación, ya que el feto se encontraba por debajo de la viabilidad (23 semanas) y, dadas las circunstancias (edad avanzada materna, primigesta, pérdida sanguínea escasa), se realizó un seguimiento diario mediante ultrasonografía, en la cual no se volvió a detectar signos ecográficos de placenta pércreta hasta la semana 31; la gestación finalizó a las 32 semanas mediante cesárea electiva, siendo necesaria la realización de un legrado debido a la imposibilidad de extracción de la placenta.
La localizacion más frecuente de rotura uterina fue el fundus (n = 18), seguido de la cicatriz de la histerorrafia (n = 11). La pérdida sanguínea estimada fue muy significativa en la casi totalidad de los casos, 1.000-3.000ml, n = 12, y ≥ 3.000ml, n = 12, necesitando la gran mayoría la transfusión de varios concentrados de hematíes, así como de plasma fresco.
El 91,2% de las pacientes sobrevivió; las muertes maternas (n = 3) fueron consecuencia de un shock hemorrágico masivo por rotura uterina, no respondiendo la paciente a las medidas de resucitación. La histerectomía obstétrica fue mayoritaria (81%; n = 30), aunque en casos seleccionados se realizó un cierre primario de la rotura con o sin resección de los bordes afectados por la placenta pércreta, acompañada de legrado evacuador en los casos en que no se pudo extraer completamente la placenta. Uno de los intentos de cierre primario terminó finalmente con la realización de una histerectomía obstétrica por complicaciones postoperatorias20.
Caso clínicoMujer de 28 años de edad, G3-P1-A1-V1, a destacar legrado evacuador por aborto diferido (embarazo gemelar), cesárea en 2009 por riesgo de pérdida de bienestar fetal, complicándose el puerperio inmediato con síndrome HELLP, una esteatosis intrahepática, pancreatitis necrosante y fallo multiorgánico que requirió ingreso en la Unidad de Cuidados Intensivos durante 30 días.
La paciente estaba siendo seguida en la consulta de alto riesgo por diabetes gestacional insulinodependiente y por sospecha de tuberculosis peritoneal (en tratamiento empírico con isoniazida, rifampicina y etambutol). Hasta la fecha, la evolución de la gestación transcurrió sin ningún dato a destacar, buenos controles glucémicos, analíticas normales y ecografías de primer y segundo trimestres sin hallazgos ecográficos de sospecha. A destacar: consultó en Urgencias de nuestro hospital a las 19 + 5 semanas por dolor abdominal.
La paciente acudió a nuestro Servicio de Urgencias en la 20 + 3 semanas de gestación refiriendo dolor abdominal intenso hipogástrico, irradiado a la fosa ilíaca derecha, de inicio súbito tras mantener relaciones sexuales, acompañado de un vómito y de mareo sin pérdida de conocimiento. En la exploración física, mal estado general, palidez de piel y mucosas, abdomen blando y depresible, doloroso a la palpación en el hipogastrio y el mesogastrio, y de mayor intensidad en fosa ilíaca derecha. Blumberg positivo. Taquicárdica e hipotensa al ingreso (92/41mmHg), tras infusión de 1.000ml suero glucosalino + 1.000ml R.L remontaron las constantes de la paciente.
Se solicitan pruebas cruzadas y analítica preoperatoria; a destacar 14.920 leucocitos con desviacion izquierda; hemoglobina de10,4 g/dl y hematocrito del 30%.
En la exploración ecográfica se comprueba la vitalidad fetal. Placenta inserta en cara anterior y fondo siendo muy extensa su extension, el miometrio se encuentra adelgazado encontrandose una dudosa solución de continuidad a nivel de la histerorrafia anterior con una imagen compatible con hematoma retrovesical adherido a la misma. Los ovarios eran de morfologia y ecoestructura normal. A destacar la presencia de abundante liquido libre en Douglas (grado III) y también peritoneal, llegando hasta el angulo hepático, altamente sugestivo de hemoperitoneo.
Ante la sospecha de rotura uterina y dada la inestabilidad clínica de la paciente, se decide realizar una laparotomía exploradora.
Durante la misma, el útero estaba aumentado de tamaño, como de unas 20 semanas de gestación.
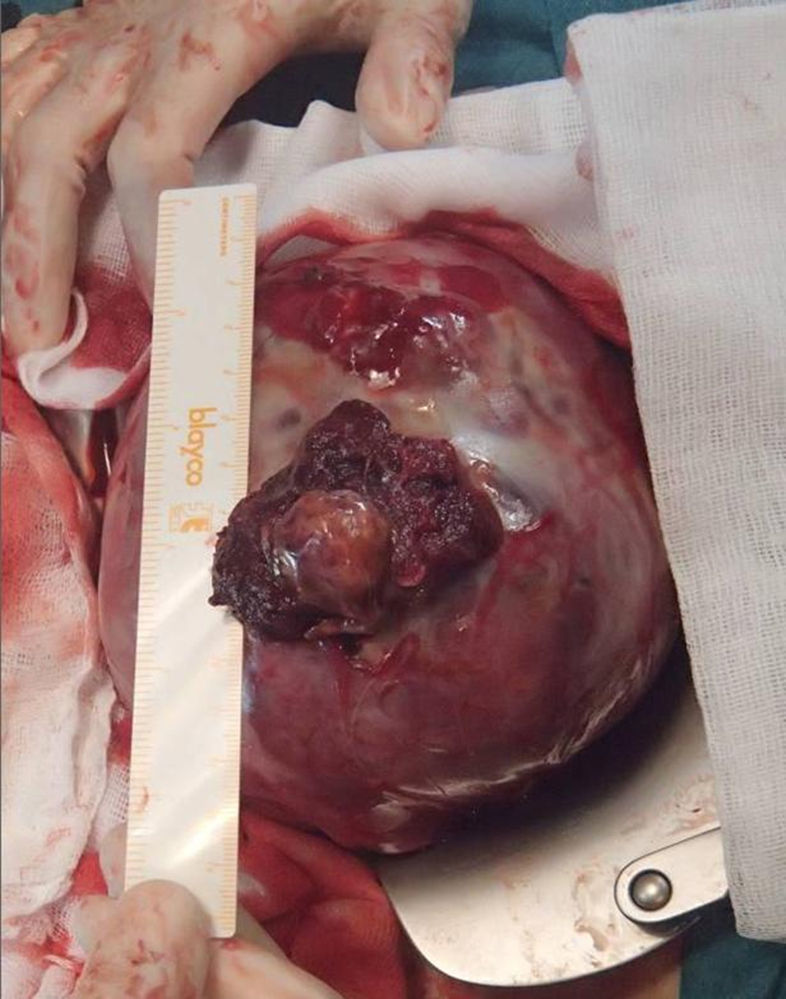
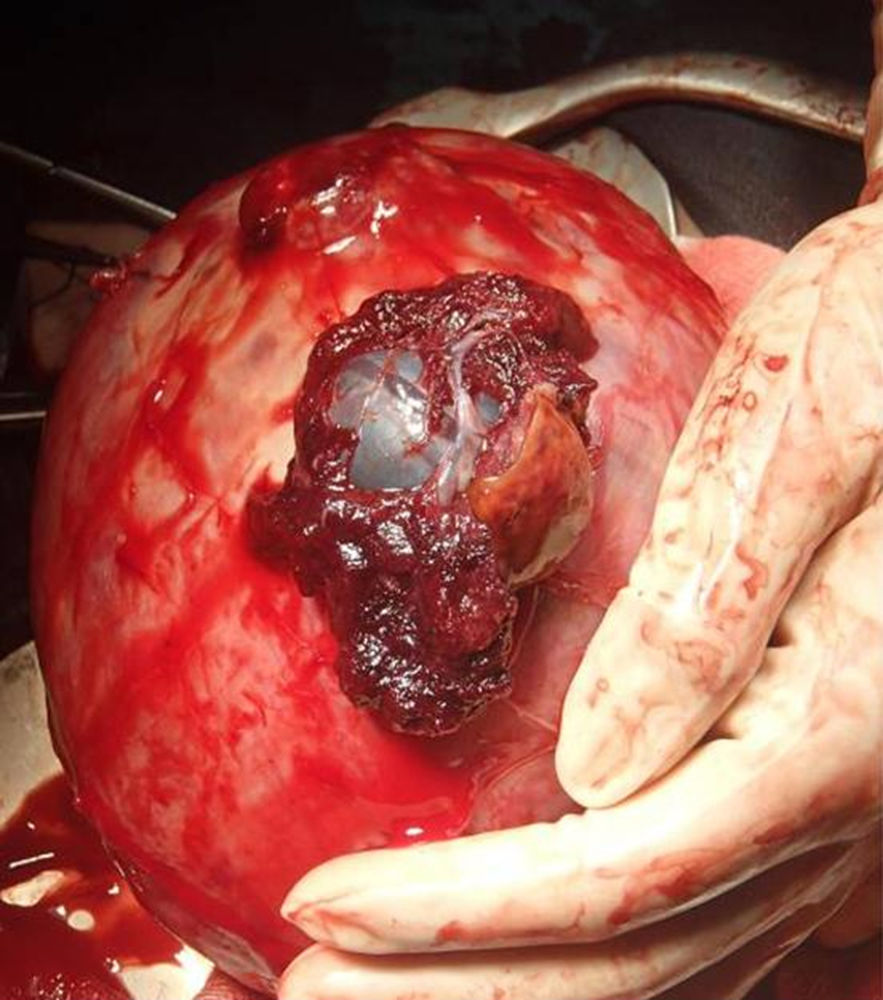
Hemoperitoneo abundante (2.000ml de cálculo estimado). Se revisa la histerorrafia de la cesárea anterior, comprobándose su integridad. Revisión de anejos, normales. Al revisar el útero, se visualiza en el fondo uterino y la cara anterior una placenta pércreta extruida en 2 áreas (de 4cm y de 2cm) (fig. 1), con sangrado activo de ambos focos, protruyendo por el mayor de ellos la bolsa amniótica (fig. 2). Se transfunden intraoperatoriamente 4 concentrados de hematíes y se infunden 5.000 cc de cristaloides y 1.000 cc de coloides.
Ante la cuantía del sangrado y la imposibilidad de cierre primario del defecto se decide practicar una histerectomía subtotal simple. El postoperatorio cursa sin coplicaciones, siendo dada de alta a los 3 días desde el ingreso.
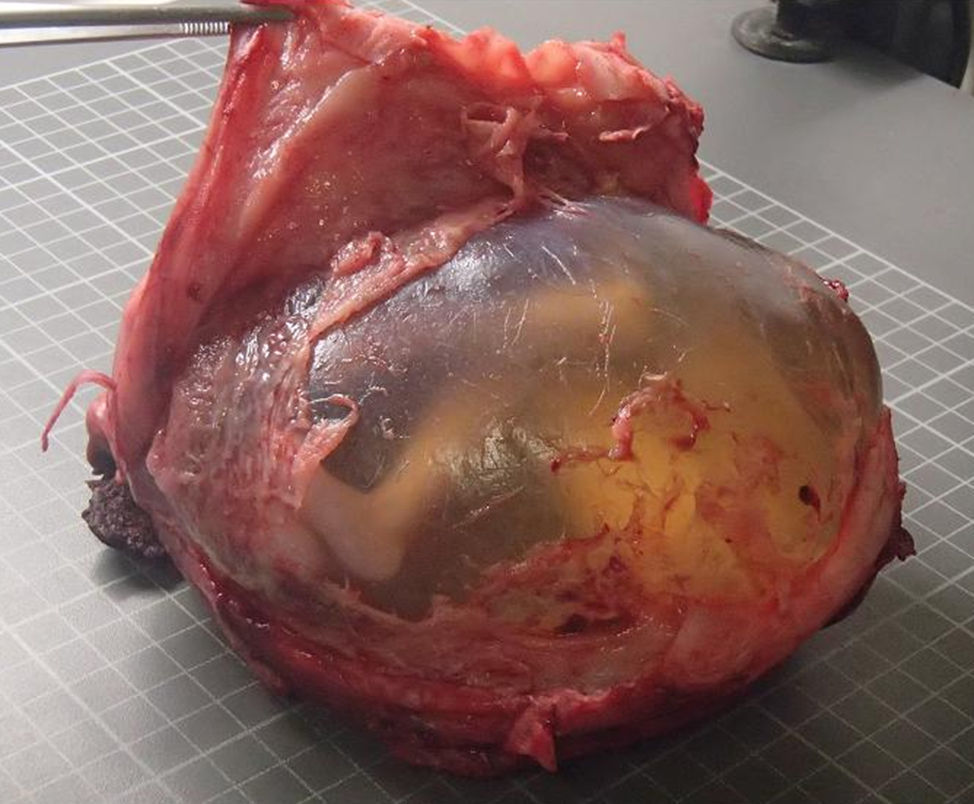
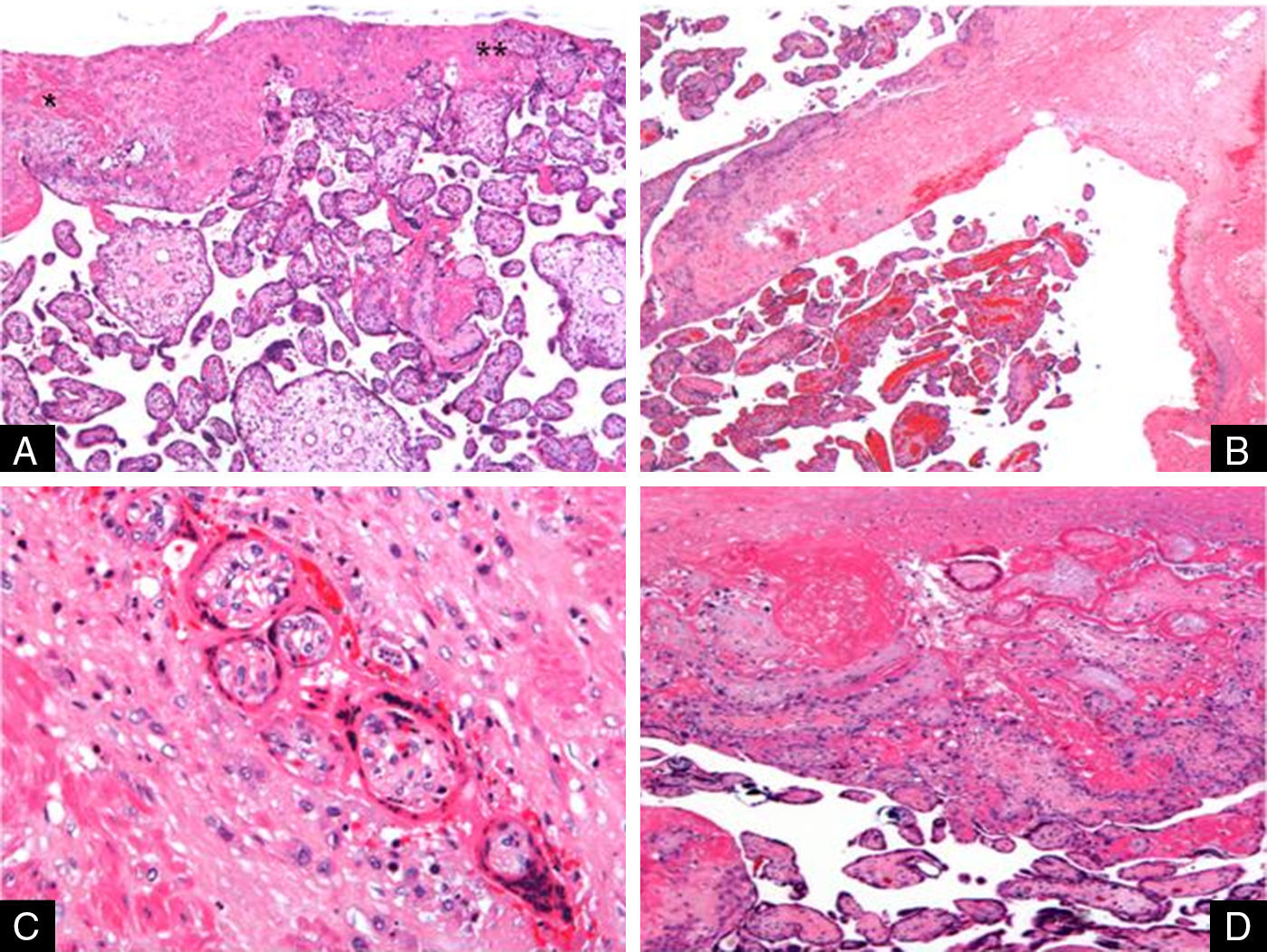
Diagnóstico anatomopatológicoLa anatomía patológica de la pieza de histerectomía revela útero grávido de 15×13cm, con feto femenino intraútero, bolsas íntegras translúcidas y placenta pércreta que produce en el fondo uterino una solución de continuidad de 7,5cm y otra de 3,5cm, por las cuales protruyen membranas amnióticas integras, abombadas, rodeadas de tejido placentario (fig. 3). La implantación de la placenta corresponde a más del 90% de la superficie interna uterina. Microscópicamente, la placenta está adelgazada y las vellosidades coriales infiltran en grado variable el miometrio subyacente, con escasa mucosa decidualizada interpuesta (fig. 4). Necrosis e infarto extenso de fascículos de músculo atrapados por crecimiento de vellosidades placentarias y agregados extensos de fibrina con extravasación hemática. El tejido velloso muestra vasos congestivos, estroma fibroso moderadamente celular y ausencia de alteraciones en el trofoblasto. A nivel del fondo, desaparece completamente el músculo, quedando el tejido placentario expuesto a la cavidad pélvica en una de las soluciones de continuidad en el miometrio, mientras que la segunda de ellas está parcialmente cubierta por serosa.
A) 5x H-E. Miometrio* adelgazado e infiltrado por vellosidades coriales** que rompen el miometrio. B) 2,5x H-E. Vellosidades coriales congestivas, y protrusión de las mismas por solución de continuidad en fondo uterino. C) 20x H-E. Fibras musculares lisas miometriales normales y necróticas, infiltradas por vellosidades coriales vascularizadas y congestivas. D) 20x H-E. Vellosidades coriales y agregados de fibrina interpuestos entre ellas y el miometrio. Infarto muscular y corial. Ausencia de decidua.
La placenta pércreta con resultado de rotura uterina40,41 supone uno de los posibles diagnósticos diferenciales en caso de dolor abdominal en una mujer con embarazo pretérmino, sobre todo en pacientes con factores de riesgo.
El comienzo clínico más habitual de la rotura uterina en gestaciones pretérmino es el dolor abdominal severo de inicio súbito en ausencia de sangrado vaginal, presentando poco más de la mitad de las pacientes abdomen agudo y signos de shock. El dolor abdominal es debido a irritación por sangre intraperitoneal; es descrito como súbito, irradiado en cinturón e incluso referido al hombro debido a la irritación subdiafragmática.
La hipotensión materna junto con taquicardia, así como signos de pérdida de bienestar fetal o muerte fetal, son signos indicativos de rotura uterina, siendo necesario para el diagnóstico un alto grado de sospecha, incluso con factores de riesgo presentes.
El problema más importante es que el diagnóstico es clínico; se realiza habitualmente cuando el cuadro está ya instaurado, y la única solución, llegados a este punto, en la mayoría de los casos, es la histerectomía obstétrica urgente, dado que las consecuencias para la madre pueden llegar a ser fatales, terminando con la muerte fetal en casi todos los casos.
Cuando la paciente está asintomática, la sospecha diagnóstica de esta patología es por medio de la ecografía, pudiendo coexistir en una misma paciente distintos grados de acretismo42.
La ecografía tiene una sensibilidad teórica del 82-86% y una especificidad del 93-96,8% para el diagnóstico de placenta pércreta31,39,43; entre los signos ecográficos indicativos están:
- 1.
Imagen en escala de grises
- a.
Visualización de lagunas placentarias: sensibilidad del 79%, es el signo con mayor VPP (92%), pero no es patognomónico42,43.
- b.
Ausencia del espacio útero-placentario: normalmente, antes de la semana 20 (a partir de la 12) puede identificarse una zona hipoecogénica en la interfase útero-placentaria que correspondería a la decidua basal. El problema es la tasa de falsos positivos: 50%.
- c.
Disminución del espesor miometrial retroplacentario (< 1mm). Sensibilidad cercana al 100%, especificidad del 79% y el VPP del 73%42.
- d.
Interrupción/irregularidad de la interfase entre vejiga y útero: una irregularidad o interrupción focal de la interfase hipoecogénica entre útero y vejiga, normalmente regular, traduce la invasión trofoblástica a través del miometrio.
- a.
- 2.
Doppler color/power:
- a.
Aumento de la vascularización subplacentaria.
- b.
Flujo lacunar.
- c.
Vasos puenteando desde la placenta al borde uterino/serosa.
- d.
Hipervascularización de la interfase entre la serosa uterina y la vejiga.
- e.
Vasos desde la placenta a la vejiga.
- f.
Presencia de ejes vasculares cruzando la solución de continuidad entre la placenta y el miometrio.
Aunque los criterios ecográficos que han demostrado su utilidad para el diagnóstico del grado de extensión de la invasión placentaria son los siguientes38:
- –
ausencia del espacio uteroplacentario, aumento de la vascularización subplacentaria,
- –
interrupción de la interfase placenta tejidos (vejiga, miometrio),
- –
presencia de vasos cruzando la solución de continuidad de la interfase útero placentaria,
siendo estos 2 últimos los que tienen mayor VPP y valor predictivo negativo44.
Para establecer el grado de acretismo, los criterios que han demostrado su utilidad son: la hipervascularización de la interfase entre la serosa uterina y la vejiga, las conexiones vasculares entre placenta y vejiga, la interrupción de la interfase placenta tejidos (vejiga, miometrio) y la presencia de vasos cruzando la solución de continuidad de la interfase útero-placentaria44.
Respecto al uso de la RM, no existen evidencias estadísticamente significativas de la superioridad diagnóstica de la RM respecto a la ecografía en la identificación de trastornos de la implantación placentaria43.
La ecografía es el método más utilizado, quedando relegado el uso de la RM para casos en los que la ecografía no es concluyente pero hay criterios de sospecha. Una excepción sería el caso en que la placenta esté situada en la cara posterior del útero; en este supuesto, está demostrada la superioridad diagnóstica de la RM respecto a la ecografía43. Otras ventajas de la RM respecto a la ultrasonografía serían que proporciona una visión global y completa de la inserción placentaria y de sus relaciones con órganos adyacentes, facilitando la descripción topográfica del grado de invasión y su extensión, además de haber demostrado buenos resultados interobservador43. El diagnóstico de placenta previa puede ser establecido 6-7 semanas antes con RM que con ecografía.
Los criterios diagnósticos en la RM son43:
- –
Bandas intraplacentarias de baja intensidad en T2.
- –
Señal de intensidad heterogénea intraplacentaria.
- –
Placenta de localización previa.
- –
Interrupción focal de la pared uterina.
- –
Grosor miometrial menor de 1mm.
- –
Invasión de órganos adyacentes.
No existe evidencia estadística suficiente para recomendar el uso de RM como prueba de cribado ni tampoco como primera elección en caso de sospecha para el diagnóstico de anomalías de la inserción placentaria42.
Ante la sospecha o el diagnóstico, la actitud médica debe basarse en el grado de invasión placentaria, el deseo genésico de la paciente y, sobre todo, la situación hemodinámica37,40,41,45–48, debiendo ser agresiva en caso de situación de shock desde el primer momento, realizando una laparotomía exploradora ante la sospecha clínica. Una vez confirmado el diagnóstico intraoperatorio, la primera opción de tratamiento sería la realización de una histerectomía obstétrica, basada en que el tratamiento conservador asocia una mayor mortalidad44, si bien la cirugía conservadora parece estar justificada en casos seleccionados (pacientes sin descendencia, jóvenes), especialmente si la solución de continuidad es focal, no existe un sangrado excesivo o hay deseo de mantener la fertilidad15. No existen evidencias estadísticamente significativas de superioridad entre el tratamiento quirúrgico y el conservador39.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.