El objetivo principal del estudio es determinar cuál es la técnica empleada en el País Vasco para practicar la conización del cuello del útero, así como el lugar más adecuado para practicar una conización (en consulta o en el quirófano), tomando como parámetro la tolerancia al dolor de la paciente, la incidencia de complicaciones inmediatas y tardías, y los resultados anatomopatológicos de los dos procedimientos.
Material y métodosSe seleccionó a 232 pacientes con un diagnóstico citológico y colposcópico de displasia cervical, que debieran estudiarse y/o tratarse mediante un procedimiento excisional del cuello uterino durante el período comprendido entre el 1 de septiembre de 2006 y el 31 de julio de 2007 en 8 hospitales del País Vasco.
ResultadosEl 94,8% de las conizaciones se hicieron con asa de diatermia en todos los hospitales y, excepcionalmente, con bisturí. La anestesia utilizada fue local en los hospitales terciarios y regional en los hospitales comarcales. La tolerancia al dolor en las conizaciones ambulatorias realizadas con asa de diatermia bajo anestesia local fue excelente. En el Hospital Donostia se puntuó el dolor con una escala analógica visual, logrando puntuaciones bajas concordantes con la alta satisfacción del procedimiento. La afectación de los bordes de la pieza de conización depende del grado de displasia y no de la técnica utilizada. Las complicaciones inmediatas fueron pocas, y fueron incluso menores las tardías.
ConclusiónLa conización con asa de diatermia bajo anestesia local en la consulta es muy bien tolerada por la paciente y tiene pocas complicaciones, por tanto, es una alternativa razonable frente a la conización en quirófano bajo anestesia general o regional con bisturí o con asa de diatermia. La conización con asa de diatermia bajo anestesia local ofrece múltiples ventajas a la paciente y al sistema sanitario, ya que implica un coste muy inferior y no presenta desventajas médicas, con una tolerancia satisfactoria.
The main objective of this study was to evaluate the conization technique used in Basque Country hospitals and to determinate the most appropriate place to perform this procedure (outpatient clinic or operating room) by evaluating pain, early and late complications and histological results.
Materials and methodsWe selected 232 patients with a cytologic and colposcopic diagnosis of cervical dysplasia requiring surgical cervical conization between September 2006 and July 2007 in eight public hospitals of the Basque Country.
ResultsA total of 94.8% of conizations were performed with long loop excision of transformation zone (LLETZ) and, exceptionally, with cold knife conization. Local anesthesia was used in tertiary hospitals and regional anesthesia in county hospitals. Pain tolerance in outpatient conization with LLETZ under local anesthesia was excellent. In Hospital Donostia, pain was scored on a visual analogue scale and low scores were achieved, in accordance with the high degree of satisfaction obtained with the procedure. Conization margins depended on the grade of dysplasia rather than on the technique. There were few early complications and even fewer late complications.
ConclusionThe LLETZ method performed under local anesthesia in the outpatient clinic is very well tolerated by patients and has few complications. Consequently, this option is a valid alternative to conization under general or regional anesthesia. The LLETZ technique provides multiple advantages for the patient and health service due to its lower cost, without medical disadvantages, and satisfactory tolerance.
En los últimos 30 años se ha observado un notable incremento en la prevalencia de la infección por el virus del papiloma humano (VPH), tanto en sus formas clínicas o condilomas, como en sus formas de expresión subclínica, identificables por los cambios en la citología y/o la colposcopia. Hoy día se acepta que el cáncer de cérvix es una enfermedad de transmisión sexual.
Los estudios sobre la historia natural de la infección por VPH han evidenciado que un número importante de mujeres jóvenes se infecta en las edades de mayor actividad sexual. La mayor parte de estas infecciones se resuelve de forma espontánea y sin consecuencias. La persistencia del VPH ocurre en un 5% de las mujeres después de los 35-40 años. Este subgrupo constituye el de mayor riesgo para desarrollar lesiones escamosas intraepiteliales de alto grado (HSIL) y cáncer cervical.
La introducción, hace 50 años, de la citología de Papanicolaou como técnica de cribado ha producido una importante disminución en las tasas de incidencia y mortalidad por cáncer cervical. Últimamente, esta tendencia se ha reducido y al mismo tiempo se ha observado un aumento del número de adenocarcinomas.
Otro campo en el que se han producido importantes avances es en el tratamiento. La introducción de fármacos inmunomoduladores, de utilidad demostrada en las lesiones condilomatosas de genitales externos, abre una nueva vía terapéutica. Actualmente, se están investigando nuevos fármacos con actividad antiviral y se está trabajando intensamente en el desarrollo de vacunas, con resultados preliminares alentadores en humanos.
La tasa actual de incidencia ajustada del cáncer de cérvix en España, excluido el carcinoma in situ, es del 7,2 por 100.000 mujeres y la tasa de mortalidad del 2,7 por 100.000 mujeres/año. Se estima que en España se diagnostican unos 2.000 nuevos casos de cáncer invasor de cérvix al año, de los cuales algo menos de la mitad morirá por esta causa. La prevalencia en España se estima en unos 40.000 casos. La tendencia temporal en la mortalidad por cáncer de cérvix, en la mayoría de los países desarrollados, muestra un descenso mantenido desde la segunda mitad del siglo xx. A este patrón general se le ha superpuesto en la última década una tendencia creciente de la mortalidad en algunos países desarrollados, como Inglaterra, parte de Estados Unidos, Australia y Nueva Zelanda. El análisis por grupos histológicos en 62 registros poblacionales de tumores de 24 países durante el período 1973-1991 (que ha incluido cerca de 180.000 casos) concluyó que el incremento en la incidencia observado en algunos países era atribuible al subgrupo de adenocarcinomas y carcinomas adenoescamosos, pero no al grupo mayoritario de los carcinomas escamosos. En países con actividades de cribado las tasas de cáncer de cérvix han disminuido de forma sostenida1–6.
La relación entre la edad y la prevalencia de la infección por VPH es alta en edades jóvenes y baja en edades adultas; en cambio, la tasa de incidencia de cáncer de cérvix es baja en edades jóvenes y creciente a partir de los 30-35 años de edad. Este patrón prevalencia VPH/incidencia de cáncer sugiere que, en la población, el período de inducción entre la exposición al VPH y el cáncer de cérvix es de, aproximadamente, unos 10-15 años, y que son las portadoras crónicas de una infección VPH oncogénico (adquirida probablemente en la juventud) las que constituyen el grupo de alto riesgo para desarrollar cáncer. En conjunto, se considera que un 80-90% de las infecciones se resuelven espontáneamente y entre un 10-20% persisten7–12.
El concepto y la terminología de las alteraciones premalignas del epitelio cervical han evolucionado paralelamente al avance del conocimiento de su biología e historia natural. Inicialmente, se describió el carcinoma in situ, y en los años cincuenta se denominó displasia a los cambios epiteliales menos acusados. La demostración de cambios histológicos similares en algunas displasias y el carcinoma in situ condujo, a principios de los años setenta, a la introducción del concepto de neoplasia cervical intraepitelial (CIN), que los unificaba clasificando las lesiones en tres grados. Esta terminología sigue empleándose en la actualidad en el diagnóstico histológico. En 1989 se propuso el sistema de Bethesda para describir las alteraciones citológicas, que incluyó nuevos conceptos sobre la infección por el VPH. En 2001 se ha revisado y modificado ligeramente dicha clasificación. En el sistema de Bethesda se sustituye el término neoplasia por el de lesión escamosa intraepitelial (SIL), con dos categorías: bajo grado (LSIL) y alto grado (HSIL). Esta división en dos grupos se justifica por la evidencia de que las LSIL corresponden básicamente a infecciones virales autolimitadas y que sólo excepcionalmente progresan a carcinoma, mientras que las HSIL corresponden a verdaderos cambios premalignos.
Toda lesión de alto grado diagnosticada por biopsia debe tratarse para evitar su progresión. En general, en las mujeres con HSIL se aconseja un tratamiento escisional, preferentemente mediante asa de diatermia13, que se ha demostrado como un método seguro y efectivo frente a la conización clásica con bisturí, que precisa de anestesia y quirófano, tiene una mayor cifra de complicaciones, principalmente hemorragias y estenosis del canal endocervical, para descartar así un inesperado carcinoma inicialmente invasivo o una eventual microinvasión, presente en el 1% de los casos. Por otra parte, el riesgo de enfermedad persistente se relaciona con el tamaño de la lesión y no con su grado; por ello, las lesiones que afectan a más de dos cuadrantes del exocérvix deben tratarse y seguirse adecuadamente.
No está justificado el tratamiento inmediato sistemático, con exéresis de la zona de transformación, a todas las mujeres con cualquier citología anormal (see and treat), dado el elevado número de tratamientos innecesarios que resulta de aplicar este proceder.
Previamente se debe realizar un estudio con colposcopia-biopsia. Sólo en una mujer con citología de HSIL y colposcopia con cambios mayores podría omitirse la pequeña biopsia y realizar de entrada una exéresis con asa.
Asimismo, la histerectomía no está, en absoluto, justificada como tratamiento primario de las lesiones intraepiteliales.
Con el asa puede practicarse una exéresis simple de la zona de transformación o una doble exéresis cónica, que incluya exocérvix y endocérvix. Uno de los inconvenientes del asa es la dificultad en la lectura de los bordes del cono por artefactos térmicos que se minimizan limitando el número de cortes requeridos para obtener la pieza quirúrgica completa. La ventaja es que la duración de la intervención, la tasa de complicaciones y el coste económico son menores que con el láser13 y el bisturí, y no hay diferencias significativas en cuanto a la cifra de persistencia de la lesión. La cifra de enfermedad residual encontrada en el estudio de Natee et al14 sobre histerectomías tras una conización fue del 38,3%, con mayor riesgo para las piezas con bordes positivos.
Una conización diagnóstica se considerará terapéutica si reúne las siguientes condiciones:
- 1.
Tamaño suficiente, en relación con el tamaño del cuello uterino.
- 2.
Márgenes exocervical, endocervical y profundos libres de lesión.
- 3.
Legrado de la parte alta del canal, practicado después del cono negativo.
- 4.
Colposcopia, citología y determinación del VPH oncogénico de alto riesgo negativas en el control posterior.
El seguimiento postratamiento es necesario, porque una vez tratada la lesión intraepitelial no se ha eliminado el riesgo de cáncer invasivo; este riesgo está aumentado hasta 20 veces con relación a las mujeres con citología siempre negativa.
Entre un 5 y un 10% de las pacientes tratadas presentarán persistencia o recidivas lesionales15. En el seguimiento postratamiento, los mejores resultados para detectar la persistencia o recurrencia de la neoplasia se consiguen mediante el empleo conjunto de la citología y la colposcopia.
El seguimiento postratamiento escisional de la lesión intraepitelial depende del estado de los márgenes de resección. Un margen afectado no es equivalente a lesión residual, pues sólo un 15-20% de las pacientes con un margen de exéresis afectado presenta lesión residual en la histerectomía posterior.
Un margen exocervical afectado es fácilmente controlable con citología y colposcopia. Sin embargo, la afectación del margen superior, en la parte alta del canal endocervical, o del margen profundo, a nivel de los fondos glandulares, plantea una mayor dificultad en el seguimiento, por la posibilidad de que en el proceso de curación quede enterrado tejido neoplásico, que se escape a las técnicas de detección pero pueda progresar a un cáncer. Existe una indicación de reconización o histerectomía cuando los márgenes superior y/o profundo de la pieza de conización están afectados y persisten citologías de lesión intraepitelial. Esta conducta se debe individualizar, valorando el análisis de VPH de alto riesgo oncogénico si la paciente no ha completado su descendencia.
Con la intención de mejorar el tratamiento de las distintas formas de expresión de la infección por VPH, se están investigando nuevas terapéuticas, como la terapia fotodinámica, las terapias génicas y el desarrollo de nuevos medicamentos inmunomoduladores derivados del Imiquimod. Pero el objetivo prioritario, y uno de los principales beneficios que cabe esperar de la investigación sobre el VPH, es el desarrollo de vacunas que sean eficaces y eficientes frente al VPH.
El desarrollo de vacunas profilácticas fue posible a partir del ensamblaje, por ingeniería genética de las VLP (o partículas semejantes al virus [virus like particles]) conformadas por las proteínas L1 de la cápsula del VPH, pero que carecen de ADN viral en su interior, por lo que no son infectantes. Las VLP tienen una intensa capacidad antigénica que produce una elevada respuesta de anticuerpos neutralizantes. En noviembre de 2002, Koutsky et al16 publicaron el primer ensayo doble ciego con una vacuna profiláctica. Las vacunas terapéuticas se investigan a partir de las propiedades inmunogénicas de las proteínas de los genes precoces, E6 y E7, que persisten después de la integración viral y son un elemento necesario para la oncogénesis.
De este modo, el tratamiento escisional de lesiones en el cérvix uterino mediante conización quirúrgica es el tratamiento de elección hoy día en mujeres con lesiones cervicales de alto grado. Este procedimiento, como ya se ha comentado, será realizado con una intención dual, tanto diagnóstica como terapéutica en la mayoría de los casos. Si la lesión es completamente extirpada, las posibilidades de curación son altas y el riesgo de recidiva, bajo.
Este procedimiento puede realizarse de forma ambulatoria en consulta o en quirófano, y no hay diferencia en cuanto a sus resultados a corto o a largo plazo para las pacientes, aunque sí en los costes que estos generan para el sistema de salud. La conización con asa de diatermia tiene múltiples ventajas. Pueden realizarse en consulta con anestesia local17, son baratas y presentan menos riesgos según la literatura18–22.
Asimismo, la paciente puede beneficiarse de un procedimiento ambulatorio y una rápida recuperación a su vida normal.
Con este trabajo tratamos de demostrar que todas estas ventajas pueden confirmarse en nuestro medio.
ObjetivoEl objetivo primario del estudio es determinar cuál es la técnica empleada en el País Vasco para practicar la conización del cuello del útero.
Los objetivos secundarios del estudio son determinar el lugar más adecuado para practicar una conización (en consulta, o en el quirófano), tomando como parámetro:
- 1.
La tolerancia al dolor de la paciente.
- 2.
Incidencia de complicaciones inmediatas y tardías.
- 3.
Comparar los resultados anatomopatológicos de los dos procedimientos.
Finalmente, evaluar su evolución a corto plazo.
Material y métodosSe trata de un estudio de tipo descriptivo transversal. Se incluyó a pacientes que tuvieran un diagnóstico citológico y colposcópico de displasia cervical y que debieran estudiarse y/o ser tratadas del cuello uterino. No existen criterios de exclusión para esta revisión.
Se han recogido los datos de 232 conizaciones realizadas en 8 hospitales del País Vasco durante el período comprendido entre el 1 de septiembre de 2006 y el 31 de julio de 2007. En el estudio han participado los hospitales de Basurto (65 casos), Donostia (54 casos), Txagorritxu (37 casos), Cruces (30 casos), Mendaro (19 casos), Galdácano (17 casos), Zumárraga (6 casos) y Mondragón (4 casos). La conización se practica con la mujer colocada en decúbito supino y en posición ginecológica. La anestesia utilizada puede ser local, regional (raquídea) o general. Cuando se utiliza anestesia local, tras la colocación del espéculo vaginal se infiltra el cérvix en 6 puntos, para posteriormente proceder a la conización. Tras la conización la mujer vuelve a su domicilio luego de 30 a 60min en el hospital. Este tiempo sirve para verificar que no aparece hemorragia ni dolor.
Se han recogido los siguientes datos de las historias clínicas de las pacientes: edad de la mujer, motivo de consulta, estudio anatomopatológico de la pieza de conización y afectación de los bordes de resección.
Para la evaluación de la tolerancia a la anestesia local, así como para conocer la afectación de los bordes, se ha utilizado el subgrupo de 54 conizaciones realizadas en el Hospital Donostia durante el período señalado. La anestesia local se realizaba con jeringa UNIJECT K y aguja de dentista (Carpule) y con Articaina (Ultracain) como anestésico23.
Se recogieron datos como el dolor durante el procedimiento de conización con asa en consulta (medido con una escala analógico visual, conceptualmente similar a una escala numérica), complicaciones inmediatas y tardías (registradas en una base de datos) y evolución a corto plazo de los resultados tras la conización (valorando número de histerectomías y de reconizaciones posteriores).
Las complicaciones relacionadas con la conización se clasifican en inmediatas o tardías. Entre las inmediatas podemos señalar el dolor (utilizando una escala analógica visual), la hemorragia y las lesiones vaginales. Entre las tardías, la hemorragia, que puede ser causa de ingreso hospitalario, y la fiebre. Todas estas variables se evaluaron sobre la base de la revisión de la historia clínica de la paciente. En el Hospital Donostia, además, las variables de complicaciones inmediatas eran recogidas tras el procedimiento en la base de datos diseñada con tal fin.
La descripción de las variables cualitativas se realiza mediante proporciones y las variables continuas mediante medias. Se utilizó la prueba de la χ2 y la prueba de la Student para comparar proporciones y medias, respectivamente.
ResultadosLa edad media de las pacientes conizadas en todos los Hospitales del País Vasco es de 35,7 años (con intérvalos de 18 años en el hospital de Basurto-69 años en el Hospital Donostia); la media de edad varía ampliamente entre los distintos hospitales, destacando 33,5 años en el hospital de Basurto y 47,5 años en el hospital de Mondragón (tabla 1). El motivo de consulta más frecuente por el que concurrieron las pacientes fue la citología de cribado oportunista o la de control, hallazgo común en la totalidad de los hospitales (tabla 2).
Edad de las pacientes en los diferentes hospitales de Osakidetza.
| Basurto | Txagorritxu | Cruces | Mendaro | Donostia | Zumárraga | Galdácano | Mondragón | |
| Edad media (años) | 33,5 | 34,8 | 35,2 | 35,1 | 39,2 | 30,6 | 42 | 47,5 |
| Rango | 18-61 | 19-50 | 20-53 | 20-50 | 23-69 | 18-39 | 25-73 | |
| Menos de 25 años | 13 (20%) | 7 (18,9%) | 4 (13,3%) | 2 (10,5%) | 4 (7,4%) | 1 (16,6%) | 2 (11,7%) | 3 (75%) |
| Entre 26 y 50 años | 50 (76,6%) | 30 (81%) | 25 (83,3%) | 17 (89,4%) | 44 (81,4%) | 5 (83,3%) | 12 (70,5%) | 1 (25%) |
| Más de 50 años | 2 (3%) | 0 | 1 (3,3%) | 0 | 6 (11,1%) | 0 | 3 (17,6%) |
Motivos de consulta al inicio del estudio.
| Basurto | Txagorritxu | Cruces | Mendaro | Donostia | Zumárraga | Galdácano | Mondragón | |
| Citología HSIL | 50 (76,9%) | 11 (29,7%) | 12 (40%) | 9 (47,3%) | 26 (48,1%) | 1 (16,6%) | 10 (58,8%) | 2 (50%) |
| Citología LSIL | 14 (21,5%) | 26 (70,2%) | 11 (36,6%) | 9 (47,3%) | 11 (20,3%) | 5 (83,3%) | 4 (23,5%) | 2 (50%) |
| Otro | 1 (15,3% | 7 (23,3%) | 1 (5,2%) | 17 (31,4%) | 3 (17,6%) |
HSIL: lesión escamosa intraepitelial de alto grado; LSIL: lesión escamosa intraepitelial de bajo grado.
La indicación más frecuente para la práctica de la conización fue la terapéutica, entendiendo como tal la que se hace tras la obtención de una biopsia con diagnóstico de CIN II-III (tabla 3).
El 94,8% de las conizaciones se hicieron con asa de diatermia en todos los hospitales y, excepcionalmente, con bisturí (tabla 4). Sólo 4,2% de nuestras conizaciones se han hecho con bisturí, aunque en el Hospital Donostia se hicieron un 16,6%. Estos casos se debieron a situaciones muy concretas, en un caso porque el diagnóstico colposcópico fue de cáncer que no se confirmó con la biopsia, en dos porque había una estenosis del orificio cervical externo después de una conización previa y en el resto porque había lesión residual tras una conización anterior.
La anestesia utilizada fue local en los hospitales de Basurto, Cruces y Txagorritxu en un 100%; regional en los hospitales de Galdácano, Mendaro, Zumárraga y Mondragón, también en un 100%. En el Hospital Donostia se utilizaron ambas anestesias, local en un 66% y local y/o regional en un 33% (tabla 5).
La tolerancia al dolor en las conizaciones ambulatorias realizadas con asa de diatermia bajo anestesia local en la consulta de ginecología externa (evaluada sólo mediante la escala analógica en el Hospital Donostia) se realizó en las 36 pacientes que fueron sometidas a anestesia local (66,6% de las 54 conizaciones practicadas en el Hospital Donostia). 32 pacientes (88,75%) dieron una puntuación 0-3 y 4 (11,42%) una puntuación 3-6. Ninguna paciente refirió haber tenido dolor superior a 6 (tabla 6).
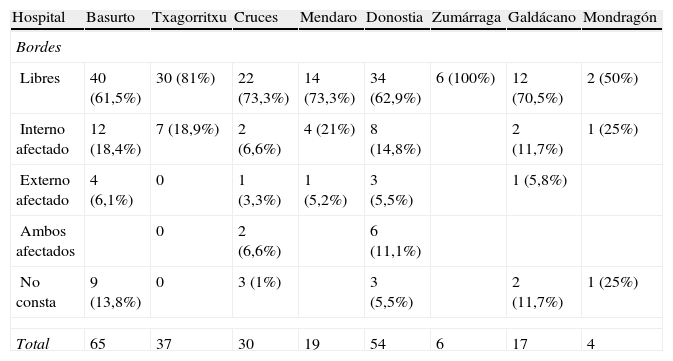
El resultado de la anatomía patológica de la pieza de conización se puede ver en la tabla 7. En la tabla 8 se aprecia el resultado de los bordes del cono, donde la mayoría de los casos eran libres.
Resultados de la anatomía patológica.
| Hospital | Basurto | Txagorritxu | Cruces | Mendaro | Donostia | Zumárraga | Galdácano | Mondragón |
| Negativo | 5 (7,6%) | 2 (10,5%) | 7 (12,9%) | 3 (50%) | 2 (11,7%) | |||
| CIN I | 9 (13,8%) | 6 (16,2%) | 4 (21%) | 1 (1,8%) | 1 (16,6%) | 2 (11,7%) | ||
| CIN II | 4 (13,3%) | 1 (5,2%) | 17 (31,4%) | 4 (23,5%) | ||||
| CIN III | 50*(76,9%) | 31*(83,7%) | 25 (83,3%) | 12 (66,6%) | 27 (50%) | 1 (16,6%) | 6 (35,2%) | 3 (75%) |
| Microinvasión | ||||||||
| Invasión | 1 (1,5%) | 1 (1,8%) | ||||||
| Adenocarcinoma | 1 | 1 (25%) | ||||||
| Otro | 1 (3,3%) | 1 (1,8%) | 1 (16,6%) | 2 (11,7%) | 1 (25%) | |||
CIN: neoplasia cervical intraepitelial.
*Refieren a alto y bajo grado en lugar de CIN I, II y III.
Resultados de los márgenes de escisión.
| Hospital | Basurto | Txagorritxu | Cruces | Mendaro | Donostia | Zumárraga | Galdácano | Mondragón |
| Bordes | ||||||||
| Libres | 40 (61,5%) | 30 (81%) | 22 (73,3%) | 14 (73,3%) | 34 (62,9%) | 6 (100%) | 12 (70,5%) | 2 (50%) |
| Interno afectado | 12 (18,4%) | 7 (18,9%) | 2 (6,6%) | 4 (21%) | 8 (14,8%) | 2 (11,7%) | 1 (25%) | |
| Externo afectado | 4 (6,1%) | 0 | 1 (3,3%) | 1 (5,2%) | 3 (5,5%) | 1 (5,8%) | ||
| Ambos afectados | 0 | 2 (6,6%) | 6 (11,1%) | |||||
| No consta | 9 (13,8%) | 0 | 3 (1%) | 3 (5,5%) | 2 (11,7%) | 1 (25%) | ||
| Total | 65 | 37 | 30 | 19 | 54 | 6 | 17 | 4 |
Resulta de especial interés el estudio del Hospital Donostia, comparando la afectación de los bordes según el tipo de anestesia utilizada (local en las realizas en la consulta) y la subdivisión del estado de los bordes en las lesiones CIN III y en las lesiones CIN II (tabla 9).
Bordes de la pieza quirúrgica según los diferentes tipos de conización en casos de CIN II y III en el Hospital Donostia.
| Tipo de conización AP Bordes | Bisturí | Asa quirófano | Asa Consulta | Total |
| CIN III | ||||
| Libres | 1 (11,1%) | 3 (33,3%) | 4 (26,6%) | 8 (29,6%) |
| Interno afectado | 2 (22,2%) | 6 (40%) | 8 (29,6%) | |
| Externo afectado | 1 (6,6%) | 1 | ||
| Ambos afectados | 2 (22,2%) | 2 (13,3%) | 4 (14,8%) | |
| A menos de 3 mm | 2 (22,2%) | 2 (22,2%) | 2 (13,3%) | 6 (22,2%) |
| Total | 3 | 9 | 15 | 27 |
| CIN II | ||||
| Libres | 1 | 10 (66,6%) | 11 (64,7%) | |
| Interno afectado | ||||
| Externo afecto | 2 (13,3%) | 2 | ||
| Ambos afectados | 1 | 1 | ||
| A menos de 3mm | ||||
| Otros | 3* | 3 | ||
| Total | 17 | |||
CIN: neoplasia cervical intraepitelial.
Las complicaciones inmediatas son pocas, y son todavía menores las tardías. En el Hospital Donostia, en el subgrupo de anestesia local ambulatoria, no hubo ninguna complicación digna de mención, excepto dos sangrados de intensidad algo superior a lo habitual que fueron resueltos en la propia consulta con 2 puntos de sutura, en 2 pacientes se tocó la pared vaginal con el asa de diatermia provocando un sangrado escaso que se resolvió espontáneamente o aplicando solución de Monsel. No se produjo ninguna complicación tardía; todas las pacientes regresaron a sus domicilios sin necesidad de ingresar en el hospital como consecuencia de la misma. Respecto al subgrupo de anestesia locoregional en quirófano, destacamos una lesión de vagina con asa de diatermia que precisó puntos de sutura y dos hemorragias, una de las cuales prolongó el ingreso 24h (realizada con bisturí) y otra paciente que precisó un reingreso durante 24h a los 3 días de la conización. Datos similares se reflejan en el Hospital de Basurto y no se dispone de resultados del resto de los hospitales.
En cuanto a la evolución clínica de las pacientes, aportamos los datos recogidos en el Hospital Donostia. Todos los controles posteriores a la conización, fueron negativos, no habiendo evidencia de que hubiera enfermedad residual, excepto en 7, aunque 6 se perdieron para estudio ya que no acudieron al control posterior.
De las 7 pacientes con enfermedad residual, destaca una paciente que precisó histerectomía radical tipo Whertein por enfermedad invasora en la pieza de conización y 2 pacientes a las que se les practicó una histerectomía simple por borde interno afecto tras la conización, con citologia positiva en el control posterior en ambas había enfermedad residual CIN III en el diagnóstico definitivo histológico en la pieza de histerectomía y habían sido realizadas sus conizaciones previas en quirófano con bisturí un caso y con asa de diatermia el otro, y presentaron bordes afectados en dichas piezas.
Una paciente precisó reconización porque habia tenido el borde interno afecto y citología positiva en el primer control no encontrando CIN en la nueva pieza de conización. El resto de las pacientes continúan controlándose satisfactoriamente en consulta, al haber sido conizadas por un CIN III y presentar citología ASC-US en el control (una paciente con un borde libre, otra con un borde afectado y otra paciente con un borde a menos de 3mm de la lesión).
DiscusiónSegún el Documento de Consenso de la Sociedad Española de Ginecología y Obstetricia (SEGO), la Sociedad Española de Citología (SEC) y la Asociación Española de Patología Cervical y Colposcopia, el tratamiento escisional, la conización, es el tratamiento de elección en las mujeres con CIN II-III24. El 81,8% de las conizaciones en nuestro estudio fueron terapéuticas. Del resto, la mayoría fueron diagnósticas, es decir, por discordancia entre la citología y la colposcopia.
Según el mismo protocolo, en la actualidad, la conización se realiza con asa diatérmica con anestesia local y de forma ambulatoria24. La tolerancia a la anestesia local es excelente. En el Hospital Donostia se seleccionan las conizaciones que se realizan en quirófano según el tamaño de la lesión y de la previsión de que la lesión sea invasora. Esto se hace, fundamentalmente, porque cuando la lesión es muy amplia existe mayor riesgo de lesión vaginal, y esta es más difícil de resolver en la consulta o porque la profundidad que precisamos a nivel del cuello hace aconsejable su realización en quirófano.
Hoy día se aceptan muy pocas indicaciones para realizar una conización clásica con bisturí en quirófano24, aunque sigue teniendo vigencia su utilización, sobre todo cuando la lesión es glandula lesiones que se introducen en el canal, reconización por bordes endocervicales afectados o, fundamentalmente, el adenocarcinoma in situ. Algunos autores prefieren realizar en algunos de estos casos una conización con asa de diatermia en dos tiempos, usando externamente una asa más grande y más profundamente en el cérvix un asa más pequeña.
La conización con asa en consulta, con anestesia local, va ganando terreno a la conización con bisturí bajo anestesia, como se ve en este artículo, pero hoy día se siguen aceptando indicaciones para la conización con bisturí; además, se debería de admitir un período de transición entre ambas técnicas.
El tratamiento escisional permite el estudio histológico exhaustivo y diagnosticar un carcinoma oculto inicialmente invasor en aproximadamente un 1% de los casos24. Dos (0,9%) han sido los cánceres invasores diagnosticados en la conización durante el período de estudio; uno había sido diagnosticado colposcópicamente, pero no se había confirmado en la biopsia.
Los márgenes quirúrgicos exocervical, endocervical o profundos pueden estar afectados hasta en un 48% de los tratamiento escisionales25. En este estudio, el porcentaje de bordes afectados es muy variable entre los distintos hospitales. La media es de 31% (0% en Zumárraga y 47% en San Sebastián); la forma de recogida de los casos así como el reducido número de pacientes incluidas por algunos hospitales pueden ser el motivo de esta variabilidad. El porcentaje de bordes afectados es sensiblemente mayor en caso de CIN III, estadísticamente significativo cuando lo comparamos con los de CIN II (p=0,006), tal y como está descrito que cuanto más gradación tenga la lesión mayor es el volumen de tejido afectado26–28. El porcentaje de bordes afectados es similar en la conización con asa diatérmica practicada bajo anestesia regional o general a cuando lo hacemos con anestesia local (p=0,78, NS).
Tras una conización con asa por CIN II-III, se estima que entre 5 y 30% de los casos presentan una enfermedad residual o recurrente29–31. Aunque el tiempo de seguimiento de las pacientes del Hospital Donostia es aún breve, hasta la fecha se han practicado 1 histerectomía radical, operación de Wertheim, por cáncer invasor, 2 histerectomías por CIN III residual y 1 reconización sin evidencia de patología.
Aunque el estado de los márgenes se ha considerado predictivo de enfermedad residual32–38, aproximadamente un 60% de las pacientes con márgenes positivos no presentarán lesión durante el seguimiento, mientras que un 12% con márgenes negativos presentará lesión. Por tanto, el estado de los márgenes debe tomarse en cuenta como factor de riesgo de persistencia, pero por sí solo no justifica una reconización o histerectomía. Las dos mujeres histerectomizadas y la reconizada tenían márgenes positivos. Pero es necesario esperar un tiempo más amplio para conocer la evolución de todas estas mujeres.
Es aconsejable, según el protocolo de consenso, realizar el primer control tras la conización a los 6 meses del tratamiento cuando los bordes sean negativos y a los tres cuando están afectados. En el primer control se practicarán una citología, una colposcopia y eventuales biopsias, y cuando la colposcopia no es satisfactoria o los bordes de la conización estuvieran afectados por la lesión se incluirá un estudio endocervical. El análisis del ADN-VPH se realizará a partir de los 6 meses. El ADN-VPH tiene una alta sensibilidad para la detección de enfermedad residual24. En el Hospital Donostia se practica el primer control tras la conización a los 4 meses, con las técnicas expuestas anteriormente, es decir citología, colposcopia y determinación del ADN-VPH. Esta conducta se lleva a cabo en nuestra consulta antes de haber sido publicado el primer protocolo de la SEGO. Nuestro valor predictivo negativo es elevado tal como ha sido publicado por nuestro grupo en Progresos39.
ConclusionesLa conización con asa de diatermia es la técnica utilizada de manera habitual en los hospitales del País Vasco.
La anestesia local es la anestesia más utilizada en los hospitales grandes, mientras que la anestesia regional lo es en los hospitales pequeños.
La conización con asa de diatermia bajo anestesia local en la consulta es muy bien tolerada por la paciente y tiene pocas complicaciones, por tanto, es una alternativa razonable frente a la conización en quirófano bajo anestesia general o regional con bisturí o con asa de diatermia.
La cifra de conizaciones con borde afectado es alta, pero similar a la descrita por otros autores y no existen diferencias si se efectúan en consulta bajo anestesia local o en quirófano bajo anestesia regional o general. La cifra de bordes afectados es muy superior cuando la lesión es un CIN III que cuando corresponde a un CIN II o inferior.
La conización con asa de diatermia bajo anestesia local ofrece múltiples ventajas a la paciente y al sistema sanitario, ya que implica un coste muy inferior, sin presentar desventajas médicas, con una tolerancia satisfactoria.
Tras valorar nuestro estudio se recomienda instaurar progresivamente la conización ambulatoria con anestesia local como estándar de procedimiento en todos los procesos de conización, tanto diagnósticos, como terapéuticos, salvo casos seleccionados.
FinanciaciónEste estudio se financiado gracias a una beca de investigación comisionada del Departamento de Sanidad del Gobierno Vasco (Osteba).
Conflicto de interesesLos autores de este estudio declaran no tener ningún conflicto de intereses.