Hace 9 años se realizó en España la primera intervención de cirugía fetal endoscópica y desde entonces se han realizado ya más de 600 intervenciones. La fetoscopia, que se inició de forma estable en Europa a mediados de los años noventa, no fue la primera intervención de terapia fetal, dado que la transfusión intraútero para anemia fetal se realizaba ya hacía más de 10 años. Sin embargo, la terapia endoscópica representó una revolución en el número de casos tratados de terapia fetal. En la actualidad constituye la parte más importante de la terapia fetal y es una alternativa consolidada para un número pequeño pero significativo de indicaciones. Los casos de terapia fetal en España, si bien todavía en número proporcionalmente inferior a otros países europeos, no ha dejado de crecer cada año. La demanda seguirá sin duda aumentando por los avances en el diagnóstico prenatal y la información de médicos y pacientes.
Esta revisión ofrece un resumen actualizado de las principales indicaciones de terapia fetal y los criterios de selección para ofrecer tratamiento. A través de un análisis sistemático de la literatura científica y de bases de datos construidas por el grupo Eurofoetus, que suma más del 85% de la experiencia en Europa, se resume la evidencia más reciente sobre los resultados actuales. El ámbito de la revisión se centra, fundamentalmente, en la terapia endoscópica y la que implica la utilización de trocares, instrumentos de mayor tamaño que una aguja. Por ello, no se discute en esta revisión la anemia fetal, verdadera pionera de la terapia fetal, sobre la que existen resultados consolidados ya hace años y excelentes revisiones. Tampoco se incluyen tratamientos aislados descritos como casos de carácter anecdótico, por ser afecciones extremadamente inusuales. Finalmente, se realiza una breve discusión sobre aspectos éticos, de seguridad materna y de futuro en terapia fetal.
TERAPIA Y CIRUGÍA FETAL: PRINCIPALES INDICACIONES Y RESULTADOSComplicaciones de la gestación monocorialTransfusión fetofetalPrevalencia e historia natural. La transfusión fetofetal (TFF) ocurre aproximadamente en un 10-12% de los embarazos monocoriales1,2, aproximadamente 1/2.000 embarazos, unos 250 casos al año en España. La base anatómica son las anastomosis vasculares interfetales de la placenta monocorial, que facilitan un desequilibrio crónico en el intercambio de sangre3. El feto donante desarrolla hipovolemia e hipertensión y su hermano receptor hipervolemia y paradójicamente también hipertensión al recibir sustancias vasoactivas del donante. La TFF se asocia a una mortalidad del 100% antes de las 20 semanas y más del 80% entre las 21–26 semanas, con más de un 50% de secuelas graves en los supervivientes3. La mortalidad resulta de la combinación de los trastornos hemodinámicos fetales con la prematuridad derivada del polihidramnios extremo.
Criterios diagnósticos e indicaciones para tratamiento prenatal. Los criterios son ecográficos y se basan en la presencia de una secuencia polihidramnios/oligohidramnios en una gestación gemelar monocorial conocida (tabla 1)4. El Doppler no es necesario para el diagnóstico, pero se utiliza para estadificar la progresión de la enfermedad (tabla 1)5. Los criterios clásicos basados en discordancia de peso fetal o hemoglobina han quedado obsoletos dado que se pueden asociar o no a TFF6. Es importante el diagnóstico diferencial con retraso de crecimiento selectivo, la otra complicación de la gestación monocorial (fig. 1).
Criterios diagnósticos de transfusión fetofetal y estadios de gravedad
| Criterios diagnósticos |
| Diagnóstico confirmado de monocorionicidad |
| Secuencia polioligohidramnios |
| Receptor: columna máxima vertical > 8cm (< 20 semanas) o > 10cm (21–28 semanas) |
| Donante: columna < 2cm |
| Discordancia de vejigas: muy distendida en receptor, muy pequeña o no visible en donante |
| Estadios de gravedad según Quintero et al |
|
Técnicas disponibles y bases fisiopatológicas. El tratamiento causal es la coagulación láser de las anastomosis placentarias por vía fetoscópica (fig. 2), que elimina las anastomosis interfetales y revierte el proceso hemodinámico. En la actualidad, se realiza desde las 15 hasta las 28 semanas. El amniodrenaje agresivo es el tratamiento alternativo si no se dispone de fetoscopia. Es un tratamiento paliativo que reduce el polihidramnios masivo, prolongando la gestación.
Resultados del tratamiento de la transfusión fetofetal. Un ensayo clínico aleatorizado que comparó láser contra amniodrenaje demostró que el láser es el mejor tratamiento disponible para la TFF7. Los resultados en series de centros con experiencia publicados en los últimos 10 años oscilan entre un 75 y un 90% de supervivencia para al menos un feto8–16. En la experiencia del autor, con más de 400 casos tratados, la supervivencia en los últimos 100 casos considerados candidatos a tratamiento fue > 90% para al menos un feto y > 70% para los 2 (datos no publicados). La edad media al parto en las series más recientes y en nuestro medio es de 35 semanas12,13; por tanto, unas dos semanas antes de la media en gemelares18, principalmente por la tasa de rotura prematura de membranas (RPM, véase más adelante). La tasa de secuelas neurológicas graves al año de vida oscila alrededor del 6%18. Esta cifra es difícil de interpretar, dado que la tasa media en gemelos monocoriales es generalmente superior a la tasa en gestación única del 1,5 % y según datos indirectos se acercaría al 3-4%19,20. El amniodrenaje presenta supervivencias de al menos un feto en el 50%7,8,16,21, con tasas de secuelas neurológicas muy superior, que al año pueden superar el 40%22, lo que se explica por la mayor prematuridad y naturaleza paliativa del tratamiento.
Crecimiento intrauterino retardado selectivoPrevalencia, tipos e historia natural. El crecimiento intrauterino retardado selectivo (CIRS) es la segunda complicación más importante de la gestación monocorial. Su prevalencia es aproximadamente del 10% de los monocoriales1,2, 1/2.500 gestaciones, unos 200 casos al año en España, aunque no todos requieren tratamiento. Se trata de la presencia de CIR en un solo feto, producida por un reparto asimétrico de la placenta, que condiciona una insuficiencia placentaria en un feto. A diferencia de un embarazo único o un gemelar bicorial, la existencia de anastomosis interfetales interfiere en la historia natural del CIR y determina diferentes patrones clínicos con cursos clínicos y pronósticos muy diferentes. La mayoría de los casos pueden clasificarse en tres grandes patrones según el Doppler de arteria umbilical del feto con CIR (tabla 2).
Clasificación del CIR según tipo de Doppler de arteria umbilical del feto con CIR y correspondencia con el patrón de anastomosis característico
| Tipo CIR | Doppler de arteria umbilical | Evolución/pronóstico |
| Tipo I | Normal | Bueno |
| Tipo II | ARFD* constante | Gran riesgo de deterioro in utero. Si deterioro en edades previas informar posibilidad de oclusión de cordón |
| Tipo III | ARFD intermitente | Riesgo elevado de muerte fetal o secuela neurológica. Valorar actitud activa, láser u oclusión de cordón según el estado feto CIR |
ARFD: ausencia o reversión del flujo diastólico; CIRS: crecimiento intrauterino retardado selectivo.
Criterios diagnósticos, indicaciones de tratamiento y resultados disponibles. El diagnóstico se establece por un crecimiento inferior al percentil 10 en un feto. Suele asociarse a discordancia interfetal de peso mayor al 25%, pero este criterio se utiliza poco actualmente. El manejo cambia sustancialmente según el tipo (tabla 2). Verdaderamente, los casos susceptibles de tratamiento son los tipos II y III, dado que en el tipo I se puede seguir una conducta expectante con seguimiento estricto y finalizar sobre las 34–35 semanas, con buenos resultados perinatales en general23.
- –
CIRS tipo II: debe controlarse de forma estricta. En la mayoría de los casos el feto con CIR se deteriora23,24, lo cual se detecta mediante la alteración progresiva del Doppler de arteria umbilical y el ductus venoso. Según la edad gestacional y las preferencias de los progenitores, hay 2 opciones: tratamiento intrauterino o finalización de toda la gestación. Si se decide tratamiento intraútero, la primera opción es la oclusión de cordón, dadas las probabilidades mínimas para el feto con CIR, pero si los progenitores rechazan un feticidio se puede ofrecer coagulación láser de anastomosis25.
- –
CIRS tipo III: entidad recientemente descrita23, de gran complejidad y curso clínico impredecible y engañoso. El feto CIR no suele deteriorarse intraútero26, pero puede morir de forma inesperada en un 15% de los casos, y el feto normal puede presentar lesión neurológica en un 15-20%26. La presencia de una gran anastomosis arterioarterial condiciona la aparición del flujo intermitente y el curso clínico particular, al favorecer accidentes agudos de TFF aguda que explican las complicaciones27,28. La actitud actual es ofrecer una conducta expectante con finalización electiva alrededor de las 32 semanas, o un tratamiento intrauterino. La coagulación láser incrementa el riesgo de morir del feto con CIR, al eliminar su mecanismo fundamental de supervivencia, pero mejora los resultados del feto mayor29. La segunda opción es realizar una oclusión electiva de cordón. En una muestra preliminar de 12 casos, se obtuvo supervivencia del mayor en todos los casos y no se observaron secuelas neurológicas en ningún superviviente30. En este momento existe un estudio colaborativo internacional para documentar mejor la historia natural de esta condición y los resultados de las opciones de tratamiento.
Prevalencia e historia natural. Un 3-4% de las gestaciones monocoriales presentan una malformación grave31, tres veces más que una gestación única o gemelar bicorial, y representan 1/6.000-8.000 embarazos, unos 70-80/año en España. En más del 90% de los casos, la malformación es discordante, sólo la presenta un feto. Los riesgos para el feto normal se incrementan de forma variable según el problema, por el riesgo de muerte fetal y de complicaciones asociadas, por ejemplo polihidramnios. En algunos casos el riesgo es claramente alto y en otros es un riesgo inespecífico difícil de cuantificar32.
Criterios de tratamiento. No existe un criterio estricto de tratamiento y la actitud más recomendable es informar sobre los riesgos de una actitud expectante según cada malformación32. En nuestra experiencia, las principales motivaciones para solicitar tratamiento son el no dar a luz a un feto con malformación grave y reducir la incertidumbre para el feto normal.
Técnicas y resultados. La técnica de elección es la oclusión de cordón, que se realiza bien con láser o, más habitualmente, con coagulación bipolar32–34. En caso de gestación monoamniótica debe realizarse sección de cordón para evitar el riesgo elevado de accidente de cordón con muerte del feto normal. Se han descrito técnicas de radiofrecuencia35, pero en la reducción de un feto vivo se asocian a alto riesgo de fallo técnico por rotura vascular y muerte de los dos fetos.
Resultados actuales de la oclusión de cordón. Con un total de 191 casos descritos, la supervivencia global osciló entre el 75 y el 90%33,34,36–40, pero este resumen incluye todos los casos de los centros desde el inicio de la fetoscopia. Si se analizan las experiencias más recientes consolidada la evolución de la técnica, la supervivencia suele aproximarse al 90%33. La edad gestacional media al parto es de 36 semanas33,34. La aparición de secuelas se observa fundamentalmente en niños nacidos antes de las 30 semanas y se sitúa en un 3%, aproximadamente, en las series recientes33. El procedimiento se realiza en el saco del feto reducido y esto reduce las tasas de RPM respecto a otros tratamientos fetoscópicos, hasta un 3% antes de las 32 semanas33,34.
Gestación monocorial con gemelo acardias. Secuencia TRAPDefinición, prevalencia e historia natural. Afecta al 1% de los monocoriales, 1/25.000 embarazos, unos 20/año en España. En un caso extremo de discordancia placentaria, un feto se desarrolla parcialmente y su cuerpo sobrevive por una comunicación arterioarterial que lleva sangre del hermano en sentido inverso (TRAP, twin reverse arterial perfusion sequence). El gemelo perfusor presenta circulación hiperdinámica, con riesgo de insuficiencia cardíaca e hídrops fetal. En la mayor revisión disponible41, el riesgo de prematuridad es del 75% y la mortalidad perinatal es del 30%. En gestación monoamniótica se añade el riesgo de accidente de cordón.
Criterios de tratamiento. El principal factor pronóstico es el tamaño del feto acardias respecto al normal y la existencia de signos de sobrecarga en el feto normal42, pero acardias pequeños se asocian también a muerte fetal43. Parece razonable informar de un riesgo basal inespecífico, que podría oscilar entre un 25 y un 50% sobre la base de lo descrito en la literatura científica. Si se trata, es mejor hacerlo electivamente a las 16–18 semanas, y no esperar al desarrollo de hídrops.
Técnicas disponibles y resultados. La técnica es la oclusión del cordón del acardias, bien en asa libre —con láser o bipolar— o en la base de implantación del cordón —con radiofrecuencia o coagulación monopolar—. Las tasas de supervivencia en series consecutivas oscilan entre el 80 y el 90%44–46. En caso de gestación monoamniótica es fundamental realizar la sección del cordón. Las técnicas basadas en inyección de esclerosantes están contraindicadas por alto riesgo de muerte del feto normal47.
Cirugía fetal en gestación tripleLa fetoscopia se ofrece rutinariamente en la gestación triple, que no es ninguna contraindicación para la terapia fetal. En 2 series de casos tratados con fetoscopia, los resultados de supervivencia y complicaciones eran similares a los descritos para gemelares48,49.
Patología pulmonar y torácicaHernia diafragmática congénitaDefinición, prevalencia e historia natural. La hernia diafragmática congénita (HDC) aislada ocurre aproximadamente en 1/4.000 embarazos, unos 150/año en España. La característica principal es la hipoplasia pulmonar, que afecta tanto al árbol traqueobronquial como al vascular. El término de HDC agrupa desórdenes de etiología genética diversa y la hipoplasia es secundaria a una compresión visceral; en muchos casos existen probablemente anomalías primarias del desarrollo pulmonar en grado variable50. Esto explica las diferencias en el resultado perinatal y en la respuesta a la terapia prenatal en casos aparentemente similares. En la mayor serie colaborativa publicada, con más de 200 casos, la HDC aislada diagnosticada in útero se asocia a una mortalidad perinatal de alrededor del 50%51. La cifra no ha cambiado en más de 20 años, como demuestran estudios poblacionales52,53, a pesar de una percepción subjetiva de mejoría de la supervivencia, en realidad sesgada por la interrupción del embarazo y los nacidos en hospitales periféricos que no sobreviven al transporte52–54.
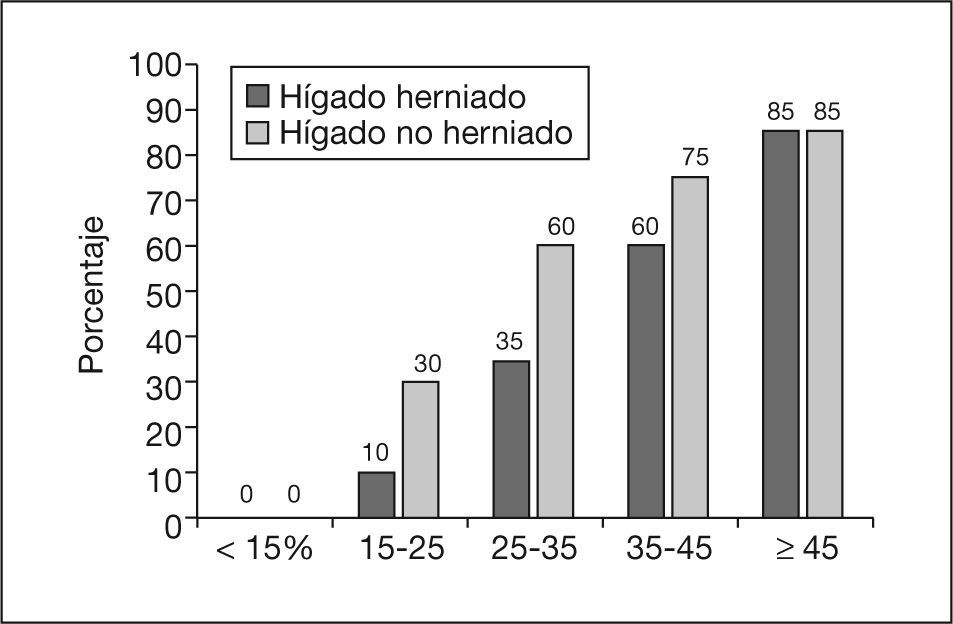
Criterios para el tratamiento. Se ofrece tratamiento prenatal en los casos en los que existe un riesgo elevado de mortalidad. El lung-to-head ratio (LHR), obtenido al dividir el área pulmonar entre el perímetro cefálico, es un parámetro sujeto a variabilidad, pero en grandes estudios se ha demostrado como el parámetro que permite estimar de forma más reproducible la probabilidad de supervivencia51. En la actualidad se utiliza la relación entre LHR observado y el esperado (O/E) para edad gestacional, que da un porcentaje que no varía con la edad gestacional55. La utilización de criterios pronósticos basados en el tamaño pulmonar y la presencia o no de hígado en el tórax permite estratificar de forma aproximada la probabilidad de supervivencia postnatal (fig. 3). En este momento se ofrece tratamiento a casos con un pronóstico de supervivencia inferior o igual al 60%.
Técnica y base fisiopatológica. La estrategia actual se basa en la oclusión traqueal fetoscópica con balón (fig. 4)56, que impide la salida del fluido traqueobronquial e induce un crecimiento acelerado pulmonar mediante estímulo directo mecánico y secreción de factores de crecimiento57. El balón se coloca en un momento variable, que puede oscilar entre 27–28 semanas en casos con LHR O/E < 28% y a las 30–32 en LHR O/E del 28-40%. El balón se retira en una segunda fetoscopia, punción ecoguiada o técnica EXIT (véase más adelante).
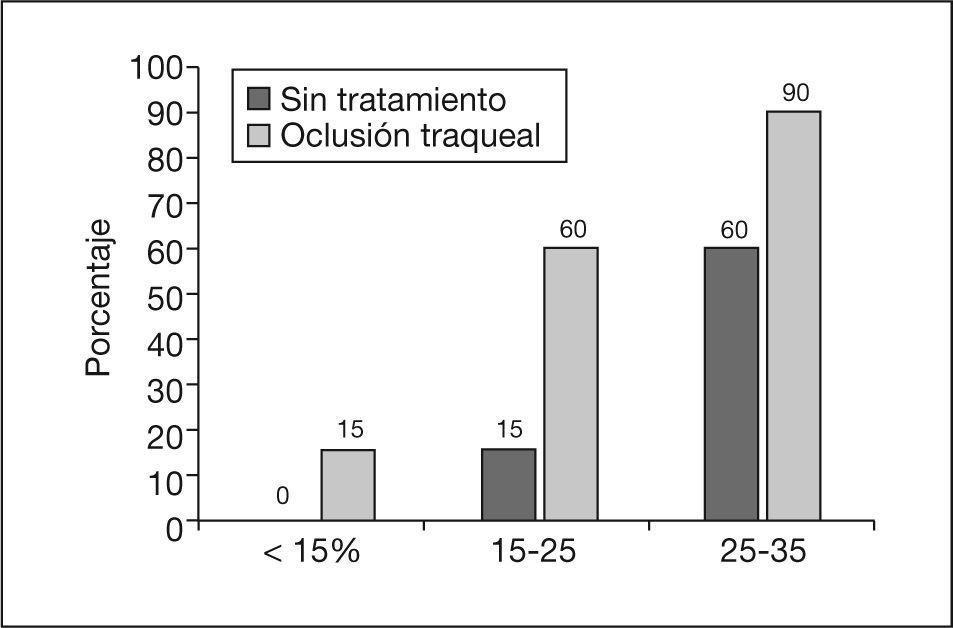
Resultados actuales. La oclusión traqueal es todavía un tratamiento en evolución técnica, por la notable dificultad que comporta, pero la experiencia acumulada ha mejorado los resultados y reducido las complicaciones al mínimo. En el grupo Euro-CDH56 que creó y ha aplicado la técnica mayoritariamente hasta ahora, la colocación y retirada del balón se han realizado con éxito en los más de 150 casos realizados. La duración media del procedimiento es de 17min y en los últimos 50 casos la tasa de RPM antes de las 32 semanas es inferior al 8%. La supervivencia global es del 60%58. Sin embargo, la cifra debe ajustarse al grado de gravedad inicial. Por debajo de un LHR O/E del 15%, el beneficio parece ser mínimo, y por encima de este límite el tratamiento mejoraría en un 30-40% las probabilidades de supervivencia respecto al pronóstico inicial (fig. 5). Datos no publicados sobre morbilidad a medio plazo demuestran que el 75% de los supervivientes no presentan afección asociada y un 23% presentaban anomalías leves, fundamentalmente pulmonares (7%) y gastrointestinales (4%). Un caso de los seguidos hasta ahora (2%) presentó retraso neurológico severo, si bien se trata de un prematuro nacido a las 28 semanas.
El principal reto actual es predecir la variabilidad clínica en el grupo de hipoplasia severa (16-27%), que asocia a una supervivencia del 50%. A igual tamaño pulmonar existen al menos tres subgrupos de casos con un pronóstico progresivamente peor: a) buena respuesta clínica a nivel de volumen pulmonar y función vascular, generalmente con buena evolución posnatal (aproximadamente la mitad de los casos); b) incremento de tamaño pulmonar y mejora en función respiratoria, pero con hipertensión pulmonar grave y gran mortalidad, y c) no incremento de tamaño pulmonar, con mortalidad prácticamente segura. En estudios preliminares, la combinación de Doppler y perfusión pulmonar intraútero permitiría clasificar mucho mejor estos casos y se espera que esto permita informar de forma mucho más fiable a los pacientes59.
Como resumen de la situación actual, el tratamiento con oclusión traqueal no es obviamente el definitivo para este problema. Existe un importante esfuerzo investigador para mejorar la capacidad predictiva de la respuesta al tratamiento y hallar tratamientos médicos que, combinados con el actual, contribuyan a revertir la hipoplasia en los grados más severos de la afección. Sin embargo, a pesar de sus limitaciones, la oclusión traqueal es un tratamiento efectivo en una proporción significativa de casos y constituye una esperanza real para parejas que deseen intentar mejorar el terrible pronóstico de esta enfermedad, y claramente existe un número importante de niños vivos que se han beneficiado del tratamiento prenatal. Se están diseñando en este momento ensayos clínicos para evaluar diferentes aspectos del tratamiento en el contexto de proyectos subvencionados por la Comisión Europea.
Hidrotórax fetalDefinición y fisiopatología. El hidrotórax fetal, o derrame pleural, es la presencia de líquido en la cavidad torácica. La prevalencia es de 1/10.000 embarazos, unos 50 casos/año en España. El pronóstico depende fundamentalmente de la causa y de la magnitud. Los derrames severos, cualquiera que sea la causa, producen hipoplasia pulmonar, hídrops por compresión mediastínica y muerte fetal60.
Criterios para el tratamiento fetal. Un hidrotórax aislado a tensión, sea uni o bilateral, es siempre tributario de tratamiento. Se considera a tensión si existe desviación mediastínica o reducción marcada del tamaño pulmonar. Antes de las 34 semanas, debe intentarse terapia fetal, dado que el riesgo posnatal de un feto prematuro con hídrops es alto y el riesgo de una derivación es (relativamente) bajo para el feto. En casos con derrame pleural masivo después de las 34 semanas, se puede finalizar, pero debe madurarse antes y realizar una toracocentesis ecoguiada intraútero antes del parto o en el momento de la cesárea, para facilitar la reanimación neonatal61,62.
Técnica y resultados. La técnica de elección es la colocación de un shunt (fig. 6), o derivación, pleuroamiótica. Es correcto realizar antes una toracocentesis evacuadora, que permite un mejor examen ecográfico del tórax y el corazón, pero salvo excepciones, el líquido pleural se reacumula en 24h. El pronóstico del hidrotórax tratado con shunt depende fundamentalmente de la causa subyacente, y más secundariamente de la unilateralidad y ausencia de hídrops. La derivación, en manos expertas, es segura, consigue la descompresión pulmonar y mejora claramente el pronóstico63,64. Los supervivientes presentan función pulmonar normal65. El análisis de las series publicadas, con más de 200 casos, revela una supervivencia en fetos no hidrópicos superior al 90%66–68. En fetos hidrópicos la supervivencia oscila entre el 50 y el 60%66–68, bien por anomalías asociadas no detectadas o por el mayor riesgo de prematuridad, pero es importante diferenciar entre unilateral y bilateral. La mayoría de los casos con hídrops que mueren son bilaterales, por lo que, al informar a los pacientes, es muy importante precisar que el hidrotórax unilateral sigue presentando buen pronóstico, aun cuando exista hídrops.
Masas pulmonares: MAQ, secuestro pulmonar y quistes pulmonaresPrevalencia e historia natural. La masa pulmonar más frecuente es la malformación adenomatoidea quística (MAQ), aislada o en forma de complejo MAQ-secuestro pulmonar. El resto son secuestros pulmonares y, excepcionalmente, quistes broncogénicos o masas de otros orígenes. En conjunto, se presentan en 1/3.000 embarazos68, pero claramente menos del 10% requiere tratamiento, seguramente unos pocos casos al año en España. Por razones de espacio no discutiremos el diagnóstico diferencial entre entidades, pero las consideraciones en términos de terapia prenatal son las mismas. En cualquier masa pulmonar el pronóstico es casi siempre bueno. Depende fundamentalmente del tamaño, por tanto, de la existencia o no de compresión mediastínica, dado que el tipo histológico es realmente poco relevante68–70. La evolución más habitual en la MAQ es que exista un crecimiento discreto que alcanza su máximo sobre las 25 semanas68–71. A partir de este momento, en más del 90% el tamaño se estabiliza, e incluso en la MAQ suele reducirse. En casos infrecuentes la masa desplaza el mediastino y produce un trastorno del retorno venoso e hídrops fetal. En estos casos, el pronóstico es infausto y la mayoría de los fetos morirán in útero68–73.
Criterios para el tratamiento fetal. Los criterios para indicar tratamiento son: a) desplazamiento mediastínico marcado y b) signos francos de trastorno del retorno venoso (Doppler de ductus venoso con flujo auricular reverso y/o regurgitación tricuspídea). El tercer criterio es, obviamente, el desarrollo de signos de hídrops, pero lo ideal sería actuar de forma precoz antes de su debut, aunque no siempre es posible. No existe un buen predictor de pronóstico para masas grandes, y aunque se ha propuesto utilizar una ratio entre el volumen de la masa y la circunferencia fetal69, la mayoría de los grupos clínicos nos basamos habitualmente en un seguimiento estricto, generalmente semanal.
Técnica y resultados. El objetivo es evitar la muerte fetal y llegar a la cirugía neonatal sin hídrops, que tiene buen pronóstico. La técnica de elección siempre que haya quistes es la colocación de un shunt en la cavidad mayor o área con mayores cavidades. No existen series publicadas pero sí diversos casos clínicos en series clínicas o como casos aislados68,69,74–76. En la experiencia del autor, en 5 casos tratados, todos con hídrops, el shunt permitió la reversión del hídrops y la supervivencia prenatal en todos ellos. De forma muy excepcional, en masas sólidas con arteria nutricia se ha descrito la coagulación con láser intersticial77. Finalmente, hay algunos estudios recientes que sugieren que los corticoides maternos podrían asociarse a una reducción de la masa, e incluso se han descrito casos de resolución del hídrops78,79. Aunque los resultados deben confirmarse con series más amplias —existen 9 casos publicados— dado lo poco agresivo del tratamiento, parecería razonable intentar un tratamiento con corticoides y esperar unos días a una posible mejoría.
La evolución a largo plazo de la MAQ y el secuestro pulmonar sugieren que la mayoría de los casos presentan una función posnatal pulmonar buena80,81. Los niños que sobreviven a la colocación de un shunt presentan buena función pulmonar y un discreto incremento de las anomalías deformativas leves de la pared torácica82.
Uropatía obstructivaObstrucción urinaria bajaDefinición e historia natural. Se define así la obstrucción en al uretra. La prevalencia se estima en 1/3.000, unos 165 casos/año en España. En más del 95% se produce por valvas, repliegues anómalos de la mucosa, de uretra posterior. La obstrucción se asocia a lesión renal por compresión e hipoplasia pulmonar por oligoanhidramnios, con mortalidad muy elevada si debuta en fases previas. La obstrucción parcial o la posible permeabilidad del uraco durante un período variable podría explicar que existan casos que debuten en momentos variables del embarazo o incluso de forma posnatal.
Diagnóstico, bases y criterios para el tratamiento prenatal. El diagnóstico se establece por la combinación de unos signos que por sí solos no son patognomónicos y deben existir siempre en conjunto: presencia de megavejiga con dilatación de la uretra posterior (signo de la cerradura), oligoanhidramnios de instauración rápida y dilatación pielocalicial. Por tanto, en presencia de líquido amniótico visible no está indicado un tratamiento fetal. Para ser candidato a tratamiento debe además: a) no existir signos de displasia del parénquima (hiperecogenicidad y microquistes periféricos) y b) comprobarse función urinaria, estudiada en orina y sangre fetal, en márgenes de normalidad83,84. El tratamiento se basa en la descompresión vesical para permitir recuperar líquido amniótico y para mejorar la compresión sobre el riñón. En casos indicados, con anhidramnios e imagen sugestiva de valvas uretrales, la descompresión permite evitar la muerte in útero o posnatal debida a hipoplasia pulmonar. La descompresión vesical habitualmente no es la única solución requerida por esta patología, que con frecuencia se asocia a otros problemas o disfunciones del sistema nefrourológico. Por esta razón, el tratamiento descompresivo puede preservar o retardar significativamente el deterioro posnatal de la función renal en algunos casos y en otros no tener ningún efecto en el desarrollo de una displasia renal grave.
Técnicas y resultados. La descompresión vesical, si se realiza de forma técnicamente exitosa y en fetos bien seleccionados, es decir con anhidramnios, permite recuperar líquido amniótico y salvar la vida fetal en casi todos los casos. En términos de función renal, de una forma simple podría decirse que, en casos bien seleccionados, la descompresión vesical permite obtener un 75% de casos con resultados de buena función renal a largo plazo, y un 25% con insuficiencia renal crónica en grados variables. Esto se debe a la existencia de cuadros más complejos, no detectables en el momento de la exploración por su carácter evolutivo, a pesar de estudios de función renal en sangre fetal y técnicas de imagen. El tratamiento «clásico» es la descompresión vesical mediante shunt (o derivación) vesicoamniótica, con más de 20 años de experiencia85–87. Si se analizan series consecutivas con buena identificación de casos verdaderos de obstrucción uretral, con mala función renal previa el pronóstico de supervivencia es del 33% (frente a un 0% sin tratamiento) y dos tercios de los supervivientes desarrollarán fallo renal a medio plazo87,88. Al contrario, en casos con función renal conservada, la supervivencia al año de vida, si se trata, es del 75 al 91%88 frente a un 33% en los no tratados. En un estudio de evolución a largo plazo (media de 5,8 años) todos los niños eran neurológicamente normales87. La proporción de niños con fallo renal era del 16% y un tercio de casos tenían problemas de vaciado vesical. Por tanto, el drenaje vesical mejora sustancialmente el pronóstico en casos bien seleccionados, pero existen dos factores claramente mejorables: a) es muy difícil mantener el shunt en su sitio, en muchos casos hay que poner varios, y b) el vaciamiento anómalo durante la vida intraútero puede generar problemas vesicales secundarios posnatalmente. La técnica que puede constituir el futuro es la cistoscopia fetal y fulguración de válvulas uretrales (fig. 7)89,90. Es más compleja técnicamente, pero menos agresiva para el feto; se realiza con vainas de 2mm. Se trata de una solución teóricamente definitiva y que evita muchos de los problemas del shunt. No hay series con casos consecutivos. Algunos grupos disponemos de series pequeñas de casos. Nuestro grupo ha evaluado 10 casos en los dos últimos años. En 5 casos se consideró que existían criterios de tratamiento, los otros 5 presentaban función renal muy deteriorada. Se trataron 5 casos, todos técnicamente de forma satisfactoria. Uno de los fetos no consiguió recuperar líquido y se solicitó la interrupción. Presentaba una malformación asociada del resto de la uretra, descubierta en la necropsia, posteriormente. Uno de los 4 supervivientes presentó fallo renal crónico, si bien se trataba del caso más evolucionado y tratado más tardíamente (25 semanas). Los casos tratados en fases precoces evolucionaron de forma satisfactoria. Se trata de una serie demasiado pequeña para sacar conclusiones, pero ilustra que la cistoscopia es una opción satisfactoria para un subgrupo de casos bien seleccionados. En este momento se dispone de material específico y experiencia para completar la intervención en poco tiempo y con mínima manipulación fetal, pero lógicamente es necesario disponer de series más amplias.
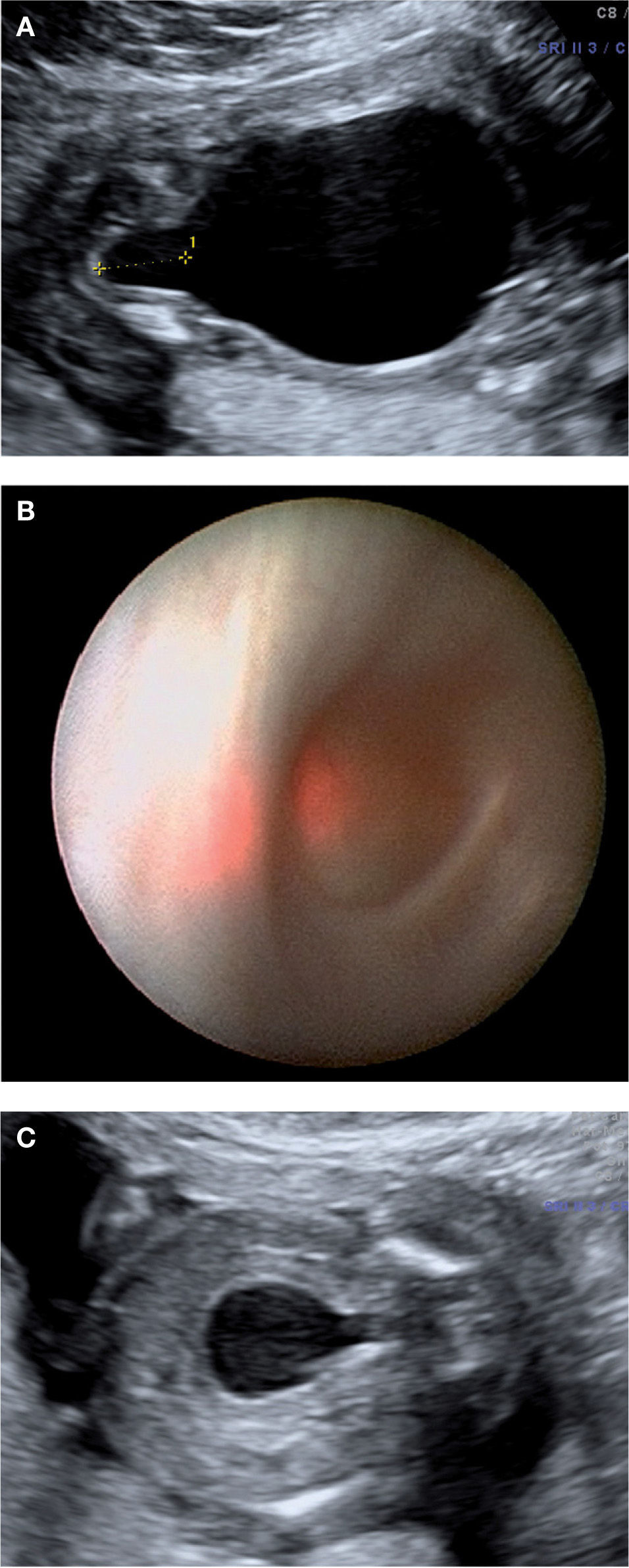
Obstrucción urinaria baja. A) Anhidramnios, vejiga extremadamente dilatada y signo de la cerradura (key sign). B) Visión endoscópica del cuello vesical y uretra dilatada desde la vejiga en el mismo caso. C) Aspecto ecográfico 2 días después de la fulguración de las valvas, con recuperación del líquido amniótico.
Los tumores fetales susceptibles de terapia fetal presentan incidencias muy bajas y no representan más que un pequeño número de casos al año, incluso en un área como España. Algunos de ellos pueden producir la muerte fetal.
Teratoma sacrococcígeoEl teratoma sacrococcígeo, si presenta un tamaño relativamente grande respecto al feto, puede producir un cuadro de insuficiencia cardíaca por alto gasto, hídrops y muerte fetal91. El tratamiento es difícil. Se han hecho intentos de coagulación dirigida de los vasos nutricios mediante radiofrecuencia92, láser93 o inyección de sustancias esclerosantes94 con el fin de reducir la masa tumoral, con resultados variables. Realmente es muy difícil hablar de probabilidades en un caso concreto dada la escasez de datos. En general, debe considerarse una complicación de mal pronóstico, por el alto riesgo de compromiso de estructuras intrapelvianas, pero si la familia no desea interrumpir ciertamente se debe intentar evitar la muerte fetal con terapia fetal.
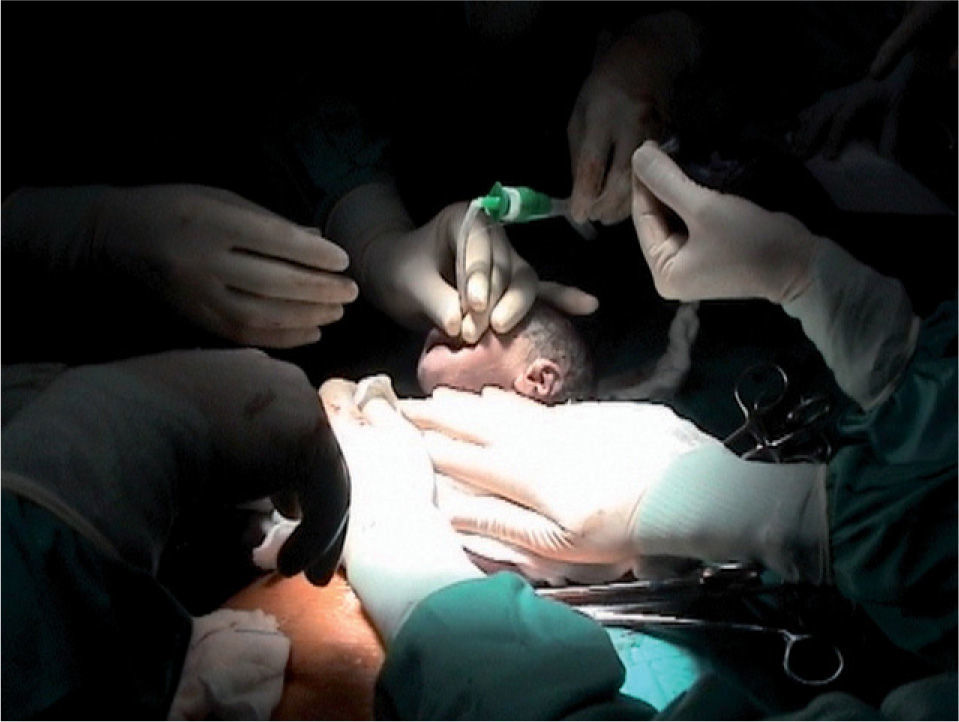
Teratoma y otras tumoraciones cervicales gigantesLos teratomas de origen en la región orofaríngea y cervical pueden tener tal tamaño que comprometan la respiración neonatal, e incluso impidan la intubación fetal, conduciendo con gran frecuencia a la muerte neonatal. En estos casos debe programarse una cirugía EXIT (ex-utero intrapartum treatment), que permite la extracción fetal parcial manteniendo la perfusión placentaria95. Es una cirugía que requiere una gran planificación y coordinación, tiene riesgos evidentes para la madre, pero bien realizada permite a los cirujanos pediátricos disponer de un tiempo corto pero suficiente para realizar una traqueostomía o incluso resecar la masa si no existe otra opción (fig. 8). La técnica EXIT también se utiliza en casos de parto prematuro para retirar el balón en la hernia diafragmática. En la experiencia del autor, en 16 intervenciones EXIT, 4 de ellas para tumoraciones fetales, en todos los casos se dispuso de tiempo suficiente para completar la intervención neonatal. Todos los casos con tumoración fetal sobrevivieron. Esta experiencia coincide con la reportada en pequeñas series.
Terapia fetal en cardiopatía congénitaEn los últimos años, se han revivido los intentos iniciados en los años noventa en algunos centros Europeos96 de dilatar intrauterinamente las estenosis valvulares arteriales, antes de que éstas condujesen a un síndrome de corazón hipoplásico. Los casos en los que estaría indicado el tratamiento serían, fundamentalmente, la estenosis aórtica y la estenosis pulmonar con septo interventricular íntegro. El objetivo esencial no es mejorar la supervivencia a corto plazo, que ya es muy alta, si no conseguir salvar la función del ventrículo afectado y evitar un corazón univentricular, claramente con peor calidad de vida y supervivencia a largo plazo. La indicación que parece más clara es la estenosis aórtica, dado que tiene un riesgo mucho más elevado que la pulmonar de desembocar en corazón univentricular, y gran parte de la experiencia se ha concentrado en un centro de EE. UU97. El aspecto más difícil del tratamiento es: a) seleccionar los casos adecuadamente, es decir, aquellos que realmente van a evolucionar a ventrículo hipoplásico, y b) realizar el tratamiento en el momento adecuado, es decir, no demasiado tarde. Combinar estos dos requerimientos es realmente difícil y reduce mucho el número de candidatos potenciales. En el centro pionero, en los primeros 20 casos reportados, se pudo realizar la técnica en 14, con una tasa de muerte intrauterina del 15% y una tasa de corazón biventricular del 33%97. La terapia cardíaca prenatal se encuentra en una fase de mejoría técnica y selección de casos98, y es necesario acumular más experiencia antes de establecer el grado en que mejora el pronóstico. En España, se han realizado casos en varios centros, con uno de ellos publicado99.
COMPLICACIONES DE LA CIRUGÍA FETALLa cirugía fetal implica siempre un riesgo añadido a la gestación, aspecto del cual los progenitores deben ser conscientes. En general, el riesgo es bajo a nivel obstétrico, muy bajo a nivel fetal y excepcional a nivel materno.
Los riesgos principales son sobre útero y membranas, y dependen de manera crítica de la duración y manipulación, por tanto de la experiencia, y en una proporción muy pequeña de factores idiosincrásicos. Desde las primeras series publicadas se evidenció que el principal riesgo era la rotura prematura de membranas100, y si bien el riesgo se ha reducido gracias a la experiencia y la reducción del tiempo operatorio, la RPM continúa siendo el problema fundamental de la fetoscopia. Resumir la tasa históricamente es imposible porque las series más largas incluyen casos durante la curva de aprendizaje. Una cifra que resume bastante bien el riesgo actual para cualquier terapia que implique inserción de un trócar es del 15-20% antes de las 32 semanas101. Para la RPM antes de 37 semanas el riesgo es mucho más alto, entre el 25 y el 50% según las series e indicaciones, pero debe considerarse que muchos de estos casos son gemelares, con lo que la tasa ya es mucho más elevada per se. Por esta razón, la terapia fetal acorta la duración de la gestación un promedio de 3–4 semanas. Sin embargo, no se incrementa la tasa de amenaza de parto prematuro con membranas íntegras. La corioamnionitis es la segunda complicación más frecuente, con profilaxis antibiótica sucede en < 1% de casos102. Otros riesgos son excepcionales. Se han descrito desprendimientos de placenta, pero casi siempre en operaciones largas y traumáticas. En nuestra experiencia, no se ha observado ningún caso en más de 500 intervenciones.
La seguridad materna de la fetoscopia o cualquier procedimiento que implique inserción de un trócar es extremadamente elevada. Existe al menos una comunicación personal (no publicada) de una embolia de líquido amniótico durante una fetoscopia. Por tanto, de forma remota, la fetoscopia podría asociarse a complicaciones graves maternas, aunque debe recordarse que se han descrito complicaciones fatales también después de procedimientos tan poco invasivos como la amniocentesis diagnóstica103,104. En España, que sepamos, no se ha producido ninguna muerte materna por terapia fetal. Existe un caso de muerte materna en una gestación gemelar por embolia de líquido amniótico durante una interrupción de la gestación realizada a los pocos días de una fetoscopia por TFF105. Sin embargo, también hemos observado una muerte materna por esta causa en un parto prematuro gemelar que debutó días antes de un feticidio selectivo programado, o un síndrome de HELLP con gran agresividad materna e ingreso prolongado en la unidad de cuidados intensivos, días antes de una fetoscopia programada para oclusión traqueal, casualmente aplazada por solicitud de los progenitores (casos no publicados). En conclusión, la atribución de causalidad en complicaciones de tal excepcionalidad es muy difícil y debe realizarse con cautela. Con la experiencia actual, con más de 10.000 fetoscopias realizadas en el mundo, la tasa de complicaciones maternas puede calificarse razonablemente como excepcional.
En definitiva, la terapia fetal es una técnica potencialmente asociada a complicaciones graves, y debe realizarse en condiciones indicadas y con plena información y consentimiento de los progenitores. La probabilidad de complicaciones es muy baja si se realiza por grupos con experiencia y, lógicamente, los riesgos se incrementan con la duración y la manipulación. Actualmente, una fetoscopia implica una media de 30 minutos intraútero para la mayoría de las indicaciones107 y esto ha sido un factor clave en conseguir tasas de complicación mínimas comparadas a las iniciales.
CALIDAD DE VIDA DESPUÉS DE TERAPIA FETAL E INFORMACIÓN A PROGENITORESLa patología fetal es un problema siempre grave y, al igual que en cualquier enfermedad, con un resultado nunca asegurado. Cuenta además con un aspecto peculiar que lo diferencia del resto de la medicina y es que existe la opción de interrumpir la gestación. Obviamente, esta opción forma parte del abanico de posibilidades que se ofrecen a la pareja, pero para una proporción significativa de progenitores no constituye la primera, al menos no antes de haber recibido una información lo más completa posible. No debe olvidarse de que la interrupción de un feto de edad gestacional relativamente avanzada es una opción siempre traumática y con consecuencias a largo plazo para toda la familia108,109. Por este motivo, informar a los progenitores es un aspecto de gran dificultad y responsabilidad. Aunque existen casos en los dos extremos, con preferencias a priori sobre la actitud que se debe tomar, la mayor parte de progenitores se hallan una zona gris en la que es esencial la información que reciban. Como es lógico, casi uniformemente, la preocupación fundamental es la calidad de vida a largo plazo. Esta información, siempre basada en probabilidades, debe darse además a una pareja en un estado emocional muy perturbado y con poco tiempo para pensar. Parecería de sentido común que una información tan delicada deba gestionarse de forma multidisciplinar siempre que sea necesario y por personal especializado dedicado al seguimiento de fetos y niños con estas patologías, aunque por desgracia esto no siempre sucede. Debe recordarse que la calidad de vida percibida por padres y niños con malformaciones consideradas como inhabilitantes o que interfieren en la vida normal son muy variables en función de cada pareja, y existe siempre una proporción significativamente alta de casos en los que la percepción es similar a la de niños sanos110,111. Estos resultados son similares en estudios en niños con terapia fetal87.
Por tanto, la gestión y responsabilidad en la información ofrecida a los progenitores es un aspecto tan importante como la propia terapia fetal y deben evitarse actitudes simplificadoras, paternalistas y, por supuesto, que condicionen al paciente. Este tipo de información debe calificarse hoy en día, sin ningún tipo de matización, de poco responsable. La gran mayoría de los pacientes son capaces de resolver por sí mismos las decisiones al enfrentarse a la información objetiva, como es lógico siempre que reciban una información y soporte adecuados. Como ejemplo, se ha demostrado que en el diagnóstico invasivo de síndrome de Down, existe una correlación lineal entre el porcentaje de los pacientes que solicita una prueba invasiva y el porcentaje de riesgo numérico en el cribado no invasivo112. Si bien no existen estudios sobre terapia fetal, nuestra experiencia de 10 años y más de 2.000 pacientes que consideraban una terapia fetal sugiere que esta correlación lineal se produce igualmente en las decisiones de los progenitores.
SITUACIÓN ACTUAL Y FUTURO DE LA TERAPIA FETALInicialmente, la cirugía fetal endoscópica en Europa se realizaba por un pequeño grupo de especialistas, que constituyeron el grupo Eurofoetus con el fin de trabajar en colaboración con la industria para desarrollar instrumentos endoscópicos y realizar estudios y evaluaciones conjuntas sobre la evolución de la cirugía fetal113. En el seno de este grupo se han introducido criterios diagnósticos que utilizamos en la actualidad y estudios que han permitido tener resultados en muestras suficientes de pacientes más rápidamente. En este momento existe un número mayor de centros y especialistas en Europa y el mundo, y los hospitales con gran volumen contamos con dos especialistas entrenados en cirugía fetal.
El número óptimo de centros en un área o país es un tema muy difícil de precisar, no puede ser muy elevado por motivos obvios, pero no se pueden hacer estimaciones porque depende de muchos factores. El autor no es partidario en absoluto de una regulación política de números o áreas de influencia, dado que el riesgo de arbitrariedad es muy elevado y siempre va a ir en contra de la calidad. Por otra parte, los argumentos de distancia geográfica que con frecuencia se esgrimen son poco sólidos. La patología fetal, como problema grave y poco común, genera un gran estrés en el paciente y el médico, y realmente el resultado depende de forma muy crítica del grado de excelencia que se consiga. Por muchos centros que existan, la gran mayoría de los pacientes que deciden someterse a cirugía fetal van a tener que viajar igualmente, y lo que priorizan por encima de todo es el resultado, no si van a viajar 30min o 3h. Por tanto, sería mucho más lógica una regulación de «mercado», es decir basada en la competitividad del servicio y el control de calidad, que lógicamente debería ejercerse desde fuera de los centros. Probablemente, la forma más justa de asegurar la calidad en unas técnicas tan complejas y con números siempre reducidos sería establecer un registro nacional centralizado de obligado cumplimiento para todo centro que desee ofrecer la técnica. Indudablemente, debe existir un número mínimo de intervenciones anuales para garantizar resultados reproducibles, y que la oferta se adecue a los estándares de calidad actuales. Es crítico también que los centros que se dediquen a terapia fetal cuenten con especialistas que hayan dedicado un tiempo suficiente y acreditado a subespecializarse en técnicas de terapia fetal avanzada. Sólo de esta forma se pueden garantizar resultados consistentes, evitar complicaciones propias de la curva de aprendizaje que desacreditan la técnica, y en definitiva ofrecer al paciente la medicina fetal de hoy, no la de hace 15 años, cuando se inició el desarrollo de las técnicas actuales. Finalmente, los procedimientos de terapia fetal ecoguiada o endoscópica los deben realizar especialistas en medicina fetal, por supuesto en el marco de un equipo multidisciplinar. La habilidad quirúrgica en técnicas pediátricas o endoscópicas ginecológicas con frecuencia no sirve para mucho en un campo de conocimiento con problemática y condiciones diferenciadas. Este tipo de tentativas son simplificaciones injustas con una subespecialidad como la medicina maternofetal, que seguramente serían consideradas como injerencias inaceptables desde la perspectiva de cualquier otra especialidad, y que con frecuencia conducen al mal resultado, cuando no al desastre.
Como última consideración, para que existan más centros en el futuro es muy importante que aumente el nivel de diagnóstico prenatal y de información adecuada, que en este momento es todavía inferior al que presentan países de nuestro entorno. En este momento estimamos que se estaría ofreciendo terapia fetal a menos de la mitad de los casos diagnosticados en España, aunque ciertamente esta cifra ha crecido de forma importante en pocos años. Para mantener esta evolución es fundamental que el conocimiento y el diagnóstico de las patologías susceptibles se extiendan aún más y disponer de fuentes de información adecuadas es un componente fundamental en estos objetivos. Esperamos que esta revisión ayude a estos objetivos y pueda constituir una herramienta útil de trabajo para los miles de obstetras que, con grados variables de especialización, dedican parte de su tiempo a la medicina fetal en España y el mundo hispanoparlante.