INTRODUCCIÓN
Los tumores de células de Leydig del ovario son neoplasias poco frecuentes, que se incluyen dentro del grupo de los tumores de células esteroideas junto con el luteoma estromal y el tumor de células esteroideas no especificado1. Típicamente, el tumor de células de Leydig aparece en mujeres posmenopáusicas, con una media de edad de 58 años, y se asocian a un cuadro de hirsutismo y virilización en el 75% de los casos, con valores plasmáticos elevados de testosterona1. Desde el punto de vista histológico, el tumor de células de Leydig se clasifica en 2 grupos: tumores de células hiliares, que suponen el 80% de los casos, y tumores de células no hiliares2. Las células hiliares son morfológicamente idénticas a las células de Leydig del testículo, incluyendo la presencia de cristales de Reinke, cuya demostración se considera un requisito imprescindible para poder realizar el diagnóstico de tumor de células de Leydig.
En este artículo presentamos el caso de un tumor de células de Leydig en una mujer de 72 años asociado a un cuadro de virilización con elevación inusualmente alta de los valores de testosterona.
CASO CLÍNICO
Mujer de 72 años sin antecedentes ginecológicos ni personales de interés que acude al servicio de ginecología en marzo de 2003 remitida desde el servicio de endocrinología para estudio de un cuadro de virilización de 1 año de evolución, en el que se había descartado el origen suprarrenal. El cuadro clínico consistía en hirsutismo, hipertricosis y agravamiento de la voz, y se acompañaba de unos valores de testosterona plasmática de 12.038 pg/ml. Durante el estudio hormonal se observó que éste 448era el único andrógeno alterado, que progresivamente fue aumentando hasta alcanzar cifras por encima de 30.000 pg/ml.
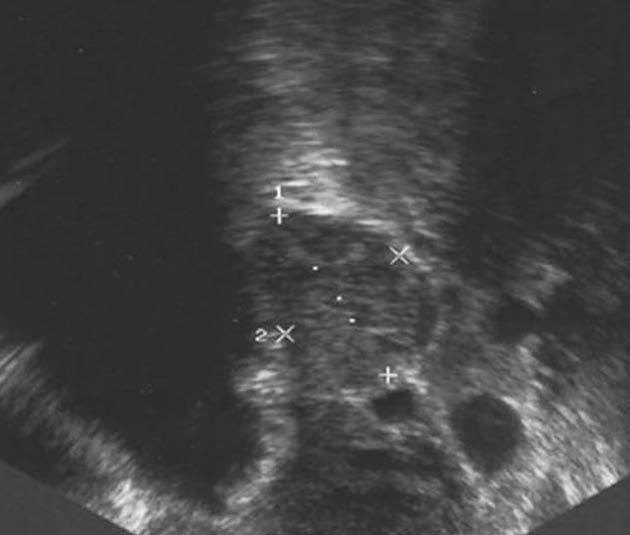
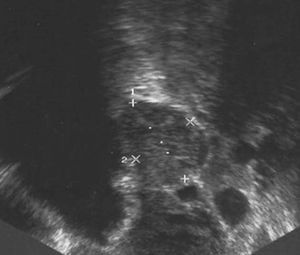
En la ecografía ginecológica se observó que la cavidad endometrial estaba ocupada por una formación heterogénea de 70 mm de diámetro máximo. El ovario derecho era normal y en el ovario izquierdo se apreció una dudosa tumoración de 10 mm de diámetro, ligeramente hipoecogénica (fig. 1). En abril de 2003 se realizó una histeroscopia en la que se observó una formación polipoidea de 7 * 6,5 cm, que se extirpó en el mismo acto. El diagnóstico anatomopatológico fue de pólipo endometrial. A continuación, se administró un análogo de la hormona liberadora de hormona luteinizante (LHRH) (Decapeptil 3,75) y se observó que la fuente productora de andrógenos era sensible éste. Seguidamente, se propuso a la paciente la realización de una histerectomía total con anexectomía bilateral asistida por laparoscopia que se llevó a cabo en mayo de 2003.
Figura 1. Tumoración de 10 mm, de características ligeramente hipoecogénicas, en el ovario izquierdo.
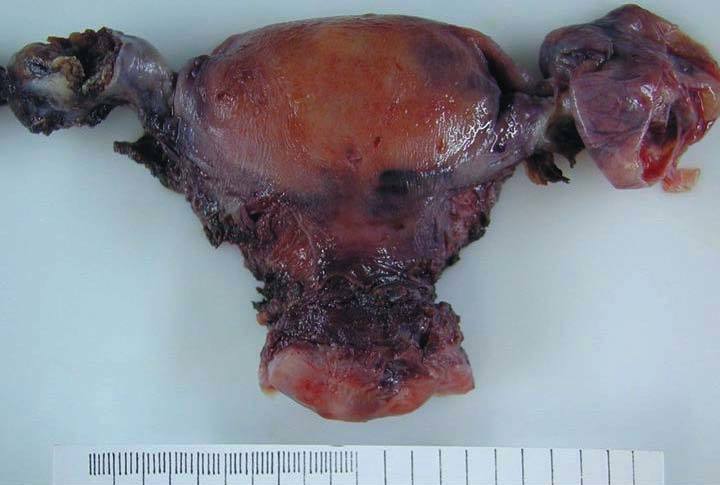
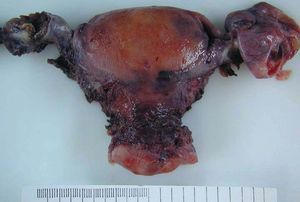
La pieza de histerectomía pesaba 154 g y tenía unas dimensiones de 8 * 7 * 4 cm. No se observaron alteraciones macroscópicas en la superficie serosa, en el cérvix ni el endometrio. El ovario izquierdo medía 3 * 2 cm y la sección mostraba un nódulo bien delimitado de coloración parda de 11 mm (fig. 2). El resto del aparato genital no presentaba alteraciones relevantes.
Figura 2. Aspecto macroscópico de la pieza de histerectomía y doble anexectomía (vista posterior). Se observa una tumoración irregular, parcialmente seccionada, en el ovario izquierdo. En el anejo derecho se reconoce un hidrosálpinx.
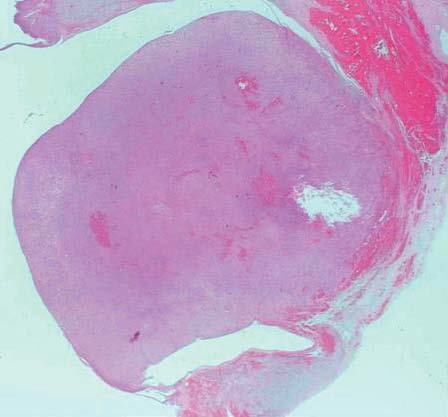
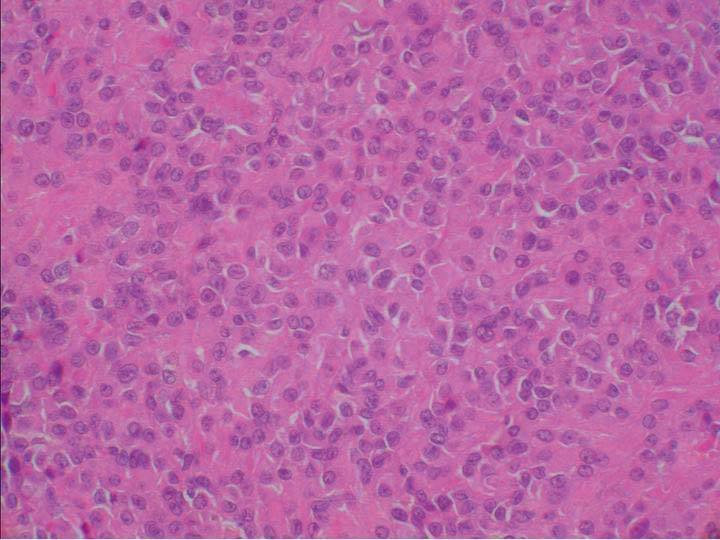
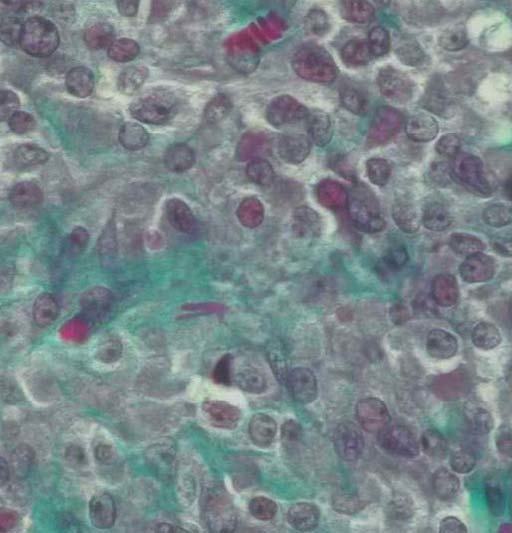
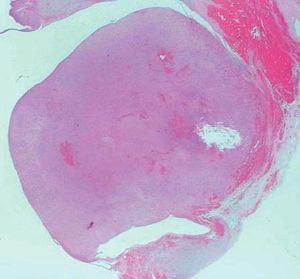
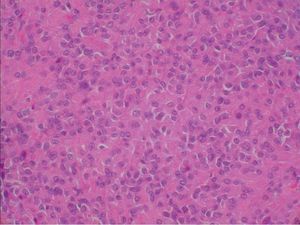
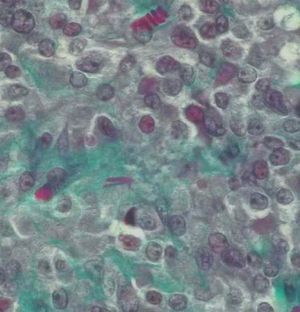
Microscópicamente, el nódulo descrito en el ovario correspondía a una tumoración formada por células de citoplasma eosinófilo, con bordes mal definidos y núcleo redondeado, con nucleolo ocasional, sin atipia significativa. No se observaron mitosis (figs. 3 y 4). Arquitecturalmente, las células tumorales se disponían de manera difusa. El tumor estaba muy vascularizado, a expensas de vasos de pequeño y mediano calibre que, ocasionalmente, mostraban hialinización de la pared. De forma ocasional, en el interior de las células tumorales, se observaron estructuras alargadas eosinófilas correspondientes a cristales de Reinke (fig. 5). El tumor estaba bien delimitado del parénquima ovárico adyacente por una seudocápsula fibrosa. Con técnicas de inmunohistoquímica, se observó inmunorreactividad citoplasmática intensa y difusa en las células tumorales frente a *-inhibina.
Figura 3. Tumoración redondeada, bien delimitada, de aspecto sólido, localizada en el hilio ovárico (hematoxilina-eosina).
Figura 4. Detalle de la tumoración: células de amplio citoplasma eosinófilo, con límites citoplasmáticos imprecisos, núcleo redondeado y ocasional nucleolo prominente (hematoxilina-eosina).
Figura 5. Detalle de las células tumorales a gran aumento en el que se observa la existencia de una estructura con forma de bastón en el interior del citoplasma, correspondiente a un cristal de Reinke (tricrómico de Masson).
Durante el seguimiento posterior, la paciente evolucionó favorablemente y se constató una normalización de los valores de testosterona, así como una remisión de su cuadro de virilización.
DISCUSIÓN
La producción excesiva de andrógenos en la mujer posmenopáusica puede deberse a distintos motivos, que pueden resumirse fundamentalmente en causas de etiología adrenal (hiperplasia, adenoma, carcinoma) y otras de etiología ovárica, entre las que se incluyen: a) tumores de los cordones sexuales-estroma, tumores de células esteroideas, tecomas luteinizantes, tumores de células de Sertoli-Leydig y tumores de células de la granulosa; b) tumores de células hiliares extraováricas; c) tumores ováricos primarios o secundarios con hiperplasia estromal reactiva, y d) hipertecosis estromal e hiperplasia de células hiliares3. Entre éstos, los tumores de células esteroideas suponen un 0,1% de los tumores ováricos y se dividen en 3 categorías: el luteoma estromal (20%), el tumor de células de Leydig (20%) y el tumor de células esteroideas sin otra especificidad (60%)1. El luteoma del estroma ovárico tiene su origen en la capacidad del estroma ovárico de desdiferenciarse hacia células luteínicas en casos de hipertecosis estromal, presente en un 92% de los casos. Se asocia a hiperplasia endometrial en un 88% de los casos, frecuencia que es mucho mayor en los otros 2 tumores pertenecientes a este grupo. Los tumores de células esteroideas sin otra especificidad corresponden, en la mayoría de los casos, a luteomas del estroma de gran tamaño o a tumores de células de Leydig en los que no pueden identificarse cristales de Reinke. Suelen aparecen en mujeres más jóvenes, y su tamaño es mayor que el del resto de tumores de esta categoría. Además, se asocian a manifestaciones clínicas de síndrome de Cushing en un 6% de los casos. El tumor de células de Leydig es el que con más frecuencia se presenta con síntomas de virilización (83%) y, a diferencia de los anteriores, no muestra elevación de los valores de estrógenos. Las principales características clinicopatológicas de los tumores de células esteroideas se resumen en la tabla 1.
El primer caso clínico de un tumor de células hiliares de ovario formado por células de Leydig fue publicado en 1942 por Berger4. Desde entonces, se han publicado al menos otros 100 casos más. La mayoría de estos tumores aparece en mujeres posmenopáusicas, entre los 50 y los 70 años. Los tumores de células hiliares son unilaterales en la gran mayoría de los casos. Se trata de tumores pequeños, con un diámetro medio de 2,4 cm, por lo que en la mayoría de los casos no se detectan clínicamente. Macroscópicamente, los tumores de células de Leydig presentan una coloración amarillenta o marrón anaranjada característica y suelen estar bien delimitados. Histológicamente, la identificación de cristales de Reinke por microscopia óptica o electrónica en el citoplasma de las células tumorales es necesaria para el diagnóstico.
Aunque suelen presentarse esporádicamente, los tumores de células de Leydig también se han descrito en asociación con cuadros de ovario poliquístico, disgenesia ovárica en el síndrome de Turner, tirotoxicosis, hipertensión diabetes y síndrome de Cushing4,5.
Desde el punto de vista endrocrinológico, el patrón de secreción de las hormonas estroideas en el tumor de células de Leydig es diferente del observado en el resto de los tumores de células esteroideas. Así, los tumores de células de Leydig producen principalmente testosterona y dihidrotestosterona; los valores de 17-cetosteroides en orina suelen ser normales o estar sólo ligeramente aumentados. Sin embargo, el resto de los tumores de células esteroideas secretan menores cantidades de testosterona y producen una elevación mayor de los valores de 17-cetosteroides en orina4.
Por tanto, ante un cuadro de virilización en una mujer posmenopáusica, y descartada la causa suprarrenal, debe sospecharse la existencia de un tumor ovárico. A continuación, es necesario realizar un detallado examen clínico, establecer su localización y evaluar las concentraciones plasmáticas de testosterona, andrógenos y 17-cetosteroides en orina. El tratamiento del tumor de células de Leydig consiste en una ooforectomía bilateral en pacientes posmenopáusicas. El endometrio debe evaluarse, particularmente si hay sangrado uterino, ya que, aunque infrecuente, se ha descrito la asociación de un tumor de células de Leydig con hiperplasia o adenocarcinoma del endometrio6. Clínicamente, prácticamente la totalidad de los tumores de células de Leydig muestran un comportamiento benigno.
En conclusión, los tumores de células de Leydig de ovario son raros y difíciles de diagnosticar preoperatoriamente por cirujanos y endocrinólogos. Aunque infrecuentes, debemos sospechar la existencia de este tumor en pacientes posmenopáusicas con cuadros de virilización.