La vacunación frente al virus del papiloma humano (VPH) es una estrategia preventiva primaria altamente eficaz y segura contra el cáncer de cuello de útero, pero no elimina la necesidad de seguir aplicando a las mujeres vacunadas un programa de prevención secundaria.
El uso clínico de la vacuna determinará un número apreciablemente menor de resultados citológicos anormales, expresión de la alta eficacia de la vacunación frente a la infección incidente por VPH. En consecuencia, se deberá usar una prueba muy sensible en primera línea del cribado en sustitución de la citología, con problemas de sensibilidad. La prueba de determinación del VPH es muy sensible, y cuando se usa en el grupo de edad adecuado (> 30 años) es muy específico.
El uso sinérgico de vacunación y cribado rediseñado se ha mostrado en los modelos de evaluación publicados como una estrategia altamente eficaz y muy eficiente.
The HPV vaccine is a primary preventive strategy against cervical cancer. It is highly effective and safe, but its implementation does not preclude the need to maintain a secondary prevention protocol for all vaccinated women.
The clinical use of the vaccine will lead to a noticeably lower number of abnormal smear reports, as a result of the vaccine's high efficacy against the HPV infection. Consequently, a higher sensitivity test needs to be applied as a first-line screening test, instead of Pap smears, with lower sensitivity.
The HPV test is highly sensitive, and when applied to the appropriate age group (30+), it is also very specific.
In the published evaluation models, the combined use of the vaccine and the redesigned screening test has been proved to offer high levels of efficacy and efficiency.
Está fuera de duda que debemos continuar con el cribado de cáncer de cuello de útero (CCU) en las poblaciones vacunadas frente al virus del papiloma humano (VPH). La relación coste-efectividad de la vacunación está estrechamente vinculada a su aplicación sinérgica con un programa de cribado modificado1. Esta conclusión se subrayó y asumió en el último Congreso de la International Papillomavirus Society2. En enero de 2008, el Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC) ha emitido una directiva3 en la que señala rotundamente que la necesidad del cribado para el CCU no debe eliminarse en las mujeres que hayan sido vacunadas frente al VPH.
En este artículo actualizamos los conocimientos relativos a este tema, con especial referencia la situación española.
NECESIDAD DE MANTENER EL CRIBADOLa vacuna bivalente (VB) ha demostrado, en una prolongación de análisis de seguimiento a 6,4 años de su ensayo clínico en fase II, una protección del 100% frente a neoplasias intraepiteliales de cérvix de grado II o superior (CIN-II+) causadas por los tipos vacunales de VPH 16 y 184. Los resultados del análisis interino a 14,8 meses de su fase III, los únicos comunicados, indican una eficacia del 90,4% frente al CINII/III causados por los tipos 16 y 18 del VPH5.
La vacuna tetravalente (VT) tiene documentada en el análisis combinado final de sus ensayos fase II/III6, con un seguimiento a 4 años, una eficacia del 100% frente a CIN-II, del 97% frente a CIN-III y del 100% frente a adenocarcinoma in situ (AIS), producidos por los tipos vacunales del VPH 6, 11, 16 y 18.
En protección cruzada, es decir, protección no prevista en los objetivos iniciales contemplados en el diseño de los ensayos frente a tipos filogenéticamente próximos a los vacunales, la VB ha mostrado protección a 5,5 años frente a la infección incidente por los tipos 31 (54%) y 45 (88%)7 y la VT ha incorporado ya a su nueva ficha técnica8 la protección frente a CIN-II/III y AIS por el tipo 31 (56%) y el conjunto de tipos 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 (23%) en un seguimiento a 4 años.
Debe precisarse que la protección cruzada, dada la baja prevalencia en CCU de los tipos implicados9, aumentaría la efectividad vacunal entre 3 y 5 puntos como máximo.
La altísima capacidad preventiva descrita representa, para el conjunto de los CCU, una potencia que debe situarse sobre el 70-75% del total, proporción atribuible de forma muy constante a los tipos 16 y 18 sobre el total de CCU. Efectivamente, hay una gran uniformidad9 en la distribución mundial de los tipos de VPH detectados en las biopsias de CCU10, distribución que puede consultarse en la tabla ;1. Informaciones recientes al respecto en Francia, la serie EDITH11, así lo confirman. En España, los datos disponibles sitúan las cifras algo por debajo, en el rango del 55-60% de CCU atribuibles a los tipos 16 y 1812.
Distribución de tipos de VPH en biopsias de cáncer invasor de cérvix
| Tipo de VPH | Distribución en cáncer de cérvix (%) |
| VPH 16 | 58,1 |
| VPH 18 | 15,7 |
| VPH 33 | 4,4 |
| VPH 31 | 4,0 |
| VPH 45 | 2,9 |
| VPH 35 | 1,6 |
| VPH 58 | 1,2 |
| VPH 56 1,0 Otros tipos de VPH | > 1% cada uno |
Modificada de Smith et al10.
Sabemos que la vacuna reduce mucho el riesgo de presentar un CCU, aunque que no lo elimina en su totalidad. Queda siempre una fracción de CCU no evitado por la vacuna (en términos generales, 1 de cada 4), por lo que será necesario seguir aplicando el cribado. Es necesario que este mensaje sea contundente: la mujer vacunada mal informada puede sentir una sensación de protección total y abandonar su adhesión a los programas preventivos secundarios de CC. Este riesgo ya se ha denunciado en la literatura científica y debe tenerse muy en cuenta13.
Entonces, mantenemos el cribado, pero ¿qué cribado?
CRIBADO EN LAS POBLACIONES VACUNADAS: RAZONES PARA UNA NUEVA ESTRATEGIAAmbas vacunas han demostrado una eficacia del 100% en la protección frente a la infección incidente por VPH5,14. En consecuencia, las cohortes vacunadas podrán empezar su programa de control más tarde. Iniciar los programas pronto, a edades muy tempranas, por debajo de los 25 años, incluso en poblaciones no vacunadas, incrementa mucho los diagnósticos de patologías irrelevantes en su mayoría (atipias inciertas, lesiones de bajo grado), con el consiguiente riesgo de sobrevaloración y sobretratamiento, y es, en consecuencia, muy ineficiente15.
La desaparición por el efecto protector vacunal de la mayor parte de las infecciones incidentes por el VPH comportará, en el plazo inmediato, un descenso de los resultados citológicos anómalos, expresión morfológica de la presencia viral. Esta reducción se ha establecido recientemente de una manera muy precisa para la vacuna tetravalente16:
- 1.
El 23% para atipias escamosas de significado incierto (ASCUS).
- 2.
El 35% para atipias escamosas inciertas, no se descarta lesión intraepitelial (ASCH).
- 3.
El 16% para lesión de bajo grado (LSIL).
- 4.
El 43% para lesión de alto grado (HSIL).
Estamos en condiciones de establecer la repercusión de estas cifras en España. Si consideramos que, según los datos del último censo registrado17, en España viven 14.222.389 mujeres, con edades comprendidas entre los 20 y los 64 años, y teniendo en cuenta los resultados del Estudio Afrodita18, una encuesta poblacional que describe las circunstancias epidemiológicas relacionadas con el CCU, que establece en un 75,6% la cobertura citológica para este grupo etario, puede concluirse que, en España, anualmente se practican unas 10.752.389 citologías de cuello de útero. Una encuesta entre laboratorios de citología de referencia españoles19 informó de que la tasa de resultados citológicos anómalos, que se emite según las diferentes categorías de resultados, es: ASCUS/AGC (atipias inciertas [AI]), 1,98%; LSIL, 1,20%, y HSIL, 0,3%.
Puede, en consecuencia, deducirse que en España se informan: AI, 212.897 casos/año; LSIL, 129.029 casos/año, y CHSIL, 32.257 casos/año.
Aplicando a este número de casos informados por año el potencial preventivo publicado de la VT16, puede afirmarse que en España su aplicación podría evitar anualmente: 61.740 casos de AI; 20.644 casos de LSIL, y 13.870 casos de HSIL.
Es muy sencillo suponer la enorme carga asistencial que para el sistema sanitario representa evaluar, a veces tratar y siempre controlar este volumen de citologías anormales. Todas estas mujeres entran en un proceso de control que genera nuevas visitas, con reiteración de citologías, determinaciones de VPH, colposcopias y eventuales biopsias, con un coste sumado, no fijado con precisión en nuestro país, pero que se ha estimado en unos 147 millones de euros20 para el conjunto de neoplasias intraepiteliales de cérvix. Además, y no es una razón de pequeña entidad, este es un proceso de resultado incierto, que crea una cierta ansiedad a la mujer e influye en su calidad de vida.
El escenario preventivo secundario que, en consecuencia, habrá generado la implantación de la vacuna contendrá un volumen menor de resultados anómalos citológicos. La citología es la técnica de cribado que hemos usado de forma continuada y universal. Sus resultados de aplicación en los países con estructuras preventivas bien organizadas han sido excelentes21, pero presenta serios problemas de reproducibilidad y sensibilidad.
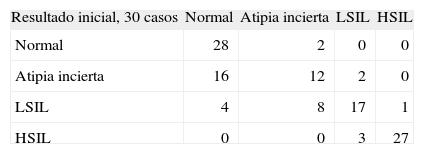
La citología es altamente dependiente del observador, hecho evidenciado en controles tanto inter como intraobservador. La experiencia propia así lo atestigua. En el laboratorio de citología que uno de los firmantes dirige (40.000 citologías/año) es práctica de calidad realizar cada diciembre un control intraobservador de una serie de 30 citologías informadas durante el año, con cada una de las grandes categorías de resultados. En la tabla ;2 puede comprobarse que, a menor atipia, peor reproducibilidad: de los 30 casos iniciales de AI, 16 se recalificaron a normales y 2 a LSIL; sin embargo, en el extremo opuesto del arco de categorías de resultados, 27 de 30 casos de HSIL se reconfirmaron, con 3 casos reinformados como LSIL.
Citología: reproducibilidad intraobservador
| Resultado inicial, 30 casos | Normal | Atipia incierta | LSIL | HSIL |
| Normal | 28 | 2 | 0 | 0 |
| Atipia incierta | 16 | 12 | 2 | 0 |
| LSIL | 4 | 8 | 17 | 1 |
| HSIL | 0 | 0 | 3 | 27 |
Laboratorio de Citología Dr. Cortés, Palma de Mallorca, Control de Calidad Intraobservador, 2007.
HSIL: lesión intraepitelial de alto grado; LSIL: lesión intraepitelial de bajo grado.
Corregir sus problemas de sensibilidad, bien documentados y que pueden consultarse en la tabla ;3, ha hecho necesaria una gran reiteración en su práctica. En consecuencia, los costes de la aplicación poblacional de la citología fueron, probablemente, muy altos y la eficiencia de los programas, muy baja, hecho que de forma histórica se ha estudiado insuficientemente.
Una técnica de cribado agrava sus déficit de sensibilidad cuando se aplica, como en el caso que nos ocupa, a la búsqueda de lesiones poco prevalentes, situación que requiere la utilización de una prueba muy sensible. La determinación del ADN del VPH lo es (tabla ;3); su problema radica en que necesita mejorarse su especificidad. Para el conjunto de la población, la prevalencia del VPH mantiene una curva muy consistente para todas las poblaciones estudiadas22: una alta tasa de adquisición al inicio de las relaciones sexuales, intenso aclarado de la presencia viral en los años inmediatos y una configuración posterior —siempre a partir de los 30–35 años— de una fracción de entre el 3 y el 10% de la población general portadora crónica del VPH. La especificidad general de la determinación de ADN/ VPH está penalizada por su alta prevalencia, intrascendente en el primer tercio de la vida. Si lo usamos a partir de los 30–35 años, con las presencias virales pasajeras desaparecidas, identificaremos a las portadoras crónicas del virus, mujeres a las que este hallazgo sitúa realmente en una posición de riesgo para desarrollar CCU. Un riesgo que las últimas informaciones vinculan a los tipos 16, muy especialmente, y 18 del VPH25. Una mujer VPH positiva frente al tipo 16 presenta un riesgo acumulado del orden del 20% de desarrollar CIN-III a los 10 años; si es positiva al tipo 18, del 17%, y si lo es para cualquiera de los otros tipos de riesgo alto, del 1%.
La prueba de determinación de ADNA/VPH, si se usa a partir de la edad adecuada y probablemente con tipificación 16/18 incorporada, tiene en consecuencia el perfil adecuado para usarse como prueba inicial de cribado en las cohortes vacunadas. Podría asumirse, por tanto, que la edad pertinente de inicio del cribado debe situarse en los 30 años26, pero ¿podemos incorporar simultáneamente un espaciamiento de los controles preventivos? Probablemente sí, y con un margen muy alto de seguridad y eficiencia27. Hay datos recientes en la literatura científica que van fijando la amplitud de los intervalos, dotándoles de la necesaria seguridad. Con una metodología que contemple un control cada 3 años, y a pesar de que un número indeterminado, probablemente bajo, de mujeres contraerán inevitablemente tipos de riesgo alto de VPH durante el intervalo, el proceso para desarrollar CIN-III es lo bastante largo como para hacer posible su detección en la siguiente vuelta del programa28. La tasa de incidencia acumulada consistentemente baja de CIN-II+en mujeres negativas frente al VPH al inicio del control conduce a la conclusión de que una estrategia de cribado con la prueba de VPH cada 6 años es segura y efectiva29.
Tomando todo lo expuesto en consideración, el grupo de trabajo español que se formó con motivo del I Foro Español sobre vacuna VPH, celebrado en Sevilla el 12 de junio de 200830, formuló una propuesta de modificación de la estrategia de cribado que se debe aplicar en las cohortes de mujeres vacunadas y que queda reflejada en la figura ;1: inicio a los 30 años, uso de la prueba de VPH en primera línea, citología para los casos positivos; con citología de HSIL o superior, colposcopia; con citología con resultado de atipia incierta o LSIL, tipificación de VPH: hallazgo de 16 o 18, colposcopia; hallazgo de otros tipos de AR, control doble prueba al año (citología y determinación de VPH). Las mujeres con resultado negativo en la prueba frente al VPH serían controladas cada 5 años. Dada la prevalencia estimada del VPH en España para la población así controlada, no menos del 95% del total pasarían a control quinquenal, dato muy que se debe tener en cuenta a la hora de estimar el coste/beneficio de este algoritmo. Además, una estrategia de cribado como la propuesta, basada en la determinación del VPH, reportaría un beneficio añadido en forma de vigilancia epidemiológica de la población, en relación con la prevalencia del VPH y con las posibles pero improbables fluctuaciones en las tasas de presencia de los diferentes tipos de VPH en las cohortes vacunadas31.
Pero en España no sólo habría que reconsiderar las técnicas y los algoritmos de cribado. En el mencionado I Foro Español sobre VPH, se estudió en profundidad la situación del cribado de CCU en España. Hubo 2 conclusiones especialmente relevantes: la primera, que con las excepciones de los nuevos programas de Castilla-León y Cataluña, los programas aplicados por las diferentes Comunidades Autónomas son de base oportunista, a veces con pequeñas correcciones, y la segunda, que la actividad de los laboratorios de citología españoles es muy desigual, sin ningún programa de control de calidad.
Está claramente establecido que la actividad preventiva oportunista es ineficaz e ineficiente32, hasta el punto de que el Consejo de la Unión Europea acaba de recomendar a sus Estados miembros que, para romper la inequidad detectada en el acceso a los programas preventivos de cáncer creada por la actividad oportunista, se reconduzca a criterios de cribado poblacional33.
Como resultado de esta inadecuada actividad preventiva, la incidencia de CCU en España se ha mantenido constante en un período de 15 años, entre 1983 y 1997, sin ningún cambio de tendencia en el período estudiado para el conjunto de la población. La ausencia de reducción del riesgo de CCU en España significa que el cribado en estas mujeres no ha sido efectivo.
Además, cuando en España se estudia la tendencia relacionada con la edad de la paciente, se ha observado un aumento en la incidencia del CCU en las mujeres nacidas entre 1930 y 1940, con una media de incremento anual del 1%, aunque no significativo (intervalo de confianza [IC] del 95%, -1,8 a 4,2), con una fuerte tendencia consolidada al alza de la incidencia de CCU en mujeres de menos de 35 años. Este incremento será probablemente más elevado cuando estas mujeres alcancen las edades en las que la expresión de esta enfermedad es máxima.
Es obvio que únicamente con programas poblacionales se alcanza coberturas que obtengan un impacto sobre las tasas de mortalidad. El ejemplo ampliamente utilizado de lo ocurrido en el Reino Unido se ha refrendado recientemente por la experiencia mexicana: descenso de la mortalidad asociado a coberturas altas en el conjunto de la población34.
El trabajo de Lazcano-Ponce et al34 aporta otra información de la máxima importancia: la centralización y el control de calidad de los laboratorios de citología mexicanos se tradujo en una implementación decisiva del impacto reductor del programa sobre la mortalidad por CCU. Esta es una acción que el mencionado I Foro Español reclamó emprender en España con la máxima prioridad.
INTERACCIÓN DE LA VACUNA VPH/ CRIBADO: EFICIENCIA PARA ESPAÑALa Organización Mundial de la Salud ha publicado una norma35 por la que define que las intervenciones con ratio de coste-efectividad (coste por año de vida salvado) inferior al producto interior bruto per cápita (PIB-C) del país involucrado deben considerarse muy eficientes.
En los países en desarrollo, el coste de la vacuna es la variable básicamente vinculada a la eficiencia de su aplicación. El objetivo ineludible es alcanzar altas coberturas, superiores al 70%. La eficiencia se implementa de forma decisiva combinando la vacunación con un cribado que utilice la prueba de determinación del VPH en primera línea. Un análisis de eficiencia de un modelo mixto vacunación/cribado aplicado en India en estas condiciones llegó a la conclusión de que con un coste por dosis de 2 I$, la combinación de vacuna con 3 controles de cribado citológico durante la vida produciría una reducción de riesgo de presentar CCU del 56%. Si se combina con dos controles realizados con la prueba de determinación de VPH, la reducción sería del 63%. El coste por año de vida salvado se situaría muy por debajo del PIB-C del país: 3.452 I$36.
Está en duda que el impacto sobre la mortalidad por CCU obtenido mediante el cribado en los países desarrollados pueda reproducirse en los países en desarrollo, con grandes problemas de cobertura (19% de media) y abandono de las mujeres mayores y pobres. Para expandir el cribado se debe contar con sistemas de salud eficaces e infraestructuras adecuadas, algo muy difícil de conseguir en estos países, por lo que parece que la vacunación sería la alternativa más adecuada37.
En EE. UU. y en Francia 2 publicaciones38,39 recientes concluyen que la aplicación en salud pública de la vacunación frente al VPH es altamente costeefectiva, especialmente incentivada la vacuna tetravalente por la protección generada de forma temprana y robusta frente a las verrugas genitales, como se comprueba en varios análisis de primer nivel que han explorado su eficiencia en el Reino Unido40 y en EE. UU.41,42.
En España, el PIB-C se situó, en 2007, en 23.396 €, un poco por debajo de la media europea, 24.700 €43. El PIB-C en España presenta ciertas diferencias territoriales. La mejor situación la disfrutan 7 Comunidades Autónomas, con PIB-C por encima de la media: desde el País Vasco, primero, con 30.599 € hasta La Rioja, con 24.717 €. Entre ellas, la Comunidad de Madrid, la Comunidad Foral de Navarra, Cataluña, Aragón y las Islas Baleares. El peor PIB-C español corresponde a Andalucía (18.298 €) y Extremadura (16.080 €).
En este escenario, 2 estudios de reciente publicación han evaluado la eficiencia de la aplicación de la VT en España. No hay datos disponibles relativos al coste/beneficio de la aplicación española de la VB.
En el primero44, se ha efectuado un análisis de coste-efectividad mediante un modelo de Markov. Se ha supuesto la vacunación de una cohorte de niñas de 11 años a la que se ha seguido hasta cumplir 100 años y los resultados se han comparado con una cohorte no vacunada. La vacunación ha evitado 656 casos de CCU y 310 muertes, ganando un total de 11.132 años de vida, con un coste adicional frente a la no vacunación de 63 millones de euros. Para evitar un CCU habría que vacunar a 308 mujeres; para evitar una muerte por CCU, a 653.
El coste por año de vida salvado en la rama de pacientes vacunadas se ha calculado en 5.688,39 €, con un coste de efectividad incremental de 5.646,55 €, en total 11.333 €.
En el segundo45 se ha adaptado al contexto español un modelo de Markov de la historia natural de la infección por VPH, que incluía vacunación y cribado. Esta estrategia (vacunación más cribado) se comparó con la administrada a una cohorte de niñas de 11 años con cobertura del 80% con los sistemas de cribado actuales. El coste incremental por año de vida ganado y por año de vida ganado ajustado por calidad fue en España de 8.657 € y de 6.493 €, respectivamente. Los análisis de sensibilidad demostraron que este coste-efectividad es estable.
En ambos estudios, uno sin tomar en consideración la sinergia con el cribado y el otro haciéndolo, los costes por año de vida salvado se sitúan perfectamente por debajo del peor PIB-C español, 16.080 €.
La conclusión obvia es que la aplicación de la VT en España debe considerarse en términos de salud pública como una intervención sanitaria muy eficiente. Una conclusión asociada de estos estudios es que la vacunación en España frente al CCU con la vacuna tetravalente presenta un beneficio clínico y social superior a la mayoría de las intervenciones terapéuticas del Sistema Nacional de Salud, incluidos los tratamientos de determinadas enfermedades crónicas, con costes farmacológicos totales muy superiores a los de esta vacuna. La tabla ;4 recoge de forma comparativa la eficiencia de algunas intervenciones preventivas aplicadas en España.
Gardasi®: eficiencia comparada
| Intervención | Coste por año de vida salvado |
| Cribado cáncer de mama* | 5.531 € |
| Gardasil® más cribado de cáncer de cérvix | 8.657 € |
| Tratamiento antihipertensivo: hidroclorotiazida (75mg/día) en mujeres de 40 a 49 años* | 13.639 € |
| THS en mujeres>50 años* | 15.965 € |
| Prevención accidentes cardiovasculares: lovastatina (20mg/día) en varones de 45 a 49 años y colesterol>300mg/dl* | 29.777 € |
THS: tratamiento hormonal sustitutivo.
Trabajo realizado con los auspicios de la Fundación Santiago Dexeus Font.