Introducción
El tratamiento periodontal regenerador comprende diversos métodos terapéuticos concebidos específicamente para posibilitar la neoformación predecible de estructuras del aparato periodontal (cemento radicular, ligamento periodontal y hueso alveolar)5,49. Es cierto que con el tratamiento periodontal convencional, quirúrgico o no, se consigue una reducción de la profundidad de sondaje y una ganancia de inserción clínica, pero histológicamente la curación se caracteriza en la mayoría de los casos por la formación de un epitelio largo de unión y por una regeneración no predecible, es decir, no se produce una restitución completa del hueso alveolar, del cemento radicular ni del ligamento periodontal5.
La gran cantidad de materiales disponibles en el mercado y la complejidad de los defectos periodontales hacen que no siempre sea fácil para el odontólogo elegir el material más adecuado o la mejor combinación de distintos materiales regeneradores. Por otro lado, los resultados de algunos estudios clínicos muestran que ciertos factores como la selección de los pacientes y de los defectos por tratar, la elección de la técnica quirúrgica y el tratamiento postquirúrgico influyen de forma decisiva en los resultados7-9,11,12,14,15,23,27,44,45,47. El objetivo de este trabajo es presentar los conceptos clínicos del tratamiento periodontal regenerador.
Selección de las técnicas y materiales regeneradores
El éxito de un tratamiento periodontal regenerador depende de las técnicas y materiales utilizados. La selección del material regenerador debería regirse por principios biológicos consolidados, es decir, se debe disponer de una evidencia biológica e histológica sólida de todos los materiales utilizados en el tratamiento regenerador.
Materiales de sustitución ósea
Hasta el momento la regeneración periodontal sólo se ha podido demostrar con un número muy reducido de materiales de sustitución ósea. Así, se ha confirmado que la implantación de hueso autólogo, de hueso liofilizado desmineralizado y de un mineral óseo natural de origen bovino puede dar lugar a una regeneración periodontal2,4,13,25,38,42. La curación después de la implantación de materiales de sustitución ósea sintéticos, como hidroxiapatita, beta-fosfato tricálcico (β-TCP), polímeros o cristales bioactivos, estuvo caracterizada principalmente por un epitelio largo de unión y por un encapsulamiento de las partículas con tejido conjuntivo. Por consiguiente es de suponer que los éxitos clínicos obtenidos después de la implantación de la mayoría de los materiales de sustitución ósea (disminución de la profundidad de sondaje y ganancia de inserción clínica) sólo suponen una regeneración periodontal real en casos aislados y en general se trataba de un cierre del defecto con un material sintético. Con frecuencia las partículas del material son encapsuladas por tejido conjuntivo, y a lo largo de la superficie radicular se forma un epitelio largo de unión18,29,32,39,41,43.
El odontólogo debería ser consciente de que los parámetros clínicos y radiológicos no necesariamente representan un proceso de regeneración demostrable histológicamente5,46. Por otro lado, todavía no se ha aclarado el mecanismo por el que un material de sustitución ósea influye en la regeneración periodontal. Se asume que las funciones más importantes de un material de sustitución ósea son estabilizar el coágulo y evitar que se produzca un colapso del colgajo31,37,49. Si se va a utilizar un material de sustitución ósea en el tratamiento periodontal regenerador, su elección debería realizarse en función de criterios biológicos. Es decir, conviene seleccionar materiales cuya capacidad para promover la regeneración periodontal ha sido demostrada en estudios histológicos.
Regeneración tisular guiada
El principio de la «Guided tissue regeneration» o regeneración tisular guiada (RTG) se basa en aislar las células de desarrollo lento del ligamento periodontal y del hueso alveolar de las células del epitelio y del tejido conjuntivo circundante y en la estabilización del coágulo por medio de una barrera mecánica19,22,49. Se ha demostrado que después de la aplicación de técnicas de RTG con membranas de politetrafluoretileno expandido (PTFE-e) se puede lograr la formación clara de una nueva inserción de tejido conjuntivo y hueso alveolar19,22. Otros estudios han revelado que los resultados dependen en gran medida de la proporción de ligamento periodontal remanente, de la morfología del defecto, de la técnica quirúrgica y de la infección bacteriana7,8,11,12,14,19,22,23,27,40,45.
El tratamiento con RTG y utilización de membranas de PTFE-e suele dar lugar a una ganancia de inserción y de hueso nuevo. Una complicación frecuente en la aplicación de membranas de PTFE-e no reabsorbibles es la exposición de la membrana. En función del grado de exposición puede ser necesario retirar la membrana para evitar infecciones. Cuanto menos tiempo ha permanecido la membrana in situ, menor es el grado de regeneración (permanencia recomendada: de 6 a 8 semanas). Otro inconveniente de las membranas de PTFE-e no reabsorbibles es la necesidad de realizar una segunda intervención quirúrgica para retirar la membrana. Además, existe el riesgo de traumatizar el tejido neoformado bajo la membrana y de afectar negativamente al resultado del tratamiento.
Para evitar estos riesgos se han intentado desarrollar membranas biorreabsorbibles con unas propiedades de barrera comparables a las de las membranas de PTFE-e no reabsorbibles. Los resultados de estudios clínicos y de estudios con animales de experimentación permiten concluir que con las membranas reabsorbibles se pueden obtener ganancias de inserción de tejido conjuntivo y de hueso neoformado similares a las obtenidas con las membranas de PTFE-e no reabsorbibles3,6,10,16. Las membranas reabsorbibles se componen de biomateriales naturales o sintéticos. El biomaterial natural utilizado es colágeno de tipo I y III de origen animal (bovino o porcino) o humano (duramadre). El periodo de reabsorción va de cuatro semanas a seis meses. Algunos estudios histológicos han demostrado que por medio del tratamiento con RTG y utilización de membranas, reabsorbibles o no, se puede lograr una regeneración periodontal19,34,35.
Proteínas de la matriz del esmalte
El concepto biológico de las proteínas de la matriz del esmalte se basa en la asunción de que las proteínas que contiene la matriz del esmalte (principalmente la amelogenina) influyen de forma decisiva en la cementogénesis y en la cicatrización periodontal (liberando factores de crecimiento de los fibroblastos periodontales e impidiendo una proliferación epitelial)1. De acuerdo con los resultados de diversos estudios histológicos en humanos y en animales, la cirugía regeneradora con proteínas de la matriz del esmalte promueve la regeneración periodontal1,20,26,33-35,50. Según los últimos datos disponibles, los resultados de la cirugía regeneradora con proteínas de la matriz del esmalte se pueden mantener durante un periodo de hasta 10 años36.
Combinación de varios tratamientos
De acuerdo con los resultados de diversos estudios clínicos experimentales la proporción de la regeneración depende en gran medida del espacio libre que se encuentra bajo el colgajo mucoperióstico19,22,31,37,45,49. Un colapso del colgajo mucoperióstico podría limitar el espacio necesario para el proceso de regeneración y afectar negativamente al resultado del tratamiento19,22,31,37,45,49. Para eludir estos inconvenientes se empezaron a combinar varios tratamientos. Los resultados de algunos estudios clínicos y preclínicos demostraron que la combinación de tratamientos ofrecía más ventajas que la instauración de un solo tratamiento en los defectos sin soporte (como los defectos amplios y supraalveolares o los defectos con ausencia de paredes óseas), en los que es probable que se produzca un colapso del colgajo mucoperióstico. Según dichos estudios en defectos extensos parece ser recomendable combinar materiales de relleno y membranas30,31,37,49. Las membranas reabsorbibles se colapsan en el defecto y limitarían notablemente el espacio por regenerar si se utilizaran sin materiales de relleno. Las proteínas de la matriz del esmalte tampoco pueden evitar el colapso del colgajo mucoperióstico debido a su consistencia gelatinosa24,48,51.
Diversos estudios histológicos demostraron una regeneración periodontal después del tratamiento de defectos periodontales con algunas de estas combinaciones4,38,39 (fig. 1). Los datos aportados por diversos estudios clínicos y preclínicos y por un artículo de revisión sistemática publicado recientemente muestran que combinando materiales de sustitución ósea y RTG o materiales de sustitución ósea y proteínas de la matriz del esmalte se puede lograr un cierre más adecuado del defecto y una mayor ganancia de inserción clínica que con materiales de sustitución ósea, RTG o proteínas de la matriz del esmalte solos4,24,30,31,37,48,51. No obstante, en otros estudios la combinación de tratamientos no aportó ninguna ventaja frente a la instauración de un solo tratamiento21. A pesar de que actualmente no se puede dictaminar inequívocamente en qué medida mejora los resultados la combinación de varios materiales regeneradores, algunos datos apuntan a que este método de tratamiento sólo ofrece ventajas en determinados tipos de defectos31,37 (defectos sin soporte).
Figura 1. Curación después del tratamiento de un defecto intraóseo humano con una combinación de proteínas de la matriz del esmalte y vidrio bioactivo. La curación se caracteriza por la neoformación de cemento y ligamento periodontal. Las partículas están rodeadas por hueso neoformado (tinción de hematoxilina-eosina, 25 aumentos).
Conceptos para la aplicación de técnicas y materiales regeneradores
Lograr una buena regeneración de tejido en defectos óseos periodontales pasa por cumplir cuatro condiciones fundamentales:
1. Eliminar las toxinas de la superficie radicular (mediante instrumentación mecánica).
2. Crear el espacio suficiente para posibilitar la migración coronal de células progenitoras sobre la superficie radicular (por medio de materiales de relleno y/o membranas).
3. Estabilizar la herida quirúrgica para proteger el coágulo de fibrina, de gran importancia para la regeneración (utilizando membranas o membranas y materiales de relleno, además de técnicas de sutura adecuadas).
4. Cicatrización por primera intención mediante un cierre de la herida completo y sin tensiones (técnica de sutura adecuada).
Factores que influyen en el resultado clínico
Para lograr resultados predecibles antes de iniciar cualquier tratamiento regenerador es imprescindible establecer de forma precisa la indicación tanto por lo que respecta al paciente como en relación con el defecto.
El paciente
Según los resultados de algunos estudios clínicos, el tabaquismo y una higiene oral deficiente van asociados a un resultado mucho peor del tratamiento periodontal regenerador7,9,12. La infección residual periodontal constituye otro aspecto importante. Antes de las medidas terapéuticas de regeneración periodontal se debe instaurar siempre un tratamiento antiinfeccioso no quirúrgico de la periodontitis. A pesar de que no existe una evidencia clara en este sentido, en la selección del paciente se recomienda tener en cuenta factores como la diabetes mellitus, la limitación del campo de trabajo y la fortaleza psicológica del paciente.
El defecto
A pesar de que los defectos óseos poco profundos tienen la misma capacidad de regeneración que los defectos más profundos, se observaron ganancias de inserción mayores en los defectos cuya profundidad superaba los 3 mm. Por otro lado, cuantas más paredes óseas limiten el defecto, más se incrementará su capacidad de regeneración. Así, el pronóstico de los defectos óseos de tres paredes es más favorable que el de defectos con una o dos paredes. Cuando en la radiografía el ángulo formado por la pared del defecto y el eje dentario es menor de 25º (defectos angostos y profundos), la ganancia de inserción es una media de 1,5 mm mayor que en defectos cuyo ángulo supera los 37º12,15,23,40,47 (defectos anchos y poco profundos). En tratamientos con membranas el grosor del tejido que cubre el defecto desempeña un papel importante. En algunos trabajos se demostró que un grosor del tejido inferior a 1 mm iba asociado a una mayor prevalencia de exposición de la membrana.
Incisión y diseño del colgajo
La conservación del tejido interdental desempeña un papel clave para conseguir el cierre completo de la herida quirúrgica. Dado que esto es prácticamente imposible cuando se levantan colgajos de acceso «normales» (access flap), se han desarrollado técnicas quirúrgicas a colgajo especiales. Los colgajos de preservación de papila modificados y simplificados se desarrollaron inicialmente para el tratamiento regenerador con membranas, si bien también deberían encontrar aplicación en el tratamiento con proteínas de la matriz del esmalte8,11,14,27,44.
Técnicas de sutura
Se distingue entre las suturas de retención y las suturas de cierre. El cometido de la sutura de retención es absorber la tensión del colgajo para poder practicar una sutura de cierre sin tensión. Éste es un requisito indispensable en la regeneración con membranas, dado que si la herida se ha cerrado con tensión, la exposición de la membrana es inevitable. Es conveniente esperar algo más de 15 días a retirar los puntos de sutura, puesto que de lo contrario se puede desestabilizar la herida. Los excelentes resultados obtenidos con GoreTex en diversos estudios clínicos hacen que sea el material de sutura de elección en la cirugía regeneradora. Dicho material mostró una colonización bacteriana muy reducida12,49. En caso de utilizar otros materiales de sutura se deberán emplear hilos monofilamento, dado que presentan una colonización bacteriana tan reducida como la sutura de GoreTex.
Protocolo postquirúrgico
El objetivo de los cuidados postquirúrgicos es evitar que la herida se infecte y que se produzcan traumatismos mecánicos. El protocolo postquirúrgico deberá incluir necesariamente un control químico de la placa en forma de enjuagues bucales en la zona intervenida dos (si es necesario, tres) veces al día con una solución de clorhexidina (al 0,2% o al 0,12%). No existen evidencias de que la administración sistémica de antibióticos durante más de una semana proporcione mejores resultados, pero puede estar indicada en casos concretos. Después del tratamiento con proteínas de la matriz del esmalte debe interrumpirse el cepillado dental en la zona intervenida durante cuatro semanas. Tras el tratamiento con membranas no reabsorbibles no se realizará la higiene oral durante cuatro a seis semanas, hasta que sean retiradas. Si se utilizan membranas reabsorbibles está indicada una interrupción de la higiene oral durante seis semanas. Durante el lapso de tiempo en el que la higiene oral en el hogar está contraindicada, deberá citarse al paciente una vez a la semana para realizar una limpieza dental profesional supragingival. Otro aspecto importante es evitar el sondaje periodontal en la zona que ha recibido el tratamiento regenerador durante al menos seis meses.
Estrategias terapéuticas para defectos intraóseos
Se presentan a continuación algunas estrategias terapéuticas basadas en los trabajos de Froum et al17 y de Cortellini y Tonetti12 que pueden ser de utilidad para el odontólogo en la toma de decisiones a la hora de afrontar el tratamiento de defectos óseos periodontales.
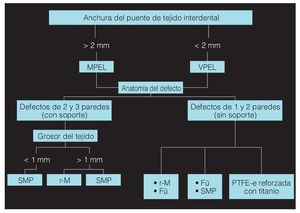
La elección del colgajo de acceso debe regirse por la anchura del puente de tejido interdental y por la localización del defecto. Si el defecto se encuentra en el sector anterior y el tejido interdental tiene una anchura superior a los 2 mm, se levantará un colgajo de preservación de papila modificado. Pero si la anchura del tejido interdental es inferior a 2 mm o el defecto se encuentra en el sector posterior, deberá optarse por el colgajo de preservación de papila simplificado. El procedimiento que seguir irá en función de la anatomía del defecto. Los defectos óseos de dos y de tres paredes con zonas anatómicas de soporte se pueden tratar con proteínas de la matriz del esmalte o con membranas (reabsorbibles o no). Si el grosor del tejido es inferior a 1 mm, se optará por un tratamiento con proteínas de la matriz del esmalte, dado que en tales casos el riesgo de que se produzca una exposición de la membrana es mayor. Los defectos óseos de una y de dos paredes sin zonas anatómicas de soporte se pueden tratar combinando un material de relleno y proteínas de la matriz del esmalte (figs. 2a a 2d) o con membranas (preferiblemente reabsorbibles) (fig. 3). El uso de membranas no reabsorbibles reforzadas con titanio puede dar buenos resultados clínicos, pero está asociado a una gran cantidad de complicaciones postoperatorias, como la exposición de la membrana y dehiscencias.
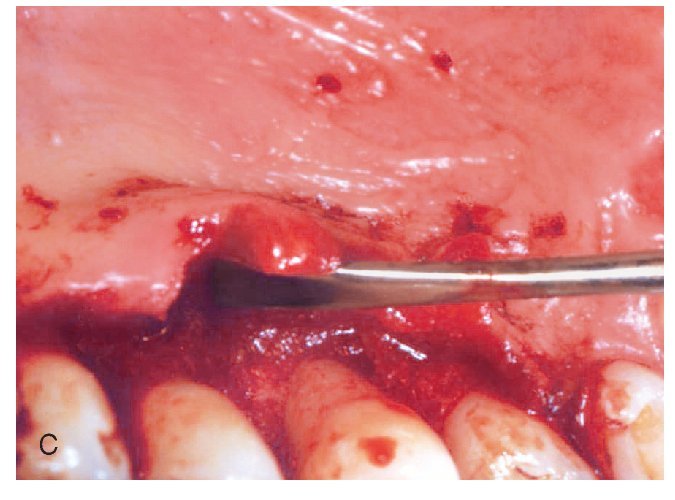
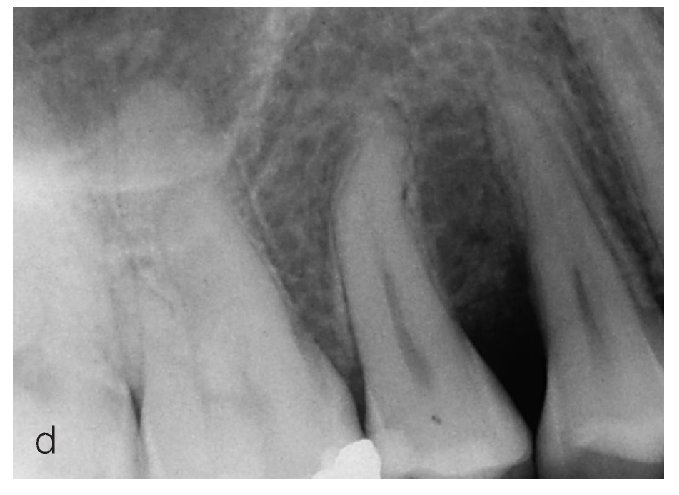
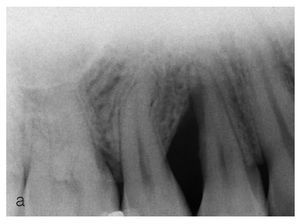
Figuras 2a a 2d. Tratamiento de un defecto óseo con una mezcla de proteínas de la matriz del esmalte y vidrio bioactivo.
Figura 2a. En la radiografía preoperatoria se observa la presencia de una bolsa infraósea profunda.
Figura 2b. Vista palatina del defecto. Se observa un defecto óseo cóncavo ancho.
Figura 2c. Cierre del defecto con una mezcla de proteínas de la matriz del esmalte y vidrio bioactivo.
Figura 2d. Radiografía realizada a los doce meses. Se aprecia claramente el cierre del componente infraóseo del defecto.
Figura 3. Diagrama sobre la estrategia de tratamiento (Fü: material de relleno; MPEL: colgajo de preservación de papila modificado; PTFE-e: membrana GoreTex; r-M: membrana reabsorbible; SMP: proteínas de la matriz del esmalte; VPEL: colgajo de preservación de papila vertical).
Métodos de tratamiento de la afectación de furca
Los defectos de grado II localizados en la mandíbula constituyen la indicación principal del tratamiento con RTG de la afectación de furca. En el maxilar sólo se pueden tratar con técnicas regeneradoras de forma predecible defectos a nivel de furca de grado II vestibulares28. En humanos todavía no se ha observado una regeneración de defectos de grado III ni en el maxilar ni en la mandíbula. En defectos a nivel de furca de grado I la ganancia de inserción es tan reducida que no justifica en absoluto la gran inversión que supone un tratamiento regenerador. En general se puede decir que el cierre completo de una afectación de furca de grado II se puede lograr, si bien con resultados no predecibles. No obstante, algunos estudios que comparaban la RTG con la cirugía a colgajo mostraron que el tratamiento con RTG de defectos a nivel de furca de grado II en la mandíbula permitía lograr una ganancia significativamente mayor de inserción clínica que con la cirugía a colgajo sola28. Por otro lado, en el tratamiento de la afectación de furca se han descrito resultados más favorables con la utilización de membranas de polímeros y PTFE-e. Si se instauran técnicas de RTG en el tratamiento de defectos a nivel de furca se debería combinar la utilización de una membrana con la aplicación complementaria de materiales de relleno. Parece que combinar las técnicas de RTG con materiales de relleno es más eficaz para el tratamiento de defectos de clase II que la utilización exclusiva de proteínas de la matriz del esmalte (fig. 3).
Complicaciones
Las complicaciones más frecuentes surgen en el tratamiento con membranas no reabsorbibles como consecuencia de la exposición de la membrana. Gracias a la utilización de colgajos de preservación de papila modificados y simplificados y a la aplicación de membranas reabsorbibles se ha podido disminuir notablemente el número de casos en los que se produce exposición de la membrana. Si la membrana queda expuesta, no se podrá evitar su contaminación bacteriana. Como consecuencia, en función del grado de exposición, en muchos casos no queda otro remedio que extraer la membrana cuando no es reabsorbible. Dado que la extracción de las membranas reabsorbibles es mucho más compleja, se puede intentar en primer lugar instaurar un tratamiento (antiséptico) con gel de clorhexidina y colutorios y limpiar la porción perforada con un cepillo de dientes blando o con una bolita de algodón. Pero en cualquier caso una exposición de la membrana tiene como consecuencia una menor ganancia de inserción. Otras complicaciones postoperatorias, como tumefacciones, enrojecimiento o supuración, se pueden tratar de forma eficaz mediante una profilaxis antiinfecciosa estricta (limpieza dental profesional, posible administración sistémica de antibióticos).
Correspondencia: Anton Sculean.
Freiburgstrasse 7, CH-3010 Berna, Suiza.
Correo electrónico: anton.sculean@zmk.unibe.ch
Nicole B. Arweiler.
Hugstetter Straße 55, 79106 Friburgo, Alemania.