La dificultad de diagnosticar un liquen plano
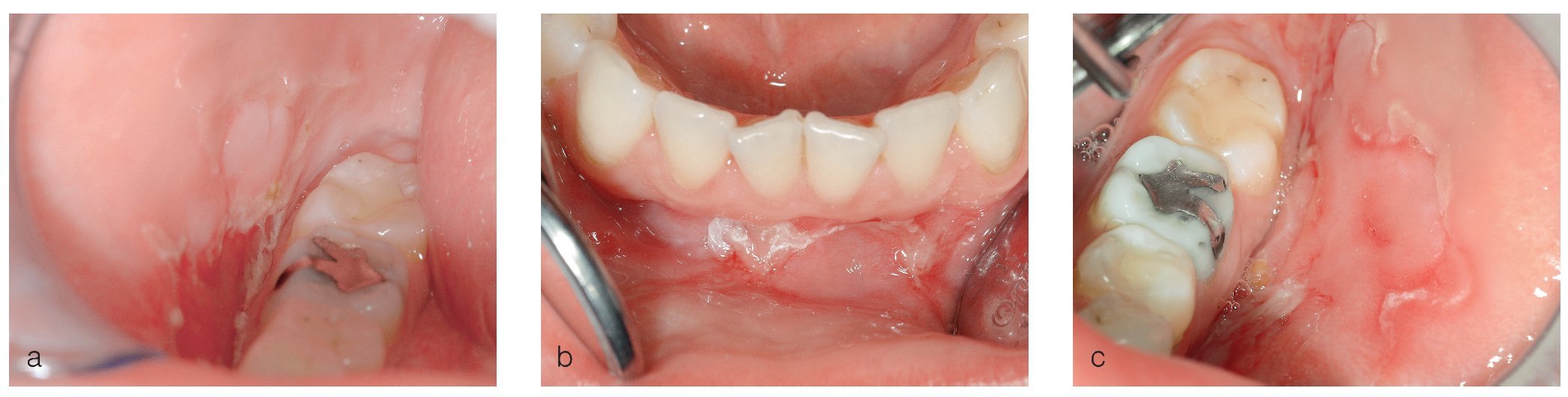
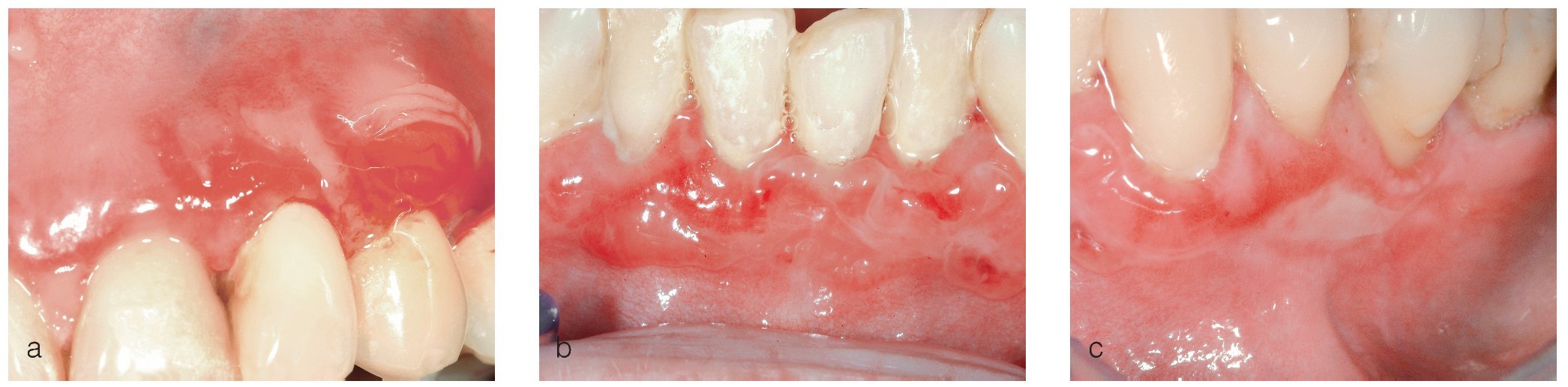
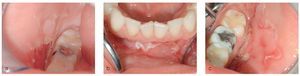
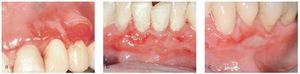
En general, el diagnóstico del liquen plano oral (LPO) es clínico e histopatológico. A pesar de que un LPO con una trama reticular marcada, afectación simétrica de la mucosa oral y un exantema cutáneo manifiesto concomitante, puede conformar un cuadro patognomónico, se recomienda obtener una muestra de mucosa oral para confirmar el diagnóstico y para descartar una posible displasia epitelial. Se debe hacer el diagnóstico diferencial sobre todo con reacciones liquenoides, leucoplasias orales, lupus eritematoso y con todo el espectro de enfermedades ampollosas autoinmunes. Entre estas últimas hay que pensar principalmente en el pénfigo vulgar (figs. 1a a 1c) y, en presencia de lesiones atróficas (eritematosas) de la encía queratinizada, en el penfigoide benigno de mucosas (figs. 2a a 2c). Otro posible proceso que descartar es el penfigoide paraneoplásico en caso de una afectación extensa de la mucosa oral y de los labios resistente al tratamiento7.
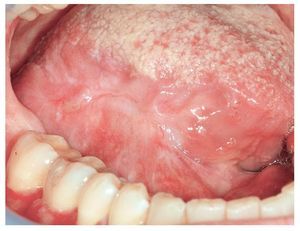
Figuras 1a a 1c. Paciente de 23 años con descamaciones epiteliales en la mucosa yugal de ambos lados (a y c) y en el vestíbulo mandibular (b). Las lesiones aparecieron de forma aguda un mes antes y se habían extendido progresivamente a toda la cavidad oral. La paciente refiere sobre todo una sensación de ardor. El examen histopatológico y la inmunofluorescencia directa (IFD) reveló un pénfigo vulgar.
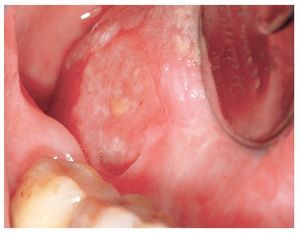
Figuras 2a a 2c. Paciente de 59 años con lesiones vesiculares muy dolorosas en la mucosa queratinizada del maxilar y de la mandíbula. Se pueden generar vesículas mediante fricción y una jeringa de aire (signo de Nikolski positivo; a y b). En las zonas en las que se han abierto las vesículas, se observan áreas erosivas, cubiertas de fibrina (c).
La variabilidad a la hora de establecer el diagnóstico de un mismo examinador y también entre distintos examinadores al evaluar un LPO en función de signos clínicos y características histopatológicas es un problema importante, no resuelto por ahora, que dificulta considerablemente la comparación de estudios clínicos. Diversas investigaciones llevadas a cabo en los Países Bajos pusieron de manifiesto esta situación32,33,36. Este grupo de autores reclamó como solución la definición de criterios diagnósticos de la OMS modificados y más estrictos para el LPO que permitieran establecer diagnósticos en el futuro de forma más reproducible36. La tabla 1 muestra características y signos clínicos e histopatológicos típicos con los que se pretende facilitar al médico un diagnóstico inequívoco del LPO.
En casos dudosos y, sobre todo, para descartar otras enfermedades ampollosas autoinmunes, se recomienda realizar un análisis de inmunofluorescencia directa e indirecta y determinar la presencia de autoanticuerpos mediante ELISA (por ejemplo, desmogleína 3 o BP180/ BPAG2). Algunos centros ofrecen además técnicas de inmunoelectrotransferencia.
Atención y tratamiento de los pacientes con LPO
En general, el paciente con LPO asintomático no precisa tratamiento. En los casos que proceda, se pueden eliminar factores irritantes locales, como cantos agudos de restauraciones (fenómeno de Köbner = reacción isomórfica). El paciente debe recibir, en primer lugar, una información detallada de su enfermedad, en el marco de la que se hará hincapié sobre todo en el carácter crónico del LPO. Se deben explicar también las distintas presentaciones clínicas y la posibilidad de una evolución a una forma sintomática6.
En el LPO sintomático, el tratamiento varía en función de la gravedad de la sintomatología. Por ahora, no se dispone de ningún tratamiento curativo, dado que la etiología del LPO es desconocida. Conviene tener en cuenta los aspectos siguientes:
* Medidas generales: se recomienda eliminar los factores irritantes locales y optimizar la higiene oral antes de iniciar un tratamiento farmacológico, ya que a veces estas medidas son suficientes para mejorar la sintomatología15. Además, en la anamnesis se deberían buscar signos y síntomas de hepatitis y descartar posibles reacciones liquenoides por medicamentos («oral lichenoid drug reactions»1). Se recomienda interrumpir la administración de los medicamentos causantes, previo acuerdo con el médico responsable del tratamiento, y buscar una alternativa adecuada si fuera necesario.
* Tratamiento: para el tratamiento farmacológico se da preferencia al uso de corticosteroides (habitualmente en forma de pasta adhesiva o gel tópico)4,5,9.
La evaluación y el seguimiento de los pacientes con OLP pertenecen, por principio, a un ámbito multidisciplinario del que también debería formar parte un dermatólogo experimentado. En la Clínica de Cirugía Oral y Estomatología de la Universidad de Berna se recomienda para el tratamiento del LPO sintomático triamcinolona en una base adhesiva (0,1%, Kenacort A Orabase, 3-4 veces al día durante 1-2 semanas sobre las lesiones sintomáticas) o fluocinonida en gel (0,05%, Topsyn, 3-4 veces al día durante 1-2 semanas). Si este tratamiento no proporciona la respuesta deseada, se pueden utilizar corticosteroides más potentes, como clobetasol o betametasona, durante un período de tiempo corto. El uso tópico de corticosteroides a largo plazo no es recomendable, dado que no todos carecen de efectos sistémicos y, además, se puede favorecer la aparición de una candidiasis oral.
En las lesiones ulcerosas crónicas localizadas del OLP se utilizan ocasionalmente inyecciones intralesionales de corticosteroides (en general, 10 mg de triamcinolona en suspensión cristalina mezclados con una solución de lidocaína al 2%), que en determinados casos hay que repetir 2 a 3 veces. Se obtuvieron también resultados prometedores con inhibidores de la calcineurina tópicos, entre los cuales destacan tacrolimus y pimecrolimus, que se emplean en forma de crema, pomada o enjuagues20,23.
Se ha descrito como alternativa la aplicación tópica de rapamicina, un inmunosupresor con estructura de macrólido, que posee simultáneamente un efecto inmunosupresor y un efecto antitumoral31. Estas propiedades son especialmente favorables en el LPO por considerarse una lesión precancerosa.
En los cursos evolutivos tórpidos o en la afectación orogenital u orocutánea se administran también corticosteroides sistémicos, en un primer momento a dosis altas (prednisona 40-60 mg/día), pero posteriormente a dosis decrecientes5. En los casos resistentes al tratamiento, se puede añadir acitretina (análogo aromático sintético del ácido retinoico, 10 mg/día) a dosis bajas, después de haber descartado previamente una hepatopatía, una hipercolesterolemia y un embarazo. Por ello, se debe extremar la precaución en las mujeres jóvenes, dado que durante el tratamiento y durante un período de hasta
2 años (¡!) las pacientes no deben quedarse embarazadas (efecto teratogénico).
Los inmunomoduladores, también denominados fármacos biológicos, son muy eficaces en determinadas enfermedades inflamatorias. Se puede considerar su uso especialmente en casos en los que ha fracasado el resto de los tratamientos. Entre estos fármacos hay que resaltar los antagonistas del TNF-α y efalizumab28. Sin embargo, estas sustancias son relativamente caras y actualmente sólo se pueden prescribir en el marco de un 'uso no contemplado'. En un caso clínico publicado recientemente se administró con buenos resultados rituximab (un anticuerpo monoclonal anti-CD20 que se utiliza en numerosas enfermedades mediadas por el sistema inmunitario) para tratar un liquen erosivo de localización oral y esofágica29.
El problema de la transformación maligna
La posible transformación maligna del LPO ha sido objeto de numerosos debates controvertidos en el pasado. Algunos estudios prospectivos16,30 y estudios retrospectivos2,5,19,21,26,38 se han ocupado de esta problemática y han comunicado tasas de transformación maligna que oscilan entre el 0% y el 9% de las lesiones de LPO (figs. 3a a 3c y figs. 4a a 4c). Esta gran variabilidad parece deberse a que se han establecido diagnósticos iniciales de LPO sin disponer de un estudio histopatológico, a la aparición de carcinomas de células escamosas orales (CCEo) sin tener en cuenta la localización anatómica de la lesión inicial o sin considerar otros factores de riesgo carcinogénicos17.
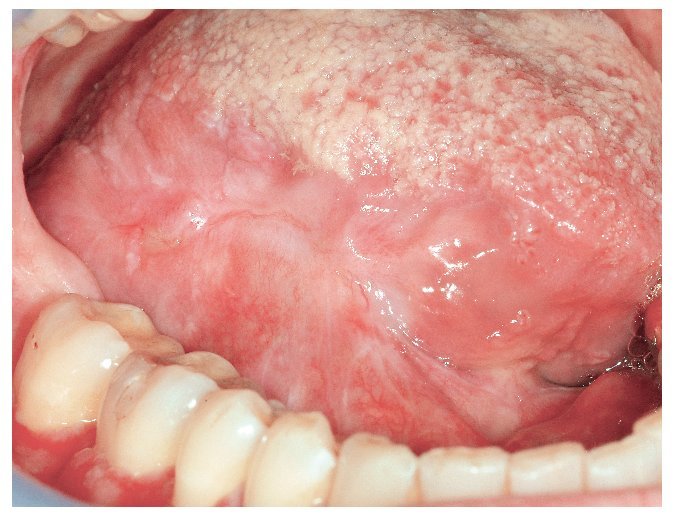
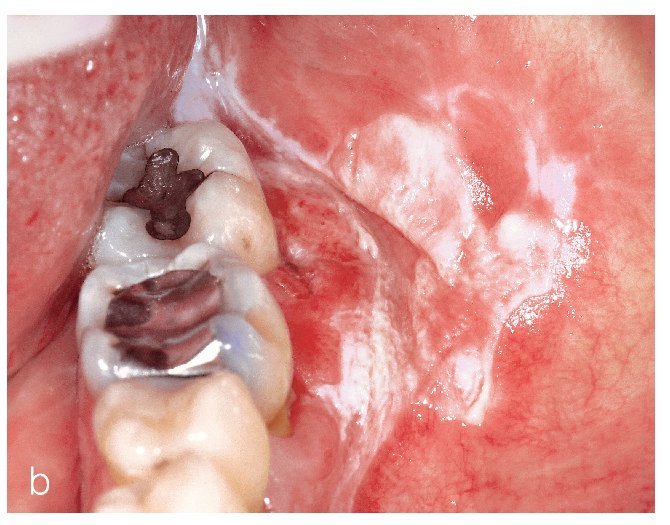
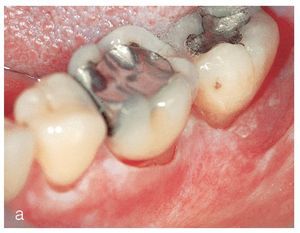
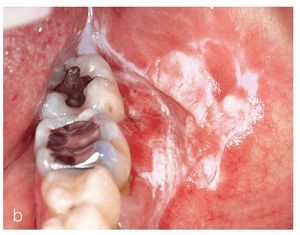
Figura 3a. Paciente de 61 años con liquen plano oral diagnosticado. En una revisión de rutina se observó una úlcera cubierta de fibrina en el borde derecho de la lengua, delimitada en algunos tramos por unas lesiones blanquecinas. Los resultados de la biopsia mostraron un carcinoma de células escamosas de la cavidad oral con aspecto liquenoide en algunas zonas.
Figura 3b. La paciente de la figura 3a: visita de control 4 meses después del diagnóstico de carcinoma de células escamosas en el borde derecho de la lengua. Estado posterior a la extirpación tumoral y a la radioterapia local.
Figura 3c. La paciente de las figuras 3a y 3b: visita de control 18 meses después del diagnóstico de carcinoma de células escamosas en el borde derecho de la lengua. Se observa una úlcera indurada extensa en la parte posterior del borde lingual. La biopsia efectuada muestra una recidiva del carcinoma de células escamosas.
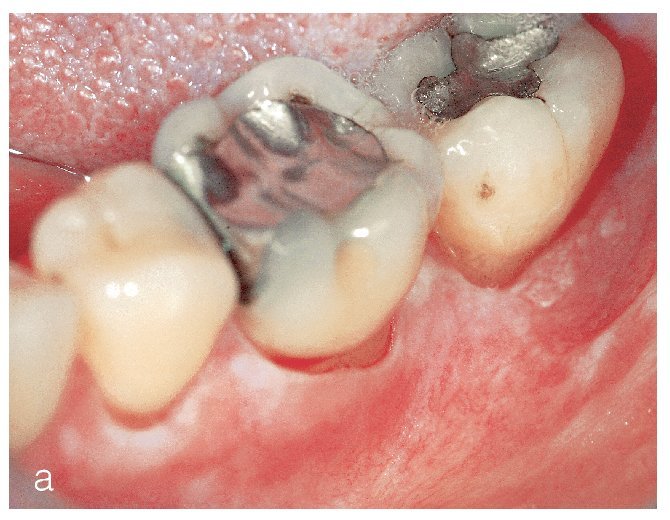
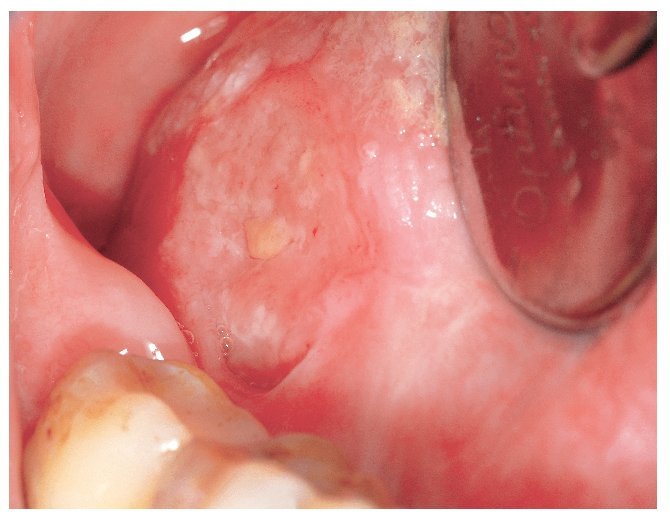
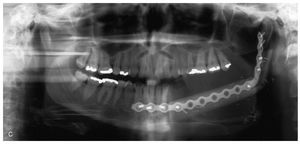
Figura 4a. Liquen plano oral en una paciente de 41 años. Durante la primera visita, se observaron lesiones blancas atróficas, pero también algunas lesiones en placas, en la encía vestibular de la mandíbula izquierda.
Figura 4b. La paciente de la figura 4a: visita de control 2 años después de la primera exploración. Además de la trama reticular característica del LPO en la mucosa yugal izquierda, se observa una zona leucoplásica irregular en la encía vestibular de los dientes 36 y 37 hacia el vestíbulo. Los resultados de la biopsia mostraron un carcinoma de células escamosas.
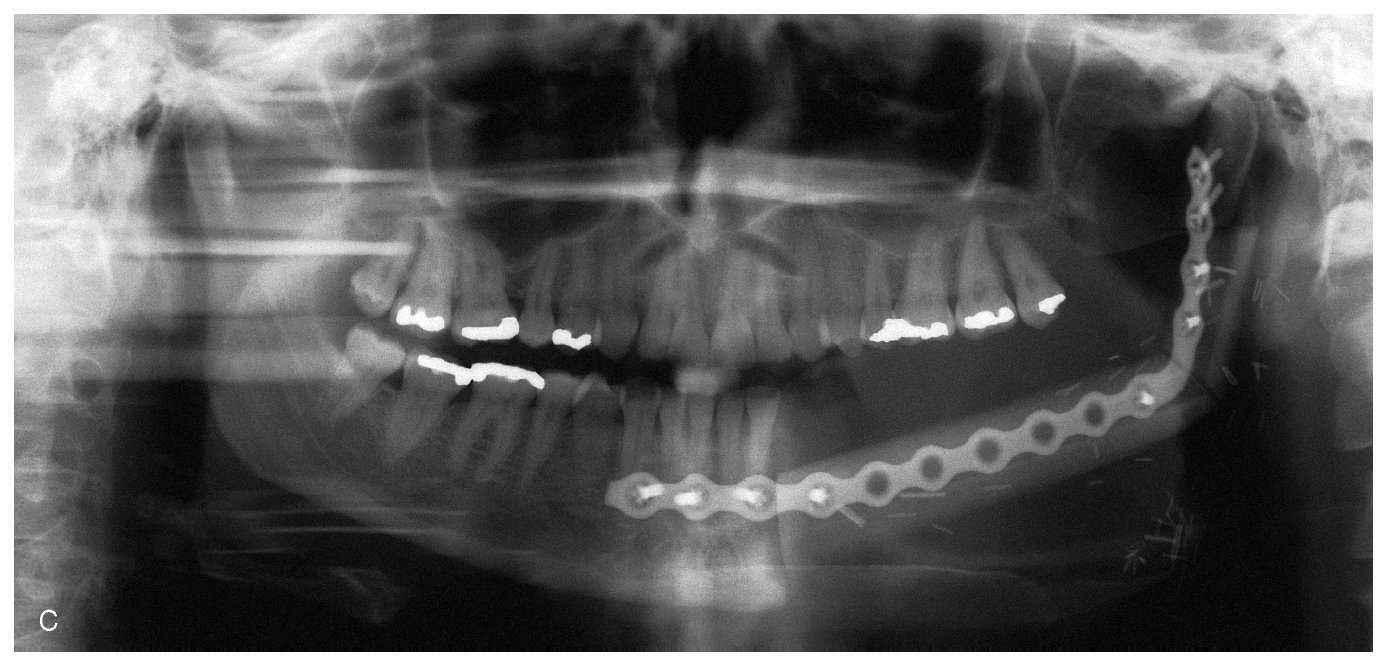
Figura 4c. La paciente de las figuras 4a y 4b: radiografía panorámica postoperatoria después del tratamiento quirúrgico del carcinoma con resección de la mandíbula desde la región del 33 hasta las apófisis condílea y coronoides, y sustitución con un injerto de peroné revascularizado utilizando técnicas microquirúrgicas.
Un aspecto frecuentemente criticado de algunos estudios que comunicaron un aumento significativo de la incidencia de CCEo a partir de una lesión de LPO fue que no se había asegurado adecuadamente el diagnóstico inicial de LPO. Los críticos de estos estudios insisten en que el diagnóstico de LPO se estableció sin el cumplimiento de criterios diagnósticos estrictos12,17,18.
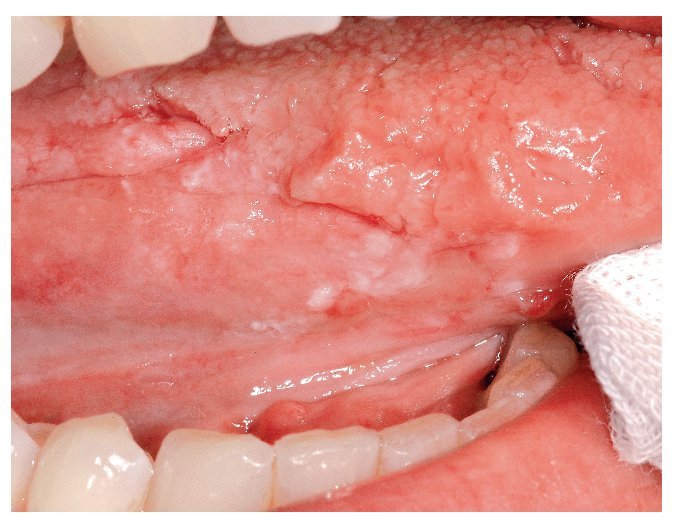
Todavía no se presta la atención debida al hecho de que la lesión clásica del LPO presenta, en principio, una citomorfología, maduración y arquitectura del epitelio normales13. Por lo tanto, según estos autores, queda descartado el LPO en presencia de una estructura epitelial que difiera histológicamente de la estructura normal12,13,18 (figs. 5a a 5d). Krutchkoff et al18 calificaron estas lesiones de «displasias liquenoides» (DL). Otros autores subrayaron la importancia de la valoración clínica para establecer la hipótesis diagnóstica y criticaron la práctica de establecer el diagnóstico únicamente en función del examen histológico con microscopia óptica por aportar una información insuficiente11,30. Epstein et al14 recalcaron que el término DL define una «entidad» que se basa exclusivamente en exámenes histopatológicos del tejido obtenido en las inmediaciones de los lugares biopsiados.
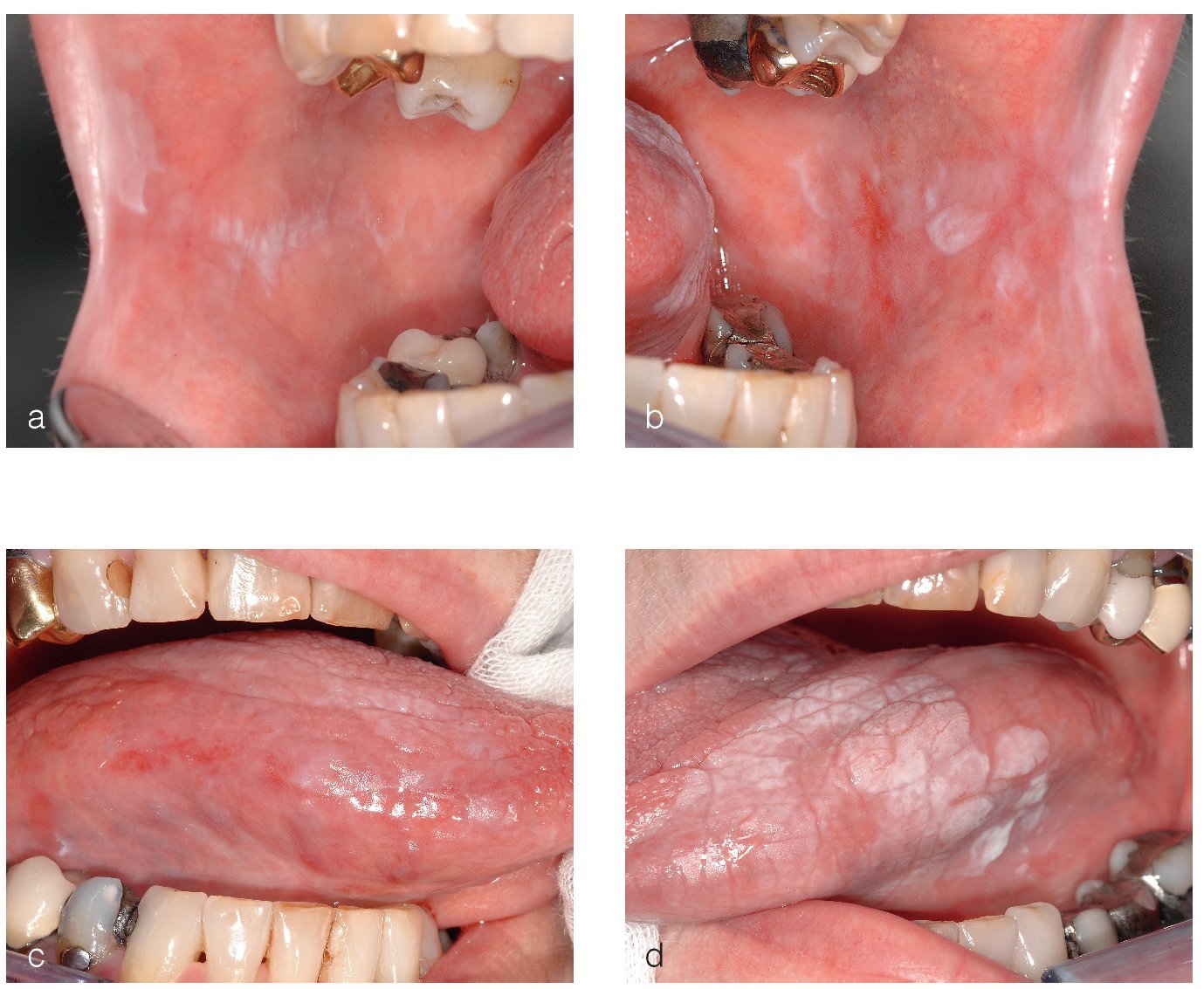
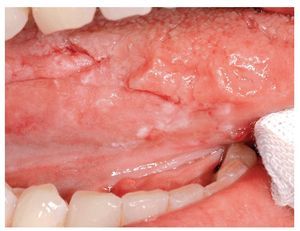
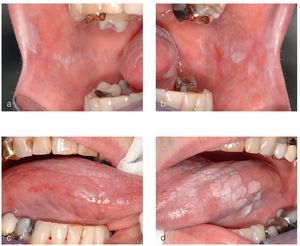
Figuras 5a a 5d. Paciente de 75 años con un liquen plano oral (LPO) confirmado histológicamente: se observan lesiones reticulares, atróficas y erosivas de LPO en la mucosa yugal (a y b) y en el borde derecho de la lengua (c). En el borde izquierdo de la lengua (d) destaca una lesión en placa, plana en su parte anterior y ligeramente sobreelevada hacia la parte posterior. La biopsia efectuada en la parte anterior reveló la existencia de un LPO clásico, mientras que los resultados de la biopsia de la parte posterior mostraron una lesión liquenoide con una displasia epitelial leve a moderada. Cabe preguntarse si es lícito seguir calificando esta lesión de liquen plano.
En un estudio prospectivo de los Países Bajos que hizo una distinción estricta entre LPO y reacción liquenoide (exclusión de lesiones con displasia epitelial del grupo con LPO) se demostró la presencia de un CCEo en tres de 173 pacientes35. Curiosamente, todos los casos de transformación maligna aparecieron en el grupo de las reacciones liquenoides orales. Esto llevó a los autores a concluir que las reacciones liquenoides orales son lesiones precancerosas, mientras que en los pacientes con LPO no se logró demostrar un aumento del riesgo de transformación maligna.
Actualmente se acumulan las referencias a un incremento de la aparición de CCEo a partir de lesiones de LPO en presencia de otros factores de riesgo22 (como el tabaquismo o la diabetes). Se ha propuesto que las transformaciones malignas asociadas al LPO en pacientes con factores de riesgo como el consumo abusivo de tabaco y alcohol se relacionen más con el factor de riesgo carcinogénico correspondiente que con el LPO17,34. La bibliografía no ha aportado por ahora datos vinculantes acerca de las repercusiones de otros factores de riesgo carcinogénicos, como la malnutrición o las infecciones crónicas por Candida albicans en relación con el LPO22. Tampoco se ha podido confirmar la importancia de la hepatitis C27 ni de la diabetes mellitus10 como factores de riesgo potenciales para una transformación maligna del LPO. En el pasado se había mencionado la hepatitis C como posible factor etiológico del LPO, lo que sin embargo ha sido puesto en duda por distintas publicaciones recientes3,8,9.
El seguimiento de los pacientes con LPO
Es interesante comprobar que en la bibliografía no se encuentran datos que sugieren que un programa de citas de revisión intensivo en pacientes con LPO disminuye la morbimortalidad de los CCEo secundarios a un LPO25.
No obstante, parece más que razonable instaurar un programa de citas de revisión periódicas, dado que el LPO es una enfermedad crónica con fases de exacerbación y fases de remisión. Además, se considera que el LPO es una lesión precancerosa5.
Los pacientes asintomáticos pueden ser sometidos a revisiones anuales. En pacientes sintomáticos se recomiendan revisiones a intervalos de 3 a 4 meses7. Con este intervalo más corto entre revisiones se pretende optimizar la higiene oral, realizar el control evolutivo de posibles tratamientos farmacológicos y detectar precozmente zonas de mucosa de aspecto irregular. No es excepcional que en pacientes con LPO sintomático se efectúen biopsias de repetición de las zonas de mucosa afectadas para el diagnóstico precoz de posibles displasias. La biopsia con cepillo combinada con la citometría de ADN es una técnica no invasiva que complementa eficazmente el examen histopatológico clásico24.
Conclusiones
El LPO es una mucodermatosis crónica frecuente de etiología desconocida. Las lesiones pueden aparecer en la piel, la mucosa oral y la zona genital. En la cavidad oral dan lugar a alteraciones mucosas asintomáticas (habitualmente lesiones reticulares, papulares o en placas) o sintomáticas (lesiones atróficas, ampollosas o erosivoulcerosas). El tratamiento consiste en la aplicación tópica de corticosteroides y, sólo en casos graves, se recurre a la administración de fármacos por vía sistémica. Se recomienda un tratamiento interdisciplinar en colaboración con un dermatólogo en los casos en que exista afectación cutánea o genital. Se recomiendan citas de revisión frecuentes debido al carácter precanceroso del LPO. La frecuencia de las revisiones se establecerá en función de la sintomatología de cada paciente.
Correspondencia: P.A. Reichart.
Clínica de Cirugía Oral y Estomatología. Clínicas Odontológicas de la Universidad de Berna. Freiburgstraße 7, CH-3010 Berna, Suiza.
Correo electrónico: michael.bornstein@zmk.unibe.ch
H. Beltraminelli.
Clínica Universitaria de Dermatología. Inselspital Berna. Freiburgstrasse Eingang 14 A-D, CH-3010 Berna, Suiza.