Farmacología de los antibióticos
Definición del término
Desde un punto de vista lingüístico se debería dar preferencia a la expresión «fármacos antiinfecciosos» para designar al grupo terapéutico conocido habitualmente por el término antibióticos. Un argumento más a favor es que el término antibiótico no ha sido utilizado nunca en sentido literal, sino que sirvió originalmente para distinguir a los fármacos antiinfecciosos de origen biológico (penicilina como producto del hongo Penicillium notatum) de aquellos obtenidos mediante síntesis química (sulfonamidas). Los fármacos antiinfecciosos incluyen, además de las sustancias con actividad antimicrobiana, los antimicóticos, los virostáticos y los desinfectantes. En adelante se utilizará el término antibiótico como sinónimo de «sustancias con actividad antimicrobiana» y, por consiguiente, el artículo se centrará exclusivamente en este grupo de sustancias.
Relación triangular: principio activo antimicrobiano-bacteria-ser humano
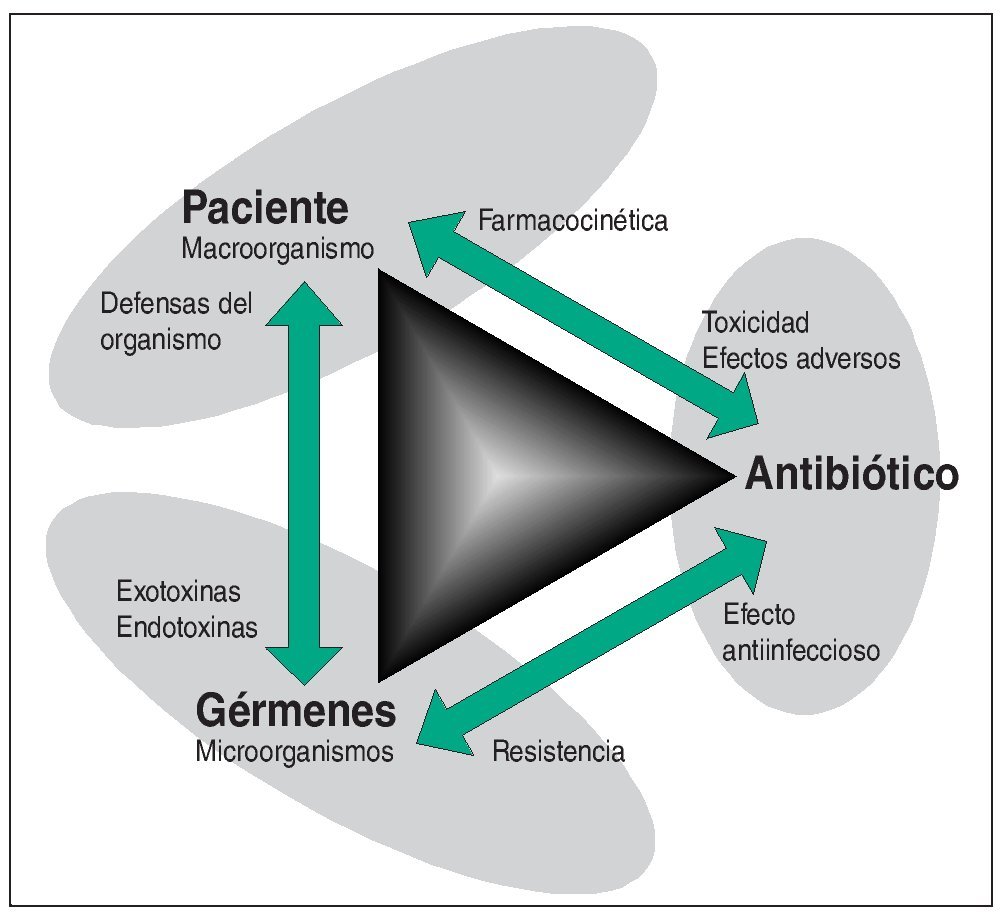
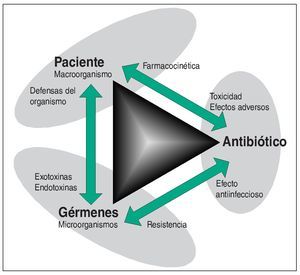
Los antibióticos ocupan una posición privilegiada entre la multitud de grupos de sustancias farmacológicas. Los representantes de otros grupos de principios activos farmacológicos influyen en alguna estructura o función del organismo humano, mientras que la acción de los antibióticos va dirigida a los microorganismos. Para el antibiótico ideal, el organismo humano constituye únicamente el espacio físico de acción. Toda acción del antibiótico sobre una estructura del macroorganismo constituye un efecto adverso. Dado que los antibióticos aprobados se hallan más o menos alejados de la condición ideal de actuar exclusivamente sobre los microorganismos, la evaluación de un antibiótico se basa en la siguiente relación triangular: principio activo-macroorganismo-microorganismo (fig. 1).
Figura 1. Los antibióticos se distinguen de otros fármacos por su lugar de acción que, en este caso, no es una estructura o una función del organismo humano, sino un microorganismo. Se establece una relación triangular. Lado 1: El antibiótico debe inhibir el crecimiento del microorganismo. Éste puede responder a la acción del antibiótico con el desarrollo de una resistencia. Lado 2: El antibiótico llega al microorganismo alojado en el organismo humano. Las propiedades farmacocinéticas y la biotransformación del antibiótico en el organismo determinan su concentración y su permanencia en el lugar de acción. Pueden aparecer efectos adversos del antibiótico. Lado 3: La patogenicidad y la virulencia, como características del microorganismo, determinan la gravedad de la enfermedad en el ser humano. El macroorganismo reacciona a través de su sistema de defensa contra el microorganismo invasor.
En realidad, el uso de los antibióticos se enmarca en circunstancias más complejas. No basta con tener en cuenta la sensibilidad del o de los gérmenes implicados en la infección existente y los posibles efectos adversos en el sujeto tratado, sino que también se ha de valorar el beneficio del uso terapéutico (y más aún del uso preventivo) para el individuo en relación con el riesgo de acelerar el desarrollo de resistencias y, por ende, de perjudicar a la comunidad. Por consiguiente se debe contraponer el beneficio del uso en el individuo frente al riesgo de la pérdida de sustancias y grupos de sustancias con una gran actividad antimicrobiana.
Lugares de acción de los antibióticos
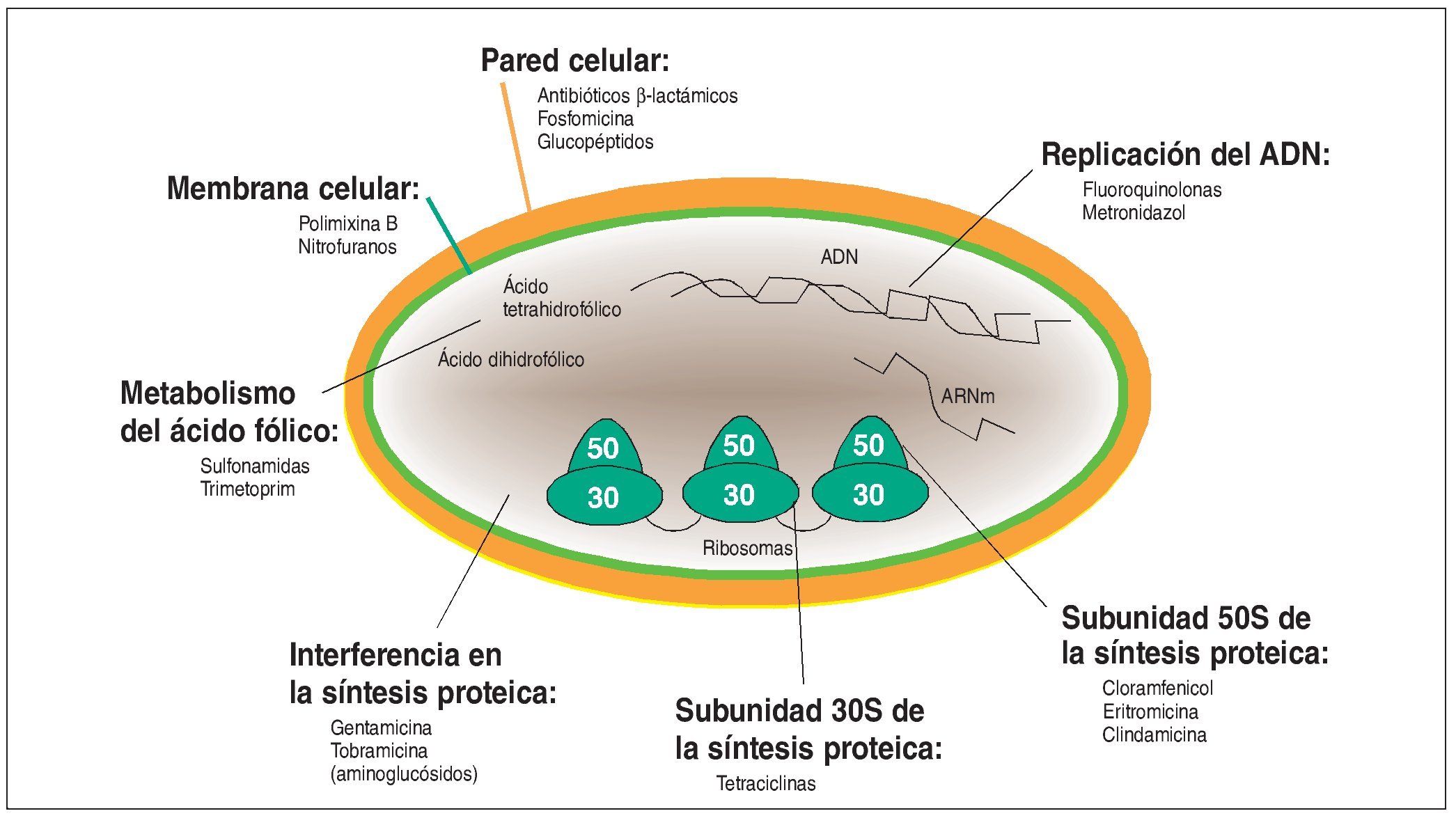
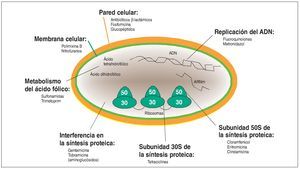
La inhibición de los microorganismos se consigue fundamentalmente por las diferencias estructurales y funcionales de la célula bacteriana (fig. 2):
Figura 2. Representación esquemática de una célula bacteriana que protege su medio interno frente al medio externo, como todas las demás células, con una membrana celular (verde) que posee una permeabilidad limitada a los electrolitos. Además, la célula bacteriana posee una pared celular (rojo-amarillo) que ofrece protección mecánica a la célula. La célula bacteriana dispone también de las herramientas para la síntesis proteica (ribosomas). Para la supervivencia de la especie hace falta el material genético (ADN) que, a diferencia de las células eucariotas, no se halla condensado en el núcleo, sino que está disperso en el citoplasma. Los principios activos antimicrobianos ejercen su efecto a través de la interacción en la estructura y la función de la membrana o de la pared celular, la interferencia en la biosíntesis proteica, en la biosíntesis del ácido fólico o a través de la alteración de la estructura o la replicación del ADN. Se intenta aprovechar las diferencias entre la célula bacteriana y la célula de los homeotermos para reducir al mínimo los efectos de la administración del antibiótico sobre el huésped. La representación esquemática pretende dar una idea de la multiplicidad de lugares de acción de los antibióticos.
El grupo de los antibióticos β-lactámicos (penicilinas, cefalosporinas) se aprovecha de la circunstancia de que la célula bacteriana no dispone sólo, como el resto de las células, de una membrana celular, sino que posee también una pared celular. Parece lógico que la alteración de la síntesis de la pared celular provocada por el antibiótico β-lactámico sólo dañe al microorganismo, sin influir en el macroorganismo, de lo que se deriva una relación beneficio-riesgo favorable.
Los representantes del grupo de los aminoglucósidos, los macrólidos y las tetraciclinas interfieren en la biosíntesis proteica de las bacterias. Una serie de diferencias estructurales mínimas en los ribosomas favorece la selectividad del efecto sobre los microorganismos.
Los inhibidores de la girasa (inhibidores de la topoisomerasa ~ fluoroquinolonas) y los nitroimidazoles inhiben la replicación del ADN. En el caso de los inhibidores de la girasa, la selectividad microbiana viene determinada por diferencias estructurales y funcionales de las topoisomerasas responsables de la formación de la doble hélice de cadenas de nucleótidos. En el caso de los nitroimidazoles (metronidazol), el depósito de un producto de reacción generado en el medio anaerobio provoca roturas de cadena, lo que explica su efecto selectivo sobre los gérmenes anaerobios.
Las sulfonamidas compiten con el ácido p-amino-benzoico durante la síntesis del ácido tetrahidrofólico en las bacterias. La célula eucariota depende del aporte exógeno de ácido fólico, es decir, carece de la capacidad de sintetizar ácido fólico, por lo que no resulta dañada por la acción de las sulfonamidas.
Por último, los polienos y los azoles son principios activos que modifican la permeabilidad de la membrana celular. Debido a la similitud de esta estructura celular en las células procariotas y las células eucariotas, no se consigue una gran selectividad. Por lo tanto, su tolerabilidad es relativamente menor en comparación con otros antibióticos.
Por motivos evidentes, se aspira a conseguir una gran selectividad, aunque esto no asegura forzosamente una buena tolerabilidad, dado que los principios activos pueden tener efectos totalmente independientes de su efecto antimicrobiano. Los aminoglucósidos, por ejemplo, son nefrotóxicos y ototóxicos, un efecto totalmente independiente de su mecanismo de acción antibiótico, o algunas fluoroquinolonas son hepatotóxicas y tendinotóxicas. Además del perfil de efectos adversos que puede diferir entre los distintos grupos de sustancias e incluso entre los diferentes principios activos, todos los tratamientos antimicrobianos se asocian a un riesgo de alteración de la flora oral, colónica y vaginal. La alteración de la colonización fisiológica en estas cavidades orgánicas puede dar lugar a la proliferación de especies cuyo crecimiento es inhibido en condiciones normales por poblaciones competidoras de la flora fisiológica. La colonización por gérmenes no fisiológicos explica la frecuencia de trastornos gastrointestinales, enteritis y cistitis crónicas recidivantes durante y después del tratamiento antibiótico.
Efecto bacteriostático-efecto bactericida
Además de la clasificación en función de su mecanismo de acción, los antibióticos se pueden diferenciar por su acción bactericida o su acción bacteriostática. Esta diferencia es importante para el tratamiento. Los principios activos con acción bactericida dependiente de la concentración deben administrarse a dosis altas durante un período de tiempo corto, mientras que en el caso de las sustancias bacteriostáticas y las sustancias con acción bactericida dependiente del tiempo es más importante mantener concentraciones antibacterianas eficaces durante un período de tiempo más largo. Se quiere advertir aquí de este hecho para evitar que las recomendaciones para una administración a corto plazo, incluso a dosis únicas, de un determinado antibiótico se trasladen sin más consideraciones a otros antibióticos. Una pauta de administración que puede estar justificada en el caso de los aminoglucósidos con acción bactericida dependiente de la concentración no es válida para los antibióticos β-lactámicos con acción bactericida dependiente del tiempo.
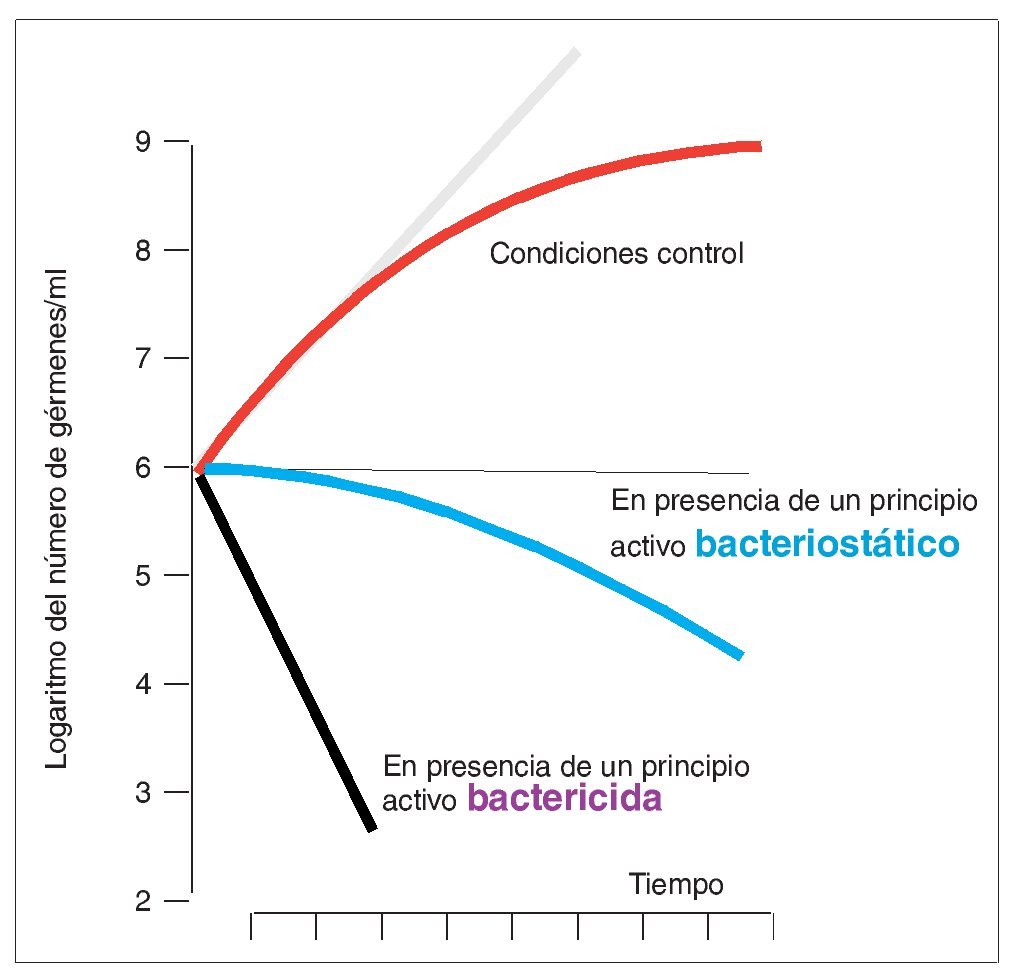
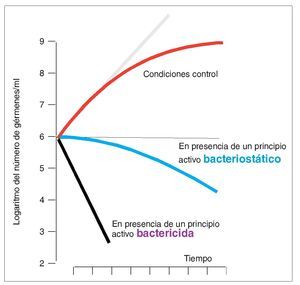
Los principios activos bacteriostáticos y los bactericidas muestran una cinética de inhibición diferente. Los dos principios activos, el bacteriostático y también el bactericida, inhiben el crecimiento bacteriano como muestra la figura 3. En el caso del principio activo bactericida, la población bacteriana disminuye de forma más rápida y más acusada. Sin embargo, ninguno de los principios activos consigue la erradicación completa de la población bacteriana. El tratamiento antibiótico es capaz de reducir la población microbiana, pero para lograr la erradicación de los gérmenes residuales deben intervenir las defensas del organismo. La importancia de un sistema inmunitario intacto se pone de manifiesto con especial contundencia en vista de la gravedad que pueden adquirir las infecciones más triviales en pacientes inmunodeprimidos.
Figura 3. Evolución cronológica de la eficacia antimicrobiana de principios activos bacteriostáticos y principios activos bactericidas. En el momento 0, el número de gérmenes es de 106. En condiciones control, es decir, sin inhibidores, aumenta exponencialmente (véase la división logarítmica de la ordenada). La desviación (negro) del aumento exponencial (gris) se explica, entre otros motivos, por el agotamiento de los recursos necesarios para el crecimiento. En presencia de una sustancia bacteriostática se ralentiza el crecimiento de los gérmenes. El número de gérmenes disminuye como consecuencia de la muerte de los mismos (azul). En el caso de las sustancias bactericidas, el número de gérmenes disminuye con mayor rapidez (violeta). La representación esquemática ilustra que ni siquiera con sustancias bactericidas se consigue una erradicación completa de los gérmenes. Aunque la reducción de la población de gérmenes es mucho mayor con la sustancia bactericida, el número de gérmenes no llega nunca a cero. En la práctica, esto significa que el tratamiento antibiótico sólo puede proporcionar un efecto duradero si las defensas del organismo eliminan los gérmenes residuales.
Parámetros del efecto inhibitorio y de la resistencia
La concentración mínima inhibitoria (CMI) o la concentración mínima bactericida (CMB) son las concentraciones de una sustancia con actividad antimicrobiana que inhiben el crecimiento in vitro de una determinada cepa bacteriana o disminuyen la población de gérmenes vitales. Los gérmenes se califican de resistentes si para su inhibición o destrucción hacen falta concentraciones más altas de un principio activo que las que se alcanzan en el organismo a dosis terapéuticas.
Lamentablemente, la CMI y la CMB no son valores inmutables de la potencia de un antibiótico que una vez establecidos sirven para siempre, dado que la sensibilidad de una especie bacteriana frente a un principio activo antibiótico puede ir disminuyendo. El desarrollo de resistencia se debe, bien a una selección de gérmenes menos sensibles, bien a mutaciones en las bacterias como consecuencia de las cuales se activan funciones o enzimas a través de las que la bacteria se puede sustraer a la acción antibiótica (resistencia secundaria).
Tratamiento antibiótico en odontología
El procedimiento ideal para elegir un antibiótico y determinar la dosis adecuada es la identificación del germen o de los gérmenes y la determinación de su sensibilidad frente a los antibióticos disponibles. Por motivos técnicos y de tiempo, este procedimiento se aplica sólo en casos excepcionales en la consulta dental. En su lugar, la elección del antibiótico se orienta habitualmente por datos estadísticos de frecuencia con la que se identifican los gérmenes en una determinada infección y por la sensibilidad de éstos, estudiada recientemente en uno de los institutos microbiológicos regionales.
Antes de exponer situaciones terapéuticas concretas hay que resaltar que la administración de antibióticos no suele ser la medida más importante ni tampoco la única en el tratamiento de las infecciones odontogénicas. Este comentario previo es importante, dado que este artículo se centra en los principios activos antiinfecciosos. En el caso de los abscesos, por ejemplo, el drenaje quirúrgico es el tratamiento de elección y el tratamiento antibiótico sólo cumple una función complementaria.
Infecciones odontogénicas
En general, las infecciones odontogénicas son infecciones mixtas, es decir, en ellas están implicados varios gérmenes patógenos. Hasta hace algunos años, se recomendaba administrar penicilina V como tratamiento de elección. La aparición de nuevos datos respecto a la situación de las resistencias, sobre todo de gérmenes anaerobios en infecciones odontogénicas, obligó a la comisión de expertos de la Sociedad Paul Ehrlich a revisar esta recomendación: la penicilina V es sustituida por una aminopenicilina combinada con un inhibidor de la β-lactamasa. A diferencia de la penicilina V, el efecto inhibitorio de las aminopenicilinas incluye entre el espectro de gérmenes habitual algunas especies patógenas gramnegativas.
Aminopenicilinas
Las aminopenicilinas disponibles incluyen la ampicilina y la amoxicilina. La amoxicilina se absorbe casi totalmente (70-95%) después de la administración oral, mientras que en el caso de la ampicilina la absorción se reduce al 40%. La fracción no reabsorbida de la ampicilina, es decir, la que permanece en la luz intestinal, daña la flora intestinal. Por lo tanto, el tratamiento con ampicilina se asocia a menudo a trastornos gastrointestinales. Éste es el motivo por el que se recomienda cambiar a amoxicilina, al menos para el tratamiento oral.
Con las penicilinas se obtienen concentraciones tisulares (también óseas) suficientemente altas4,38. La amoxicilina se elimina por vía renal. Su semivida de 1-2 h es aproximadamente dos veces mayor que la de la bencilpenicilina. Las aminopencilinas se descomponen y, por consiguiente, se inactivan por acción de la enzima β-lactamasa. Dado que la resistencia frente a la penicilina se basa en gran parte en la inducción de la β-lactamasa bacteriana es útil combinarla con un inhibidor de esta enzima.
Alergia a la penicilina
La amoxicilina se tolera bien. Está contraindicada en pacientes alérgicos a la penicilina y en pacientes que padecen simultáneamente una infección vírica, sobre todo una mononucleosis infecciosa (riesgo de una reacción cutánea grave). Las reacciones alérgicas son de lejos el efecto adverso más frecuente asociado al uso de la penicilina. Hasta un 10% de los pacientes afirma ser alérgico a la penicilina, aunque sólo el 10-20% de éstos muestre realmente una hipersensibilidad a la penicilina. En la mayoría de los casos, las reacciones alérgicas son de tipo retardado y se manifiestan por un exantema cutáneo y fiebre. Las reacciones de tipo inmediato con edema laríngeo, urticaria y shock anafiláctico son mucho menos frecuentes. Las pruebas de alergia (prueba de punción) son poco viables por motivos de tiempo en casos concretos, por lo que la obtención de una anamnesis completa es la mejor forma de detectar el riesgo de una diátesis alérgica y optar por un antibiótico alternativo a un β-lactámico. Entre las alternativas destacan sobre todo la clindamicina y, como segunda opción, los macrólidos (eritromicina, roxitromicina, claritromicina) o el moxifloxacino.
Macrólidos
Los macrólidos difieren escasamente entre ellos en lo que se refiere al espectro de gérmenes inhibido. Este espectro de gérmenes coincide parcialmente con el de la penicilina, pero su eficacia contra los anaerobios de la cavidad oral es menor. Los macrólidos se pueden administrar por vía oral. Además, los macrólidos de nueva generación, como la roxitromicina y la claritromicina, se absorben mejor (aproximadamente un 60%) que la eritromicina (variable, 25% por término medio). Los macrólidos se eliminan por vía hepática, por lo que se pueden producir interacciones con fármacos, como la fenprocumona (Marcumar), determinados virostáticos, las estatinas y otros.
El efecto adverso más frecuente de la eritromicina son las molestias epigástricas. Estas molestias difieren de las desencadenadas por muchos antibióticos de amplio espectro por una alteración de la flora intestinal. La eritromicina también es un agonista de los receptores de la motilina. La motilina es una hormona peptídica intestinal. La estimulación de los receptores de la motilina desencadena las contracciones gástricas interdigestivas (fase de ayuno). Si estas contracciones se producen con el estómago lleno, el paciente las percibe como epigastralgias cólicas. Se puede evitar la aparición de estas molestias espaciando lo máximo posible la toma de la eritromicina respecto a la ingesta de alimentos. La probabilidad de este efecto adverso es menor con la roxitromicina y la claritromicina. Además, estos macrólidos nuevos muestran una permanencia tisular más prolongada. La eritromicina debe tomarse cada 6 h, mientras que este intervalo puede alargarse a 12 h en el caso de la roxitromicina y la claritromicina, o incluso a 24 h si se elige una forma farmacéutica de liberación retardada de claritromicina.
Clindamicina
La clindamicina inhibe un espectro de gérmenes similar al de los macrólidos. Se caracteriza además por su especial eficacia sobre los bacilos anerobios gramnegativos y los estafilococos. Después de la administración oral, se absorbe de forma rápida y casi completa, y pasa a los tejidos, entre ellos también al hueso, donde alcanza concentraciones eficaces35,56.
Entre los principios activos antiinfecciosos, la clindamicina se considera un antibiótico de reserva para las infecciones anaerobias y las infecciones estafilocócicas, lo que, sin duda, también es válido para las infecciones piógenas odontogénicas. Sin embargo, su utilidad se ve algo mermada por una resistencia paralela parcial con los macrólidos. Debe evitarse, por lo tanto, recurrir a la clindamicina en caso de fracasar un tratamiento previo con macrólidos.
Situación de las resistencias en la odontología
A diferencia de la medicina general, se dispone de pocos datos en relación con la situación de las resistencias en la odontología. Algunos autores informaron de tasas de resistencia bajas a la penicilina en pacientes con abscesos odontogénicos no complicados19,20,34. Otros autores, en cambio, demostraron la presencia de β-lactamasa en hasta un 15-35% de las especies de gérmenes aisladas en abscesos odontogénicos, lo que se traduce en una resistencia a la penicilina V y a las aminopenicilinas22,30,40,48.
Igual de contradictorios son los datos obtenidos para clindamicina: algunos de los gérmenes aislados fueron sensibles, mientras que otros informes documentan resistencias en hasta un 25-45% de los gérmenes aislados6,30,40,48. Sin embargo, hay que tener en cuenta que la información disponible acerca de la situación de las resistencias procede habitualmente del medio hospitalario en el que se identifican especies de gérmenes especialmente críticas. No es fácil trasladar este estado de cosas a las circunstancias de los pacientes ambulatorios de la consulta dental. Sin embargo, en conjunto, se puede afirmar que el porcentaje de gérmenes resistentes a la penicilina (selección de gérmenes productores de β-lactamasa) ha ido en aumento en las últimas décadas también en las infecciones del ámbito odontológico2. En este sentido parecen desempeñar un papel especial los tratamientos antibióticos preventivos. A modo de ejemplo, se puede destacar que en abscesos graves previamente tratados se identificaron hasta un 40% de los gérmenes resistentes a la penicilina5,31.
La eficacia de la penicilina y la clindamicina está asegurada en infecciones odontogénicas no complicadas y no tratadas previamente. En cambio, en abscesos odontogénicos graves, normalmente pretratados, cabe esperar una tasa de resistencia más alta a ambas sustancias6,21,30,40,48. En prácticamente todos los estudios llevados a cabo en el ámbito odontológico ha mostrado ser eficaz la combinación de una aminopenicilina (como amoxicilina) y un inhibidor de la β-lactamasa (ácido clavulánico), es decir, una penicilina «protegida».
Osteomielitis
La osteomielitis maxilar representa una forma especial de infección odontogénica ya que en este caso es más complicado alcanzar concentraciones eficaces in situ que en las infecciones de tejidos blandos habituales. Las formas más importantes son la osteomielitis aguda y la osteomielitis crónica secundaria de origen bacteriano (infección odontogénica, infección pulpar y periodontal, heridas de extracción infectadas), supuración y formación de trayectos fistulosos y secuestro óseo. En estos cuadros se identifican gérmenes patógenos parecidos a los que se hallan en un absceso odontogénico con una composición polimicrobiana41. Se han descrito también colonizaciones o infecciones por gérmenes grampositivos multirresistentes especialmente en tratamientos profilácticos a largo plazo8,51.
El tratamiento de la osteomielitis consiste en una terapia combinada de intervención quirúrgica y antibioterapia10,49. El principio terapéutico de la osteomielitis se basa en la eliminación del foco y la remoción del hueso necrótico infectado en combinación con un tratamiento antibiótico empírico, si bien lo ideal sería una antibioterapia específica en función del germen causal. Los antibióticos aplicados por vía tópica han mostrado ser eficaces en la forma crónica24. El tratamiento antibiótico complementario al procedimiento quirúrgico debe cubrir, además de los estafilococos frecuentemente aislados en estas lesiones, el espectro de gérmenes anaerobios29. Se recomienda un régimen basado en clindamicina o penicilina. Para los cuadros tratados previamente rigen las mismas limitaciones antes descritas47, dado que después de tratamientos profilácticos se identifican frecuentemente gérmenes resistentes a la penicilina41. En general, se recomienda continuar el tratamiento antibiótico durante 4 a 6 semanas después del procedimiento quirúrgico inicial12. Es posible que la evolución sea complicada y se prolongue en el tiempo, por lo que se recomienda realizar las pruebas microbiológicas adecuadas para identificar el germen o los gérmenes.
Sialoadenitis aguda
La sialoadenitis es una infección de origen bacteriano o vírico de las glándulas salivales. Se debe a menudo a sobreinfecciones secundarias a alteraciones funcionales de las glándulas salivales. Se localiza preferentemente en la glándula submandibular. Las alteraciones de la secreción en las glándulas mucosas y las glándulas salivales provocan un aumento de la viscosidad salival que favorece la precipitación de sustancias inorgánicas. Los sialolitos en desarrollo favorecen la colonización y la infección bacterianas, por lo que deberían ser extirpados en la fase crónica. Existen formas evolutivas agudas y crónicas. Los gérmenes causales suelen ser sobre todo virus (virus de la parotiditis, virus paragripal, citomegalovirus), y en el caso de los adultos son preferentemente estafilococos y estreptococos15,32,33,42.
En estudios más recientes se llama la atención sobre la gran prevalencia de gérmenes anaerobios en la sialoadenitis supurada14,32 y se ha advertido también de la presencia de fusobacterias de difícil tratamiento28. En la fase aguda adquiere mayor importancia el tratamiento conservador. En presencia de signos y síntomas de una diseminación sistémica de la infección se debe iniciar un tratamiento parenteral o proceder al drenaje quirúrgico, el cual requiere normalmente la hospitalización del paciente. En infecciones más leves suele bastar con la administración oral de antibióticos. Los gérmenes causales suelen ser resistentes a la penicilina, por lo que se recomienda administrar una aminopenicilina combinada con un inhibidor de la β-lactamasa o una clindamicina53. Se han propuesto también tratamientos con cefalosporinas23, aunque la actividad de las mismas frente a los posibles anaerobios es limitada.
Gingivitis necrosante aguda
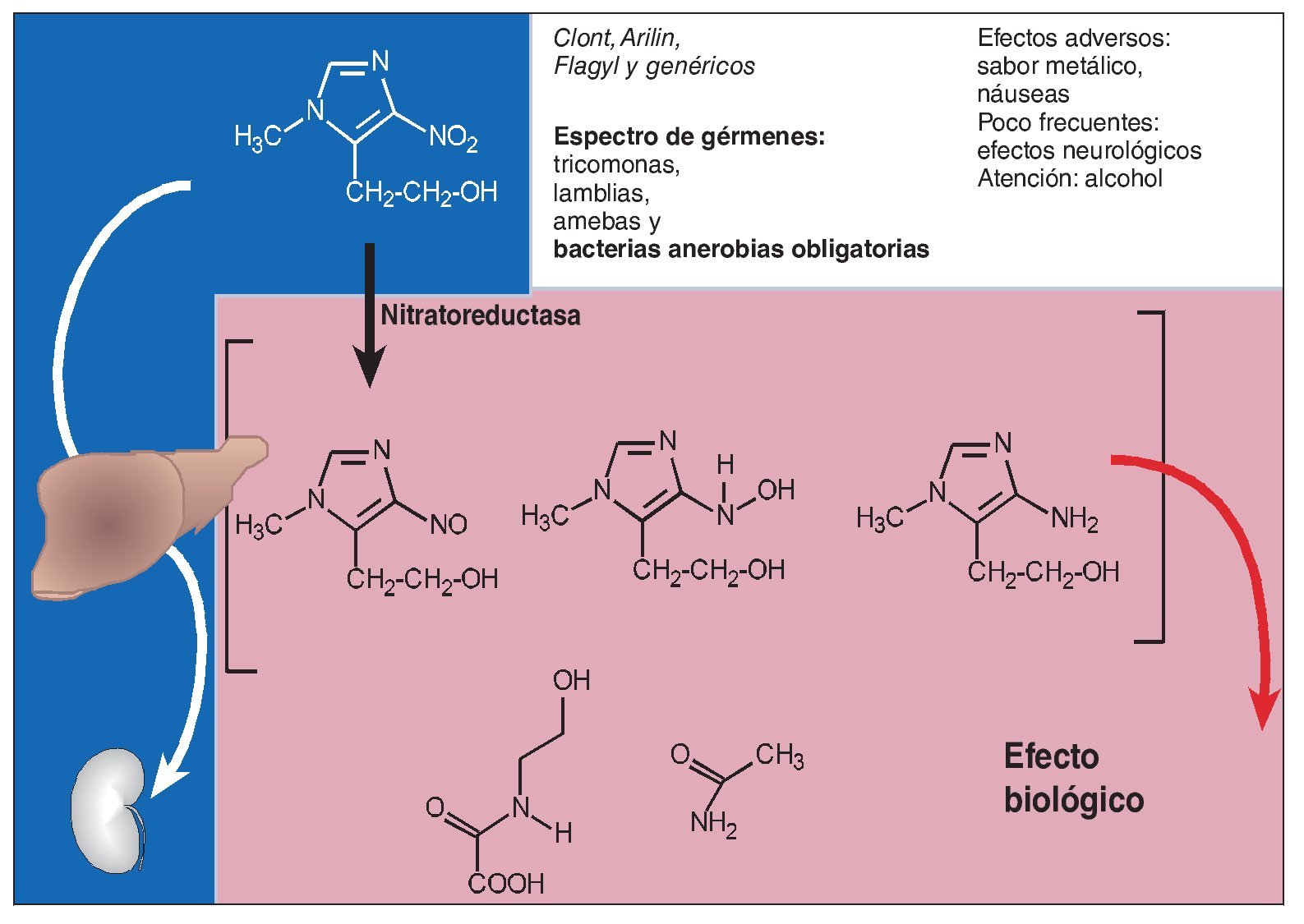
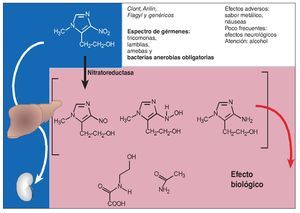
La accesibilidad al foco infeccioso permite utilizar desinfectantes como el peróxido de hidrógeno o soluciones de clorhexidina. En formas evolutivas graves puede ser útil la administración sistémica o la aplicación tópica de metronidazol. El metronidazol tiene efecto bactericida en bacterias microaerófilas o anaerobias obligatorias (fig. 4). Después de la administración oral, se absorbe de forma rápida y casi completa, y después de un proceso de oxidación y unión a ácido glucurónico se elimina con una semivida de 4-6 h. Entre los efectos adversos destacan los trastornos gastrointestinales y un sabor metálico desagradable. En tratamientos a largo plazo se comunicaron cefaleas, mareo, parestesias, exantemas y leucopenia. Se ha de tener en cuenta también que, en caso de administración sistémica, se produce con toda seguridad una intolerancia al alcohol y en la aplicación tópica esta intolerancia es muy probable. El metronidazol inhibe la alcohol deshidrogenasa de modo similar al disulfiram (Antabus), lo que provoca una intolerancia a cantidades incluso mínimas de alcohol etílico.
Figura 4. El metronidazol como tal es un profármaco inactivo de un principio activo. Este profármaco es transformado en el principio activo en el medio anaerobio, es decir, en el lugar donde reinan condiciones óptimas para el crecimiento de las bacterias anaerobias. El profármaco biológicamente inactivo pasa del resto de los tejidos al hígado, desde donde es eliminado por vía renal después de la unión a ácido glucurónico.
Profilaxis antiinfecciosa en determinados colectivos de pacientes
La profilaxis antiinfecciosa está indicada en pacientes
con una inmunodepresión patológica o inducida farmacológicamente
después de la radioterapia por un cáncer de cabeza o cuello
que han padecido previamente una endocarditis bacteriana
portadores de una prótesis valvular
La profilaxis antiinfecciosa implica, como en toda profilaxis, que no se sabe si el acontecimiento (la infección) llegará realmente a producirse y cuál es el posible germen causal, disponiéndose únicamente de datos estadísticos acerca del germen o de los gérmenes más frecuente(s) en la supuesta infección. El tratamiento profiláctico conlleva forzosamente un uso innecesario de antibióticos, lo que no sólo tiene implicaciones económicas, como todas las medidas profilácticas en general, sino que además plantea un dilema ante la certeza de que se produce un aumento amenazador de los gérmenes resistentes y multirresistentes. Por una parte, se sabe que ha de imperar la contención en la dispensación de antibióticos y, por otra parte, está el temor a denegar al paciente una posible prestación que éste espera.
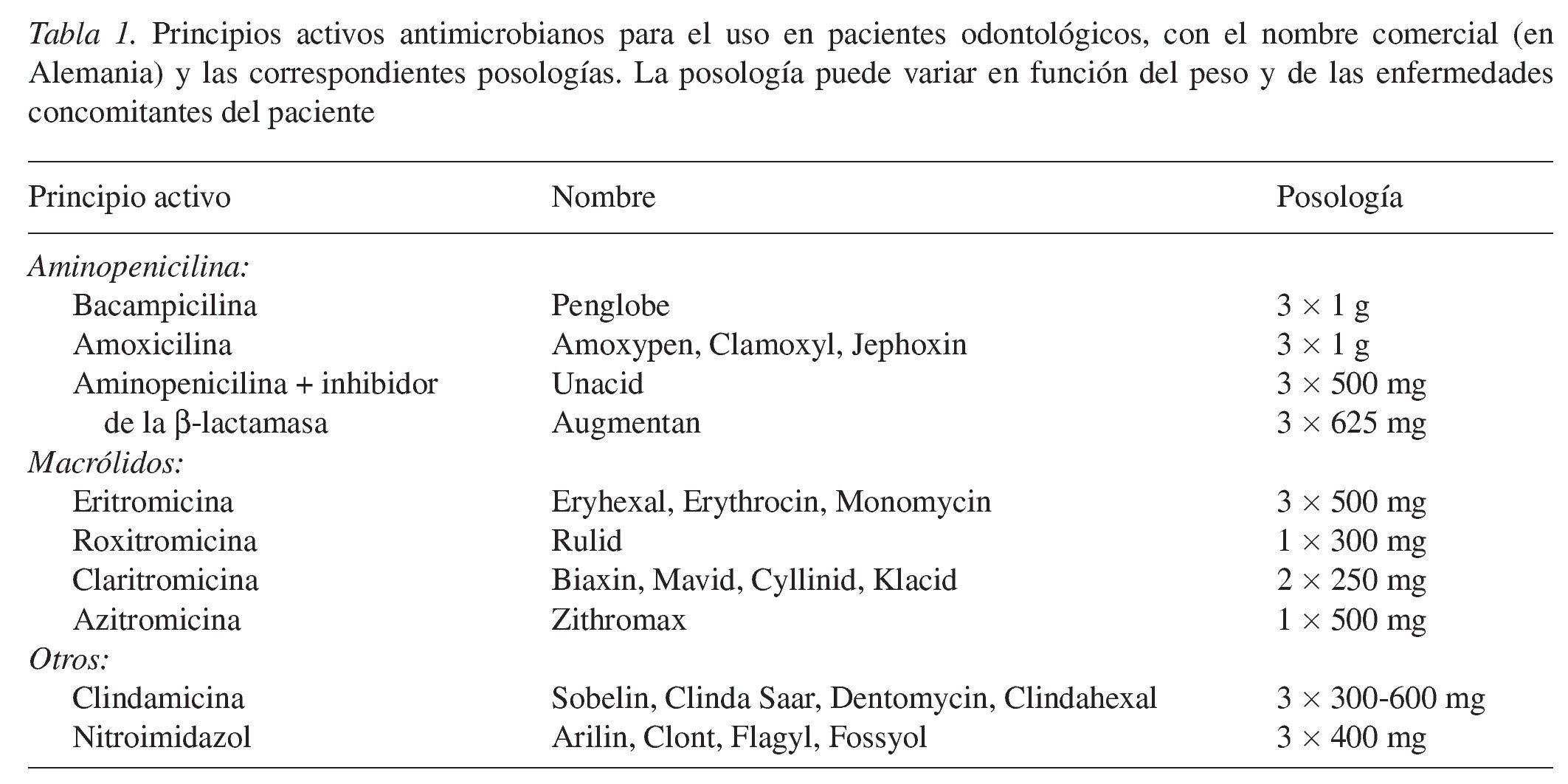
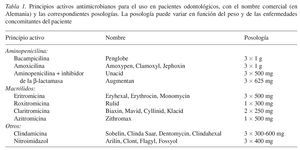
En este contexto no existe una recomendación válida para todos los casos. Se ha de evaluar y considerar en cada caso el riesgo de una posible infección y la capacidad para detectarla precozmente y para tratarla adecuadamente. Para estimar el riesgo puede ser útil saber que una limpieza dental minuciosa puede provocar por sí sola una bacteriemia transitoria en el 40% de los sujetos estudiados (tabla 1). Esta bacteriemia se suele controlar eficazmente con las defensas del organismo en la mayoría de los casos.
Pacientes sometidos a tratamiento inmunosupresor
Los riesgos pueden ser muy variables, como ilustra la comparación entre un paciente físicamente vigoroso con artritis reumatoide y un paciente oncológico debilitado. En el paciente reumático se inhibe la reacción inmunitaria con metotrexato u otro inmunosupresor, mientras que el paciente oncológico experimenta una merma grave de su inmunocompetencia por los efectos de la radioterapia y la quimioterapia. La situación de riesgo es totalmente distinta para estos dos pacientes inmunodeprimidos. El paciente reumático sólo necesitará una profilaxis antiinfecciosa en casos excepcionales, pero en el paciente oncológico sometido a irradiación de la región de la cabeza y del cuello la no administración de una profilaxis constituirá un hecho absolutamente excepcional.
Pacientes con alteraciones del metabolismo óseo (bifosfonatos, radioterapia)
La radioterapia de cánceres de cabeza y cuello con dosis superiores a 50 Gy da lugar a una hipoperfusión ósea importante y a un daño osteoblástico que puede persistir durante años. La remodelación ósea fisiológica se resiente después de intervenciones quirúrgicas odontológicas. La temida osteorradionecrosis infecciosa, sobre todo mandibular, puede aparecer incluso varios años después de la radioterapia.
El tratamiento con bifosfonatos provoca una alteración de la fisiología ósea a través de otro mecanismo. Los bifosfonatos se administran para el tratamiento de distintas metabolopatías óseas y de la hipercalcemia. Las indicaciones principales incluyen:
Plasmocitoma y mieloma múltiple
Metástasis óseas de tumores sólidos (sobre todo del carcinoma de mama y del carcinoma de próstata)
Osteoporosis
Enfermedad de Paget
La osteonecrosis maxilar por bifosfonatos es una enfermedad grave, dado que se acompaña de alteraciones funcionales relevantes (compromiso de la función masticatoria y de las fases orales del habla y de la deglución) y, en general, de una merma importante de la calidad de vida asociada a la cavidad oral. El tratamiento de la osteonecrosis maxilar manifiesta inducida por bifosfonatos requiere a menudo la eliminación de la necrosis con procedimientos que van desde la resección marginal o la resección segmentaria a una resección de continuidad con anestesia general e ingreso hospitalario. La tasa de recidiva es superior a la de otras osteopatías de los maxilares.
De forma similar a la osteorradionecrosis infecciosa, el perfil de riesgo individual de aparición de una osteonecrosis maxilar por bifosfonatos es muy variable y depende de numerosos factores. Por ello se ha de adaptar la profilaxis y la prevención al perfil de riesgo correspondiente para evitar situaciones de sobretratamiento e infratratamiento. En casos de riesgo especialmente elevado, como el asociado a la administración intravenosa de bifosfonatos en una enfermedad oncológica de base y una corticoterapia complementaria, se ha de evaluar estrictamente la indicación de las intervenciones quirúrgicas odontológicas. Las profilaxis antibióticas a largo plazo son razonables. Dado que los factores desencadenantes de la osteonecrosis en ambas enfermedades son odontogénicos en muchos casos26,54, se recomienda la administración de un antibiótico de amplio espectro eficaz también frente a los gérmenes anaerobios (amoxicilina/ ácido clavulánico y, como alternativa, clindamicina).
Pacientes con enfermedades gastrointestinales crónicas
Los efectos adversos gastrointestinales habituales de los antibióticos provocan un gran malestar a pacientes con enfermedades gastrointestinales crónicas, como la colitis ulcerosa o la enfermedad de Crohn. Se entiende por diarrea asociada a antibióticos (DAA) una diarrea que no se puede explicar por otras causas y que aparece en relación con una antibioterapia13. En general, no se logra identificar ningún germen y se cree que el cuadro se debe a una alteración del ecosistema microbiológico en el intestino. Sin embargo, los casos graves suelen deberse a la presencia de Clostridium difficile y provocan una entidad denominada colitis pseudomembranosa.
Estas infecciones han ido adquiriendo importancia en los últimos años, sobre todo en el ámbito hospitalario9,44.
La DAA afecta al 5-30% de los pacientes y puede aparecer hasta al cabo de 1 mes después de haber finalizado el tratamiento antibiótico9,55. Se hallan implicados sobre todo los antibióticos de amplio espectro activos también frente a gérmenes anaerobios (clindamicina y amoxicilina/ácido clavulánico). Por ello es importante que el odontólogo esté especialmente alerta ante esta problemática que frecuentemente es un tema tabú en la consulta dental. Los prebióticos que estabilizan de forma preventiva la flora intestinal a través del aporte de microorganismos seleccionados (cultivos para yogur16,39, Saccharomyces boulardii50, Lactobacillus casei y bifidobacterias27) pueden ser útiles en estos casos.
Se debe hacer una evaluación estricta de la indicación en pacientes con las enfermedades gastrointestinales mencionadas. Se instaurará el tratamiento previo acuerdo con el paciente y se limitará su duración al mínimo imprescindible. Debido a su amplio espectro terapéutico, se dará preferencia a la amoxicilina sola frente a la combinación con ácido clavulánico para el tratamiento preventivo3,53.
Pacientes con hepatopatía
Las hepatopatías crónicas, como la cirrosis, se deben en la mayoría de los casos al alcoholismo crónico o a infecciones víricas (hepatitis C). En la fase de compensación es fácil subestimar la importancia de la problemática, ya que alteraciones mínimas pueden desencadenar una descompensación que pueden poner en riesgo la vida del paciente. Además del trastorno de la coagulación, frecuentemente grave, que puede llegar a impedir cualquier intervención quirúrgica en la consulta dental, no se debería empeorar la función hepática con la administración de antibióticos. Presumiblemente, los pacientes con hepatopatía se suelen hallar en una situación inmunitaria precaria, lo que hace prácticamente imprescindible un tratamiento antibiótico (a corto plazo). A la hora de planificar un tratamiento con metronidazol en las hepatopatías secundarias a un alcoholismo crónico que puede persistir en la actualidad, se deben tener presentes sus efectos adversos (efecto Antabus). Asimismo se ha descrito un aumento de las enzimas hepáticas asociado a la administración de ácido clavulánico25, de modo que se evitará esta combinación en las hepatopatías. Sin embargo, la metabolización del antibiótico alternativo, clindamicina, también afecta la función hepática. La amoxicilina parece, por tanto, una buena alternativa. Se recomienda llevar a cabo controles periódicos de la función hepática, sobre todo en administraciones a largo plazo.
Pacientes bajo tratamiento anticoagulante
En pacientes sometidos a tratamiento anticoagulante es esencial saber el motivo de esta prescripción. En las fases precoces (< 6 meses) después de un infarto de miocardio o de una embolia pulmonar existe una contraindicación estricta para tratamientos odontológicos programados. Los pacientes portadores de una prótesis valvular deben recibir un tratamiento para prevenir la endocarditis. Los antibióticos que se eliminan por vía hepática (macrólidos, clindamicina) pueden provocar cambios en el efecto de los anticoagulantes y, por lo tanto, influir en el estado de coagulación del paciente. En general se recomienda realizar controles estrechos de la coagulación en la fase infecciosa o de la intervención quirúrgica en pacientes que reciben anticoagulantes orales.
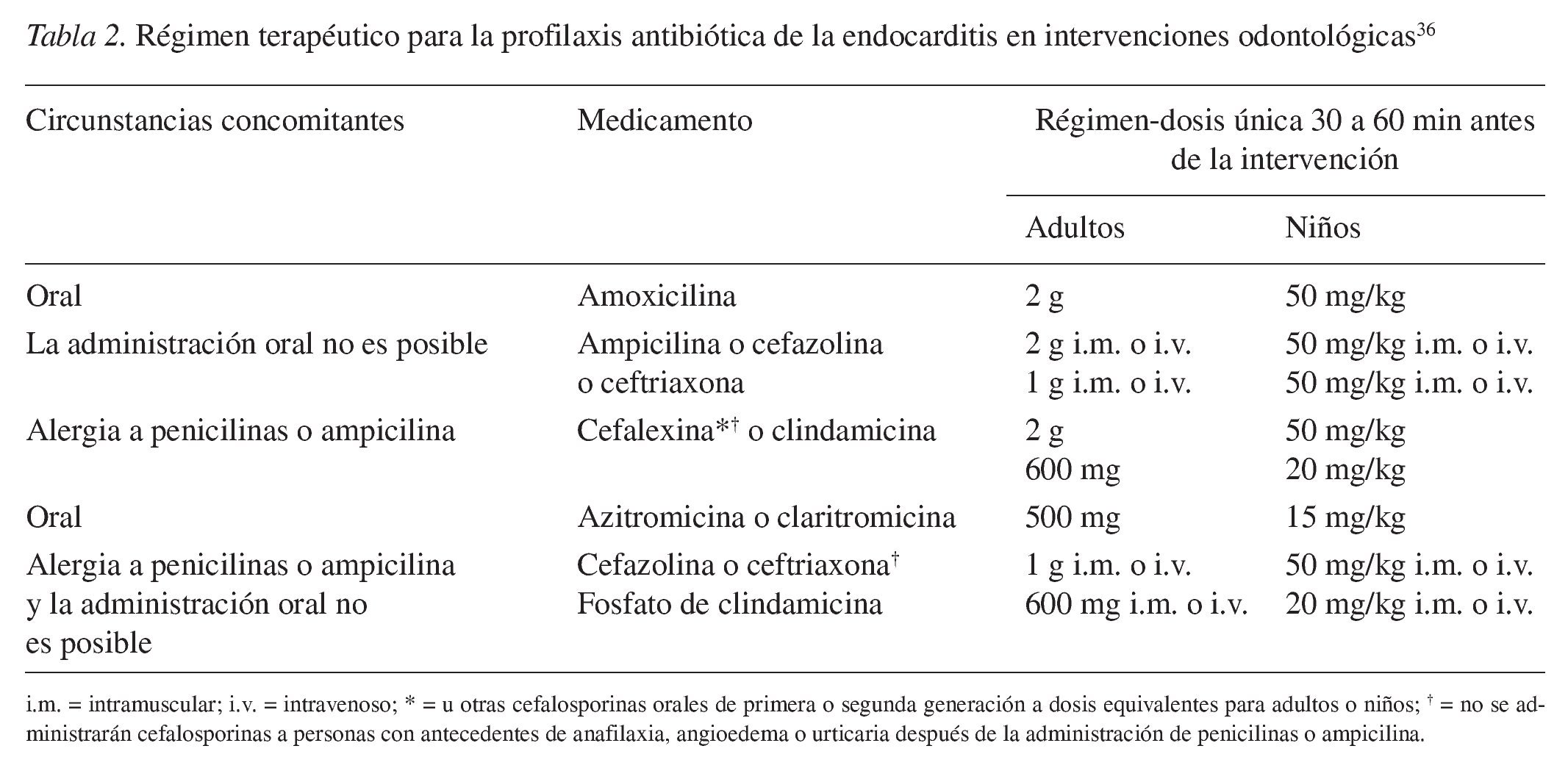
Pacientes con riesgo de endocarditis
En 2007 se revisaron las recomendaciones imperantes desde hacía décadas en relación con la profilaxis de la endocarditis36. En principio se acepta el modelo según el que las bacteriemias pueden desencadenar una endocarditis infecciosa en pacientes con lesiones endocárdicas previas. Se sabe que todos los tratamientos odontológicos que conllevan manipulaciones en las encías y también los tratamientos endodónticos dan lugar a bacteriemias, pero no es menos cierto que después de actividades rutinarias, como la limpieza dental o la masticación, también se detectan gérmenes en la sangre.
Otro aspecto que debería hacer reflexionar es el relativo a la cantidad de gérmenes. En el modelo animal hacen falta cantidades de 106-108 gérmenes/ml de sangre para desencadenar una endocarditis11. Sin embargo, después de tratamientos odontológicos y actividades rutinarias se identifican únicamente 1-10 gérmenes/ml17,43,45. En un trabajo innovador publicado en Francia se evaluó de forma crítica la eficacia de la profilaxis antibiótica18: parece ser que hace falta un gran número de tratamientos profilácticos para prevenir un número reducido de enfermedades. A esto se añade el hecho de que hasta ahora no se ha estudiado nunca la eficacia del tratamiento preventivo de la endocarditis en humanos en el marco de un estudio prospectivo, aleatorizado y controlado con placebo. Algunos estudios recientes cuestionan la eficacia de la profilaxis de la endocarditis sobre la base de esta evaluación del riesgo: los efectos adversos de los antibióticos pueden llegar incluso a sobrepasar los posibles beneficios1.
A la vista de estos resultados, se llegó a un acuerdo según el que no todos los pacientes con un riesgo de sufrir una endocarditis infecciosa deben recibir un tratamiento preventivo, sino sólo aquellos con un riesgo muy alto o aquellos en los que la enfermedad puede evolucionar a la muerte36. De este grupo forman parte pacientes con
prótesis valvulares
endocarditis infecciosa superada
receptores de un trasplante cardiaco que desarrollan una valvulopatía
cardiopatías congénitas en las que la recomendación actual para el uso de una profilaxis antibiótica se limita a las enfermedades/estados clínicos siguientes:
- cardiopatías congénitas cianóticas no corregidas, incluidas aquellas con cortocircuitos y conductos paliativos
- cardiopatías congénitas totalmente corregidas mediante una intervención quirúrgica o con cateterismo para la implantación de prótesis u otros dispositivos, en los 6 primeros meses después de la intervención
- cardiopatías congénitas corregidas, con defectos residuales en o próximos a injertos protésicos u otros dispositivos protésicos
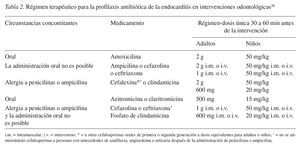
Los principios activos utilizados son los mismos y se adecuan a los «patógenos orales» previsibles (tabla 2). Para los pacientes que habían recibido un tratamiento profiláctico, pero en los que ya no está «indicado», existe la posibilidad de administrar una profilaxis opcional individualizada. De acuerdo con los datos disponibles sobre las bacteriemias, se consideran procedimientos de riesgo todas las intervenciones que pueden dar lugar a bacteriemias: manipulaciones en las encías y en la región periapical y perforaciones de la mucosa oral.
Pacientes con prótesis articulares
Un panorama parecido, sólo que basado en menos datos todavía, se nos presenta en relación con la profilaxis de infecciones en las endoprótesis. Existe una recomendación estadounidense del año 2003 sobre la profilaxis que en Alemania no se va a implantar de momento7. Algunos metaanálisis recientes de la bibliografía existente cuestionan abiertamente la utilidad de esta profilaxis en pacientes sanos52. Una revisión actual incluye 144 estudios relativos al tema, de los que el 19% recomienda una profilaxis, el 8% la rechaza y la mayoría no se pronuncia46.
Los autores de la revisión concluyen que la infección de endoprótesis de cadera y rodilla como consecuencia de una bacteriemia después de intervenciones orales es un acontecimiento excepcional. La base científica para un tratamiento sistémico cabe calificarla, según esto, de poco fundada en el mejor de los casos. Aunque existen grupos de trabajo que proponen una profilaxis antibiótica durante los primeros meses después de la artroplastia37, se debería esperar un consenso interdisciplinario antes de promulgar el uso sistemático de antibióticos en esta indicación, también en consideración a una posible sobrevaloración médica forense. Por ahora, la profilaxis antibiótica en pacientes sometidos a una artroplastia parece estar indicada exclusivamente en presencia de otros factores de riesgo médicos.
Comentario final
Con el presente artículo se ha pretendido ofrecer un resumen de algunos principios de la antibioterapia, cuyo conocimiento es necesario para entender las posibilidades y las limitaciones del tratamiento antibiótico. A continuación, se han presentado las herramientas farmacológicas que el odontólogo necesita para el tratamiento de las infecciones y que entran en su ámbito de responsabilidad. Forzosamente, representan sólo una pequeña parte de todos los principios activos antimicrobianos disponibles. Se han estudiado y considerado eficaces también otros antibióticos, como las cefalosporinas y los inhibidores de la girasa, para el tratamiento de infecciones en el paciente odontológico. Sin embargo, no han sido incluidos en las recomendaciones terapéuticas de la comunidad profesional, dado que no constituyen alternativas terapéuticas adicionales o se muestran inferiores a las sustancias aquí presentadas en lo que a perfil de tolerabilidad se refiere.
Correspondencia: B. Al-Nawas.
Clínica de Cirugía Oral y Maxilofacial, Cirugía Plástica. Facultad de Medicina de la Universidad Johannes Gutenberg Mainz. Augustusplatz 2, 55131 Mainz, Alemania.
Correo electrónico: al-nawas@mkg.klinik.uni-mainz.de
A. Ziegler.
Richterstrabe 18a, 24159 Kiel, Alemania.
Correo electrónico: aziegler@pharmakologie.uni-kiel.de