Introducción
Se define como ultrasonido una energía sónica en el intervalo de frecuencias superior a 25 kHz. En el ámbito de la odontología, el uso de esta técnica se limitó durante mucho tiempo casi exclusivamente a la periodoncia y su introducción en la endodoncia no se produjo hasta 1953 de la mano de Richman. Transcurrieron otros 20 años hasta que Howard Martin desarrolló en 1976 un sistema de ultrasonidos comercial, el Endosonics, para la instrumentación y la limpieza de los conductos radiculares. Los primeros aparatos sólo introdujeron modificaciones sencillas en los sistemas ya existentes, como el aparato Cavi-Endo basado en el sistema Cavitron. Las primeras limas ultrasónicas reaccionaban con gran sensibilidad a las vibraciones, y los movimientos cortantes durante la preparación del conducto radicular eran incontrolados, lo que daba lugar a irregularidades en las paredes de los conductos o dañaba las estructuras apicales de los conductos48. Los primeros aparatos funcionaban con magnetostricción, que consistía en exponer tiras metálicas magnetostrictivas a un campo magnético cambiante generando de ese modo un movimiento vibratorio. Los aparatos de nuevo desarrollo se basan en la transducción de energía piezoeléctrica. Para ello se utilizan cristales que modifican sus dimensiones bajo tensión eléctrica para generar de este modo vibraciones mecánicas. La ventaja de la transducción piezoeléctrica es el movimiento lineal de la punta ultrasónica, que en las aplicaciones endodónticas es preferible a los movimientos elípticos. En general, estos aparatos funcionan con una frecuencia fija de ± 30 kHz y una intensidad variable (potencia en vatios/m2).
En los últimos 10 años ha surgido un interés renovado por el uso de los ultrasonidos en la endodoncia. Los progresos en el perfeccionamiento de puntas y aparatos ultrasónicos especiales han permitido ampliar el espectro de indicaciones. Actualmente se utilizan los ultrasonidos en el ámbito de la endodoncia con los siguientes fines:
Mejora del acceso endodóntico (por ejemplo, para la extracción de cálculos pulpares).
Irrigación de los conductos radiculares.
Extracción de pernos, de instrumentos fracturados y de otras obstrucciones.
Humectación de las paredes de los conductos radiculares con sellador.
Condensación de las obturaciones de conductos radiculares de gutapercha.
Aplicación de agregado trióxido mineral (MTA).
Intervenciones quirúrgicas apicales (apicectomías).
Aumento de la permeabilidad dentinaria en el blanqueamiento dental.
Mejora del acceso a los conductos radiculares
Entre las primeras fases del tratamiento endodóntico se encuentran la preparación de una cavidad de acceso primaria y de otra secundaria adecuadas y la localización y exposición de las entradas de los conductos radiculares.
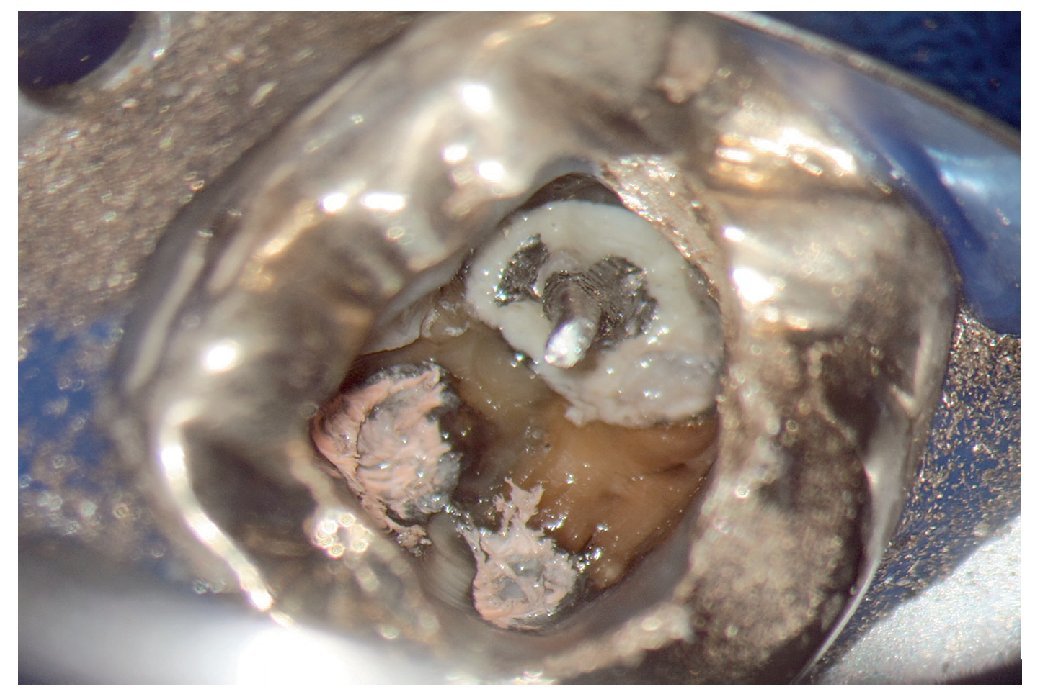
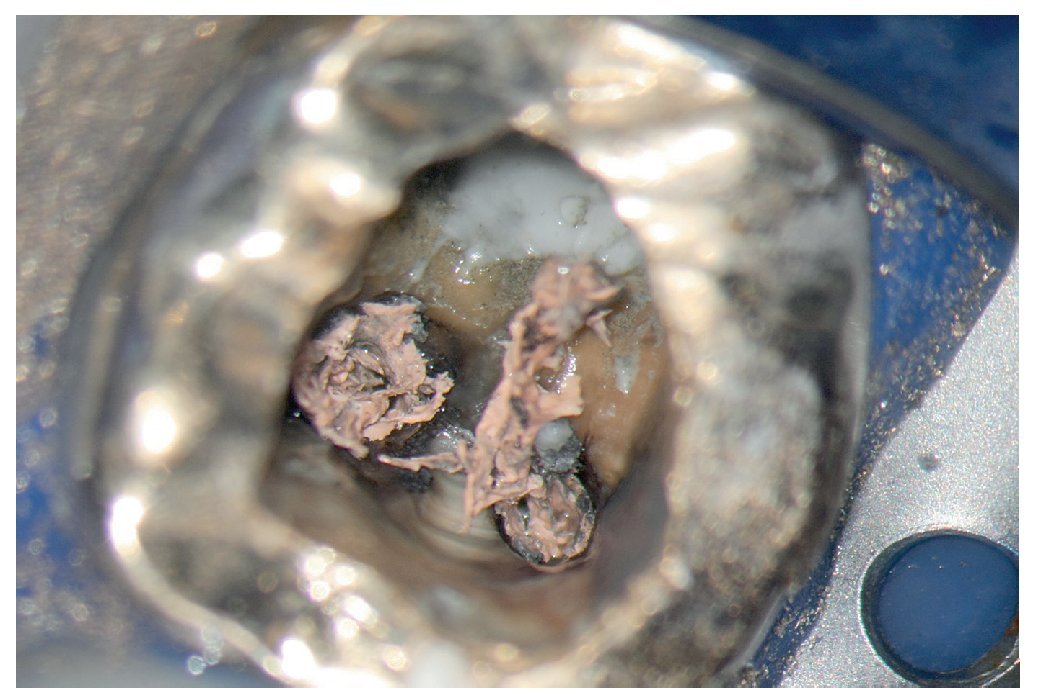
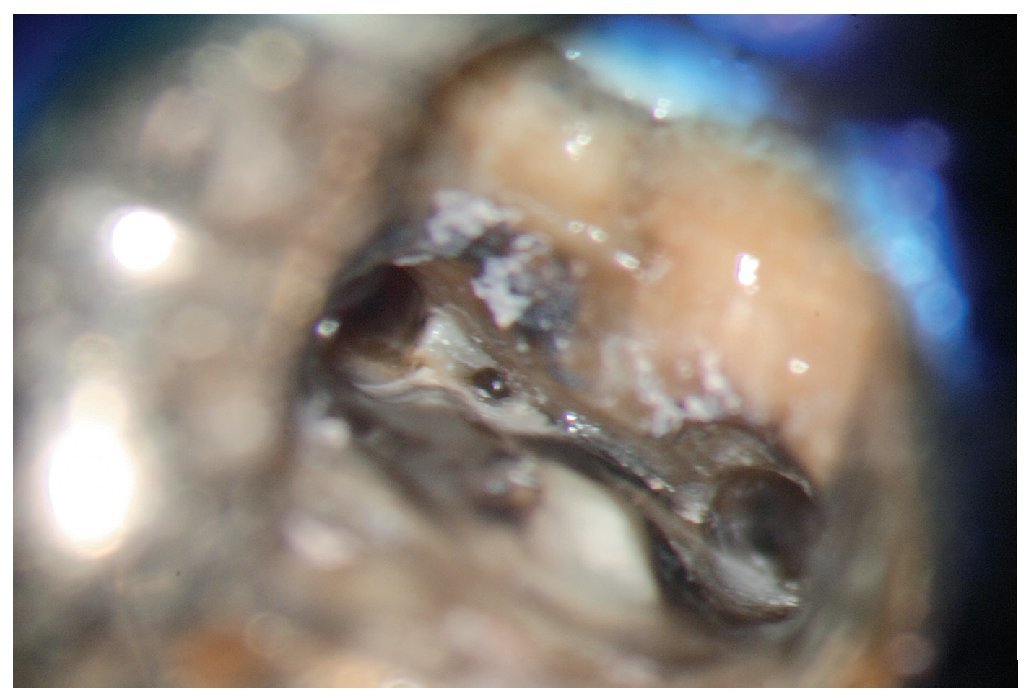
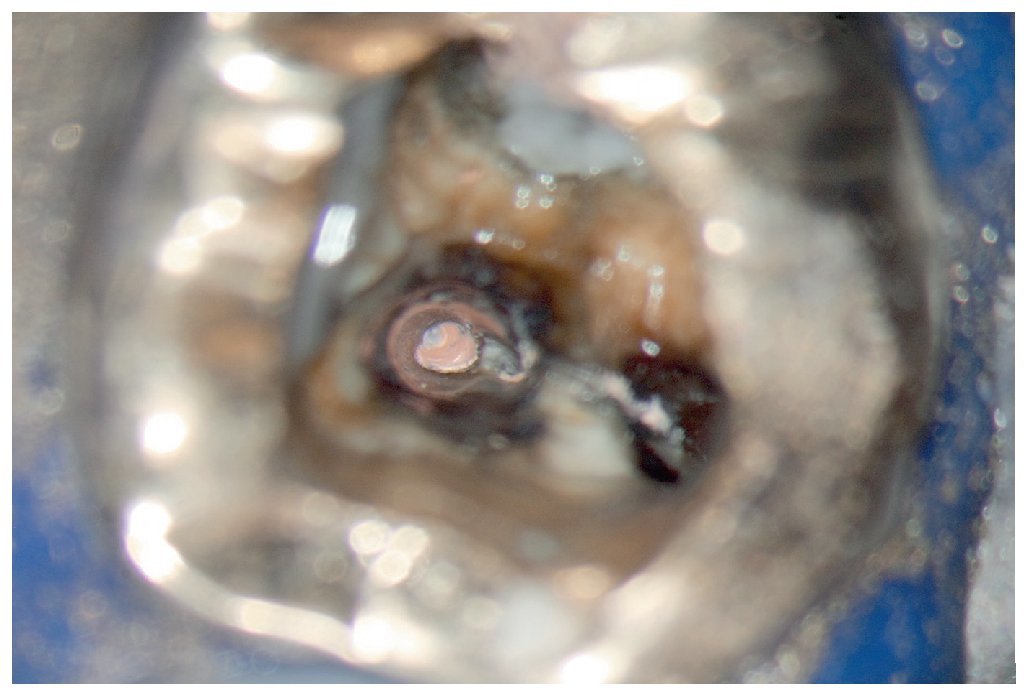
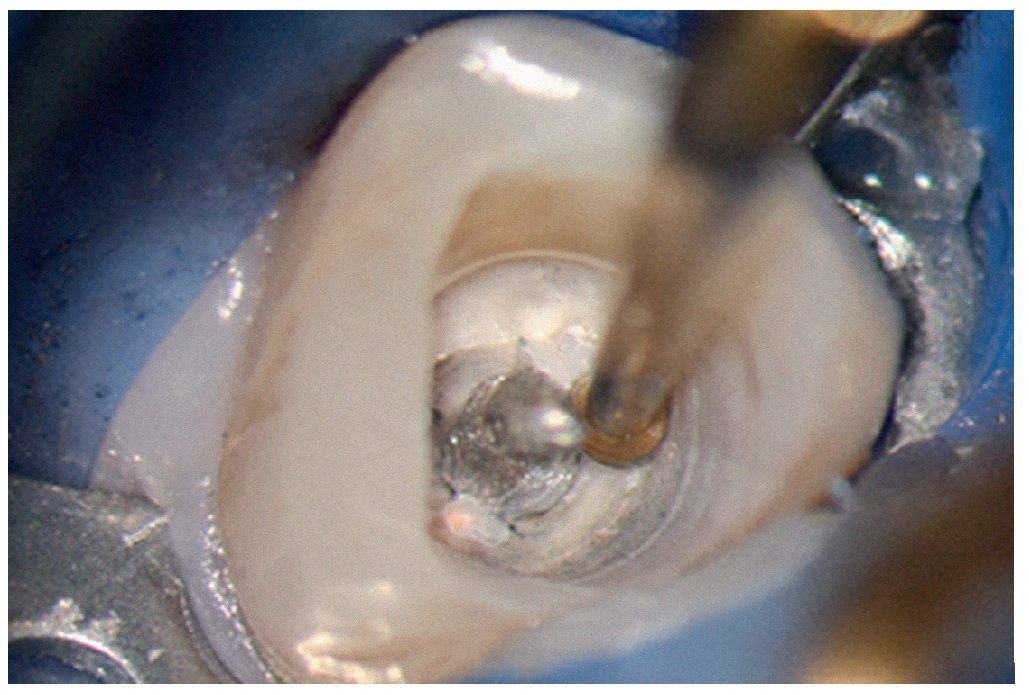
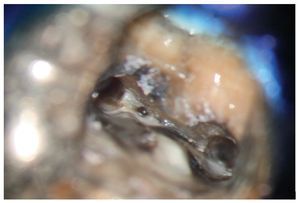
Esta tarea puede ser complicada dependiendo sobre todo de la región del maxilar, del estado de la pulpa y del tipo de restauración existente. Cualquier concesión que se haga en esta fase puede influir negativamente en el desarrollo posterior del tratamiento endodóntico15 (fractura de instrumentos, perforación, imposibilidad de exponer y preparar los conductos). El uso de instrumentos ópticos de aumento y una buena iluminación del campo de trabajo no siempre son suficientes. Si se trabaja con un microscopio óptico habrá que preparar la cavidad de acceso con visión indirecta, a través de un espejo, y muchas veces el contraángulo obstaculiza la visión directa sobre la cavidad de acceso22,39,44. En comparación con las fresas convencionales que se fijan al contraángulo, el uso de puntas ultrasónicas especiales mejora notablemente la visión de la zona en la que se ha de eliminar dentina o material de restauración (figs. 1a a 1d).
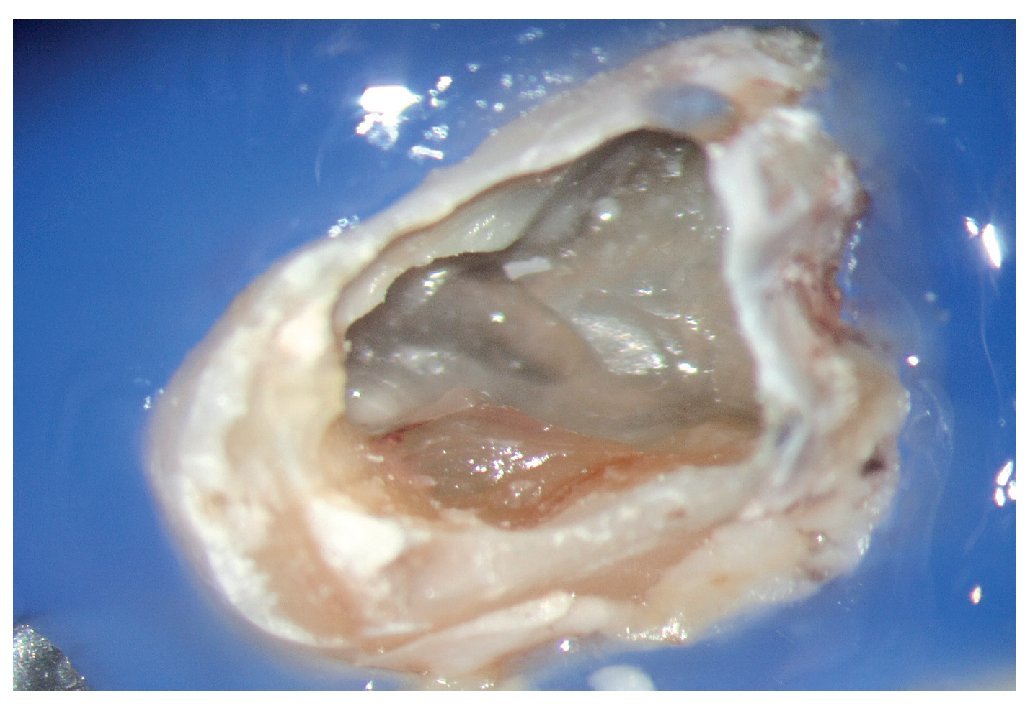
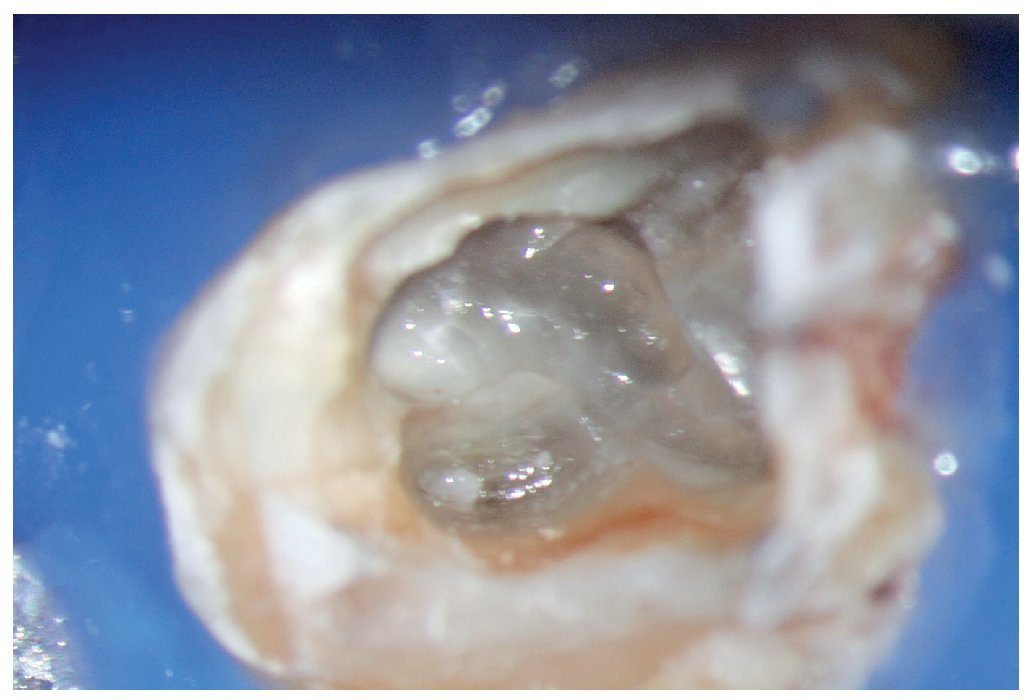
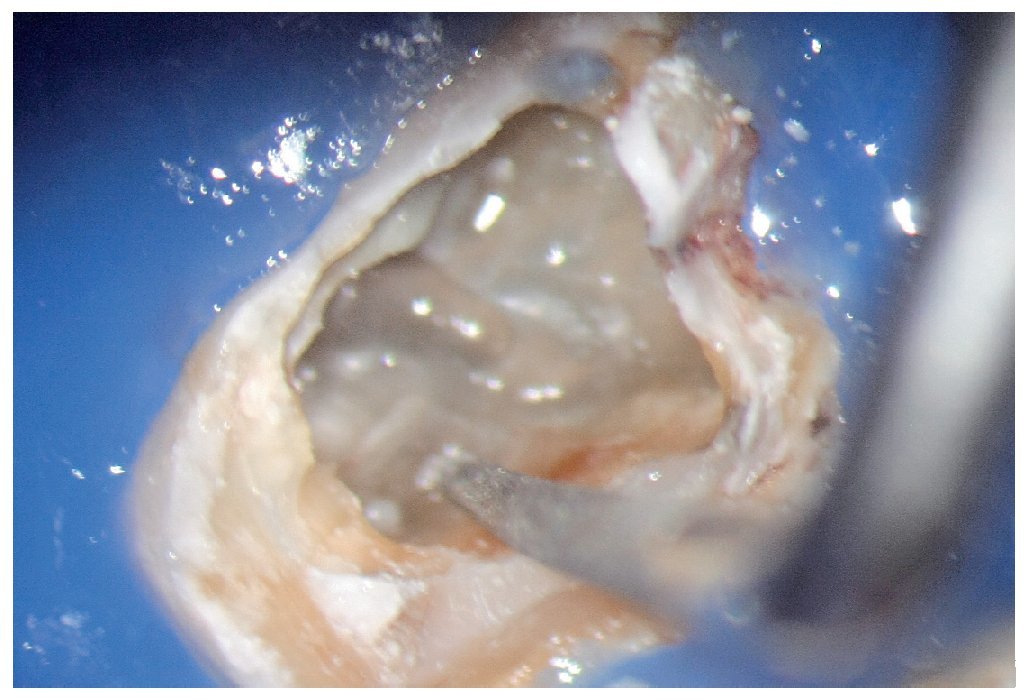
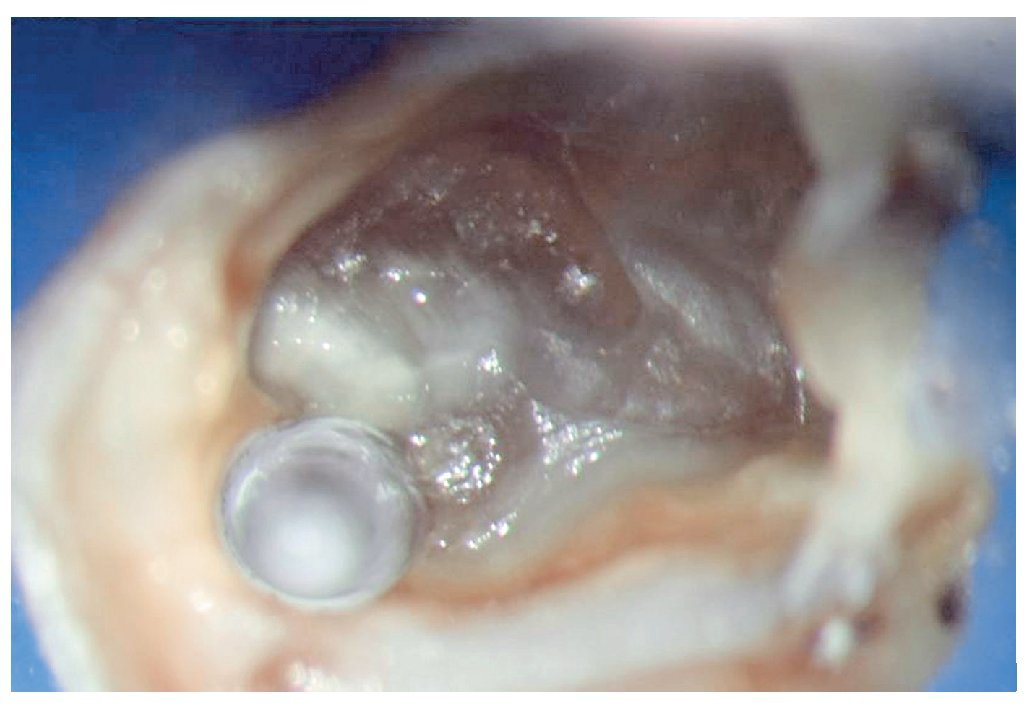
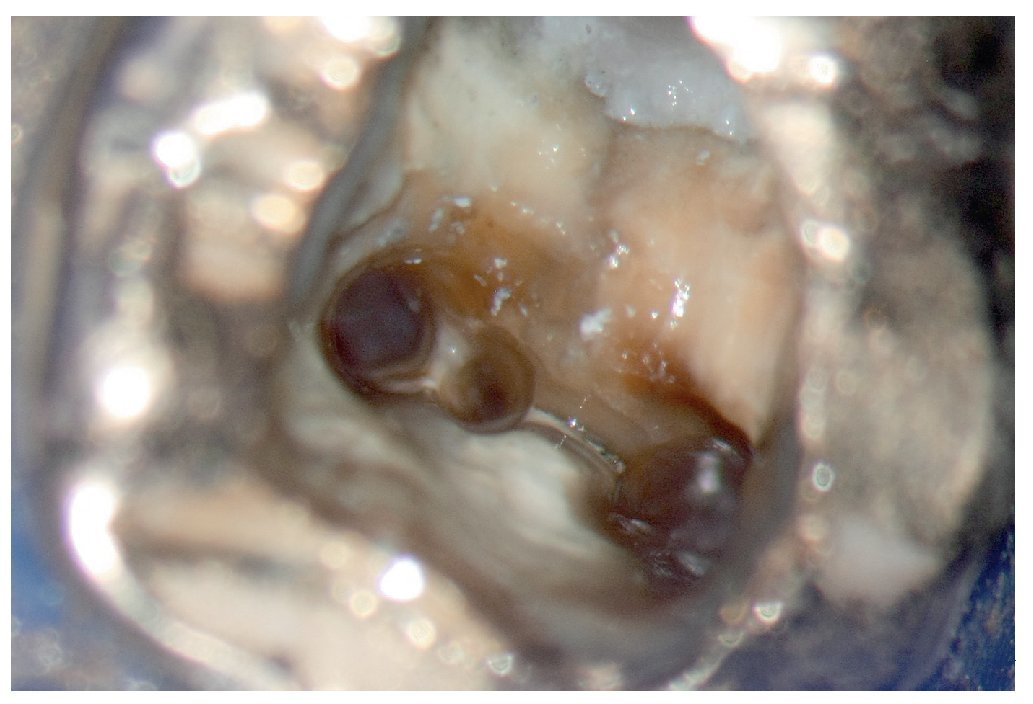
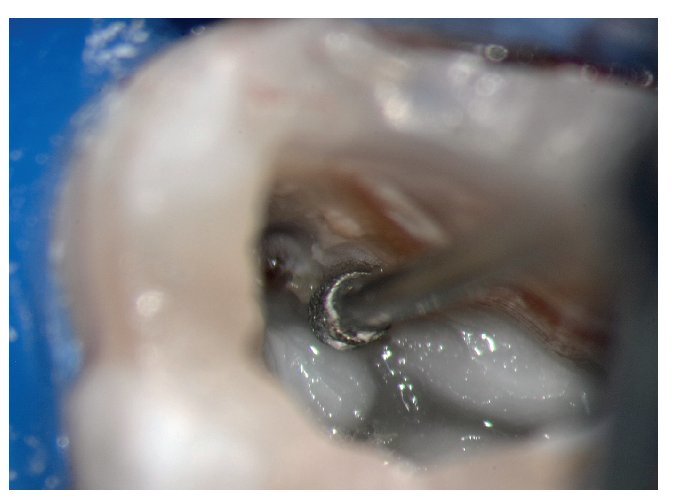
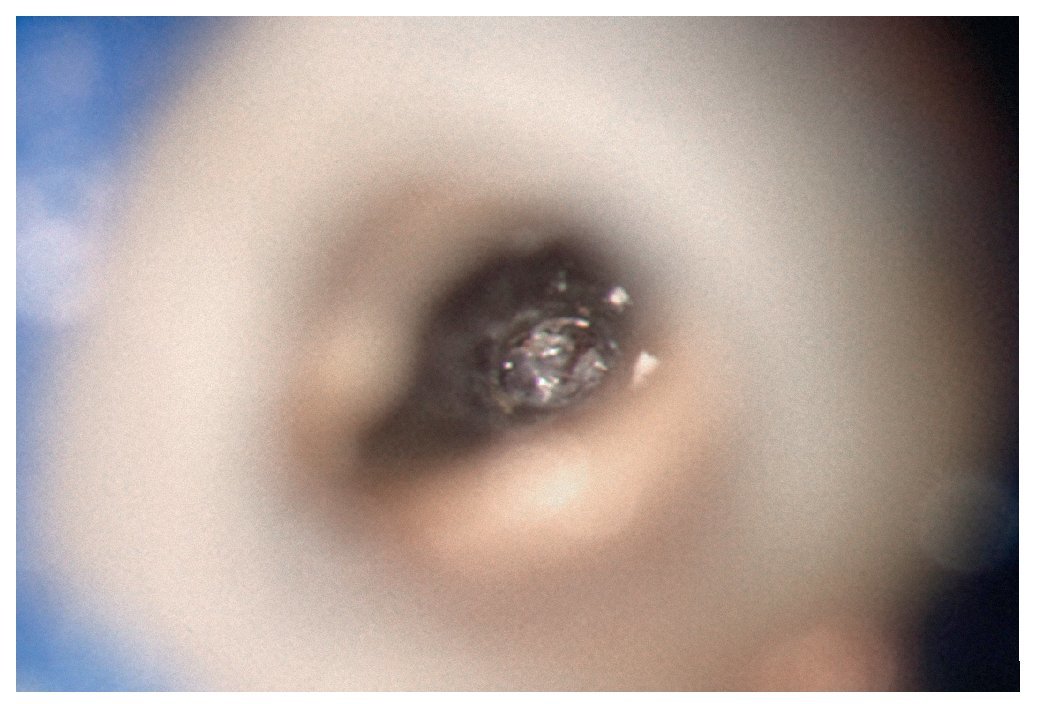
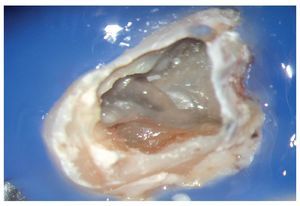
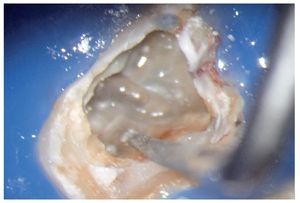
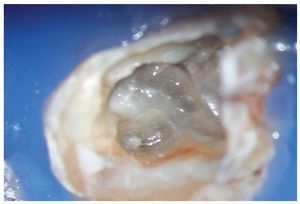
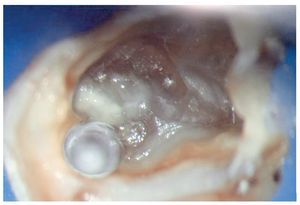
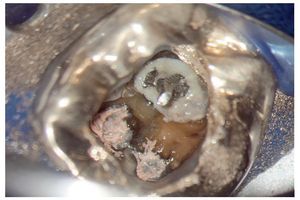
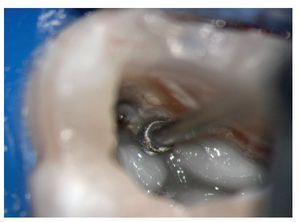
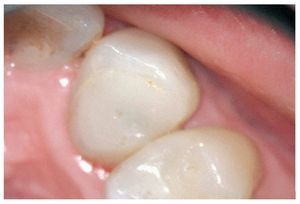
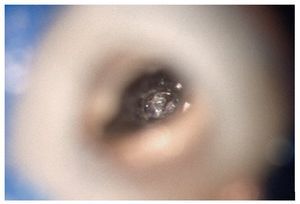
Figura 1a. Un cálculo pulpar obstruye la entrada del conducto radicular palatino del diente 16.
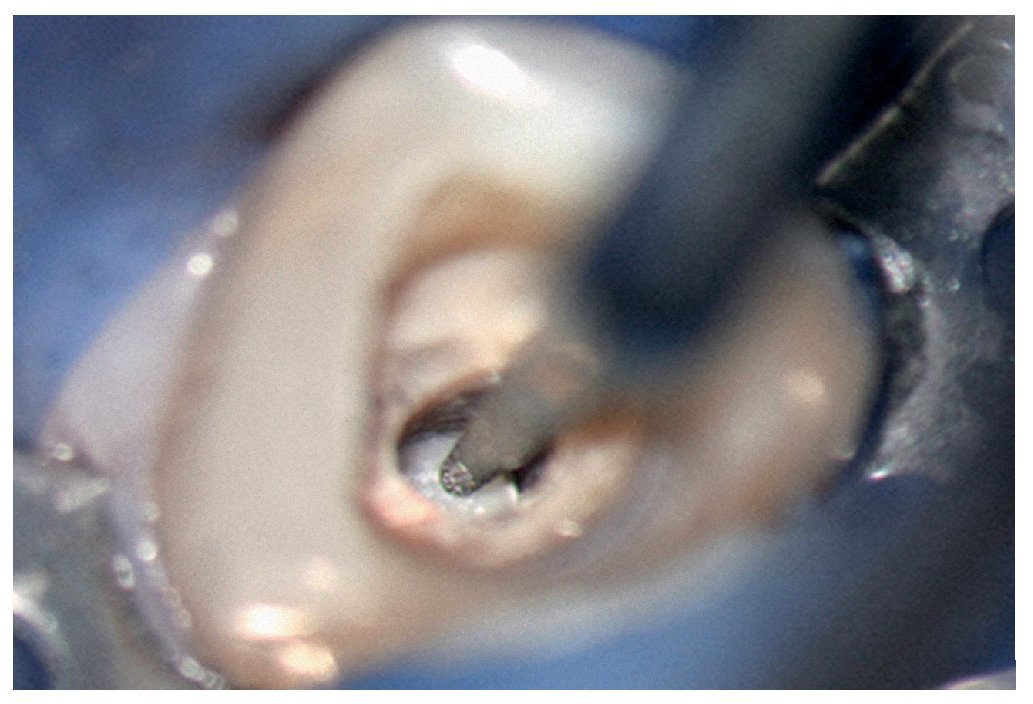
Figura 1b. Remoción del cálculo pulpar bajo visión directa con una punta ultrasónica diamantada.
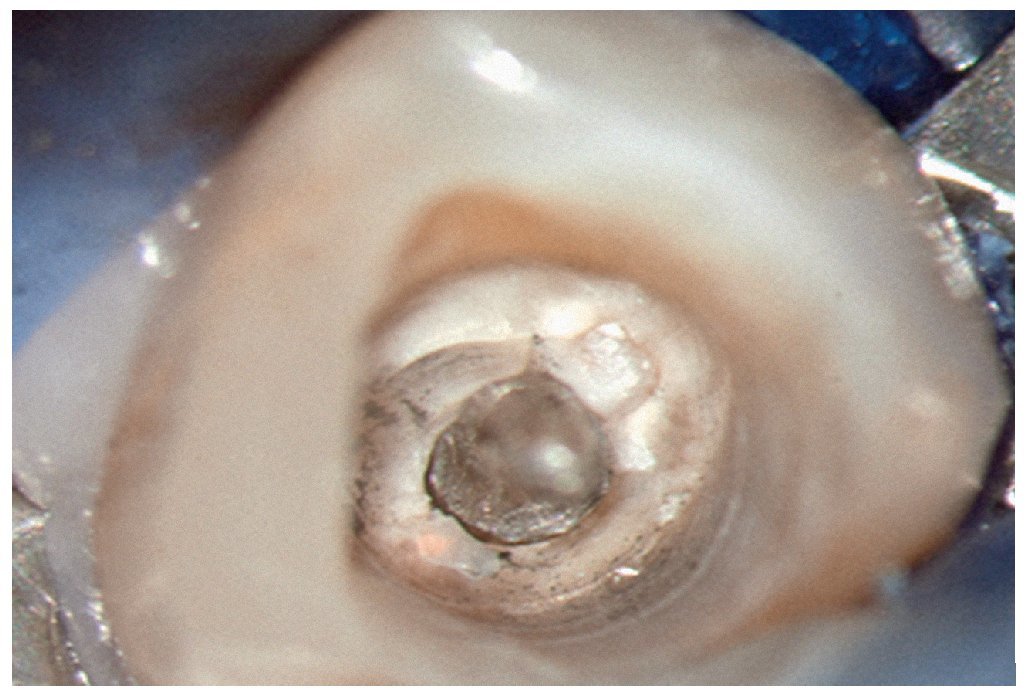
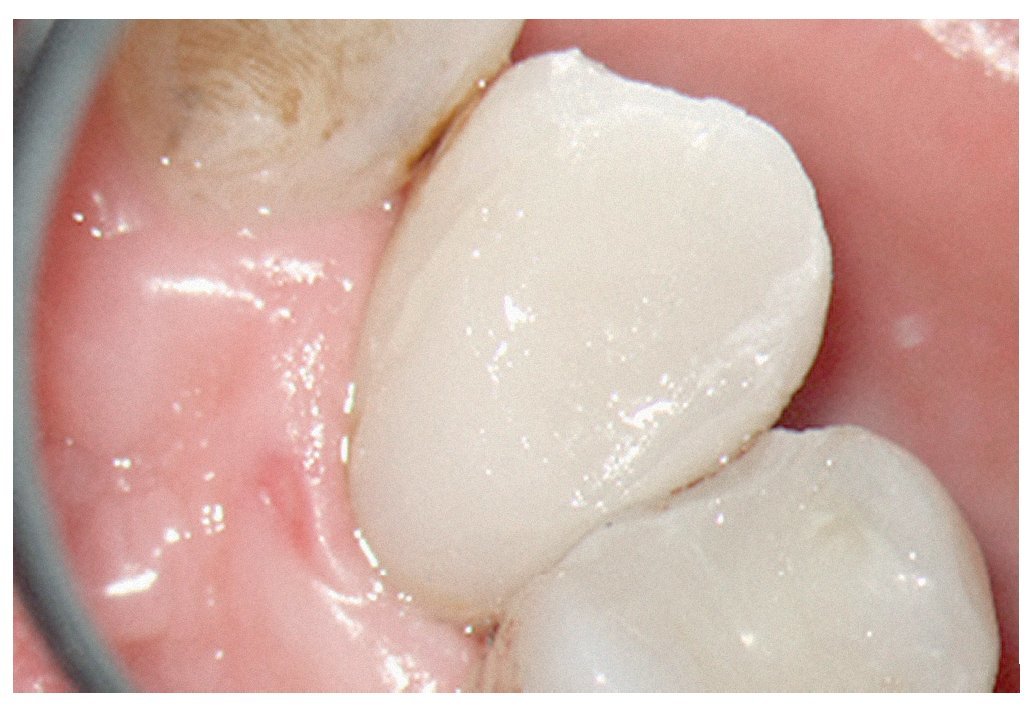
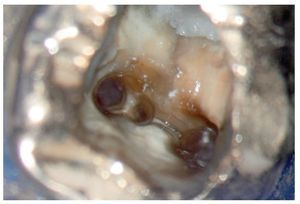
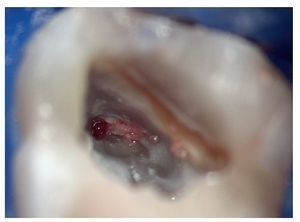
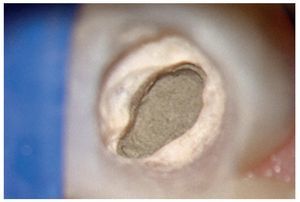
Figura 1c. El resultado del procedimiento ultrasónico. Entrada visible del conducto palatino.
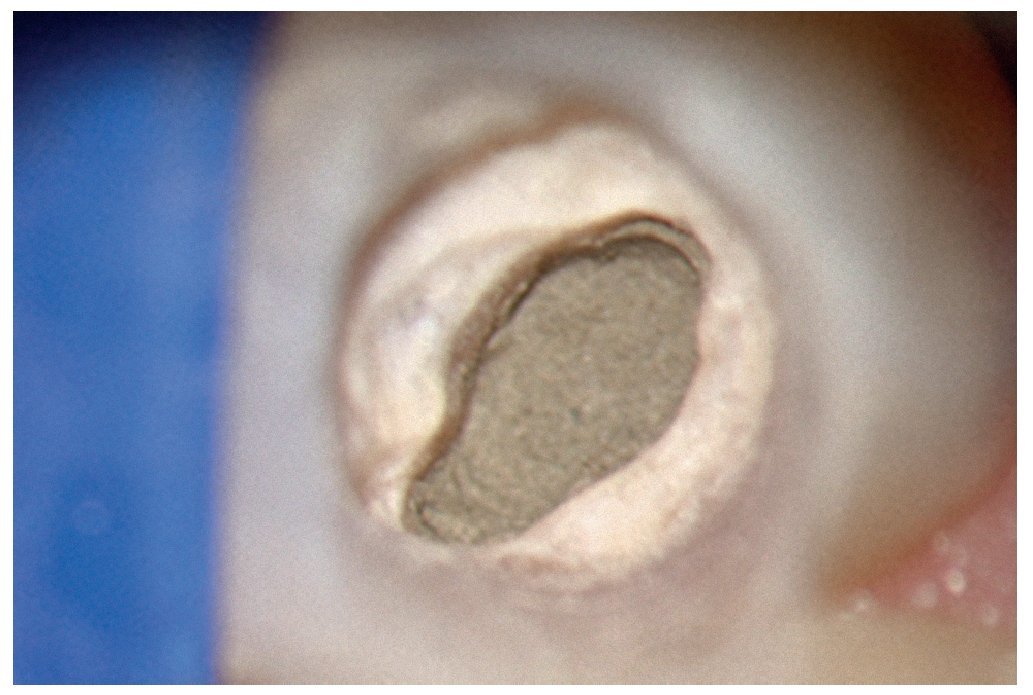
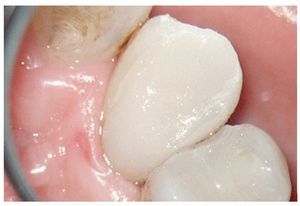
Figura 1d. La entrada del conducto palatino después de la preparación y la limpieza.
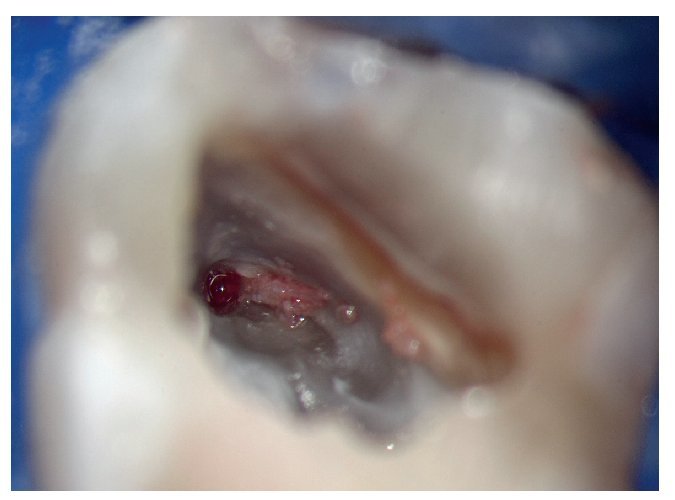
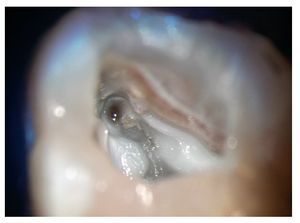
En la búsqueda de las entradas de los conductos radiculares se deben analizar e interpretar correctamente las estructuras anatómicas situadas en el suelo de la cámara pulpar (figs. 2 y 3). La dentina reparadora o las calcificaciones tienen una tonalidad más clara que el suelo de la cámara pulpar. Las entradas de los conductos se encuentran al final de las líneas de desarrollo de aspecto oscuro (en caso de existir), situadas en el suelo de la cámara pulpar29.
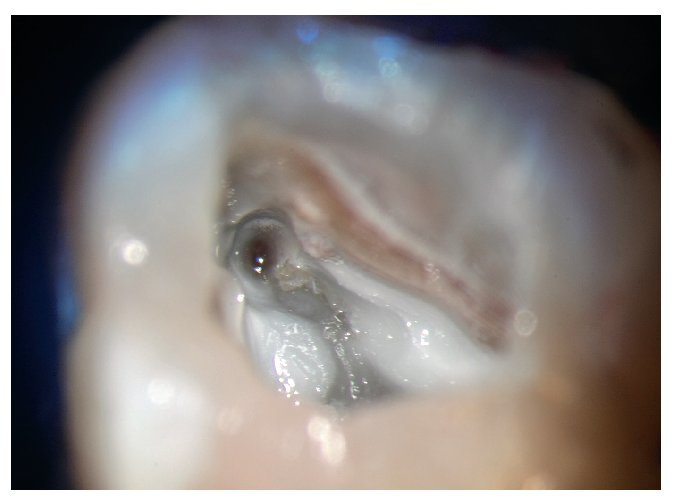
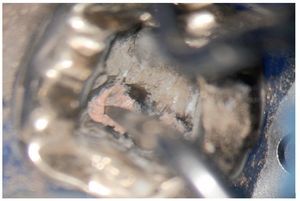
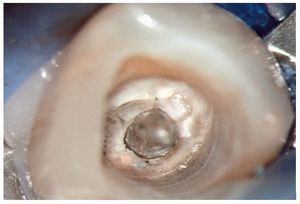
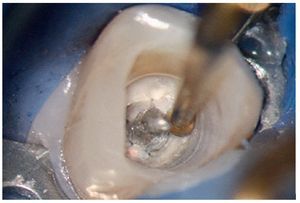
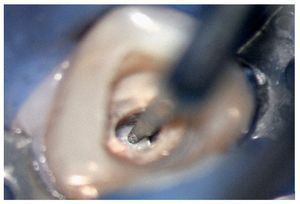
Figura 2a. Retratamiento del diente 36. Presencia de gutapercha en el conducto mesiovestibular y mesiolingual.
Figura 2b. La punta ultrasónica en contacto con la gutapercha.
Figura 2c. Eliminación de la gutapercha de la zona coronal.
Figura 2d. Resultado después del procedimiento ultrasónico.
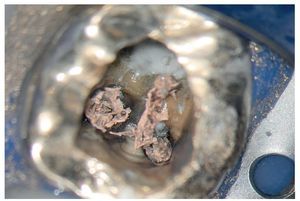
Figura 3a. Preparación del istmo entre el conducto mesiovestibular y el conducto mesiolingual en el diente 36.
Figura 3b. Exposición del conducto mesial medio entre el conducto radicular mesiovestibular y el conducto mesiolingual después de la preparación del istmo.
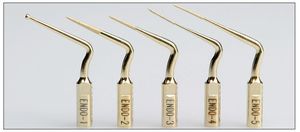
El uso de puntas ultrasónicas de distintas formas facilita la eliminación de los cálculos pulpares si éstos obstruyen la entrada del conducto radicular (figs. 1a a 1d). A pesar de que no rotan, cortan mejor y permiten un uso más fiable y más controlado37 (figs. 4 y 5).
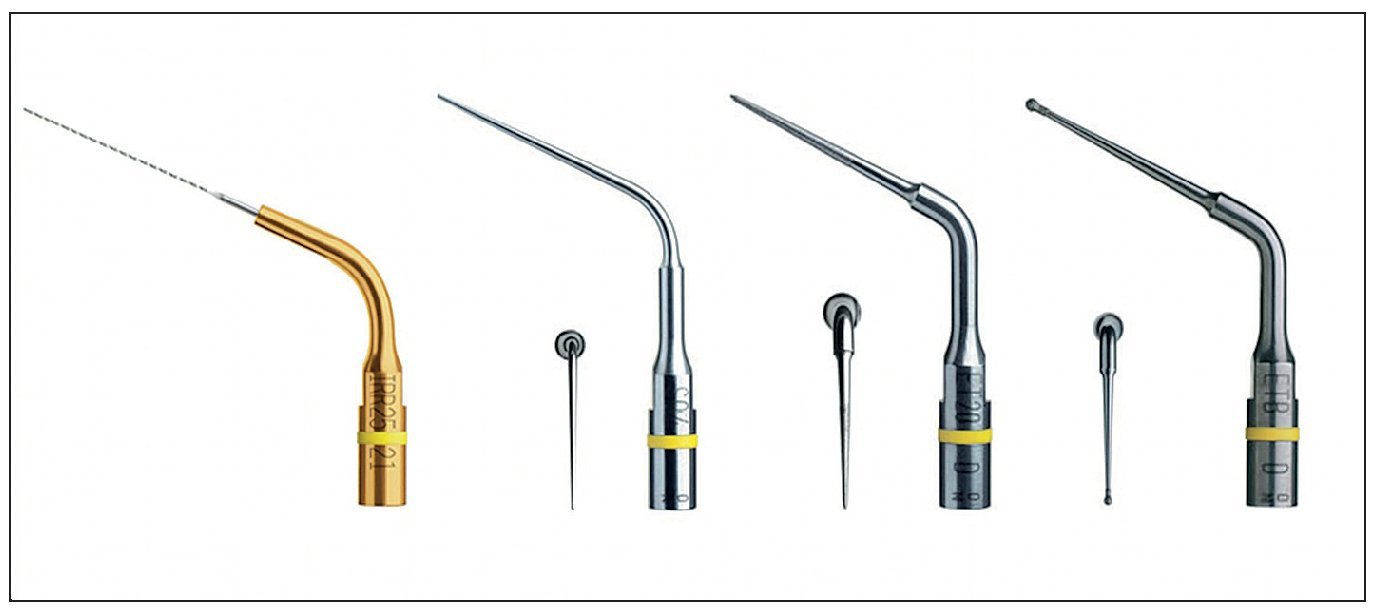
Figura 4. Puntas ultrasónicas para endodoncia y para retratamiento.
Figura 5. Puntas ultrasónicas para retratamiento endodóntico.
También se recomienda utilizar puntas ultrasónicas para localizar el segundo conducto mesiovestibular en los molares superiores. Para ello se ha de aplicar muchas veces el «procedimiento de avellanado». Este procedimiento consiste en eliminar con ultrasonidos las capas de dentina sobresalientes para poder despejar totalmente la entrada del segundo conducto mesiovestibular, que en ocasiones se localiza en la raíz a una profundidad de 1 a 3 mm30 (figs. 6 a 8).
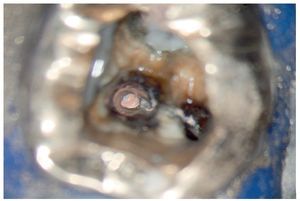
Figura 6. Anatomía del suelo de la cámara pulpar del diente 26 con exposición de la entrada del conducto radicular mesiovestibular y ampliación en forma de ranura de la preparación hacia palatino para localizar el segundo conducto mesiovestibular.
Figura 7. Uso de una punta ultrasónica diamantada para la exposición de la entrada del segundo conducto mesiovestibular.
Figura 8. Después de la aplicación de la punta ultrasónica se expone tejido vital en la ranura preparada.
Irrigación de los conductos radicularesLa desinfección y la instrumentación del sistema de conductos radiculares constituyen fases importantes del tratamiento endodóntico. Sin embargo, la anatomía compleja del diente impide una limpieza completa del sistema de conductos radiculares sólo con limas y ensanchadores35. Este problema no se puede solucionar ni siquiera con instrumentos de níquel-titanio de última generación. Además, la instrumentación produce barrillo y restos dentinarios en el conducto radicular que deben ser eliminados mediante irrigación26. Por consiguiente, la irrigación sigue siendo un componente importante del tratamiento endodóntico24.
En la irrigación ultrasónica pasiva se coloca en el centro y siempre que sea posible sin contacto con la pared del conducto radicular preparado una lima pequeña, oscilante, adaptada al trayecto del conducto o un alambre liso (como ISO 15 o 20) para transmitir con la máxima eficiencia posible la energía de la lima al irrigante. De este modo se generan efectos de microflujo acústico y/o de cavitación2,40. El irrigante puede circular a través del conducto radicular preparado y la lima o el alambre pueden vibrar con relativa libertad. La lima incluye nodos y vientres de vibración. Esto también es válido para limas precurvadas y explica en parte la eficacia de irrigaciones ultrasónicas pasivas en conductos curvos33.
Las irrigaciones ultrasónicas pasivas con hipoclorito sódico (NaOCl) como irrigante eliminan más residuos, gérmenes y tejido pulpar que las irrigaciones con jeringa51. El NaOCl es más eficaz que el agua50 en la irrigación ultrasónica pasiva, dado que la activación ultrasónica potencia su efecto antibacteriano y su efecto histolítico por calentamiento12 y patrones de flujo activos54. Existen tres métodos de irrigación ultrasónica pasiva. El primer método consiste en un flujo de irrigante continuo desde la pieza de mano ultrasónica hasta la cámara pulpar. En el segundo método, el flujo de irrigante continuo pasa a través de una aguja activada con ultrasonidos. La tercera variante es un método de irrigación intermitente que consiste en la inyección manual del irrigante en el conducto radicular y en la renovación del mismo después de cada activación ultrasónica.
Las bacterias, los residuos o el tejido orgánico que se desprenden de la pared del conducto radicular durante la activación ultrasónica se absorben o disuelven en el irrigante34,57. A continuación, se irriga el conducto con 2 ml de irrigante nuevo para eliminar los residuos. En las condiciones de la técnica de irrigación intermitente (duración de la irrigación 1 min y renovación del NaOCl después de cada activación ultrasónica de 20 s), ésta parece proporcionar mejores resultados en lo que se refiere a la eliminación de residuos del conducto radicular que la irrigación continua de la cámara pulpar55. La aplicación del flujo de líquido continuo en el conducto radicular mediante una aguja activada con ultrasonidos proporciona resultados comparables a los obtenidos con la técnica de irrigación intermitente27.
En la irrigación continua de la cámara pulpar, el diámetro de preparación del conducto pulpar influye en la eficacia con la que se eliminan los residuos. Es más fácil eliminar los residuos de un conducto radicular preparado a tamaño ISO 20 con una conicidad del 10% que de un conducto radicular del mismo tamaño ISO pero con conicidades menores, por ejemplo, del 8% o del 6%23. Un alambre no cortante o liso es tan eficaz como una lima con bordes cortantes, pero tiene la ventaja de no actuar sobre la pared del conducto, con lo que se pueden evitar perforaciones y otras complicaciones en la zona apical del conducto52.
Las soluciones de NaOCl son criticadas con frecuencia por provocar la acumulación de productos de corrosión en el depósito del aparato de ultrasonidos y la obstrucción e incluso corrosión por sales de sodio de los tubos que transportan el líquido a través del sistema. El aparato, el sistema de tubos y la pieza de mano deben ser lavados con agua desmineralizada después de cada ciclo de irrigación con NaOCl. En general, los aparatos actuales no dan problemas siempre que se efectúe un mantenimiento correcto y se utilicen concentraciones de NaOCl no superiores al 5%.
Activación del irrigante: ¿ultrasónica o sónica?
Los aparatos de sonido audible trabajan a frecuencias más bajas (100 a 6.000 Hz) que los aparatos de ultrasonidos (25.000 Hz). En ambos aparatos, la lima está firmemente sujeta en un ángulo de 60-90º respecto al eje longitudinal de la pieza de mano. Las diferencias residen en los patrones de vibración de los instrumentos. Las limas accionadas por ultrasonidos presentan numerosos nodos y vientres de vibración en sentido longitudinal, mientras que los instrumentos sónicos muestran un único nodo de vibración cerca del encaje de la lima y un vientre de vibración en la punta de la lima. Los instrumentos sónicos dan lugar a un movimiento lateral elíptico, por lo que se asemejan a las limas ultrasónicas de tipo magnetostrictivo. En algunos aparatos sónicos se puede influir en el movimiento de la lima de modo que el movimiento lateral queda anulado y las vibraciones restantes se orientan en sentido longitudinal. Si bien no se dispone de evidencias científicas confirmadas, en teoría, este movimiento longitudinal podría facilitar el proceso de irrigación. Los ultrasonidos son más eficaces que los sonidos audibles para eliminar los residuos del conducto radicular27, presumiblemente porque las frecuencias más altas potencian los efectos del flujo acústico y de la cavitación51. Sin embargo, los dos sistemas parecen tener una eficacia similar en lo que se refiere al recambio del irrigante en los conductos laterales17.
Se pueden hacer las recomendaciones clínicas siguientes en relación con la irrigación ultrasónica:
Se recomienda NaOCl como irrigante.
Posibilidad de aplicar un flujo de irrigante continuo en la cámara pulpar (irrigación durante 3 min por conducto, posibilidad de disminuir el volumen de irrigante a 15 ml/min).
Posibilidad de aplicar un flujo de irrigante continuo en el conducto radicular mediante una aguja (irrigación durante 1 min por conducto).
En caso de utilizar el método de irrigación intermitente, se recomienda irrigar cada conducto durante 1 min con una triple activación ultrasónica de 10 a 20 s respectivamente y un triple recambio del irrigante con 2 ml de NaOCl por recambio.
Se debería utilizar una lima no cortante, lo más fina posible (ISO 15 o 20) o un alambre de grosor reducido.
De utilizar limas o alambres sin efecto cortante, se puede introducir el instrumento hasta una distancia de 1 mm de la longitud de trabajo.
En caso de conductos curvos se deberá precurvar el instrumento y colocarlo a 1 mm en coronal del primer punto de resistencia perceptible.
Una pregunta que se plantea frecuentemente es si los aparatos ultrasónicos integrados en las unidades dentales son adecuados también para la activación del irrigante. Sin duda, la respuesta es afirmativa, si bien se recomienda cerrar la entrada de agua. Si esto no es posible, se recomienda utilizar el método de irrigación intermitente. Es improbable que en los 10-20 s que dura la activación el agua procedente de la unidad dental desplace el NaOCl del conducto radicular. Si no se dispone de instrumentos no cortantes, puede realizarse la activación con una lima fina (ISO 10 o 15) o con un espaciador, que se pueden introducir manualmente en el conducto radicular y poner posteriormente en contacto con una punta ultrasónica como las que se utilizan normalmente para la remoción de cálculo.
Retirada de pernos, instrumentos fracturados y otras obstrucciones
Pernos
La técnica ultrasónica sirve también para retirar pernos de diversos tipos e instrumentos fracturados de los conductos radiculares. La retirada de pernos supone un gran desafío para el odontólogo, ya que el riesgo de complicaciones intraoperatorias, como perforaciones o fracturas radiculares, es alto3,7,47,60.
La aplicación del aparato ultrasónico para esta finalidad depende, entre otros factores, del tipo de perno y del cemento utilizados8,64. Aunque los pernos de fibra de vidrio actuales son más fáciles de extraer, hacen falta para ello un campo visual despejado e instrumentos de aumento, dado que por su color los pernos son difíciles de distinguir del tejido duro dentario37. En este caso se recomienda el uso de juegos de fresas o puntas ultrasónicas especiales18,32.
En el cementado adhesivo con composite, los ultrasonidos son poco eficaces, dado que no son capaces de generar las microfracturas que provocan en los cementos convencionales36. En esta situación cobra fuerza el argumento de que los ultrasonidos son más eficaces en ausencia de agua20, dado que la adherencia de un composite disminuye con los termociclos56. Se considera que el uso de puntas ultrasónicas con irrigación de agua integrada también es desfavorable, porque el flujo de agua a lo largo del instrumento ultrasónico atenúa las vibraciones y reduce el rendimiento de la punta. Dado el diámetro reducido de los instrumentos ultrasónicos, se debilitan por la integración adicional de una irrigación de agua y se fracturan con mayor facilidad. Además, el agua se mezcla con el polvo dentinario para formar un barrillo que dificulta la visión42.
La aplicación de ultrasonidos a un perno durante más de 15 s sin refrigeración por agua provoca un aumento de la temperatura en la superficie radicular10. Por lo tanto, muchos autores recomiendan utilizar un chorro de agua refrigerante de aproximadamente 30 ml/min10,19.
La retención de pernos fijados con cemento de fosfato de cinc o de vidrio ionómero disminuye un 39% y un 33% respectivamente después de la aplicación de ultrasonidos durante 10 min21.
Se recomienda rebajar la parte coronal del muñón hasta que tenga la misma medida que el diámetro intraconducto para la remoción del perno-muñón confeccionado en el laboratorio dental41. La punta aplicada en sentido antihorario no debe ser excesivamente larga, pero sí tener un cierto diámetro para asegurar un contacto estrecho con el perno y evitar la aparición de fracturas42 (fig. 9e). Las comunicaciones en la bibliografía permiten concluir que normalmente es posible extraer un perno en un plazo de 10 min una vez retirado todo el material de restauración situado alrededor del segmento coronal11,64.
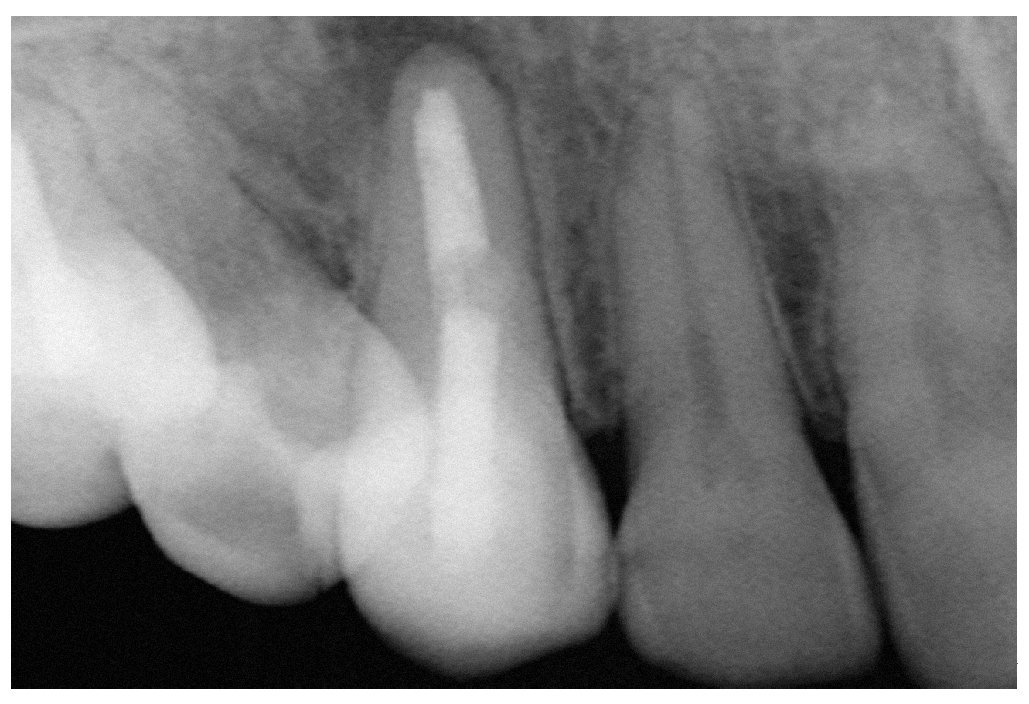
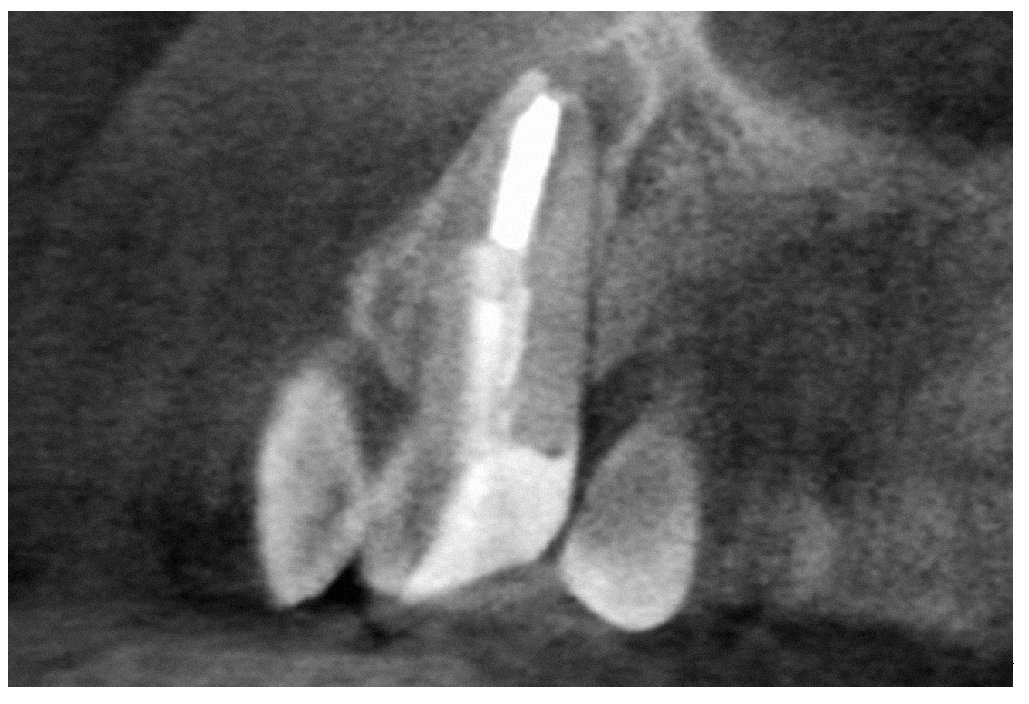
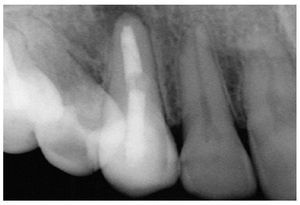
Figura 9a. Radiografía del diente 13 con perno metálico y periodontitis apical.
Figura 9b. La tomografía computarizada de haz cónico muestra la posición del perno en el conducto radicular desde mesial.
Figura 9c. Imagen clínica del diente antes del tratamiento.
Figura 9d. Eliminación del composite alrededor del perno.
Figura 9e. Aplicación de la punta ultrasónica directamente en el segmento coronal del perno.
Figura 9f. Eliminación de la capa de cemento en apical del lugar de introducción del perno.
Figura 9g. Visión directa sobre el ápice abierto.
Figura 9h. Aplicación de MTA con uso de vibraciones ultrasónicas indirectas.
Figura 9i. Restauración coronal después del tratamiento endodóntico.
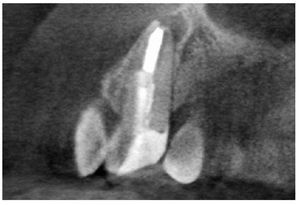
Figura 9j. Radiografía postoperatoria. No fue necesario utilizar un perno.
Los pernos cerámicos o de óxido de zirconio no se pueden extraer o, en todo caso, con grandes dificultades, por lo que el odontólogo debe sopesar cuidadosamente las ventajas y los inconvenientes antes de cementar este tipo de pernos43.
Instrumentos fracturados
El pronóstico endodóntico de un diente con presencia de instrumentos fracturados en el conducto radicular depende del estado del tejido periapical16,23. Una comparación de la supervivencia de dientes con y sin fragmentos en el conducto radicular proporcionó una tasa de éxito del 87% frente al 93% en presencia de una radiolucidez periapical y del 92% frente al 94,5% en ausencia de radiolucidez46.
La extracción de un instrumento fracturado puede ser una operación muy laboriosa en función de su localización en el conducto radicular y, lo que es peor, puede exigir sacrificar una cantidad importante de sustancia dentaria sana. Dado que los dientes dañados tienen una mayor predisposición a las fracturas62, convendría reflexionar si es mejor renunciar a la extracción de los fragmentos localizados en el tercio apical45.
Otro factor importante para el éxito de la extracción es saber en qué material están fabricados los fragmentos fracturados. Los instrumentos de níquel-titanio suelen mostrar puntos de fractura más profundos en el conducto debido a la producción de calor por efecto de las puntas ultrasónicas14. Por ello se debería ajustar la intensidad de los aparatos ultrasónicos con prudencia y seguir las instrucciones del fabricante. Se recomienda a facultativos inexpertos que practiquen el procedimiento en dientes exodonciados.
En la bibliografía se recomienda crear un hombro o una plataforma de trabajo a la altura de la cabeza del fragmento mediante fresas de Gates-Glidden modificadas (n.º 3 o 4)41,42. Sin embargo, esto conlleva el riesgo de debilitar o incluso perforar la raíz.
En un futuro próximo se incorporará la tomografía computerizada de haz cónico (TCHC) a la endodoncia. Con esta técnica de imagen se podrá obtener información detallada de la anatomía del diente en los tres planos del espacio. Esto permitirá pronosticar con mayor fiabilidad la posibilidad de una extracción segura de los fragmentos de un instrumento fracturado. Sin embargo, aunque se disponga de una reconstrucción tridimensional del diente, el procedimiento seguirá siendo un gran reto y ha de realizarse únicamente con los instrumentos de aumento adecuados y una iluminación suficiente.
Humectación del conducto radicular con cemento o sellador
La humectación completa y uniforme de la pared del conducto radicular con cemento o sellador se considera muy importante, ya que se trata del elemento de unión entre la gutapercha y la pared del conducto. En otras técnicas, en cambio, se condensa la gutapercha (por ejemplo, mediante condensación vertical) y se comprime el sellador hasta que sobresale del conducto radicular, lo que impide controlar la humectación de la pared del conducto radicular con sellador59. También hay que decir que es muy complicado conseguir una humectación uniforme y completa del conducto radicular y que, hoy por hoy, no se sabe qué técnica es la más adecuada. No existen estudios basados en la evidencia al respecto que también analicen variables como la viscosidad de los distintos selladores49.
El uso de limas ultrasónicas oscilantes es un método para introducir el sellador en el conducto radicular. En este momento no se pueden hacer recomendaciones generalizadas relativas a esta técnica, dado que las publicaciones disponibles ofrecen opiniones contradictorias1,25,58,59.
Condensación de gutapercha
Los espaciadores activados por ultrasonidos constituyen un medio útil para la termoplastificación de la gutapercha durante la obturación del conducto radicular. Las vibraciones ultrasónicas y el calor generado por las mismas proporciona una densidad igual o superior de la gutapercha condensada en comparación con un espaciador calentado de forma convencional5. Una ventaja de la obturación asistida por ultrasonidos es que la gutapercha no se pega al espaciador, lo que facilita mucho el aprendizaje del procedimiento.
La obturación ultrasónica es el procedimiento más adecuado para la condensación lateral si se utiliza gutapercha como material de obturación5,6. La ventaja principal es la posibilidad de controlar con precisión la profundidad de obturación apical. Después de la humectación del conducto radicular con sellador, se introduce la punta maestra de gutapercha hasta la longitud de trabajo y se condensa lateralmente con un espaciador digital. A continuación, se introduce una segunda punta complementaria. Posteriormente se termoplastifica la gutapercha con un espaciador activado por ultrasonidos durante aproximadamente 2 a 6 s en función de la intensidad ajustada en el aparato utilizado. El tiempo puede variar dependiendo del aparato ultrasónico, aunque normalmente suele ser suficiente una intensidad baja a media. La intensidad baja tiene la ventaja de provocar un calentamiento mínimo de la gutapercha, por lo que el aumento de volumen es menor. A continuación, se introduce una nueva punta de gutapercha en el conducto radicular y se termoplastifica nuevamente con el espaciador activado por ultrasonidos. Este procedimiento se repite cuanto sea necesario hasta la obturación completa del conducto radicular. La termoplastificación y la condensación apical de la gutapercha se logran situando la primera vez el espaciador a 1 mm de la longitud de trabajo. Con cada nueva introducción de puntas de gutapercha, el espaciador penetra a menor profundidad en el conducto radicular. Este procedimiento proporciona una masa de gutapercha más condensada en comparación con la condensación lateral en frío. La técnica requiere menos tiempo y su aprendizaje es más fácil, dado que la gutapercha no se pega al espaciador.
No existen estudios basados en la evidencia que muestren que la compactación de la gutapercha proporcione obturaciones radiculares más densas o tratamientos endodónticos con mejores resultados. Por ello se describe aquí un método asistido por ultrasonidos sin compactación de la gutapercha en el conducto radicular. En este procedimiento se inserta la punta maestra después de introducir el sellador en el conducto radicular. Se debería percibir una resistencia en el ápice radicular («tug back») de modo que en el momento de la obturación la punta no pueda atravesar el foramen apical. A continuación, se introducen una o más puntas de gutapercha pequeñas (ISO 20) de forma pasiva en el conducto radicular hasta su obturación completa. La o las puntas se pueden separar después fácilmente con un espaciador activado por ultrasonidos a alta intensidad. Posteriormente se extrae la gutapercha con el espaciador activado por ultrasonidos ajustado a baja o media intensidad de los 3 mm coronales del conducto radicular. Se termoplastifica la gutapercha remanente y se condensa hacia apical con un atacador. Dado que las puntas de gutapercha no se termoplastifican en el conducto radicular, la punta maestra debe quedar ajustada en apical («tug back») para evitar su extrusión a través del foramen apical durante este paso de trabajo. Se introduce un material adhesivo en el segmento coronal de 3 mm del conducto radicular para evitar posibles filtraciones coronales.
Aplicación de MTA
Se recomienda también el uso de ultrasonidos para la aplicación de MTA en el conducto radicular61. Se obtuvieron obturaciones más densas después de la aplicación indirecta de una punta ultrasónica63. Para condensar el MTA se puso la punta en contacto directo con un atacador. Sin embargo, las imágenes radiográficas y de microscopia óptica obtenidas en un estudio anterior mostraron resultados mejores para la condensación manual de MTA en comparación con la técnica ultrasónica4. De acuerdo con los resultados de otro estudio, el uso de ultrasonidos proporcionó una mayor impermeabilidad del MTA a la invasión bacteriana31.
Esta técnica requiere tomar precauciones especiales en los casos de ápice abierto, dado que existe la posibilidad de paso de grandes cantidades de MTA al tejido periapical9. Después de introducir y condensar los primeros milímetros de MTA en la zona apical, se recomienda realizar un control radiográfico para evaluar la profundidad de adaptación y la densidad de obturación (fig. 9h).
Cirugía periapical
La instrumentación retrógrada es complicada en las intervenciones quirúrgicas periapicales dada la limitación del campo visual. En comparación con las puntas ultrasónicas, el tamaño de los contraángulos y de las fresas convencionales es considerable, por lo que obstaculizan la visión y también el acceso al área de trabajo. Los microscopios quirúrgicos mejoran la visión, pero requieren el uso de instrumentos especiales. Las puntas ultrasónicas son de menor tamaño y permiten una aplicación precisa también bajo el microscopio quirúrgico. Los distintos recubrimientos (óxido de zirconio, de diamante) proporcionan puntas ultrasónicas de mayor o menor agresividad. Se puede optar además entre distintas angulaciones, lo que facilita al cirujano el trabajo en la zona periapical. Con este método se pueden realizar pequeñas preparaciones apicales paralelamente al eje longitudinal de la raíz y también preparar el istmo situado entre dos conductos.
Aumento de la permeabilidad dentinaria antes del blanqueamiento de dientes no vitales
El blanqueamiento interno para aclarar dientes endodonciados es un método conservador que proporciona resultados positivos a costes relativamente bajos. El efecto del blanqueante depende de la profundidad a la que penetra en los túbulos y a la que puede descomponer a través de una reacción oxidativa los pigmentos que tiñen la dentina. De acuerdo con los resultados de un estudio, un líquido (como NaOCl al 1% o EDTA al 17%) introducido en la cámara pulpar y activado tres veces con ultrasonidos durante 15 s puede aumentar notablemente la permeabilidad dentinaria13. Para ello, se utilizó una punta ultrasónica, como las utilizadas para la remoción del cálculo dental, ajustada a una intensidad media y sin entrar en contacto con las paredes de la cavidad. A continuación, se aplicó el blanqueante.
Microfisuras después de la aplicación de ultrasonidos
En la bibliografía se encuentran referencias contradictorias sobre la posibilidad de aparición de microfisuras en la dentina después del uso de puntas ultrasónicas en intervenciones periapicales o después de la extracción de pernos o instrumentos fracturados. Parece ser que su aparición depende de la intensidad seleccionada y del diseño de las puntas ultrasónicas28,38. Por lo tanto, se recomienda ajustar la intensidad siguiendo las instrucciones del fabricante.
Resumen
Los aparatos ultrasónicos se han convertido en un elemento imprescindible en la práctica endodóntica diaria. Son muy útiles no sólo en la desinfección del conducto radicular, sino también en los retratamientos y en intervenciones quirúrgicas periapicales.
Correspondencia: L.W.M. van der Sluis.
Louwesweg 1, NL-1066 EA Ámsterdam, Países Bajos.
Correo electrónico: l.vd.sluis@acta.nl