Introducción
En el World Workshop on Oral Medicine 2006 celebrado en Puerto Rico se agruparon bajo el término «alteraciones liquenoides orales» las cuatro enfermedades siguientes2:
1. Liquen plano oral
2. Reacción liquenoide oral de contacto
3. Reacción liquenoide oral inducida por medicamentos
4. Enfermedad del injerto contra el huésped
Estas alteraciones no se pueden distinguir entre sí ni clínicamente ni histológicamente. Si bien la OMS definió ya en 1978 criterios de inclusión para el diagnóstico del liquen plano oral36 (LPO), siguen sin existir definiciones o criterios estrictos para las reacciones liquenoides orales (RLO). Por lo tanto, antes se confundían y ahora se siguen confundiendo a menudo casos de RLO con LPO.
Un grupo de trabajo de Ámsterdam definió criterios para el diagnóstico de RLO35 en función de la definición del LPO. Estos criterios tienen en cuenta aspectos clínicos y también aspectos histopatológicos. En consecuencia, se utiliza el término RLO si se cumplen las condiciones siguientes:
Clínica característica, pero la histopatología sólo es compatible con un LPO
Histopatología característica, pero la clínica sólo es compatible con un LPO
Clínica e histopatología compatibles con un LPO
En coincidencia con los síntomas del LPO, los síntomas clínicos de las RLO incluyen los siguientes:
Alteraciones blanquecinas, estriadas, en placas o reticulares
Lesiones erosivas o eritematosas (atróficas)
Alteraciones ulcerosas
La reacción liquenoide oral de contacto
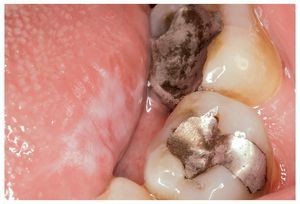
Determinadas enfermedades de la mucosa oral con características clínicas idénticas a las del LPO pueden aparecer en relación con materiales de obturación, entre otras causas. Algunos estudios clínicos demuestran la existencia de una relación topográfica entre las obturaciones de amalgama y las RLO4,19,20.
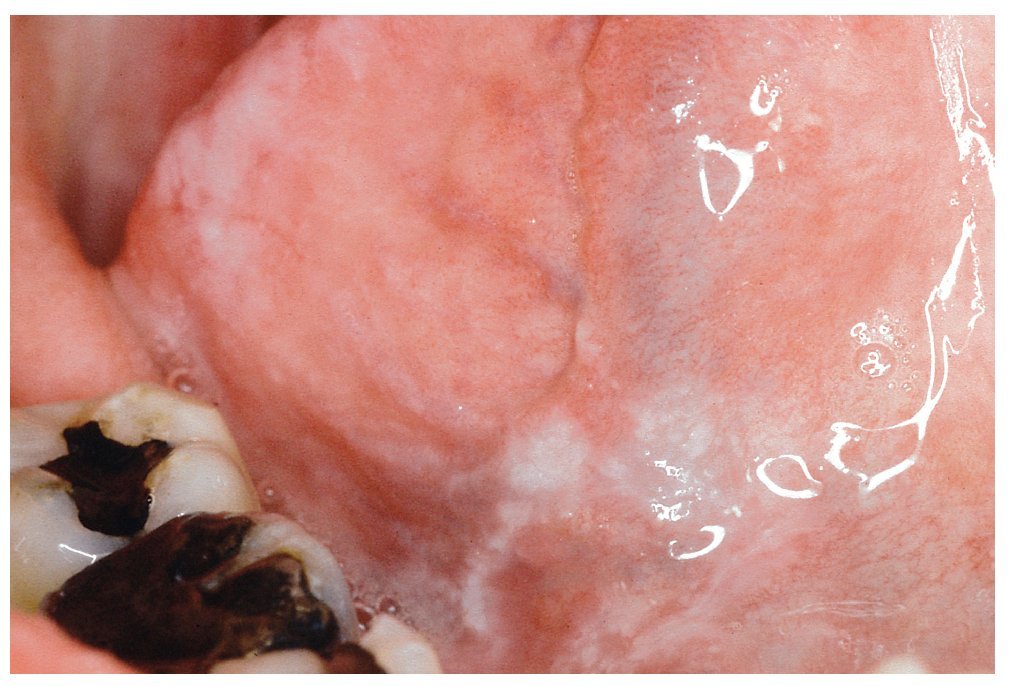
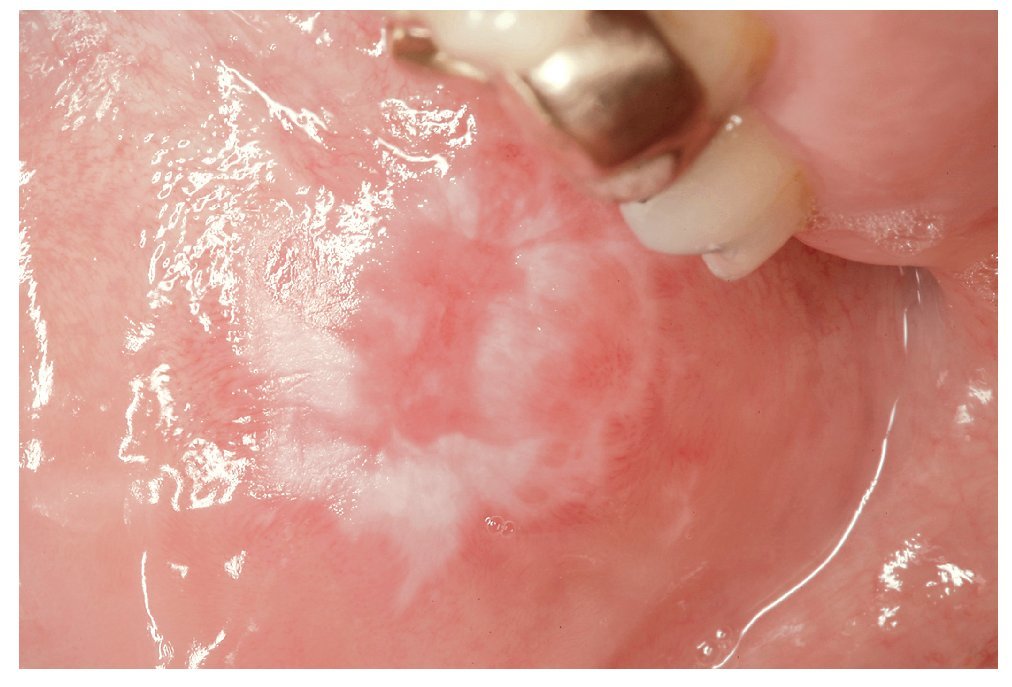
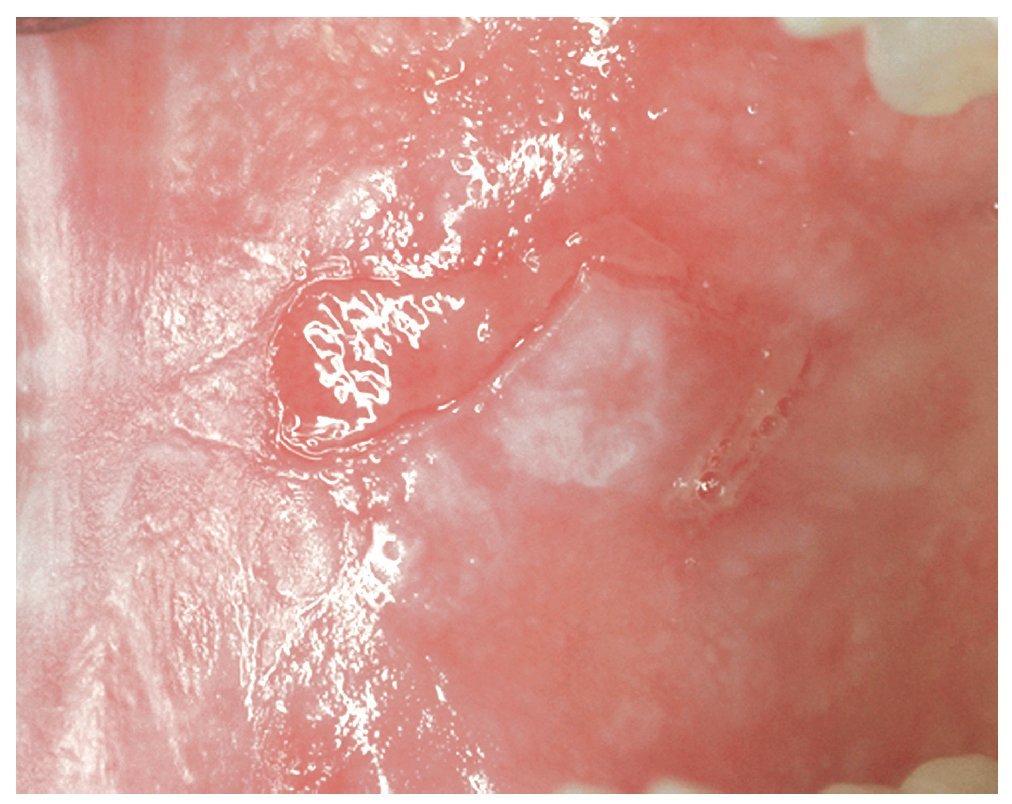
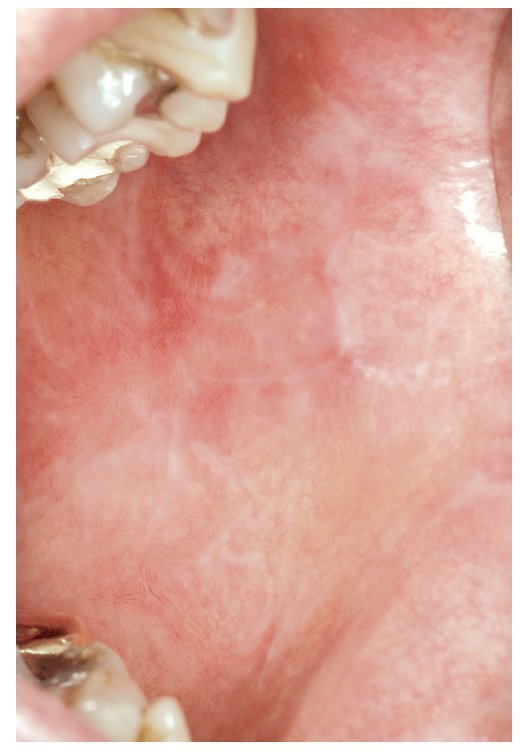
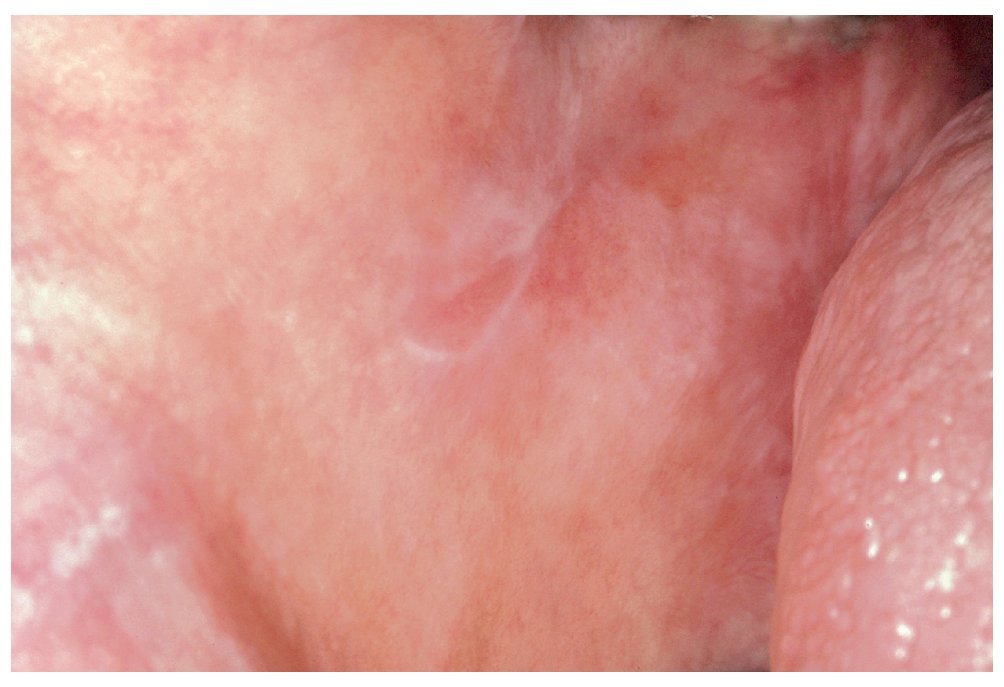
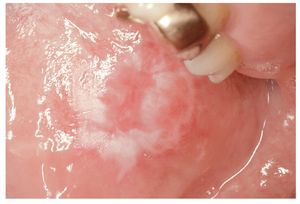
La RLO de contacto sólo se puede distinguir clínicamente de un LPO por su ubicación próxima a obturaciones de amalgama (fig. 1). Las reacciones locales al oro son relativamente raras8,18 (fig. 2) y, si bien se han descrito RLO al composite, casi no se encuentran estudios publicados al respecto hasta ahora.
Figura 1. Reacción liquenoide de contacto debida a una obturación de amalgama corroída en el borde izquierdo de la lengua en un paciente de 42 años.
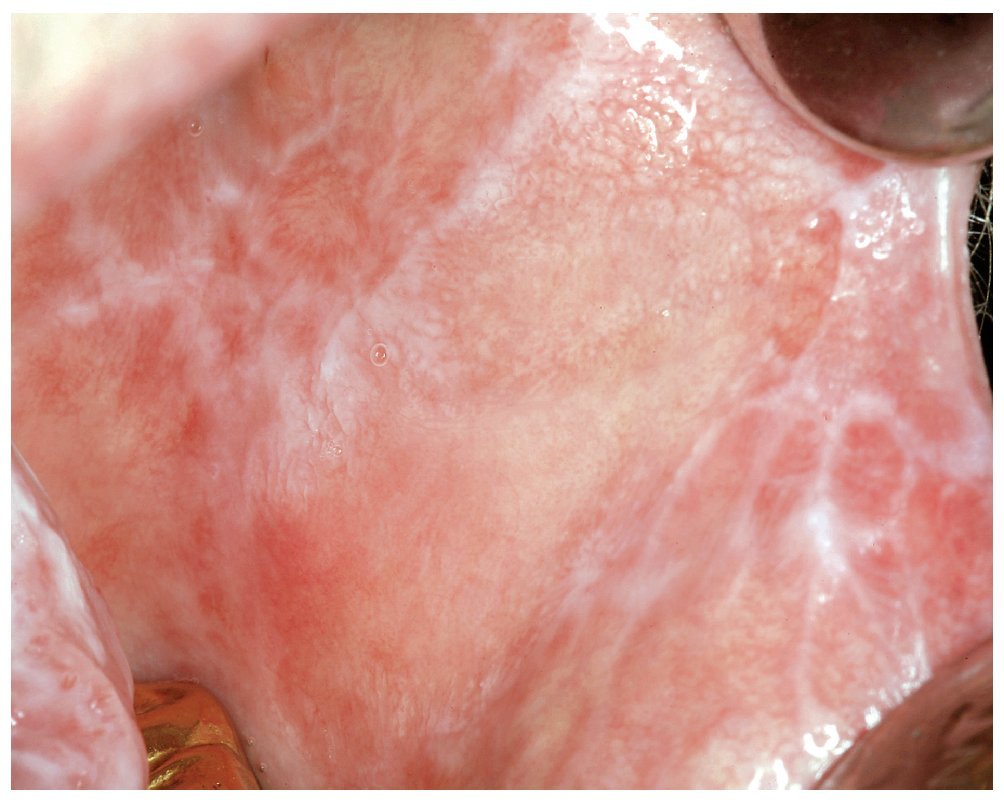
Figura 2. Reacción liquenoide debida posiblemente a una corona de oro con metales no nobles en la región del diente 16 en la cara yugal izquierda de un paciente de 43 años.
Fernström et al13 supusieron ya en 1962 que existía una relación entre la alergia tipo IV y el mercurio y los componentes mercuriales de la amalgama. Éstos parecen ser los alergenos más importantes de la amalgama, mientras que otros metales (estaño, cobre, cinc) parecen poco probables como agentes desencadenantes. La amalgama en la cavidad oral está expuesta a procesos corrosivos y puede ser responsable de sensibilizaciones y reacciones alérgicas de tipo retardado (alergia tipo IV dependiente de los linfocitos T). Este proceso provoca una estimulación antigénica con la aparición posterior de alteraciones de la mucosa oral. Una hipótesis menos verosímil de la aparición de RLO es que metales distintos (como amalgama y oro) generan potenciales diferentes que desencadenan reacciones electroquímicas, corrosión y una mayor liberación de iones metálicos responsables, a su vez, de alteraciones en la mucosa oral25.
Diagnóstico
La tabla 1 incluye los criterios diagnósticos más importantes para las RLO de contacto.
Se pudo demostrar que las RLO remitieron después de la retirada de las obturaciones de amalgama, pero en pacientes con liquen plano oral la retirada de la amalgama apenas influyó sobre las lesiones intraorales9. Esto permite deducir que los componentes de la amalgama desempeñan un papel en la aparición de una RLO, pero posiblemente sólo como un cofactor9,26.
En un estudio clínico prospectivo en 33 pacientes con 79 RLO, Magnin et al26 observaron una mejoría clara (disminución superior al 50% del tamaño de las lesiones iniciales, transición a formas clínicas más leves o disminución de las molestias) durante los 3 meses siguientes a la sustitución de las restauraciones de amalgama. Al cabo de 12 meses, el 54% de las lesiones había curado totalmente. Los autores recomiendan aplicar los cuatro criterios siguientes en relación con el saneamiento de las amalgamas:
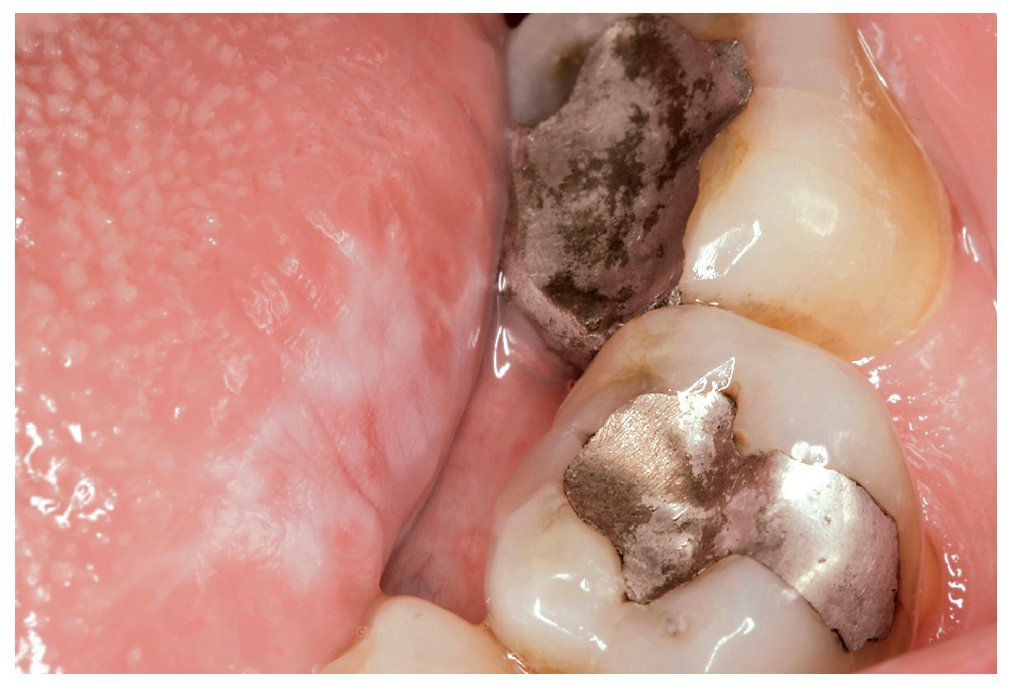
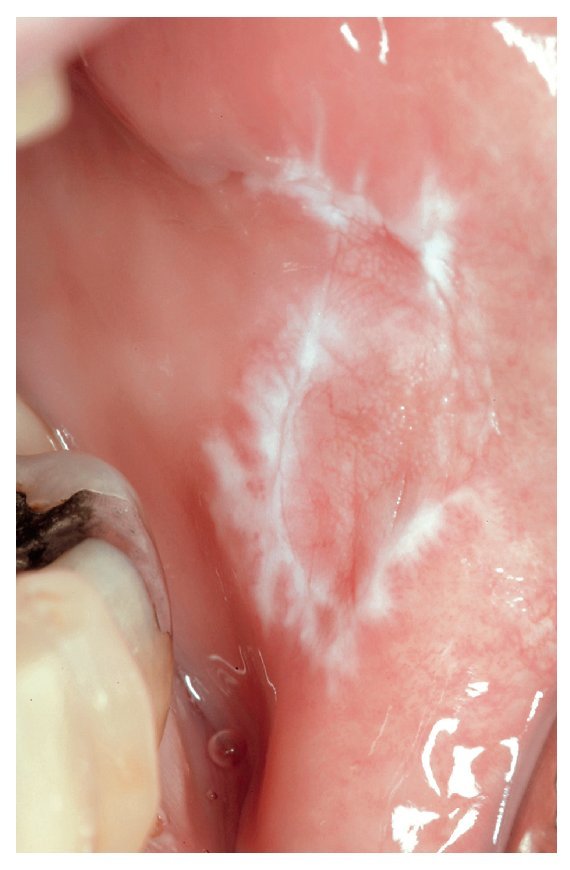
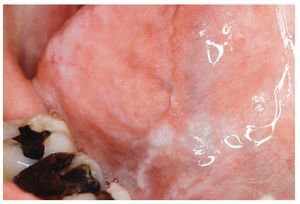
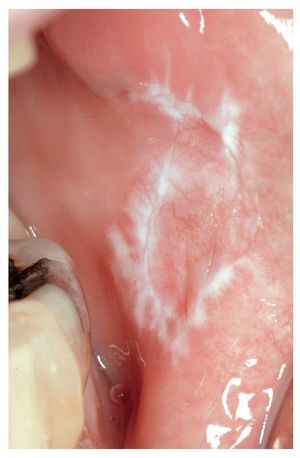
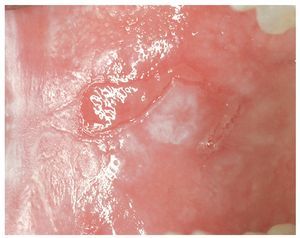
1. En caso de establecerse una relación coherente entre una obturación de amalgama y una lesión mucosa se impone el diagnóstico de una RLO (figs. 3 y 4). En las lesiones eritematosas o erosivo-ulcerosas está indicada la realización de una biopsia. Se recomienda someter a estos pacientes a un saneamiento de las obturaciones y también a controles periódicos.
Figura 3. Paciente de 70 años con una reacción liquenoide de contacto en el borde lateral izquierdo de la lengua como resultado de una restauración de amalgama corroída e insuficiente en los dientes 36/37.
Figura 4. El mismo paciente de la figura 3 con la reacción liquenoide oral de contacto correspondiente en la cara yugal izquierda.
2. El tratamiento de sustitución de las amalgamas se llevará a cabo por cuadrantes, siendo recomendable empezar el saneamiento por el cuadrante más afectado.
3. En caso de reconstrucciones amplias se recomienda una fase provisional.
4. Si el saneamiento no proporciona los resultados esperados, estas lesiones deben tratarse como un LPO, es decir, se procederá a eliminar los posibles factores locales y se iniciará un tratamiento farmacológico, si procede.
La cuestión de si el resultado de una prueba epicutánea (prueba del parche) puede predecir el éxito de un tratamiento de sustitución de las amalgamas en las RLO es importante desde el punto de vista clínico. La prueba epicutánea es de dudosa utilidad, dado que la retirada de las obturaciones de amalgama en contacto con RLO lleva a la desaparición de los síntomas clínicos, independientemente del resultado de la prueba epicutánea. Según Skoglund33 incluso se puede cuestionar la necesidad de la prueba. Magnin et al26 llegan a las mismas conclusiones: en el 29% de los pacientes estudiados con una prueba epicutánea positiva, la lesión control remitió por completo a los 12 meses del tratamiento de sustitución de la amalgama, en comparación con el 33% de los pacientes con una prueba negativa. Los autores hacen hincapié en la dudosa utilidad de la prueba epicutánea como herramienta pronóstica. También Dunsche et al9 pudieron mostrar en un estudio de 3 años de duración que los pacientes con una prueba epicutánea tanto positiva como negativa para mercurio reaccionaron de forma parecida a la retirada de la amalgama.
Histología
En diversos estudios se ha observado que entre el cuadro histológico del LPO y el de la RLO no existen diferencias5,9,21,27. El aspecto histopatológico del LPO se abordará exhaustivamente en una próxima edición.
Pronóstico
Bratel et al6 afirmaron en 1996 que, a diferencia del LPO, que forma parte de las lesiones precancerosas, todavía no se había descrito una malignización de las RLO asociadas a obturaciones de amalgama, pero en un estudio más reciente se ha podido demostrar que tanto los pacientes con RLO como los pacientes con LPO tienen un riesgo alto de desarrollar un carcinoma de células escamosas35. En este último estudio, que comparó 111 pacientes con RLO con 62 pacientes con LPO, este riesgo fue incluso mayor en los pacientes con RLO, aunque no se distinguió entre RLO de contacto y RLO inducidas por medicamentos.
Reacción liquenoide oral inducida por medicamentos
En la mucosa oral pueden aparecer enfermedades de características clínicas idénticas al LPO en relación con la ingesta de medicamentos (figs. 5 a 7). A diferencia de las manifestaciones cutáneas asociadas a medicamentos, las RLO inducidas por medicamentos son relativamente raras. Sin embargo, en los últimos años se han publicado numerosos casos y algunos estudios que informaron de RLO después de la administración de inhibidores de la ECA y de antiinflamatorios no esteroideos. Ficarra et al15 refirieron casos de RLO en pacientes con infección por el VIH después de la ingesta de zidovudina (antirretroviral) y ketoconazol (antimicótico).
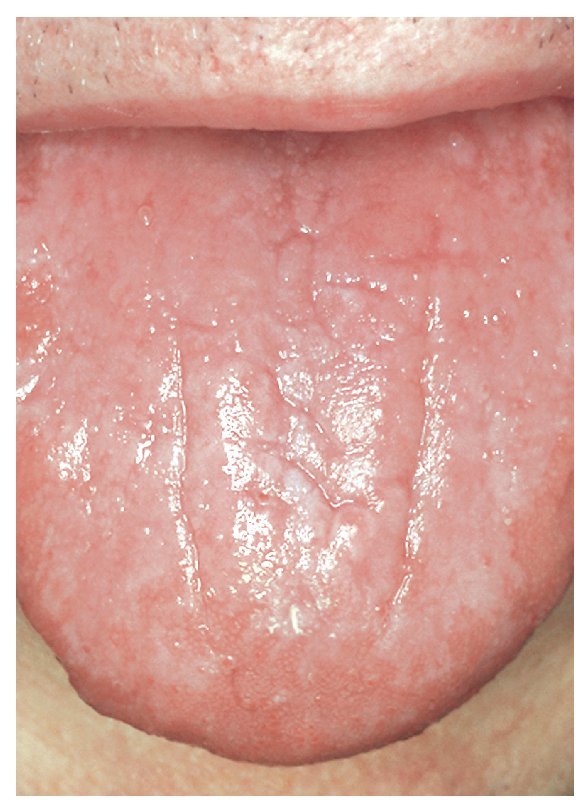
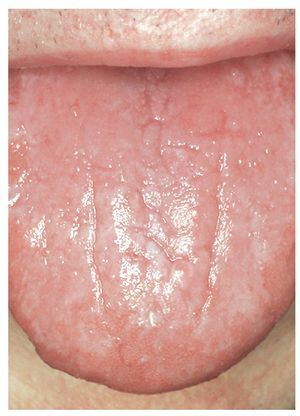
Figura 5. Reacción liquenoide oral inducida por medicamentos con áreas erosivas y en placas en la cara yugal izquierda en un paciente de 63 años con un tumor gástrico estromal (TGE) sometido a tratamiento citostático con imatinib (nombre comercial: Glivec).
Figura 6. El mismo paciente de la figura 5 con lesiones atróficas y en placas en el dorso de la lengua.
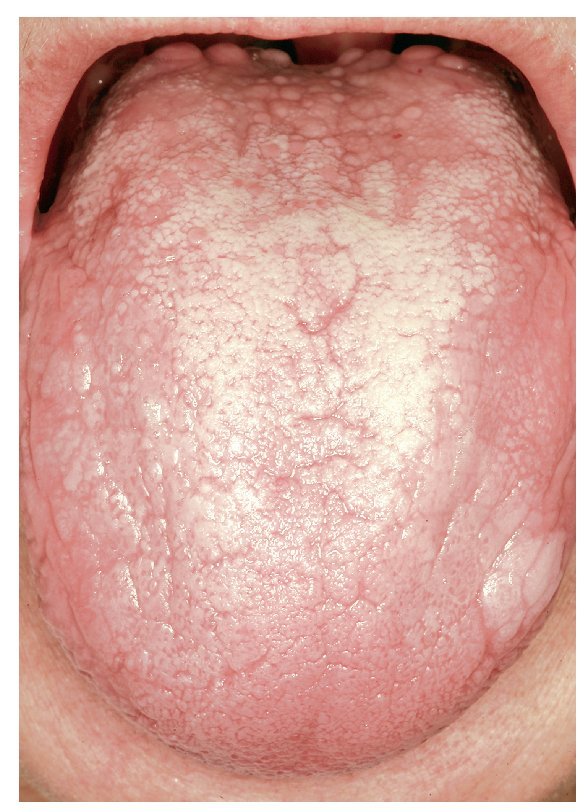
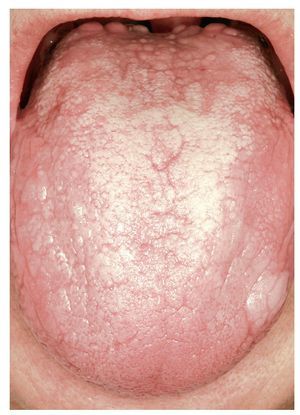
Figura 7. RLO en placas inducida por medicamentos en el dorso de la lengua de una paciente de 62 años con un carcinoma vesical superficial en tratamiento con BCG (bacilo de Calmette-Guérin).
Diagnóstico
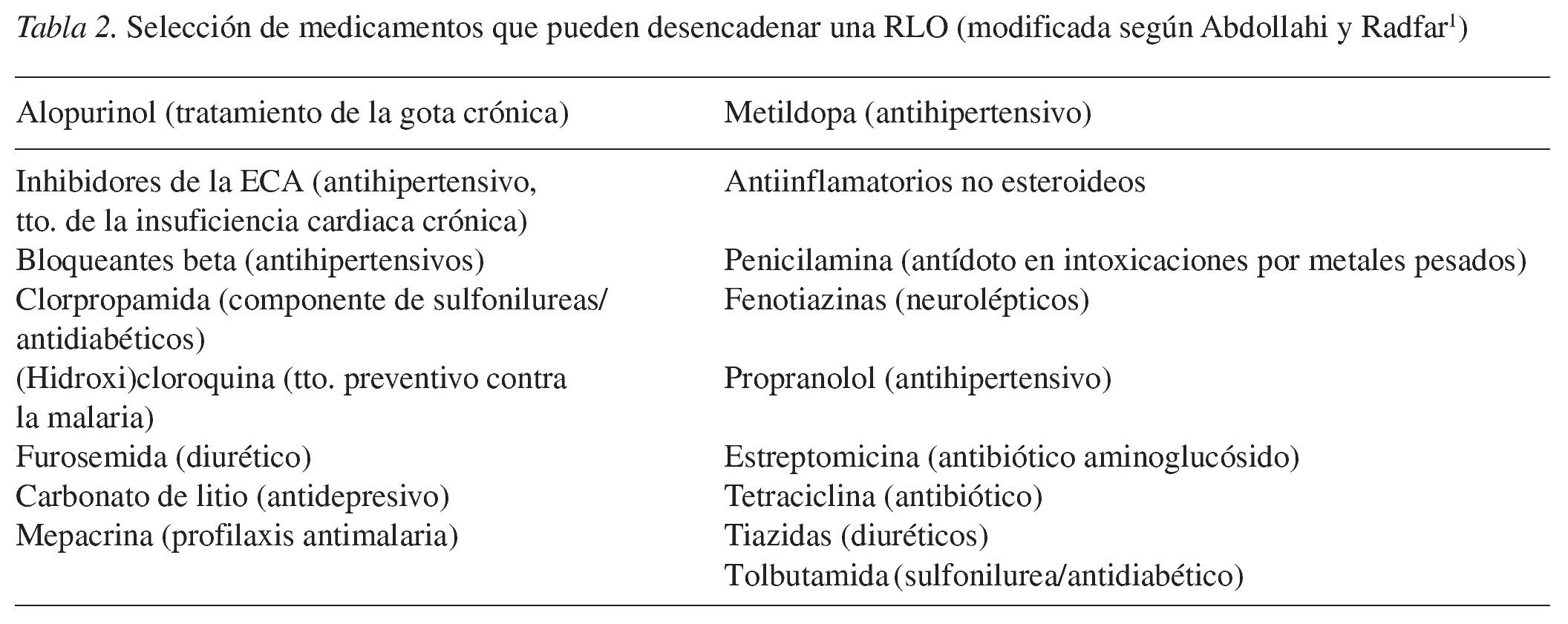
La tabla 2 muestra una serie de medicamentos que pueden provocar RLO.
Las RLO remiten después de suspender el fármaco desencadenante, a diferencia del LPO. No sorprende que no existan estudios basados en la evidencia en relación con RLO inducidas por medicamentos: el inicio y la interrupción de un tratamiento farmacológico pueden tener consecuencias graves para el paciente en determinadas circunstancias y, además, la fase de regresión de la RLO puede llegar a durar meses. Actualmente se plantea la posibilidad de que una RLO inducida por medicamentos pueda empeorar los síntomas clínicos de un LPO previo1.
Histología
No existen signos histológicos que permitan distinguir claramente entre RLO inducidas por medicamentos y el LPO10-12,29,32. Las reacciones asociadas a medicamentos pueden aparecer en cualquier momento, incluso años después de iniciar el tratamiento28.
Pronóstico
El pronóstico de las RLO inducidas por medicamentos no difiere del de las RLO de contacto (véase apartado anterior).
Enfermedad del injerto contra el huésped
En los últimos 20 años, el trasplante de médula ósea y el trasplante de células progenitoras hematopoyéticas se han impuesto como un procedimiento normal en el tratamiento del cáncer hematológico y de distintos cuadros asociados a la insuficiencia de la médula ósea. Por lo tanto, el odontólogo debe conocer las alteraciones de la mucosa oral asociadas a estos tratamientos.
Generalidades
Para el trasplante de células progenitoras se recolectan células progenitoras hematopoyéticas pluripotentes de la médula ósea, de sangre periférica y de sangre de cordón umbilical. Si bien es posible tratar también a los pacientes con leucemia con un trasplante de células progenitoras, hay que tener presente la tasa elevada de complicaciones de este procedimiento, así como una mortalidad de hasta un 30% asociada a este tipo de trasplantes. Estas complicaciones están estrechamente relacionadas con reacciones inmunológicas cutáneas y mucosas (enfermedad del injerto contra el huésped, EICH; Graft-versus-Host Disease, GvHD, por sus siglas en inglés).
La EICH no sólo puede aparecer después de un trasplante de médula ósea o de células progenitoras, sino también después de la transfusión de hemoderivados con leucocitos no irradiados o después de un trasplante de órgano sólido. Los órganos diana de la EICH son órganos que contienen células linfoides y estructuras epiteliales22 (piel, hígado, tracto gastrointestinal, pulmones, ojos, aparato neuromuscular).
Existen los siguientes tipos de trasplante de células progenitoras:
Alogénico (donante emparentado o no emparentado)
Singénico (el donante es un gemelo univitelino)
Autólogo (células progenitoras del propio paciente después del tratamiento citostático)
Trasplante
El tipo más frecuente es el trasplante alogénico de células progenitoras. En este tipo de trasplante, las células progenitoras del donante asumen parcial o totalmente la hemopoyesis en el receptor después del trasplante. El paciente debe someterse antes del trasplante a un tratamiento de acondicionamiento (quimioterapia a dosis altas e irradiación corporal total, si procede) para destruir las poblaciones celulares cancerosas.
Complicaciones
Además de muchos otros posibles riesgos del trasplante de células progenitoras (infecciones, sobre todo por el virus del herpes humano, pancitopenia, pancreatitis, cardiotoxicidad y muchos otros) y de la elevada mortalidad asociada, las complicaciones están relacionadas sobre todo con la aparición de una EICH. La EICH se caracteriza por la reacción de los linfocitos T inmunocompetentes del injerto con las estructuras antigénicas del tejido receptor inmunodeprimido14,34 (huésped). Esta reacción se puede manifestar en todos los tejidos con células linfoides y estructuras epiteliales, pero sobre todo en los órganos diana piel (mucosa), hígado y tracto gastrointestinal. Se distingue entre EICH aguda (aparece en los 100 días posteriores al trasplante) y EICH crónica (a partir del día 100 del período postoperatorio).
Alteraciones de la mucosa oral en la EICH aguda
Los síntomas de la afectación mucosa incluyen sobre todo la xerostomía como signo de una disfunción de las glándulas salivales y dolor a la ingesta de alimentos. Las alteraciones de la mucosa pueden recordar a las de un LPO y se observan los signos clínicos siguientes:
Focos papulares blanquecinos
Tramas reticulares
Lesiones erosivas ulceradas
Histología
Los estudios ponen de manifiesto que no existen diferencias histológicas entre el LPO y la EICH16,31.
Diagnósticos diferenciales
Las alteraciones iniciales de la mucosa oral en la EICH a menudo son imposibles de distinguir clínicamente de las de una RLO (de origen medicamentoso) o de un enantema vírico.
Alteraciones de la mucosa oral en la EICH crónica
La EICH crónica es una enfermedad multisistémica que se puede manifestar a partir del día 100 después del trasplante, pero también al cabo de años en aproximadamente el 30% al 50% de los receptores de trasplantes3,30. Un factor de riesgo de la aparición de una EICH crónica es haber padecido previamente una forma aguda, aunque también existe una variante de nueva aparición que se manifiesta sin EICH aguda previa.
Las lesiones de la mucosa oral se pueden manifestar por los signos clínicos siguientes:
Focos blanquecinos en placas (parecidos a los de un LPO en placas)
Tramas reticulares (estrías de Wickham parecidas a las de un LPO) (figs. 8 y 9)
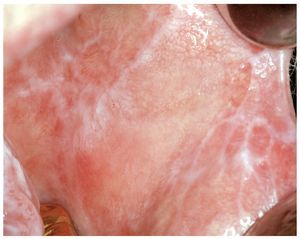
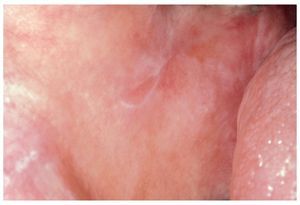
Figura 8. EICH crónica en una paciente de 51 años después de un trasplante de médula ósea debido a una enfermedad mieloproliferativa (policitemia vera): áreas reticulares y proliferativas en la cara yugal izquierda.
Figura 9. La misma paciente de la figura 8 con signos de EICH crónica en la cara yugal izquierda: patrón reticular y erosivo. Obsérvese que las lesiones sobrepasan claramente las zonas de contacto de las obturaciones.
Erosiones y úlceras (variante erosiva o ulcerosa de un LPO) (fig. 10)
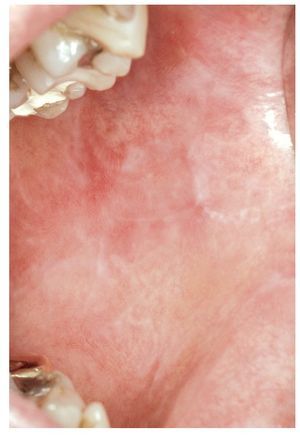
Figura 10. EICH en una paciente de 57 años después de un trasplante de células progenitoras a la edad de 52 años por un linfoma no hodgkiniano: áreas reticulares y erosivas en la cara yugal derecha.
Si la afectación de la mucosa oral es extensa, se añaden a menudo síntomas de xerostomía y de disfagia.
Histología
Los estudios muestran, igual que para la EICH aguda, que no existen diferencias entre la histología del LPO y la de la EICH16,31.
Diagnósticos diferenciales
Además del LPO debe hacerse el diagnóstico diferencial con reacciones liquenoides a medicamentos, la esclerodermia y el síndrome de Sjögren.
Profilaxis y tratamiento de la EICH
La profilaxis primaria para evitar una EICH consiste en hallar un donante lo más compatible posible en lo que se refiere a las moléculas de histocompatibilidad. En caso de una EICH aguda existente, el tratamiento consiste en la mayoría de los casos en la administración adicional de inmunosupresores (glucocorticoides y ciclosporina A). Para el tratamiento de la EICH crónica, se administra inicialmente ciclosporina A y además glucocorticoides o los inmunosupresores micofenolato mofetilo y tacrolimus en las EICH resistentes al tratamiento.
El hecho de que la EICH se manifiesta en más del 90% de los casos inicialmente en la piel y las mucosas, y de que las primeras alteraciones son difíciles de diagnosticar clínicamente e histológicamente subraya la importancia de una colaboración estrecha entre el hematólogo y el odontólogo en el cuidado de estos pacientes después del trasplante de células progenitoras. Debido a la mayor incidencia de tumores secundarios después del trasplante de células progenitoras y a la posible transformación de la EICH en un carcinoma de células escamosas, incluso años después del diagnóstico inicial, hacen falta controles periódicos para la detección precoz de las alteraciones respectivas7,23.
Displasia liquenoide
La posible capacidad de malignización del LPO por sí mismo es objeto de controversia en la bibliografía. Una serie de expertos defienden esta hipótesis, pero otros insisten en que sólo pueden sufrir una transformación maligna las alteraciones parecidas al LPO con características propias de una displasia. Eisenberg y Krutchkoff24 opinaron que algunas alteraciones diagnosticadas de LPO eran en realidad displasias epiteliales con características clínicas liquenoides. Constataron que la displasia epitelial con características liquenoides constituye una entidad histopatológica propia con predisposición a la malignización, la displasia liquenoide. Sin embargo, en un artículo de revisión publicado recientemente se advierte que con la exclusión a priori de todos los LPO con displasia epitelial se podría subestimar la tasa de transformación real del liquen. De ello se puede deducir que algunos casos de LPO que se descartan por la mera presencia de una displasia epitelial podrían ser en realidad casos verdaderos de transformación de un LPO17.
Correspondencia: A.M. Schmidt-Westhausen.
Área de Medicina Oral, Radiología y Cirugía Odontológica. Centro Charité de Odontología, Medicina Oral y Maxilofacial (CC3). Charité-Medicina Universitaria Berlín.
Abmannshauser Strabe 4-6, 14197 Berlín, Alemania.
Correo electrónico: schmidt-westhausen@charite.de