Introducción
En el año 1962 se introdujo en Alemania la técnica de la metalocerámica como desarrollo conjunto de Vita Zahnfabrik, Bad Säckingen, y de la antigua Degussa, actualmente DeguDent, Hanau. La metalocerámica se ha consolidado como un sistema extremadamente fiable y, pese al auge de la cerámica sin metal, continúa ocupando el primer lugar destacado en la restauración con coronas y puentes. Sin embargo, a principios de los años 90 se produjo en Alemania una considerable incertidumbre desencadenada políticamente. El cambio de las aleaciones con elevado contenido en oro a las aleaciones a base de paladio (Pd), introducido en la sanidad por los seguros de enfermedad por motivos de ahorro de costes, chocaba contra la conciencia de salud que se estaba desarrollando socialmente y el consiguiente deseo de materiales odontológicos biocompatibles. Informes aislados sobre reacciones de intolerancia con los más diversos grados de intensidad contra las aleaciones a base de Pd, a los que se dedicó amplio espacio en la prensa, condujeron a una campaña contra el metal noble Pd, que fue responsabilizado prematuramente por estas reacciones de intolerancia. De este modo se produjo un cambio de tendencia, con un aumento de la utilización de aleaciones con elevado contenido en oro y con el rápido desarrollo de nuevas aleaciones de metales nobles sin Pd. Éstas fueron desarrolladas por una parte sobre la base de las aleaciones Au-Pt conocidas, y por otra parte sobre la base de las aleaciones Au-Ag-Cu, si bien para éstas era necesaria una nueva cerámica de recubrimiento de bajo punto de fusión debido a las bajas temperaturas de fusión. El primer y más conocido sistema de esta tecnología fue el Golden Gate System (DeguDent).
Actualmente se considera unánimemente que la metalocerámica es un sistema fiable con una elevada tasa de éxito, pero la variedad de materiales ha alcanzado niveles excesivos. En consecuencia, la tolerabilidad biológica, esto es, la biocompatibilidad de los materiales, continúa constituyendo para la metalocerámica una cuestión central del tratamiento odontológico. Las definiciones tradicionales del concepto de biocompatibilidad parten de un comportamiento inerte del material, de modo que durante la implantación el material no debe ser degradado por el organismo anfitrión ni liberar material en forma de productos de corrosión, y por consiguiente no puede desencadenar reacciones patológicas9, mientras que actualmente este concepto designa la propiedad de un material de desempeñar su tarea en el organismo anfitrión de tal manera que no se produzcan reacciones biológicas indeseadas41.
Los materiales cerámicos están considerados generalmente como biocompatibles, si bien naturalmente también se ensayan siempre estos materiales para verificar su biocompatibilidad. Sin embargo, en la cuestión de la biocompatibilidad de los sistemas metalocerámicos la atención se dirige a las aleaciones. E incluso hoy en día, después de casi 50 años de evolución en la metalocerámica, continúa teniendo sentido discutir sobre la biocompatibilidad de las aleaciones. Esto vuelve a ponerse especialmente de manifiesto en los últimos tiempos, toda vez que por motivos de costes se utiliza con creciente frecuencia para la metalocerámica una nueva clase de aleación, las aleaciones sin metales nobles.
El factor determinante para la biocompatibilidad de las aleaciones es su comportamiento de corrosión, ya que sólo aquellos componentes que se disuelven pueden ser absorbidos por el organismo e interferir con el metabolismo. A su vez, el comportamiento de corrosión viene determinado en gran medida por la composición de las aleaciones. De ahí que para la consideración de la biocompatibilidad de las aleaciones aptas para el recubrimiento cerámico deba ofrecerse primero una visión de conjunto de las composiciones típicas de las aleaciones, para posteriormente abordar el comportamiento de corrosión y finalmente la biocompatibilidad.
Los requisitos planteados a las propiedades mecánicas y térmicas de las aleaciones aptas para el recubrimiento cerámico están definidos en la norma DIN EN ISO 9693. La versión actual de esta norma todavía no contempla especificaciones para el comportamiento de corrosión. Sin embargo, los requisitos planteados a la resistencia a la corrosión están establecidos en la DIN EN ISO 22674 para todos los materiales metálicos restauradores en la odontología. Además se recomienda tener en cuenta la ISO 10993-1 para la elección de ensayos de biocompatibilidad adecuados y la ISO 7405 como norma específica para materiales dentales, y someter a prueba los materiales para determinar posibles riesgos biológicos o toxicológicos.
Perfil de requisitos y composición de las aleaciones aptas para el recubrimiento cerámico
Los requisitos definidos en las normas son el resultado de las largas experiencias clínicas con los materiales. Para poder satisfacer estos requisitos deben alcanzarse los datos técnicos correspondientes mediante la elección adecuada de la composición de la aleación.
Aleaciones de metales nobles
Las composiciones típicas de las aleaciones de metales nobles aptas para el recubrimiento cerámico pueden recogerse con bastante claridad en un esquema simplificado (tabla 1). En los ejemplos mencionados se trata de aleaciones seleccionadas de un fabricante (Cendres & Métaux SA, Biel, Suiza) en cuyo desarrollo tuvo una considerable participación el autor, motivo por el cual cuenta con amplias experiencias y conocimientos al respecto, si bien esto no quiere decir que aleaciones de otros fabricantes sean menos apropiadas. Las composiciones de las aleaciones son indicadas por los fabricantes en porcentaje de la masa (%m). Esto obedece a motivos prácticos, ya que de este modo se simplifica el cálculo del precio. Sin embargo, para poder evaluar mejor las verdaderas particularidades, es más interesante conocer las proporciones atómicas de los elementos de la aleación. De ahí que en la tabla 1 se indican en la primera fila de números los valores en porcentaje atómico (%at). De esta manera resulta más claramente visible la estructura lógica de la tabla. Bajo esta fila se indican también los datos en porcentaje de la masa, tal como se encuentran en las documentaciones de venta. Descripción individual de los grupos de aleaciones según la tabla 1:
Au-Ti. En principio, el oro (Au) está considerado como el metal noble más biocompatible, en virtud de su comportamiento inerte y la consiguiente resistencia a la corrosión. Sin embargo, el oro es demasiado blando como para poder ser utilizado como sustancia pura para la metalocerámica. De ahí que, dependiendo del tipo de aleación, sean necesarios componentes de aleación específicos que resulten en un endurecimiento.
Si va a alearse Au con sólo otro metal, puede recurrirse al titanio (Ti), considerado ya de por sí el metal no noble compatible en la odontología, dado que se utiliza con éxito en la implantología. Mediante pequeñas adiciones de Ti al Au se forma la fase intermetálica TiAu4, la cual conduce a un endurecimiento significativo de la aleación. Estudios exhaustivos han demostrado que una aleación basada en Au con 1,7% Ti y 0,1% Ir como afinador de grano constituye una composición óptima para lograr unas propiedades mecánicas y térmicas adecuadas12. Las propiedades de la aleación resultan de la estructura, la cual consiste en una matriz de Au en la que está empotrada la fase intermetálica TiAu4 en forma de pequeñas agujas (fig. 1). Esta malla de pequeñas agujas estabiliza el material hasta temperaturas elevadas, lo cual resulta en una resistencia propia suficiente y una estabilidad de cocción excelente a pesar del elevado contenido en Au. Sorprendentemente, el afinador de grano Ir conduce, ya en el orden de magnitudes mencionado de 0,1%, a una drástica mejora de la estabilidad de cocción, que pese al elevado contenido en Au es equiparable a la de las aleaciones basadas en Pd o las aleaciones sin metales nobles13. La unión metalocerámica se ha revelado, a pesar de la fuerte oxidación del óxido de titanio durante el proceso de cocción, como equiparable a la de las aleaciones aptas para el recubrimiento cerámico tradicionales14. La proporción de Ti es de 6,7 %at con un porcentaje de la masa del 1,6%. Esta elevada proporción de Ti da lugar a una intensa oxidación durante el proceso de colado, en caso de que no se trabaje adoptando medidas de protección especiales. Entre éstas se cuentan un recubrimiento de gas protector con argón y la utilización de crisoles de carbono15,16. En virtud de su estructura especial, también puede mecanizarse sin problemas la aleación en máquinas fresadoras, pero debido a los costes asociados al almacenamiento de las piezas en bruto no es viable la confección rentable de prótesis dentales sobre esta base en el laboratorio dental, sino únicamente cuando va acompañada de un reciclaje.
Fig. 1. Estructura de la aleación AuTi. La fase intermetálica cristalizada en forma de agujas estabiliza la matriz de oro blando.
Au-Pt-Zn. La base de las aleaciones aptas para el recubrimiento cerámico con elevado contenido en oro la constituye el sistema binario Au-Pt, ya que presenta una temperatura de solidificación lo suficientemente elevada, y debido a la laguna de miscibilidad entre Au y Pt en estado sólido posibilita un buen endurecimiento. Sin embargo, el sistema Au-Pt presenta el inconveniente de que el intervalo de fusión resulta relativamente amplio ya con un bajo contenido en Pt, y debido a la segregación durante el enfriamiento tras el colado se forma una estructura de aleación inhomogénea. En consecuencia, sólo se puede añadir Pt a la aleación hasta aproximadamente un 15 %at. En el proceso protésico normal, con esta baja proporción de Pt sólo es posible un endurecimiento limitado. Mediante la adición de cinc (Zn) a la aleación pueden ajustarse los datos técnicos de tal manera que se obtienen una resistencia suficiente, un coeficiente de expansión térica adecuado y una temperatura de fusión favorable. Además, gracias a la formación de óxido adhesivo durante el proceso de cocción, el cinc garantiza la unión química a la cerámica. La composición ideal en cuanto a los datos técnicos se obtuvo con un contenido de aproximadamente 16,9 %at Pt (junto con 0,1 %at Ir, esto resulta en 17,0 %at) y 6,0 %at Zn. La estructura (fig. 2) presenta en los límites de grano una reducida disgregación hacia la fase rica en Au y Pt. La disgregación tiene lugar con especial facilidad en los límites del grano, dado que aquí es posible la difusión a lo largo de las superficies limítrofes, y la concentración de defectos constructivos en las superficies limítrofes facilita adicionalmente la difusión.
Fig. 2. Estructura de la aleación AuPtZn. La separación de fases se aprecia claramente en los límites de grano.
Au-Pt-Pd-In. Mediante la adición de Pd al sistema Au-Pt puede evitarse el problema de la segregación18, dado que el Pd tiene como efecto la homogeneización y el estrechamiento del intervalo de fusión. En lugar de Zn, ahora el indio (In) es el metal no noble de elección para alcanzar un endurecimiento18. Además, el indio garantiza, en virtud de la formación de óxido adhesivo durante el proceso de cocción, una buena unión química a la cerámica24. Los parámetros óptimos en cuanto a las propiedades de la aleación se alcanzaron con la composición (en %at) de 72,0% Au, (9,4 + 0,1%) (Pt + Ir), 19,0% Pd y 5,5% In. La homogeneidad de la aleación se pone de manifiesto en la micrografía (fig. 3). Por lo tanto, en %at la proporción de Pd es mayor que la proporción de Pt, mientras que la proporción al convertir a %m es exactamente la inversa. Dado que este sistema es muy tolerante ante las fluctuaciones de procesamiento, las primeras aleaciones aptas para el recubrimiento cerámico se basan en el sistema Au-Pt-Pd-In. Las aleaciones de este tipo tienen un color relativamente amarillo pálido y sólo satisfacen parcialmente los requisitos estéticos. Mediante la reducción de la proporción de Pd puede optimizarse el color, pero la aleación pierde en el proceso resistencia mecánica y estabilidad de cocción17 y en consecuencia puede deformarse en mayor medida durante el proceso de cocción. Mediante pequeñas adiciones de plata (Ag), cobre (Cu), Zn, así como hierro (Fe) y renio (Re), pueden optimizarse el color y la trabajabilidad.
Fig. 3. Estructura de la aleación AuPtPdIn. La adición de Pd conduce a una estructura homogénea.
Au-Pd-In-Ga. Mediante la sustitución parcial del Au y la sustitución total del Pt por el más económico Pd, se dispone de una posibilidad ilimitada para el desarrollo de aleaciones aptas para el recubrimiento cerámico, dado que Au y Pd se mezclan excelentemente y, mediante la adición de In, galio (Ga) y otros metales no nobles en las proporciones de cantidad adecuadas, pueden adaptarse en un amplio ámbito a los requisitos de la técnica de recubrimiento metalocerámica. Para el endurecimiento y para rebajar la temperatura de fusión debe añadirse una cantidad apreciable de In superior a 10 %at. Típicamente, estas aleaciones presentan alrededor del 50 %at de Pd, de modo que ya pueden considerarse aleaciones basadas en Pd, pese a que debido a la proporción de Au superior expresada en porcentaje de la masa (tabla 1) continúan denominándose aleaciones reducidas en oro. No es posible rebajar en la medida suficiente mediante In la temperatura de fusión. En este caso debe trabajarse adicionalmente con galio (Ga). Ga posee un punto de fusión de 37 ºC, lo cual lo convierte en muy eficiente en este sentido23. Con una proporción de Pd tan elevada, es preciso utilizar rutenio (Ru) en lugar de Ir como afinador de grano.
Au-Pd-Ag-In-Ga. Pueden desarrollarse aleaciones aún más económicas basadas en Pd, prescindiendo en gran medida de Au. Sin embargo, un incremento adicional de la proporción de Pd lleva aparejada la necesidad de añadir a la aleación una mayor proporción de metales no nobles y sustituir por Ag parte del oro ausente. De ello resulta el denominado tipo 75/6 con aproximadamente 75 %m Pd y 6% Au, además de aproximadamente 6,5% Ag, 6% In y 9% Ga.
Pd-Ag-Sn. El incremento de la proporción de Ag permite prescindir por completo de Au. Sin embargo, es preciso incrementar considerablemente la proporción de Ag y reducir nuevamente la proporción de Pd para evitar que la temperatura de fusión aumente en exceso. En este sistema, Sn es el componente de aleación más efectivo.
Aleaciones universales. Gracias al desarrollo exitoso de cerámicas de recubrimiento de bajo punto de fusión resistentes a la corrosión, fue posible recubrir cerámicamente también aleaciones con bajo intervalo de fusión. En estas condiciones puede prescindirse también del componente de alto punto de fusión Pd utilizado en las aleaciones aptas para el recubrimiento cerámico tradicionales.
Las aleaciones se basan en las aleaciones ternarias del sistema AuAgCu, bien ajustables en cuanto a su resistencia y poco propensas a la corrosión, con añadidos de Pt y Zn para un mejor endurecimiento, así como Ir para la afinación de grano. Sin embargo, estas aleaciones se oxidarían en exceso durante el proceso de cocción, debido a la elevada proporción de Cu. No obstante, mediante la sustitución de una parte del Cu total por Pt y adiciones de In puede modificarse este tipo de aleación de tal manera que resulte un componente de aleación adecuado para las cerámicas de bajo punto de fusión, mientras que el usuario valora especialmente el color amarillo dorado considerado estético. Debido al bajo intervalo de fusión, tanto para el colado de estructuras de coronas y puentes como en las aleaciones con elevado contenido en oro no aptas para el recubrimiento cerámico tradicionales, puede utilizarse una masa de recubrimiento ligada por yeso y cualquier equipo de colado convencional.
Debido a sus propiedades mecánicas, estas aleaciones pueden utilizarse también como aleaciones de tipo 4 para la técnica de coronas y puentes convencional, para elementos de construcción colados y, si el modelado es lo suficientemente grueso, incluso para la técnica de esqueléticos. De este modo, por primera vez en la odontología restauradora resulta viable el tratamiento de los pacientes con una sola aleación, lo cual constituye una posibilidad atractiva para evitar la multiplicidad de aleaciones en la boca.
Aleaciones sin metales nobles
En este grupo de aleaciones puede distinguirse básicamente entre las aleaciones basadas en cobalto (Co) y las basadas en níquel (Ni). A temperatura ambiental, Co está presente en una estructura cristalina hexagonal, lo cual confiere una elevada resistencia a una aleación basada en Co. El cromo (Cr) añadido a la aleación forma con Co fases intermetálicas que endurecen aún más la aleación. Además, el Cr forma mediante oxidación un óxido muy estable químicamente que, disponiéndose como denominada capa pasiva sobre la superficie de la aleación, incrementa la resistencia de la corrosión. Mediante adiciones de molibdeno (Mo) o wolframio (W) puede estabilizarse la estructura hexagonal del Co y mejorarse aún más la resistencia a la corrosión. Los añadidos de silicio (Si) mejoran la fluidez de las masas de aleación fundidas. El manganeso (Mn) actúa como captador de oxígeno en la masa fundida.
La resistencia de las aleaciones basadas en Ni se logra mediante una formación de cristales mixtos con Cr, por lo demás se aplican en cuanto a la composición de la aleación especificaciones similares a las que se dan en las aleaciones a base de Co.
Liberación corrosiva de componentes de la aleación
El término corrosión designa todas las reacciones de un material con su entorno8. Para la odontología, la corrosión electroquímica en forma del elemento galvánico es importante, dado que en la cavidad oral se encuentra por una parte saliva, la cual constituye un excelente electrolito, y por otra parte aleaciones con a menudo diversos grados de nobleza (p. ej. amalgama y aleaciones de colado o aleaciones de colado y metal de aportación), las cuales se hallan en contacto directo, esto es, unidas entre sí de forma conductora de electricidad. En estas condiciones se produce siempre una disolución de la aleación menos noble, formándose iones metálicos como producto de la corrosión. También son posibles elementos galvánicos de tamaño muy reducido. De este modo se forman por ejemplo, en caso de aleaciones solidificadas de forma inhomogénea o heterogénea, diferencias de concentración en la estructura que, actuando como elemento galvánico, pueden conducir a fenómenos de corrosión limitados localmente. Estos elementos se denominan elementos locales52. Incluso las aleaciones homogéneas pueden corroerse en una denominada célula de aireación si la concentración o la composición de electrolito varía localmente. Así, por ejemplo, bajo una placa el valor pH es más bajo y, por consiguiente, la concentración de H+ es más elevada que en la saliva circundante, mientras que el contenido en O2 es más bajo. Lo mismo ocurre en poros superficiales de una corona sometida a un acabado deficiente o en intersticios entre distintas partes de un trabajo protésico. La causa de esta corrosión es el empobrecimiento de O2 en el electrolito en zonas a las que no puede llegar rápidamente nuevo oxígeno. El oxígeno es ligado en estas zonas mediante procesos de oxidación y no se completa con la suficiente rapidez. Mientras que en ausencia de O2 los iones metálicos pueden permanecer en solución, en presencia de una oferta suficiente de O2, es decir, fuera de la zona empobrecida en cuanto a oxígeno, se depositan como capa compuesta por óxidos o hidróxidos.
Para la evaluación de la biocompatibilidad de una aleación, sin duda son importantes la cantidad y el tipo de los iones disueltos. A fin de determinar dichos parámetros, se lleva a cabo un ensayo de corrosión mediante el denominado ensayo de inmersión, descrito en la norma DIN EN ISO 10271. Se almacenan pequeñas placas de tamaño definido en una solución de NaCl de 1 mol y ácido láctico de 1 mol con un valor pH de 2,3 durante 7 días a una temperatura de 37 ºC, y a continuación se analiza el contenido en productos de corrosión presente en la solución. El valor límite de la liberación corrosiva está establecido en la DIN EN ISO 22674 con 200 µg/cm2 en 7 días.
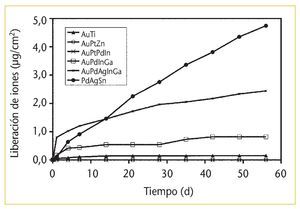
Las aleaciones de metales nobles muestran un comportamiento de corrosión muy distinto en función de su composición. Las aleaciones a base de paladio presentan una mayor propensión a la corrosión que las aleaciones con elevado contenido en oro, independientemente del ensayo de corrosión elegido3,11,65. Con el paso del tiempo, la pérdida superficial de metales no nobles conduce a un ennoblecimiento y por ende a una disminución de los índices de corrosión33,39,47 (fig. 4).
Fig. 4. Datos de corrosión a largo plazo de las aleaciones de la tabla 1. (Representación acumulada, cada valor medido indica la cantidad total de iones liberada en este momento). La tendencia a la saturación se observa claramente en el hecho de que el recorrido de las curvas se va suavizando.
En las aleaciones de metales no nobles, las aleaciones a base de níquel presentan un índice de corrosión claramente superior al de las aleaciones basadas en cobalto. Estas últimas pueden competir perfectamente con las aleaciones de metales nobles por lo que respecta a la pérdida de masa20,21,28. El motivo de la escasa corrosión reside, en las aleaciones sin metales nobles, en la formación de una capa de óxido muy estable, especialmente de óxido de cromo, que pasiviza la superficie protegiéndola así de nuevos ataques corrosivos. En caso de valor pH bajo, esto es, en contacto con ácidos, las aleaciones de metales nobles presentan una elevada resistencia a la corrosión, mientras que las aleaciones a base de níquel arrojan resultados más bien malos a este respecto53.
Junto a la composición de la aleación, la calidad de la manipulación protésica ejerce una influencia considerable sobre la resistencia de las aleaciones a la corrosión. Especialmente una estructura con rechupes e inhomogénea (fig. 5) puede conducir a un drástico aumento del índice de corrosión31. En términos generales, no es posible extraer conclusiones sobre el comportamiento de corrosión de una aleación a partir de su composición. Siempre es necesario llevar a cabo un ensayo de corrosión22.
Fig. 5. Estructura de un colado con rechupes, de grano grueso e inhomogéneo, que conduce a un drástico incremento de la corrosión.
En las aleaciones aptas para el recubrimiento cerámico, se forma sobre la superficie de la aleación una capa de óxido que es deseable de cara a una buena unión a la cerámica de recubrimiento (fig. 6). En superficies metálicas no recubiertas, esta capa de óxido debe eliminarse a conciencia mediante un pulido muy meticuloso. Un pulido deficiente de zonas de aleaciones metalocerámicas oxidadas y no recubiertas con cerámica conduce inevitablemente a un notable incremento del índice de corrosión en comparación con la superficie metálica (fig. 7). La consecuencia de este pulido insuficiente pueden ser los conocidos síntomas de la intolerancia al metal61,64.
Fig. 6. Imagen de microscopio electrónico de barrido de la capa de óxido sobre la superficie pulida de una aleación con elevado contenido en oro.
Fig. 7. Datos de corrosión a largo plazo de la aleación AuPtPdIn en los estados metálico y oxidado.
Iones metálicos en el organismo
Los metales nobles puros están considerados de por sí como biocompatibles, en virtud de su comportamiento inerte. Sin embargo, no debe perderse de vista el hecho de que también los materiales aparentemente inertes se corroen. Se trata más bien de una cuestión del índice de corrosión, es decir, la cantidad de iones liberados por unidad de tiempo. Los metales nobles presentan una corrosión prácticamente no medible. Sin embargo, las sales de metal noble pueden provocar reacciones de intolerancia acusadas1.
Por lo tanto, si los metales nobles se corroyeran en mayor medida no serían aptos para el uso clínico. En casos extremadamente infrecuentes se ha observado una dermatitis inducida por oro, conocida como crisiasis55. Una parte de los metales no nobles utilizados en las aleaciones dentales, como Co, Cr, Cu, Fe, Sn y Zn, son oligoelementos esenciales, sin los cuales no podrían desarrollarse determinadas reacciones bioquímicas en el organismo. Los demás iones metálicos liberados por las aleaciones deben considerarse, conforme al estado actual de los conocimientos, como sustancias extrañas para el organismo. Además de la acción fisiológica de los oligoelementos esenciales, todos los iones metálicos pueden provocar también reacciones patológicas. En este contexto, cabe distinguir entre las reacciones tóxicas y las alérgicas. Las reacciones tóxicas se producen en función de la dosis y con la misma intensidad en todos los individuos. De ahí que sean calculables y predecibles. En cambio, las reacciones alérgicas vienen determinadas genéticamente, son básicamente independientes de la dosis y por ende dependen en gran medida del individuo. No es posible realizar una predicción al respecto1.
Toxicidad
Las aleaciones sólo pueden desencadenar una reacción tóxica si se corroen en un medio biológico y forman productos de corrosión que sean reabsorbibles y pueden formar complejos metaloproteínicos tóxicos en combinación con proteínas. El efecto depende también de la vía de absorción, así como de la cantidad y velocidad de la absorción y la eliminación35. Se sabe que los oligoelementos esenciales en una dosis demasiado baja o demasiado elevada también pueden provocar reacciones patológicas37,41. Un buen ejemplo de ello es el cobre, cuya falta da lugar a la aparición de anemia, leucopenia y neutropenia45, mientras que, en caso de sobredosis, debido a la ausencia heredada recesivamente de ceruloplasmina, la proteína ligadora del cobre, las acumulaciones de Cu en el hígado y en el sistema nervioso central y las lesiones parenquimales resultantes de ello provocan la manifestación del síndrome de Wilson36. En general, las cantidades de iones metálicos liberados por corrosión se sitúan claramente por debajo de la cantidad que se suministra al organismo mediante la alimentación diaria. Por ejemplo, la ingesta diaria de Cu se sitúa entre 2 y 5 mg y la de Zn entre 10 y 15 mg25. Las mediciones de corrosión indican que las aleaciones de metales nobles de uso dental liberan una cantidad sensiblemente menor de iones (fig. 4). Las variaciones en la alimentación ejercen una mayor influencia en la concentración de iones metálicos en la saliva y en la orina que la colocación de una nueva restauración44.
Las reacciones tóxicas locales representan la mayoría de las reacciones de intolerancia a los materiales metálicos63. La causa reside en la concentración local comparativamente elevada de los productos de la corrosión, especialmente también debido a la acumulación de los elementos. Los fracasos clínicos60-62 se interpretan en este sentido, sin que de todos modos sea posible una demostración en toda regla30. Sin embargo, es evidente que a menudo se observa una carga de la encía por parte de los elementos de aleación en el entorno de las reconstrucciones metálicas40,59,61,62.
Alergenicidad
Las reacciones alérgicas a las aleaciones dentales desempeñan un papel secundario pero creciente48. Las reacciones alérgicas a iones metálicos son casi siempre del tipo retardado (reacción del tipo IV). Por regla general, la sensibilización no tiene lugar a través de la mucosa oral, sino mediante un primer contacto con la piel. Las células de Langerhans en la epidermis, las cuales identifican como alérgeno al ión metálico ligado a una proteína y lo ligan a su pared celular, migran a los nodos linfáticos regionales y presentan el antígeno a los linfocitos. Al mismo tiempo segregan citoquinas, especialmente interleuquina 1, a fin de atraer a otros linfocitos. Los linfocitos crean clones que, al contactar nuevamente con el alérgeno, desencadenan una acción inflamatoria como células efectoras1. La causa de la baja tasa de sensibilización a través de la mucosa es, por una parte, el enjuague constante de la cavidad oral y por ende la dilución de los alérgenos, y por otra parte, la mucosa presenta una permeabilidad mucho mayor a las moléculas que la piel, de modo que el tiempo de contacto de las células de Langerhans con el alérgeno es más corto1. Los síntomas orales de una reacción alérgica son enrojecimientos, papulovesículas, erosiones, inflamaciones edematosas, eccemas periorales y molestias subjetivas del paciente, como ardor, opresión, parageusias, dentera y sensación de cuerpo extraño. Debido a la necesaria mayor concentración de alérgeno en una estomatitis de contacto en comparación con una dermatitis de contacto, no todos los pacientes sensibilizados cutáneamente reaccionan con una estomatitis de contacto en caso de contacto alérgeno en la mucosa oral. La intensidad de una reacción alérgica no depende exclusivamente de la composición de la aleación, sino del tipo y la cantidad de los iones metálicos liberados. Las alergias a Au aparecen con muy escasa frecuencia7,19,57. Se conocen reacciones alérgicas a Ni, Co, Cr, Pd, Au y Pt10,50. No se dispone de datos confirmados sobre el potencial alergénico de los demás metales utilizados en las aleaciones de metales nobles43.
Los principales componentes de las aleaciones de metales no nobles Ni, Co y Cr son los alérgenos más potentes de entre los metales. Pero también en este caso la sensibilización o el desencadenamiento de una reacción alérgica depende de la dosis, y en virtud del bajo índice de corrosión en general estos materiales no presentan riesgos. Así, por ejemplo, un alérgico al NI puede tolerar perfectamente una prótesis dental que contenga Ni42,43.
En vista de la infrecuencia de las reacciones alérgicas, no se recomienda efectuar un test epicutáneo rutinario antes de cada restauración protésica43.
Ensayo biológico de las aleaciones dentales
En la norma ISO 7405 se recogen propuestas detalladas para el ensayo biológico de los materiales dentales, y en la norma ISO 10993-1, para todos los productos médicos, si bien para el ensayo de aleaciones dentales se han acreditado como adecuados especialmente el ensayo conocido como «direct cell contact assay» con cultivos de células y el ensayo de sensibilización en forma del test epicutáneo abierto26,27.
El ensayo de cultivo celular se ha revelado como un método de ensayo racional y de fácil manipulación para la investigación del potencial tóxico de un material. Este ensayo proporciona informaciones básicas importantes, si bien clínicamente éstas pueden ser modificadas por numerosas y complejas influencias56. Los resultados de los ensayos de cultivo celular dependen en gran medida de la línea celular escogida. Si bien la clasificación por rango de la citotoxicidad de diversos iones metálicos es la misma en distintos ensayos de cultivo celular, se observan diferencias claras en la magnitud de la reacción celular en función de la sensibilidad de las células empleadas54. Para realizar el ensayo se diseminan células, por ejemplo fibroblastos, en un medio de cultivo y se incuban durante 24 h. Transcurrido este tiempo se pone la sustancia a ensayar en el cultivo en contacto directo con las células. Al cabo de otras 24 h se examinan la morfología y la proliferación de las células (figs. 8a a 8d). Si no se observa ningún perjuicio al metabolismo celular, se evalúa como aceptable el riesgo de toxicidad.
Figs. 8a a 8d. Ensayo de citotoxicidad con fibroblastos. a Cultivo de fibroblastos 4 h después de la diseminación. b Cultivo de fibroblastos 24 h después de la diseminación. c Cultivo de fibroblastos 48 h después de la diseminación y 24 h tras la adición de la aleación a ensayar. El cuerpo de ensayo aparece negro en la fotografía al trasluz. Las células presentan una morfología normal también en el entorno inmediato del cuerpo de ensayo, la proliferación no está inhibida. d Cultivo de fibroblastos 48 h después de la diseminación y 24 h tras la adición del control positivo (caucho). Algunas de las células ya no presentan una morfología normal, la proliferación está claramente inhibida.
El test epicutáneo abierto se lleva cabo en cobayas. Para ello se colocan pequeñas placas de aleación sobre la piel rasurada del lomo del cobaya. El contacto tiene lugar a lo largo de cuatro semanas, cinco veces por semana durante doce horas cada vez. Durante estos 28 días puede producirse una sensibilización de los cobayas. Una semana después tiene lugar el test de provocación. Para ello se colocan las placas sobre una zona de la piel distinta que hasta ese momento nunca había estado en contacto con la aleación. En caso de que se haya producido una sensibilización, ahora deben poder observarse reacciones alérgicas26,27.
Una evaluación definitiva de la biocompatibilidad debe basarse en la suma de todos los conocimientos parciales de los distintos ensayos y de las observaciones clínicas que ya pudieran existir32. Sin embargo, todos los ensayos in vitro y con animales no pueden sustituir en última instancia al ensayo clínico de los materiales56.
Conclusión
Ningún biomaterial puede sustituir al tejido ausente en toda su función, de ahí que en la práctica clínica siempre deban aceptarse compromisos. La elección de un material adecuado debe orientarse por la función principal del tejido que se va a sustituir, teniendo en cuenta los posibles efectos secundarios58,63. Todas las aleaciones dentales comercializadas deben llevar el distintivo CE y por ende cumplir los requisitos de las normas. Sin embargo, a fin de minimizar riesgos, antes del uso clínico se deberían ensayar en un espectro lo más amplio posible las aleaciones antes del uso clínico. Por este motivo, para la máxima protección posible del paciente, debería llevarse a cabo tanto un ensayo de corrosión a largo plazo como un ensayo biológico de las aleaciones, ensayos éstos que no están prescritos como obligatorios.
Naturalmente, no es posible trasladar directamente al ser humano los resultados de los distintos ensayos4. De ahí que el odontólogo y el protésico dental deban adoptar también bajo su propia responsabilidad medidas para la minimización de riesgos. Para ello, ante todo es necesaria una anamnesis exhaustiva. Si existen sospechas de intolerancia, debería averiguarse qué metales no tolera el paciente. Por ejemplo, en caso de una alergia al níquel es aconsejable cambiar a una aleación sin Pd, dado que se han observado alergias cruzadas entre el níquel y el paladio49,51, si bien éstas no se producen necesariamente6. En cambio, hasta la fecha no se conocen alergias cruzadas entre el paladio y el platino, sobre todo por el hecho de que el paladio provoca principalmente alergias del tipo IV, mientras que el platino causa reacciones del tipo I mediadas por IgE2,38 (inmunoglobulina E). A la hora de escoger los materiales se deben tener en cuenta las aleaciones de las restauraciones ya presentes. La aleación prevista para la nueva restauración debería ser como mínimo similar a la aleación presente34, dado que de lo contrario se forman elementos galvánicos que, especialmente en contacto directo de las dos aleaciones distintas, pueden conducir a una mayor corrosión de la aleación menos noble.
En caso de primeras restauraciones, debería informarse al paciente de que en el sector de elevado contenido en oro existen alternativas a las aleaciones a base de Pd y de que la diferencia de precio sólo representa una fracción de los costes totales de la restauración23. De este modo se garantiza que el paciente pueda participar activamente en la decisión de cuáles son los materiales indicados para él y se evitan sorpresas tras la colocación de la prótesis dental.
El odontólogo es responsable de la elección de la aleación5. Sin embargo, no siempre es aconsejable prescribir al protésico dental una aleación si éste no está habituado a trabajar con dicha aleación46, dado que en ese caso existe un mayor riesgo de error de manipulación23. Si el protésico dental trabaja con una aleación de composición similar de otro fabricante, esto es perfectamente aceptable. Parece más importante la ejecución esmerada del trabajo protésico. Una aleación pulida presenta un índice de corrosión sensiblemente inferior al de una superficie de aleación no pulida o posiblemente todavía cubierta por óxidos29. La evitación de soldaduras innecesarias debería ser una obviedad, dado que los metales de aportación son a menudo una aleación de menor calidad en comparación con el material básico y pueden dar lugar a una corrosión galvánica. El protésico dental debería proporcionar al odontólogo los datos correspondientes, dado que el odontólogo está obligado a documentar estos datos5.
Las aleaciones actualmente disponibles satisfacen los requisitos normativos y en consecuencia pueden utilizarse siempre que la anamnesis no lo desaconseje. No obstante, de cara a la minimización de riesgos sería deseable reducir el valor límite de la liberación de iones desde 200 hasta 10 µg/cm2¿7d. Este valor se deriva de normativas nacionales previas. Los ejemplos aquí presentados demuestran que es posible alcanzar sin problemas este valor con las composiciones de aleación adecuadas.
Correspondencia
PD Dr. med. dent. Dr. rer. nat Jens Fischer.
Klinik für Kronen und Brückenprothetik, Teilprothetik und zahnärztliche Materialkunde. Zahnmedizinische Kliniken der Universität Zürich.
Plattenstrasse 11, 8032 Zúrich, Suiza.
Correo electrónico: jens.fischer@zzmk.uzh.ch
y
Vita Zahnfabrik.
Ballyweg 6, 79713 Bad Säckingen, Alemania.