
El radiólogo de urgencias ha de prepararse para enfrentarse a enfermedades de todo tipo, de cualquier órgano y en cualquier momento. Son muchas las entidades con afectación torácica por las que un paciente puede acudir a urgencias. En este capítulo se exponen las enfermedades que se manifiestan con opacidades pulmonares multifocales y que clínicamente pueden simular y diagnosticarse erróneamente como una neumonía. Se han abordado considerando la distribución más característica, con el objetivo de que fuesen identificables empleando la principal herramienta diagnóstica torácica de que se dispone en urgencias: la radiografía de tórax. Se exponen de forma esquemática, aportando claves diagnósticas radiológicas, clínicas, de laboratorio y antecedentes personales, a las que se puede tener acceso en la primera valoración del paciente.
Radiologists in the emergency department must be prepared to deal with any type of disease in any organ at any time. Many entities involving the chest can result in patients’ presenting at the emergency department. This chapter deals with entities that manifest with multifocal lung opacities and that can be mistaken for pneumonia. To facilitate their identification, this chapter approaches these entities by considering their most characteristic distribution on chest X-rays, the main diagnostic modality used for thoracic problems in the emergency department. Our schematic approach includes the key findings in patients’ personal histories, clinical examination, laboratory tests, and imaging studies that can be available during the initial workup.
En este capítulo se abordará de manera esquemática el diagnóstico diferencial en urgencias de las entidades pulmonares cuya semiología radiológica consista en opacidades pulmonares, bien en vidrio deslustrado, consolidaciones o ambas, multifocales, bilaterales, denominadas opacidades pulmonares multifocales (OPM). Se puntualizarán aspectos útiles y accesibles desde el ámbito de urgencias, como síntomas, tiempo de instauración del cuadro (agudo-subagudo), alteraciones de laboratorio y antecedentes clínicos y radiológicos que ayuden a un primer diagnóstico diferencial.
Salvo el edema agudo pulmonar, todas las enfermedades que se presentan pueden cursar con fiebre o febrícula, favoreciendo la confusión con infecciones. Síntomas como la tos, la disnea y el dolor torácico podrán presentarse en todas las enfermedades que se exponen, por lo que, en la práctica, tendrán una utilidad limitada para discriminarlas.
Se han excluido las entidades cuya semiología principal sea distinta de las OPM y las propias del paciente pediátrico, traumatizado u oncológico, o relacionadas con trasplante de progenitores hematopoyéticos u órgano sólido.
Revisión del temaEl diagnóstico diferencial se va a establecer con base en la distribución de las OPM en el eje axial, en el eje craneocaudal y finalmente, atendiendo a otras distribuciones.
En la figura 1 se resumen los datos clave de las entidades que se desarrollarán a lo largo del capítulo para que pueda servir de índice y de documento final de consulta del diagnóstico diferencial de las OPM.
Esquema de los datos diagnósticos clave de las entidades que pueden presentarse en la urgencia con opacidades pulmonares multifocales (OPM).
Se ha considerado como eje central la distribución predominante de las opacidades, conjuntamente con el curso clínico, las de instauración aguda a la izquierda, y subaguda, a la derecha de la imagen. Se han añadido los datos clave para cada enfermedad y, en cursiva, los hallazgos radiológicos, destacando el tipo de OPM y otros hallazgos radiológicos frecuentes o característicos. De arriba abajo se exponen las OPM de predominio central y en regiones inferiores (a), central y en regiones superiores (b), periférico y en regiones inferiores (c), periférico y en regiones superiores (d), en regiones superiores frente a regiones inferiores (e) y de distribución difusa (f).
DAD: daño alveolar difuso; EPID: enfermedad pulmonar intersticial difusa; GM-FSC: factor estimulante de colonias de granulocito y macrófagos; HAD: hemorragia alveolar difusa; NEA: neumonía eosinofílica aguda; NEC: neumonía eosinofílica crónica; NH: neumonitis por hipersensibilidad; NHnf: neumonitis por hipersensibilidad no fibrótica; NINE: neumonía intersticial no específica; NO: neumonía organizada; NIU: neumonía intersticial usual; QT: quimioterapia; UH: unidades Hounsfield; VD: vidrio deslustrado, NH: neumonitis por hipersensibilidad.
* Entidades descritas anteriormente en otra distribución más característica.
Se distinguen las OPM de predominio central, periférico y con gradiente anteroposterior.
OPM de predominio centralEdema agudo pulmonar cardiogénico. Cuando la enfermedad está evolucionada, tienen lugar las consolidaciones típicas en «alas de mariposa» de distribución típicamente central, perihiliar, correspondientes a la última fase del edema pulmonar cardiogénico, cuando el exceso de líquido acumulado en el pulmón por un fallo de la bomba cardíaca ya ocupa el espacio alveolar. En el edema pulmonar de origen cardiogénico, a diferencia de un edema por aumento de permeabilidad, la arquitectura pulmonar se preserva, permitiendo así que en la evolución del proceso se vayan afectando compartimentos diferentes1. Esto permite establecer una serie de fases que pueden diferenciarse radiológicamente, cuya detección ayuda a orientar el cuadro. Las manifestaciones de cada fase en la radiografía de tórax en bipedestación en el edema cardiogénico son2:
- –
Aumento retrógrado de la volemia hacia venas y arterias pulmonares por un fallo de la bomba cardíaca. Se manifiesta radiológicamente con dilatación de las venas pulmonares de los lóbulos superiores, que se reconocerá sobre todo comparando el calibre de los vasos con el visible en radiografías previas. En las venas de los lóbulos inferiores el hallazgo es menos reconocible porque se encuentran más ingurgitadas en situación basal por el efecto gravitacional, de modo que el exceso de volumen busca territorios menos congestionados, como los lóbulos superiores. En la progresión se dilatarán también las arterias pulmonares (hipertensión pulmonar poscapilar), que mostrarán un diámetro mayor que el bronquio acompañante, valorable en radiografía de tórax en la proximidad del hilio pulmonar (fig. 2a y b)1.
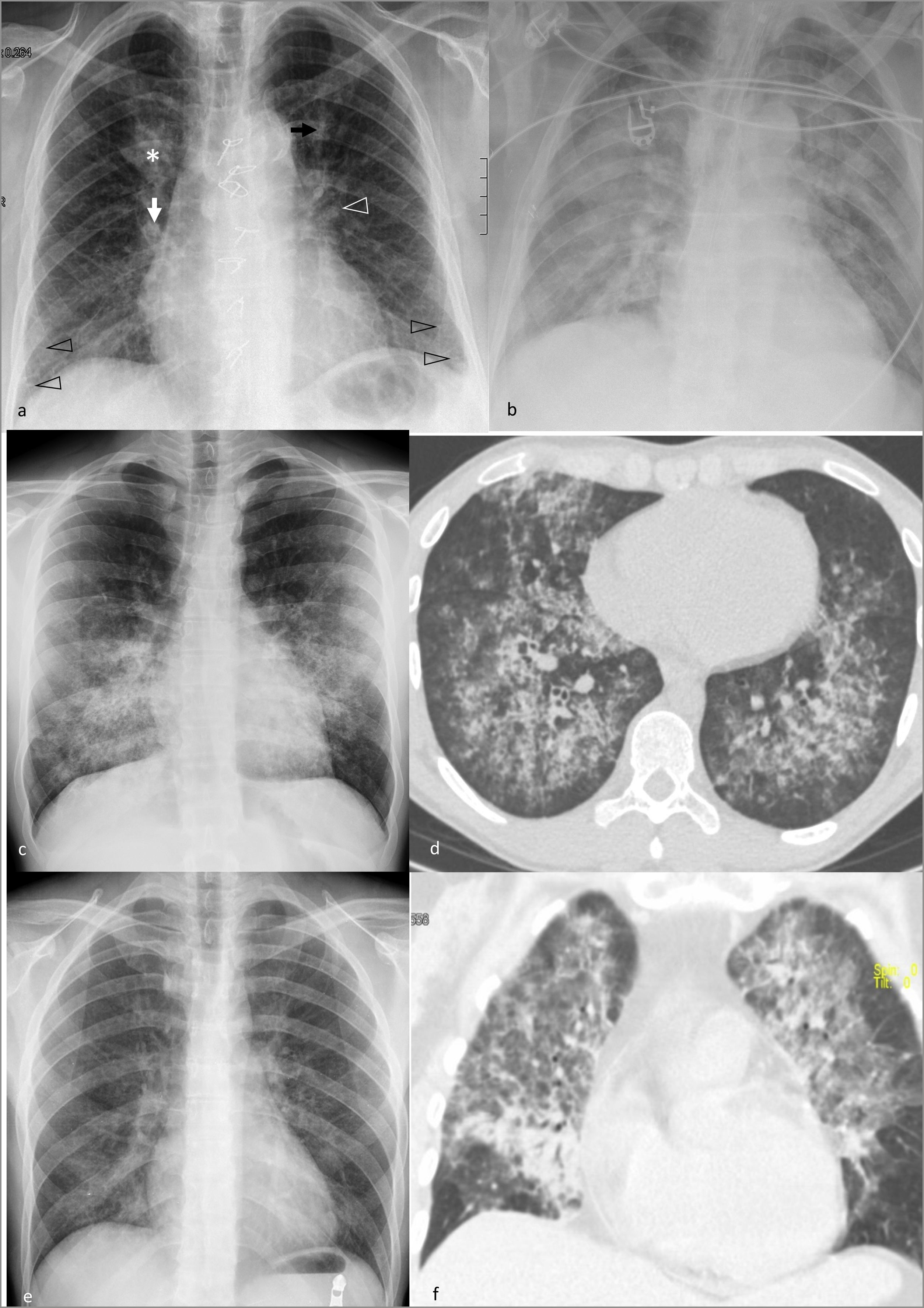
Figura 2.Opacidades pulmonares multifocales de distribución predominantemente central.
Edema agudo pulmonar cardiogénico en radiografía. a) Fase alveolar incipiente, con signos de volemia aumentada (dilatación de venas [flecha negra] y arterias pulmonares [flecha blanca], e índice cardiotorácico aumentado), de edema intersticial (engrosamiento de manguitos peribroncovasculares [cabeza de flecha blanca] y líneas B de Kerley [cabezas de flecha negras]) y de edema alveolar, con pequeña consolidación central en el lóbulo superior derecho (asterisco). b) Fase alveolar más evolucionada en otro paciente, con consolidaciones perihiliares en alas de mariposa.
Hemorragia alveolar difusa en paciente con síndrome de Goodpasture en radiografía (c) y tomografía computarizada (d), con consolidaciones centrales de predominio medio-basal, opacidades en vidrio deslustrado y reticulación, con respeto subpleural.
Neumonía por Pneumocystis jirovecii en paciente VIH positivo diagnosticado a posteriori, con opacidades centrales de predominio en regiones superiores, principalmente en vidrio deslustrado, en radiografía (e); en otro paciente, sometido a altas dosis de corticoterapia por un tumor cerebral, se objetiva una afectación más grave, con mayor extensión y densidad de las opacidades, predominantes en vidrio deslustrado y en regiones superiores, con respeto subpleural, en la tomografía computarizada (f).
(0.73MB). - –
Edema intersticial. Cuando el espacio vascular alcanza su máxima capacidad y la presión hidrostática capilar supera los 18mmHg, el líquido continúa ocupando el espacio intersticial pulmonar, tanto el axial o peribroncovascular (generando engrosamiento de los manguitos peribroncovasculares), como el interlobulillar (generando un patrón reticular fino de predominio central y bibasal, y las líneas de Kerley, siendo las líneas B las más características y fáciles de identificar en las radiografías, perpendiculares a la superficie pleural y en las bases pulmonares) (fig. 2a)3. En la evolución aparece característicamente el engrosamiento cisural y, a continuación, el derrame pleural, de distribución bilateral, aunque de predominio derecho, o únicamente derecho si es unilateral.
- –
Edema alveolar. A partir de 25mmHg de presión hidrostática capilar el intersticio no soporta el líquido acumulado y este termina ocupando el espacio alveolar, produciendo las consolidaciones centrales en «alas de mariposa» (fig. 2b), si bien solo se llega a esta situación en el 10% de casos1,3. Pueden encontrarse distribuciones atípicas del edema si asienta sobre un pulmón previamente desestructurado como en el enfisema, y excepcionalmente (2%), en casos de regurgitación mitral grave, en forma de consolidaciones en el lóbulo superior derecho4,5. Apoyarán el diagnóstico encontrar datos de cardiopatía, como un índice cardiotorácico aumentado, marcapasos, stents o by-pass coronario, la clínica de ortopnea y el aumento del NT-proBNP en la analítica. Los hallazgos radiológicos aparecen y se resuelven, con tratamiento, con rapidez.
Hemorragia alveolar difusa (HAD). Radiológicamente se manifiesta con OPM centrales que, aunque sean extensas, respetan característicamente la zona subpleural6. El componente en vidrio deslustrado suele ser extenso, y pueden asociar también consolidaciones, ocupación de vía aérea distal, con nódulos centrolobulillares o en árbol en brote. En la evolución aparece engrosamiento intersticial periférico. La aparición radiológica suele ser rápida; la resolución también, aunque menos que la del edema. Las opacidades alveolares y el engrosamiento septal causados por un episodio de hemorragia aguda se resuelven en 2 semanas7. La hemoptisis es el síntoma cardinal, pero está ausente en un tercio de los casos, además de no ser exclusiva de la HAD. Cursa con leucocitosis y anemia. La presencia de hematuria y elevación de creatinina indica un síndrome renopulmonar, siendo estos responsables de la mayoría de las hemorragias alveolares7. La granulomatosis con poliangitis (antigua granulomatosis de Wegener), una de las vasculitis con anticuerpos anticitoplasma de neutrófilo positivo, es la más frecuente. Asocia sinusitis en un 75-90% y estenosis traqueo-bronquial en un 20%. Se sigue del síndrome de Goodpasture, con positividad para anticuerpos antimembrana basal glomerular y con un pico de enfermedad en jóvenes varones (fig. 2c-d)7. En pacientes anticoagulados debe indicarse la anticoagulación como causa más probable; no es infrecuente su asociación con el edema agudo pulmonar al tratarse de pacientes de mayor edad. La diferenciación radiológica entre edema pulmonar y hemorragia alveolar puede ser compleja8.
Neumonía por Pnemocystis jirovecii (P. jirovecii). Característicamente da OPM de predominio central o difuso, con respeto de la zona subpleural6. El componente de vidrio deslustrado es claramente protagonista y puede asociarse engrosamiento intersticial dando lugar a un patrón «en empedrado»9–11. En la evolución asocia consolidaciones que, según algunos autores, tienden a distribuirse hacia lóbulos superiores, a diferencia de la HAD11,12. Estarán ausentes los signos de aumento de volemia y de ocupación por edema del espacio intersticial, típicos del edema (fig. 2e-f). En fases avanzadas puede dar quistes pulmonares que eventualmente pueden complicarse con neumotórax, pero es raro encontrarlos al diagnóstico. Apoyará el diagnóstico el antecedente de VIH positivo, aunque a menudo esta es la primera manifestación de la enfermedad, así como una instauración subaguda (1-2 semanas), salvo si se da en el contexto de corticoterapia o inmunosupresión por quimioterapia, circunstancias en las que el cuadro clínico y las OPM pueden desarrollarse de forma más rápida13. Suelen presentarse con hipoxemia grave refractaria a tratamiento con requerimiento de ingreso en la Unidad de Cuidados Intensivos. La linfopenia y la elevación de LDH serán otros datos característicos14.
OPM de predominio periféricoNeumonía por SARS-CoV-2. La distribución de las OPM es clave. Predominan en la periferia y regiones posteriores de campos medios e inferiores11,15. Si las OPM predominan en lóbulos superiores o región central, deben considerarse otras entidades11. Suele comenzar, en la primera semana del cuadro, con opacidades parcheadas en vidrio deslustrado, a veces asociadas a reticulación. Evolutivamente en casos más graves aparecen consolidaciones16, a veces seudonodulares, con patrón de neumonía organizada (fig. 3a). El pico máximo de afectación pulmonar se alcanza en los 3 días para casos leves y 2 semanas en casos con gravedad moderada15. La mayoría de los cuadros son leves. Sin embargo, algunos pueden desarrollar disnea (típicamente a los 5-8 días del comienzo)15, linfopenia y, en casos más graves, hipoxemia, de forma similar a la neumonía por P. jirovecii. Además de las diferencias semiológicas radiológicas entre ambos, la neumonía por SARS-CoV-2 se desarrolla generalmente más rápido, en horas o días desde el comienzo del cuadro 11. Por otra parte, las dilataciones vasculares en el seno de la afectación parenquimatosa y el signo del halo invertido con su variante, el signo de la diana, son signos característicos de la neumonía por SARS-CoV-217,18. Cuando la enfermedad es grave pueden evolucionar entre la primera y la tercera semana desde el comienzo de los síntomas hacia opacidades difusas, cuyo principal diagnóstico diferencial y desenlace posible es el síndrome de distrés respiratorio agudo (SDRA)5,9. En la segunda o tercera semanas ya aparecen cambios reparativos, con reticulación, líneas curvilíneas subpleurales, bandas parenquimatosas, opacidades retráctiles con morfología «en banda», paralelas a la superficie pleural, dilataciones bronquiales y distorsión, mayoritariamente reversibles15. Este patrón de la enfermedad corresponde a las primeras oleadas. Probablemente la vacunación y las nuevas variantes del virus puedan modificar esta forma de presentación hacia formas radiológicas más leves19.
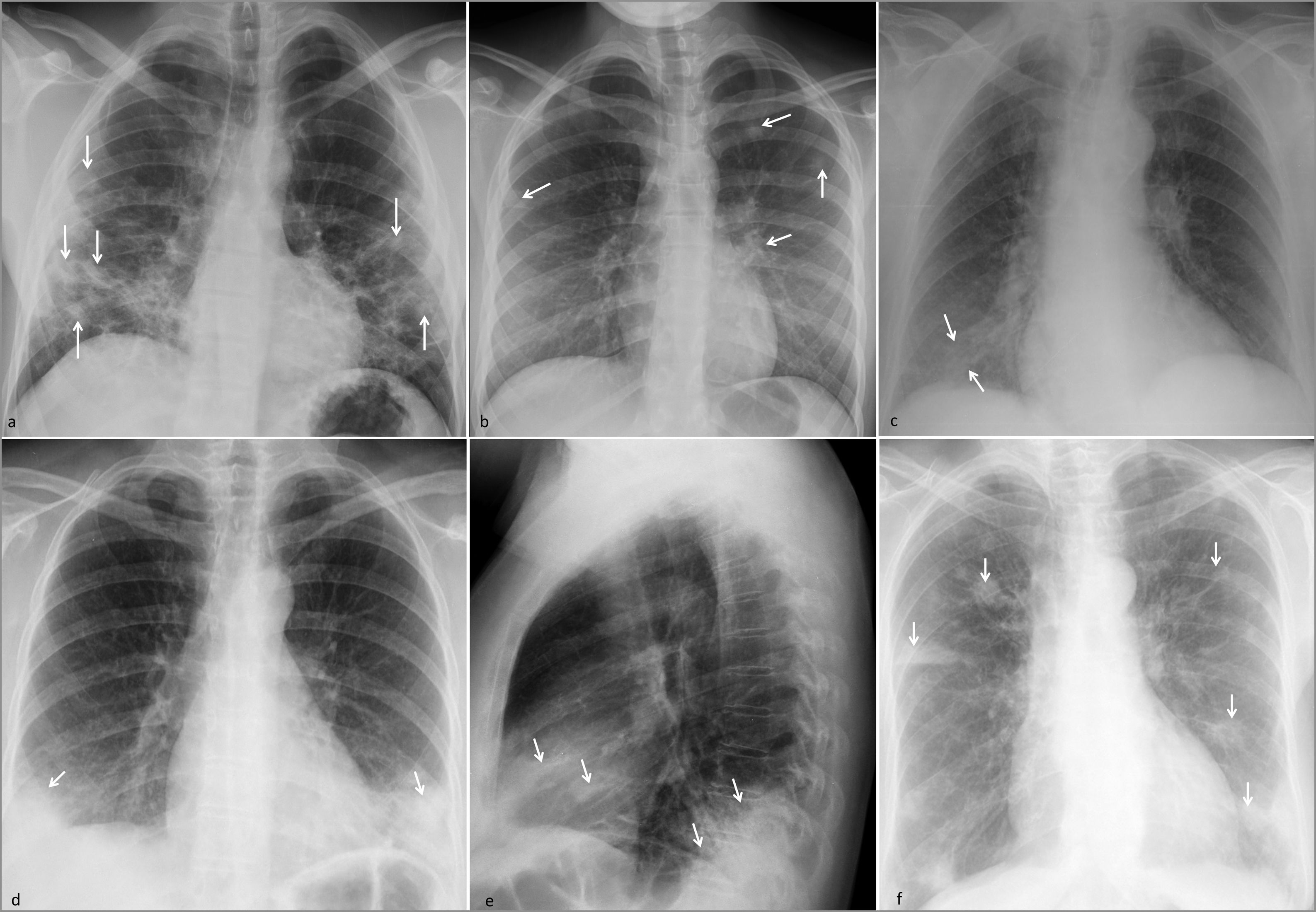
Opacidades pulmonares multifocales de distribución predominantemente periférica.
Neumonía por SARS-CoV-2. a) Opacidades en vidrio deslustrado con pequeñas consolidaciones en campos medios e inferiores (flechas) en paciente joven con cuadro clínico de semanas de evolución.
Émbolos. b) Émbolos sépticos en paciente con foco séptico cutáneo y bacteriemia por Staphyloccocus aureus, con consolidaciones tenues de predominio periférico (flechas). c) Consolidación periférica por infarto pulmonar secundario a tromboembolia pulmonar aguda (flechas).
Neumonía organizada. d y e) Consolidaciones densas periféricas en lóbulos inferiores y lóbulo medio (flechas). La paciente tenía antecedentes de artritis reumatoide y episodios previos de neumonía organizada.
Neumonía eosinofílica crónica. f) Consolidaciones densas periféricas con cierto predominio en regiones superiores (flechas). La paciente, de edad mediana, tenía antecedentes de episodios previos.
Émbolos. Ocasionan OPM a modo de consolidaciones característicamente periféricas (subpleurales), de predominio en campos medios e inferiores, con forma nodular o triangular, correspondientes a infartos. En un contexto séptico, el cuadro puede orientarse hacia émbolos sépticos, sobre todo si las OPM están cavitadas y se halla un foco séptico, algunos detectables en el contexto urgente (cutáneo, dentígeno, etc.) (fig. 3b). En la TC podrá verse el halo en vidrio deslustrado, correspondiente con hemorragia, que traduce su condición de infarto hemorrágico, así como el signo del halo invertido, característico en un contexto apropiado20 y el signo del vaso nutricio, correspondiente a un vaso que alcanza el seno de la consolidación. En los infartos asépticos, principalmente por tromboembolia pulmonar aguda, la cavitación es menos frecuente, pero pueden encontrarse áreas radiolucentes centrales. Será clave detectar defectos de repleción en arterias pulmonares (fig. 3c).
Neumonía organizada21. Cursa con OPM periféricas, de predominio en las bases, pero también con distribución peribroncovascular y patrón perilobular (fig. 3d-e)22. En el interior de las consolidaciones se producen dilataciones bronquiales y es característico el signo del halo invertido22. Tiene un curso clínico subagudo, migratorio y recurrente. Frecuentemente se relaciona con otras entidades, como la artritis reumatoide, los fármacos o las infecciones previas, aunque puede darse de forma criptogénica. A menudo se enfoca inicialmente como un proceso neumónico.
Neumonía eosinofílica crónica. OPM en forma de consolidaciones característicamente periféricas, y de predominio en los campos superiores y medios (fig. 3f)23. Cuando son muy extensas, pueden manifestarse como el «negativo del edema agudo pulmonar», aunque solo se da en un tercio de casos23. Asocian adenopatías mediastínicas en el 50%. Las OPM migratorias y recurrentes constituyen un rasgo característico, aunque no patognomónico, visible también en la neumonía organizada y las vasculitis, pero útil para disuadirnos de la posibilidad infecciosa23. Se da frecuentemente en mujeres de edad mediana, con curso clínico subagudo y eosinofilia periférica.
OPM con gradiente anteroposteriorEdema por aumento de permeabilidad o SDRA2. Se produce una agresión parenquimatosa que produce daño alveolar y un edema por aumento de permeabilidad. A diferencia del edema cardiogénico, no se encuentra un engrosamiento intersticial que anteceda a la afectación alveolar ni ingurgitación de venas ni arterias pulmonares, dado que no existe un fallo de la bomba cardíaca1. En el SDRA, las OPM se distribuyen de manera difusa o parcheada, alcanzando la periferia pulmonar. Normalmente tiene un desencadenante, que puede ser inmediato, como la aspiración de ácido gástrico o la transfusión de productos sanguíneos, o producido horas o días antes del cuadro de edema, como sepsis, traumatismos, cirugías, inhalación de tóxicos o «casi ahogamiento»24. Cuando el desencadenante es extrapulmonar puede desarrollarse un gradiente de afectación anteroposterior, con la porción pulmonar anterior o antideclive normal o incluso hiperinsuflada, la porción media afectada por opacidades en vidrio deslustrado y la porción declive, por consolidaciones con bronquios dilatados, y atelectasias. La pérdida de volumen en zonas declive puede estar compensada por la ventilación mecánica que habitualmente portan estos pacientes25. El derrame pleural es variable en esta entidad. El inicio clínico del SDRA suele preceder al radiológico, con hipoxia refractaria al tratamiento, requerimientos precoces de ventilación mecánica y puede asociar fiebre25,26. Si ante un cuadro clínico y radiológico compatibles no existe un desencadenante, se habla de neumonía intersticial aguda25. El daño pulmonar agudo postransfusional (TRALI, por sus siglas en inglés) es una causa infradiagnosticada de SDRA, pero que constituye la principal causa de mortalidad asociada a las transfusiones. Puede aparecer precozmente, incluso una hora postinfusión27. Ante signos radiológicos de edema no cardiogénico, detectar anemia o trombocitopenia serán datos clave. Debe diferenciarse de un edema hidrostático por la sobrecarga hídrica que supone la infusión de líquido, con características radiológicas de edema cardiogénico, pero sin los datos de ingurgitación vascular en venas ni arterias pulmonares, dado que no existe un problema de bomba cardíaca28. Otra entidad causante de SDRA es el síndrome de embolia grasa, que se manifiesta con OPM bilaterales con un gradiente anteroposterior de menor a mayor densidad; puede asociar reticulación y, a diferencia de otras causas de SDRA, nódulos <1cm mal definidos de distribución aleatoria2,29. El cuadro respiratorio se desarrolla característicamente en los 3 días siguientes a un traumatismo con fractura de huesos largos. Se produce por migración de la grasa de la médula ósea del hueso fracturado hacia las venas intramedulares. Se previene mediante inmovilización precoz de la fractura. Encontrar datos de embolia grasa en otros órganos, característicamente en la piel, la retina, el encéfalo, el esputo y la orina, apoyará este diagnóstico.
Según distribución en el eje craneocaudalOPM de predominio en regiones inferioresNeumonía aspirativa. Asienta en regiones declive, que corresponden a los lóbulos inferiores, sobre todo el derecho, y lóbulo medio en pacientes en bipedestación o sedestación, y a los segmentos posteriores de lóbulos superiores y apicales de los lóbulos inferiores en pacientes en decúbito supino. Pueden ser unilaterales en la región declive en pacientes en decúbito lateral30. Se caracterizan por consolidaciones densas con ocupación de vía aérea tanto distal como en la tráquea y bronquios. Puede asociar pérdida de volumen pulmonar por la ocupación por secreciones de la vía aérea grande (fig. 4a). Es la causa más frecuente de abscesos pulmonares. A menudo, los hallazgos radiológicos no aparecen en la primera radiografía realizada en el ámbito de la urgencia. Se da característicamente en pacientes con dificultades deglutorias, ya sea de origen digestivo o neurológico. La dilatación y la ocupación esofágica visible radiológicamente puede ser un dato clave31. Si el contenido aspirado es ácido gástrico, se producirá una neumonitis química, con desarrollo de los síntomas en minutos, con broncoespasmo e hipotensión, y que radiológicamente se comporta como un edema no cardiogénico32.
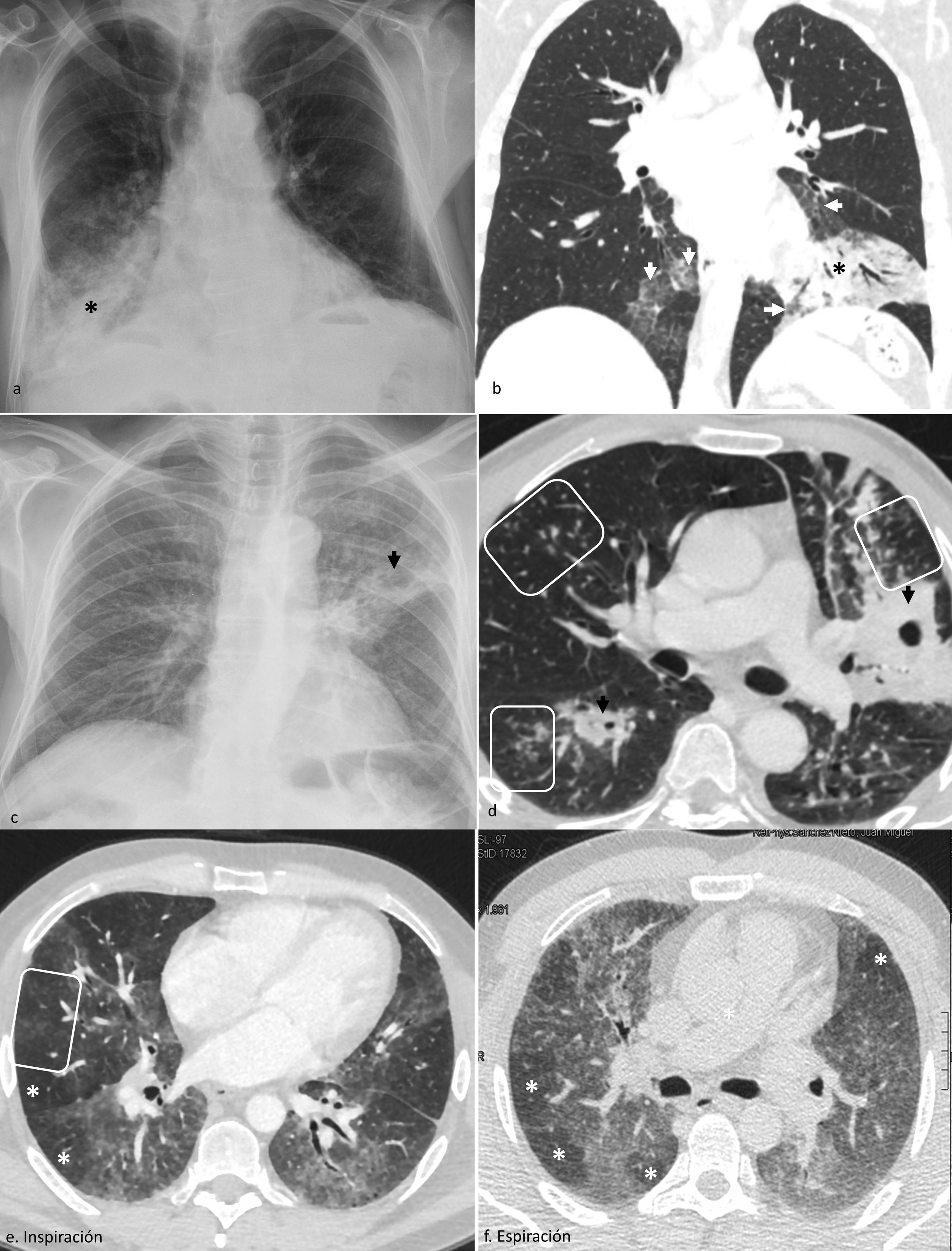
Opacidades pulmonares multifocales según su distribución en el eje craneocaudal.
Predominio en regiones inferiores: neumonía aspirativa (a), radiografía con consolidaciones en ambos lóbulos inferiores, sobre todo el derecho (asterisco); neumonía lipoidea (b), tomografía computarizada con opacidades en vidrio deslustrado en lóbulos inferiores (flechas), con reticulación asociada en el derecho y consolidación (asterisco) de baja atenuación en la ventana de mediastino (no mostrada) en el izquierdo.
Predominio en regiones superiores: reactivación tuberculosa, radiografía (c) y tomografía computarizada (d), con consolidaciones cavitadas (flechas negras) y nódulos en árbol en brote (recuadros) en regiones superiores (lóbulos superiores y segmentos apicales de los inferiores); neumonitis por hipersensibilidad no fibrótica en fase subaguda en tomografía computarizada en inspiración (e) y espiración forzadas (f), con patrón en 3 densidades: opacidades en vidrio deslustrado difusas, atrapamiento aéreo (asteriscos blancos) y pulmón normal (no mostrado), así como nódulos centrolobulillares en vidrio deslustrado (recuadro en e).
Neumonía nosocomial. Es aquella neumonía que aparece tras 48h desde el ingreso. La fiebre y la leucocitosis pueden estar ausentes, lo que dificulta la sospecha clínica. Suelen deberse a gérmenes gramnegativos, con más riesgo de complicaciones que la neumonía adquirida en la comunidad. La ventilación mecánica aumenta el riesgo, con prevalencia en torno al 40%, y empeora su pronóstico, con mortalidad en torno al 80%. Suelen manifestarse en forma de bronconeumonía con predominio en los lóbulos inferiores, aunque no siempre33. Puede complicar un edema agudo pulmonar de base, sobreinfección que debe sospecharse ante nuevas opacidades pulmonares uni o multifocales progresivas, con distribución distinta del edema, es decir, periférica/s, asimétrica/s y con una evolución más lenta.
Otras entidades, más infrecuentes: a) neumonitis por hipersensibilidad no fibrótica (NHnf) de presentación aguda; b) tuberculosis primaria, y c) neumonía lipoidea (fig. 4b)30,34,35.
OPM de predominio en regiones superioresReactivación tuberculosa. Por ser las regiones más oxigenadas del pulmón y con peor drenaje linfático, los lóbulos superiores y segmentos apicales de los lóbulos inferiores son su asiento típico, en pacientes inmunocompetentes o levemente inmunodeprimidos (fig. 4c-d)35.
NHnf de presentación subaguda. Es característico el «patrón en 3 densidades», que hace referencia a la combinación de pulmón normal con opacidades en vidrio deslustrado y atrapamiento aéreo, junto con los nódulos centrolobulillares mal definidos (fig. 4e-f)34.
Otras distribucionesOPM de distribución difusa. Es frecuente en cuadros agudos ya explicados, como la neumonía por P. jirovecii, la neumonía grave por SARS-CoV-2, el SDRA (fig. 5a-c) y la NHnf de presentación aguda. También es el patrón más frecuente en la neumonía eosinofílica aguda, que muestra consolidaciones difusas parcheadas no periféricas, con engrosamiento marcado de los septos interlobulillares en la TC y derrame pleural. No asocia adenopatías. Se presenta como un cuadro febril agudo de menos de 5 días e insuficiencia respiratoria aguda, simulando una neumonía23,36. A diferencia de otros procesos eosinofílicos, no suele asociar eosinofilia periférica, sí en el lavado broncoalveolar, ni historia de atopia o asma23. Puede evolucionar rápidamente hacia fallo respiratorio agudo, sin tratamiento. Procesos subagudos como la proteinosis alveolar o la neumonía por vapeo también siguen más frecuentemente esta distribución, ambos con respeto subpleural6,11.
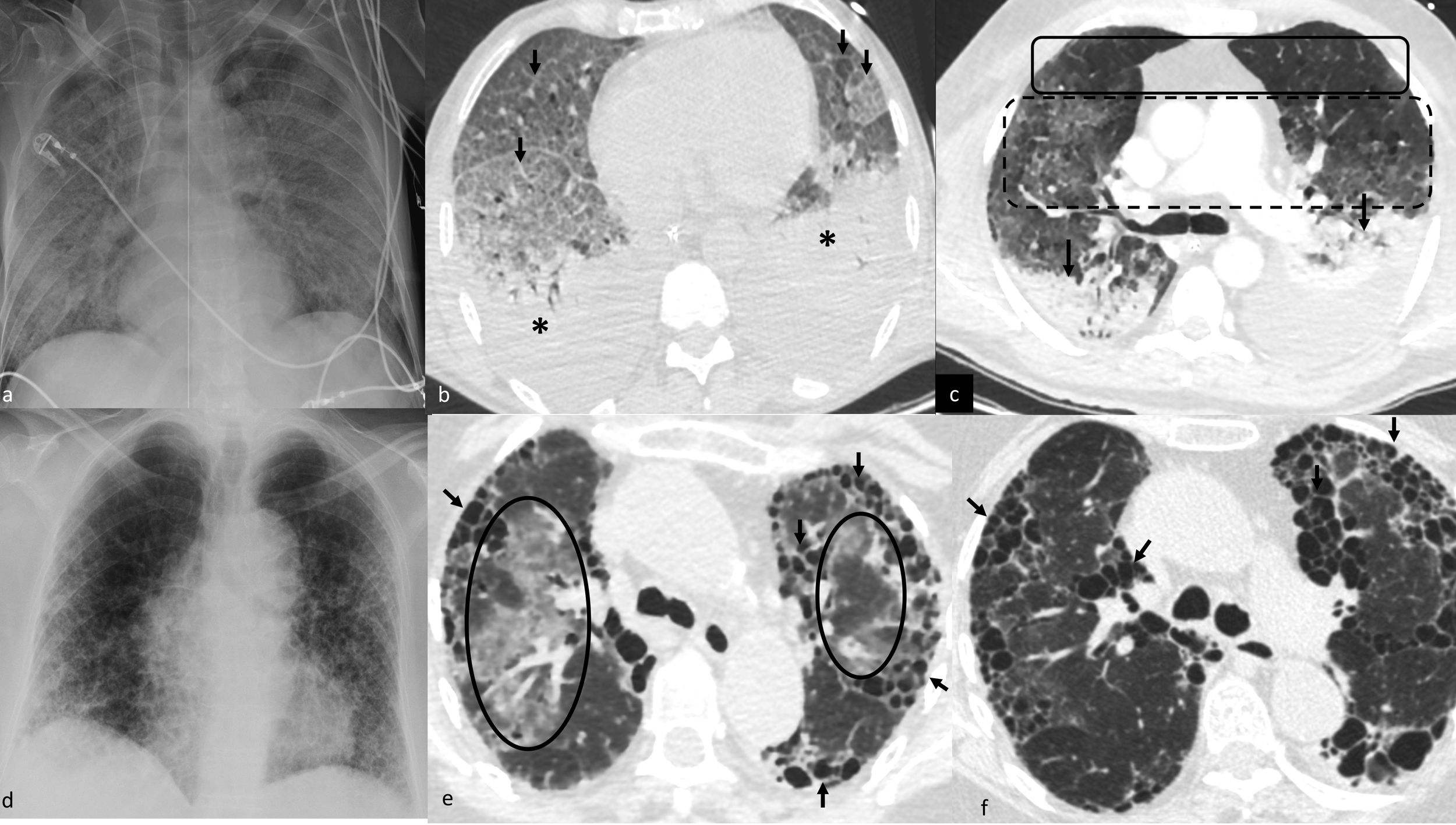
Opacidades pulmonares multifocales (OPM) con otras distribuciones.
Edema agudo pulmonar no cardiogénico de origen secundario: OPM en vidrio deslustrado de distribución difusa en radiografía (a) y tomografía computarizada (b), con engrosamiento intersticial asociado (patrón en empedrado, flechas en b) y consolidaciones en regiones declive (asteriscos en b). OPM en otro paciente (c) con gradiente anteroposterior más evidente, observándose pulmón normal (recuadro continuo), opacidades en vidrio deslustrado (recuadro discontinuo) y consolidaciones/atelectasias con bronquios dilatados (flechas) en la región más declive.
Exacerbación aguda de neumonía intersticial usual. Patrón reticular grosero de predominio periférico en la radiografía (d) correspondiente con áreas de panalización en la tomografía computarizada (flechas en e) y opacidades tenues en vidrio deslustrado en regiones pulmonares centrales (círculos en e). En la tomografía computarizada evolutiva se observa progresión de la panalización (flechas en f).
OPM en enfermedad pulmonar intersticial difusa (EPID). Se produce por exacerbación aguda de una EPID, principalmente la neumonía intersticial usual (NIU)37. Está infradiagnosticada. La exacerbación aguda se define como un «deterioro respiratorio agudo, radiológicamente caracterizado por OPM bilaterales con densidad en vidrio deslustrado o consolidaciones, no explicadas claramente por descompensación cardiopulmonar aguda, sobrecarga hídrica ni infección»38. Aparecen en el pulmón sano, que suele corresponder a las regiones centrales en estos pacientes (fig. 5d-f). Puede desencadenarla una agresión directa sobre el pulmón, como la biopsia, la cirugía o la radioterapia, o la quimioterapia39. Conlleva una progresión posterior de la fibrosis (fig. 5d-f). Reconocer el característico patrón reticular grosero periférico crónico de las EPID será muy útil, si bien la forma aguda puede ser su primera manifestación.
Conclusiones- 1.
La figura 1 resume las características de las entidades que pueden presentarse en urgencias con OPM.
- 2.
En un paciente con OPM el radiólogo debe detenerse en las sutilezas de los hallazgos radiológicos, la historia clínica y los datos de laboratorio antes de hablar únicamente de edema y bronconeumonía.
- 3.
En radiología torácica urgente:
- –
Fiebre y febrícula no son sinónimo de infección, pudiendo aparecer en todas las entidades expuestas, salvo el edema pulmonar agudo.
- –
Comparar con estudios previos permitirá detectar la rapidez de instauración de los hallazgos, si anteceden a las manifestaciones clínicas, enfermedad de base (cardiopatía, enfermedad oncológica, EPID, proceso recidivante) y hallazgos sutiles, como volemia pulmonar aumentada y edema intersticial.
- 1.
Responsable de la integridad del estudio JMPM
- 2.
Concepción del estudio JMPM
- 3.
Diseño del estudio JMPM
- 4.
Obtención de los datos. No aplicable
- 5.
Análisis e interpretación de los datos. No aplicable
- 6.
Tratamiento estadístico. No aplicable
- 7.
Búsqueda bibliográfica JMPM
- 8.
Redacción del trabajo JMPM
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes JMPM
- 10.
Aprobación de la versión final JMPM
La autora declara no tener conflicto de intereses.








![Opacidades pulmonares multifocales de distribución predominantemente central. Edema agudo pulmonar cardiogénico en radiografía. a) Fase alveolar incipiente, con signos de volemia aumentada (dilatación de venas [flecha negra] y arterias pulmonares [flecha blanca], e índice cardiotorácico aumentado), de edema intersticial (engrosamiento de manguitos peribroncovasculares [cabeza de flecha blanca] y líneas B de Kerley [cabezas de flecha negras]) y de edema alveolar, con pequeña consolidación central en el lóbulo superior derecho (asterisco). b) Fase alveolar más evolucionada en otro paciente, con consolidaciones perihiliares en alas de mariposa. Hemorragia alveolar difusa en paciente con síndrome de Goodpasture en radiografía (c) y tomografía computarizada (d), con consolidaciones centrales de predominio medio-basal, opacidades en vidrio deslustrado y reticulación, con respeto subpleural. Neumonía por Pneumocystis jirovecii en paciente VIH positivo diagnosticado a posteriori, con opacidades centrales de predominio en regiones superiores, principalmente en vidrio deslustrado, en radiografía (e); en otro paciente, sometido a altas dosis de corticoterapia por un tumor cerebral, se objetiva una afectación más grave, con mayor extensión y densidad de las opacidades, predominantes en vidrio deslustrado y en regiones superiores, con respeto subpleural, en la tomografía computarizada (f). Opacidades pulmonares multifocales de distribución predominantemente central. Edema agudo pulmonar cardiogénico en radiografía. a) Fase alveolar incipiente, con signos de volemia aumentada (dilatación de venas [flecha negra] y arterias pulmonares [flecha blanca], e índice cardiotorácico aumentado), de edema intersticial (engrosamiento de manguitos peribroncovasculares [cabeza de flecha blanca] y líneas B de Kerley [cabezas de flecha negras]) y de edema alveolar, con pequeña consolidación central en el lóbulo superior derecho (asterisco). b) Fase alveolar más evolucionada en otro paciente, con consolidaciones perihiliares en alas de mariposa. Hemorragia alveolar difusa en paciente con síndrome de Goodpasture en radiografía (c) y tomografía computarizada (d), con consolidaciones centrales de predominio medio-basal, opacidades en vidrio deslustrado y reticulación, con respeto subpleural. Neumonía por Pneumocystis jirovecii en paciente VIH positivo diagnosticado a posteriori, con opacidades centrales de predominio en regiones superiores, principalmente en vidrio deslustrado, en radiografía (e); en otro paciente, sometido a altas dosis de corticoterapia por un tumor cerebral, se objetiva una afectación más grave, con mayor extensión y densidad de las opacidades, predominantes en vidrio deslustrado y en regiones superiores, con respeto subpleural, en la tomografía computarizada (f).](https://static.elsevier.es/multimedia/00338338/00000065000000S1/v1_202303211149/S0033833822002259/v1_202303211149/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)




