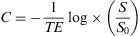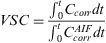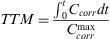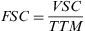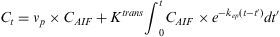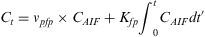Clasificar las áreas tumorales en pacientes con astrocitoma de grado IV mediante el cálculo y análisis estadístico de parámetros cuantitativos de perfusión por RM.
Material y métodosSe aplicaron 2 modelos de perfusión por RM, monocompartimental y farmacocinético, en 15 pacientes diagnosticados de astrocitoma grado IV. Con el modelo monocompartimental se cuantificó el volumen sanguíneo cerebral (VSC), el tiempo de tránsito medio (TTM) y el flujo sanguíneo cerebral (FSC). Con el farmacocinético se midió la constante de permeabilidad (Ktrans), el coeficiente de extracción (kep), la fracción de volumen del espacio intersticial (ve), la fracción de volumen vascular (vp), la permeabilidad en primer paso (Kfp) y el volumen vascular en primer paso (vpfp). Para cada parámetro se obtuvieron los histogramas del área tumoral total, peritumoral y sana. El análisis estadístico incluyó un análisis de varianza para cada parámetro y un análisis discriminante.
ResultadosLas diferencias más significativas entre las regiones se obtuvieron con el VSC, FSC, Ktrans y vpfp, siendo VSC el que mostró mejores resultados. La mejor función clasificatoria mediante análisis discriminante se obtuvo para una combinación de Ktrans y VSC. El análisis de la forma del histograma evidenció diferencias estadísticamente significativas para la curtosis de Ktrans y kep, así como para la asimetría de VSC, FSC, Ktrans y vpfp.
ConclusiónEl VSC es el parámetro que aisladamente permitió diferenciar mejor entre área tumoral, peritumoral y sana. La función clasificatoria generada a partir de VSC y Ktrans consiguió mejorar estos resultados haciendo más eficaz la clasificación por áreas.
To classify the tumor areas in patients with grade IV astrocytoma by calculating and statistically analyzing quantitative MRI perfusion parameters.
Material and methodsWe applied two models of MRI perfusion, the unicompartmental and the pharmacokinetic models, in 15 patients diagnosed with grade IV astrocytoma. In the unicompartmental model, we quantified cerebral blood volume (CBV), mean transit time (MTT), and cerebral blood flow (CBF). In the pharmacokinetic model, we measured the permeability constant (Ktrans), the extraction coefficient (kep), the fraction of the volume in the interstitial space (ve), the fraction of the volume in the vessels (vp), the permeability in the first pass (Kfp), and the vascular volume in the first pass (vpfp). For each parameter, histograms were obtained for the total tumor area, for the peritumoral area, and for the healthy tissue. The statistical analysis included an analysis of variance for each parameter and a discriminant analysis.
ResultsThe most significant differences between the regions were obtained with CBV, CBF, Ktrans, and vpfp; of these, CBV had the best results. The best classificatory function on the discriminant analysis was the combination of Ktrans and CBV. The analysis of the shape of the histogram showed statistically significant differences for the kurtosis of Ktrans and kep, as well as for the skewness of CBV, CBF, Ktrans, and vpfp.
ConclusionWhen parameters are considered individually, CBV is the one that best enables differentiation between tumor, peritumoral, and healthy tissue. The classificatory function generated from CBV and Ktrans results in improved classification by areas.
Los astrocitomas son los tumores cerebrales primarios más frecuentes del SNC. La OMS los clasifica en circunscritos o difusos1. Solo los astrocitomas grado I se consideran circunscritos, mientras que son difusos los grado II o astrocitomas de bajo grado, grado III o anaplásicos, y grado IV o glioblastomas.
Los glioblastomas forman el grupo más numeroso y con peor pronóstico, con una supervivencia media que oscila entre 8–15 meses2. Son tumores heterogéneos que tienen una clara disposición a infiltrar el tejido cerebral siguiendo las estructuras vasculares y los haces y comisuras de la sustancia blanca. Normalmente, la resección quirúrgica completa de estas lesiones no es posible.
El diagnóstico anatomopatológico del glioblastoma se realiza en función de la atipia celular, la presencia de mitosis, la proliferación vascular y la necrosis. Las muestras histológicas se obtienen por biopsia o resección quirúrgica, estando sujetas a errores de muestreo al ser lesiones muy heterogéneas, incluso en el caso de las resecciones amplias. Este sesgo puede conducir a catalogar un tumor en un grupo al que no pertenece, con el consiguiente riesgo de establecer un pronóstico y recibir un tratamiento inadecuado. Por otra parte, no hay una correlación completa entre el grado histológico y el comportamiento biológico del tumor. La clasificación actual de los tumores puede fallar a la hora de predecir la respuesta individual de cada tumor dentro del mismo grado histológico3.
El incremento del número de vasos es una de las características histológicas de los tumores de alto grado y uno de los parámetros fisiológicos que indican la actividad biológica de los tumores, siendo un claro factor predictivo de mal pronóstico4. Estos vasos neoformados son más tortuosos e inmaduros, presentando un aumento de la permeabilidad a las macromoléculas respecto a los vasos del tejido cerebral sano.
La angiogénesis en los tumores del SNC no puede cuantificarse de manera eficaz con los estudios de RM convencionales, debiendo emplearse secuencias especiales de perfusión potenciadas en T2* y herramientas adecuadas de posproceso. Estas secuencias se basan en la pérdida de señal por efecto de la susceptibilidad magnética que produce un medio de contraste paramagnético al circular por los vasos cerebrales. Esta reducción de señal es proporcional a la concentración del contraste y al volumen sanguíneo cerebral5. Los parámetros de perfusión con estas secuencias dinámicas de susceptibilidad magnética permiten demostrar de forma indirecta el grado de neoangiogénesis y la permeabilidad capilar de los vasos tumorales, los cuales pueden considerarse como marcadores biológicos de malignidad.
Los parámetros obtenidos de las secuencias de perfusión pueden proporcionar información in vivo de la fisiología de los tumores que complemente la gradación histopatológica, convirtiéndolos en marcadores indirectos de la neoangiogénesis6,7. Dada la enorme heterogeneidad en la distribución espacial de los neovasos, los valores obtenidos se deben calcular para la totalidad del tumor y no limitarse a áreas específicas, como sucede en el caso de las biopsias y las resecciones quirúrgicas. Es por tanto una clara necesidad metodológica el análisis de aquellas áreas concretas del tumor con valores más representativos.
Existen 2 modelos basados en la imagen para abordar la cuantificación in vivo de parámetros hemodinámicos: el basado en un análisis monocompartimental de la morfología de las curvas de captación y el multicompartimental con criterios farmacocinéticos.
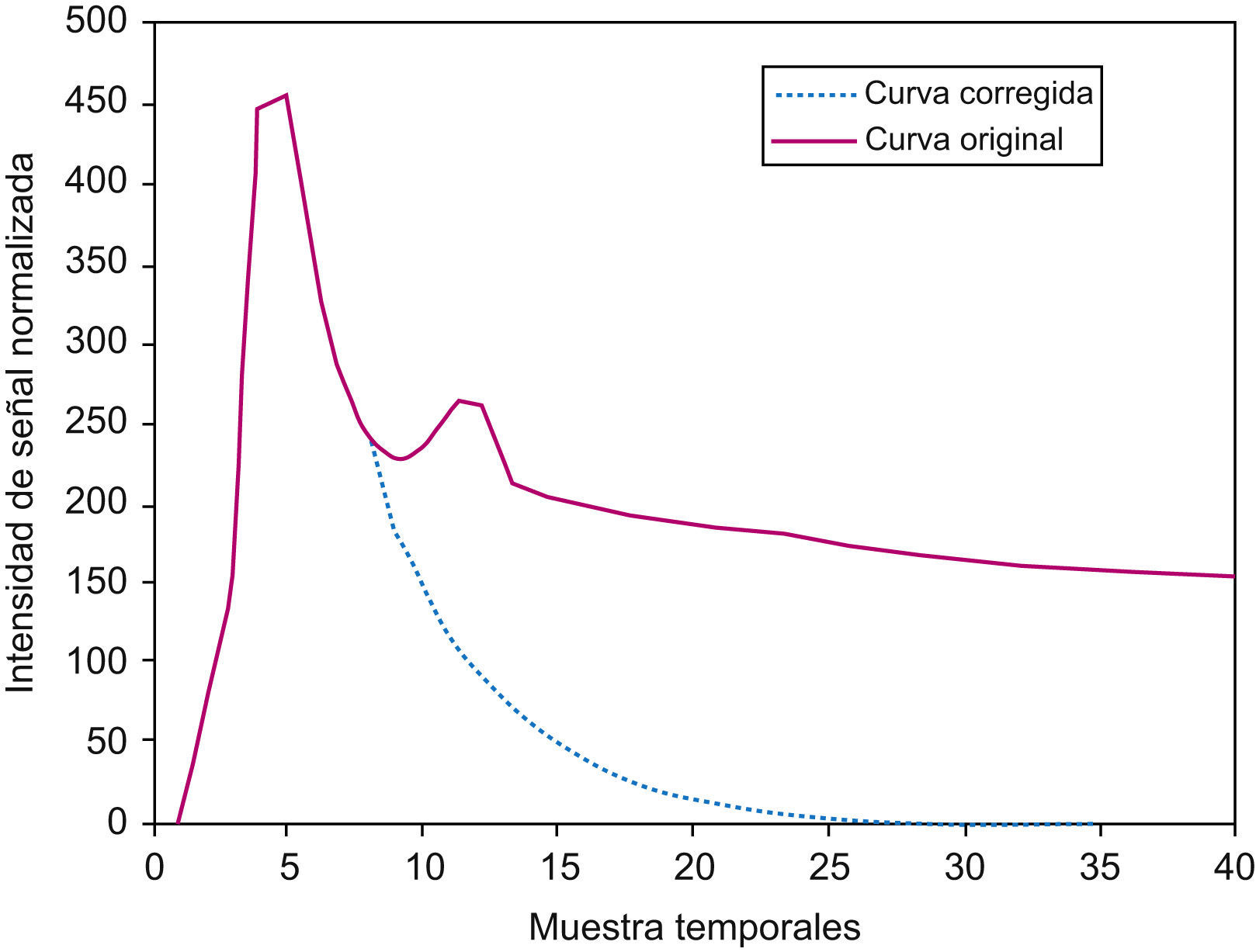
En el modelo monocompartimental de morfología de curva se asume que la concentración tisular del contraste es una función del volumen de contraste inyectado y del espacio vascular, asumiendo que la recirculación y la extravasación son insignificantes5. En la práctica esta situación no es real y para poder cuantificar se utilizan diversas aproximaciones. La más sencilla considera como área de estudio para realizar el cálculo solo el área desde el inicio de la caída hasta la recuperación de la señal. Este método lleva a sobreestimar el volumen sanguíneo en las lesiones cerebrales que tienen rotura de la barrera hematoencefálica. Otra opción es estimar el principio y el final del bolo y calcular el área que queda bajo la curva (curva corregida). Esta estimación se realiza corrigiendo la curva adquirida mediante un ajuste por una función gamma o una exponencial, de manera que la curva ajustada no presenta recirculación (fig. 1). En general, con estas aproximaciones no se pueden obtener medidas absolutas fiables, por lo que la tendencia es a utilizar valores normalizados respecto a la sustancia blanca contralateral8.
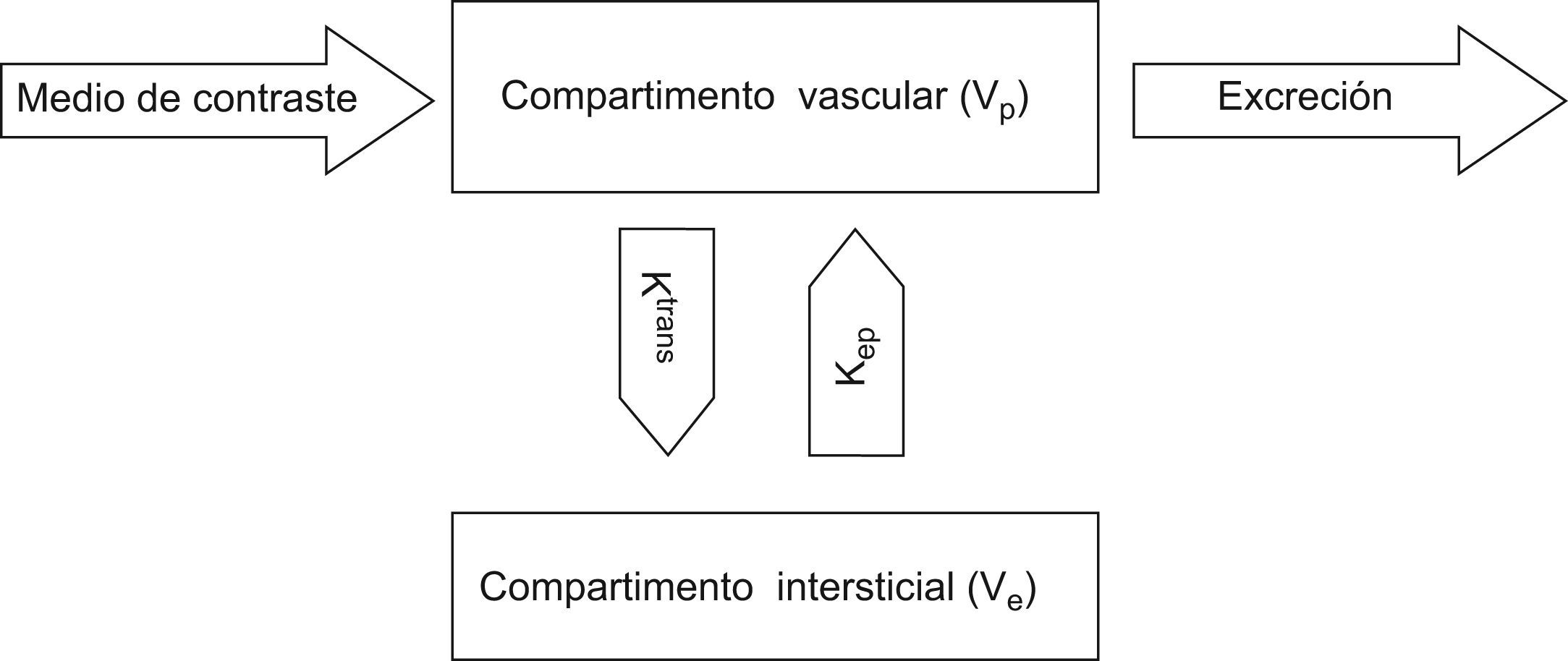
En el modelo farmacocinético multicompartimenal se plantea un intercambio bidireccional de flujos entre los compartimentos intravascular y el espacio extravascular extracelular9. Mediante este modelo las curvas de captación del tejido y de la arteria que lo irriga se usan para determinar la permeabilidad capilar, el coeficiente de extracción y los porcentajes de volumen tisular ocupados por vasos e intersticio (fig. 2). Aunque este modelo suele utilizarse con imágenes potenciadas en T1, las imágenes T2* también constituyen una fuente adecuada de datos de perfusión.
Los datos de perfusión se suelen calcular dibujando manualmente múltiples regiones de interés (ROI) habitualmente en la región tumoral, en la zona peritumoral y en la región contralateral sana. De los vóxeles de estas regiones se analizan las curvas de captación y o bien se promedian los valores para cada una de estas regiones o se grada la lesión con sus valores máximos como expresión de las áreas más relevantes. Aunque se ha demostrado que las medidas relativas obtenidas mediante esta metodología son reproducibles y sensibles, se trata de una aproximación con un componente subjetivo, ya que los resultados dependen de la elección de las regiones de interés que pueden coincidir o no con las zonas de mayor perfusión y por tanto con una inevitable variabilidad inter e intraobservador que parcialmente puede soslayarse con la experiencia del operador10. En contraposición, la utilización de histogramas permite estudiar regiones completas, ya que manejan las distribuciones de todos los valores de una región, con lo que los datos se pueden ordenar y agrupar en percentiles para a continuación realizar cálculos estadísticos sobre cada distribución. De esta forma disminuye la subjetividad asociada a dibujar pequeñas regiones dentro de la lesión y se obtiene más información que caracteriza el tejido de una forma más integral y exacta.
El objetivo del trabajo es clasificar las áreas tumorales en pacientes con astrocitoma de grado IV mediante el cálculo y análisis estadístico de parámetros cuantitativos de perfusión por RM. Para ello se aplicarán modelos matemáticos de uno y dos compartimentos y se realizará un análisis optimizado de histogramas por regiones.
Material y métodosSujetos de estudioSe realizó un estudio retrospectivo de pacientes con astrocitomas de grado IV (glioblastoma) diagnosticados mediante estudio histopatológico. El diagnóstico anatomopatológico, basado en la clasificación de los tumores cerebrales propuesta por la OMS1, se obtuvo tras resección quirúrgica en 12 (80%) y por biopsia en 3 pacientes (20%).
Se incluyen un total de 15 pacientes (11 hombres y 4 mujeres) estudiados en el periodo comprendido entre enero de 2006–julio de 2008, todos ellos con estudios de RM de perfusión tras la administración de un medio de contraste. El rango de edad de los pacientes se situó entre 28–74 años (58,3±12,9 años, media±desviación típica). Ninguno de los pacientes había recibido tratamiento oncológico previo a la obtención de las imágenes y todos los estudios se realizaron antes del abordaje quirúrgico. La localización de los tumores fue temporal en 8 (53,3%), frontal en 5 (33,3%) y parietal en 2 (13,3%).
No se solicitó el consentimiento del comité de ética del hospital para la realización del trabajo, ya que los exámenes de RM de los pacientes se obtuvieron dentro de la práctica asistencial habitual.
Adquisición de las imágenesTodos los estudios de RM se realizaron con un equipo de 1,5T (Philips Intera, Philips Cuidados de la Salud, Países Bajos) con una bobina de cabeza multielemento de 8 canales. A todos los pacientes se les realizó un estudio convencional que incluyó:
- •
Sagital TSE-T1 (TR 500ms, TE 20ms, tamaño de vóxel 0,5×0,5×5mm).
- •
Coronal TSE-FLAIR (TR 1.100ms, TE 140ms, TI 2.800ms, tamaño de vóxel 0,5×0,5×6mm).
- •
Transversal TSE-T2 (TR 2.000ms, TE 120ms, tamaño de vóxel 0,4×0,4×5mm).
- •
Transversal TSE-T1 (TR 500ms, TE 20ms, tamaño de vóxel 0,4×0,4×5mm).
- •
Transversal potenciada en difusión (TR 2946ms, TE 74ms, factores b de 0 y 1.000s/mm2, tamaño de vóxel 0,9×0,9×5mm).
- •
Secuencias con contraste intravenoso TSE-T1 (TR 500ms, TE 20ms, tamaño de vóxel 0,5×0,5×5mm) adquiridas en los 3 planos después del estudio de perfusión.
El estudio de perfusión se adquirió con la técnica dinámica de susceptibilidad magnética potenciada en T2* tras la administración de contraste. Se empleó una secuencia EPI eco de gradiente (EGR) segmentada con TR 836ms, TE 30ms, ángulo de inclinación de 40°, espesor de corte de 7mm y una matriz de 128×128 (resolución en plano de 1,8×1,8mm) con una cobertura cráneo-caudal de 13–14cm (19–20 cortes). En el estudio dinámico se obtuvieron un total de 40 volúmenes secuenciales con un tiempo de adquisición de cada uno de 2,4 segundos. La administración de contraste se realizó con una bomba de infusión, usando como vía venosa periférica habitualmente la vena antecubital, cateterizada con una cánula 18G. Se utilizó gadodiamida (Omniscan, GE Healthcare, EE.UU.) a una dosis de 0,2mmol/kg y a una velocidad de 5ml/s. Se completó con una embolada de suero fisiológico de 30ml al mismo flujo. La administración del contraste se realizó al iniciar la adquisición de la tercera secuencia de volúmenes.
Las imágenes adquiridas se transfirieron a una estación de trabajo para procesarlas con un programa de desarrollo propio creado con Matlab R2006b (MathWorks Inc., Natick, MA, EE.UU.)11,12.
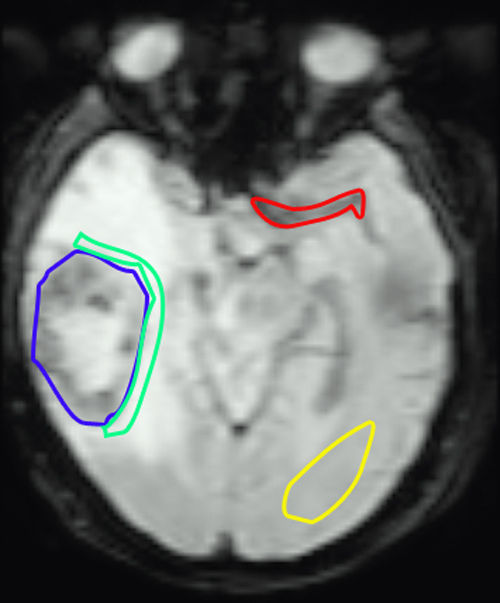
Análisis de las imágenesLos datos de perfusión se cuantificaron para todos los píxeles de los cortes transversales donde se observaba la lesión. En todos los estudios se seleccionó manualmente la arteria cerebral media, a partir de la cual se extrajo la función de entrada arterial necesaria para obtener los parámetros de perfusión (fig. 3). Una vez realizados los cálculos, se seleccionaron manualmente las regiones de interés coincidentes con el área tumoral, el área peritumoral y el área de la sustancia blanca no afecta contralateral. Finalmente las regiones seleccionadas se agruparon para manejar una sola distribución de valores por cada área. Se definió el área tumoral como la alteración de señal con captación de contraste. Se tomó como área peritumoral la región que rodeaba al nódulo de captación a una distancia máxima de 1cm del borde de captación y que presentaba alteración de la señal en la imagen potenciada en T213,14. Como sustancia blanca no afecta se consideró aquella situada a distancia de la lesión tumoral y sin conexión por fascículos de sustancia blanca con el tumor (fig. 3). Con estas definiciones de área tumoral y peritumoral asumimos que se puede encontrar tumor en la región peritumoral, siendo la definición congruente con la que habitualmente se usa en otros trabajos para la gradación de los tumores con estudios de perfusión13–15. Dos radiólogos con experiencia en perfusión cerebral con RM seleccionaron estas ROI por consenso, excluyendo los vasos sanguíneos que pudieran alterar los resultados de la cuantificación.
Los modelos para cuantificar la perfusión se describen a continuación.
Modelo de morfología de curva o monocompartimentalEn este modelo se asume que la recirculación del contraste y su extravasación son insignificantes, calculando los valores de los distintos parámetros tras corregir las curvas mediante una función estimativa de la curva que se obtendría sin recirculación ni extravasación (fig. 1)16,17.
Se calcularon los siguientes parámetros (en el anexo se pueden encontrar las expresiones para su cálculo):
- •
Volumen sanguíneo cerebral (VSC): obtenido como el área bajo la curva de captación de contraste normalizada respecto al área bajo la curva de la entrada arterial asociada al tejido.
- •
Tiempo de tránsito medio (TTM): obtenido como el área bajo la curva de captación de contraste dividida por el valor máximo de la concentración.
- •
Flujo sanguíneo cerebral (FSC): calculado como la relación entre el volumen sanguíneo y el tiempo de tránsito medio del contraste en el tejido.
El modelado farmacocinético se basa en el ajuste de las curvas de captación a un modelo de intercambio de flujo entre el compartimento intravascular y el compartimento intersticial extracelular18,19. Los parámetros farmacocinéticos derivados de este modelo son (fig. 2):
- •
Constante de permeabilidad (Ktrans): se obtiene a partir de la relación entre el aporte de flujo sanguíneo al tejido, la superficie endotelial y la permeabilidad capilar.
- •
Coeficiente de extracción (kep): refleja el retorno de contraste entre el espacio extravascular extracelular y el vaso.
- •
Fracción de volumen de espacio extravascular extracelular (ve): es un indicador del volumen intersticial. Se calcula como el cociente entre Ktrans y kep.
- •
Fracción de volumen vascular (vp): es una medida de la contribución vascular del tejido.
Para obtener cada uno de estos parámetros se ajustaron las curvas de respuesta arterial y tisular a un modelo matemático (ver anexo para la formulación). A diferencia del modelo de morfología de curva, no se realizó ningún ajuste previo para corregir el efecto de la recirculación ya que este modelo tiene en cuenta tanto el primer paso como las fases posteriores (recirculación y lavado).
Como variante del modelo, también se calcularon las variables de constante de permeabilidad de primer paso (Kfp) y fracción de volumen vascular arterial de primer paso (vpfp) aplicando una variante del modelo farmacocinético que solo tiene en cuenta el primer paso del contraste y desprecia la recirculación y la extravasación20 (ver anexo para la formulación).
Análisis por histogramasEl histograma ofrece una representación gráfica de las frecuencias de aparición de los valores para cada variable. En distribuciones homogéneas el histograma presenta un pico prominente en torno al valor medio de la distribución. Sin embargo, para distribuciones heterogéneas el histograma presenta una forma más irregular, ya que las frecuencias están mucho más repartidas.
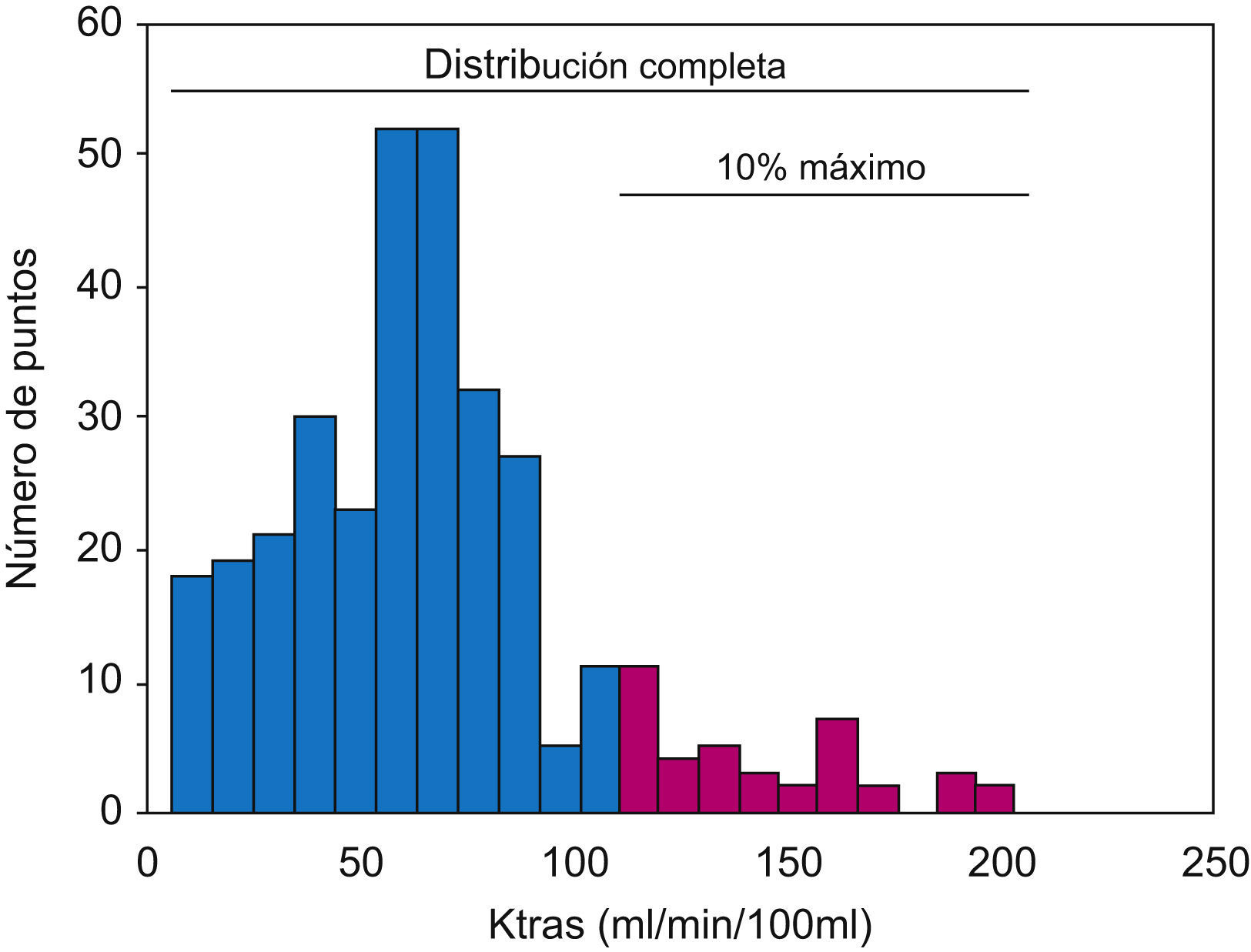
La utilización de histogramas permite estudiar la distribución de cada parámetro en cada región analizada, con distintos estadísticos que caractericen mejor la región. En este estudio se calcularon los valores de media, mediana y desviación típica para el histograma completo y para los subconjuntos del 50%, el 25% y el 10% máximo de los valores (fig. 4). Además, se obtuvieron también los valores de curtosis (medida de concentración central que estudia la frecuencia de aparición de un valor alrededor de la media de una distribución) y asimetría (medida que indica el grado de asimetría de una distribución con respecto a la media), parámetros que caracterizan la forma del histograma completo.
Análisis estadísticoPara cada parámetro se realizaron pruebas de Kolmogorov-Smirnov y de Levene para evaluar la normalidad de la distribución y la homogeneidad de la varianza, respectivamente. Estas pruebas demostraron que aproximadamente la mitad de las variables no presentaban distribuciones normales ni igualdad en las varianzas entre las regiones, por lo que posteriormente se realizaron una prueba no paramétrica de Kruskal-Wallis para evaluar diferencias entre grupos y 3 pruebas no paramétricas de Mann-Whitney corregidas por Bonferroni para estudiar diferencias grupo a grupo.
Para obtener una mejor capacidad de diferenciación entre regiones se usó un análisis discriminante, método que emplea la información multivariante de todos los parámetros calculados de forma conjunta. Mediante esta técnica se analizan las diferencias entre las 3 regiones para todas las variables de modo que se obtiene una serie de funciones llamadas discriminantes que son combinación lineal de las variables que maximizan las diferencias entre regiones.
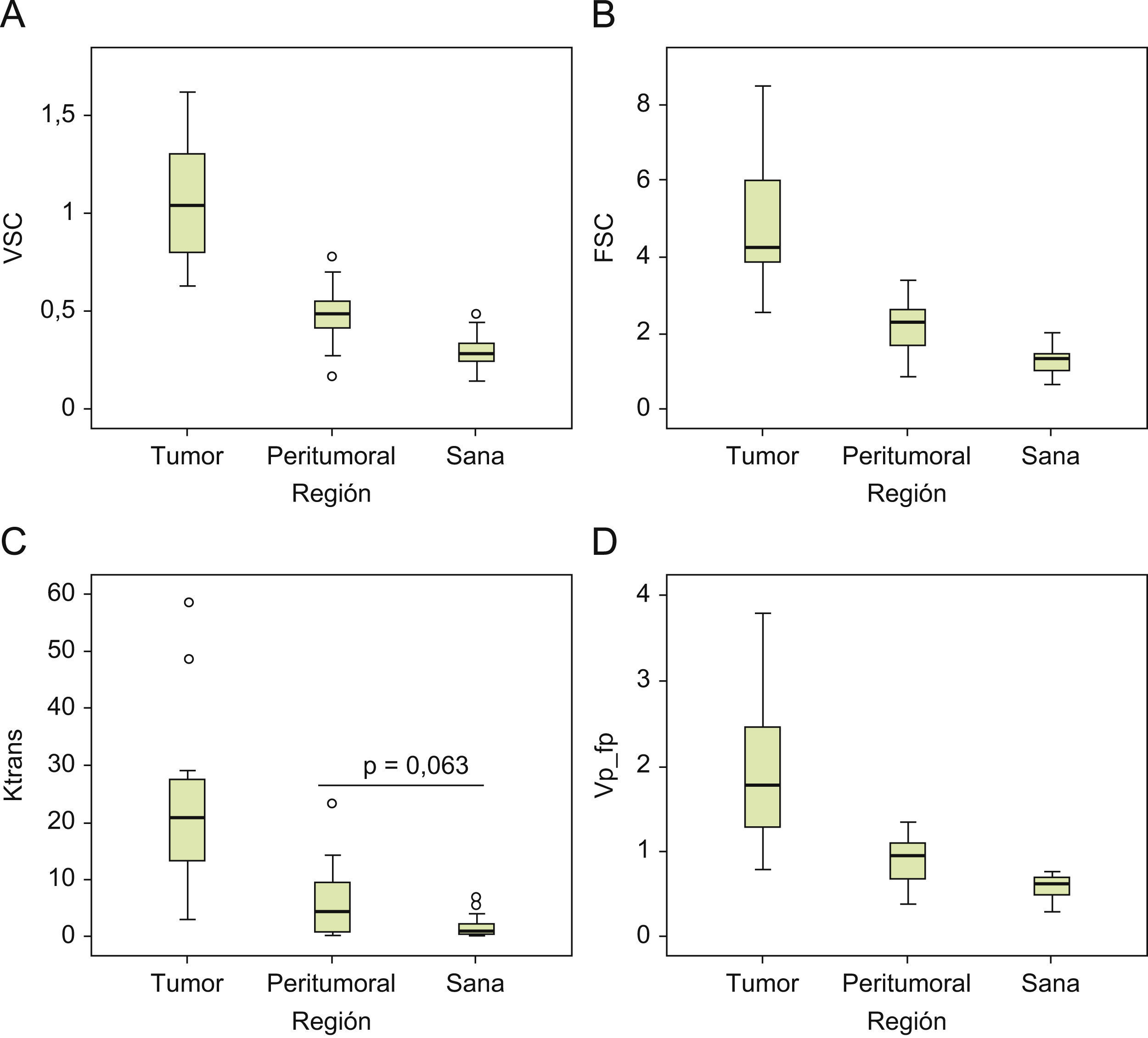
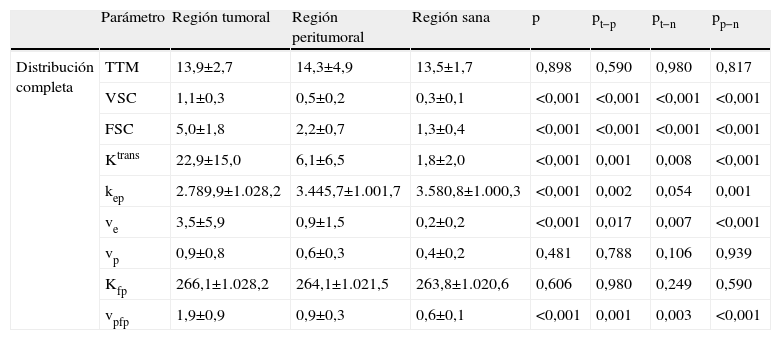
ResultadosSe obtuvieron diferencias significativas muy relevantes entre las 3 regiones de interés para el VSC, FSC, Ktrans, kep, ve y vpfp, con resultados similares para la media, la mediana y los valores máximos de las observaciones (fig. 5). De manera global, el parámetro que ofreció mejores resultados para diferenciar entre tumor, área peritumoral y tejido cerebral sano, fue el VSC independientemente de la distribución evaluada (completa, 50% máximo, 25% máximo y 10% máximo) y del estadísticos (media, mediana) (tabla 1). El resto de parámetros no presentaron diferencias significativas entre regiones.
Resultados del ANOVA con test post-hoc de Games-Howell con las diferencias entre las tres regiones de interés para cada parámetro tomando el valor medio de cada región (valores expresados como media±desviación típica)
| Parámetro | Región tumoral | Región peritumoral | Región sana | p | pt−p | pt−n | pp−n | |
| Distribución completa | TTM | 13,9±2,7 | 14,3±4,9 | 13,5±1,7 | 0,898 | 0,590 | 0,980 | 0,817 |
| VSC | 1,1±0,3 | 0,5±0,2 | 0,3±0,1 | <0,001 | <0,001 | <0,001 | <0,001 | |
| FSC | 5,0±1,8 | 2,2±0,7 | 1,3±0,4 | <0,001 | <0,001 | <0,001 | <0,001 | |
| Ktrans | 22,9±15,0 | 6,1±6,5 | 1,8±2,0 | <0,001 | 0,001 | 0,008 | <0,001 | |
| kep | 2.789,9±1.028,2 | 3.445,7±1.001,7 | 3.580,8±1.000,3 | <0,001 | 0,002 | 0,054 | 0,001 | |
| ve | 3,5±5,9 | 0,9±1,5 | 0,2±0,2 | <0,001 | 0,017 | 0,007 | <0,001 | |
| vp | 0,9±0,8 | 0,6±0,3 | 0,4±0,2 | 0,481 | 0,788 | 0,106 | 0,939 | |
| Kfp | 266,1±1.028,2 | 264,1±1.021,5 | 263,8±1.020,6 | 0,606 | 0,980 | 0,249 | 0,590 | |
| vpfp | 1,9±0,9 | 0,9±0,3 | 0,6±0,1 | <0,001 | 0,001 | 0,003 | <0,001 |
FSC: flujo sanguíneo cerebral; kep: coeficiente de lavado; Kfp: permeabilidad capilar en el primer paso; Ktrans: permeabilidad capilar; TTM: tiempo de tránsito medio; ve: fracción de espacio intersticial; vp: fracción de espacio vascular; vpfp: fracción de espacio vascular en el primer paso; VSC: volumen sanguíneo cerebral.
Unidades: kep, Kfp, Ktrans, FSC: ml/min/100ml; TMM: segundos; ve, vp, vpfp: %, sin unidades; VSC: sin unidades.
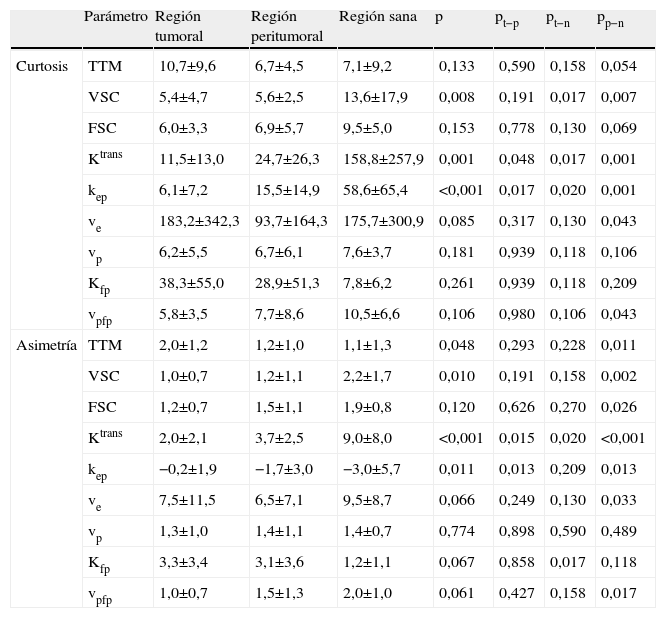
El análisis de la forma de los histogramas evidenció diferencias estadísticamente significativas para la curtosis de VSC, Ktrans y kep, así como para la asimetría de TTM, VSC, Ktrans y kep (tabla 2). En la comparación grupo a grupo se observó que estas diferencias eran evidentes sobretodo entre la región tumoral y la normal, siendo imposible separar en algunos entre tumoral y peritumoral y entre peritumoral y normal. La mayoría de parámetros presentaron unos valores más elevados de curtosis en la región sana, con disminución en la peritumoral y más en la tumoral, expresión de la heterogeneidad tumoral. El resto de parámetros no obtuvieron diferencias significativas entre regiones.
Valores de curtosis y asimetría para los parámetros cuantificados en la distribución completa cada región
| Parámetro | Región tumoral | Región peritumoral | Región sana | p | pt−p | pt−n | pp−n | |
| Curtosis | TTM | 10,7±9,6 | 6,7±4,5 | 7,1±9,2 | 0,133 | 0,590 | 0,158 | 0,054 |
| VSC | 5,4±4,7 | 5,6±2,5 | 13,6±17,9 | 0,008 | 0,191 | 0,017 | 0,007 | |
| FSC | 6,0±3,3 | 6,9±5,7 | 9,5±5,0 | 0,153 | 0,778 | 0,130 | 0,069 | |
| Ktrans | 11,5±13,0 | 24,7±26,3 | 158,8±257,9 | 0,001 | 0,048 | 0,017 | 0,001 | |
| kep | 6,1±7,2 | 15,5±14,9 | 58,6±65,4 | <0,001 | 0,017 | 0,020 | 0,001 | |
| ve | 183,2±342,3 | 93,7±164,3 | 175,7±300,9 | 0,085 | 0,317 | 0,130 | 0,043 | |
| vp | 6,2±5,5 | 6,7±6,1 | 7,6±3,7 | 0,181 | 0,939 | 0,118 | 0,106 | |
| Kfp | 38,3±55,0 | 28,9±51,3 | 7,8±6,2 | 0,261 | 0,939 | 0,118 | 0,209 | |
| vpfp | 5,8±3,5 | 7,7±8,6 | 10,5±6,6 | 0,106 | 0,980 | 0,106 | 0,043 | |
| Asimetría | TTM | 2,0±1,2 | 1,2±1,0 | 1,1±1,3 | 0,048 | 0,293 | 0,228 | 0,011 |
| VSC | 1,0±0,7 | 1,2±1,1 | 2,2±1,7 | 0,010 | 0,191 | 0,158 | 0,002 | |
| FSC | 1,2±0,7 | 1,5±1,1 | 1,9±0,8 | 0,120 | 0,626 | 0,270 | 0,026 | |
| Ktrans | 2,0±2,1 | 3,7±2,5 | 9,0±8,0 | <0,001 | 0,015 | 0,020 | <0,001 | |
| kep | −0,2±1,9 | −1,7±3,0 | −3,0±5,7 | 0,011 | 0,013 | 0,209 | 0,013 | |
| ve | 7,5±11,5 | 6,5±7,1 | 9,5±8,7 | 0,066 | 0,249 | 0,130 | 0,033 | |
| vp | 1,3±1,0 | 1,4±1,1 | 1,4±0,7 | 0,774 | 0,898 | 0,590 | 0,489 | |
| Kfp | 3,3±3,4 | 3,1±3,6 | 1,2±1,1 | 0,067 | 0,858 | 0,017 | 0,118 | |
| vpfp | 1,0±0,7 | 1,5±1,3 | 2,0±1,0 | 0,061 | 0,427 | 0,158 | 0,017 |
FSC: flujo sanguíneo cerebral; kep: coeficiente de lavado; Kfp: permeabilidad capilar en el primer paso; Ktrans: permeabilidad capilar; FSC: ml/min/100ml; permeabilidad capilar; TTM: tiempo de tránsito medio; ve: fracción de espacio intersticial; vp: fracción de espacio vascular; vpfp: fracción de espacio vascular en el primer paso; VSC: volumen sanguíneo cerebral.
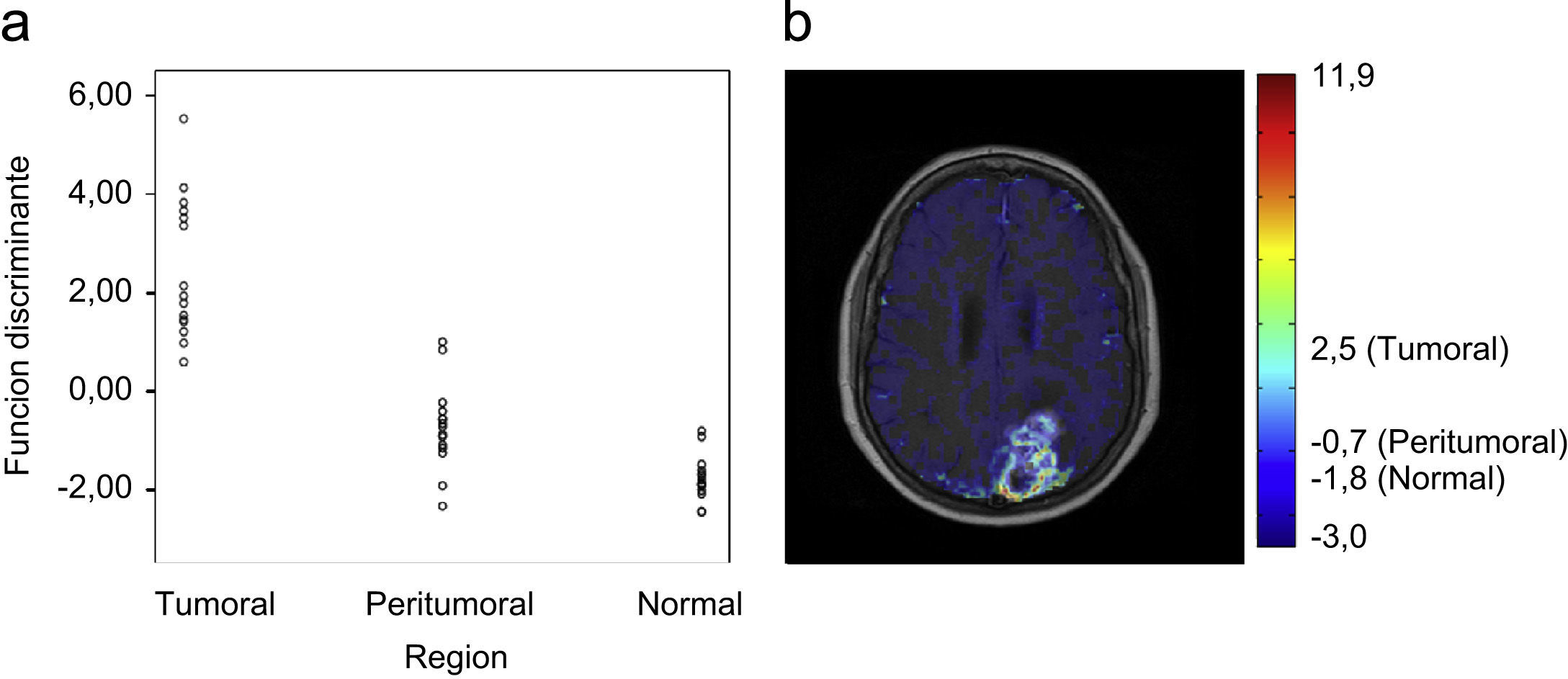
Con el análisis discriminante se obtuvo una función discriminante combinación de Ktrans y VSC, con un porcentaje de clasificación correcto de regiones del 84,4% (calculado mediante validación cruzada con la técnica leave-one-out): F=0,054 Ktrans+3,933 VSC–3 (centroides en 2,482/−0,716/−1,766 para tumoral, peritumoral y normal, respectivamente), para la distribución completa y tomando como estadístico la media.
Esta función clasificó correctamente 14 regiones tumorales (1 fue interpretada como peritumoral), 11 peritumorales (2 se interpretaron como tumorales y 2 como normales) y 13 normales (2 se interpretaron como peritumorales) (fig. 6).
a) Distribución de los valores de la función discriminante obtenida para cada una de las regiones estudiadas. b) Imagen nosológica de un corte axial generado a partir de la función discriminante calculada. En la escala de colores se indican los valores máximo, mínimo y los centroides de la función, es decir, aquellos valores que marcan los puntos de corte entre las áreas.
Este porcentaje de clasificación supone un ligero incremento sobre el potencial de clasificación de VSC para la distribución del 50% máximo y tomando como estadístico la mediana, que ofreció el mejor resultado para diferenciar entre las regiones y clasificó correctamente el 78% de las regiones. En este caso se clasificaron correctamente 10 regiones tumorales (5 se interpretaron como peritumorales), 12 peritumorales (1 se interpretó como tumoral y 2 como normal) y 13 normales (2 se interpretaron como peritumorales).
Para eliminar sesgos de reducción de datos del histograma, se utilizó la función con la distribución completa y su media. Con ella se parametrizaron las imágenes de perfusión de RM, obteniéndose mapas nosológicos de clasificación con una distribución continua (fig. 6). En estos mapas los valores numéricos y los colores asociados representan una medida cuantitativa de la probabilidad de un píxel de pertenecer a área tumoral, peritumoral o normal. La proximidad entre los centroides marca la posibilidad de separar unas áreas de otras.
DiscusiónAunque la RM es la técnica de imagen fundamental para el estudio y seguimiento de los tumores cerebrales, tiene limitaciones importantes en su diagnóstico, gradación y seguimiento. Así, no permite diferenciar de forma eficaz los distintos grados tumorales y no puede establecer claramente la extensión tumoral. El análisis de la perfusión tumoral mejora la clasificación de los gliomas, siendo varios los estudios que han demostrado una relación estadísticamente significativa entre el VSC y Ktrans con el grado tumoral de los astrocitomas7,21–23.
La finalidad en nuestro trabajo no era gradar los tumores, puesto que todos ellos correspondían a un grado IV, sino poder construir un modelo paramétrico con los datos de perfusión para identificar eficazmente el área tumoral, peritumoral y el área sana. El VSC fue el parámetro que ofreció mejores resultados para separar las regiones independientemente de la distribución máxima de valores elegida. Que el VSC sea el que de forma aislada mejor delimite las áreas señaladas concuerda con los cambios fisiológicos que se producen en los tumores, ya que el crecimiento y la infiltración tumoral se acompañan de un aumento de los vasos necesarios para estos procesos. No obstante, los pequeños acúmulos tumorales que ocupan una fracción del vóxel de los que extraemos la información no se detectan, ya que contribuyen poco, pero limitan los resultados. El cálculo del VSC se realizó a partir del modelo monocompartimental con una formulación que tiene en cuenta la entrada arterial y asumiendo que el resultado es un valor aproximativo16,17. Aunque en nuestro trabajo los resultados del VSC no eran valores relativos como en otros trabajos, se comprobó que la relación entre el área tumoral y la sana con respecto al VSC (VSCt/VSCs) se sitúa en torno a 3,6, datos que son ligeramente inferiores a los publicados en la bibliografía. Pensamos que esta diferencia en la relación se debe a que hemos considerado la totalidad de la lesión tumoral para realizar la cuantificación, exceptuando solo el área de necrosis de la que no se pueden obtener valores de perfusión, cuando en la mayoría de trabajos esta relación se extrae de los puntos con los valores máximos7,24.
Ktrans es un parámetro cuantitativo de perfusión que representa la alteración de la permeabilidad capilar. La alteración de la permeabilidad capilar está relacionada con varios factores hemodinámicos tales como el flujo sanguíneo, el volumen, la permeabilidad endotelial y el producto del área de la superficie por la permeabilidad25. Sin embargo, es difícil medir cómo contribuyen cada uno de ellos por separado al resultado final. No se ha estandarizado ningún modelo para realizar el cálculo de Ktrans; el más consolidado se basa en la cuantificación de imágenes obtenidas a partir de secuencias dinámicas con contraste potenciadas en T1. Una alternativa a este es la obtención de Ktrans a partir de secuencias dinámicas con contraste basadas en efectos de susceptibilidad magnética26. Es el método que hemos empleado en el trabajo, ya que es el que se utiliza de manera habitual para realizar la cuantificación de VSC, FSC y TTM. Los valores que hemos obtenido de Ktrans concuerdan con los publicados en la literatura27 y han permitido diferenciar las 3 áreas con una eficacia dispar. Ha separado claramente las áreas tumoral y sana pero no obtiene resultados estadísticamente significativos para delimitar el área peritumoral del parénquima sano. En cambio, cuando se analiza la curtosis de la distribución de los resultados de Ktrans sí que se obtienen unos resultados estadísticamente significativos para diferenciar las 3 regiones. Esto se puede explicar porque Ktrans es un marcador de capilares con la permeabilidad alterada, de manera que la identificación de focos con estas características indica la existencia de vasos patológicos que no deben encontrarse en las zonas de parénquima sano, donde la distribución de los valores de permeabilidad debe ser homogénea.
Los glioblastomas son tumores histológicamente muy heterogéneos en los que coexisten zonas que representan un tumor de bajo grado con áreas de alto grado, que son las que marcan la verdadera agresividad de la lesión. Esta heterogeneidad histológica se acompaña de variaciones locales en el desarrollo y maduración de los vasos, su densidad y en el flujo vascular. Los resultados que se obtienen con los estudios de perfusión con RM también muestran una distribución espacial heterogénea de los parámetros. La identificación de estas áreas con mayor alteración y su cuantificación contribuye a gradar de forma más adecuada los tumores6. Mediante el estudio de los histogramas y el cálculo de la curtosis y la asimetría se puede valorar el grado de heterogeneidad de una distribución de valores28. El análisis de la curtosis y de la asimetría de los histogramas ofrecieron diferencias estadísticamente significativas para los parámetros de perfusión, siendo baja la curtosis para la región tumoral, lo que indica que la distribución de los valores en esta región es más heterogénea en comparación a la región sana. Estos datos concuerdan con la manifestación histológica de los tumores y con los trabajos publicados al respecto con perfusión por RM. Hay trabajos que han usado la distribución espacial heterogénea de los parámetros de perfusión en las diferentes regiones de los tumores para clasificar los grados III y IV de los astrocitomas con buenos resultados28.
La introducción del análisis discriminante para cada una de las distribuciones permitió identificar que la función clasificatoria que incluye el VSC y la Ktrans mejora ligeramente la correcta clasificación de las regiones frente a los resultados obtenidos por el VSC aisladamente. En la identificación del área tumoral es donde la función clasificatoria mejoró más la eficacia. Con respecto a la región peritumoral, se detectaron 2 casos con valores de la función en el rango de tumor (fig. 6). Parece necesario establecer líneas de trabajo en las que se analice de forma prospectiva la importancia de los parámetros de perfusión obtenidos en el área peritumoral como criterios de biomarcadores de imagen relevantes a la supervivencia de los pacientes. Es posible que un análisis estadístico multivariante en una población mayor aporte suficiente conocimiento para solventar este dilema. De hecho, estos pacientes tuvieron una supervivencia menor que el resto (datos pendientes de análisis con una serie mayor de casos). Por otro lado, 2 casos presentaron valores en el rango de regiones sanas con la función clasificatoria. Será interesante comprobar en series amplias si estos casos con ausencia de infiltración en la clasificación discriminante tienen verdaderamente un mejor pronóstico. El estudio patológico de las muestras no permite realizar este análisis detallado de la infiltración peritumoral dado que es imposible hacer concordar las áreas en imagen y las muestras patológicas. En ninguno de los casos un área tumoral se clasificó como sana ni viceversa. La imagen paramétrica que se obtiene con la función clasificatoria puede reflejar mejor la extensión tumoral y la infiltración, ya que basándose en unos datos cuantitativos presenta una información que indica de forma directa el grado de la enfermedad.
En estudios futuros sería preferible aumentar el número de casos para incrementar la potencia estadística. Aun así, el número de pacientes es similar a otros estudios descriptivos que emplean modelos cinéticos para calcular los parámetros de perfusión26,29. Otra limitación se basa en la estrategia utilizada para delimitar el área tumoral. La demarcación óptima del volumen tumoral para realizar la cuantificación de los parámetros es difícil debido a las características infiltrantes de los glioblastomas, encontrándose sus márgenes más allá de los límites identificados con la captación de contraste en RM e incluso por fuera del área de alteración de señal en T2 lo que puede haber contribuido a sesgar los resultados. Esto se asume en todos los trabajos que relacionan la extensión tumoral real con la imagen de RM, ya sea convencional o funcional. Otro motivo de sesgo puede ser que hemos utilizado la arteria cerebral media como función vascular de entrada para obtener los parámetros de perfusión independientemente de la localización del tumor. Decidimos usarla para mantener una homogeneidad entre los pacientes, ya que es un vaso que se identifica fácilmente en todos los estudios frente a los vasos aferentes de los tumores que con frecuencia no se identifican fácilmente o la aferencia es mixta. Nuestra aproximación es más robusta que la utilización como función de entrada vascular de una función fija estándar o incluso el seno sagital superior9,30.
En conclusión, el VSC es el parámetro que, utilizado de forma aislada, permitió diferenciar mejor entre área tumoral, región peritumoral y parénquima sano. La función clasificatoria generada a partir de la combinación de VSC y Ktrans consiguió mejorar estos resultados haciendo más eficaz la clasificación por áreas. La aplicación de los datos obtenidos debe validarse para determinar su utilidad en la extensión de los tumores, gradar su agresividad y monitorizar la respuesta a los tratamientos.
AutoríasAntonio José Revert Ventura, Roberto Sanz-Requena y Luis Martí-Bonmatí han contribuido en la concepción, diseño, análisis, interpretación de los datos y redacción del trabajo.
José Jornet, José Piquer y Antonio Cremades han contribuido en la recogida de datos y han dado su aprobación a la versión final del trabajo.
José Miguel Carot ha participado en el análisis e interpretación de los datos dando también su aprobación a la versión final del trabajo.
Todos los autores han leído y aprobado la versión final del artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Anexo. Ecuaciones utilizadasConversión de valores de intensidad de señal a valores de concentración de contraste:
donde C es la concentración, TE es el tiempo de eco, S es la intensidad de la señal a lo largo del tiempo y S0 es la intensidad de la señal basal antes de la inyección del contraste.Volumen sanguíneo cerebral (VSC):
donde Ccorr es la curva de concentración corregida para cada punto y CcorrAIFes la curva de concentración corregida para la arteria cerebral media.Tiempo de tránsito medio (TTM):
donde Ccorrmax es el valor máximo de la curva.Flujo sanguíneo cerebral (FSC):
Modelo farmacocinético bicompartimental:
donde Ct es la curva de concentración en el tejido, CAIF es la curva de entrada arterial, vp es la fracción de volumen vascular, Ktrans es el coeficiente de permeabilidad y kep es el coeficiente de lavado.Modelo farmacocinético bicompartimental para el primer paso:
donde vpfp es la fracción de volumen vascular y Kfp es el coeficiente de permeabilidad.