Introducción
Con la evolución en curso de la tecnología de la tomografía computarizada multidetector (TCMD) cada vez más rápida y sofisticada, la tomografía computarizada (TC) cardíaca se ha convertido en un examen que se aplica en una gran variedad de indicaciones clínicas1. Con la llegada de las últimas innovaciones de la tecnología TCDM, tales como la TC de 64 cortes y la TC de doble fuente (TCDF)2, se ha mejorado la resolución tanto temporal como espacial de la angiografía por TC (angio-TC) coronaria hasta el límite de su uso en la evaluación rutinaria incruenta de la enfermedad coronaria arterioesclerótica.
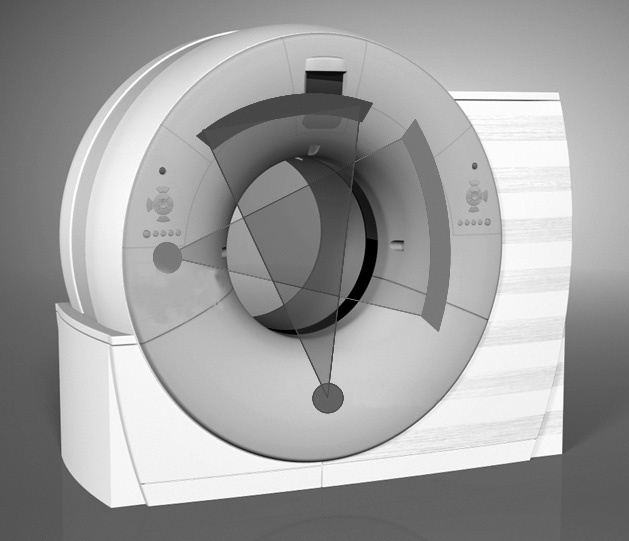
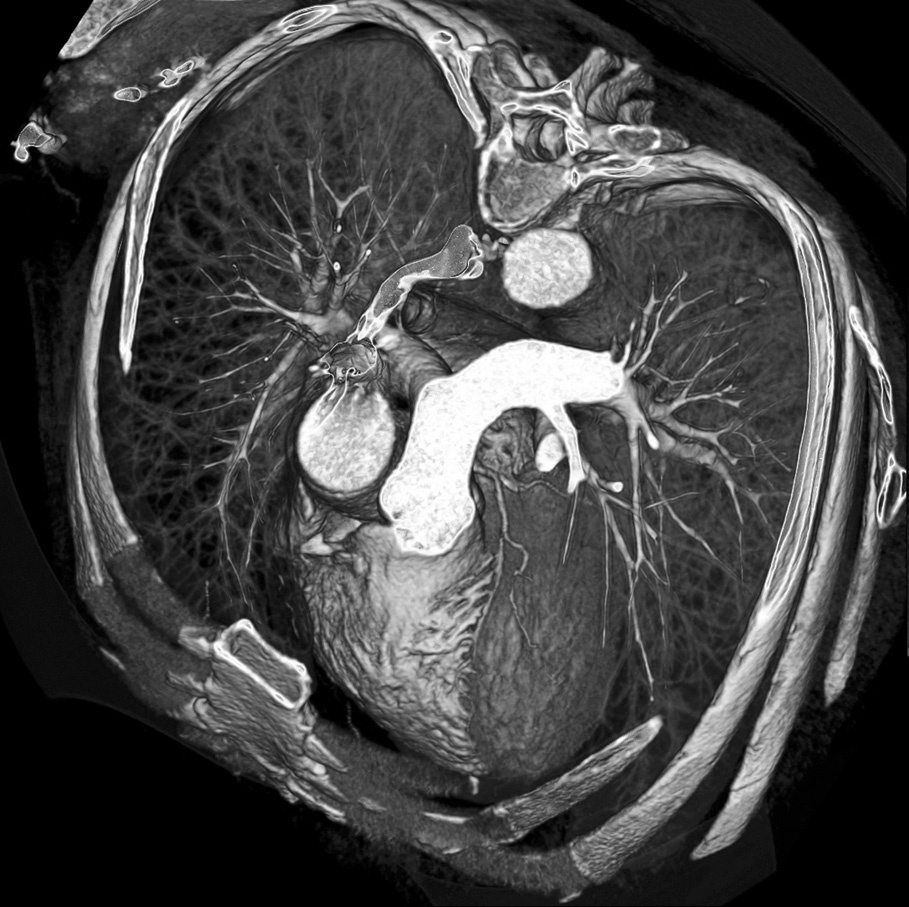
La obtención de imágenes cardíacas con TC siempre ha sido un desafío técnico debido al movimiento continuo del corazón. El desarrollo de la exploración mediante TCMD sincronizada con el electrocardiograma (ECG) y de las técnicas de reconstrucción3-5 ha aumentado la cobertura del área estudiada con una alta resolución espacial y temporal, requisito previo para la obtención de imágenes cardíacas satisfactorias6. Sin embargo, la potente tecnología que hace posible la realización de la angio-TC coronaria sobrepasa la necesaria para las aplicaciones de rutina de la TC y tiene que emplearse de forma que ofrezca resultados optimizados con un grado mínimo de invasión para el paciente. Nuestra experiencia en la realización de angio-TC coronaria ha evolucionado a lo largo de los años desde la introducción de la TCMD y ha abarcado cada paso de la evolución de esta tecnología hasta la generación más actual de la TCDF. Con esta última tecnología, la configuración tradicional del escáner con un tubo de rayos X y un arco de detectores ha permitido el desarrollo de equipos con dos tubos de rayos X y dos arcos de detectores en el mismo gantry desfasados 90º 2 (fig. 1) que emplean una velocidad de rotación de 330 ms. Un escáner de este tipo proporciona una resolución temporal equivalente a un cuarto del tiempo de rotación del gantry (es decir, 83 ms), que hace que la exploración sea independiente de la frecuencia cardíaca del paciente. El objetivo de este trabajo es compartir nuestra experiencia en la angio-TC coronaria con el fin de facilitar la aplicación de este procedimiento.
Fig. 1. Representación esquemática de un escáner de tomografía computarizada de doble fuente (TCDF) que utiliza dos tubos y sus dos correspondientes detectores en ángulo de 90°. Un escáner de este tipo proporciona una resolución temporal equivalente a un cuarto del tiempo de rotación del gantry, independiente de la frecuencia cardíaca del paciente. Imagen cedida por el Dr. Thomas Flohr, Siemens.
Angio-TC coronaria: indicaciones
Detección y evaluación de arteriopatías coronarias
La función primordial de la angio-TC es descartar de manera fiable la arteriopatía coronaria con una técnica no invasiva, evitando así la necesidad del cateterismo diagnóstico invasivo.
La evaluación de pacientes con dolor torácico debe seguir las directrices emitidas por los American Colleges of Radiology and Cardiology y la American Heart Association7-9.
La angina típica con elevación del segmento ST en el ECG del paciente es un criterio de exclusión para la realización de TC cardíaca y en su lugar requiere un tratamiento de reperfusión inmediato. La actitud es diferente en pacientes con angina sin elevación del segmento ST y depende de la naturaleza del dolor torácico (típico/atípico), de la respuesta al tratamiento antianginoso y de la evaluación de las enzimas cardíacas. Así, la angio-TC se considera indicada cuando el ECG no está alterado o no sea concluyente y las enzimas seriadas se mantengan negativas en pacientes estables con una probabilidad intermedia pre-prueba de arteriopatía coronaria. También está indicada en pacientes con dolor torácico que incapacite para el ejercicio o con pruebas de estrés dudosas.
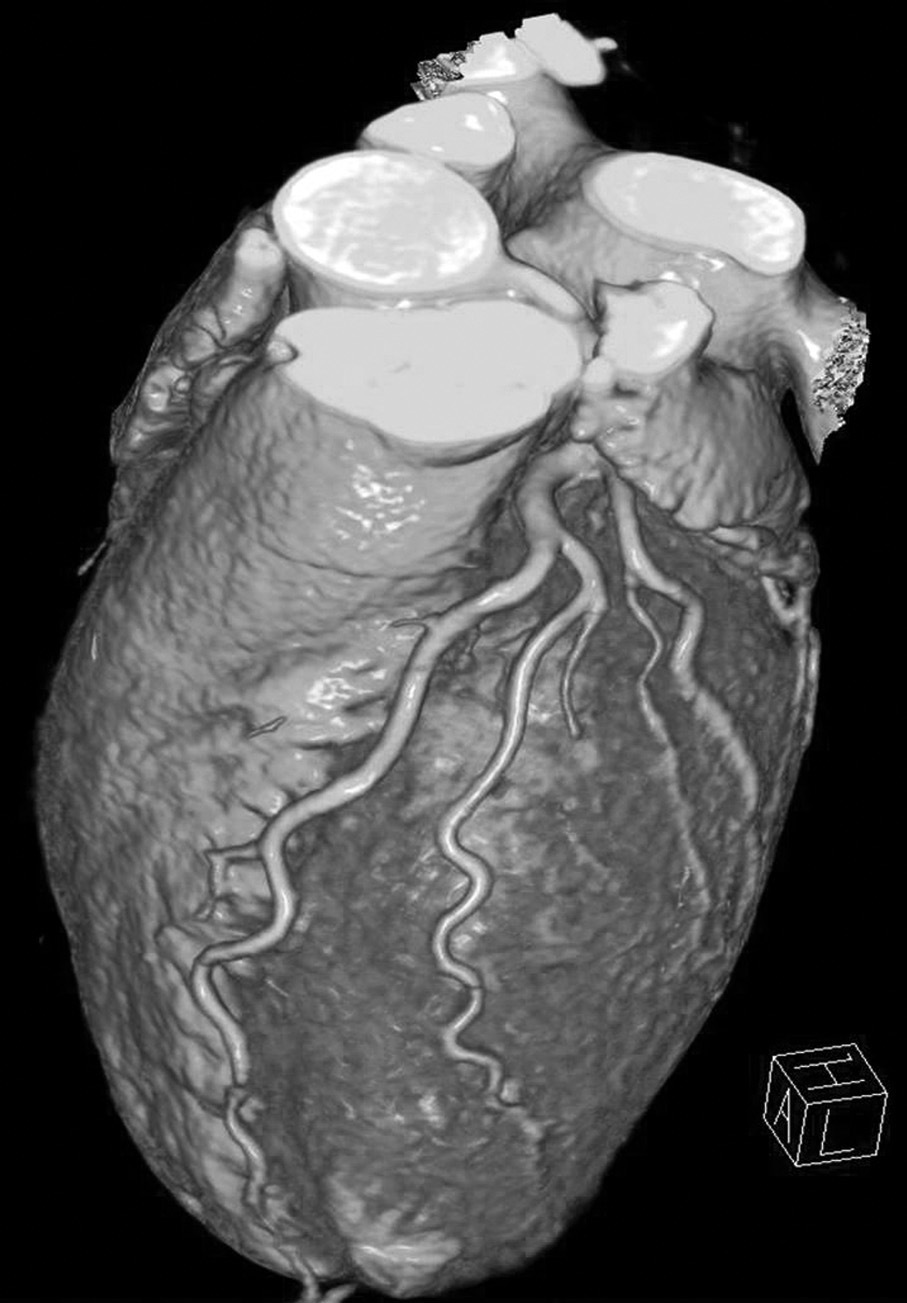
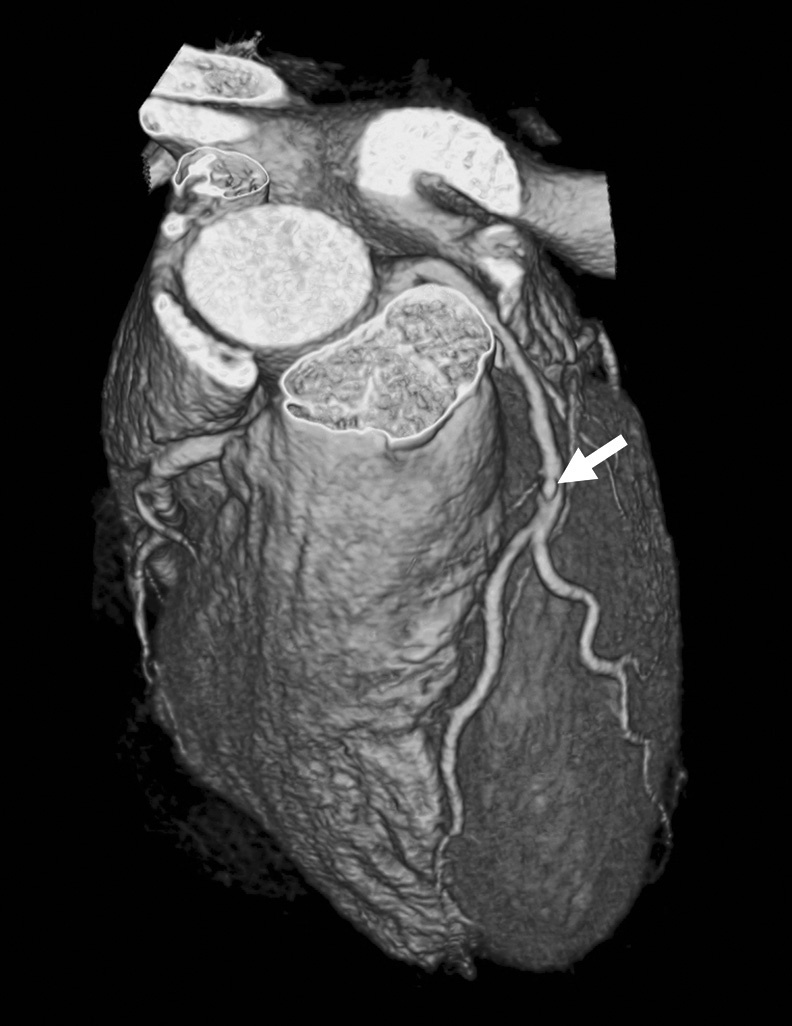
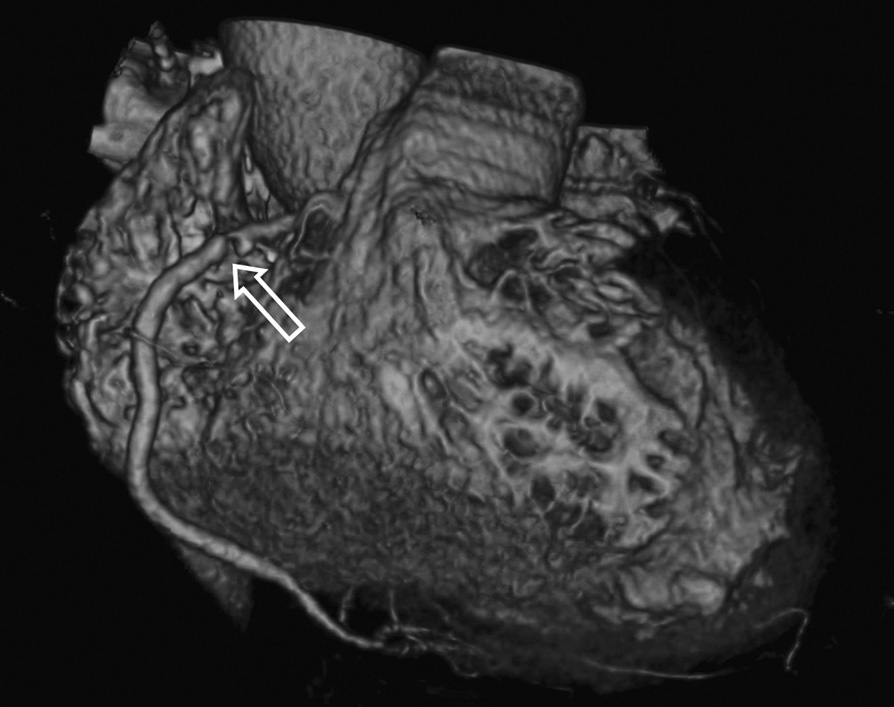
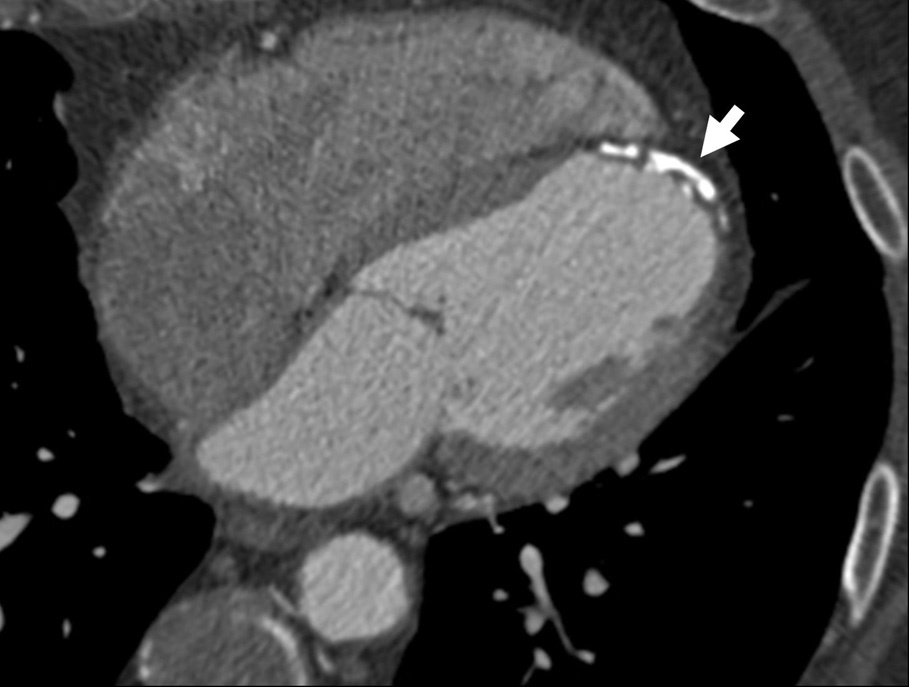
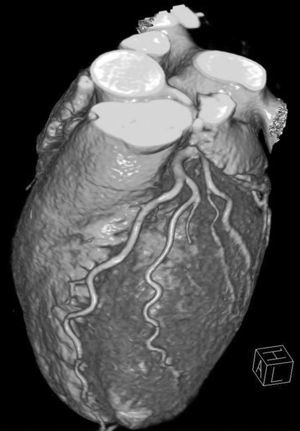
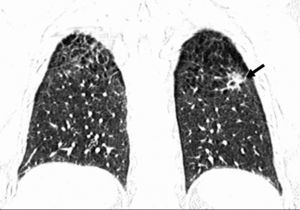
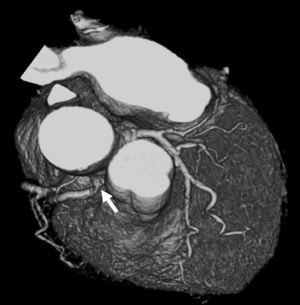
En ausencia de elevación del segmento ST y de marcadores biológicos de isquemia miocárdica, la angio-TC es una herramienta útil en la práctica clínica dado su alto valor pronóstico negativo, lo que permite descartar una estenosis importante10 (fig. 2).
Fig. 2. Angiografía por tomografía computarizada (angio-TC) coronaria de doble fuente tras la administración de contraste con sincronización electrocardiográfica retrospectiva en una mujer de 37 años de edad con dolor torácico atípico, historia familiar importante de arteriopatía coronaria y test gammagráfico de estrés anormal. La angio-TC coronaria, mostrada como imagen volumétrica en 3D (A) y árbol de vasos segmentados automáticamente (B) muestra una anatomía normal de las arterias coronarias sin manifestaciones de enfermedad aterosclerótica. Se ha demostrado que el elevado valor predictivo negativo de una angio-TC coronaria normal descarta de manera fiable e incruenta una estenosis importante, de modo que no se precisa utilizar más procedimientos invasivos en esta paciente.
La utilidad de la angio-TC en personas asintomáticas es limitada. Los criterios de idoneidad9 consideran reducido el valor de la angio-TC en personas asintomáticas con alto riesgo de arteriopatía coronaria, por lo que no está indicada la realización de una angio-TC coronaria en aquellos pacientes con riesgo bajo o moderado.
Evaluación de arteriopatía coronaria antes de cirugía no cardíaca
La angio-TC tiene un papel primordial en pacientes con un riesgo quirúrgico medio o alto que vayan a someterse a una intervención no cardíaca. Con esta prueba incruenta se puede descartar con fiabilidad una estenosis importante de las arterias coronarias antes de la intervención. Por otra parte, la obtención de imágenes de la función cardíaca por TC, incluida la evaluación del movimiento de la pared y la valoración de la fracción de eyección del ventrículo izquierdo, puede aportar una información importante para el anestesista.
Evaluación del by-pass coronario
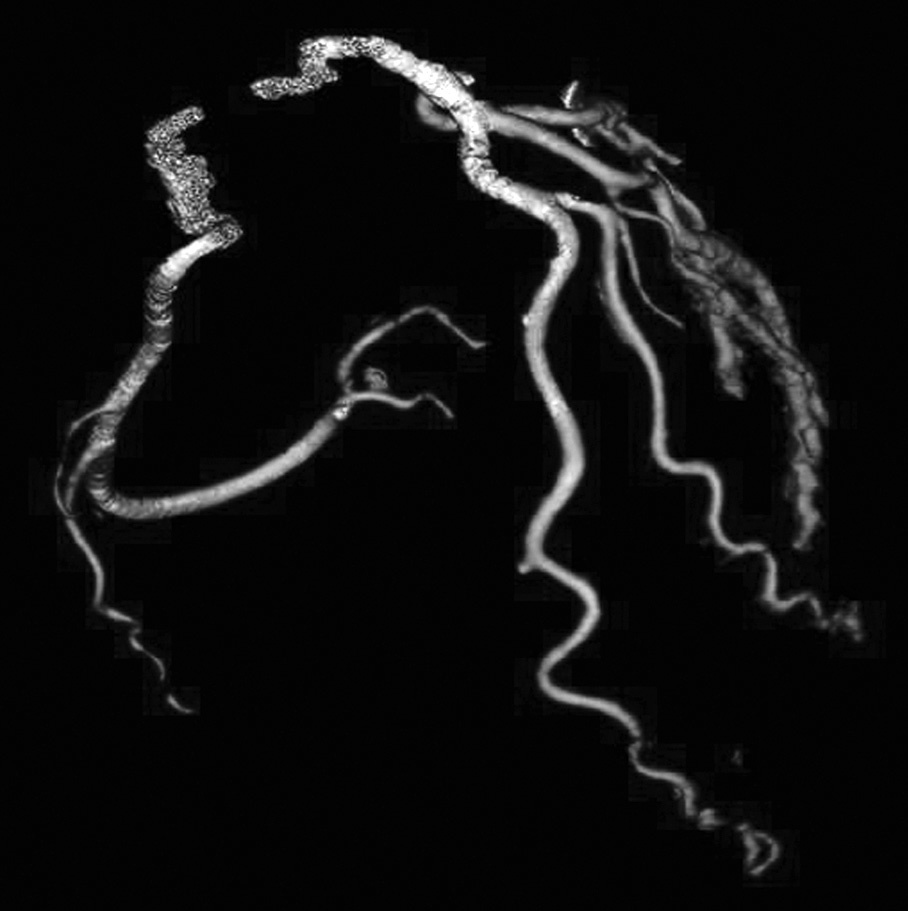
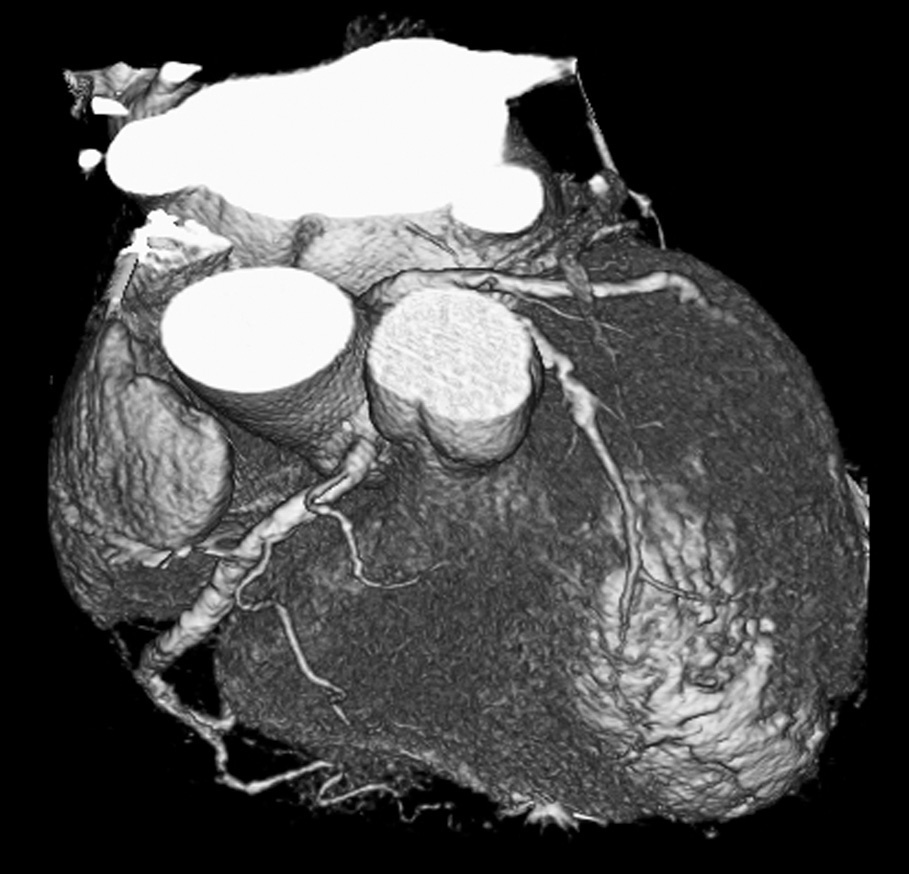
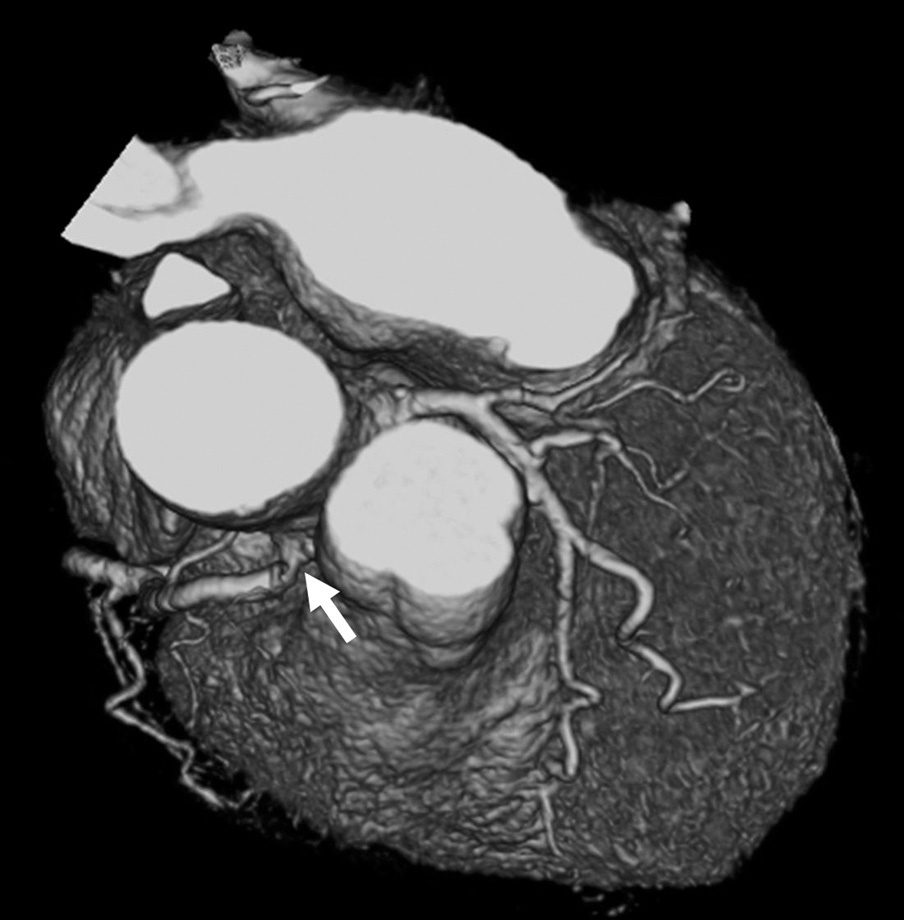
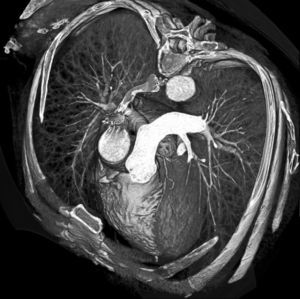
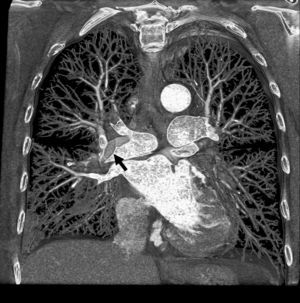
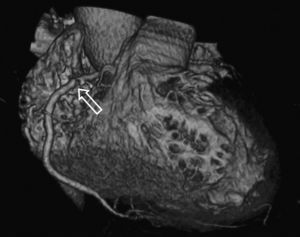
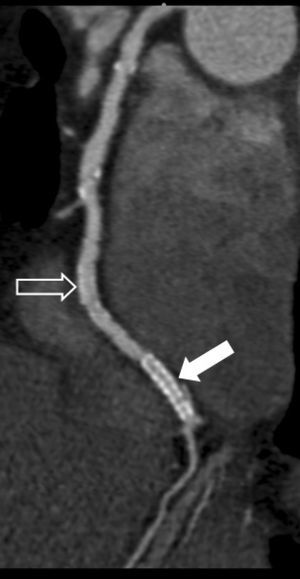
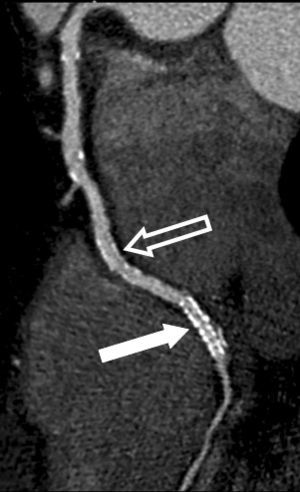
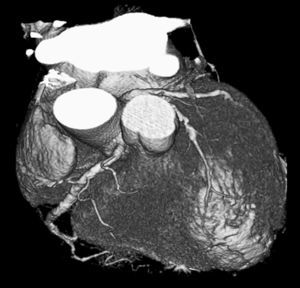
La angio-TC tiene un claro papel después de una cirugía de revascularización coronaria para comprobar si en pacientes en los que reaparecen los síntomas el by-pass sigue permeable o, por el contrario, se ha estenosado. Sin embargo, la angio-TC no está indicada en la valoración del by-pass en los pacientes asintomáticos11, con la excepción de la planificación quirúrgica para definir el curso del by-pass coronario y el de las propias arterias coronarias antes de repetir la toracotomía (fig. 3). La angio-TC es potencialmente útil antes de una cirugía de by-pass para evaluar el grado de afectación aterosclerótica de la aorta y el riesgo asociado de presentar isquemia cerebral12. Además, facilita al cirujano una información detallada de la localización y el tamaño de las arterias torácicas internas.
Fig. 3. Mujer de 67 años de edad programada para repetir cirugía de by-pass. La angiografía por tomografía computarizada coronaria, mostrada como imagen volumétrica en 3D, ayuda al cirujano cardiotorácico a elegir el método quirúrgico más adecuado para evitar lesionar los by-pass previos en la nueva cirugía.
Morfología
La aplicación sistémica de medios de contraste y la elevada resolución espacial y temporal hacen de la angio-TC la modalidad preferida para identificar y evaluar las anomalías de la circulación coronaria, los grandes vasos, las válvulas y las cámaras cardíacas.
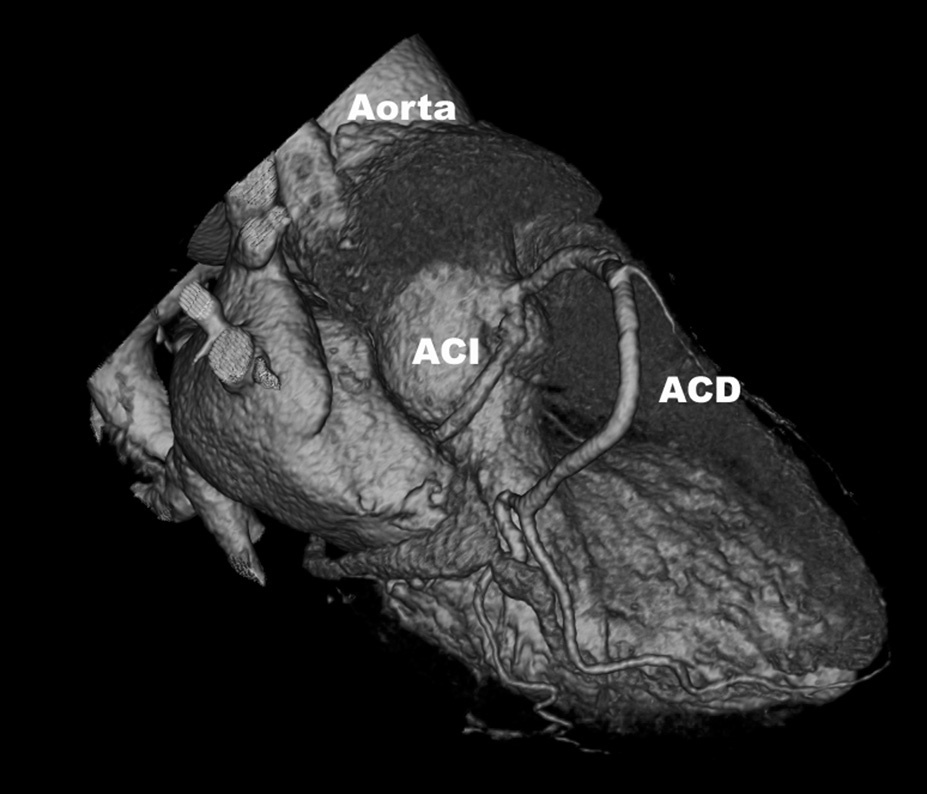
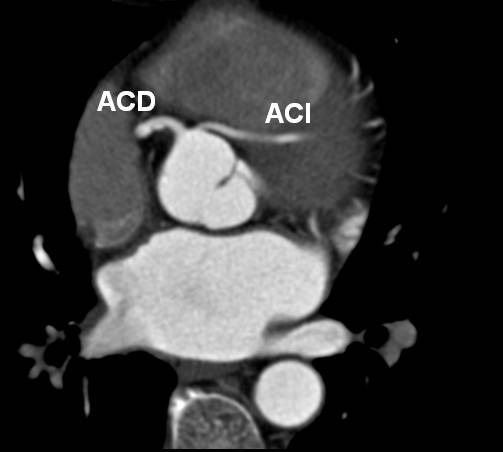
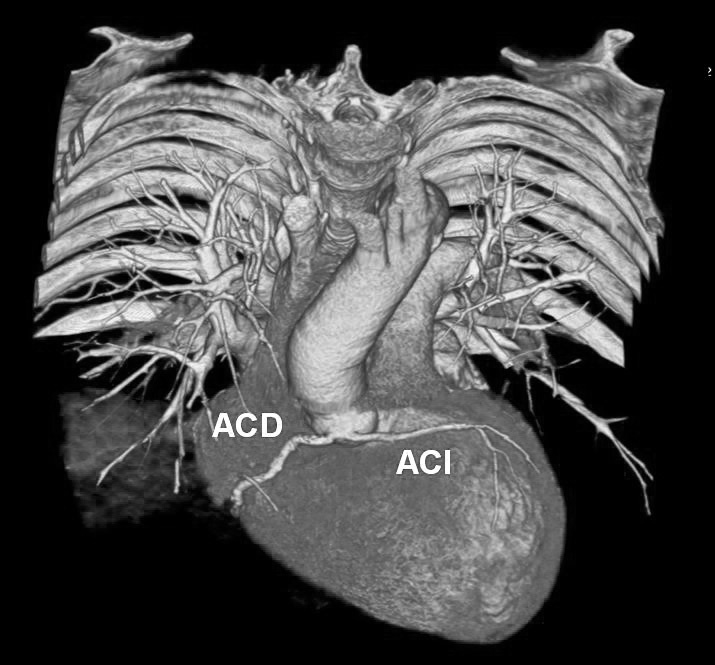
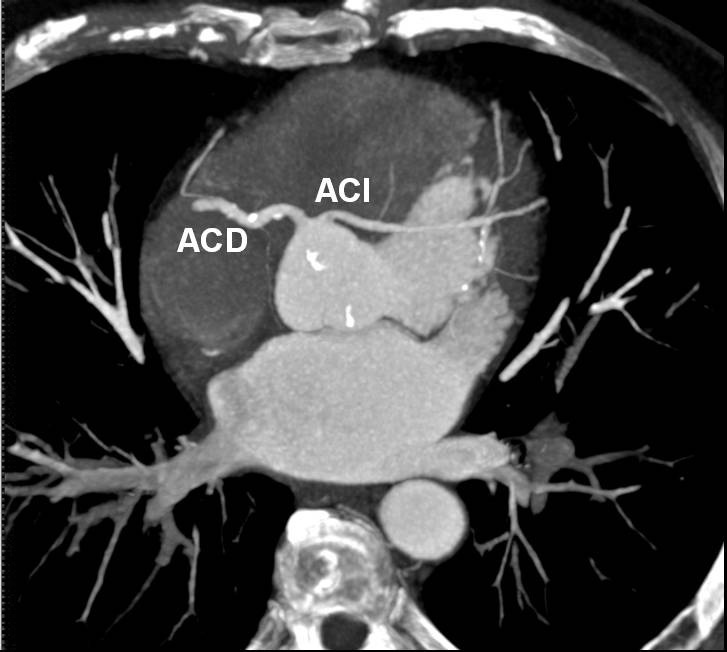
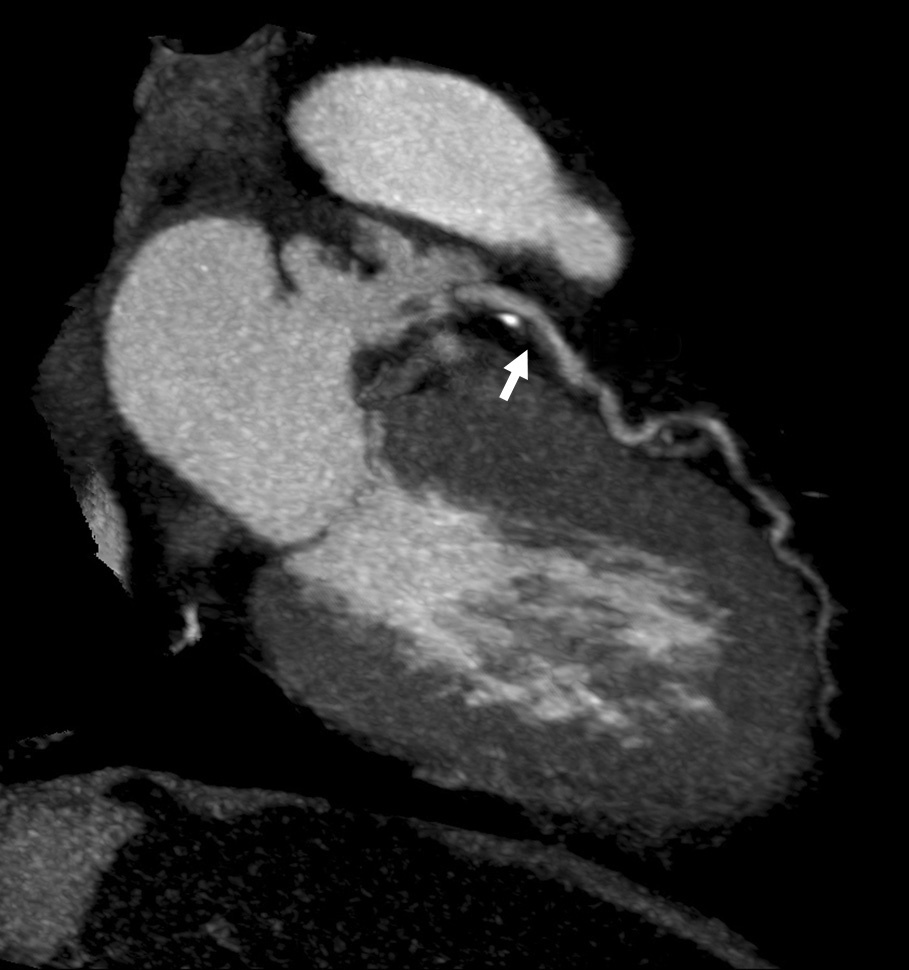
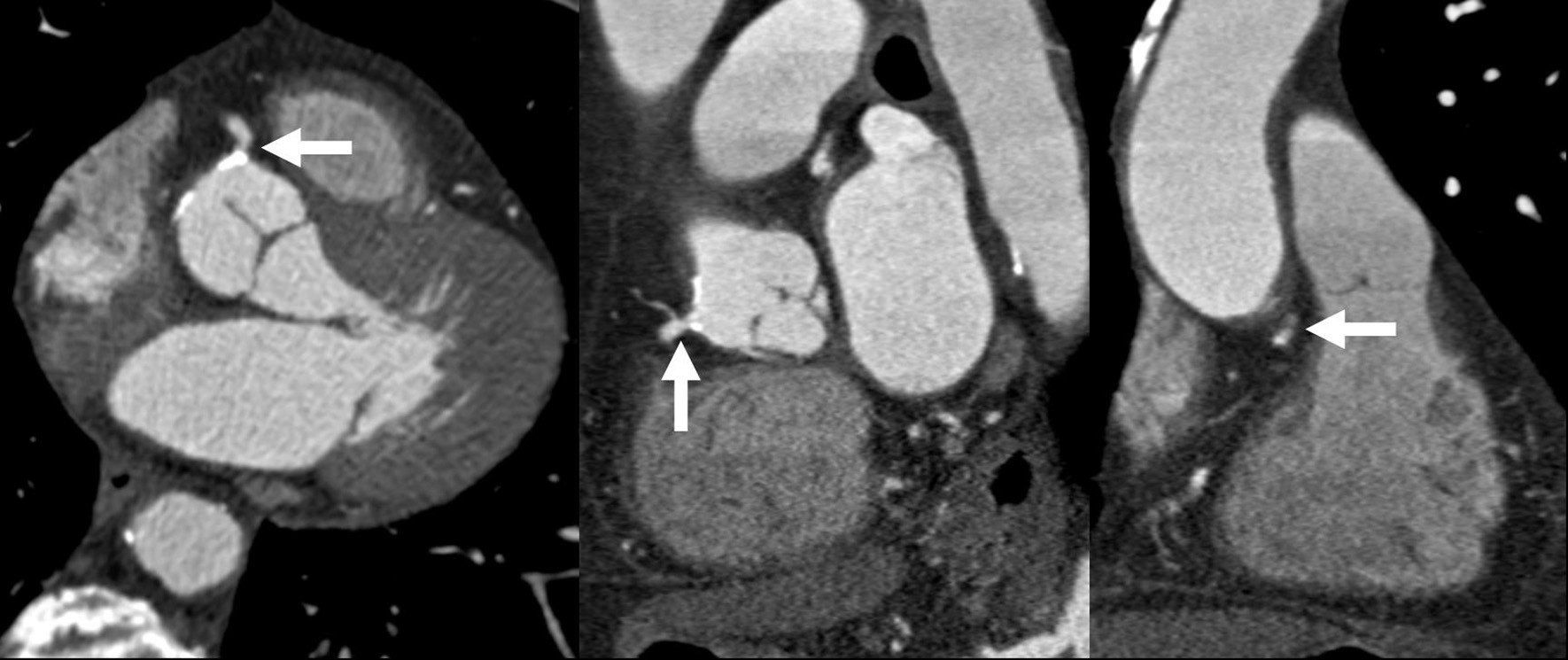
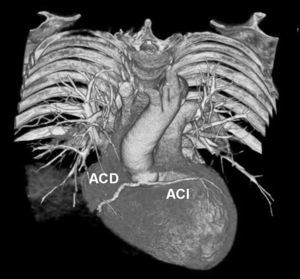
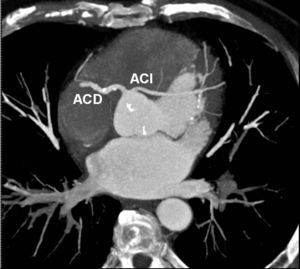
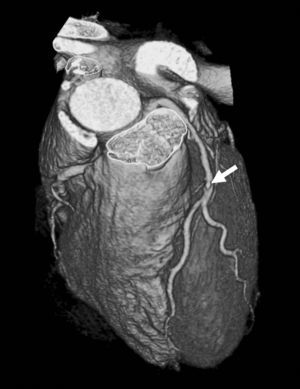
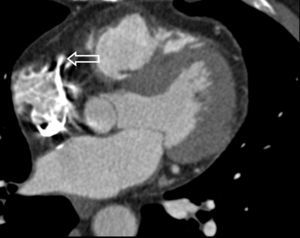
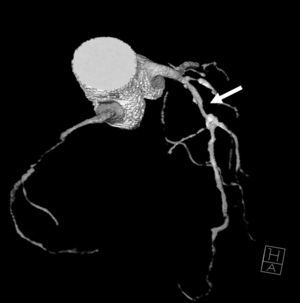
El origen y el curso de las arterias coronarias aberrantes se puede visualizar con precisión y clasificarse como variante benigna (curso por detrás de la raíz aórtica entre la aorta y la aurícula izquierda; [fig. 4]) o maligna (curso interarterial entre la aorta y la arteria pulmonar; fig. 5). Las variantes malignas se consideran vinculadas con la muerte súbita cardíaca, especialmente en atletas jóvenes (fig. 5), ya que el vaso coronario se puede ocluir durante la contracción sistólica al estar situado entre vasos de una alta presión. Además, el origen de estos vasos anómalos desde la aorta suele presentar un ángulo agudo que provoca anomalías del flujo sanguíneo que aumentan el riesgo de arritmias y condicionan una enfermedad aterosclerótica prematura.
Fig. 4. Angiografía por tomografía computarizada de 64 cortes con sincronización electrocardiográfica retrospectiva y administración de contraste en una mujer de 72 años después de una terapia de resección de la vena pulmonar por arritmia cardíaca. Se observa como hallazgo incidental un origen y un curso anómalos de la arteria coronaria izquierda (ACI). La imagen volumétrica en 3D, vista desde una perspectiva lateral inferior derecha, muestra el origen común de las arterias coronarias izquierda y derecha (ACD) fuera del seno arterial coronario correcto. Esta anomalía se considera benigna porque el trayecto proximal de la ACI no se ve sometido a ninguna presión durante la contracción cardíaca.
Fig. 5. Angiografía por tomografía computarizada coronaria tras la administración de contraste en un hombre de 21 años que perdió el conocimiento cuando jugaba al fútbol. La imagen en sección transversal (A), proyección axial de intensidad máxima (B) y presentación volumétrica en 3D (C) muestra el origen común de las arterias coronarias izquierda (ACI) y derecha (ACD) fuera del seno arterial coronario correcto. La ACI sigue luego un curso interarterial entre la aorta y la arteria pulmonar para abastecer el lado izquierdo del corazón. Como este curso expone la parte proximal de la ACI a la presión de dos grandes estructuras vasculares, la anomalía se considera maligna y explica los síntomas del paciente.
Dolor torácico: "triple estudio"
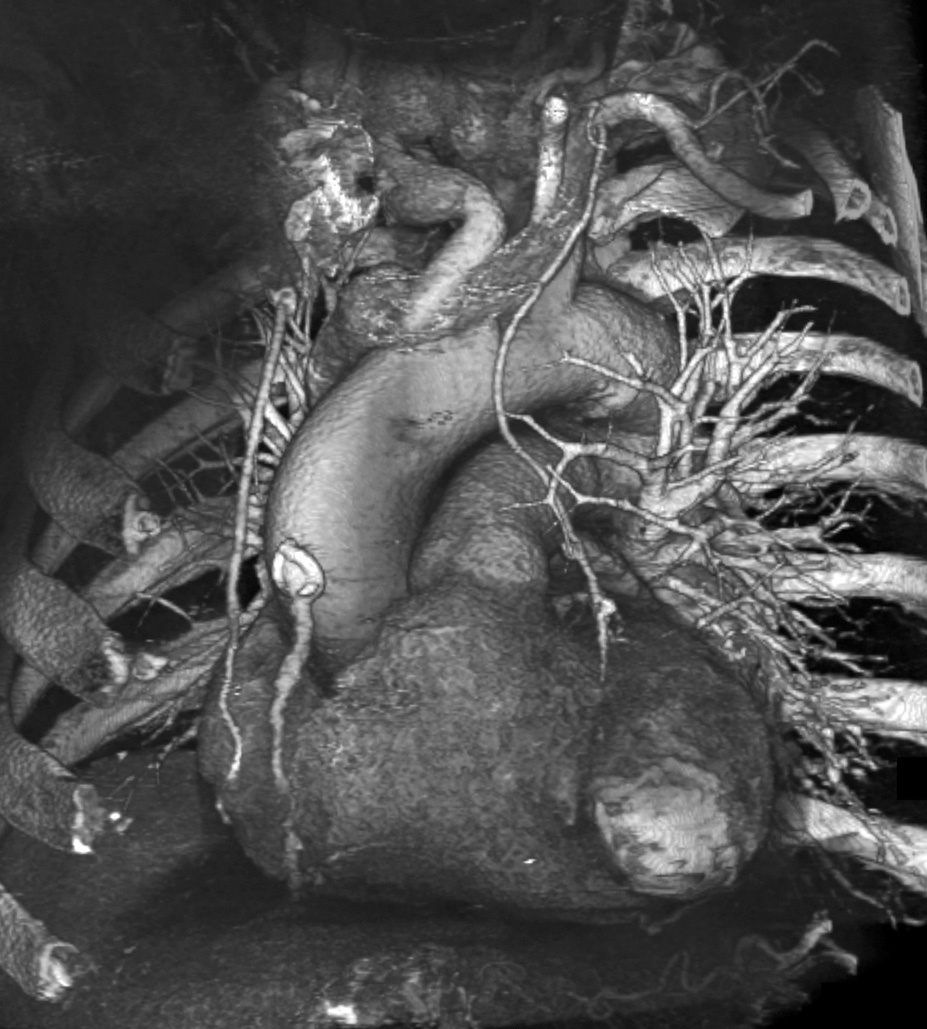
Los pacientes que presentan inequívocos síntomas coronarios agudos, con alteraciones significativas del ST y/o marcadores biológicos elevados, no son candidatos para la angio-TC coronaria. Sin embargo, la mayoría de los pacientes de Urgencias no tienen síntomas coronarios agudos concluyentes2. En los pacientes con dolor torácico agudo dudoso, la angio-TC de toda la cavidad torácica sincronizada con el ECG, conocida como "triple estudio", se ha evaluado en profundidad, dando muestras de una alta eficacia para identificar las causas del dolor torácico agudo, entre las que se incluyen la arteriopatía coronaria (fig. 6), el tromboembolismo pulmonar (fig. 7), la disección aórtica y otras patologías torácicas menos frecuentes13 (fig. 6).
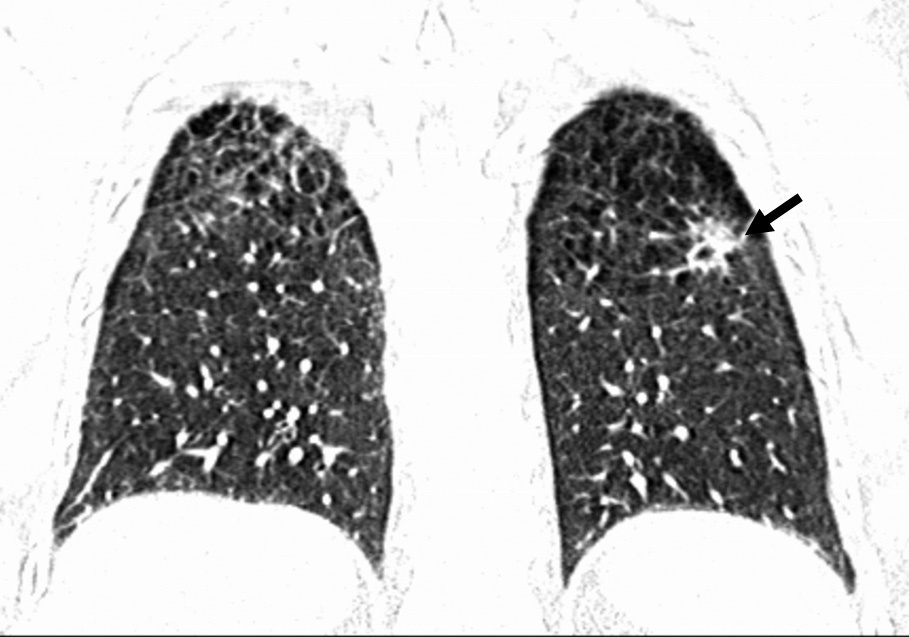
Fig. 6. Angiografía por tomografía computarizada de 64 cortes, con sincronización electrocardiográfica retrospectiva tras la administración de contraste del tórax completo de un hombre de 52 años, fumador de un paquete diario durante 25 años, que acudió a Urgencias con dolor torácico agudo. La presentación volumétrica vista desde una perspectiva craneal anterior oblicua izquierda no muestra signos de tromboembolismo pulmonar agudo ni de disección aórtica como motivo del dolor torácico (A). La proyección con máxima intensidad en una perspectiva oblicua anterior izquierda de la arteria coronaria descendente anterior izquierda (DAI) (B) muestra una placa aterosclerótica (flecha) en la pared anterior media inferior de la DAI. La placa provoca una estenosis de aproximadamente el 50% y consta de tejido no calcificado adyacente a un nódulo calcificado.
El estudio del tórax con ventana pulmonar (C) revela un enfisema panlobular con predominio en lóbulos superiores y un carcinoma de células escamosas (flecha) en el lóbulo superior izquierdo del pulmón.
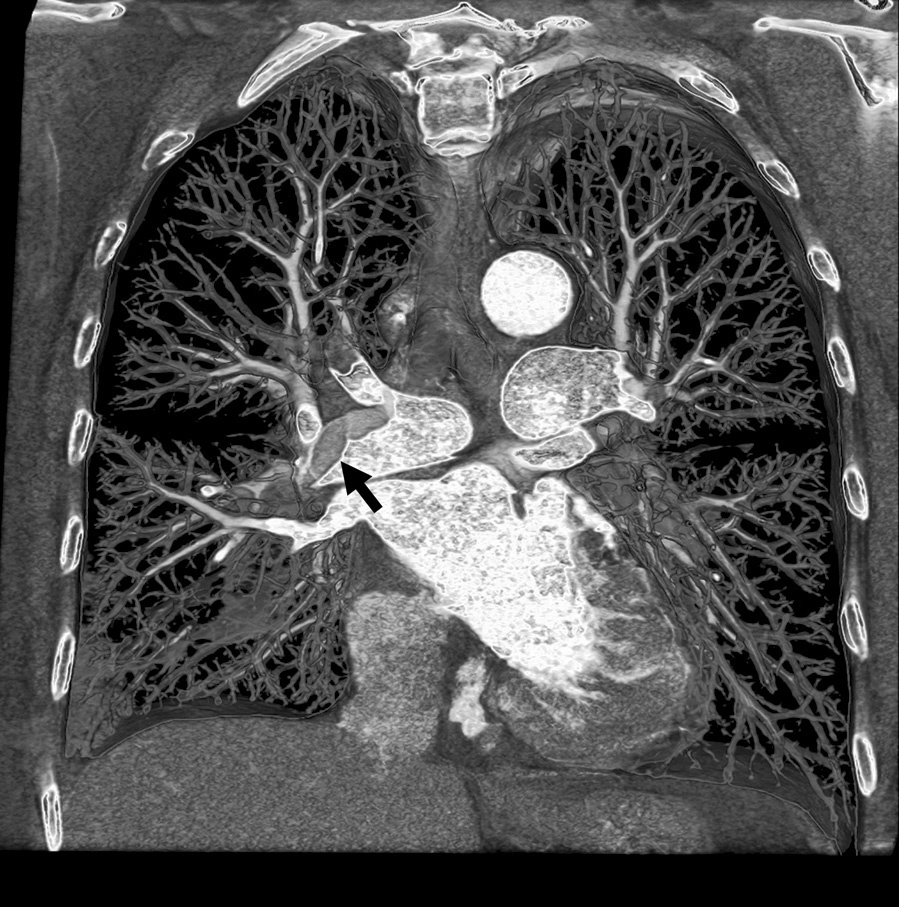
Fig. 7. Angiografía por tomografía computarizada de 64 cortes con sincronización electrocardiográfica retrospectiva y administración de contraste del tórax completo de una mujer de 54 años que acudió a Urgencias con dolor torácico agudo. La presentación volumétrica vista desde una perspectiva anterior coronal (A) muestra un tromboembolismo pulmonar agudo extenso (flecha) en la arteria pulmonar principal derecha. La evaluación de las arterias coronarias, mostrada en una representación volumétrica (B) a partir de los datos del mismo estudio, desde una perspectiva craneal oblicua anterior derecha, puso de manifiesto alteraciones ateroscleróticas leves (flecha) pero no una estenosis significativa. DAI: arteria coronaria descendente anterior izquierda.
Adquisición de imágenes
Preparación del paciente
Requisitos de la vía intravenosa
El acceso intravenoso se establece preferentemente por una vena cubital. En general, pero especialmente cuando se plantee llevar a cabo un by-pass con la arteria mamaria interna izquierda, se debe elegir el acceso por el brazo derecho para evitar los artefactos de endurecimiento del haz provocados por la alta concentración del material de contraste en la vena subclavia izquierda que dificultan la evaluación del origen de la arteria mamaria interna izquierda. Dado que se necesitan altas velocidades de inyección de hasta 5-6 ml/s, siempre que sea posible deberá utilizarse un catéter 18G o mayor.
Aplicación de los electrodos del electrocardiograma
Normalmente se utiliza un ECG de tres derivaciones. El requisito para poder sincronizar retrospectivamente la angio-TC con el ECG es una gráfica regular con un complejo QRS fácilmente identificable. Para establecer un buen contacto eléctrico y evitar que se desconecte el electrodo con la consiguiente pérdida de señal durante la obtención del registro, se recomienda utilizar abundante gel conductor y rasurar los puntos de conexión con exceso de vello.
Control de la frecuencia cardíaca para mejorar la calidad de la imagen
Con equipos de 4 a 64 cortes, las razones que justifican la necesidad de que el paciente tenga una frecuencia cardíaca baja son diversas. Las frecuencias cardíacas lentas prolongan relativamente las fases cardíacas con menor movimiento miocárdico (es decir, la relajación al final de la diástole y la contracción al final de la sístole), de manera que se puede colocar con seguridad un intervalo de reconstrucción de una duración definida dentro de estas fases sin incluir porciones, anteriores o posteriores, del ciclo cardíaco con movimiento.
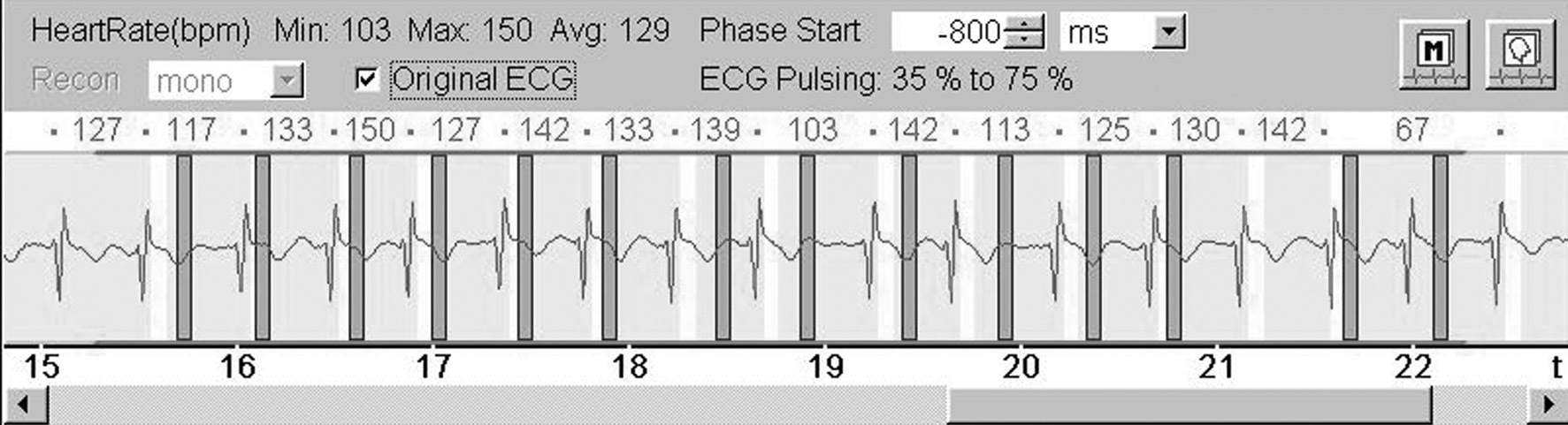
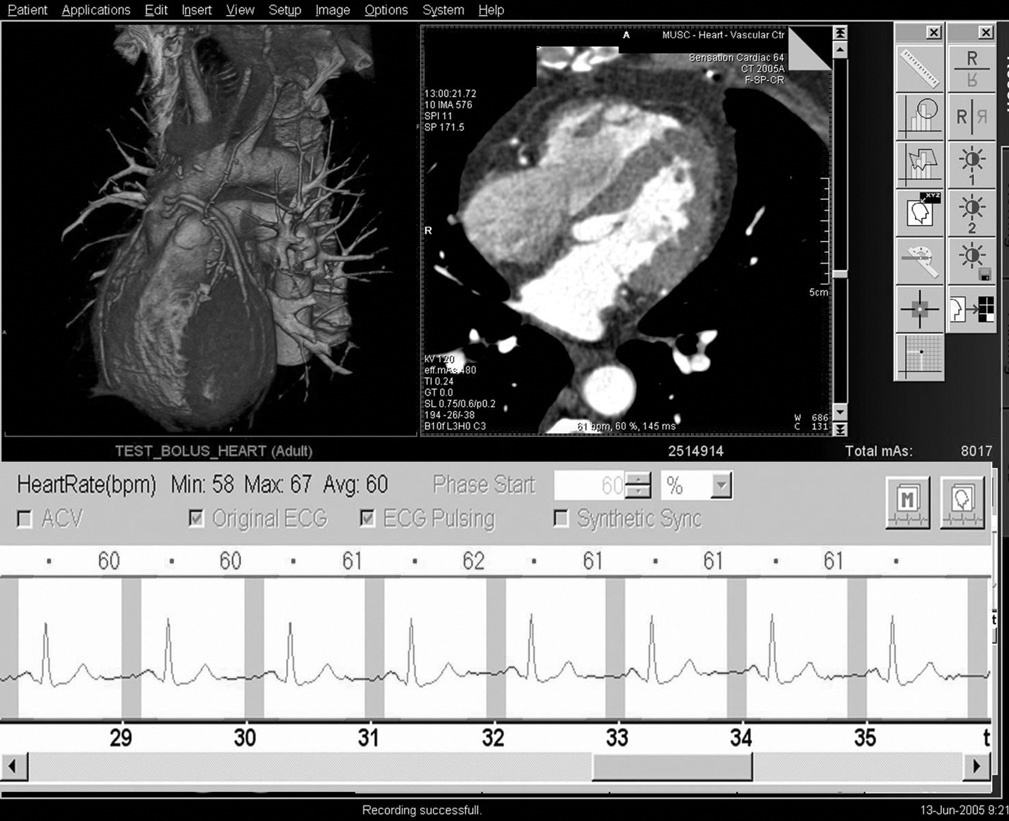
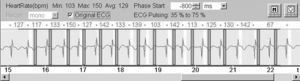
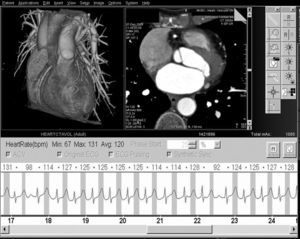
En nuestro centro tratamos de conseguir una frecuencia cardíaca comprendida entre 50 y 65 latidos por minuto (lpm) para las adquisiciones en equipos de TC de 64 cortes. Con la TCDF podría no necesitarse el control de la frecuencia cardíaca. Según nuestra experiencia, la TCDF permite la exploración de pacientes con frecuencias cardíacas elevadas (de 120 a 140 lpm) e irregulares con resultados diagnósticos (fig. 8).
Fig. 8. Angiografía por tomografía computarizada coronaria de doble fuente, con sincronización electrocardiográfica retrospectiva y administración de contraste en un hombre de 62 años con fibrilación auricular persistente y taquiarritmia después de terapia de resección de la vena pulmonar. La frecuencia cardíaca durante la tomografía computarizada osciló entre 67 y 150 latidos por minuto (A). A pesar de esta frecuencia cardíaca elevada e irregular, la resolución temporal estable de 83 ms permitida por esta tecnología permitió realizar un estudio con suficiente calidad diagnóstica. Las imágenes de presentación volumétrica, tanto durante la diástole (B) como durante la sístole (C), tienen una calidad de imagen similar y no muestran artefactos de motilidad ni de registro erróneo.
Control de la frecuencia para la reconstrucción de un segmento único en la tomografía computarizada de fuente única
Como consecuencia directa de la alta resolución temporal, generalmente se puede realizar la adquisición de las imágenes mediante la reconstrucción de un segmento único, es decir, basada en las proyecciones que se adquieren durante un único latido cardíaco. La reconstrucción de un segmento único tiene ventajas teóricas con respecto a los algoritmos de reconstrucción de segmentos múltiples que se suelen aplicar en los tomógrafos computarizados cardíacos existentes en la actualidad. En la reconstrucción de segmentos múltiples, las proyecciones que se necesitan para formar una sección única se muestrean a lo largo de dos a cuatro latidos cardíacos consecutivos6. Si bien este método mejora la resolución temporal, lo cual es bueno para las frecuencias cardíacas más rápidas, requiere que el corazón siga el mismo patrón de movimiento en cada uno de los dos o cuatro latidos durante los que se realiza el muestreo de la proyección para la reconstrucción de una única sección. Sin embargo, es poco probable que esto suceda dada la variabilidad de los patrones del movimiento cardíaco, incluso en condiciones fisiológicas en las que inevitablemente se producen incongruencias espaciales en los datos cuando se usa la reconstrucción de segmentos múltiples. En nuestro centro procuramos evitar el uso de algoritmos de reconstrucción de segmentos múltiples reduciendo la frecuencia cardíaca con la TC de 64 cortes. Esta reconstrucción se usa exclusivamente en los pacientes cuya frecuencia cardíaca sea mayor de 80 lpm, por encima de lo cual, según nuestra experiencia, las ventajas de una mejor resolución temporal superan al riesgo de la incongruencia espacial.
Control de la frecuencia para la protección radiológica
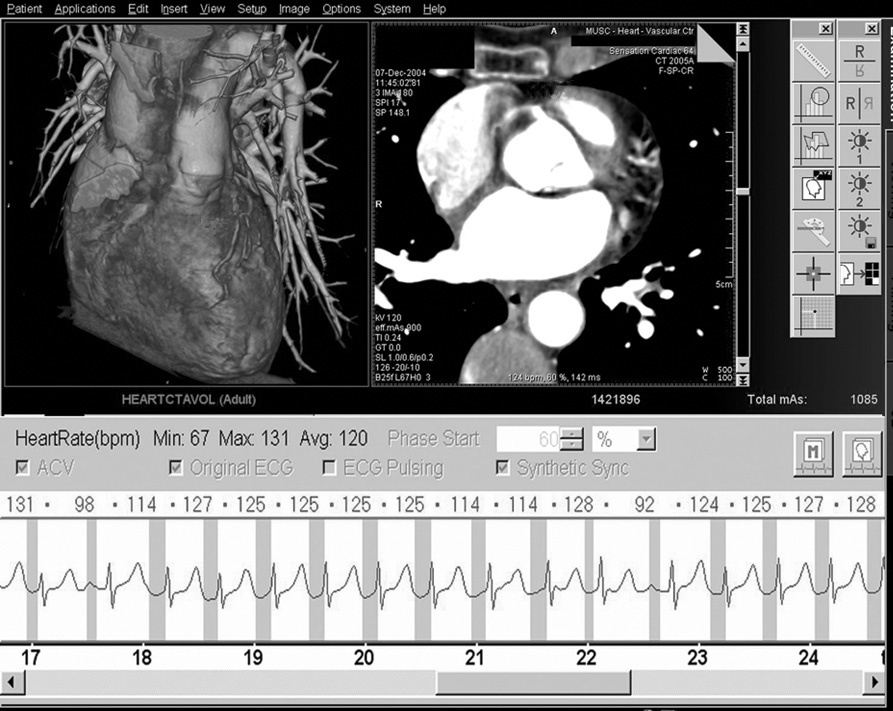
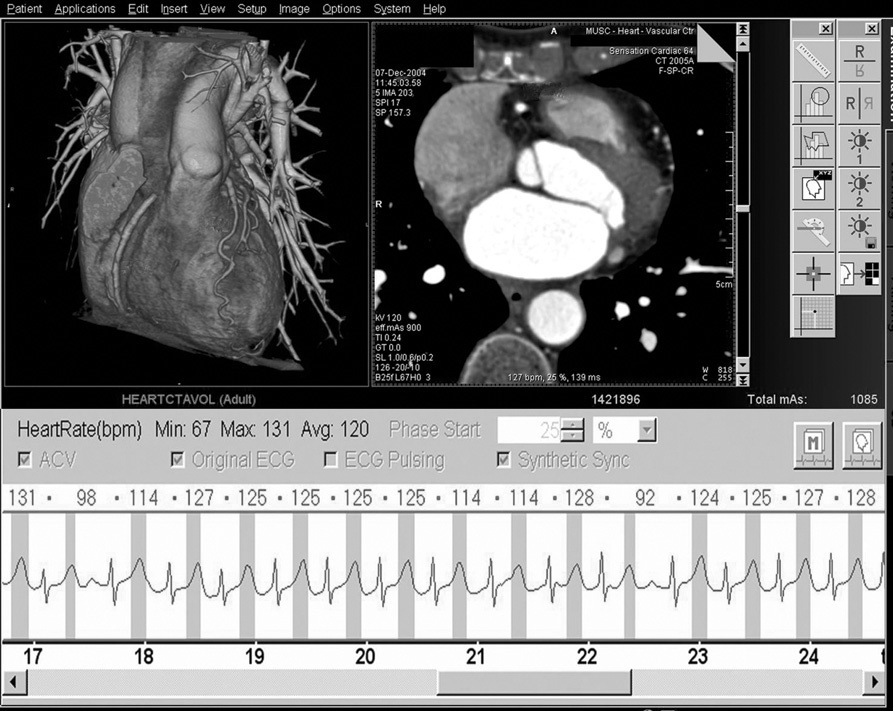
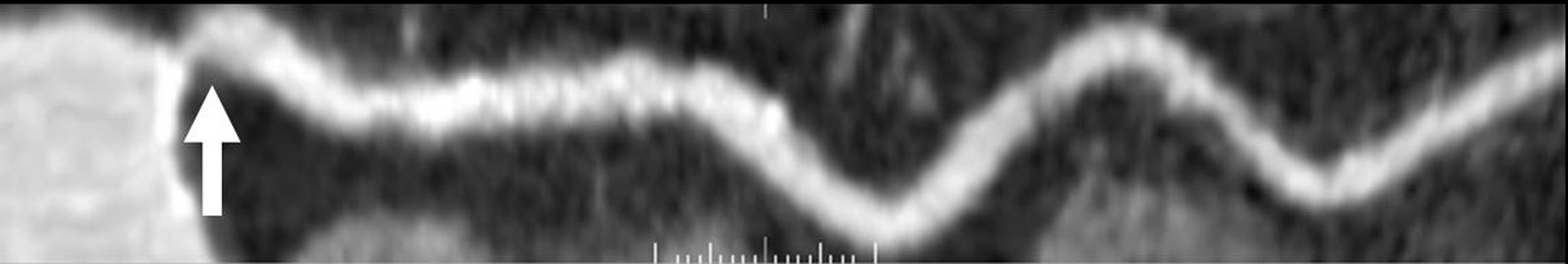
Hasta la aparición de la TC de 64 cortes, el control de la frecuencia cardíaca se había relacionado directamente con la exposición del paciente a la radiación. Se puede reducir significativamente la dosis de radiación con la modulación de dosis sincronizada con el ECG (ECG por pulsos)6,14. Este método implica el máximo rendimiento del tubo sólo durante la fase concreta del ciclo cardíaco en la que se vayan a reconstruir las imágenes. Durante el resto del ciclo cardíaco, el rendimiento del tubo se reduce. Sin embargo, el uso de modulación de dosis con sincronización electrocardiográfica sólo es aplicable a los pacientes cuyas frecuencias cardíacas sean lentas y estables, ya que el momento óptimo para la reconstrucción de la imagen se producirá previsiblemente durante la diástole (fig. 9). Según la frecuencia cardíaca aumenta, la modulación de dosis con sincronización electrocardiográfica va perdiendo cada vez más su eficacia porque el período de reducción de rendimiento del tubo se hace cada vez más corto con respecto al ciclo cardíaco. Y lo que es más importante, con frecuencias cardíacas más rápidas el momento óptimo para la reconstrucción de la imagen se hace más difícil de predecir, y en el caso de la TC de 64 cortes suele coincidir con el final de la sístole (fig. 10). Puesto que con la modulación de dosis con sincronización electrocardiográfica el nivel de radiación se reduce normalmente durante la sístole, la calidad diagnóstica se verá inevitablemente comprometida durante la reconstrucción de la imagen, por lo que no es recomendable el uso de modulación de dosis con sincronización electrocardiográfica cuando la frecuencia cardíaca sea rápida. Así pues, el control de la frecuencia se ha convertido en un factor decisivo en el intento por mantener la exposición a la radiación en la TC cardíaca dentro de límites razonables. En nuestro centro, con la TC de 64 cortes utilizamos la modulación de dosis con sincronización electrocardiográfica en pacientes con frecuencias cardíacas estables < 65 lpm. Creemos que en pacientes con frecuencias cardíacas más rápidas e irregulares la modulación de dosis con sincronización electrocardiográfica limita demasiado las opciones con respecto a la selección del momento óptimo para la reconstrucción como para recomendar su utilización.
Fig. 9. Angiografía por tomografía computarizada coronaria de 64 cortes con sincronización electrocardiográfica retrospectiva y administración de contraste en un hombre de 60 años para valorar la permeabilidad de un by-pass de arteria mamaria interna izquierda a la arteria coronaria descendente anterior izquierda y tres injertos de vena safena a las tres principales regiones coronarias. Imagen con técnica de presentación volumétrica (panel superior izquierdo) vista desde una perspectiva anterior. Una frecuencia cardíaca lenta y estable de unos 60 lpm permite el uso satisfactorio del electrocardiograma (ECG) de pulsos para reducir la dosis radiante. Sólo se aplica la corriente completa del tubo (en rojo en el registro ECG, en la parte inferior) durante la diástole, en la fase que luego se usa para la reconstrucción al 60% del RR. La imagen así obtenida es de alta calidad, con buena relación señal-ruido (superior derecha). Durante otras fases cardíacas, que no se usan para la reconstrucción de imágenes, la corriente del tubo se disminuye al 20% de la potencia de salida nominal (indicado en azul en el ECG del paciente, panel inferior).
Fig. 10. Angiografía por tomografía computarizada coronaria de 64 cortes, con sincronización electrocardiográfica retrospectiva y administración de contraste en una mujer de 70 años, enviada por anomalías dudosas en la perfusión en una tomografía computarizada cardíaca de emisión de fotón único. Debido a la frecuencia cardíaca rápida e irregular de unos 120 latidos por minuto (panel inferior en A), no se pudo prever el intervalo de reconstrucción óptimo de manera fiable y no se utilizó la técnica de electrocardiograma (ECG) por pulsos. A diferencia del paciente de la figura 9, en el que se previó el intervalo de reconstrucción óptimo durante la diástole, la reconstrucción de imágenes a RR 60% en esta paciente (A) produce una motilidad cardíaca considerable que desdibuja la arteria coronaria derecha (ACD) en las imágenes transversales (panel superior derecho en A) e impide totalmente la visualización del vaso en las imágenes con presentación volumétrica (panel superior izquierdo en A), mientras que la arteria coronaria descendente anterior izquierda (DAI) es serpiginosa. Sin embargo, como se mantiene la corriente completa del tubo a lo largo de todo el registro (indicado en rojo en el ECG de la paciente, panel inferior), se mantiene la flexibilidad para reconstruir datos durante cualquier fase del ciclo cardíaco. La reconstrucción posterior de la misma serie de datos durante la contracción sistólica completa (B) a RR 25% produce imágenes transversales casi exentas de motilidad (panel superior derecho en B), lo que permite una visión clara de la arteria coronaria descendente anterior izquierda (DAI) y la arteria coronaria derecha (ACD) en la presentación volumétrica (panel superior izquierdo en B).
Estas normas no se aplican a la TCDF. Debido a la existencia de una resolución temporal de tan sólo 83 ms, la modulación de dosis electrocardiográfica se puede aplicar con mucha más eficacia. Con estos equipos son posibles periodos de rendimiento máximo del tubo que se prolonguen únicamente durante un 10% del ciclo cardiaco. Por otra parte, la TCDF permite la adaptación del factor de paso a la frecuencia cardíaca del paciente, ya que no se necesitará la reconstrucción de segmentos múltiples para frecuencias cardíacas más altas. La velocidad de desplazamiento de la mesa puede adaptarse eficazmente a la frecuencia cardíaca del paciente y aumentar significativamente con frecuencias cardíacas más altas2. Como demostraron McCollough et al, puede reducirse así la dosis de radiación en la TC cardíaca hasta un 50% en comparación con la TC de fuente única15.
Control de la frecuencia: aspectos prácticos
En nuestro centro administramos rutinariamente un bloqueante beta por vía intravenosa (tartrato de metoprolol, Lopressor, Novartis, East Hanover, NJ) para controlar la frecuencia cardíaca de los pacientes, con resultados muy satisfactorios y sin complicaciones hasta la fecha. Son contraindicaciones para el uso del bloqueante beta la enfermedad pulmonar obstructiva crónica, el asma, la alergia a los agonistas beta, el bloqueo cardíaco de segundo o tercer grado y la hipotensión (< 100 mmHg sistólico). En caso de no haber contraindicaciones, inyectamos un bolo inicial de 5 mg de metoprolol mientras el paciente está ya sobre la mesa del escáner y se siguen los preparativos para hacer la exploración. Si la respuesta ventricular no es satisfactoria, es decir, si la frecuencia cardíaca promedio se mantiene superior a los 70 lpm, inyectamos hasta otras 2 dosis (15 mg en total como máximo). Después de la administración de 3 dosis, empezamos el registro, independientemente de la frecuencia cardíaca que se haya podido conseguir finalmente con el bloqueante beta. Un medio alternativo para controlar la frecuencia es la administración oral de bloqueantes beta. En comparación con nuestro protocolo intravenoso, la administración oral presenta mayores exigencias. Si se prefiere la administración oral, en el caso ideal debería comenzarse el régimen la noche anterior a la realización de la TC con una dosis inicial de 50-100 mg de metoprolol. Se administra otra dosis unos 30-60 minutos antes de realizar el registro, seguida de una tercera dosis si no se produce la respuesta ventricular adecuada.
Se tiene menos experiencia con otros medicamentos. Sin embargo, si hubiera contraindicaciones para utilizar agonistas beta (véase más arriba) puede merecer la pena intentarlo con bloqueadores de los canales del calcio. Estos antagonistas cálcicos pueden administrarse por vía intravenosa (0,25 mg/kg de peso, hasta un total de 25 mg, de diltiazem, Cardizem Monovial, Hoechst Marion Roussel, Kansas City, MO) o bien en régimen oral con 30 mg de diltiazem de liberación normal (Cardizem, Biovail, Toronto, Canadá). En nuestro centro, todos los pacientes que reciben medicamentos para controlar la frecuencia cardíaca o nitroglicerina (NTG) (véase más adelante) se monitorizan durante 30 minutos después de la administración de la última dosis. Se mide la presión arterial antes de la administración del fármaco y antes del alta. A los pacientes que reciban más de una dosis de bloqueantes beta se les advierte de que no conduzcan ni manejen maquinaria durante tres horas después de la administración del fármaco.
Nitroglicerina
No existen estudios sistemáticos que respalden el uso de la NTG en la TC cardíaca. En pacientes a los que se solicita una angio-TC por sospecha de arteriopatía coronaria, administramos un comprimido de 0,4 mg de NTG (NitroQuick, Ethex, St. Louis, MO) sublingual 2 minutos antes de la exploración con la intención de ensanchar las coronarias para visualizarlas mejor y suprimir los espasmos arteriales que puedan simular una estenosis, especialmente en las personas más jóvenes. Como alternativa se puede utilizar un spray sublingual. Son contraindicaciones para el uso de NTG la hipotensión, el infarto de miocardio precoz, la anemia grave, la presión intracraneal elevada y la hipersensibilidad conocida a la NTG. Tampoco damos NTG a pacientes que hayan tomado recientemente medicamentos que contengan nitrato por disfunción eréctil (Viagra, Cialis, Levitra).
El mismo protocolo relativo al control de la frecuencia y a la NTG se aplica para la exploración del "triple estudio" en la evaluación de los pacientes con dolor torácico agudo.
Parámetros de registro
Velocidad de rotación del tubo y colimación
En la angio-TC coronaria la estructura anatómica de interés es pequeña, tortuosa y de movimientos rápidos. Por ello, una angio-TC coronaria óptima, con cualquiera de los equipos de cualquier fabricante, nunca se adquiere con cortes lo suficientemente finos ni con velocidades de giro lo bastante rápidas. Así, independientemente del escáner empleado, deberá elegirse la colimación más fina y el tiempo de rotación del tubo lo más rápido posible. Constituye una excepción la situación poco habitual en que la frecuencia cardíaca del paciente sea tan lenta (habitualmente < 50 lpm) que sea preciso utilizar una rotación del gantry algo más lenta con un menor factor de paso para evitar perder datos en la serie adquirida16. Otra situación en la que se puede considerar la elección de una velocidad de rotación del gantry algo más lenta es la del paciente excesivamente obeso, en cuyo caso la rotación más lenta puede ser útil para aumentar el flujo de fotones y mejorar la relación de señal-ruido. La TCDF, con sus dos tubos de rayos X, es considerablemente mejor que la TC de fuente única para suprimir el ruido en la imagen en los pacientes obesos. Con esta última tecnología no suele ser necesario reducir la velocidad de rotación del gantry. En su lugar, para suprimir el ruido de la imagen, se puede seleccionar un intervalo de frecuencias cardíacas que sea más bajo que la frecuencia cardíaca real del paciente, lo que permite una menor velocidad de la mesa y una acumulación de dosis para disminuir el ruido.
Corriente y voltaje del tubo
Hacer recomendaciones generales en cuanto a la selección de ajustes de la corriente del tubo es complejo, ya que la corriente adecuada del tubo depende de diversas variables específicas del escáner, tales como la configuración de la colimación y la velocidad de rotación del gantry. Como ocurre con todas las aplicaciones de TC, se aplica el principio as low as reasonably achievable (ALARA) (tan bajo como sea posible), que implica la exigencia de un ajuste de los parámetros técnicos del estudio al hábito corporal del paciente, de manera que se seleccione la menor corriente del tubo posible que sea capaz de permitir un estudio de calidad diagnóstica. Cuando se estudian con la TC de fuente única adultos de tamaño medio por sospecha de arteriopatía coronaria con una colimación de 0,6 mm y una rotación del gantry de 330 ms, ajustamos normalmente la corriente del tubo a 750-800 mAseff w, empleando siempre todos los medios disponibles para reducir la exposición del paciente a la radiación (es decir, ECG de pulsos, véase más arriba). Con la TCDF se eligen normalmente los parámetros de registro de 120 kV por tubo con una corriente de 560 mA y el uso de modulación anatómica de la corriente del tubo. El tiempo de rotación del gantry se fija normalmente en 330 ms y el factor de paso oscila entre 0,2 y 0,43, dependiendo de la frecuencia cardíaca.
Puesto que la absorción de los rayos X por el yodo es inversamente proporcional a la diferencia de potencial del tubo, no es recomendable utilizar un alto voltaje (es decir, 140 kV) para la angio-TC coronaria. Para la exploración de adultos de tamaño medio, o corpulentos, por sospecha de arteriopatía coronaria, empleamos normalmente una potencia del tubo de 120 kV. Se puede reducir considerablemente la dosis disminuyendo el voltaje del tubo hasta 80-100 kV, aumentando el nivel de atenuación vascular. Así pues, en adultos delgados se puede disminuir con seguridad el voltaje del tubo hasta 100 kV con resultados muy satisfactorios. Igualmente, dependiendo del tamaño del paciente, utilizamos rutinariamente un voltaje de 80-100 kV en pacientes adolescentes o pediátricos con sospecha de anomalías en las arterias coronarias o de otros trastornos cardiovasculares congénitos17.
Opacificación con medios de contraste
Grado de realce
Una opacificación vascular buena y constante de la luz es un requisito previo para conseguir una angio-TC coronaria satisfactoria. Se necesita un realce suficiente que permita la visualización de la pared de los vasos, de las pequeñas ramas laterales del árbol coronario y, especialmente en pacientes obesos, para compensar los mayores niveles de ruido en la imagen que limitan la resolución del contraste cuando se usan colimaciones finas. Además, un realce intenso y homogéneo sirve de base para las técnicas de visualización 3D por umbralización. Para conseguir un realce vascular adecuado utilizamos un medio de contraste no iónico de alta concentración (350-370 mgI/ml) con una velocidad de inyección rápida de 5-6 ml/s. Se ha sugerido que un contraste intraluminal muy alto puede interferir en la detección de la placa aterosclerótica calcificada. Según nuestra experiencia, esta dificultad se puede evitar fácilmente ajustando correctamente el centro y el ancho de la ventana (nivel 100 HU; anchura 700 HU) según el grado de realce que se haya conseguido en el paciente.
Técnica de empuje con solución salina
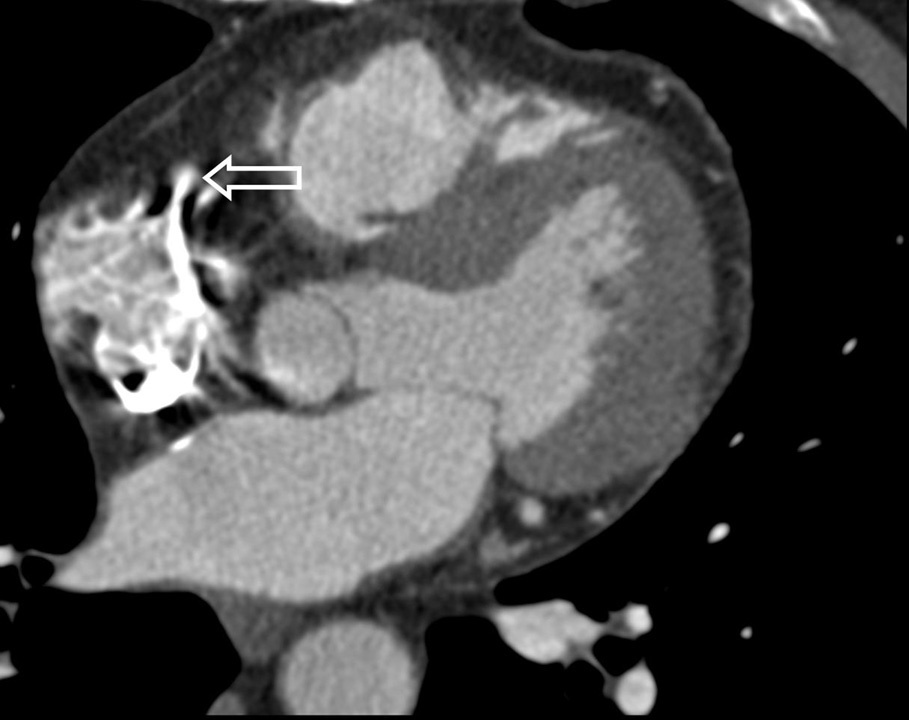
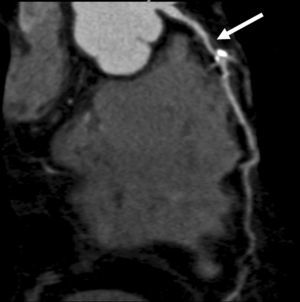
En la actualidad se está dedicando un considerable esfuerzo científico a la comprensión y optimización de la dinámica del contraste en la angio-TC18,19. Los descubrimientos realizados en las investigaciones en curso se incorporan continuamente a los inyectores automáticos comercialmente disponibles. Uno de estos avances que se ha hecho imprescindible para la angio-TC es el uso de una embolada de empuje de solución salina, factible gracias a los sistemas de inyección de doble cabezal. El uso de la técnica de empuje busca optimizar el rendimiento del medio de contraste inyectado al prolongar su fase de meseta en la opacificación. Lo que es aún más importante, el empuje con suero salino reduce la aparición de artefactos de endurecimiento por la alta densidad del contraste en la vena cava superior y en las cámaras derechas del corazón. En la angio-TC coronaria estos artefactos pueden limitar significativamente la evaluación de la arteria coronaria derecha y simular una estenosis, especialmente en el procesado posterior 2D y 3D de las imágenes (fig. 11). La presencia de estos artefactos se puede reducir o evitar por completo si en el momento de la adquisición de la imagen se lava el contraste de la parte derecha del corazón utilizando la técnica del empuje con suero salino.
Fig. 11. Angiografía por tomografía computarizada coronaria con sincronización electrocardiográfica retrospectiva y administración de contraste, sin técnica de empuje de solución salina. Imagen en sección transversal (A) y presentación volumétrica (B) vista desde una perspectiva oblicua anterior izquierda. Un artefacto de rayas producido por el material de contraste denso en la parte derecha del corazón (flecha en A) cubre la arteria coronaria derech en B) de la arteria coronaria proximal derecha.
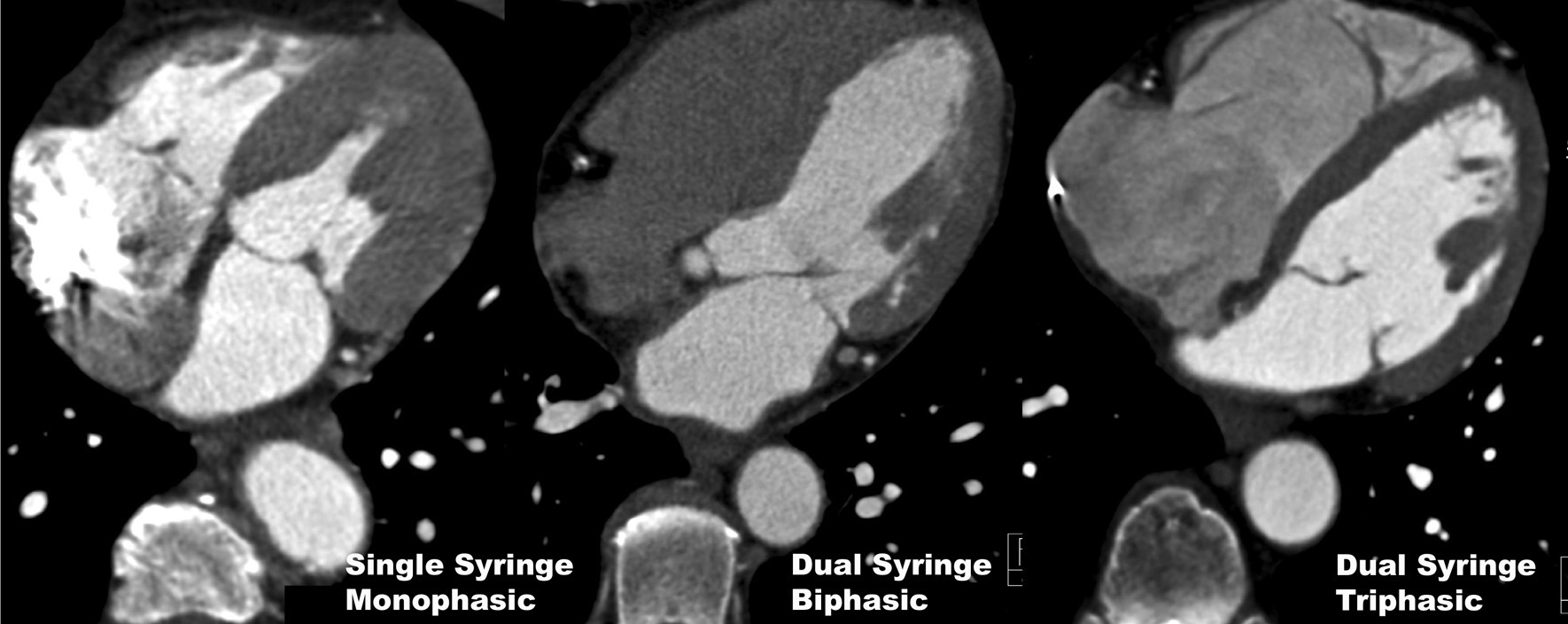
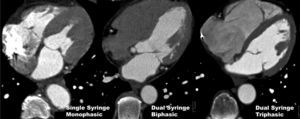
Por otra parte, ya que no es deseable vaciar por completo el contraste del lado derecho del corazón porque impediría su análisis, pretendemos mejorar su visualización utilizando tres fases de inyección donde al bolo inicial de yodo le siga una mezcla de solución salina/contraste que se realiza gracias a la inyección simultánea de ambas jeringas (Dual Flow Technology, Medrad, Pittsburgh, PA) y finalmente la embolada de salino (véase más adelante). Esta estrategia proporciona una mejora suficiente en la evaluación de la parte derecha del corazón (fig. 12) para la detección de tromboémbolos, tumores, etc., a la vez que se pueden evitar por lo general los artefactos de endurecimiento por el medio de contraste denso.
Fig. 12. Angiografía por tomografía computarizada con sincronización electrocardiográfica retrospectiva y administración de contraste en tres pacientes diferentes. El uso de una inyección monofásica (izquierda) de contraste, con un inyector de una sola jeringa, produce artefactos de rayas densas en el lado derecho del corazón. La inyección bifásica (centro) con un inyector de doble jeringa y técnica de empuje de solución salina expulsa el contraste residual del lado derecho del corazón y evita la formación de artefactos; sin embargo, las cámaras cardíacas derechas ya no se pueden evaluar. Una inyección trifásica, usando también un inyector de jeringa doble, con flujo simultáneo (derecha) de dos jeringas administrando una mezcla de contraste y solución salina durante la segunda fase de inyección. Esto proporciona una atenuación suficiente para la evaluación de la parte derecha del corazón a la vez que, en general, se pueden evitar los artefactos de rayas del material de contraste denso.
Protocolo de contraste
El tiempo de demora para cada paciente se determina con la inyección de un bolo de prueba de medio de contraste de 20 ml a 5 ml/s (TCMD de 64 cortes) o de 6 ml/s (TCDF), seguido de 50 ml de solución salina, empleando un inyector de doble jeringa (Stellant D, Medrad). Se realiza una adquisición de corte única repetida en la misma posición en el eje Z, al nivel de la raíz aórtica, para controlar la llegada y el paso del bolo de prueba. El tiempo hasta el pico máximo de realce con el bolo de prueba se utiliza como tiempo de demora. El volumen de contraste para la angio-TC se calcula individualmente aplicando la fórmula:
volumen (ml) = tiempo de adquisición (s) * 5 (TCMD de 64 cortes) o * 6 (TCDF)
El inyector se programa previamente de modo que administre 50 ml de una mezcla al 30% de medio de contraste y al 70% de solución salina durante la segunda fase de la inyección, seguido de 30-50 ml de suero fisiológico final, todas las fases a 5 ml/s (TCMD de 64 cortes) o 6 ml/s (TCDF).
El mismo protocolo se aplica en la exploración de "triple estudio" para la evaluación de los pacientes con dolor torácico agudo. Puesto que se explora todo el tórax para esta aplicación, el bolo inicial de yodo tendrá un volumen mayor, ya que la duración del registro es la variable determinante en la ecuación anterior.
Reconstrucción de imágenes
Algoritmo de reconstrucción de segmento único frente a segmentos múltiples
Ya se han comentado las cuestiones relativas al uso de la reconstrucción de un segmento único frente a segmentos múltiples ("Control de la frecuencia para reconstrucción de segmento único en tomografía computarizada de fuente única"). Por lo general, evitamos utilizar la reconstrucción de segmentos múltiples en pacientes con frecuencias cardíacas inferiores a 80 lpm con TCMD de 64 cortes y siempre con TCDF.
Elección del intervalo óptimo de reconstrucción
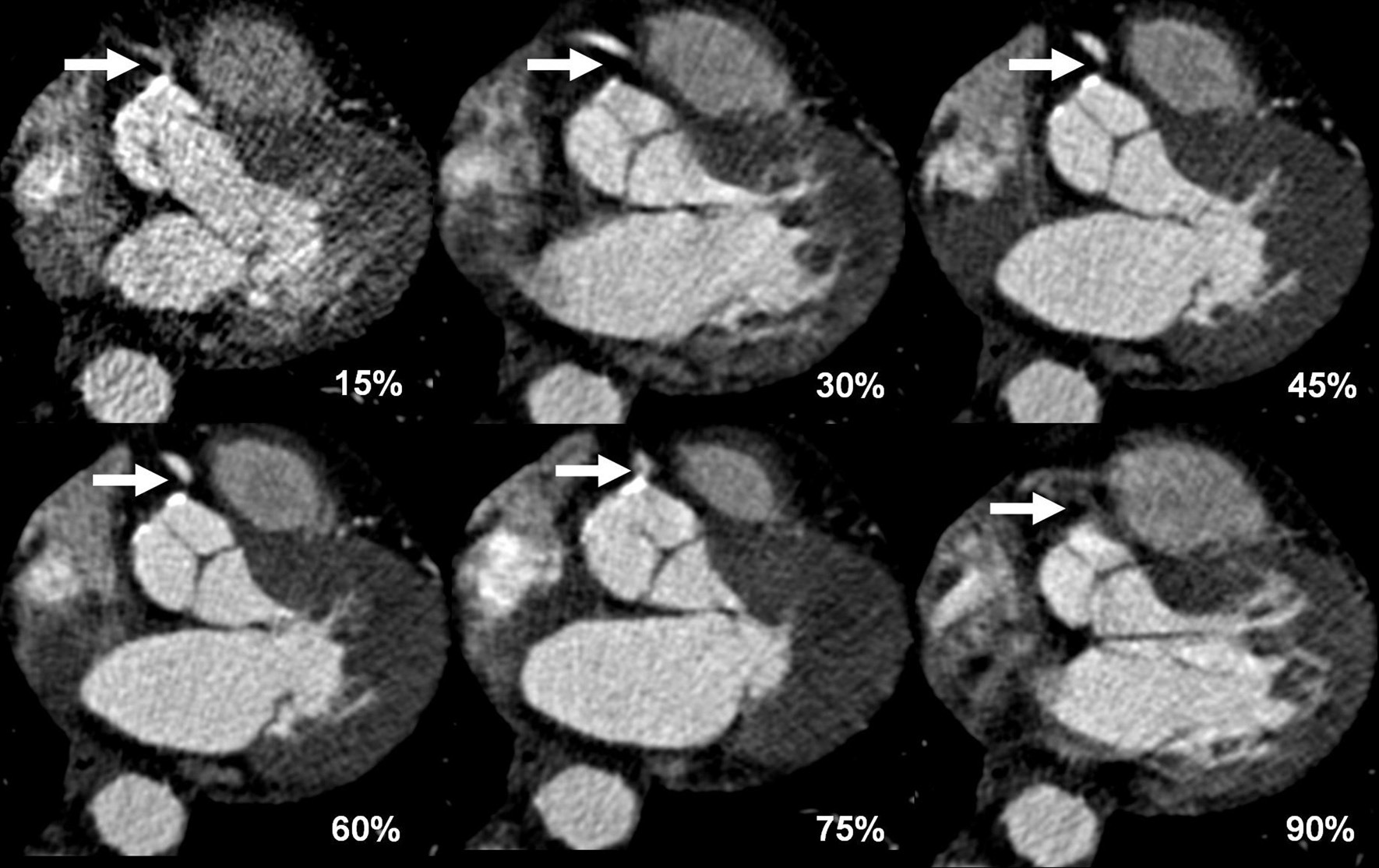
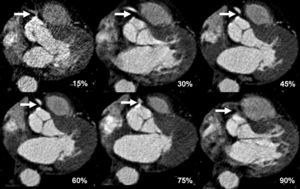
Para la evaluación de la morfología cardíaca se elige preferiblemente una fase con motilidad cardíaca mínima con el fin de situar el intervalo de reconstrucción de las imágenes. Para definir el punto de inicio del intervalo de reconstrucción dentro del ciclo cardíaco existen métodos absolutos y relativos en la mayoría de los equipos de TC. Con el método absoluto, cada intervalo de reconstrucción de imágenes se sitúa en el ciclo cardíaco con una distancia temporal predefinida (por ejemplo 400 ms), antes o después de un pico R del ECG. Con el método relativo, el punto de inicio del intervalo de reconstrucción de imágenes se define como un determinado porcentaje (por ejemplo, el 60%) de la duración del ciclo cardíaco. Nosotros utilizamos el método relativo basado en el porcentaje para la TCMD de 64 cortes y el método absoluto para la TCDF. Si está disponible, es preferible emplear la función de visualización previa para determinar la fase de reconstrucción óptima que presente la mínima motilidad cardíaca. Normalmente, la serie de visualización previa consta de 20 imágenes (fig. 13), reconstruidas en 20 posiciones RR diferentes, con incrementos del 5% (RR 0-95%), adquiridas en la misma posición Z en un plano medio del corazón. Para la reconstrucción de las imágenes se elige la fase que muestre menos artefactos de motilidad, tanto en el sistema arterial coronario izquierdo como en el derecho. En los casos en que las arterias coronarias derecha e izquierda muestren unos patrones de motilidad diferentes, se realiza más de una reconstrucción para obtener una visualización optimizada para ambos sistemas arteriales.
Fig. 13. Angiografía por tomografía computarizada coronaria de doble fuente con sincronización electrocardiográfica retrospectiva y administración de contraste (misma paciente de la figura 16). El uso de una función de visualización previa identifica la fase cardíaca más apropiada para la reconstrucción de imágenes. Se muestran 6 secciones transversales representativas en la misma posición Z a la altura de la válvula aórtica, de una serie de 20 reconstrucciones a diferentes posiciones de RR en incrementos del 5% (RR 0-95%), que abarcan todo el ciclo cardíaco. Las reconstrucciones de imágenes durante la contracción cardíaca completa al final de la sístole (RR 45%) y durante la relajación completa durante la diástole (RR 60%) son adecuadas para suprimir suficientemente la motilidad cardíaca y permiten una evaluación clara del origen de la arteria coronaria derecha estenosada, aunque esta zona quede borrosa durante otras fases del ciclo cardíaco. La reconstrucción de imágenes durante las fases precoz (15%) y tardía (90%) del ciclo cardíaco también muestra niveles más altos de ruido en la imagen, debido a nuestro uso de rutina de técnicas de electrocardiograma por pulsos durante estas fases con tomografía computarizada de doble fuente.
Si no se dispone de una función de visualización previa, se puede realizar una primera reconstrucción de las imágenes a una RR del 60% (fig. 9), que produce una calidad de imagen de valor diagnóstico en la mayoría de los pacientes20, especialmente con frecuencias cardíacas regulares más lentas. Con la mejor resolución temporal de los nuevos escáneres, la sístole tardía con contracción cardíaca total (es decir RR 30-40%) ha resultado ser el segundo momento más apropiado para la reconstrucción de imágenes (fig. 10), ya que la motilidad cardíaca es mínima. Según nuestra experiencia, la reconstrucción de imágenes durante la sístole tardía proporciona resultados diagnósticos en la mayoría de los pacientes con una frecuencia cardíaca más rápida y es especialmente idónea para la visualización de la arteria coronaria derecha.
Parámetros de la reconstrucción
Campo de visión
Con objeto de optimizar la resolución espacial para realizar la reconstrucción de las imágenes en la angio-TC deberá elegirse el campo de visión más pequeño posible que abarque toda la anatomía del corazón. Por otra parte, en cada estudio de angio-TC realizamos una reconstrucción del campo de visión completo de todo el tórax y en todo el volumen Z adquirido, con cortes de 3 mm de espesor y un algoritmo pulmonar para evaluar la patología pulmonar incidental. Para aplicaciones especializadas, como la exploración de "triple estudio", hacemos las dos reconstrucciones antes descritas y una tercera reconstrucción con espesor de 1 mm, algoritmo vascular y campo de visión que abarque todo el tórax, con el fin de evaluar la patología vascular en la circulación pulmonar y la aorta torácica.
Espesor de la sección reconstruida
Generalmente, para evitar artefactos deben reconstruirse cortes finos con un espesor ligeramente mayor que la colimación21. Por ejemplo, si el registro se obtuvo con una colimación de 0,6 mm, para la reconstrucción de imágenes se deberá elegir el siguiente grosor superior disponible de reconstrucción (por ejemplo, 0,75 mm). Normalmente, para la reconstrucción de las imágenes se emplean incrementos del 40-60%, lo que según nuestra experiencia produce una delineación algo más nítida y clara del árbol arterial coronario, aunque no mejora necesariamente la exactitud del diagnóstico en comparación con la reconstrucción de las imágenes contiguas sin superposición.
Algoritmo de reconstrucción (kernel)
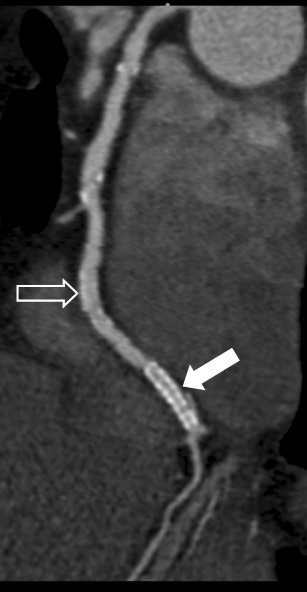
La mayoría de los escáneres de TCMD empleados disponen de un filtro de reconstrucción específico (kernel) para la reconstrucción de los estudios cardíacos. Normalmente, estos kernels mantienen un grado de realce de bordes para ofrecer la necesaria resolución espacial para visualizar los detalles vasculares de pequeño tamaño. En el mejor de los casos, los kernels también se optimizan para suprimir el ruido de la imagen tanto como sea posible y así mejorar la impresión visual y mantener la resolución del contraste para la evaluación del miocardio y la pared vascular. Para la evaluación de los stents de arterias coronarias se recomienda utilizar un kernel con borde aún más marcado y con mayor resolución espacial. Este método suprime en cierta medida los artefactos de endurecimiento del haz y produce una mejor delineación de la estructura metálica de los stents (fig. 14) que otros algoritmos usados más habitualmente. Este método también puede ayudar al diagnóstico en presencia de calcificaciones importantes, que plantean un problema semejante al de las estructuras densas del stent para evaluar la integridad luminal. Aunque los algoritmos de reconstrucción especializados mejoran la visualización de los stents de arterias coronarias, nuestra capacidad para evaluar la permeabilidad del stent es muy variable y depende de la calidad de los datos adquiridos y del tamaño y el material del stent. Debido a esta variabilidad, no se puede esperar una evaluación fiable de los stents de modo rutinario, por lo que no se recomienda el uso de la TC para su seguimiento.
Fig. 14. Angiografía por tomografía computarizada coronaria de 64 cortes con sincronización electrocardiográfica retrospectiva y administración de contraste en un hombre de 59 años enviado para vigilancia no invasiva de arteriopatía coronaria conocida. Reconstrucción de la misma serie de datos con un algoritmo de rutina (A, B) y un algoritmo con bordes más realzados (C, D) especializado en la evaluación de stents y segmentos con calcificación densa de arterias coronarias. La imagen de la arteria coronaria derecha como reconstrucción multiplanar curvada (A, C) muestra dos stents de arteria coronaria en la arteria coronaria derecha distal. Las reconstrucciones multiplanares oblicuas, perpendiculares a la línea central del vaso (B, D) se reconstruyen a la altura del stent distal. El stent proximal (flecha abierta en A y C) se puede evaluar fácilmente con ambas técnicas de reconstrucción, debido a la estructura filamentosa de su soporte.
Los soportes estructurales más densos del stent metálico más distal sin recubrir (flecha en A y C) provocan artefactos de endurecimiento excesivos en la reconstrucción de rutina (A, B), de modo que la luz permeable y las áreas de hiperplasia de la íntima, presentes como áreas hipoatenuadas en el interior del stent (flecha en D) sólo se pueden apreciar usando el algoritmo de reconstrucción especializado (C, D).
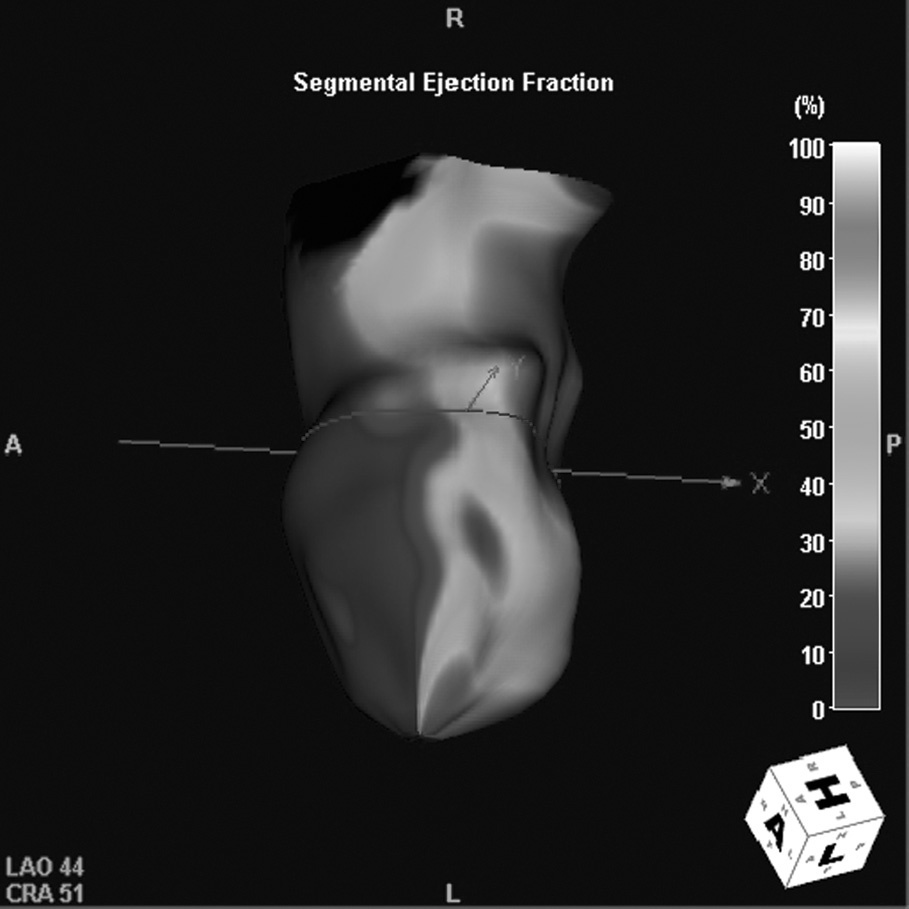
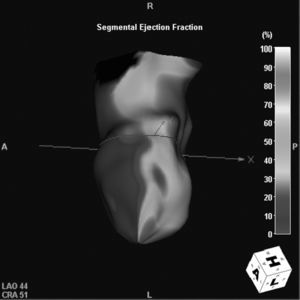
Fig. 15. Angiografía por tomografía computarizada de doble fuente con sincronización electrocardiográfica retrospectiva y administración de contraste en un hombre de 69 años, después de infarto de la arteria coronaria descendente anterior izquierda (DAI). La imagen axial (A) muestra un adelgazamiento del miocardio con calcificación (flecha) de la región perfundida por la DAI, predominantemente en la pared anterior del ventrículo izquierdo. La imagen volumétrica en 3D (B) muestra el alcance total de la calcificación distrófica debida a isquemia crónica. La evaluación de la función cardíaca según los datos de la tomografía computarizada (C) muestra acinesia de la pared anterior, indicada por los colores oscuros fríos del espectro en un modelo funcional del ventrículo izquierdo generado automáticamente.
Interpretación
Presentación de la imagen para detección y clasificación de lesiones
Estrategias diagnósticas. En el corazón, el papel de las técnicas de presentación de las imágenes y de las herramientas de análisis avanzado se considera más importante que en el resto de aplicaciones de la TC. No obstante, no se puede abandonar el examen de las imágenes fuente originales que deben siempre formar parte del proceso diagnóstico. Estas imágenes transversales contienen una información muy importante relativa a hallazgos incidentales del mediastino, artefactos (fig. 11) y la afectación global de placas ateroscleróticas dentro del árbol coronario. Cada paso de pos-procesado reduce forzosa e intencionadamente la información disponible en aras de una visualización de imágenes más intuitiva.
Según la indicación concreta para realizar una TC cardíaca, usamos estrategias ligeramente diferentes en nuestro enfoque diagnóstico. Cuando se evalúan by-pass llevados a cabo con injertos de las venas auricular izquierda y pulmonar en el marco de una terapia de resección para arritmia cardíaca, se usa una reconstrucción 3D para una orientación inicial rápida, por ejemplo, respecto al tipo y curso del by-pass coronario o a la configuración general del retorno venoso pulmonar. Esto se continúa con el examen de las imágenes fuente transversales para la detección y la clasificación de las lesiones del by-pass o la estenosis de la vena pulmonar, así como otros hechos adicionales o alternativos en el tórax. En caso de sospecha de estenosis de arterias coronarias, se examinan primero las imágenes axiales originales para obtener una información general de la presencia, localización y composición (calcificada frente a no calcificada) de las lesiones ateroscleróticas22, así como de las consecuencias de la enfermedad isquémica, tales como déficit de la perfusión miocárdica o cicatrización (fig. 15). Una vez que se han detectado las lesiones, se evalúa la gravedad de la estenosis utilizando sencillas herramientas de visualización que permiten un análisis más sencillo de la gran cantidad de datos del estudio. Las reconstrucciones multiplanares (RMP, véase más adelante) son herramientas básicas fáciles de usar que existen en la mayoría de los escáneres TCMD. Para una mejor detección y clasificación de las lesiones de las arterias coronarias empleamos herramientas de visualización y análisis especializadas (véase más adelante) para interpretar los estudios realizados por sospecha de coronariopatía estenosante. A diferencia de lo que ocurre con la evaluación del by-pass coronario (fig. 3) y de venas pulmonares, la realización de imágenes volumétricas 3D por sospecha de arteriopatía corote;n ocultas o son sobrevaloradas, dependiendo de los parámetros de la representación. En nuestro centro, la representación en 3D se usa exclusivamente para la comunicación intuitiva de nuestros resultados a los médicos y pacientes correspondientes.
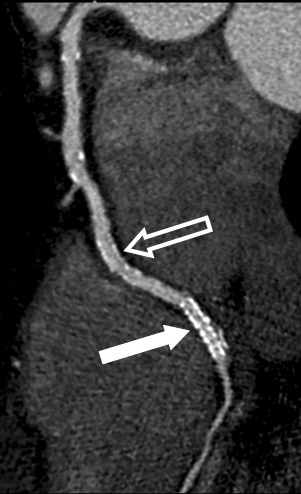
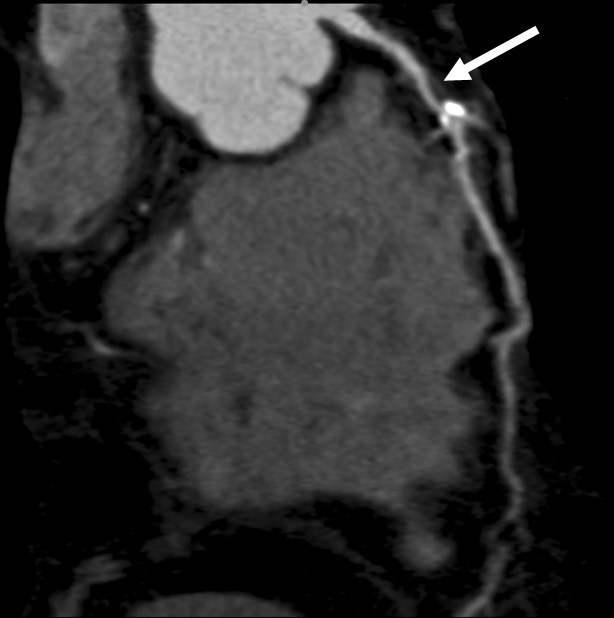
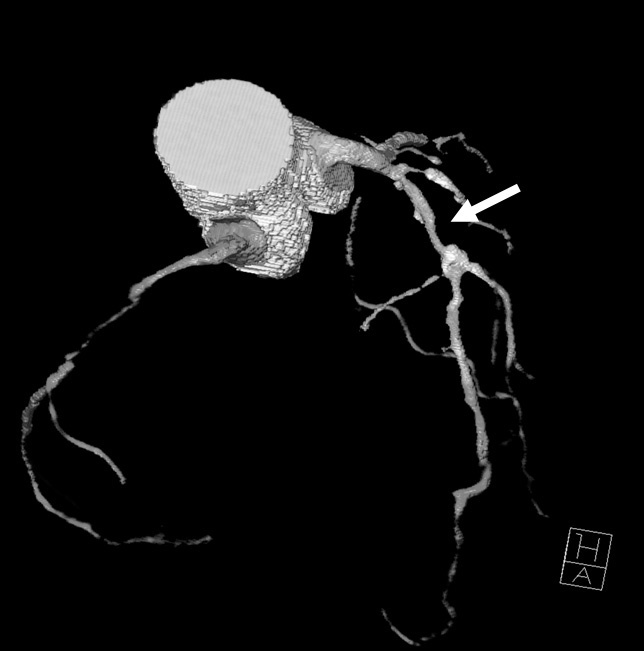
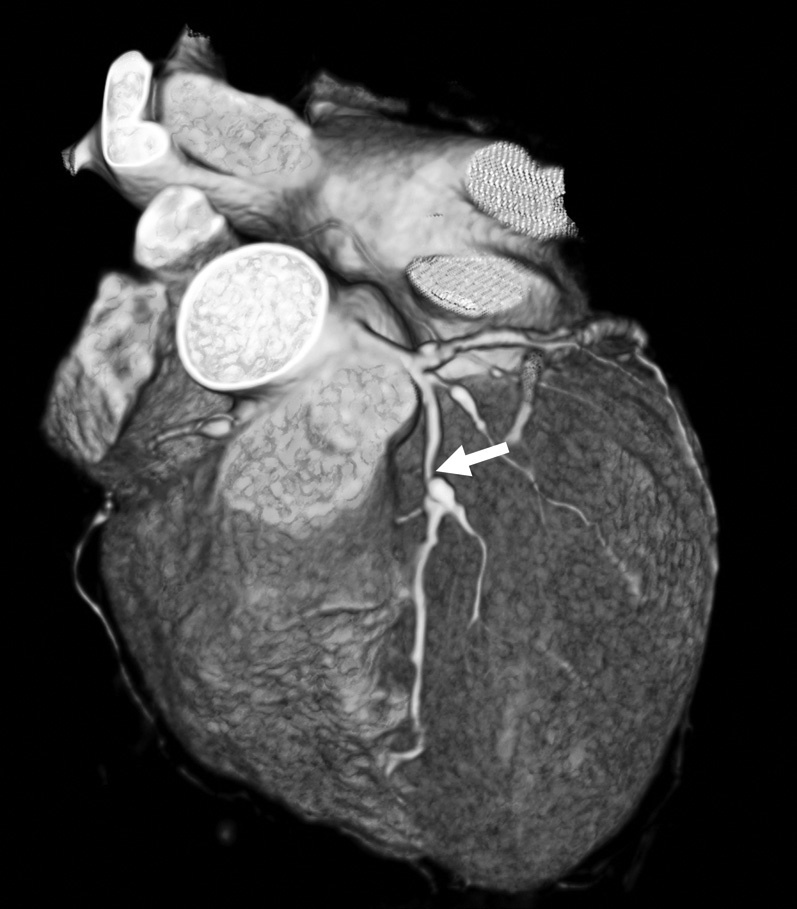
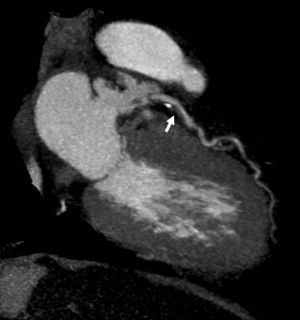
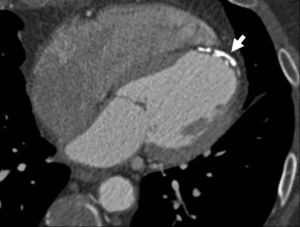
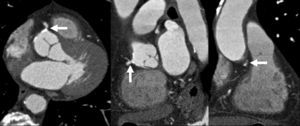
Reconstrucciones multiplanares. Las RMP se utilizan ampliamente en la valoración del árbol coronario mediante angio-TC23. Debido a la naturaleza isotrópica (iguales dimensiones de vóxel en los ejes X, Y, Z) o casi isotrópica de las adquisiciones con TCMD de alta resolución, los datos de las imágenes se pueden reorganizar en planos de imágenes arbitrarios con una calidad semejante a la de la sección transversal original. Las RMP sirven para hacer posibles visualizaciones de lesiones de arterias coronarias desde diferentes ángulos y perspectivas, lo que permite una mejor evaluación de la gravedad de la estenosis y la luz vascular residual de lo que podría apreciarse con una sola proyección. Esto tiene especial importancia cuando existen calcificaciones graves, donde una única visualización a menudo no consigue mostrar el lumen residual en las cercanías de una placa muy calcificada (fig. 16).
Fig. 16. Angiografía por tomografía computarizada de doble fuente con sincronización electrocardiográfica retrospectiva y administración de contraste en una mujer de 72 años, con dolor torácico atípico (misma paciente de la figura 13). Las imágenes fuente axiales (izquierda en A) y la reconstrucción multiplanar (RMP) sagital (centro en A) demuestran claramente una estenosis moderada del ostium (flecha) de la arteria coronaria derecha, adyacente a calcificaciones densas del seno coronario derecho de la aorta. La lesión es más difícil de detectar en la reconstrucción coronal (derecha en A). La RMP curvada generada automáticamente (B) es mejor para la detección y clasificación de la estenosis, mientras que la presentación volumétrica en 3D (C) no logra mostrar todo el alcance de la lesión.
Herramientas de visualización avanzada. Se han desarrollado herramientas de software avanzadas que se están perfeccionando continuamente y facilitan la visualización y el análisis de grandes series de datos volumétricos. La justificación usual de la mayoría de estas plataformas informáticas es proporcionar un medio de análisis rápido del árbol arterial coronario para la detección y la clasificación de las estenosis. Normalmente el primer paso del pos-procesado después del examen de las secciones transversales y las RMP consiste en la eliminación automática de la pared torácica de modo que sea posible una visualización perfecta del corazón (fig. 17A). A continuación se extraen las arterias coronarias contrastadas mediante segmentación por umbralización o por contornos (fig. 17B). La mayoría de las aplicaciones de software permiten desenmarañar el curso tortuoso de la arteria coronaria extraída, lo que proporciona una visualización intuitiva del vaso completo, normalmente como una RMP generada automáticamente (fig. 17C).
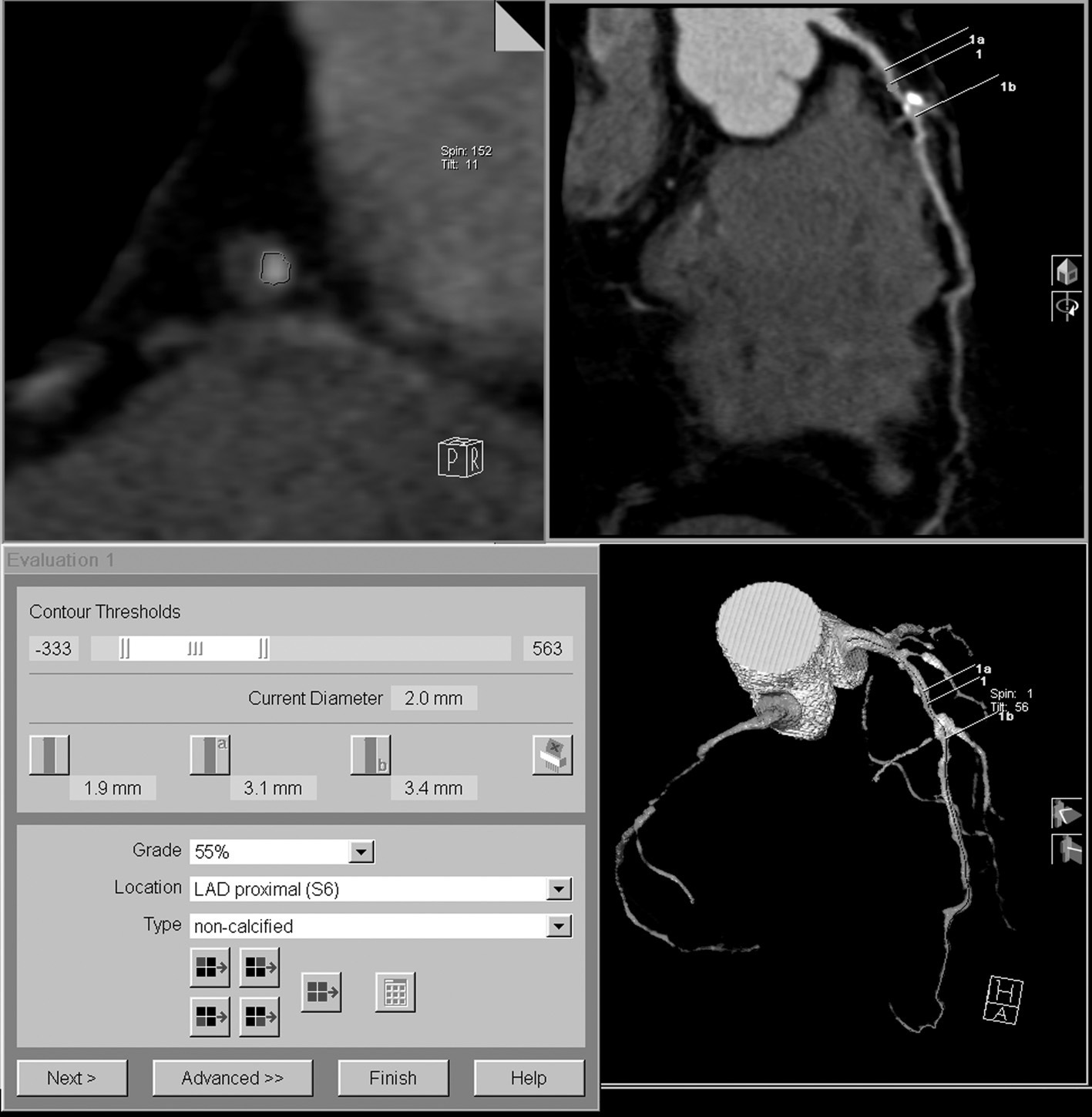
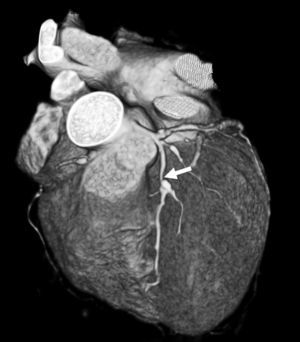
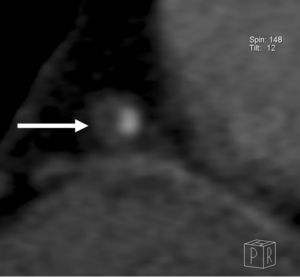
Fig. 17. Angiografía por tomografía computarizada coronaria de 64 cortes con sincronización electrocardiográfica retrospectiva y administración de contraste en un hombre de 59 años con dolor torácico atípico. Se ilustra el procedimiento de análisis utilizando plataformas de visualización especializadas. Es difícil la detección de una estenosis severa en un segmento corto de la arteria coronaria descendente anterior izquierda (DAI) proximal (flecha) en las reconstrucciones multiplanares transversales, sagitales o coronales (A). El procesado posterior consiste en la eliminación automática de la pared torácica, que permite una visualización del corazón, mostrado como presentación volumétrica, sin superposición de otras estructuras (B). Se realiza la extracción automática de las arterias coronarias de la serie de datos realzados con contraste (C).
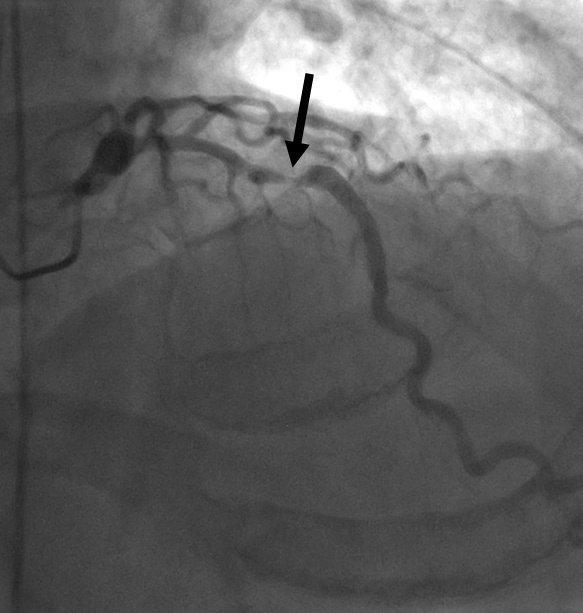
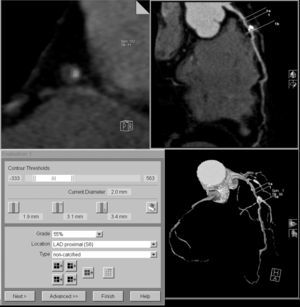
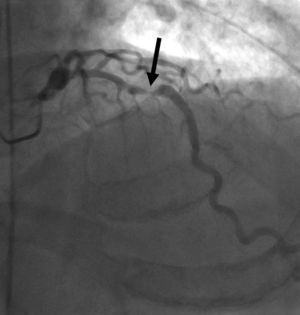
La arteria coronaria extraída se muestra como una reconstrucción multiplanar generada automáticamente (D), lo que proporciona una visualización intuitiva de todo el vaso y la lesión. La evaluación automática de la gravedad de la estenosis (E) al nivel de la lesión muestra una obstrucción luminal del 78% del diámetro. Posteriormente, la angiografía por catéter (F) confirma el sitio y la gravedad de la lesión de la DAI (flecha).
La definición de la línea central del vaso permite la reconstrucción de secciones en planos ortogonales al eje del vaso, lo que facilita la evaluación de la localización y la morfología del componente no calcificado de la placa (fig. 17D). Por último, las plataformas de software más asequibles facilitan herramientas para la evaluación cuantitativa de la gravedad de la estenosis (fig. 17E) basadas en medidas representativas del diámetro o el área de los vasos. Por su naturaleza, la exactitud de estas herramientas para la clasificación de la estenosis está directamente relacionada con la calidad y la resolución espacial de la imagen adquirida y sujeta a las limitaciones intrínsecas de la angio-TC para evaluar la gravedad de la estenosis. Por lo tanto, como ocurre con cualquier evaluación automática en medicina, no se debe confiar ciegamente en los resultados de la medición de las herramientas de análisis de vasos, sino que siguen siendo necesarias la experiencia y la perspicacia del médico para validar los resultados en el marco clínico apropiado.
El informe
Para presentar los resultados de la angio-TC coronaria empleamos una plantilla normalizada. Con la excepción de un comentario más detallado de las arterias coronarias y de otras estructuras cardíacas, nuestros informes de angio-TC coronaria no son básicamente diferentes de los informes de Radiología general e incluyen toda la patología, las variaciones y los cambios que sean visibles en las diferentes series de reconstrucción. En la sección "Procedimiento" o "Técnica de estudio" incluimos los elementos pertinentes para una facturación adecuada en nuestro entorno específico. Estos elementos pueden ser diferentes en otras regiones geográficas, pero por lo general incluyen el espesor de la sección, el uso de sincronización electrocardiográfica retrospectiva, el volumen de contraste y la velocidad de inyección, los medicamentos empleados y los métodos de pos-procesado utilizados, como las RMP o en 3D. En la sección "Resultados" empezamos describiendo la anatomía general del corazón y los grandes vasos, con comentarios sobre el miocardio (grosor, áreas de infarto, cicatrices, etc.), las cámaras cardíacas, las válvulas, el pericardio, las venas pulmonares, las arterias pulmonares y la aorta. Se dedica un apartado a los resultados incidentales de la pared torácica, el mediastino y los pulmones, por ejemplo la descripción y la clasificación de nódulos pulmonares, incluyendo recomendaciones de seguimiento acordes con la práctica clínica estándar24. En la sección cardíaca describimos la presencia y la localización de dispositivos cardíacos, catéteres, etc. Cuando existen by-pass coronarios describimos el tipo, el origen, el curso, el sitio de anastomosis, el aspecto, la localización y el grado de estenosis del injerto, así como la calidad de los vasos distales a la anastomosis del by-pass. Se indica también la presencia y el curso de las arterias coronarias anómalas, así como el tipo de suministro coronario (con dominancia derecha, izquierda o conjunta). Por último, se comenta por separado cada arteria coronaria (principal izquierda, DAI, circunfleja, ACD) con respecto a la presencia, el número y el tipo de placas ateroscleróticas (calcificada frente a no calcificada). Para describir el sitio de la estenosis, el uso del modelo segmentario de la American Health Asociation/American College of Cardiology, ampliamente utilizado con fines de investigación, ha resultado menos útil para la interpretación clínica de rutina. En su lugar utilizamos la terminología normal de los informes angiográficos estándares, que describe las lesiones como localizadas en la porción proximal, media o distal de las correspondientes arterias coronarias principales o sus ramas laterales (DAI: diagonales y septales; circunfleja: marginales obtusas; ACD: marginales agudas). Empleamos nuestros métodos de visualización (véase más arriba) para determinar tanto la gravedad de la estenosis como el porcentaje de obstrucción luminal, basándonos en medidas representativas del diámetro o el área de los vasos.
AUTOEVALUACIÓN
1. La tomografía computarizada cardíaca está más indicada en:
a) Una mujer de 31 años que toma anticonceptivos orales y presenta disnea aguda.
b) Un varón de 48 años con síndrome metabólico, pruebas de laboratorio negativas, electrocardiograma normal y opresión torácica.
c) Un varón de 78 años con enfermedad coronaria conocida y aumento del dolor torácico.
d) Una mujer de 62 años con dolor torácico agudo, ligera elevación del ST y troponina negativa.
e) El screening de la enfermedad coronaria.
2. En la tomografía computarizada cardíaca se utiliza un factor de paso bajo debido a que:
a) El área de estudio tiene una extensión craneocaudal pequeña.
b) La frecuencia cardíaca puede variar durante la adquisición.
c) Se emplea una velocidad lenta de rotación del tubo.
d) La sincronización retrospectiva y el solapamiento de las reconstrucciones requieren un factor de paso bajo.
e) Permite el solapamiento de imágenes en la reconstrucción con un pequeño incremento.
3. Respecto a los bloqueantes beta, ¿qué respuesta es la correcta?
a) Los bloqueantes beta deberían emplearse siempre.
b) Los bloqueantes beta deberían emplearse siempre en los estudios con tomografía computarizada de doble fuente (TCDF).
c) Los bloqueantes beta deberían emplearse siempre en los estudios con tomografía computarizada multidetector (TCMD) ¾ 64 cortes.
d) Los bloqueantes beta deberían emplearse siempre en los estudios con TCMD ¾ 64 cortes si no existe contraindicación y la frecuencia cardíaca es > 65 latidos por minuto.
e) Los bloqueantes beta disminuyen la dosis de radiación en la TCDF.
4. Respecto al electrocardiograma por pulsos en la TCMD de 64 cortes o menos:
a) Debería emplearse sólo en pacientes con frecuencias cardíacas lentas y estables.
b) Es más eficaz con frecuencias cardíacas rápidas.
c) Permite la obtención de las reconstrucciones sólo en la diástole.
d) Debería emplearse sólo en pacientes jóvenes.
e) No debería usarse en pacientes obesos.
5. Con respecto a la inyección con material de contraste para la angiografía por tomografía computarizada (angio-TC) coronaria:
a) Lo más adecuado es realizarla a través de una vía venosa antecubital empleando una concentración alta de medio de contraste.
b) Se recomienda la inyección directa en la vena cava superior.
c) El ritmo de inyección debe ajustarse a la frecuencia cardíaca del paciente.
d) El tiempo de inyección es menor que el intervalo de adquisición.
e) Es preferible el uso de ritmos de inyección lentos.
6. La técnica de empuje con solución salina:
a) Reduce los artefactos por endurecimiento del haz.
b) Ahorra contraste.
c) Mantiene compacto el bolo de contraste.
d) Todos los anteriores.
e) Ninguno de los anteriores.
7. Respecto a la reconstrucción de imágenes:
a) El espesor de la sección de reconstrucción debería ser idéntico a la colimación.
b) El espesor de la sección de reconstrucción debería ser ligeramente mayor que la colimación.
c) El espesor de la sección de reconstrucción debería ser ligeramente menor que la colimación.
d) El espesor de la sección de reconstrucción debería ser idéntico al incremento de reconstrucción.
e) Es independiente de la colimación.
8. En pacientes con stent coronario, la reconstrucción de las imágenes:
a) Debería realizarse con un kernel muy suave.
b) Debería realizarse con un kernel cuya resolución espacial sea ligeramente superior a la de los kernels habituales.
c) Debería realizarse con un kernel de pulmón.
d) Permite la obtención de estudios diagnósticos para la valoración de la hiperplasia intimal y la reestenosis endoluminal del stent.
e) No es necesaria.
9. En el paciente de la figura 16, ¿cuál es la causa más probable de que no se visualizara ninguna estenosis en el cateterismo coronario?
a) El paciente no tiene una estenosis significativa.
b) El catéter se colocó en la porción proximal de la arteria coronaria derecha previo a la inyección del contraste.
c) La angio-TC coronaria es de insuficiente calidad.
d) La angio-TC coronaria es una técnica más sensible que el cateterismo coronario.
e) El cardiólogo que realizó el cateterismo era corto de vista.
10. El análisis de las imágenes de la angio-TC coronaria debe basarse principalmente en:
a) Las imágenes 3D.
b) Las reconstrucciones multiplanares curvas.
c) Las imágenes fuente en el plano axial.
d) Las proyecciones de máxima intensidad gruesas.
e) Cualquiera de ellas, indistintamente.