Evaluar los resultados de la cirugía radioguiada mediante semillas de 125I como alternativa al arpón quirúrgico en pacientes con lesiones no palpables malignas de mama.
Material y métodosSe incluyeron pacientes con diagnóstico anatomopatológico de cáncer de mama, con lesiones no palpables, candidatas a tratamiento quirúrgico durante 2015-2016. Las pacientes fueron asignadas de manera aleatoria al marcaje prequirúrgico con arpón metálico (grupo A) o con semilla (grupo B). En ambos grupos, el procedimiento fue guiado mediante ecografía y/o mamografía en función de las características de la lesión radiológica. Durante la cirugía se utilizó una sonda gammadetectora y, posteriormente, se comprobó mediante radiología la presencia de las semillas en las piezas quirúrgicas. Se realizó el análisis histológico de las piezas, considerando márgenes libres la ausencia de tumor en la tinta. Las variables analizadas fueron la edad de las pacientes y varias características de la lesión (lateralidad, tamaño medido por resonancia magnética y en la pieza quirúrgica, tipo radiológico y presencia de márgenes quirúrgicos libres).
ResultadosEn el grupo A (n=53), los subtipos histológicos más frecuentes fueron el carcinoma ductal infiltrante (CDI, 84,9%) y el luminal A (LA, 49,1%); el tamaño medio lesional (TML=1,8cm). En el grupo B (n=45), los resultados fueron CDI=82,2%, LA=46,5%, TML=1,5 cm. En el grupo A, la tasa de márgenes afectados fue del 13,2% y la tasa de reintervenciones, de un 13,2% (p=0,7), y en el grupo B, la tasa de márgenes afectados fue 11,4% y la tasa de reintervenciones, del 7,5% (p=0,5). Los volúmenes de las piezas quirúrgicas fueron significativamente menores en el grupo B (V=128,68 cm3) que en el grupo A (V=189,37 cm3) (p <0,05).
ConclusionesLa utilización de semillas de 125I se ha mostrado como una técnica factible en la localización de lesiones no palpables de mama, mostrando diferencias significativas en el tamaño de las piezas quirúrgicas respecto al arpón.
To assess the usefulness of iodine-125 (125I) seeds as an alternative to surgical clips for marking the location of nonpalpable malignant breast lesions for surgery.
Material and methodsWe included patients with histologically confirmed nonpalpable malignant lesions treated by surgery in 2015 or 2016. Patients were randomly assigned to presurgical marking with metallic clips (Group A) or with 125I seeds (Group B). In both groups, marking was guided by ultrasound and/or mammography depending on the radiologic characteristics of the lesion. During surgery, a gamma probe was used and afterward the presence of seeds in the surgical specimen was checked radiologically. In the histological analysis, the absence of tumor in the stain was considered free margins. We analyzed the following variables: age, lesion characteristics (laterality, mean size on MRI and in the surgical specimen, radiological type), and presence/absence of free margins.
ResultsIn Group A (n=53), the most common histologic subtypes were infiltrating ductal carcinoma (IDC, 84.9%) and luminal A (LA, 49.1%); the mean size of the lesions was 1.8cm. In Group B (n=45), the most common histologic subtypes were IDC (82.2%) and LA (46.5%); the mean size of the lesions was 1.5cm.
In Group A, 13.2% had involved margins and 13.2% underwent a second surgical intervention. In Group, B 11.4% had involved margins and 7.5% underwent a second surgical intervention. The differences between groups were not significant (p=0.7 for involved margins and p=0.5 for reintervention). The volume of the surgical specimens was significantly lower in Group B than in Group A (128.68cm3 vs. 189.37cm3; p<0.05).
ConclusionsUsing 125I seeds was feasible and enabled significantly smaller surgical specimens than using metallic clips.
En los últimos años se ha producido un aumento en la incidencia de lesiones no palpables malignas de mama, debido a la implantación del programa de detección precoz del cáncer de mama, así como al perfeccionamiento de las técnicas de diagnóstico por imagen (mamografía digital, tomosíntesis, ecografía con transductores de alta frecuencia, resonancia magnética de mama, etc.). Ello ha supuesto un aumento en el número de tumorectomías, que precisan de una localización prequirúrgica de la lesión con el fin de realizar una cirugía conservadora1–4.
En nuestro hospital, la técnica de marcaje prequirúrgico empleada tradicionalmente ha sido el arpón metálico5, que se coloca el día de la intervención, utilizando como guía la mamografía o la ecografía. Este método no está exento de inconvenientes, entre los que destacan el desplazamiento del arpón antes de la intervención quirúrgica6 y el hecho de que el punto de entrada en la piel elegido por el radiólogo para marcar la lesión no siempre coincide con la incisión cutánea ideal para el cirujano siguiendo criterios estéticos y de proximidad. No obstante, el principal inconveniente del marcaje prequirúrgico con arpón metálico es la alta tasa de resecciones incompletas de las lesiones no palpables con márgenes afectados, que requieren una ampliación intraoperatoria e incluso una nueva intervención en algunos casos1,7.
Como alternativa al arpón metálico, y en un intento por mejorar el resultado quirúrgico en estas pacientes, surge la cirugía radioguiada mediante semillas de 125I, que consiste en la utilización de semillas de titanio marcadas con 125I como guía para la localización prequirúrgica de lesiones no palpables de mama.
Las semillas de 125I son un tipo de radiotrazador que no migra a vía linfática, al igual que los macroagregados de albúmina empleados en la técnica ROLL (localización y extirpación radioguiada de lesiones ocultas de mama), con la ventaja de que, al utilizar las semillas como radiotrazador, se puede comprobar su correcta localización con una mamografía, al ser radiopacas.
El objetivo de nuestro trabajo es evaluar los resultados del marcaje prequirúrgico de lesiones malignas no palpables de mama con semillas de 125I, comparándolos con los obtenidos mediante arpón quirúrgico.
Material y métodosSe realizó un estudio longitudinal prospectivo en el que se incluyeron pacientes con lesiones no palpables y diagnóstico anatomopatológico de cáncer de mama, candidatas a tratamiento quirúrgico conservador, en el período comprendido entre los años 2015 y 2016.
Las pacientes fueron informadas del procedimiento y firmaron el consentimiento informado. El estudio fue aprobado por el Comité de Ética de nuestro hospital de acuerdo con la declaración de Helsinki y tenía las licencias pertinentes del Consejo de sustancias radioactivas.
La patología mamaria en nuestro centro se interviene en el servicio de ginecología. En este estudio participaron un total de 4 ginecólogos con 30, 19, 11 y 6 años de experiencia, respectivamente; 3 radiólogos con 23, 11 y 9 años de experiencia, respectivamente; y 2 médicos nucleares, con 30 y 9 años de experiencia, respectivamente.
Las primeras 53 pacientes fueron sometidas a marcaje prequirúrgico con arpón metálico, antes de la introducción de la cirugía radioguiada con semilla con 125I, y conformaron el grupo de control (grupo A) para comparar con las primeras 45 pacientes en las que se empleó el marcaje prequirúrgico con semilla (grupo B).
Los criterios de inclusión fueron pacientes con diagnóstico histológico de cáncer de mama que presentaban lesiones no palpables en el momento del diagnóstico o tras el tratamiento con quimioterapia neoadyuvante, candidatas a cirugía conservadora por decisión del Comité multidisciplinar de mama.
Los criterios de exclusión para ambos grupos fueron idénticos para evitar sesgos, e incluyeron: edad menor de 18 años, lesiones palpables, lesiones extensas no palpables cuyo marcaje requería más de un arpón metálico o semilla, y pacientes con carcinoma preinvasivo sin componente infiltrante.
Las variables incluidas en el estudio fueron la edad, la lateralidad de la lesión (mama derecha o izquierda), el tamaño de la lesión radiológica obtenida en resonancia magnética de estadificación o de reevaluación tras quimioterapia neoadyuvante, el tipo de lesión radiológica visualizada en mamografía y/o ecografía (nódulo, distorsión, microcalcificaciones, densidad focal asimétrica, etc.), el tipo histológico y subtipo molecular, los tamaños tanto de la lesión tumoral como de la pieza quirúrgica determinados por anatomía patológica y los márgenes quirúrgicos libres, considerando como tales la ausencia de tumor en la tinta.
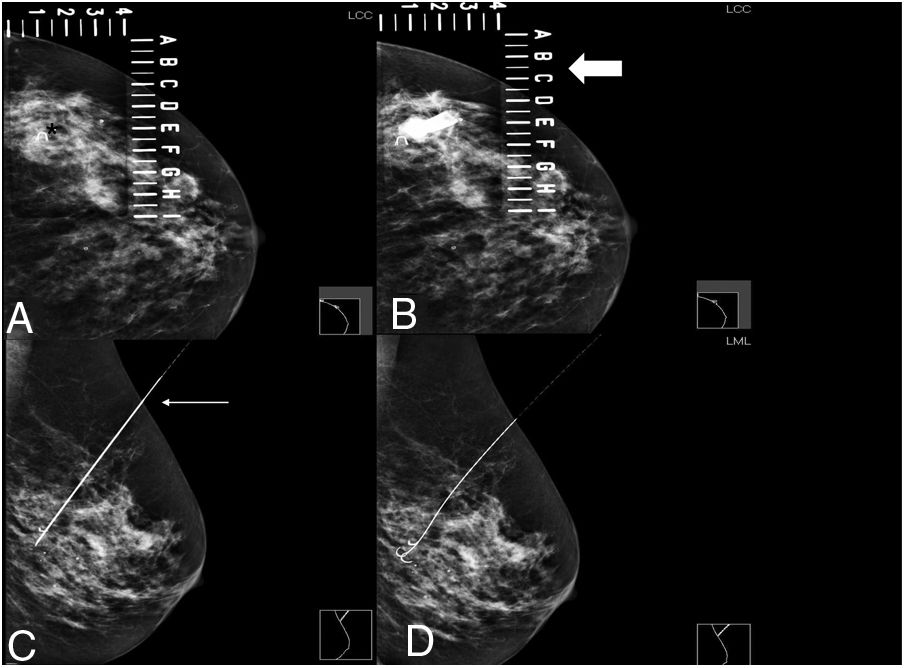
En las pacientes en las que se empleó como guía el arpón metálico, este se colocó el mismo día de la cirugía mediante el procedimiento habitual con guía mamográfica o ecográfica, especificando en el informe radiológico la distancia que sobrepasaba el extremo distal del arpón del borde de la lesión. La guía ecográfica se utilizó siempre que la lesión fuese visible mediante esta técnica. En caso contrario (respuesta radiológica completa tras la neoadyuvancia en lesión previamente marcada, microcalcificaciones con componente infiltrante o densidad asimétrica focal, sin traducción ecográfica) se utilizó la guía mamográfica. Su correcta localización se comprobó mediante mamografía (figs. 1 y 2).
Localización prequirúrgica con arpón metálico de lesión BIRADS 6 con respuesta radiológica completa, marcada al inicio del tratamiento
A. Proyección craneocaudal de MI, para localizar el marcador metálico (asterisco) dentro de la placa fenestrada
B. Introducción del arpón metálico en las coordenadas establecidas en la placa fenestrada (fecha gruesa) donde se localiza el marcador
C. Proyección lateral de mama izquierda: para comprobar que el marcador ha sido atravesado por el arpón (flecha fina) y la profundidad a la que se encuentra
D. Proyección lateral de mama izquierda: apertura del arpón correctamente posicionado, atravesando el marcador metálico.
En las pacientes en las que se realizó el marcaje prequirúrgico mediante semilla, esta pudo ser colocada hasta una semana antes de la cirugía.
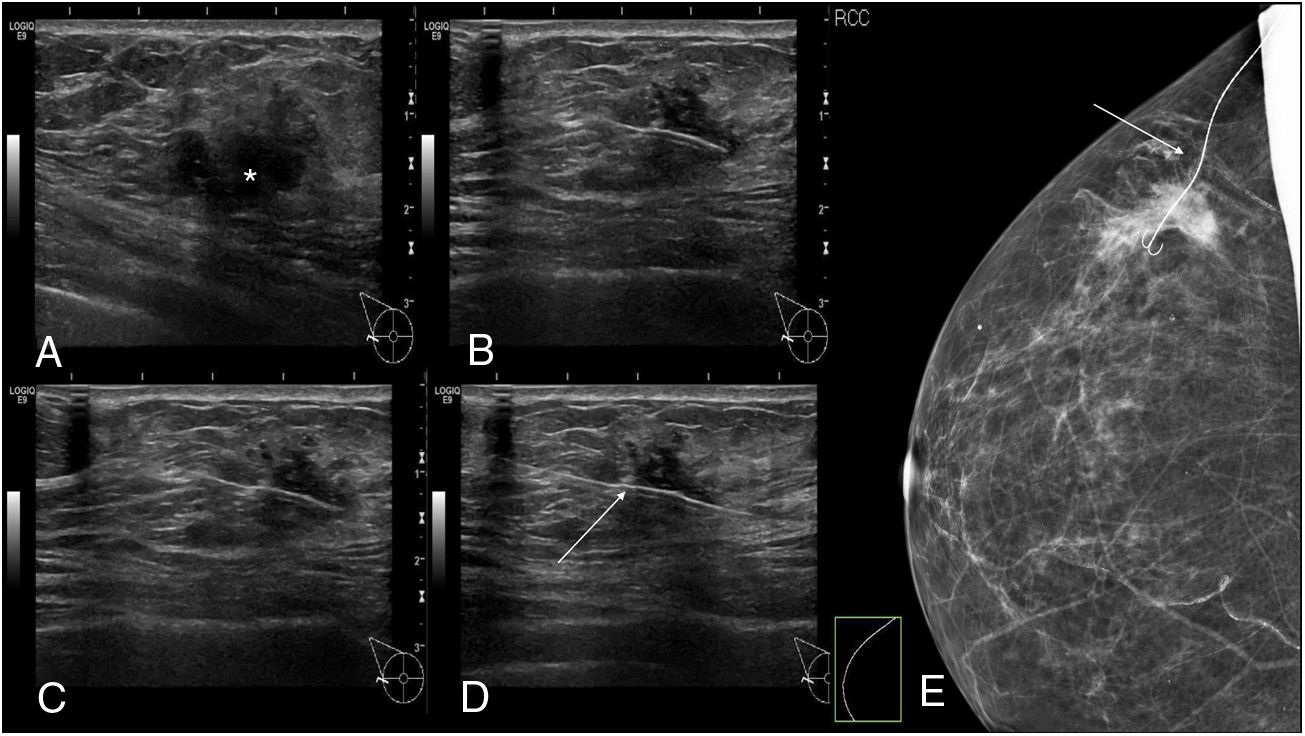
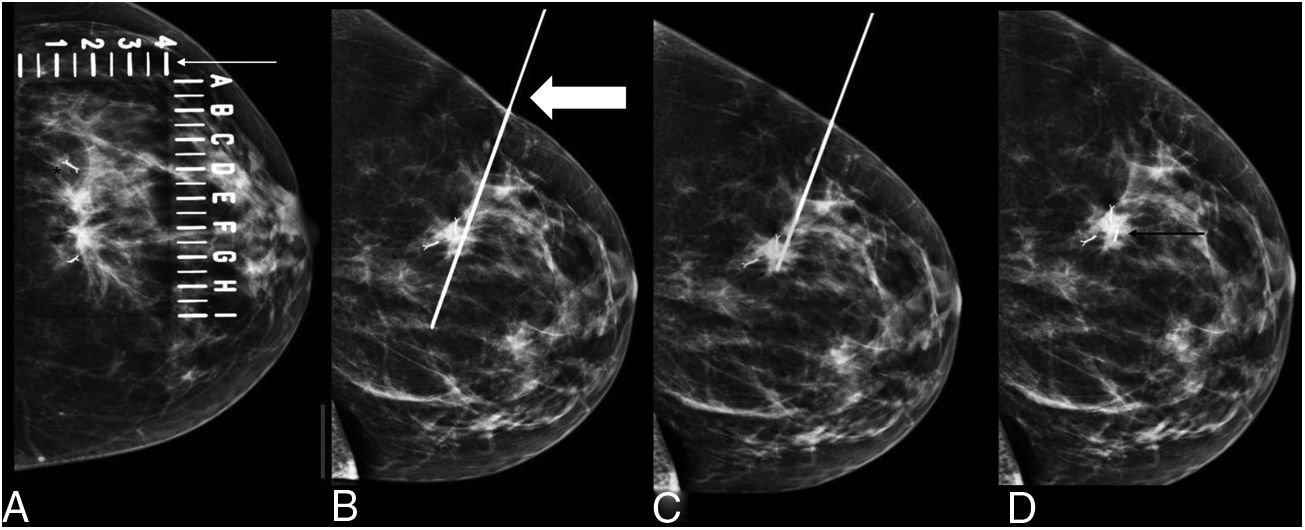
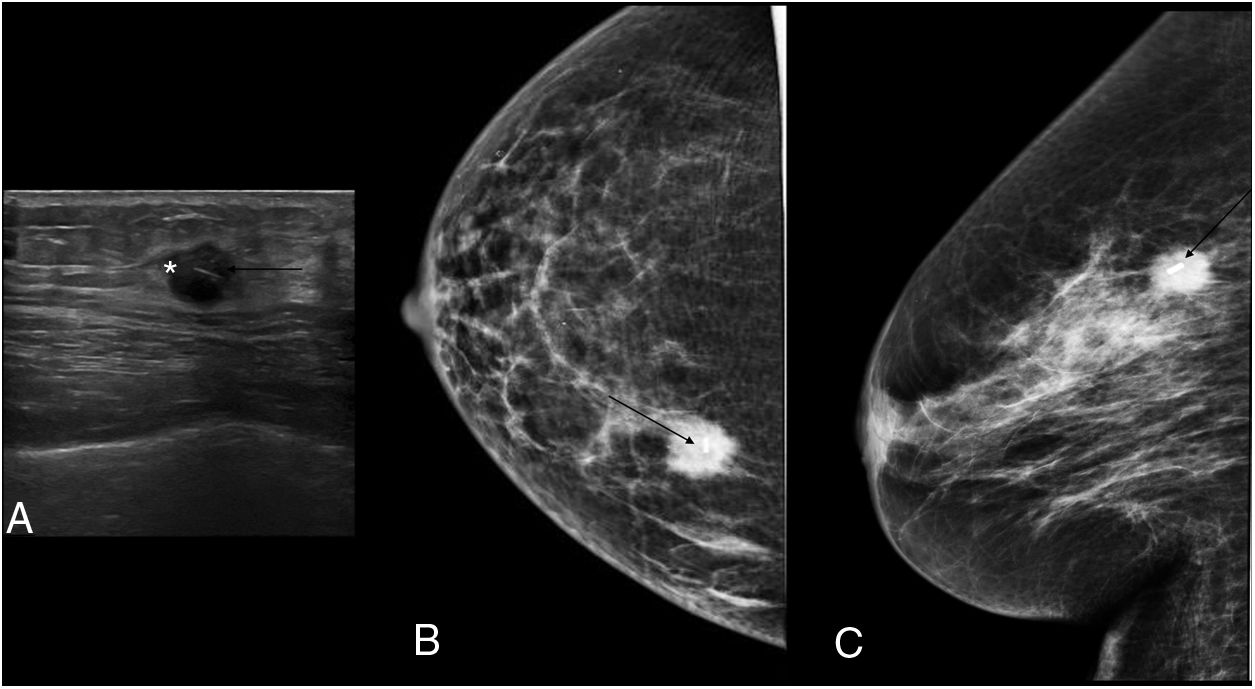
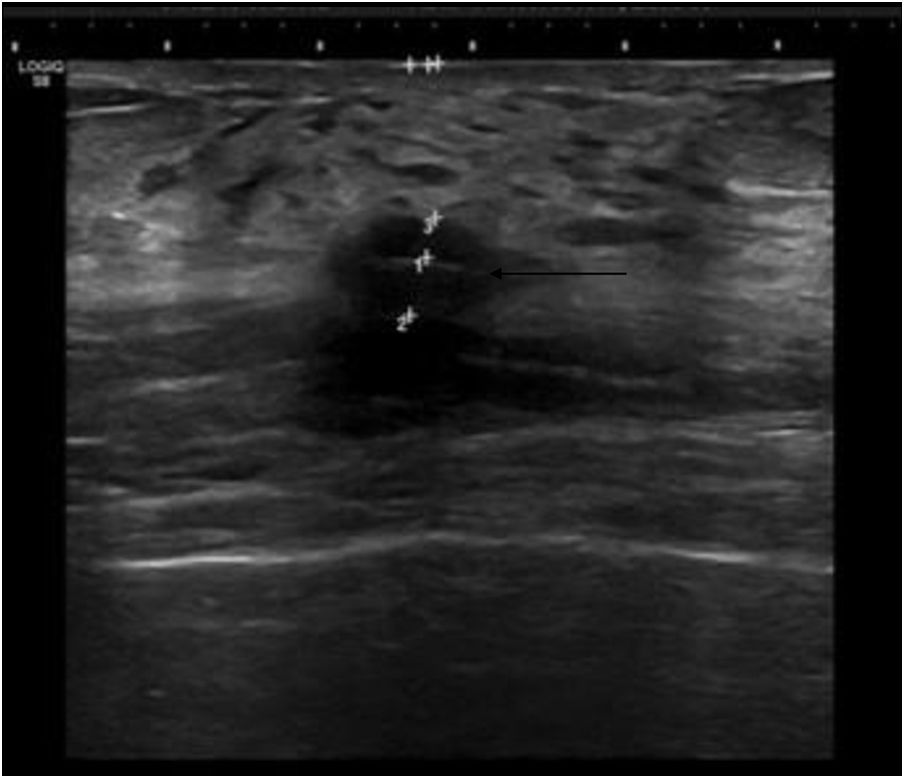
El procedimiento para la implantación de la semilla consistió en la localización de la lesión mediante mamografía (fig. 3) o ecografía (fig. 4), la administración de anestesia local y la introducción de la semilla a través de una aguja biselada de 18 G correctamente sellada con cera de hueso en su punta para impedir la salida de la semilla (fig. 5). En el informe radiológico se especificaron una serie de mediciones, como la distancia de la semilla a la piel y a los bordes anterior y posterior de la lesión, para una adecuada planificación de la cirugía (fig. 6).
Localización prequirúrgica con semilla guiada con mamografía de lesión maligna, marcada con dos marcadores, con respuesta radiológica parcial mayor, persistiendo una distorsión en el parénquima mamario en mama derecha. Se decidió localización prequirúrgica con semilla entre los dos marcadores. A) Guía con mamografía con placa fenestrada (flecha blanca fina) para localización del marcador (asterisco negro). B) Introducción de aguja de 18 G (flecha blanca gruesa) cargada con la semilla en proyección craneocaudal. C) Localización de la profundidad en proyección lateral y comprobación de que estamos en el sitio deseado, en nuestro caso entre los dos marcadores. D) Depositamos la semilla (flecha negra fina).
Una vez en el quirófano se utilizó una sonda gammadetectora con un pico de actividad centrado en 27 KeV (125I), que sirvió como guía al cirujano para extirpar la lesión en función de criterios estéticos.
Una vez extraída la lesión, se comprobó la presencia de la semilla en la pieza quirúrgica mediante visualización directa en el quirófano y mamografía (fig. 7).
Finalmente, las semillas fueron recuperadas por el servicio de medicina nuclear, que procedió a su correcta eliminación.
El análisis estadístico de los datos se realizó con el software IBM SPSS Statistics versión 19 para Windows. Las variables numéricas se describieron como media y desviación típica, o mediana y percentiles en los casos de no normalidad; y las variables cualitativas como frecuencias absolutas y relativas (número y porcentaje). Para comparar las variables entre los grupos A y B, se realizó un análisis bivariante, aplicando para las variables numéricas la prueba de la t de Student o Mann-Whitney en los casos no paramétricos. La normalidad de los datos se contrastó con el test de Kolmogorov-Smirnov. Para las variables cualitativas se utilizaron la prueba de la χ2 de Pearson o la prueba exacta de Fisher. Se consideró significativo un valor de p <0,05.
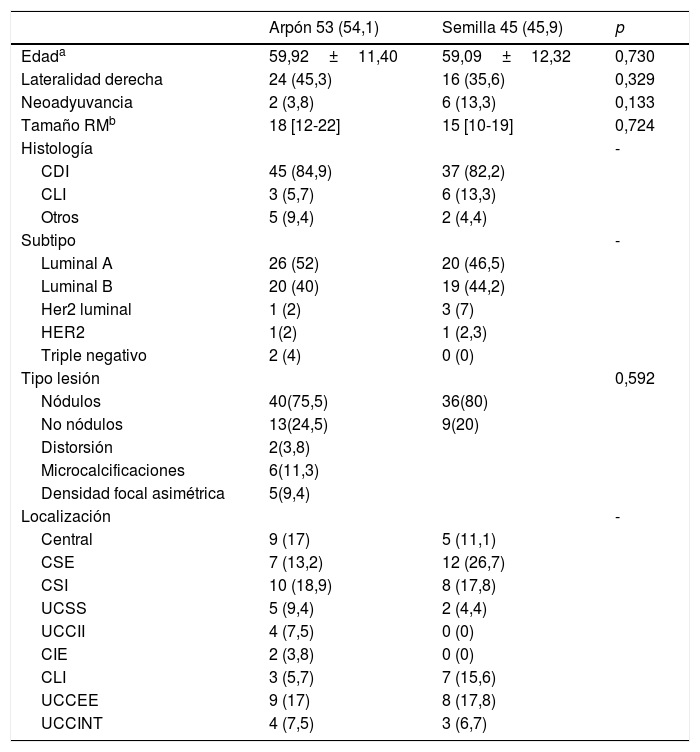
ResultadosEn el estudio se incluyó un total de 98 pacientes, de las cuales 53 pertenecieron al grupo A y 45 al grupo B. La edad media en ambos grupos fue de 59 años (grupo A: 59,9±11,4 años; grupo B: 59,1±12,3 años; p=0,73).
El tipo de lesión radiológica más frecuente en ambos grupos fue el nódulo, con un tamaño medio determinado por resonancia magnética de 18mm (grupo A) y 15mm (grupo B).
El tipo histológico más frecuente de las lesiones mamarias fue el carcinoma ductal infiltrante (grupo A: 84,9%; grupo B: 82,2%) y el subtipo molecular, el luminal A (grupo A: 52%; grupo B: 46,5%). En todas estas variables no se encontraron diferencias estadísticamente significativas (tabla 1).
Arpón quirúrgico vs. semilla de iodo (125I) en la localización de lesiones no palpables malignas de mama, resultados preliminares
| Arpón 53 (54,1) | Semilla 45 (45,9) | p | |
|---|---|---|---|
| Edada | 59,92±11,40 | 59,09±12,32 | 0,730 |
| Lateralidad derecha | 24 (45,3) | 16 (35,6) | 0,329 |
| Neoadyuvancia | 2 (3,8) | 6 (13,3) | 0,133 |
| Tamaño RMb | 18 [12-22] | 15 [10-19] | 0,724 |
| Histología | - | ||
| CDI | 45 (84,9) | 37 (82,2) | |
| CLI | 3 (5,7) | 6 (13,3) | |
| Otros | 5 (9,4) | 2 (4,4) | |
| Subtipo | - | ||
| Luminal A | 26 (52) | 20 (46,5) | |
| Luminal B | 20 (40) | 19 (44,2) | |
| Her2 luminal | 1 (2) | 3 (7) | |
| HER2 | 1(2) | 1 (2,3) | |
| Triple negativo | 2 (4) | 0 (0) | |
| Tipo lesión | 0,592 | ||
| Nódulos | 40(75,5) | 36(80) | |
| No nódulos | 13(24,5) | 9(20) | |
| Distorsión | 2(3,8) | ||
| Microcalcificaciones | 6(11,3) | ||
| Densidad focal asimétrica | 5(9,4) | ||
| Localización | - | ||
| Central | 9 (17) | 5 (11,1) | |
| CSE | 7 (13,2) | 12 (26,7) | |
| CSI | 10 (18,9) | 8 (17,8) | |
| UCSS | 5 (9,4) | 2 (4,4) | |
| UCCII | 4 (7,5) | 0 (0) | |
| CIE | 2 (3,8) | 0 (0) | |
| CLI | 3 (5,7) | 7 (15,6) | |
| UCCEE | 9 (17) | 8 (17,8) | |
| UCCINT | 4 (7,5) | 3 (6,7) |
Los números se expresan en n (%).
Mediana±RIC.
CDI: carcinoma ductal infiltrante; CIE: cuadrante inferoexterno; CII: cuadrante inferointerno; CLI: carcinoma lobulillar infiltrante; CSE: cuadrante superoexterno; CSI: cuadrante superointerno; UCCII: unión de cuadrantes inferiores; UCCII: unión de cuadrantes internos; UCEE: unión de cuadrantes externos; UCCINT: Unión de cuadrantes internos; UCSS: unión de cuadrantes superiores.
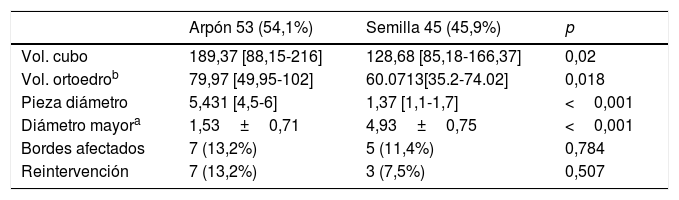
El volumen medio de las piezas obtenidas en ambos grupos presentó diferencias estadísticamente significativas (grupo A: V=189,37 cm3; grupo B: V=128,68 cm3; p <0,05).
La tasa de márgenes afectados en el grupo A fue del 13,2% y en el grupo B fue del 11,4%, si bien no se obtuvo significación estadística (p=0,784).
Fue necesaria la reintervención quirúrgica por márgenes afectados en 7 pacientes del grupo A y en 3 pacientes del grupo B (p=0,507). En la tabla 2 pueden consultarse los valores de estas y otras medidas comparadas en ambos grupos.
Resultados de las medidas obtenidas en el grupo arpón y en el grupo semilla
| Arpón 53 (54,1%) | Semilla 45 (45,9%) | p | |
|---|---|---|---|
| Vol. cubo | 189,37 [88,15-216] | 128,68 [85,18-166,37] | 0,02 |
| Vol. ortoedrob | 79,97 [49,95-102] | 60.0713[35.2-74.02] | 0,018 |
| Pieza diámetro | 5,431 [4,5-6] | 1,37 [1,1-1,7] | <0,001 |
| Diámetro mayora | 1,53±0,71 | 4,93±0,75 | <0,001 |
| Bordes afectados | 7 (13,2%) | 5 (11,4%) | 0,784 |
| Reintervención | 7 (13,2%) | 3 (7,5%) | 0,507 |
En una paciente, la implantación de la semilla no fue satisfactoria por marcaje de lesión no diana, semilla que fue rescatada mediante extirpación, previa localización con sonda gammadetectora, y recuperación de la lesión diana con arpón metálico. Esta paciente fue excluida del estudio.
DiscusiónLa localización prequirúrgica con arpón metálico de lesiones no palpables de mama ha sido la técnica más utilizada de forma universal en los últimos años2–18. Entre sus principales inconvenientes se encuentra la alta tasa de márgenes afectados en la pieza quirúrgica9,10.
Otras consideraciones técnicas para el cirujano incluyen la posibilidad de una movilización del arpón y la dificultad para ubicar la punta del alambre, y por lo tanto la lesión, lo que obliga a realizar cirugías más amplias a fin de extirpar la totalidad del tumor sin márgenes afectados, pero con una mayor cantidad de tejido sano resecado y por tanto un mayor daño cosmético1,11.
La técnica de localización mediante semillas fue descrita por primera vez por Gray et al. en 20011. La semilla es una cápsula de titanio de 4,5×0,8mm de tamaño, marcada con 125I radioactivo, que se inserta en la lesión mamaria11,12. Al tratarse de una técnica de cirugía radioguiada de lesiones ocultas (ROLL), su escisión está guiada mediante el uso de una sonda gammadetectora, si bien podemos comprobar su correcta localización mediante mamografía dado que las semillas de 125I son radiopacas, lo que constituye una clara ventaja13.
La vida media del 125I es de 59,4 días13, lo que permite su implantación con mucho tiempo de antelación a la cirugía, lo que no ocurre con el arpón metálico, si bien en nuestro estudio no excedió más de 7 días hasta la intervención, facilitando la planificación, con la consiguiente mejora de la logística entre los servicios implicados.
La implantación de la semilla permite una localización mucho más centrada14 y focal dentro de la mama y de la lesión en comparación con el arpón. Su inserción se realiza utilizando técnicas de localización similares a las que se usarían para la guía con arpón metálico (mamografía y ecografía) y no necesita un entrenamiento especial por parte de radiólogos2,3, por lo que se puede implementar en cualquier unidad de radiología mamaria con estas instalaciones.
Las desventajas al comparar la cirugía radioguiada con semillas de 125I respecto a la localización prequirúrgica con arpón metálico son principalmente de dos tipos:
- 1.
Exposición de la paciente a la radiación. En el caso de las semillas, estas muestran unos niveles de radioactividad que van de 0,1 a 0,3 mCi, considerados seguros para la exposición humana por la Comisión de Regulación Nuclear14. En nuestro trabajo se utiliza solo una semilla, que permanece dentro de la paciente durante un tiempo limitado (de 5 a 7 días) antes de la escisión quirúrgica8.
- 2.
Posible colocación incorrecta de la semilla dentro de la mama. Si una semilla no se coloca inicialmente en una posición satisfactoria, generalmente no se puede eliminar antes de la operación. Se ha de realizar una segunda incisión en la localización de la semilla para su recuperación porque no puede permanecer en la paciente, a diferencia de otros marcadores metálicos. La migración de semillas es rara (<1% de los casos) después de la implantación14. En comparación con otros autores, en nuestro estudio hemos tenidos menos complicaciones15.
Además de lo anterior, existen lesiones mamarias no palpables pero con un tamaño considerable (microcalcificaciones extensas y/o dispersas, lesiones mayores de 2 cm) en las que hay que tener en cuenta que la técnica de cirugía radioguiada con semilla, al igual que otras técnicas de marcaje preoperatorio, localiza el centro de la lesión, pero si esta es muy grande, probablemente haya zonas de la lesión alejadas de dicho centro que deben ser incluidas también en la pieza de resección para evitar márgenes afectados. Este inconveniente se puede resolver utilizando dos marcadores (en este caso semillas radiactivas), para delimitar los márgenes de la lesión4.
La cirugía radioguiada con 125I ofrece resultados no inferiores respecto al arpón en la localización de tumores no palpables de mama8-18.
En nuestro estudio, el volumen de las piezas resecadas mediante semillas fue significativamente menor que en el caso de localización con arpón. Estos resultados son equiparables a los obtenidos por otros grupos de trabajo como Lovrics9 y Bas Pow10, pero difieren de los resultados obtenidos por Ahmed y Douek19 que demuestran unas diferencias estadísticamente significativas de cirugía radioguiada con 125I sobre localización con arpón metálico de lesiones malignas no palpables en variables como el margen afectado, las tasas de reoperación y la reducción del tiempo operatorio, sin lograr una diferencia estadísticamente significativa en cuanto al volumen de las piezas quirúrgicas en el tratamiento de los cánceres de mama no palpables localizados con ambas técnicas.
En nuestro estudio, aunque no se alcanzó significación estadística, las tasas de márgenes afectados y de reintervención podrían ser inferiores con el uso de semillas en comparación con guía con arpón. Ha de tenerse en cuenta que posiblemente no se alcanzó la significación estadística debido al escaso tamaño muestral10-17.
El uso de semillas representa un avance importante en el tratamiento quirúrgico de la enfermedad mamaria no palpable en pacientes sometidas a cirugía conservadora de la mama20. Desde su introducción en nuestra Unidad de Mama, los cirujanos de la mama, radiólogos y patólogos están de acuerdo en que es preferible y ofrece mayores beneficios que la localización con arpón, tanto para las pacientes como para la Unidad de Mama.
No obstante, hay que tener en cuenta la necesidad de disponer de un servicio de medicina nuclear que suministre las semillas y que acuda al quirófano en el momento de la intervención para la localización de la semilla y por lo tanto de la lesión con la sonda gammadetectora19. Es por ello por lo que ha de existir una estrecha colaboración entre radiólogos y médicos nucleares para la implantación de esta técnica.
La limitación principal de este estudio es su reducido tamaño muestral, algo que probablemente se solventará en el futuro. Como se ha mencionado antes, la escasa muestra puede haber limitado la obtención de diferencias estadísticamente significativas en algunas de las variables medidas entre los grupos del estudio.
ConclusiónLa utilización de semillas se ha mostrado como una técnica factible en la localización de lesiones no palpables de mama, revelando diferencias significativas en el tamaño de las piezas quirúrgicas respecto al arpón, si bien no se obtiene significación estadística en los márgenes afectados, probablemente debido al pequeño tamaño muestral.
Autoría- 1.
Responsable de la integridad del estudio: IMA, RSS, MCC.
- 2.
Concepción del estudio: IMA, RSS, MCC, ÁCRA.
- 3.
Diseño del estudio: IMA, RSS, MCC.
- 4.
Obtención de los datos: IMA, RSS, MCC, ADGJ.
- 5.
Análisis e interpretación de los datos: IMA, RSS, MCC, ADGJ.
- 6.
Tratamiento estadístico: IMA, RSS, MCC, ADGJ.
- 7.
Búsqueda bibliográfica: IMA, RSS, MCC, ADGJ.
- 8.
Redacción del trabajo: IMA, MCC.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: RSS, MCC, ÁCRA, SMM.
- 10.
Aprobación de la versión final: IMA, RSS, MCC, ADGJ. SMM.
Los autores declaran no tener ningún conflicto de intereses.