Los biomarcadores de imagen definen características objetivas extraídas de las imágenes médicas, relacionadas con procesos biológicos normales, enfermedades o respuestas terapéuticas.
Para desarrollar un biomarcador de imagen es necesario realizar una serie de pasos destinados a validar su relación con la realidad estudiada y controlar su validez, tanto clínica como técnica. Este proceso incluye la definición de pruebas de concepto y de mecanismo; la adquisición estandarizada y optimizada de imágenes anatómicas, funcionales y moleculares; el análisis de los datos mediante modelos computacionales; la visualización adecuada de los resultados; la obtención de medidas estadísticas apropiadas; y la realización de pruebas de principio, eficacia y efectividad.
Nuestro objetivo en este trabajo es mostrar los pasos que deben establecerse para aplicar adecuadamente los biomarcadores de imagen, desde su concepción teórica hasta su implantación asistencial, en un entorno hospitalario. Para ello se planteará como ejemplo la valoración de la angiogénesis del cartílago articular.
Imaging biomarkers define objective characteristics extracted from medical images that are related to normal biological processes, diseases, or the response to treatment.
To develop an imaging biomarker, it is necessary to carry out a series of steps to validate its relation with the reality studied and to check its clinical and technical validity. This process includes defining tests for the concepts and mechanisms; obtaining standardized and optimized anatomic, functional, and molecular images; analyzing the data with computer models; displaying data appropriately; obtaining the appropriate statistic measures; and conducting tests on the principle, efficacy, and effectiveness.
In this article, we aim to explain the steps that must be established to enable biomarkers to be correctly applied, from their theoretical conception to their clinical implementation. To this end, we use the evaluation of angiogenesis in articular cartilage as an example.
No es lo mismo que un radiólogo informe una tomografía computarizada (TC) con un diagnóstico de atrofia que afirmar que ha perdido el 24% del volumen cerebral, ajustado a su edad, y de forma más significativa en la región del surco temporal medio derecho. No es lo mismo asegurar que existe una lesión tumoral en el hígado, que saber que su grado de agresividad biológica es muy alto y su respuesta al tratamiento muy limitada. No es lo mismo afirmar que no se ven alteraciones al ver una resonancia magnética (RM) de hueso, que asegurar que el índice de elasticidad de la esponjosa está disminuido en un 34% y que el paciente tiene osteoporosis con un alto riesgo de fractura ósea. ¿De dónde sale esta información? ¿Cómo puede el radiólogo alcanzar este conocimiento? ¿Qué debemos hacer para integrarlo ya en nuestra práctica asistencial?
El desarrollo de técnicas de imagen médica totalmente digitales ha generado imágenes de alta calidad y una amplia diversidad de la información que contienen. De manera concordante en el tiempo, la enorme expansión de las capacidades de computación ha mejorado todavía más las imágenes utilizadas hoy en día para diagnosticar y guiar el tratamiento de numerosas enfermedades. Además, en los últimos años se están desarrollando los biomarcadores de imagen como expresión de esta sinergia entre las imágenes digitales y su procesado computacional. Estos procedimientos innovadores extraen de las imágenes médicas una información cuantitativa que no puede detectarse ni medirse visualmente en las imágenes originales. Utilizar los biomarcadores de imagen permitirá a los radiólogos cambiar el concepto y los mapas de procesos de nuestro trabajo, abriendo el campo de la imagen médica tradicional a otras disciplinas como la ingeniería y la física.
Esta interacción multidisciplinaria, englobada en el área de conocimiento de la Ingeniería Biomédica, está definiendo unas nuevas técnicas de adquisición y aplicando diversos modelos matemáticos que simulan la realidad biológica y fisiológica, y que permiten obtener medidas precisas y reproducibles de la situación de los pacientes. Los modelos basados en señales o imágenes son representaciones simbólicas de un proceso real, definidos como una serie de relaciones o ecuaciones entre las distintas variables que intervienen en el mismo. El enorme potencial de estos biomarcadores de imagen los ha convertido en uno de los campos de investigación más activos, permitiendo visualizar y medir procesos fisiológicos y biológicos a partir de modelados tridimensionales de una región de interés en un paciente concreto.
Un biomarcador de imagen se puede definir como una característica extraída de las imágenes adquiridas de un sujeto, que puede medirse de forma objetiva y que se comporta como un indicador de un proceso biológico normal, una enfermedad o una respuesta a una intervención terapéutica1. Desde simples mediciones de tamaño o forma hasta la aplicación de complejos modelos computacionales, en los últimos años se ha demostrado que los biomarcadores de imagen ofrecen una información complementaria muy útil al diagnóstico radiológico tradicional para establecer la presencia de una alteración o lesión; medir su situación biológica; definir su historia natural y progreso; estratificar las anomalías en fenotipos; y evaluar los efectos de un tratamiento. En principio se pueden extraer biomarcadores a partir de cualquier modalidad de imagen para diagnóstico, pero entre todas las existentes, la RM destaca por su gran versatilidad para estudiar distintos tejidos y procesos.
Los biomarcadores de imagen presentan una doble ventaja. Por un lado representan variables numéricas que caracterizan y cuantifican diferentes parámetros, extraídos de las imágenes médicas, relevantes para una enfermedad específica. Por otro, las imágenes paramétricas permiten analizar la distribución espacial del biomarcador en la muestra observada mediante su representación visual. Estas imágenes se generan para representar gráficamente los valores de cada uno de los biomarcadores o parámetros que se calculan a partir del posproceso de las imágenes originales adquiridas.
Nuestro objetivo en este trabajo es mostrar los pasos que deben establecerse para aplicar adecuadamente los biomarcadores de imagen, desde su concepción teórica hasta su implantación asistencial, en un entorno hospitalario.
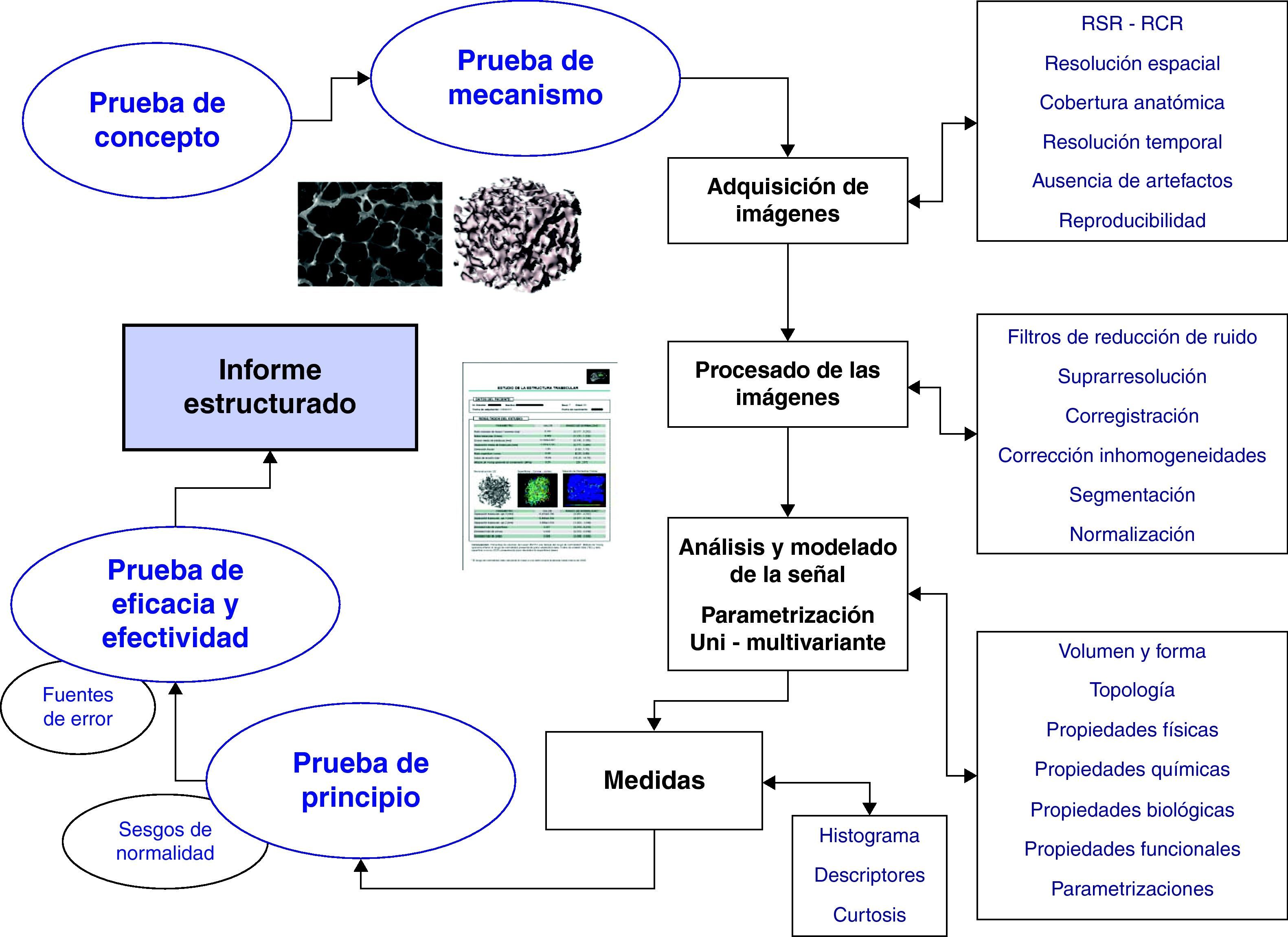
Desarrollo inicial de un biomarcador de imagenEl proceso necesario para incorporar un biomarcador de imagen, tanto en la práctica clínica como en un ensayo clínico, es complejo y debe responder a criterios de coherencia conceptual, reproducibilidad técnica, sensibilidad y especificidad. La definición del problema, la adquisición de las imágenes fuente, la metodología de análisis y la extracción del biomarcador a partir de modelos computacionales y herramientas de medida, son aspectos imprescindibles para utilizarlos adecuadamente en el estudio de una enfermedad. Básicamente, el desarrollo de un biomarcador implica validar su relación con la realidad objetivada (estructural, fisiológica, biológica o molecular) y controlar su validez técnica. Para llegar a su desarrollo, despliegue y posterior aplicación es necesario realizar una serie de pasos sucesivos que se describen a continuación (fig. 1)2.
El primer paso define los motivos por los que queremos medir un aspecto determinado de la enfermedad. Esta prueba de concepto debe verificar que un proceso biológico determinado, entendido como una cadena de causas y efectos, se puede estudiar con las pruebas disponibles de diagnóstico por imagen y computación.
Tras definir el objetivo, se debe conocer la relación existente entre el biomarcador, el parámetro que se analiza, y la enfermedad objeto de estudio. En este sentido, la prueba de mecanismo establece que hay que demostrar la interrelación entre el biomarcador y el concepto, centrándose en comprender la acción (en magnitud y dirección) que una determinada enfermedad o un tratamiento tienen sobre el biomarcador. Por ejemplo, esta prueba permite establecer si la relación entre la enfermedad y un determinado biomarcador es directa o inversamente proporcional a la gravedad, no lineal, exponencial, entre otras.
Adquisición y análisis de un biomarcador de imagenSin unas imágenes adecuadas es imposible extraer biomarcadores útiles. Es por ello que la definición del método y la técnica de adquisición de las imágenes es uno de los pasos más importantes. Independientemente de la técnica elegida (radiografía, ecografía, TC, RM, SPECT –Single Photon Emission Computed Tomography- o PET –Positron Emission Tomography-), se deben cuidar varios aspectos. La calidad de la imagen, medida como la relación señal-ruido (RSR), y la relación contraste-ruido (RCR), debe optimizarse para detectar el parámetro que se desea estudiar. Este paso es crítico para poder analizar de forma adecuada la señal del objeto de interés y sus cambios, facilitando la implementación de las herramientas de computación más adecuadas.
Respecto a la cobertura anatómica, debe estudiarse el órgano con la suficiente resolución espacial, definida ésta por el tamaño del vóxel. Tanto la resolución como la cobertura deben ajustarse al problema de estudio y al tamaño esperado de la alteración. Para que las imágenes sean reproducibles deben estar exentas de artefactos que degraden o corrompan la señal y mantener en el tiempo su calidad (RSR, RCR) sin modificar los parámetros de adquisición. En los estudios funcionales y dinámicos es además importante asegurar el mejor compromiso entre los requerimientos de resolución espacial y resolución temporal (frecuencia de adquisición de las imágenes de un mismo volumen), para poder observar detalladamente los procesos fisiológicos.
Para garantizar la estabilidad y el buen funcionamiento de los equipos de adquisición de imágenes es necesario realizar controles de calidad periódicos (aconsejable cada 2 meses) mediante maniquís donde se verifique que las variaciones de RSR, RCR, frecuencia de sintonización, relación espacial y grado de distorsión son estables y están dentro de las especificaciones del equipo proporcionadas por el fabricante.
Antes de analizar y modelar las señales, las imágenes deben procesarse garantizando que los datos adquiridos sean óptimos para el análisis. Para ello, se debe incrementar la RSR tanto como sea posible eliminando el ruido disperso mediante los filtros adecuados3; homogeneizar la imagen para eliminar señales y brillos artefactuales4 y maximizar la resolución espacial sin afectar la señal mediante algoritmos de super-resolución5, garantizando una coherencia espacial exacta entre todos los puntos del órgano durante todo el estudio mediante un corregistro6 que garantice un reposicionamiento de los vóxeles para que un área de un órgano esté representada por los mismos puntos en todas las imágenes adquiridas en distintas series.
La segmentación permite clasificar los tejidos para facilitar su análisis y visualización posterior7. Para ello pueden emplearse varios métodos, basados generalmente en la señal del tejido a segmentar tras optimizar la adquisición, mejorar el contraste y aplicar los filtros de reducción de ruido. Para una segmentación adecuada es aconsejable alcanzar en la imagen final la mayor resolución espacial posible, minimizando el problema del volumen parcial.
En numerosos procesos es recomendable normalizar la señal y el volumen del órgano estudiado a un marco de referencia que permita su comparación con otros datos poblacionales diferentes. Este proceso de normalización suele realizarse mediante algoritmos de transformación espacial, que establecen las operaciones geométricas necesarias para relacionar la estructura de interés a una plantilla de referencia que permita un análisis conjunto8.
El análisis y modelado de la señal permite extraer de las imágenes médicas digitales la información de los biomarcadores mediante los procesos computacionales adecuados. Aunque los métodos existentes son muy numerosos y sería imposible ni siquiera definirlos en este trabajo, pueden agruparse en función de los parámetros que se analizan. Así, hay métodos para calcular el volumen y la forma de un tejido (como en el carcinoma de pulmón), su topología (como en el hueso trabecular), y algunas de sus propiedades físicas (como los tiempos de relajación transversal y longitudinal), químicas (como la espectroscopia), biológicas (como la angiogénesis y la densidad celular) y funcionales (como el consumo local de oxígeno).
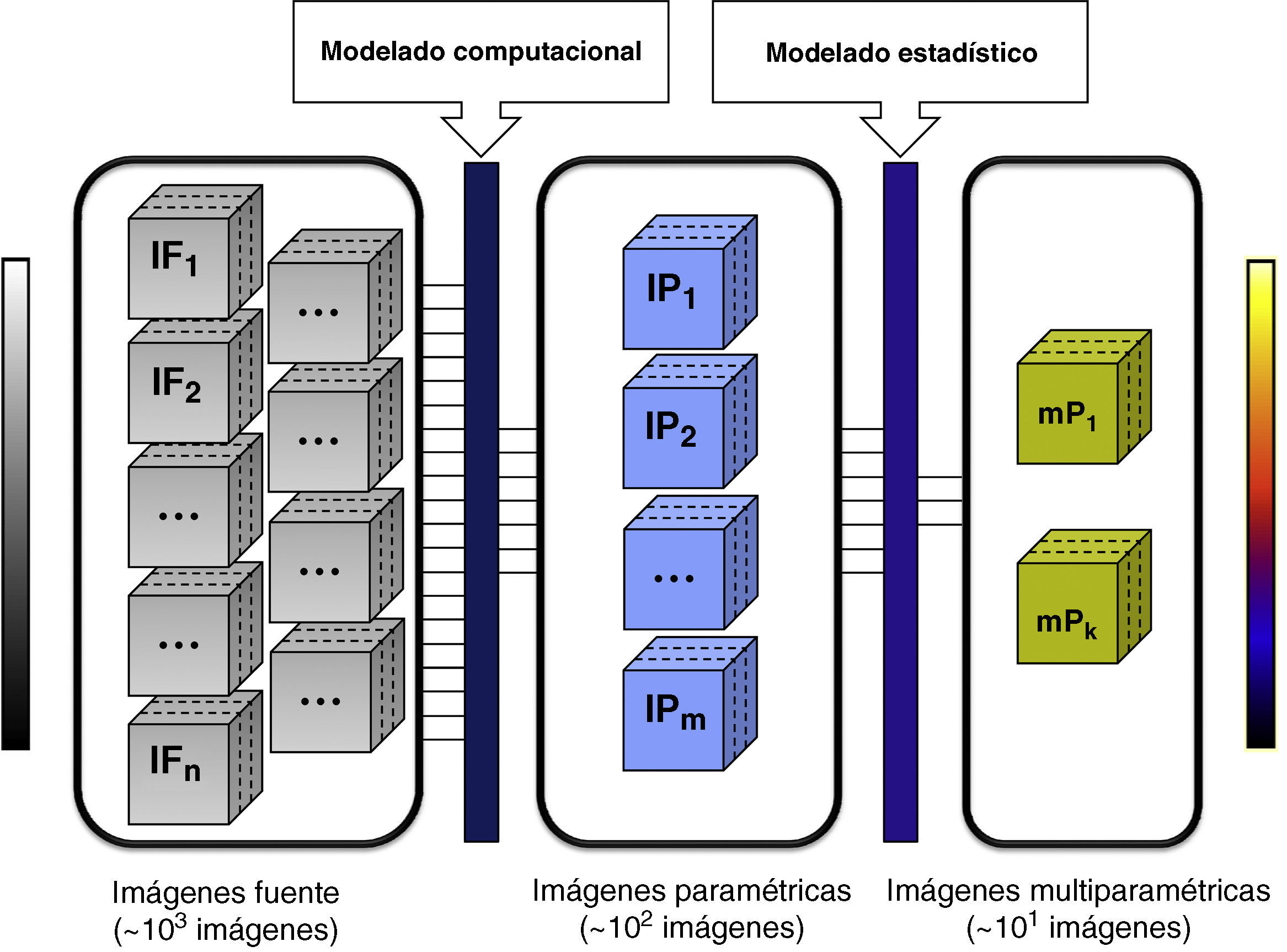
Una vez obtenidas estas variables para cada uno de los vóxeles de interés, puede representarse la distribución espacial del biomarcador mediante imágenes paramétricas (fig. 2). En estas imágenes los píxeles representan los valores de un determinado parámetro (morfológico o funcional) obtenido mediante el ajuste numérico de un modelo y representado habitualmente en una escala de colores diferente a la escala de niveles de gris de las imágenes fuente originales (aunque en algunos casos, como en los mapas del coeficiente aparente de difusión, la imagen paramétrica se representa también en escala de grises). Estas imágenes paramétricas también pueden representarse en escala de color como sólo los vóxeles anómalos superpuestos a la imagen original, con los órganos y estructuras representados en escala de grises.
Proceso de extracción de información relevante mediante la creación de imágenes paramétricas. El cuadro de la izquierda representa el número de imágenes adquiridas en un estudio de RM con información tanto morfológica como funcional. El cuadro central indica las imágenes paramétricas obtenidas tras aplicar modelos computacionales sobre las imágenes fuente. Cada una de estas imágenes representaría el valor de un biomarcador determinado para cada corte de un estudio volumétrico. En el cuadro de la derecha se muestra un ejemplo de imágenes multiparamétricas, obtenidas tras la aplicación de un modelado estadístico sobre las imágenes paramétricas. Podría tratarse del caso de obtener una o varias funciones discriminantes que indiquen qué biomarcadores y en qué proporción son relevantes para caracterizar estadísticamente procesos biológicos asociados a una enfermedad. Se puede apreciar claramente la disminución del número de imágenes entre un cuadro y el siguiente. Esto se debe a que tanto al aplicar modelos computacionales como estadísticos lo que se consigue es reducir la redundancia de la información para resaltar sólo aquellos biomarcadores que están estadísticamente relacionados con la enfermedad.
Un paso más para disminuir la redundancia de los datos adquiridos, es decir, acotar las imágenes que deben visualizarse tras optimizar la información útil, se alcanza con la utilización de imágenes paramétricas multivariantes (fig. 2). A diferencia de las imágenes paramétricas, en estas imágenes el color de cada vóxel viene determinado por el resultado de una función estadística multivariante, que es a su vez una combinación de varios parámetros o biomarcadores. Con esta aproximación se pretende valorar conjuntamente los datos para mejorar el análisis estadístico unidimensional y ayudar al radiólogo a tomar las decisiones más adecuadas. Algunos de los métodos estadísticos multivariantes más utilizados son la regresión lineal, el análisis de función discriminante y el de componentes independientes o principales.
Medición de un biomarcadorDe las imágenes paramétricas, tanto convencionales como multivariantes, se pueden obtener mediciones bien de todo el tejido u órgano estudiado, bien sólo de aquellas áreas que se consideren más representativas o anormales. En este punto debe definirse cómo se va a trabajar con el histograma de los valores obtenidos (representación gráfica de la distribución de los valores de una variable donde el eje vertical representa la frecuencia de aparición de un determinado valor del biomarcador y el horizontal sus distintos valores).
De este histograma se pueden extraer los resultados como el valor medio, la desviación típica y el rango, que pertenecen a la estadística descriptiva estándar. Un problema de esta aproximación es su clara tendencia a infravalorar los cambios en los tejidos u órganos, minimizando los valores anómalos que representan la enfermedad o sus manifestaciones más relevantes. Es por ello que en algunas situaciones deben utilizarse los valores extremos (como el 10% máximo en los mapas de perfusión tisular o el 25% mínimo en los mapas del coeficiente de difusión) para tener una mejor relación con las variables clínicas predictoras más relevantes. Para cada problema debe definirse el tipo de aproximación (histograma completo, histograma parcial por cuartiles, histograma por deciles) más conveniente por la que se opta.
Otra aproximación es analizar para una región dada (normalmente un tumor o una lesión) la heterogeneidad de la distribución espacial de un biomarcador dada por su imagen paramétrica. Un análisis clásico es mediante el cálculo de la curtosis, parámetro estadístico que indica la estrechez del histograma y donde los valores altos indican distribuciones estrechas, es decir, homogéneas, y viceversa.
Validación de un biomarcadorCuando ya se dispone del concepto, las imágenes adecuadas, el análisis y los modelados pertinentes y la metodología de medición, es necesario realizar una experiencia piloto que valide el proceso en un grupo de sujetos, con y sin enfermedad, con un tamaño muestral pequeño. La prueba de principio, o prueba piloto, se centra en demostrar la validez de las pruebas de concepto y de mecanismo, ambas teóricas, en un grupo inicial reducido, antes de emprender un desarrollo clínico completo. En ella es muy importante además definir si existen variaciones en las medidas asociadas a la edad, al sexo u otros factores que pueden ser de confusión.
Tras el éxito en la prueba piloto se debe trabajar ya con series de un tamaño muestral adecuado y bien definido para extraer conclusiones de peso estadístico. En ellas se definirá la prueba de eficacia como aquella que permite valorar la capacidad de un biomarcador de medir adecuadamente (de modo reproducible, fiable y preciso) el concepto. La eficacia es un estudio demostrativo que define la potencia de la tecnología sanitaria en condiciones de control ideales. La prueba de efectividad analiza, en condiciones habituales de uso, la bondad de un biomarcador para medir la variable clínica relevante a la enfermedad (endpoint). Es importante recordar que los objetivos sustitutos o subrogados, es decir, los biomarcadores de imagen, pueden reemplazar al objetivo clínico final sólo si se han demostrado eficaces y efectivos. Sólo los biomarcadores de imagen validados deben utilizarse como objetivos sustitutos para definir una enfermedad, su situación y su respuesta a un tratamiento.
Los sesgos son errores sistemáticos que afectan a los resultados y distorsionan los procesos de medida. Los estudios sesgados pierden validez y es por ello que deben reconocerse y minimizar sus fuentes de error para no cometer errores en la interpretación de los resultados9. Además, es importante disponer de un buen diseño experimental para la validación metodológica, pues en muchos casos la sobreestimación de los resultados hace que las medidas de bondad se desvíen hacia las metodologías propuestas en detrimento de las ya establecidas10.
Aun cumpliendo con esta cascada de pruebas y control de errores, debe tenerse en cuenta que los parámetros que definen a un biomarcador ideal son en la práctica aún más complejos. Un biomarcador debe adquirirse desde equipos tecnológicamente estables (para evitar fuentes de variabilidad en la adquisición), debe obtenerse por métodos incruentos y seguros para el paciente (en nuestro caso a partir de las imágenes médicas), debe estar disponible de forma generalizada (para garantizar su difusión y utilización universal), debe ser reproducible (capacidad de replicar el valor obtenido, de forma que sea siempre menor que las diferencias que se pretenden detectar, obteniéndose los mismos resultados en centros con equipamientos diferentes), debe estar estandarizado en cuanto a la adquisición de la imagen (parámetros técnicos), preparación y proceso (filtrados, mejora de resolución de señal-ruido y de resolución espacial), análisis y modelado de la señal (ajuste de modelos computacionales, extracción de variables), y finalmente estar validado con respecto a su precisión y eficacia.
El biomarcador ideal debe ser clínicamente útil (permitiendo una mejora clínica medible), tener una alta sensibilidad (mejor relación entre la variación del biomarcador y la del efecto que se pretende medir) y un alto porcentaje de verdaderos positivos (clasificar correctamente como anormal un hallazgo realmente alterado). Debe tener una alta especificidad (probabilidad de que un sujeto verdaderamente sano obtenga un resultado negativo en la prueba) y estar además muy vinculado al proceso biológico o la alteración patológica con la que se relaciona.
Finalmente, debe tener un coste lo más bajo posible, tanto económico (barato) como de dedicación temporal (rápido).
El informe radiológico con biomarcadoresPara innovar clínicamente hay que comunicar los resultados de los biomarcadores utilizados de forma intuitiva. Un sistema adecuado es el informe estructurado DICOM (Dicom Structured Reporting, DICOM SR). Esta arquitectura está diseñada para la codificación de documentos y el intercambio de información pertinente mediante el uso de una estructura jerarquizada. DICOM SR introduce las definiciones de objetos de información DICOM y los servicios utilizados para el almacenamiento y transmisión de estos informes estructurados. DICOM SR no sólo define las estructuras de datos (paciente, episodio, imágenes, biomarcadores e informes parciales), sino que también permite su almacenamiento, consulta, recuperación, análisis estadístico y transferencia. Además, DICOM SR tiene la capacidad de vincular el documento clínico de los biomarcadores al episodio del paciente en el PACS.El informe estructurado debe contener una información completa y precisa con evaluación de los posibles sesgos y una generalización de los resultados. La norma para la presentación de informes de diagnóstico (tipo STARD -Standards for Reporting of Diagnostic Accuracy-) contiene una lista de los principales elementos para elaborar estudios de eficacia diagnóstica y el diagrama de flujo necesario para garantizar la presencia de toda la información pertinente11. Entre las directrices del documento, cabe resaltar las siguientes:
- -
Describir el proceso de recogida de datos.
- -
Describir la población o técnica utilizada como referencia.
- -
Describir la metodología estadística y proporcionar información sobre la reproducibilidad del método.
- -
Incluir una distribución de la gravedad de la enfermedad y la situación del paciente respecto al grupo de referencia.
- -
Describir la conclusión del análisis basada en la aplicabilidad clínica final para ayudar a resolver los objetivos clínicos relevantes.
Actualmente el estudio del cartílago articular mediante RM se basa principalmente en la valoración cualitativa de las imágenes convencionales de RM. En la práctica rutinaria, se utiliza un sistema de clasificación estandarizado12, sujeto a la interpretación subjetiva del radiólogo, poco sensible para detectar el daño inicial y poco reproducible en los estudios de seguimiento. Recientemente se han desarrollado biomarcadores de imagen que permiten gradar la enfermedad de una forma más objetiva, sensible y fiable (espesor del cartílago, mapas de T2 y mapas de T1). En este ejemplo se demostrarán las propiedades microvasculares del cartílago articular como biomarcador inicial de la degeneración.
Prueba de conceptoEl cartílago articular normal es resistente a la invasión vascular desde el hueso subcondral. Se ha demostrado que a medida que el cartílago articular degenera hacia condromalacia u osteoartritis se produce un cambio en sus propiedades antivasculares, debido principalmente a condiciones de sobrecarga e hipoxia, con la consiguiente sobreexpresión del factor de crecimiento vascular (VEGF) por parte de los condrocitos13–17.
Prueba de mecanismoEl análisis farmacocinético de imágenes dinámicas de RM tras administrar un contraste se utiliza habitualmente para evaluar las propiedades microvasculares de los tejidos, especialmente en el estudio de tumores18,19. Dado que se pretende estudiar los cambios vasculares asociados a la progresión de la degeneración del cartílago, se propone que los biomarcadores de neovascularización derivados de la aplicación de un modelo farmacocinético a partir de curvas de captación de contraste podrán utilizarse para evaluar la degeneración inicial, la progresión de la degeneración y la respuesta vascular al tratamiento.
Adquisición de imágenesPara poder extraer los biomarcadores de imagen asociados al modelado farmacocinético de la perfusión por RM es necesario disponer de 3 secuencias de imágenes.
Primero se adquiere una secuencia eco de gradiente (EG) con supresión grasa (TR=3,4ms, TE=1,9ms, α=10°) para segmentar el cartílago, con una elevada resolución espacial y contraste entre cartílago, líquido y resto de tejidos.
A continuación se adquiere una secuencia que permite calcular el valor de T1 del tejido antes de la inyección del medio de contraste. Es necesario conocer este valor para convertir las curvas de variación de intensidad extraídas de la secuencia de perfusión a curvas de variación de concentración de contraste, para poder así extraer parámetros farmacocinéticos con significado fisiológico. Esta relación no es lineal y se debe estimar a partir de la disminución del T1 del tejido originada por el medio de contraste. Para obtener el T1 es necesario realizar varias adquisiciones EG con diferentes ángulos de magnetización (TR=9,2ms, TE=5,4ms, α=2°, 5°, 7°, 10°, 15°, 20°, 25°, 30°, 40°, 60°)20.
Las imágenes dinámicas de perfusión se adquieren con una secuencia EG-T1 de elevada resolución temporal para muestrear correctamente la fase arterial (TR=7,2ms, TE=3,5ms, α=15°, < 5 segundos por dinámico). La adquisición debe tener una duración de al menos 5 minutos para analizar el lavado del contraste y tener suficiente información temporal de toda la curva de captación.
Procesado de las imágenesSe aplica en primer lugar un filtro espacial para minimizar el ruido de las imágenes y posteriormente un filtro temporal para eliminar las fluctuaciones ruidosas de las curvas de captación del contraste debidas a ligeros movimientos o a ruido inherente al proceso de obtención de la imagen en RM.
Análisis y modelado de la señalAntes de extraer los parámetros farmacocinéticos hay que convertir las curvas de intensidad vs. tiempo en curvas de concentración de contraste vs. tiempo. Para ello se obtiene el valor de T1 basal antes de la inyección del contraste a partir de la secuencia multiángulo. A continuación se calculan las curvas de T1 vs. tiempo a partir de las curvas de intensidad vs. tiempo extraídas de las imágenes de perfusión. Finalmente se obtienen los valores de concentración de contraste como la diferencia entre la variación del T1 con respecto al T1 basal dividida por el coeficiente de relajatividad longitudinal del medio de contraste21.
El modelo farmacocinético utilizado es de dos compartimentos (vascular e intersticial) y una entrada (arteria poplítea). La curva de captación de cada vóxel se ajusta mediante mínimos cuadrados a la expresión matemática del modelo, lo que permite obtener los parámetros de permeabilidad capilar (Ktrans), coeficiente de lavado (kep), fracción volumétrica de espacio intersticial (ve) y fracción volumétrica de espacio vascular (vp). Los parámetros y las unidades de este modelo farmacocinético fueron estandarizados por Tofts et al22, lo que hace que frecuentemente se denomine a este modelo farmacocinético modelo de Tofts extendido.
Parametrización uni-multivarianteSe pueden representar los valores calculados de todo el cartílago como un mapa paramétrico que refleje las variaciones regionales relacionadas con mayor degeneración. La aplicación de técnicas de función discriminante permite generar nuevos mapas multiparamétricos de daño o degeneración del tejido y nosológicos (fig. 3). Estas técnicas multivariantes permiten conocer qué parámetros y en qué proporción aportan información relevante para caracterizar de forma regional la presencia y gravedad de la enfermedad.
Mapa nosológico que describe distintos grados de degeneración del cartílago articular. En la imagen de la izquierda se muestra la proyección coronal de un cartílago patelar normal, donde la escala de colores indica el grado de degeneración. En la imagen central y en la imagen de la derecha se muestran ejemplos de cartílagos patelares con degeneraciones inicial y avanzada, respectivamente. Estos mapas nosológicos se han obtenido a partir de funciones discriminantes, donde el valor de la función representa la probabilidad de que un determinado píxel sea patológico.
Las medidas de los diferentes parámetros farmacocinéticos deben realizarse mediante el estudio del histograma regional, dada la naturaleza heterogénea en la distribución de las áreas de neovascularización. De esta forma se evita perder información regional relevante cuando se realiza la media, sobre todo en los casos en que se quieran detectar pequeñas regiones con alteración que se verían enmascaradas al calcular la media de todo el cartílago. En estos casos sería conveniente trabajar sólo con los deciles o los cuartiles máximos del histograma.
Prueba de principioEstudios recientes han relacionado aumentos de estos parámetros con la progresión de la degeneración del cartílago articular en un grupo reducido, incluyendo sujetos sanos y pacientes con condropatía23,24. Con esta prueba queda demostrado que los parámetros farmacocinéticos miden el efecto que se esperaba, obteniendo diferencias estadísticamente significativas entre sujetos normales, con degeneración inicial y con degeneración avanzada para Ktrans y ve.
Prueba de eficacia y efectividadEs necesario realizar estudios a gran escala para comprobar la viabilidad y uso clínico de este biomarcador en la gradación y seguimiento del cartílago articular.
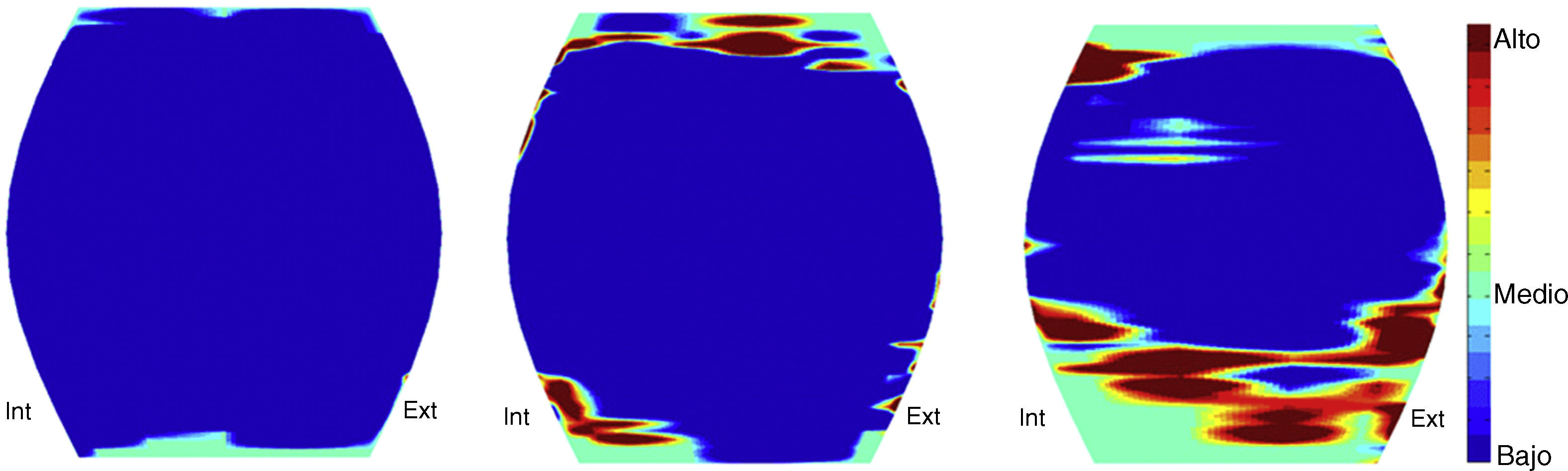
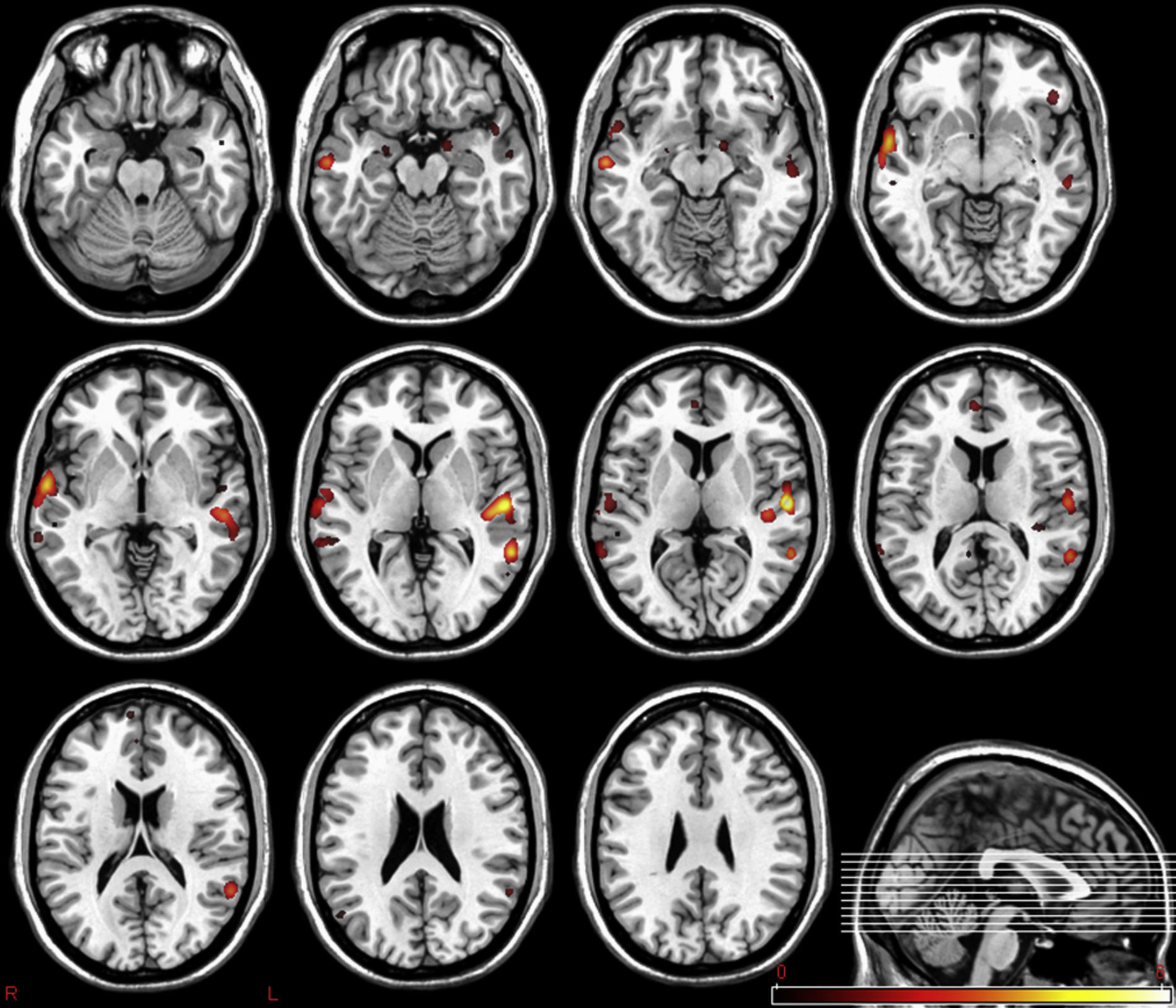
Presente y futuro de los biomarcadores de imagenEl nuevo escenario radiológico que se plantea tras la introducción de los biomarcadores proporciona un valor añadido considerable a las técnicas de diagnóstico por imagen. Al igual que ocurre con otras tecnologías emergentes, al principio pueden suscitar un pico de expectativas que dista significativamente de la realidad, pero con el tiempo, se tenderá a incorporar la información cuantitativa proporcionada por los biomarcadores en la práctica clínica diaria. Así pues, en la actualidad ya es posible, por ejemplo, estudiar la coexistencia de alteraciones estructurales y funcionales del cerebro en pacientes con trastornos psiquiátricos y neurodegenerativos, permitiendo la identificación de las áreas más relevantes de la enfermedad25,26 (fig. 4) o analizar la elasticidad y diferentes parámetros topológicos y mecánicos del hueso trabecular para establecer valores de resistencia ósea y riesgo de fracturas en procesos osteoporóticos27,28 (fig. 5).
Izquierda, reconstrucción 3D de hueso trabecular extraída a partir de imágenes de RM de alta resolución espacial. Centro, conversión de la geometría de la estructura trabecular a un modelo de elementos finitos basado en pequeños elementos hexaedro. En esta imagen tridimensional, cada pequeño cubo corresponde a un elemento finito. Cada elemento tiene unas propiedades físico-químicas, correspondientes a hueso en este ejemplo, y está unido al resto de elementos finitos formando una malla. Derecha, mapa paramétrico de las tensiones nodales resultado de la simulación de compresión de la estructura trabecular. Valores elevados (codificados en rojo) indican tensiones nodales elevadas, es decir, regiones que se corresponden con un mayor riesgo de rotura.
El presente y futuro de estas y otras aplicaciones de los biomarcadores pasa por la integración de los procesos radiológicos, con especial atención en homogeneizar los procedimientos de uso, estandarizar los protocolos de adquisición y potenciar las herramientas de extracción de conocimiento comunes con un claro enfoque orientado al mejor diagnóstico y seguimiento de las enfermedades.
ConclusiónLa imagen médica digital y el procesado computacional permiten extraer parámetros que pueden considerarse como imágenes funcionales29 o biomarcadores de imagen30. En la práctica clínica, estos biomarcadores pueden ser de gran interés por las ventajas que proporcionan al proceso de diagnóstico, terapéutico y de seguimiento en numerosas patologías. Para ello debemos cotejar la coherencia de su ciclo integral, desde la concepción hasta su puesta en marcha (fig. 1). La combinación de imagen digital y computación tiene mucho de magia, de hacer aparecer lo oculto y misterioso, pero su fin último es alcanzar el éxito profesional, entendido como la excelencia en la medicina asistencial y experimental. Todas estas ventajas residen en el trabajo multidisciplinar de distintos profesionales que aúnan esfuerzos para proporcionar un mejor servicio al paciente y una mayor comprensión de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de este trabajo forma parte de un curso de formación continuada online de IPEM.