Evaluar la posibilidad de obtener el perfil genético de los tumores primarios malignos de la mama a partir de las muestras obtenidas mediante la biopsia percutánea ecoguiada realizada durante el proceso diagnóstico.
Material y métodosEstudio retrospectivo sobre 13 pacientes consecutivas diagnosticadas de cáncer infiltrante de mama mediante biopsia ecoguiada (Modo B) con aguja gruesa (BAG) de calibre 12 G. Tras indicación clínica, el anatomopatólogo determinó, sobre los bloques de parafina, la aparente idoneidad de las muestras, antes de enviarlas al laboratorio para análisis genético con la plataforma MammaPrint®. Se han evaluado los siguientes aspectos: tamaño tumoral, validez de la muestra y porcentaje de células tumorales.
ResultadosEl tamaño ecográfico tumoral osciló entre 0,6cm y 5cm. En 11 pacientes la muestra conservada se consideró “válida” y apta para la determinación del perfil genético. En una paciente (tamaño tumoral de 1cm) y a juicio del anatomopatólogo, hubo que repetir la BAG para obtener muestras adicionales. En otra paciente (tamaño tumoral de 5cm), la muestra no fue considerada “válida” por el laboratorio genético. El porcentaje de células tumorales, entre las muestras válidas, osciló entre el 60% y 70%. En 11 de 13 (84,62%) casos fue posible el análisis genético a partir de las muestras diagnósticas previas.
ConclusiónResulta posible obtener el perfil genético en la BAG ecoguiada con agujas de 12 G, a partir de las muestras diagnósticas conservadas en bloques de parafina, en la mayoría de los casos, independientemente del tamaño tumoral.
To evaluate the possibility of determining the genetic profile of primary malignant tumors of the breast from specimens obtained by ultrasound-guided percutaneous biopsies during the diagnostic imaging workup.
Material and methodsThis is a retrospective study in 13 consecutive patients diagnosed with invasive breast cancer by B-mode ultrasound-guided 12 G core needle biopsy. After clinical indication, the pathologist decided whether the paraffin block specimens seemed suitable (on the basis of tumor size, validity of the sample, and percentage of tumor cells) before sending them for genetic analysis with the MammaPrint® platform.
ResultsThe size of the tumors on ultrasound ranged from 0.6cm to 5cm. In 11 patients the preserved specimen was considered valid and suitable for use in determining the genetic profile. In 1 patient (with a 1cm tumor) the pathologist decided that it was necessary to repeat the core biopsy to obtain additional samples. In 1 patient (with a 5cm tumor) the specimen was not considered valid by the genetic laboratory. The percentage of tumor cells in the samples ranged from 60% to 70%. In 11/13 cases (84.62%) it was possible to do the genetic analysis on the previously diagnosed samples.
ConclusionIn most cases, regardless of tumor size, it is possible to obtain the genetic profile from tissue specimens obtained with ultrasound-guided 12 G core biopsy preserved in paraffin blocks.
El cáncer de mama es una enfermedad heterogénea, por lo que el conocimiento del denominado perfil (“huella”, “firma”) de expresión génica (genotipo) tumoral se ha convertido en una herramienta importante de cara a establecer el pronóstico y planificar la terapia en pacientes afectadas de cáncer de mama1–5.
Resulta habitual que dicha información se obtenga a través de muestras tumorales quirúrgicas. Sin embargo, se plantean diversas situaciones en las que se requiere obtener tal información de modo no quirúrgico (especialmente si se plantea instaurar terapia neoadyuvante), mediante biopsia percutánea (BP) de mama.
No abundan las referencias bibliográficas específicas con respecto al uso exclusivo de los bloques de parafina resultantes de la BP diagnóstica, por lo que nuestro objetivo es determinar si las muestras de la BP diagnóstica son adecuadas para evaluar el perfil genómico tumoral mediante la plataforma génica MammaPrint®.
Material y métodosEstudio retrospectivo de 13 pacientes consecutivas, durante el periodo comprendido entre enero de 2012 y septiembre de 2015. Criterio de inclusión: diagnóstico de cáncer de mama infiltrante mediante BP, confirmado posteriormente mediante cirugía, con indicación clínica de determinación de la firma genética a partir de las muestras obtenidas durante el proceso diagnóstico. No se han considerado criterios de exclusión.
Se han seguido los protocolos establecidos en nuestros centros para acceder a los datos de las historias clínicas, con el fin de poder llevar a cabo su publicación. Todas las pacientes dieron su consentimiento informado, por escrito, para la determinación del perfil genético. No resultó necesario solicitar el permiso del Comité de Ética, puesto que no se han utilizado recursos o procedimientos diferentes a los ya protocolizados en la práctica cotidiana.
Las biopsias percutáneas correspondieron a biopsia con aguja gruesa (BAG), ecoguiada (modo B), sobre masas sospechosas de malignidad y realizadas por el mismo radiólogo, con aguja tipo “tru-cut” de calibre 12 G (Magnum®, BARD). El número de muestras por cada paciente osciló entre 3 y 4, obtenidas seleccionando el avance “largo” (22mm) y de diversas zonas de la lesión, con arreglo a nuestro protocolo habitual.
Tras la solicitud clínica, el anatomopatólogo revisaba los bloques de parafina y determinaba la idoneidad de las muestras, antes de ser remitidas para realizar el análisis genético mediante la plataforma MammaPrint® (Agendia Inc., Amsterdam, Holanda). La muestra se consideró válida cuando así lo determinaba el laboratorio genético, que considera apta el espécimen si existe, al menos, un 30% de células tumorales6. Tras el análisis genético, la muestra era devuelta al laboratorio de anatomía patológica.
El análisis genético clasificó a las pacientes en dos grupos, “alto” o “bajo”, según el nivel de riesgo de desarrollar recurrencia/enfermedad metastásica.
Se evaluaron los siguientes aspectos de cada caso: tamaño tumoral, validez de la muestra y porcentaje de células tumorales.
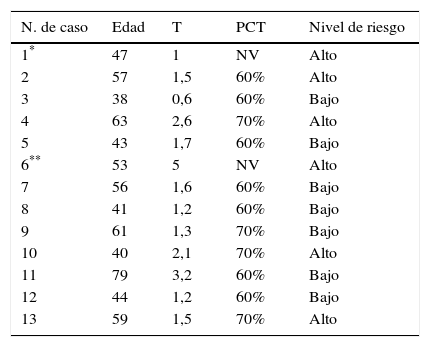
ResultadosEn la tabla 1 puede observarse la relación de casos, con la edad de las pacientes, el tamaño tumoral, el porcentaje de células tumorales en las muestras analizadas y el nivel de riesgo obtenido en el análisis.
Edad, tamaño tumoral, porcentaje de células tumorales y nivel de riesgo
La edad de las pacientes osciló entre 38 y 79 años, con una media de edad de 52 años. El tamaño tumoral osciló entre 0,6cm y 5cm, con una media de tamaño de 1,88cm.
En uno de los casos (caso n.° 1), el anatomopatólogo determinó que no existía un volumen celular neoplásico suficiente, y hubo que repetir la BAG, con lo que se obtuvo una muestra válida. En el resto de casos el anatomopatólogo consideró apta la muestra previa, y se procedió a su envío al laboratorio sin repetir la toma de nuevas muestras. Sin embargo, en un caso (caso n.° 6), el laboratorio de MammaPrint® consideró no válida la muestra.
En 11 de 13 (84,62%) casos las muestras fueron consideradas válidas y resultó posible obtener el genotipo del tumor.
El porcentaje de células tumorales notificado por el laboratorio genético osciló entre el 60% y el 70%. Entre las 11 muestras válidas, 7 contenían un 60% de células tumorales y 4 un 70%, con una moda de 60%.
En 7 casos se obtuvo un perfil genético de riesgo “bajo” (fig. 1), y en 4 casos de riesgo “alto” (fig. 2). Los dos casos en los que no fue posible el análisis genético a partir de la BP diagnóstica correspondían a tumores con perfil genético de riesgo “alto”, y el resultado se obtuvo repitiendo la toma de muestras (caso n.° 1) o a partir de muestra quirúrgica (caso n.° 6).
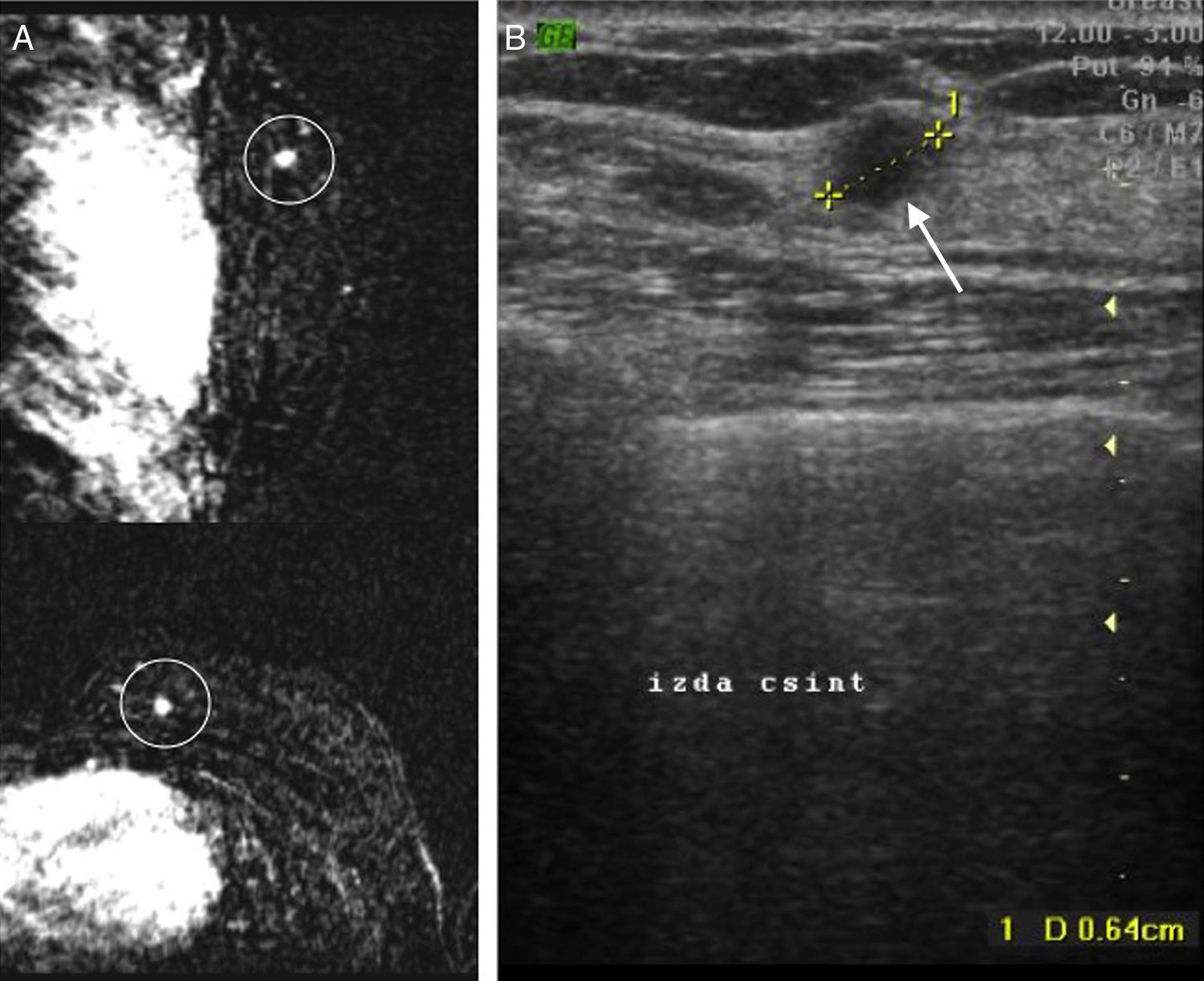
Caso n.° 3. Paciente de 38 años, con antecedentes de cáncer de mama derecha. En el control rutinario mediante resonancia magnética (A), y en mama contralateral (izquierda), masa de 0,6cm sospechosa de malignidad (círculo), que ecográficamente (B) corresponde al hallazgo señalado con flecha. Determinación mediante MammaPrint®: riesgo bajo.
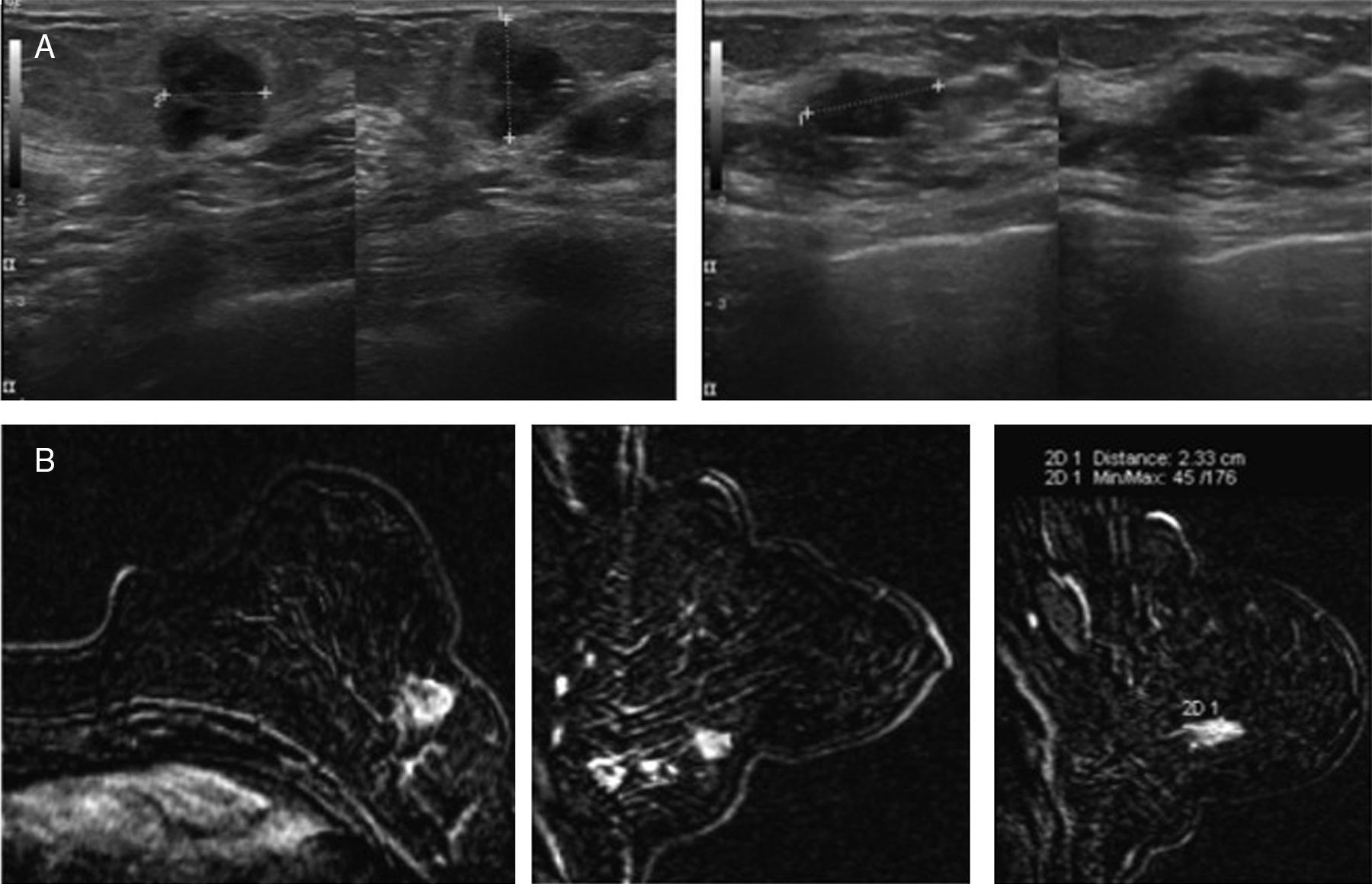
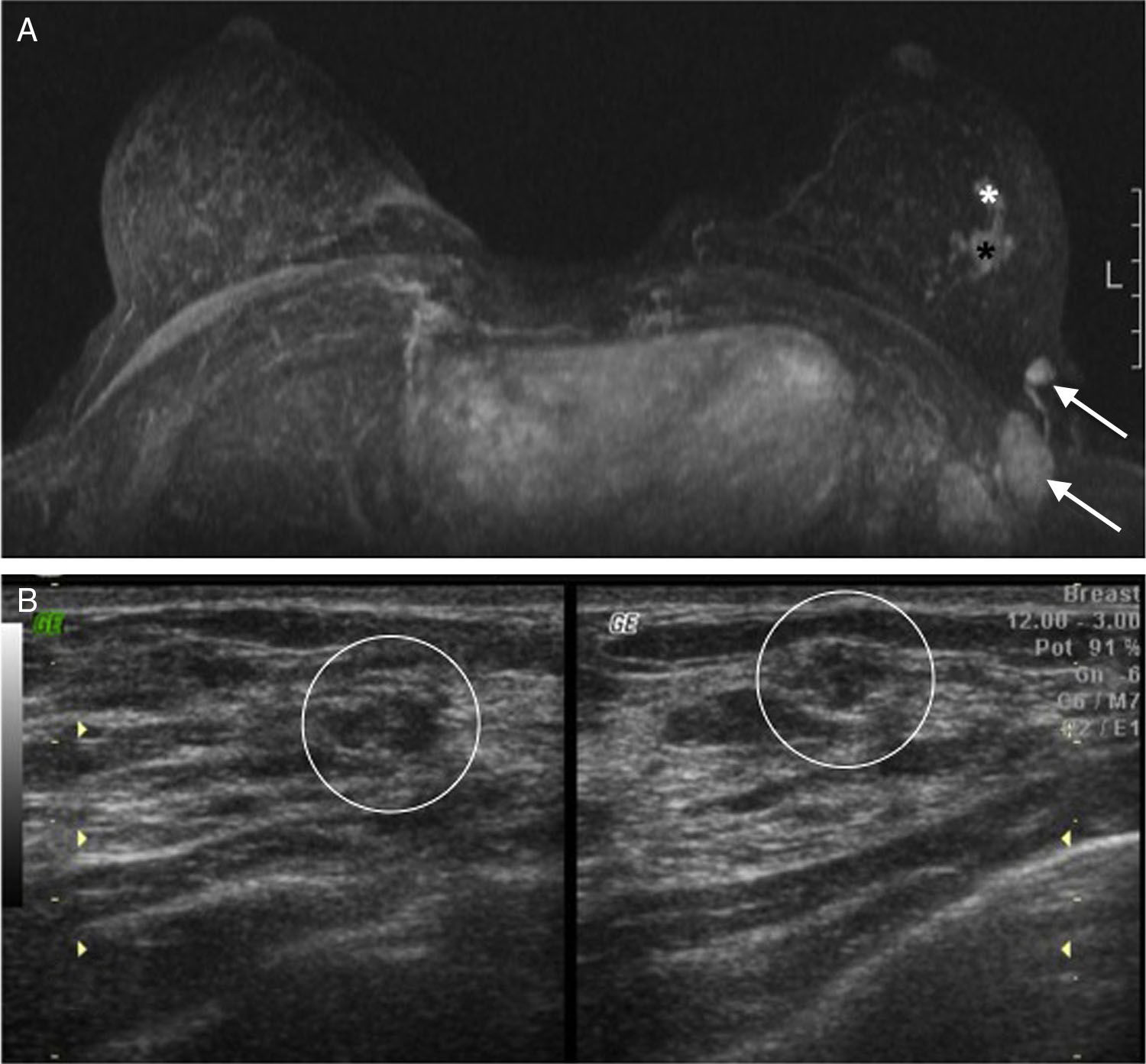
Caso n.° 2. Paciente de 57 años que consulta por masa palpable izquierda. Durante la exploración ecográfica (A) se observan varias masas sospechosas de distribución segmentaria que se correlacionan con los hallazgos en resonancia magnética (B). Determinación mediante MammaPrint®: riesgo alto.
La aparición de las plataformas génicas ha supuesto un respaldo importante a las prácticas de detección precoz, al demostrarse que los casos detectados precozmente presentan una firma genética más favorable7. Pero, además, posibilita la aplicación de terapias personalizadas y obtener unos mejores y más eficientes resultados, al seleccionar las pacientes que pueden beneficiarse, o no, de una terapia farmacológica sistémica, así como el tipo de esta1,4,5,8.
Entre las diversas plataformas comerciales, nuestro grupo de trabajo se inclinó por MammaPrint®. Dicha plataforma3, la primera aprobada por la Food and Drug Administration (FDA), es considerada por algunos autores9 la más eficiente y adecuada para establecer el pronóstico y elegir una terapia.
Al principio, la determinación del genotipo de los tumores mamarios mediante MammaPrint® requería muestras quirúrgicas frescas. Sin embargo, dos acontecimientos supusieron un notable avance al respecto. Por un lado, los trabajos de diversos autores10–13 que optimizaron técnicas que permitían obtener la expresión génica a partir de muestras muy pequeñas y, por otro, los resultados favorables4,12,14,15 para hacerlo a partir de los bloques de parafina, con resultados prácticamente equiparables a los obtenidos en muestras quirúrgicas15–17.
Pronto aparecieron publicaciones en las que se resaltaban las posibilidades de la BP con el uso de dicha plataforma, con muy escasas referencias bibliográficas en las que se especifique de manera clara la metodología seguida en la toma de BP, aunque en todas ellas el objetivo es la obtención de muestras adicionales, tras conocer el diagnóstico de malignidad.
En el año 2008 aparecen referencias bibliográficas18 acerca del uso de la BP ecoguiada sobre 50 pacientes, con agujas de 14 G, con un 70% de muestras (frescas) adicionales adecuadas para el análisis con MammaPrint®.
En el año 2011 aparecen referencias bibliográficas19 a partir de muestras obtenidas mediante biopsia asistida por vacío (BAV) ecoguiada, sobre 67 pacientes (en varios periodos), con agujas de calibre 11 G, y un porcentaje medio del 73% de muestras (tanto frescas como en bloques de parafina) adecuadas para el análisis. Como en el caso del trabajo de Mayordomo et al.18, las muestras se obtenían adicionalmente.
En el mismo año, Uribe et al20 publican una serie de 16 pacientes con tumores malignos (ya diagnosticados previamente) de hasta 2cm de tamaño, analizados con MammaPrint® a partir de muestras quirúrgicas adicionales recogidas con “punch” y BP, tanto por el cirujano (algunos casos) como por el anatomopatólogo (otros casos), sin especificar otros detalles metodológicos. El porcentaje notificado de muestras válidas fue del 53,75%, que los autores atribuyen a la poca eficacia del “punch” o a la fibrosis celular, asociada al pequeño tamaño de los tumores estudiados.
Dado que no hemos encontrado referencias bibliográficas sobre experiencias de metodología similar a la nuestra, con la exclusiva utilización de las muestras sobre las que se alcanzó el diagnóstico de malignidad para la determinación de la firma genética tumoral, nuestro porcentaje de muestras iniciales válidas (84,62%) no se puede comparar con el alcanzado por otros autores.
Resultaría razonable presuponer que el mayor porcentaje de células tumorales y, por lo tanto, la mayor probabilidad de obtener muestras válidas, dependería de los siguientes factores: tamaño tumoral, calibre de la aguja, número de muestras y tipo de muestreo realizado con la aguja durante las tomas (o factor operador).
En todos los casos realizamos la BP ecoguiada seleccionando el modo “largo” de corte de la aguja, porque creemos que ello garantiza obtener más células tumorales.
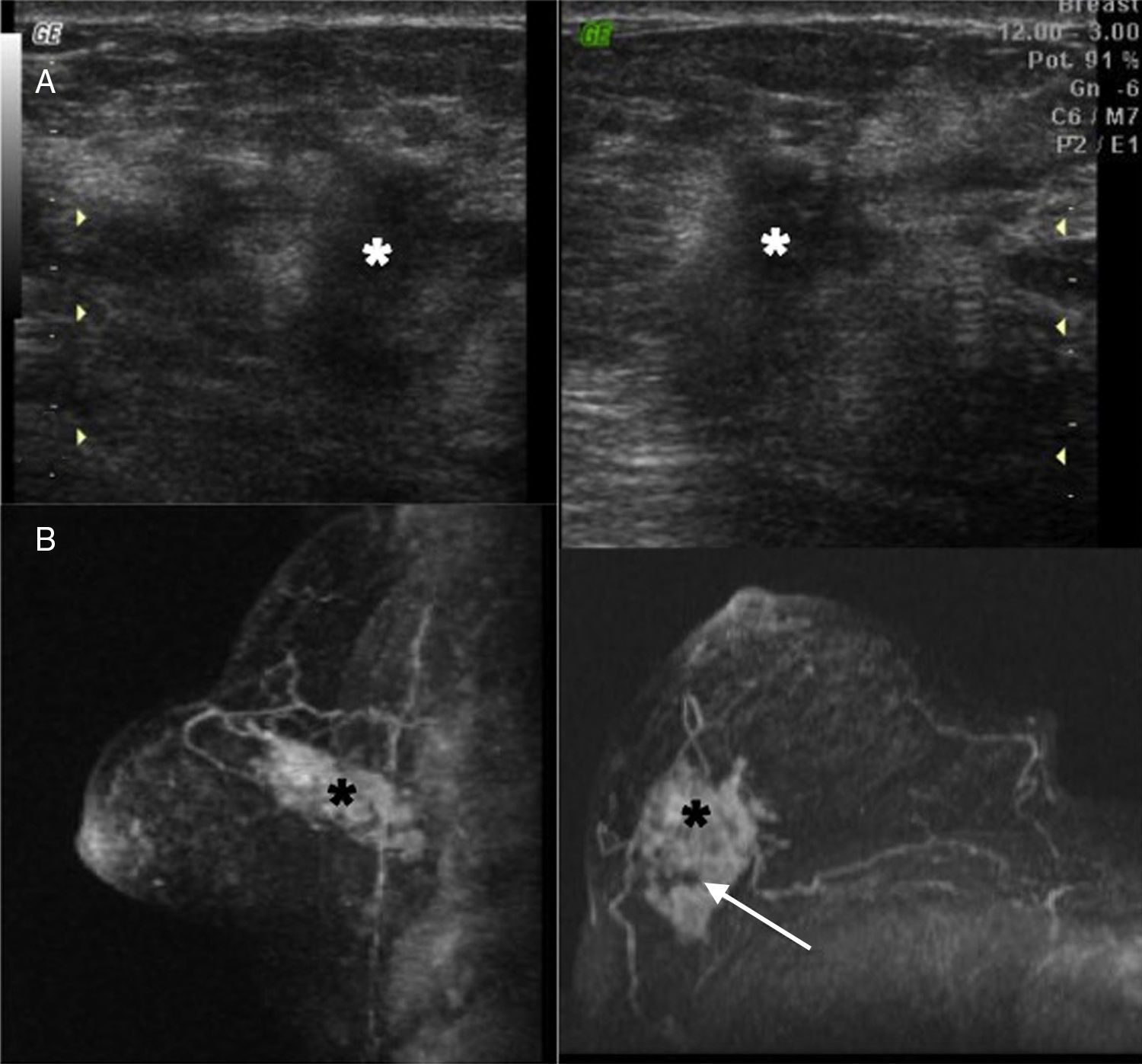
El único caso en el que la muestra no fue considerada válida por el laboratorio holandés (aunque sí por nuestro anatomopatólogo) correspondía al tumor de mayor tamaño (5cm) de nuestra serie (fig. 3). Podría especularse acerca de la posibilidad de haber biopsiado zonas necróticas del tumor, pero ello tan solo es una hipótesis.
Caso n.° 6. Paciente de 53 años que consulta por “bulto” derecho de varios meses de evolución. En ecografía (A) y resonancia magnética (B) masa (*) de 5cm que parece contener áreas heterogéneas en su interior (flecha), tal vez debidas a focos de necrosis. Determinación mediante MammaPrint®: no válida. Se procedió a análisis sobre muestra quirúrgica: riesgo alto.
El caso en el que hubo que repetir la toma correspondió a un tumor de 1cm (fig. 4). Sin embargo, en el caso n.° 3 (fig. 1), con un tamaño tumoral de 0,6cm, la muestra sí fue considerada válida. Por lo tanto y con arreglo a nuestra experiencia, no podemos afirmar que el porcentaje de muestras válidas guarde una relación directa con el tamaño tumoral.
Caso n.° 1. Paciente de 47 años que refiere bulto axilar izquierdo desde hace varios meses, con mamografía y palpación mamaria normales. El estudio ecográfico axilar muestra prominentes adenopatías axilares, que se biopsiaron con resultado de metástasis de probable tumor primario mamario. Se realiza resonancia magnética (A), confirmándose las adenopatías (flechas) y mostrando 2 masas adyacentes (*) de características sospechosas. El estudio ecográfico dirigido (B) mostraba sutiles hallazgos (círculos) correlacionables con los hallazgos de la resonancia. Se realiza biopsia percutánea ecoguiada del foco de mayor tamaño (1cm) con resultado de carcinoma infiltrante. Sin embargo y a juicio del anatomopatólogo, la muestra no contenía suficiente material para la determinación de MammaPrint®, por lo que hubo que repetirse la toma. Determinación mediante MammaPrint®: riesgo alto.
En todos los casos de muestras válidas se han obtenido porcentajes de células tumorales iguales o superiores al 60%, muy por encima del límite exigido por el laboratorio (30%), aunque tampoco podemos afirmar que el porcentaje alcanzado guarde clara relación con el tamaño tumoral. Así, se obtuvo un 60% en tumores cuyo tamaño oscilaba entre 0,6 y 3,2cm, y un 70% en tumores de 1,3-2,6cm.
Cabe plantearse la importancia del calibre de la aguja utilizada. En el trabajo de Osaki et al19, utilizando BAV ecoguiada con agujas de 11 G, se describen 3 periodos entre el total de casos y, en dos de ellos (de 16 y 28 pacientes), presentan porcentajes de muestras válidas de hasta 87,5% y 85,7%, respectivamente, discretamente superiores a los nuestros. Parecería lógico admitir que podría obtenerse un mayor porcentaje de tejido tumoral a partir de muestras extraídas con agujas de calibre 11 G, especialmente si se trata de BAV.
Otro de los factores a considerar sería el número de muestras extraídas, que en nuestra experiencia ha oscilado entre 3 y 4. Los datos bibliográficos son poco concretos al respecto. O bien no consta dicha información18,20 o bien existen referencias que hacen alusión a un número muy variable de muestras19. Con arreglo a nuestros resultados, creemos que 3 o 4 muestras, con agujas de calibre 12 G, podrían ser suficientes, teniendo en cuenta que se trata de un procedimiento de propósito inicialmente diagnóstico.
La realización de 3-4 pases con agujas de 12 G en las BAG ecoguiadas resulta habitual en nuestro grupo desde hace varios años, ante lesiones sospechosas de malignidad, porque es costumbre la solicitud de determinaciones inmunohistoquímicas, algo viable a partir de las muestras obtenidas con dicho calibre. De este modo, la determinación de Mammaprint® no ha supuesto cambios en nuestro protocolo rutinario que, con arreglo a los resultados, parece adecuado si se plantea la obtención del genotipo tumoral.
En cuanto al “factor operador”, en nuestro trabajo intervino un solo radiólogo, al igual que en los periodos en los que el grupo de Osaki et al19 obtuvo los mejores resultados, por lo que muy probablemente se trate de un factor tan importante o más que el calibre de la aguja o el tamaño tumoral. En este sentido, se recomienda realizar tomas en diversas zonas del tumor eludiendo las áreas de necrosis (si bien estas no siempre muestran una semiología ecográfica clara), evitando repetir la toma de muestras en la misma zona tumoral.
A pesar de las limitaciones del presente trabajo (retrospectivo y con escaso número de casos), y dada la alta proporción de muestras válidas (84,62%), concluimos que resulta posible obtener el perfil genético del cáncer de mama a partir de los bloques de parafina de la BP diagnóstica, en casi todos los casos de las masas malignas con traducción ecográfica, con 3-4 muestras obtenidas con agujas de 12 G, si el operador dispone de la suficiente experiencia.
Creemos que los resultados obtenidos posibilitan contemplar la posibilidad de añadir esta utilidad a la BP de propósito diagnóstico y permiten reforzar el papel del radiólogo en la planificación terapéutica del cáncer de mama.
Análisis e interpretación de los datos6. Tratamiento estadístico: JALR.
7. Búsqueda bibliográfica: JALR y JAMA.
8. Redacción del trabajo: JALR, IZE y JAMA.
9. Revisión crítica del manuscrito: JALR, IZE y JAMA.
10. Aprobación de la versión final: JALR, IZE y JAMA.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsable de la integridad del estudio: JALR, IZE y JAMA.
- 2.
Concepción del estudio: JALR.
- 3.
Diseño del estudio: JALR.
- 4.
Obtención de los datos: JALR, IZE y JAMA.
Los autores declaran no tener ningún conflicto de intereses.