El carcinoma papilar es el segundo renal en frecuencia. Su pronóstico es mejor que el del más frecuente carcinoma de células claras, aunque no en casos avanzados al no existir terapias específicas.
Se presenta como un tumor periférico circunscrito (pequeño y homogéneamente sólido o mayor quístico-hemorrágico) o como una lesión infiltrante e invasora de venas, con peor pronóstico.
Por su baja densidad vascular, el realce es menor que en otras neoplasias renales, lo que facilita su caracterización. En tomografía computarizada puede no realzar de manera concluyente, y entonces es indistinguible de un quiste hiperatenuante. La ecografía con contraste y la resonancia magnética son más sensibles para detectar vascularización. Son además característicos un patrón vascular específico, hipointensidad en T2, restricción de la difusión del agua y aumento de señal en fase opuesta.
Nuestro objetivo es presentar los aspectos genéticos, histológicos, clínicos y radiológicos de estas neoplasias, en cuyo manejo tiene un papel fundamental el radiólogo.
Papillary carcinoma is the second most common renal cell carcinoma. It has a better prognosis than the more frequent clear cell carcinoma, although this does not hold true for advanced cases, because no specific treatment exists.
It presents as a circumscribed peripheral tumor (small and homogeneously solid or larger and cystic/hemorrhagic) or as an infiltrating lesion that invades the veins, which has a worse prognosis.
Due to their low vascular density, papillary renal cell carcinomas enhance less than other renal tumors, and this facilitates their characterization. On computed tomography, they might not enhance conclusively, and in these cases they are impossible to distinguish from hyperattenuating cysts. Contrast-enhanced ultrasonography and magnetic resonance imaging are more sensitive for detecting vascularization. Other characteristics include a specific vascular pattern, hypointensity on T2-weighted images, restricted water diffusion, and increased signal intensity in opposed phase images.
We discuss the genetic, histologic, clinical, and radiological aspects of these tumors in which radiologists play a fundamental role in management.
La Organización Mundial de la Salud estableció en 2004 la clasificación vigente de los tumores renales, que modificaba las previas de Mainz (de 1986, morfológica) y Heidelberg (1997)1. El creciente protagonismo de los criterios genéticos supone una rápida evolución en esta clasificación, con introducción constante de nuevos conceptos y entidades.
El 90% de las neoplasias renales malignas del adulto son carcinomas de células renales (CCR), que representan un 2-3% del total2. Su diagnóstico crece a un ritmo de un 2% anual3, como consecuencia del empleo progresivo de las técnicas de imagen diagnósticas, pues su hallazgo es habitualmente incidental.
El tipo más frecuente de CCR es el carcinoma renal de células claras (crCCl), antiguamente llamado hipernefroma por la similitud de sus células, de citoplasma claro, con las adrenales. El segundo en frecuencia es el carcinoma papilar de células renales (cPcr), que se correspondería con el subtipo “eosinofílico” de la clasificación de Mainz y representa un 10-20% de todos los CCR diagnosticados1,4–6, un 64% de todos los que no son de células claras7. Que el tumor epitelial más frecuente en estudios histológicos, el adenoma renal, sea considerado su precursor, y el carácter hipovascular del cPcr, que dificulta su caracterización en estudios de imagen, hacen sospechar que podría estar infradiagnosticado. Son más infrecuentes los carcinomas renales de células cromófobas (crCCr) y otros subtipos.
La distribución por edad y sexo del cPcr es similar a la del crCCl, y afecta con mayor frecuencia a varones de mediana o avanzada edad. La preferencia por los varones es incluso más acusada en el cPcr, con ratios de 2-4:16,8,9. Una minoría de los cPcr (aproximadamente el 24%) son sintomáticos8.
Nuestro objetivo es presentar los aspectos genéticos, histológicos, clínicos y radiológicos de estas neoplasias, en cuyo manejo tiene un papel fundamental el radiólogo.
Histología, genética y subtipos del cPcrEl rasgo definitorio del cPcr es su arquitectura papilar predominante, con una estructura central fibrovascular (con macrófagos y cuerpos de psamoma en el estroma y una vascularización pobre y ordenada) cubierta por células con citoplasma escaso1,4.
En el subtipo 1 (cPcr1, antes “basofílico”), más frecuente, estas células son cuboides, con núcleos ovales pequeños y uniformes, y se disponen en una capa monoestratificada (fig. 1A). Estos tumores son casi siempre de grado Fuhrman 1-26.
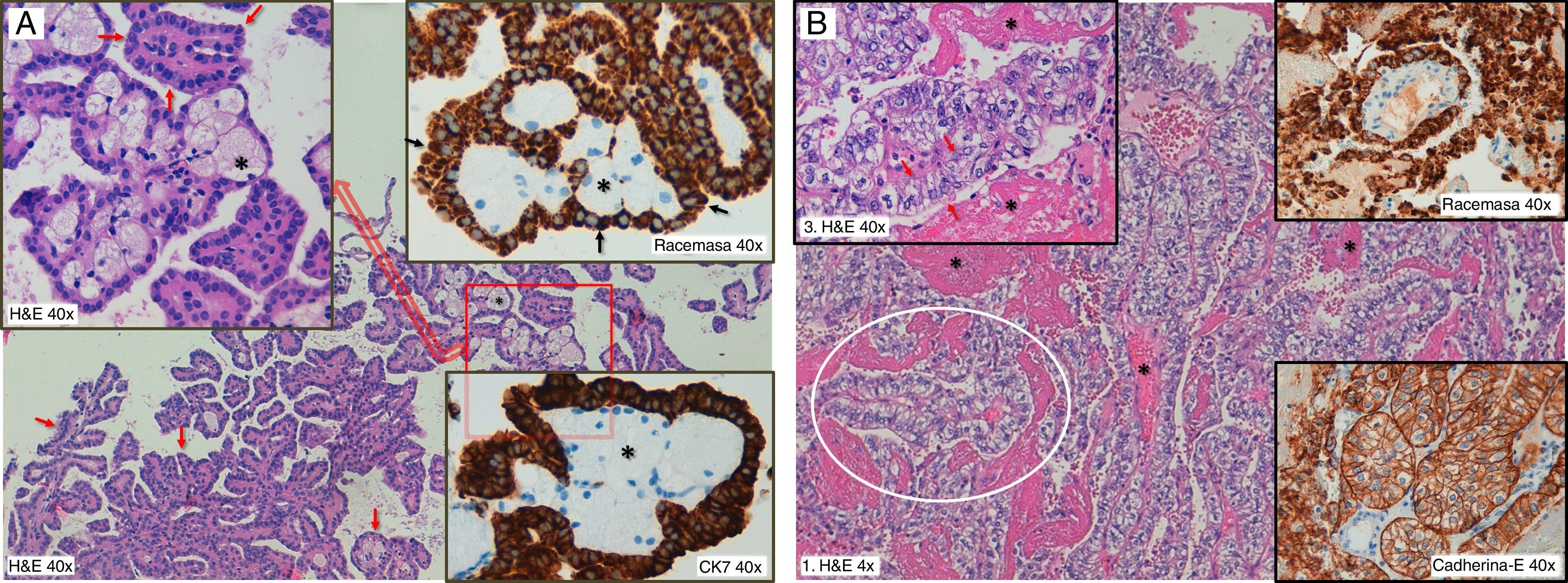
Hallazgos histológicos e inmunohistoquímicos típicos del cPcr. A) Tipo 1. Se aprecian células pequeñas con citoplasma escaso y núcleos uniformes ovalados, dispuestos en una capa con aspecto monoestratificado (flechas rojas), con una arquitectura papilar. En los centros de las papilas hay escasa vascularización, con macrófagos que tienen citoplasma vacuolado (*) y núcleos pequeños y uniformes. Hay tinción citoplasmática granular intensa con racemasa (flechas negras). Con CK7 hay también intensa positividad citoplasmática difusa, con refuerzo focal de membrana. B) Tipo 2. También se aprecia arquitectura papilar, con escasa vascularización, amplias áreas de degeneración necrótica y hemorrágica (*) y células tumorales prominentes (óvalo blanco). Estas células son mayores que en el tipo 1, con núcleos esféricos e irregulares y disposición seudoestratificada (flechas rojas). Tienen nucléolos prominentes y citoplasma más voluminoso y eosinofílico. En este caso hay intensa inmunotinción citoplasmática difusa con racemasa y de membrana con cadherina epitelial. Las tinciones con CK7 y EMA eran negativas, mientras que con CD10 había moderada positividad citoplasmática difusa, con refuerzo apical de membrana (no mostrados).
H&E: tinción con hematoxilina y eosina.
En el subtipo 2 (cPcr2, antes “eosinofílico”), que representa aproximadamente un 37,7%, estas células tienen núcleos esféricos más grandes, a menudo con mayor índice nuclear y atipia, y se disponen en una capa seudoestratificada (fig. 1B). Presentan con mayor frecuencia grado nuclear 3-45,6.
Aproximadamente un 17% no pueden clasificarse en uno de estos subtipos y se consideran indeterminados5,6.
Hay autores que sugieren que el adenoma papilar sería precursor del cPcr, con una secuencia evolutiva similar a la que lleva del adenoma colorrectal al carcinoma2. El adenoma es un nódulo sólido milimétrico con arquitectura tubulopapilar y mecanismos genéticos similares a los del cPcr, que se encuentra con mucha frecuencia en la corteza renal (10-40% de los especímenes)1,4.
Un pequeño porcentaje de cPcr puede presentar células con citoplasma claro más abundante. Además, no es excepcional que otros CCR, incluidos los crCCl, contengan focos relativamente extensos con arquitectura papilar; todo lo cual puede dificultar el diagnóstico histológico6.
El carcinoma renal papilar de células claras es una entidad independiente del cPcr y del crCCl, con un perfil genético también distinto. Se trata de un tumor bien delimitado, con estructuras papilares que proliferan en espacios quísticos, delineadas por células con citoplasma claro4. Es indolente y puede asociarse a nefropatía avanzada.
Respecto al perfil inmunohistoquímico del cPcr, es bastante similar en los tipos 1 y 2, con mayor frecuencia de expresión de citoqueratina 7, EMA, racemasa en cPcr1 y de CD10, PAX2 y cadherina-E en cPcr26, aunque sin que ninguna combinación permita el diagnóstico como criterio único (fig. 1).
El aspecto macroscópico más frecuente es el de una masa sólida bien circunscrita por una seudocápsula. Al corte es amarillenta-marronácea por la existencia de macrófagos cargados de hemosiderina4. Puede presentarse, sobre todo las lesiones grandes, como una masa quística intrínsecamente o por degeneración necrótica y/o hemorrágica (presumiblemente por la baja vascularización), con áreas sólidas periféricas con crecimiento de aspecto “papilar” (concepto que no debe confundirse con el microscópico). En algunas series, los fenómenos degenerativos se describen como más frecuentes en los cPcr26.
La cuestión del perfil genético de los CCR está adquiriendo gran protagonismo en la delimitación de las entidades, su estratificación pronóstica y el desarrollo de tratamientos dirigidos. Así, el comportamiento relativamente homogéneo de los crCCl, un 70% de los cuales presentan una inactivación bialélica del gen Von Hippel-Lindau, está permitiendo el desarrollo de un eficaz arsenal terapéutico frente a este tumor.
En el cPcr, sin embargo, los mecanismos genéticos son más variables. Se han identificado 11 mutaciones significativas en estudios de secuenciación completa del exoma5. En los cPcr1 hay un comportamiento relativamente homogéneo, con alteración de la vía MET (mesenchymal epithelial transition) (81%). Los cPcr2 son genéticamente mucho más heterogéneos, si bien el hecho dominante es la alteración de la vía Nrf2-ARE (nuclear factor E2-related factor 2-antioxidant response element). Se diferencia un subgrupo de tumores con fenotipo CIMP (CpG island methylator phenotype), con mutación en el gen FH (fumarate hidratase), que afecta a mujeres más jóvenes y con un pronóstico especialmente malo. Probablemente pronto asistamos al desarrollo de terapias dirigidas y a la reclasificación de algún subtipo de tumor ahora considerado entre los cPcr25,10.
Pronóstico y tratamiento del cPcrEn términos generales, el cPcr (supervivencia a 5 años: 82-92%) tiene un pronóstico mejor que el crCCl (44-69%) y similar al crCCr (78-92%)7,8,11,12. El grado nuclear y la estadificación TNM son en general inferiores al inicio. Solo un 4-6% de CCR metastásicos al diagnóstico son cPcr13–15, y presentan entonces un peor pronóstico que el crCCl (supervivencia media de 9,1 meses frente a 22), probablemente por la ausencia de terapias dirigidas2,6. Los cPcr descritos con invasión de grandes venas (figs. 2 y 3) son de tipo 2 y presentan un pronóstico también peor que los crCCl con el mismo fenómeno16,17. Otros predictores pronósticos son: la existencia de sintomatología; el grado nucleolar (en algún estudio mejor que el nuclear)1,12; los cambios sarcomatoides; el tamaño; la necrosis tumoral1,12; el fenotipo CIMP5, y la presentación en resonancia magnética (RM) como masa con crecimiento infiltrante y afectación venosa, presente en un pequeño porcentaje de cPcr2 y que se comporta como predictor pronóstico independiente18.
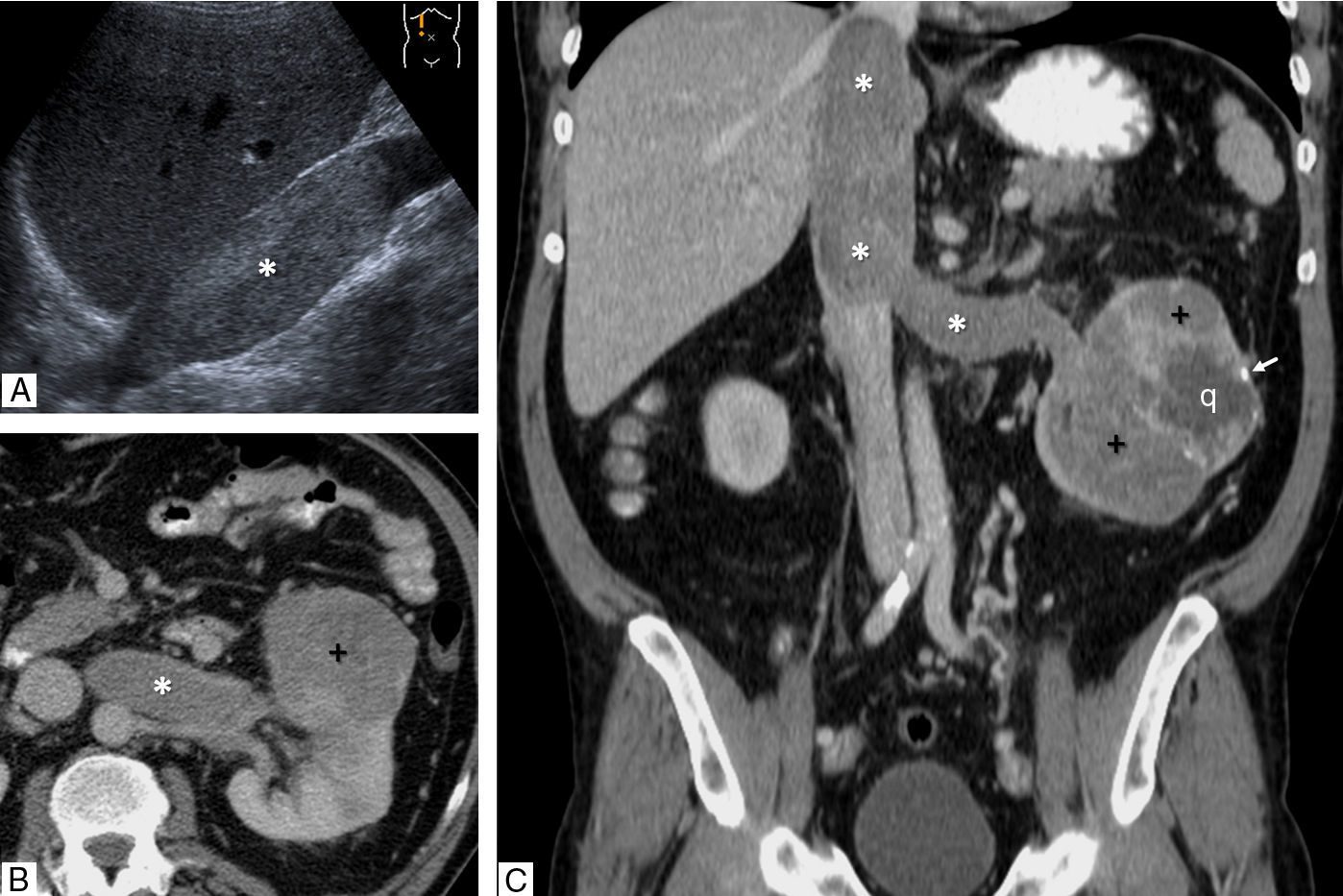
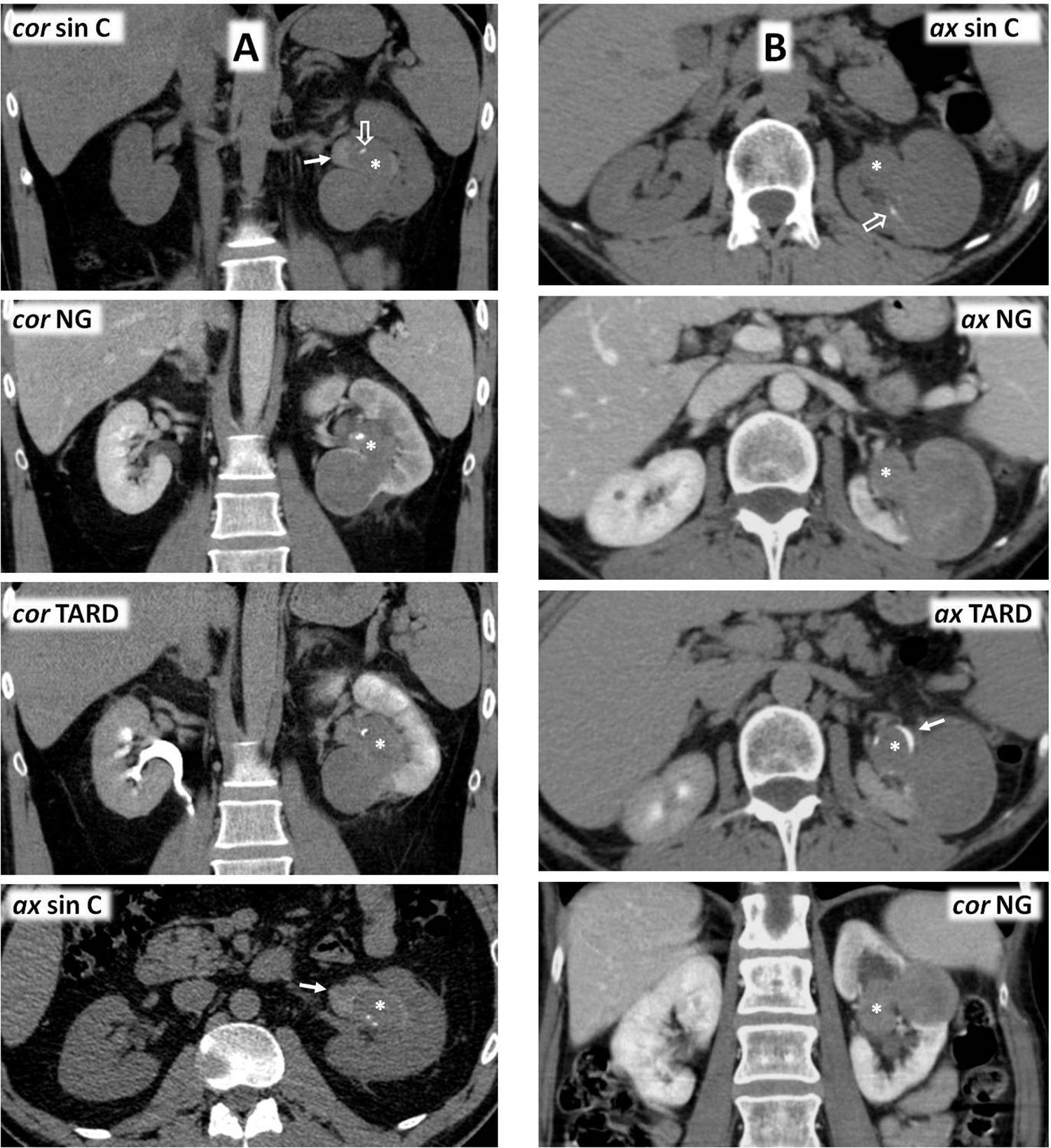
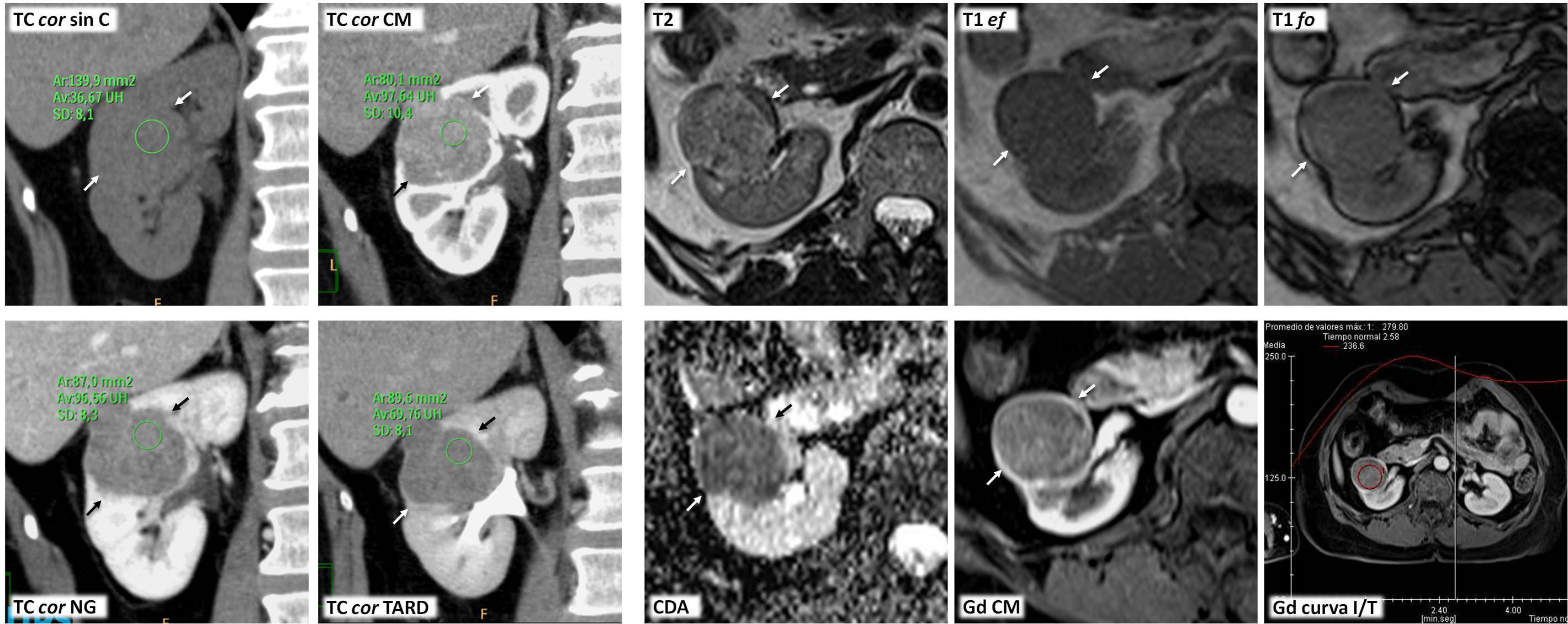
Carcinoma papilar de células renales tipo 2 con trombosis venosa tumoral en un varón de 59 años con dolor en flanco izquierdo y hematuria. A) Corte parasagital derecho de ecografía. Ocupación ecogénica expansiva de la vena cava inferior (*), que alcanza el nivel del diafragma. B y C) Tomografía computarizada con contraste en fase nefrográfica (B: axial; C: coronal). Tumor sólido hipocaptante (+) con focos quísticos (q) y algunas calcificaciones (flecha), que se acompaña de trombo, también hipocaptante (*) y expansivo ocupando la vena renal y extendiéndose a la cava inferior hasta el nivel de la desembocadura de las venas suprahepáticas (nivel III de la clasificación de la clínica Mayo; T3b en la clasificación TNM).
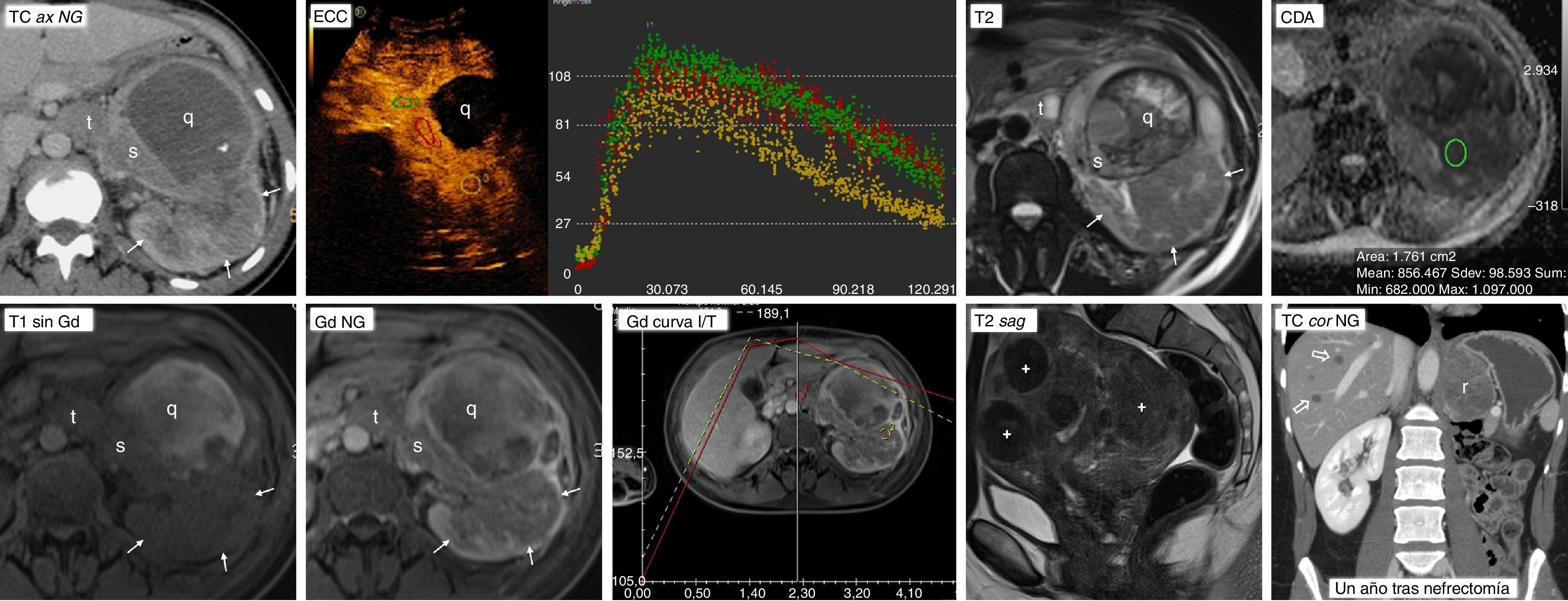
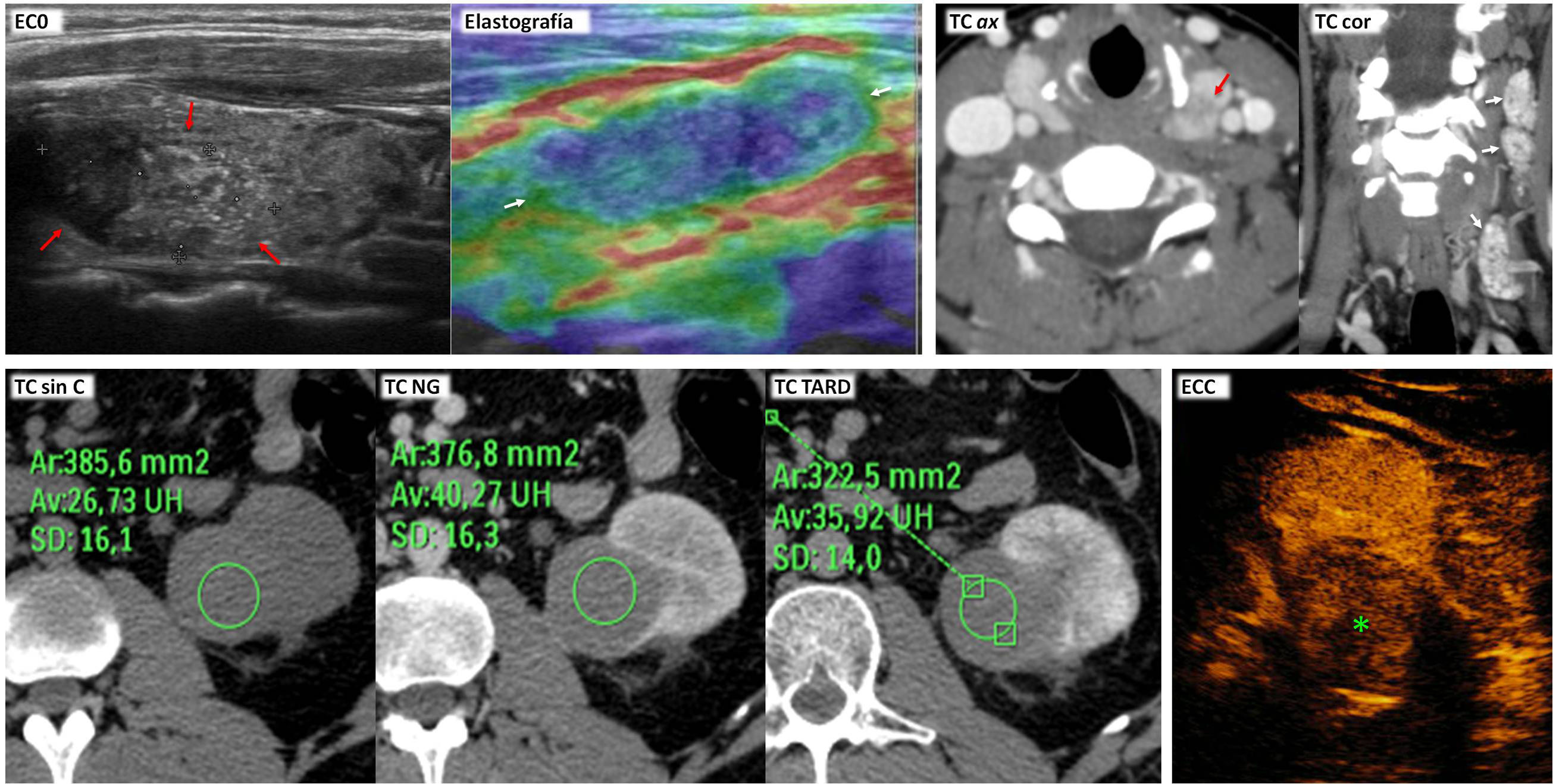
Carcinoma papilar de células renales tipo 2 con patrón de crecimiento infiltrante e invasión venosa. Síndrome de leiomiomatosis y carcinoma renal hereditario. Mujer de 26 años que acude por fiebre alta. En ecografía urgente se aprecia una masa renal izquierda (no mostrada), que en tomografía computarizada (TC ax NG) se comporta como una masa infiltrante con límites imprecisos (flechas) y con un componente quístico anterior (q) que a su vez presenta polos sólidos periféricos (s). Hay un trombo en la vena renal izquierda (t). Al día siguiente se completa el estudio con ecografía con contraste (ECC), que demuestra un realce similar en el trombo tumoral (ROI y curva verdes), en las áreas sólidas del componente quístico (rojos) y en las regiones donde la neoplasia tiene un comportamiento infiltrante (amarillos). Este realce es más intenso y rápido de lo que se ve habitualmente en carcinomas papilares. Las áreas quísticas no realzan. También se realizó resonancia magnética (RM). Tanto las áreas infiltrantes como las sólidas del componente quístico y el trombo tumoral muestran una intensidad de señal intermedia en T2, más alta de lo que es habitual en carcinomas papilares. En las áreas quísticas el comportamiento es heterogéneo, con un halo hipointenso por hemosiderina. Hay marcada restricción de la difusión del agua en todas las áreas sólidas, con valores de coeficiente de difusión aparente (CDA) de 0,86×10−3 mm2/s. En este caso es probable que esto refleje más la agresividad tumoral que hipovascularización. Las áreas quísticas muestran alta señal en T1 por hemosiderina, mientras que la de las áreas sólidas es intermedia. Estas presentan un realce algo más intenso y rápido de lo que es habitual en carcinomas papilares. Véase la buena correlación de las curvas de intensidad tiempo (Gd curva I/T) en el trombo tumoral (roja) y la parte infiltrante de la neoplasia (amarillo) con respecto a las de la ecografía. No obstante, la escala está truncada en el eje de las ordenadas, lo que da una impresión visual de un mayor realce. El máximo es en realidad de un 84%. La paciente tenía también abundantes leiomiomas uterinos, que se muestran en una imagen sagital potenciada en T2 de la pelvis (T2 sag) como marcadamente hipointensos (+), algunos con límites más imprecisos. También presentaba leiomiomas cutáneos. Se realizó nefrectomía radical y el resultado fue de carcinoma papilar tipo 2, con crecimiento muy infiltrante y trombosis venosa tumoral. Aunque no se hizo estudio genético, probablemente correspondiera al subtipo de fenotipo CIMP, en un contexto de síndrome de leiomiomatosis y carcinoma renal hereditario. Un año después (TC cor NG) presentó una recidiva local (r) y metástasis hepáticas hiporrealzantes (flechas huecas); falleció pocos meses más tarde.
El subtipo 2 supone globalmente un peor pronóstico que el 11,4,12. Sin embargo, corrigiendo factores como el grado nuclear, tamaño, estadio tumoral o la forma de presentación en RM, no es un predictor independiente6,18,19. En un amplio estudio multiinstitucional no hay diferencias pronósticas por subtipos en pacientes sometidos a cirugía local20.
Como en otros CCR, el tratamiento de elección en formas localizadas es quirúrgico: nefrectomía parcial en estadio IA, parcial o total en IB y radical en II y III11,21. El tratamiento percutáneo con radiofrecuencia, microondas o crioablación ha demostrado seguridad y buenos resultados oncológicos en estadio IA (aunque hay pocos estudios aleatorizados y específicos en cPcr) (fig. 4), especialmente en tumores pequeños, exofíticos y posteriores11,22. Por su mejor pronóstico y mayor tendencia a la multifocalidad y bilateralidad, algunos autores sugieren un abordaje más conservador, cuando se comportan como lesiones bien definidas y con estadios bajos22,23. Todo ello indica el importante papel de las pruebas de imagen, incluyendo el de la RM, en la selección de pacientes con cPcr candidatos a seguimiento activo15,18 y el confirmativo de la biopsia percutánea.
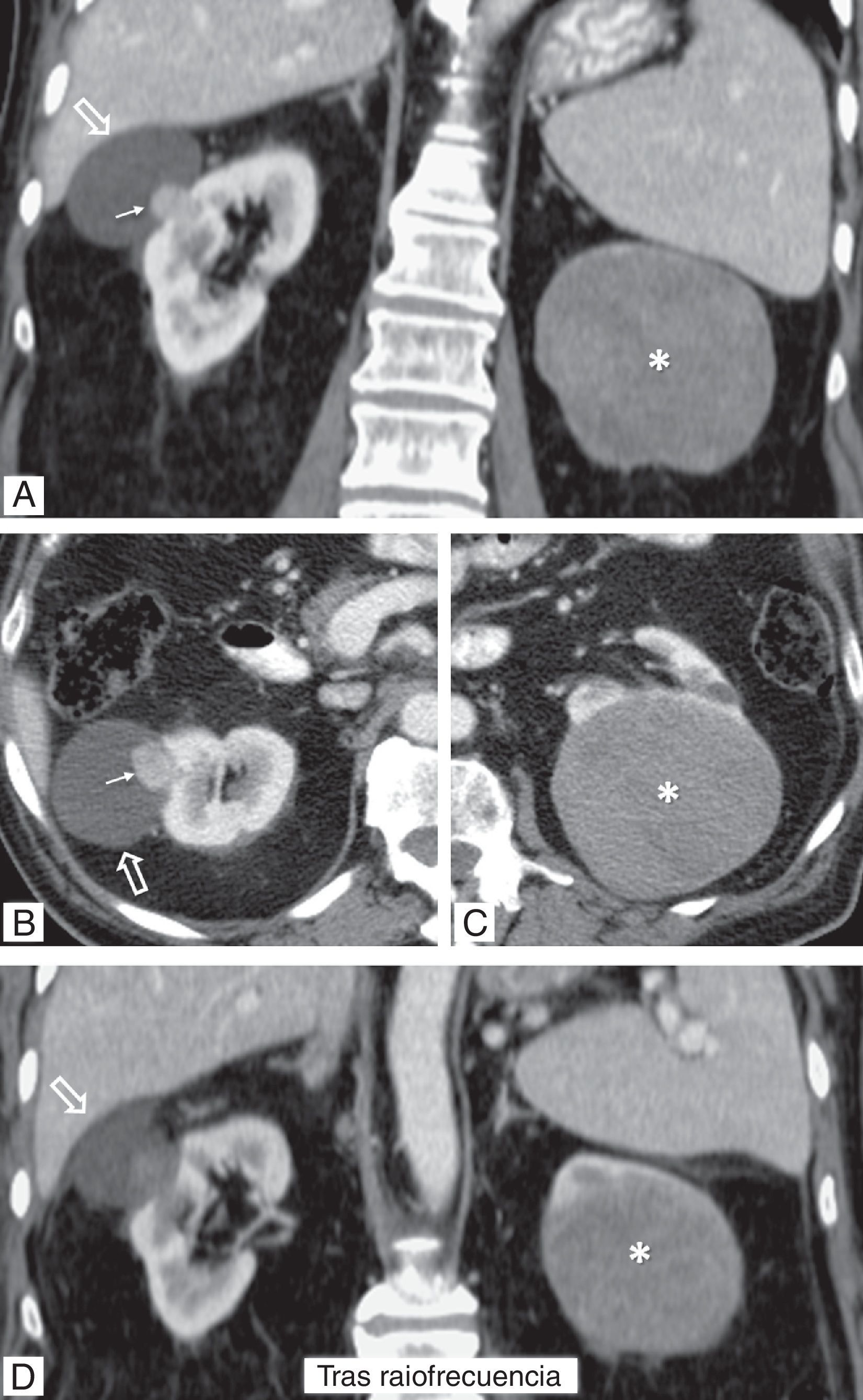
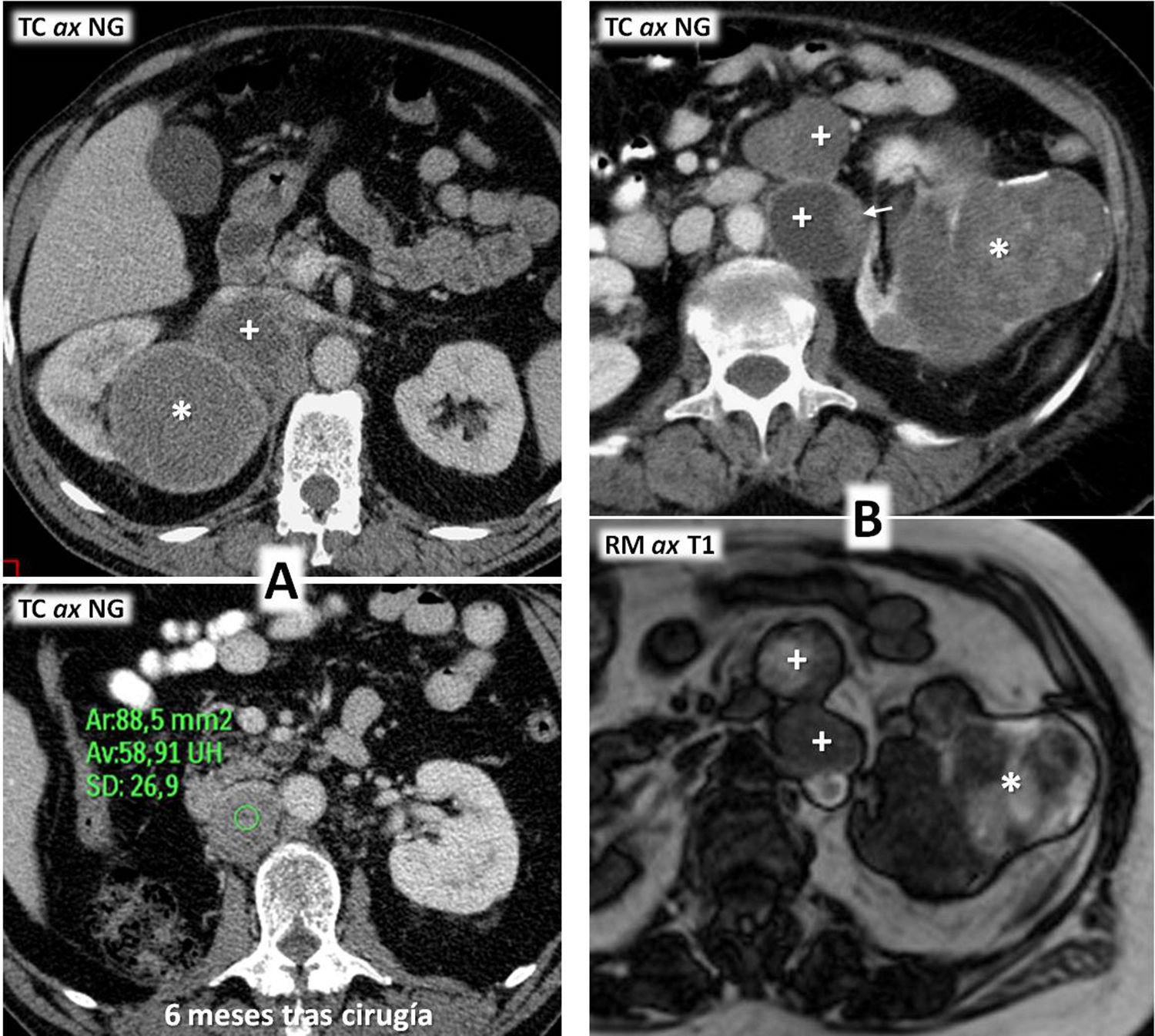
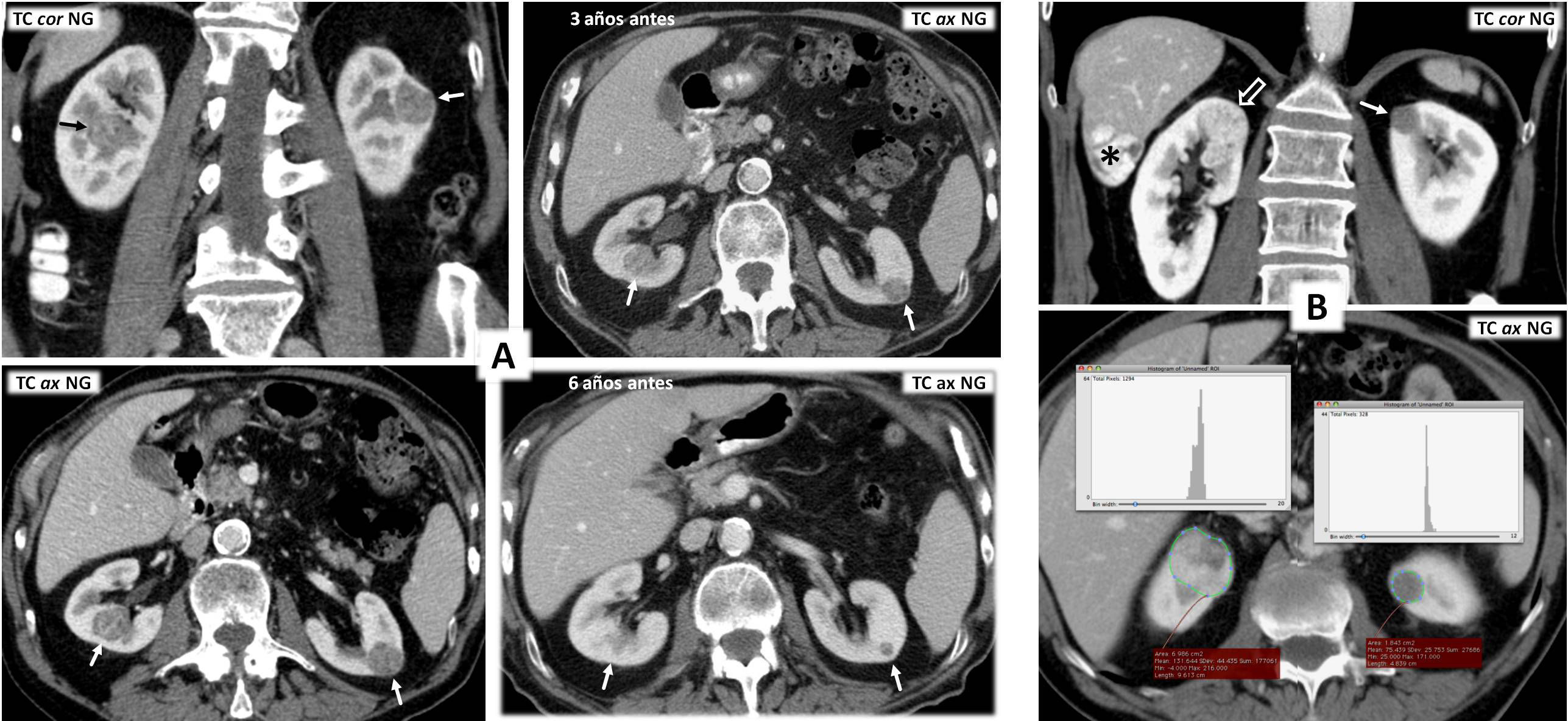
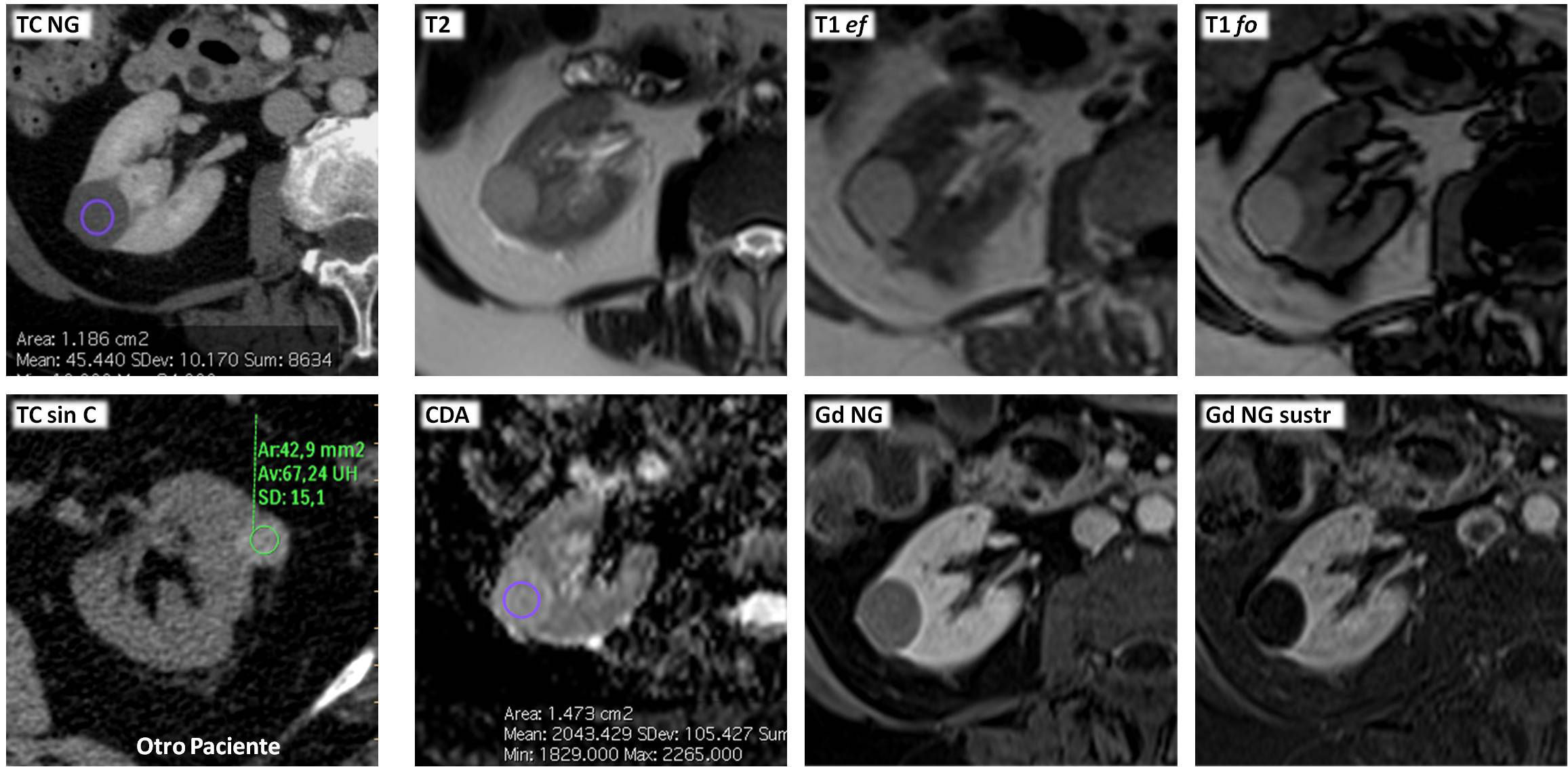
Carcinoma renal papilar hereditario. Varón de 76 años. Hallazgo incidental ecográfico de sendas tumoraciones renales (no mostradas). Tomografía computarizada en fase nefrográfica. A) Coronal. B y C) Axial, en los niveles de las lesiones derecha e izquierda, respectivamente. D) Coronal, un día después del tratamiento percutáneo con radiofrecuencia del componente sólido de la lesión derecha. Hay una masa quística exofítica en el riñón derecho (flecha hueca), con un nódulo sólido periférico (flecha), que realza menos que la corteza renal. En el riñón contralateral hay una gran masa con contenido ecogénico complejo (no mostrado) y baja atenuación global, sin realce demostrado (*). Se realizó una biopsia percutánea del componente sólido de la lesión derecha, con el resultado de carcinoma papilar de células renales tipo 1. Se realizó radiofrecuencia guiada ecográficamente de este polo sólido y en el estudio de control 24h después del procedimiento no se demuestra realce alguno de la lesión. Tres meses después el paciente fue sometido a nefrectomía total izquierda, y en anatomía patológica se encontró una masa quística hemorrágica bien definida, con papilas sólidas que cumplían criterios histológicos e inmunohistoquímicos de carcinoma papilar de células renales tipo 1, además de numerosos adenomas papilares milimétricos. Se realizó estudio genético, que demostró una mutación germinal en el gen MET. Cuatro años después no hay evidencia de recidiva de su tumor renal derecho ni aparición de otros nuevos.
Tras la descripción de sus características genéticas, el tratamiento del crCCl en estadio avanzado experimentó una revolución desde el año 2006 con el desarrollo de fármacos antiangiogénicos contra el VEGF (vascular endothelial growth factor), su receptor, híbridos, análogos o la vía tirosina cinasa (sunitinib y sorafenib inicialmente, a los que se han ido añadiendo otros), así como inhibidores de la vía mTOR (mammalian target of rapamycin) (everolimus, temsirolimus, etc.), en general como segunda línea24,25. Las terapias citotóxicas e inmunológicas previas a las moleculares tuvieron malos resultados en cPcr avanzados24. Aunque hay un beneficio probado del sunitinib en CCR de células no claras, es mucho menor que en crCCl24,25. Los estudios son heterogéneos y pocos focalizados en el cPcr. Se esperaría que los fármacos enfocados a la vía MET fueran eficaces en cPcr1. Algún estudio muestra resultados discretamente positivos del temsirolimus24, otros peores de lo esperado con everolimus26 y otros mejores del foretinib en casos seleccionados con mutación germinal en MET25. Hay numerosos ensayos en curso con diversos fármacos25,26, y se espera que los recientes hallazgos genéticos permitan avances notables en un futuro a medio plazo5,25.
Factores generales que condicionan el comportamiento radiológico del cPcrPor su apariencia macroscópica, una mayoría son tumores corticales pequeños, sólidos, homogéneos y bien delimitados (figs. 5 y 6). Un 5-13%, en general mayores de 3-4cm, con independencia del subtipo27,28, se presentan como masas quísticas, también bien delimitadas, con contenido hemorrágico o necrótico y focos sólidos papilares periféricos2,9,11,29 (fig. 7). Hay discrepancias respecto a si la presentación quística es más o menos habitual que en el crCCl2,9,30, aunque sí que es con más frecuencia unilocular y hemorrágica. Una tercera apariencia, muy rara (2-7%) y con mucho peor pronóstico, es la de una masa con crecimiento infiltrante y tendencia a invadir venas grandes18,29 (fig. 3). Es probable que estos tumores se correspondan con el subtipo de cPcr2 con fenotipo CIMP, más frecuente en mujeres jóvenes. La invasión del sistema excretor es también más habitual en este grupo, aunque puede verse en otros (fig. web 1).
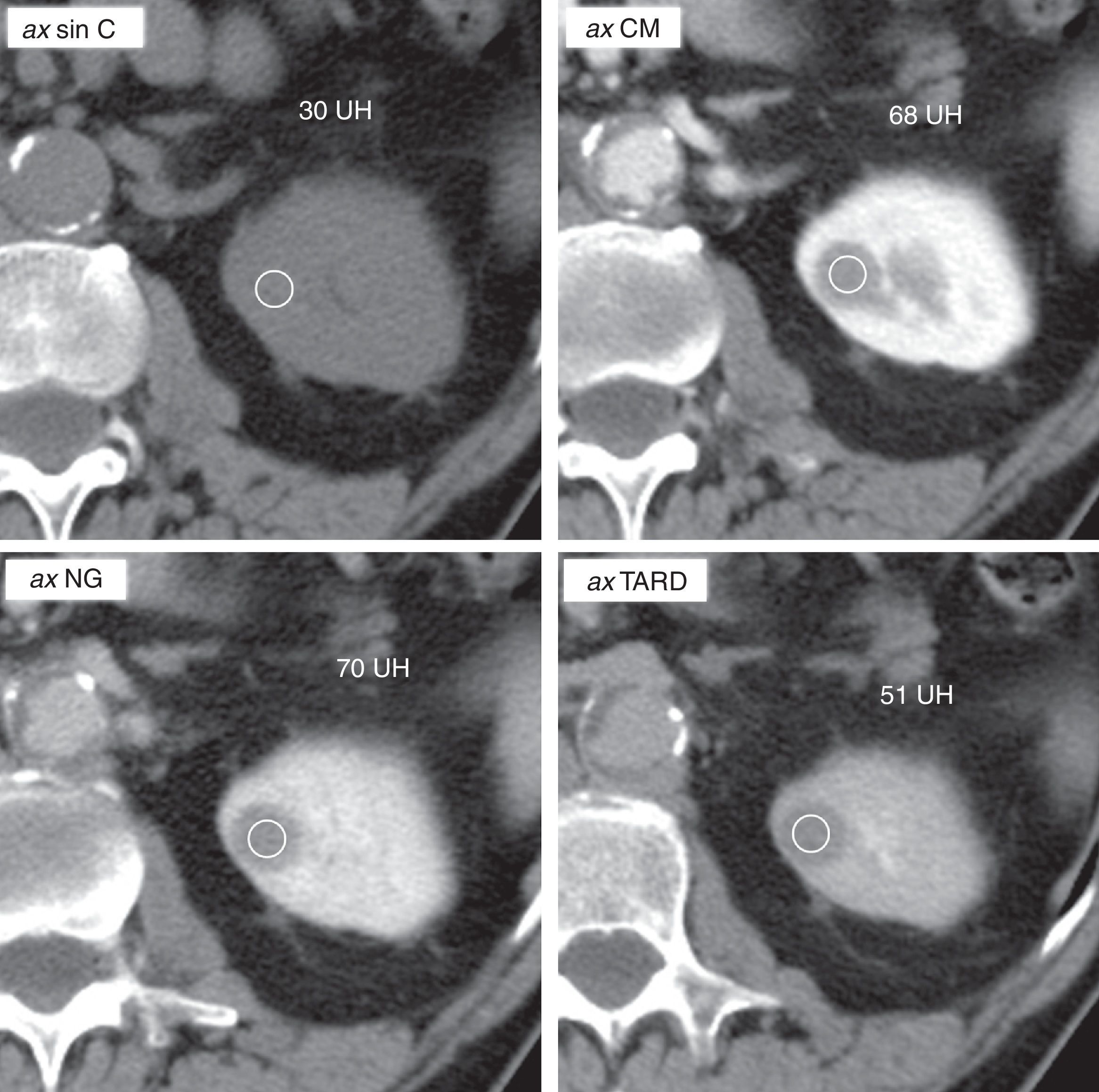
Hallazgos típicos de un carcinoma papilar tipo 1 pequeño en tomografía computarizada (TC) multifásica. Varón de 68 años. Hallazgo incidental ecográfico de un pequeño tumor cortical sólido en el riñón izquierdo (no mostrado). En TC es homogéneo, perfectamente delimitado y muestra valores de atenuación discretamente mayores que el parénquima renal en el estudio sin contraste (promedio de 30 UH en la ROI). El realce es discreto, y alcanza su máximo en la fase nefrográfica (realce absoluto: 40 UH; porcentaje de realce: 133%; ratio de realce respecto de la corteza renal: 0,29). La fase en la que el contraste con el parénquima renal es mayor, y por lo tanto su definición mejor, es la nefrográfica.
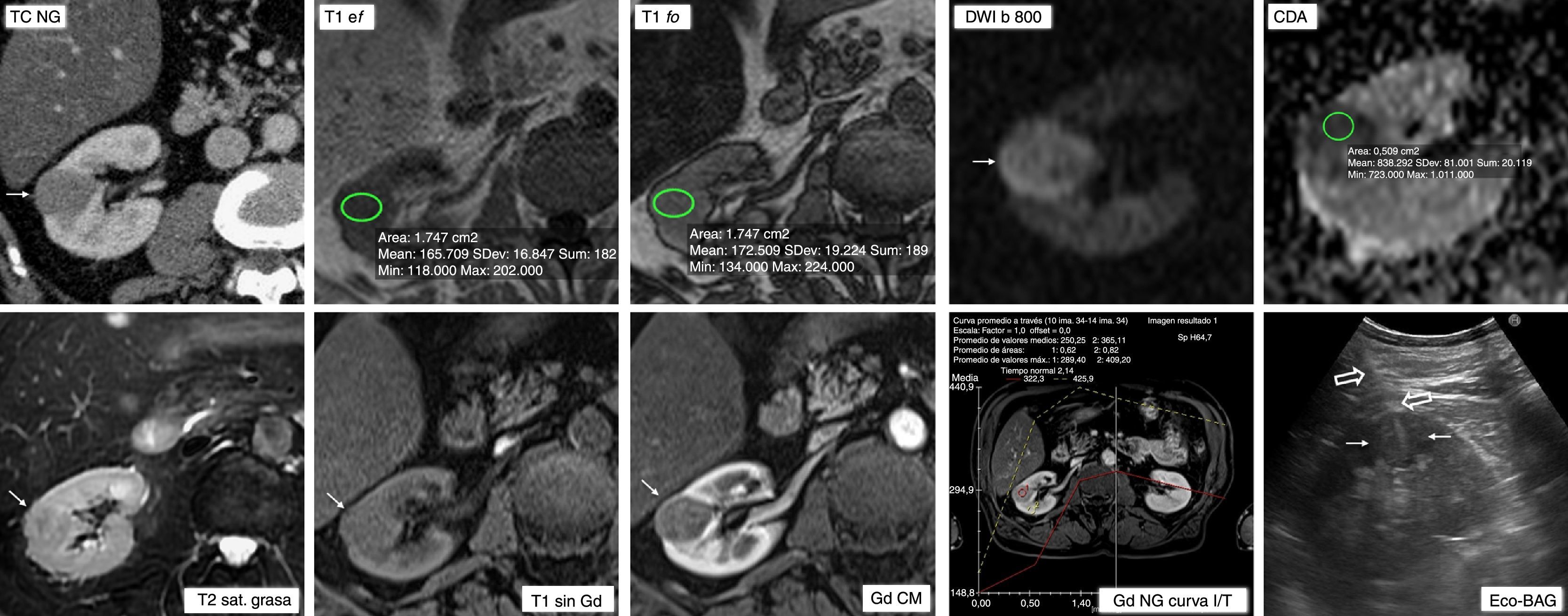
Carcinoma papilar de células renales tipo 1 que se presenta como nódulo cortical sólido homogéneo y bien definido. Varón de 74 años con diagnóstico de granulomatosis con poliangitis (vasculitis de Wegener) con datos clínicos de nefropatía. En el estudio ecográfico, por la existencia de datos clínicos de nefropatía, se identifica una lesión nodular sólida isoecogénica de 2cm en el riñón derecho (no mostrado). En tomografía computarizada (TC) con contraste en fase nefrográfica (TC NG) esta lesión tiene bordes nítidos, es homogénea y marcadamente hipocaptante con respecto al parénquima renal (flecha), con un realce absoluto de 38 UH (no mostrado). En resonancia magnética se muestra como hipointensa en T2 (con saturación espectral de la grasa en la secuencia mostrada). Aunque discreto, muestra un aumento de señal del 4,35% en la secuencia en fase opuesta (T1 fo) con respecto a la secuencia en fase (T1 ef), con corregistro de ROI. Presenta alta señal en la secuencia potenciada en difusión con valor alto de b (DWI b 800) y bajo coeficiente de difusión aparente (CDA), de 8,4×10−3 mm2/s. En T1 sin gadolinio (Gd) es prácticamente isointensa respecto al parénquima, y muestra escaso realce tanto en fase corticomedular (CM) como nefrográfica (NG). En la curva de intensidad respecto a tiempo del estudio dinámico de realce con el contraste (Gd NG curva I/T) la lesión presenta realce más tardío (curva roja, con pico en fase nefrográfica) que el parénquima renal (curva amarilla), con un porcentaje de realce máximo del 82%. La sensación de realce en la curva es mayor por estar truncado el eje de ordenadas. Se decidió realizar biopsia con aguja gruesa guiada ecográficamente (Eco-BAG) tanto de la lesión (flechas huecas) como del parénquima renal, con diagnóstico de carcinoma papilar de células renales tipo 1 con bajo grado histológico en la primera y glomerulonefritis focal con necrosis fibrinoide segmentaria (compatible con vasculitis asociada a anca positivos) y nefritis intersticial focal en la segunda. Contemplando la nefropatía, la histología y el pronóstico de la lesión y su edad, el paciente optó por someterse a seguimiento activo de su tumor renal. Tres años después ha experimentado un crecimiento de apenas 3mm en su eje mayor.
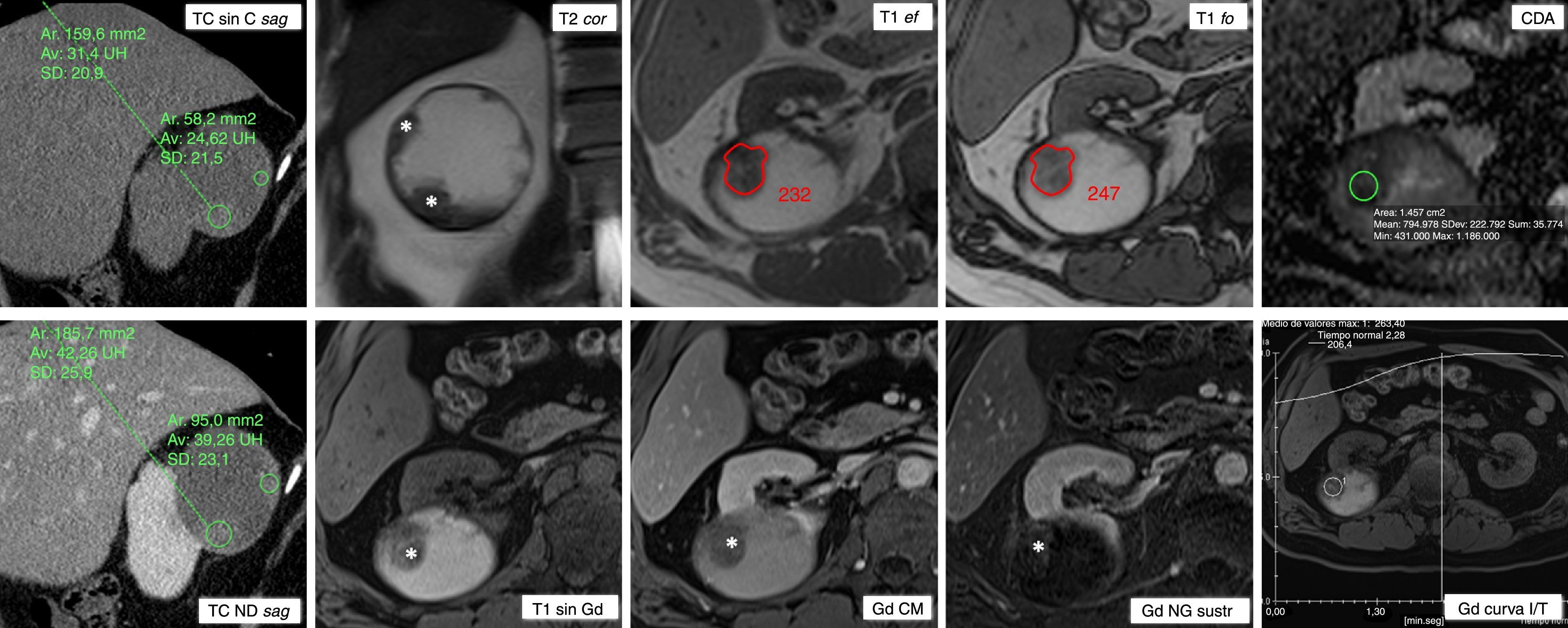
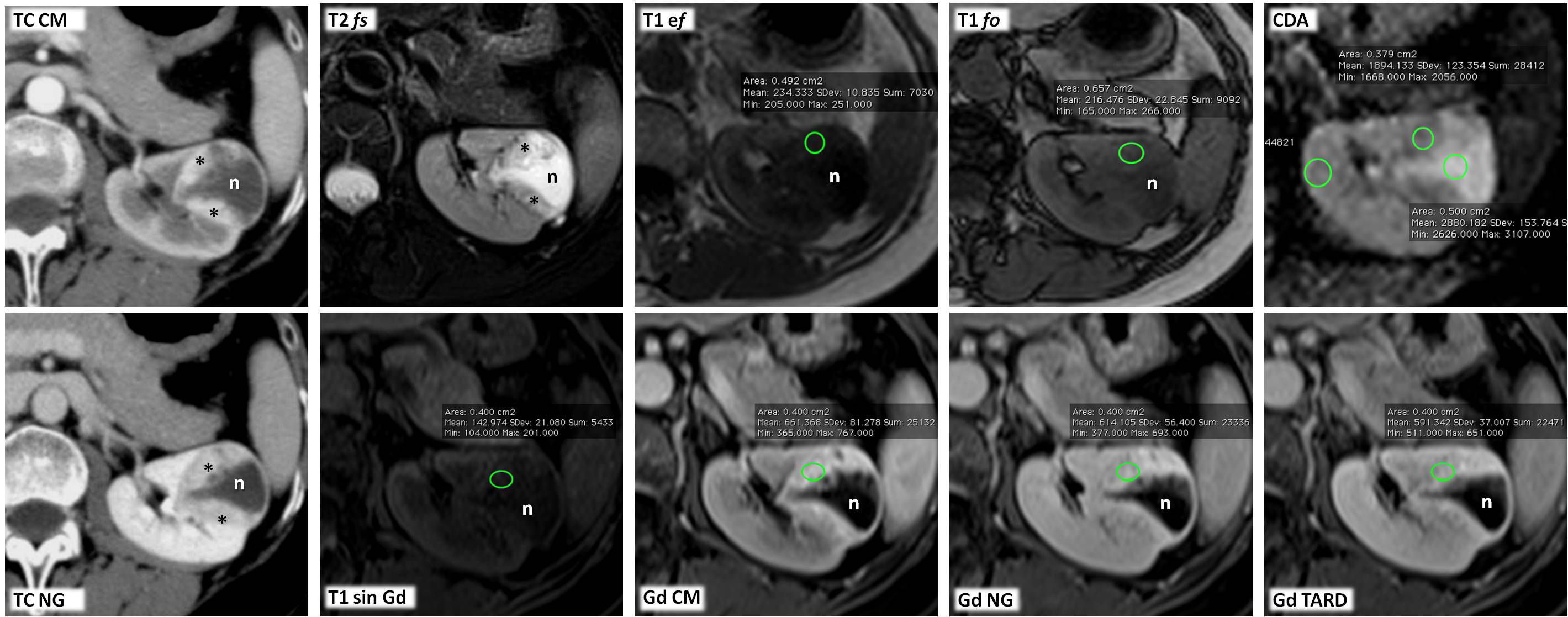
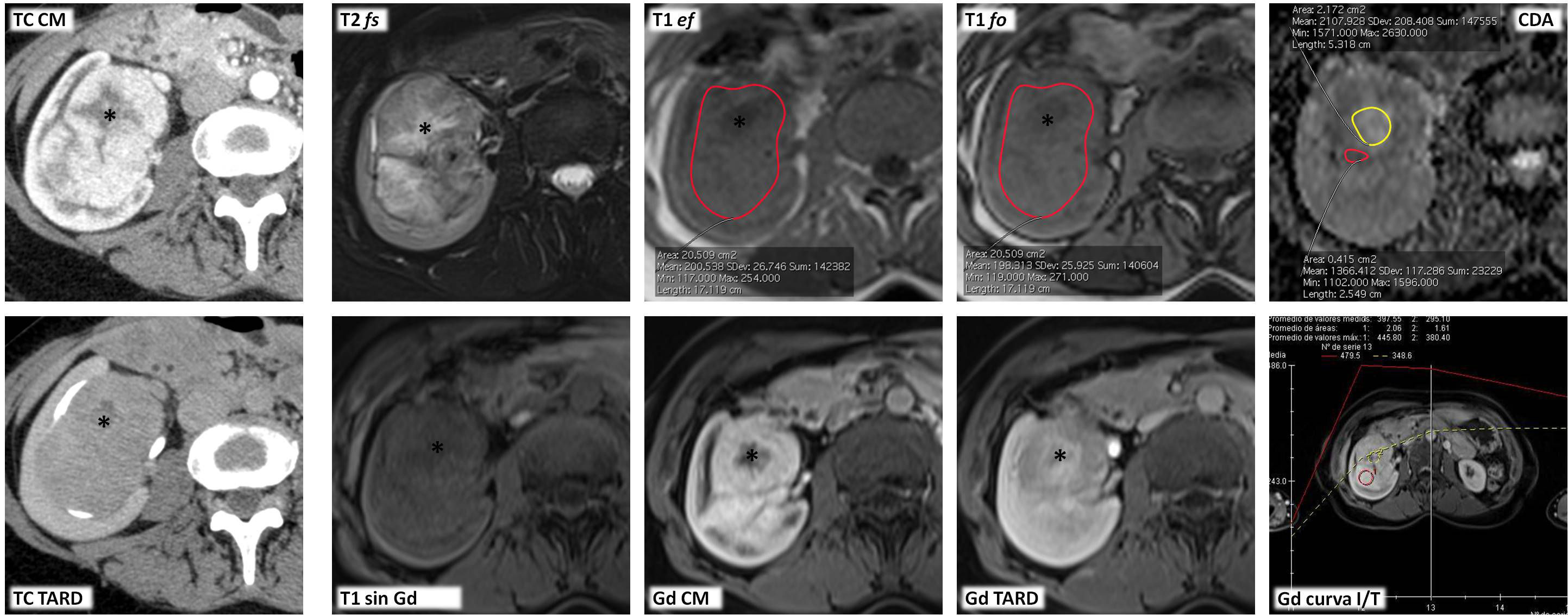
Carcinoma papilar de células renales tipo 2 que se presenta como una masa quística hemorrágica bien circunscrita. Varón de 51 años. Hallazgo incidental de masa renal derecha en estudio ecográfico por hipertensión arterial (no mostrada). Esta masa mide 8cm y es predominantemente quística, presentando sutiles focos papilares periféricos (ROI) con mayor atenuación en tomografía computarizada (TC) parasagital antes de administrar contraste (TC sin C sag). En fase nefrográfica (TC NG sag) es cuando alcanzan mayor atenuación, aunque con un realce absoluto de menos de 15 UH, indeterminado. Las áreas papilares se definen con gran facilidad en resonancia magnética (RM), tanto en T2 en incidencia coronal (T2 cor) como en estudio eco de gradiente con doble eco, tanto en fase (T1 EF) como en fase opuesta (T1 FO). El componente sólido presenta baja intensidad de señal en T2 (*) e intermedia en T1 (ROI), con un incremento de señal en FO de un 6,5%, mientras que el quístico muestra alta señal en T1 por hemosiderina. Las áreas sólidas periféricas muestran un bajo coeficiente de difusión aparente (CDA), de 0,79×10−3 mm2/s (ROI). En el estudio dinámico tras administrar contraste basado en gadolinio, aunque discreto, hay realce tardío, lo que se demuestra mejor en fase nefrográfica con sustracción de la imagen basal (Gd NG sustr) y en la curva de intensidad de señal respecto al tiempo (Gd curva I/T). Este realce se cuantifica en un 23%, por encima del umbral de 15% para considerarlo significativo.
El cPcr es el CCR con menor densidad vascular en estudios histológicos y de imagen2, lo que se traduce en un realce significativamente menor en su componente sólido con los diversos medios de contraste. Este comportamiento también se ve en las adenopatías y metástasis hematógenas (hepáticas, pulmonares y óseas las más frecuentes) (fig. 3, fig. web 2). El crCCr presenta una densidad vascular intermedia y el crCCl la más alta. Otros tumores malignos con baja densidad vascular, aunque superior a la del cPcr, son el linfoma, el carcinoma de células transicionales y las metástasis renales. Entre los tumores benignos, los oncocitomas presentan una vascularización comparable a la del crCCl, mientras que la del angiomiolipoma (AML) es intermedia.
La existencia de calcificaciones en el cPcr es variable en la bibliografía (7-32%)2,29 (fig. web 1). Aunque parecen ser algo más habituales que en el crCCl, su detección no tiene relevancia diagnóstica2,14.
La presencia de focos macroscópicos de grasa es excepcional, y se han descrito en un solo caso de una serie de 10231, por metaplasia ósea. En el apartado de RM se discutirá su comportamiento en estudios de cambio químico con secuencias en fase/fase opuesta (EF/FO).
En un estudio amplio, aunque no reproducido, se encuentra una coexistencia significativamente mayor de cPcr y quistes renales (en un 73% de riñones con cPcr, sin diferencias significativas por subtipos) (fig. 8) que de crCCl (33%), crCCr (6%) o tumores benignos y malignos en general (38%) y quistes9.
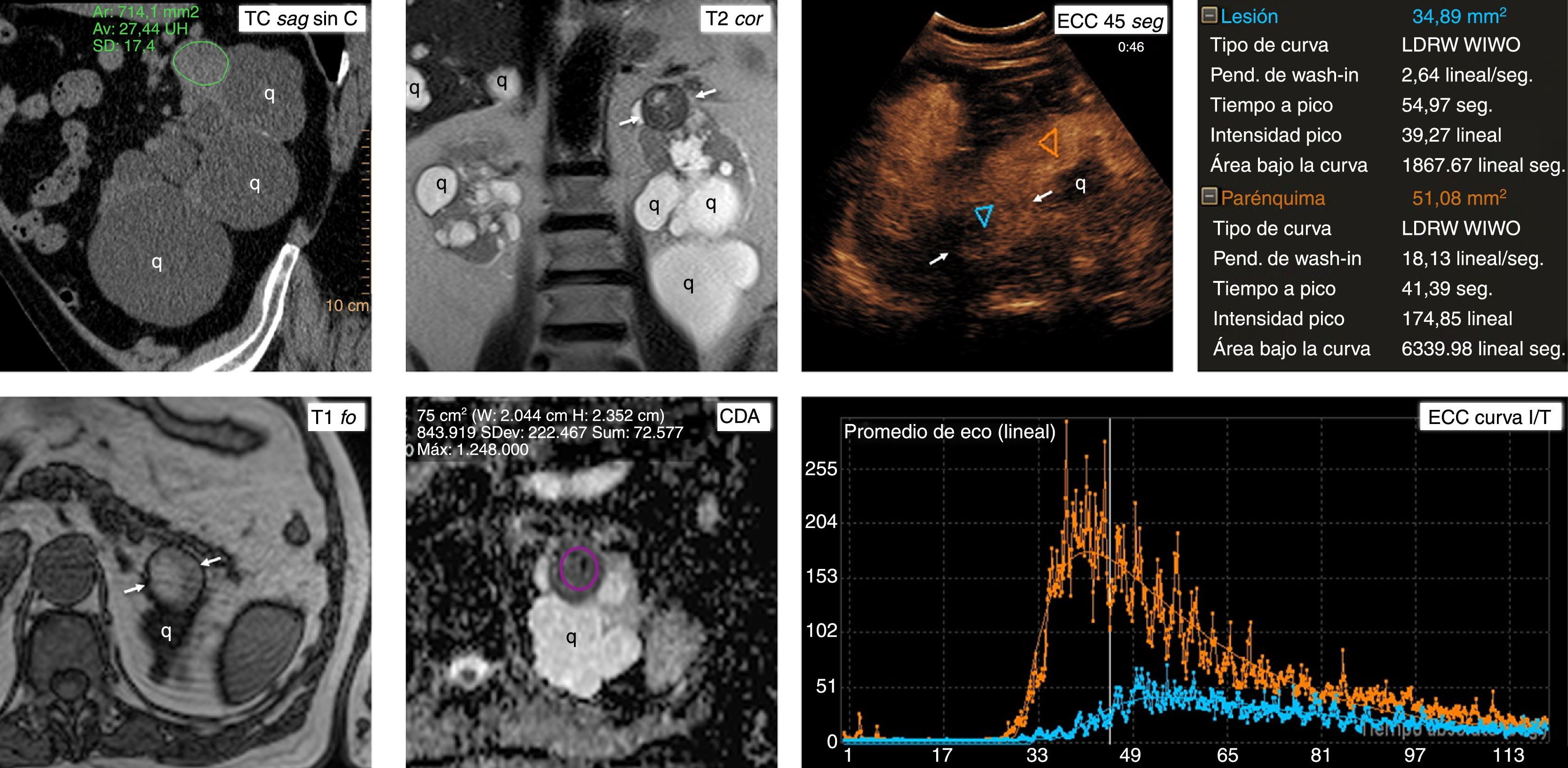
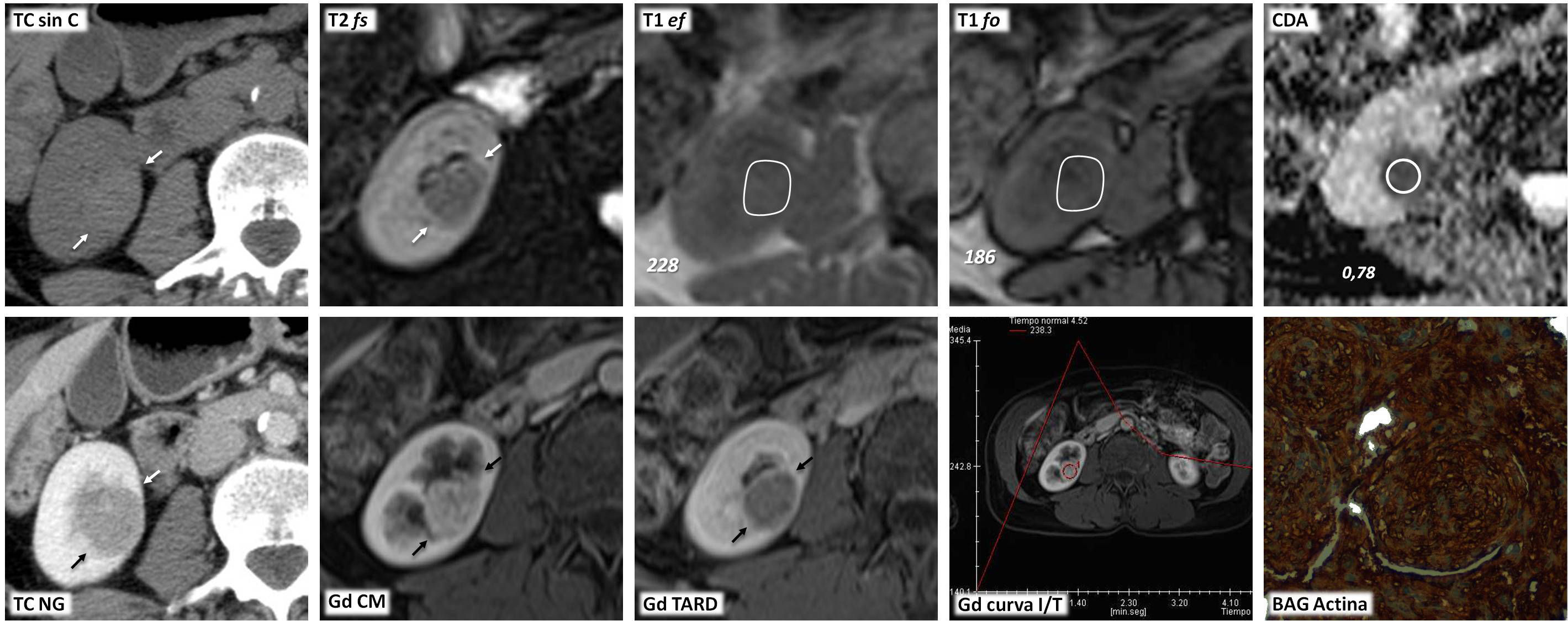
Carcinoma papilar de células renales tipo 1 en un paciente con poliquistosis hepatoesplénica. La ecografía con contraste es una alternativa al contraste yodado o paramagnético para demostrar realce. Valor del estudio cuantitativo. Varón de 73 años con poliquistosis hepatorrenal e insuficiencia renal, en seguimiento por “quiste renal con contenido ecogénico”. En tomografía computarizada (TC) sin contraste (TC sag sin C) hay numerosos quistes renales bilaterales y hepáticos (q), y una lesión con atenuación inespecífica en el polo superior del riñón izquierdo (ROI). En la resonancia magnética, la lesión está perfectamente definida y presenta baja señal en T2 (T2 cor), alta en T1 (T1 FO, en fase opuesta) y bajo valor de coeficiente de difusión aparente (CDA), de 0,84×10−3 mm2/s. Este comportamiento es sugerente de carcinoma papilar, pero al no poder administrar contraste yodado o gadolinio no se puede demostrar el realce y descartar definitivamente que corresponda a un quiste hemorrágico. La ecografía con contraste (ECC) demuestra la vascularización al mostrar realce. Pese a que visualmente puede parecer que el realce es casi tan intenso en la lesión como en el parénquima renal, los datos del estudio cuantitativo y la curva de intensidad respecto al tiempo (ECC curva I/T) muestran marcadas diferencias. En la lesión (ROI y curvas azules) el realce es notablemente menos intenso (“intensidad pico” menor) y amplio (“área bajo la curva” menor), además de alcanzarse el pico de realce más tarde (“tiempo a pico” mayor) y con una pendiente más tendida (“pendiente de wash in” menor) que en el parénquima (ROI y curva naranjas). La biopsia confirmó carcinoma papilar tipo 1. El paciente se está sometiendo a seguimiento activo.
Algún estudio muestra una mayor tendencia a la rotura hemorrágica en cPcr2 que en otros CCR31 (fig. web 3).
Hay un acuerdo generalizado en considerar al cPcr, sobre todo de tipo 15,6, como el CCR con más frecuencia multifocal de forma esporádica (7% frente al 2% en general)9,32,33. El 37% de los tumores multifocales del mismo tipo son cPcr (fig. web 4A), que también son los más habituales entre los de histología discordante33 (fig. web 4B).
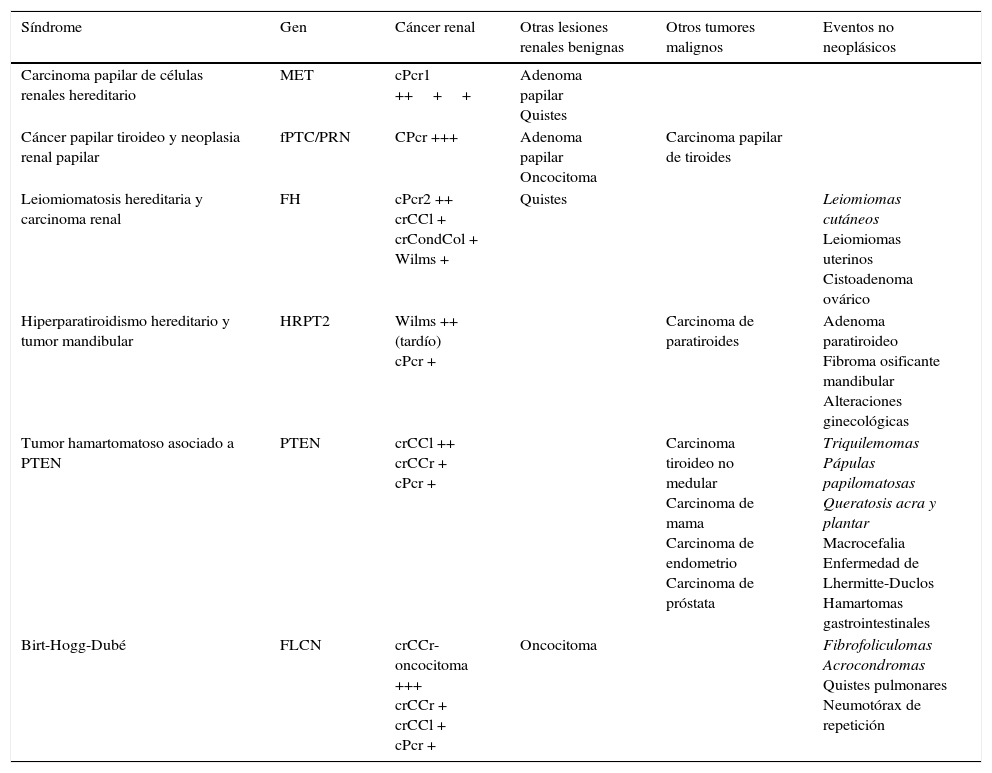
En la tabla 1 se describen algunas características de los síndromes hereditarios en los que pueden aparecer cPcr. En general, debe sospecharse CCR hereditario en pacientes menores de 46 años34, ante multifocalidad o una historia familiar sospechosa. El síndrome del cPcr hereditario es una infrecuente entidad autosómica dominante con alta penetrancia, pese a lo cual se diagnostican generalmente tarde35. A los 80 años, un 90% de los pacientes tienen cPcr1, indistinguibles de los esporádicos (fig. 4). Un 20% de pacientes con síndrome de leiomiomatosis hereditaria y cáncer renal sufren a una edad temprana un tumor renal único, de alto grado histológico, infiltrante y muy agresivo, clasificado como cPcr 235 (fig. 3), probablemente de los caracterizados como de fenotipo CIMP, aunque esta cuestión aún no está suficientemente definida. Son más frecuentes los leiomiomas uterinos (75-98%) y cutáneos dolorosos (80-100%). El síndrome del cáncer papilar tiroideo y neoplasia renal papilar debe sospecharse en mujeres jóvenes en las que coexistan carcinomas papilares tiroideo y renal (fig. web 5).
Características generales de los síndromes hereditarios asociados al carcinoma papilar de células renalesa (la asociación es progresivamente menor en las entidades que aparecen en la tabla; los términos en cursiva indican entidades cutáneas) sustr)
| Síndrome | Gen | Cáncer renal | Otras lesiones renales benignas | Otros tumores malignos | Eventos no neoplásicos |
|---|---|---|---|---|---|
| Carcinoma papilar de células renales hereditario | MET | cPcr1 ++++ | Adenoma papilar Quistes | ||
| Cáncer papilar tiroideo y neoplasia renal papilar | fPTC/PRN | CPcr +++ | Adenoma papilar Oncocitoma | Carcinoma papilar de tiroides | |
| Leiomiomatosis hereditaria y carcinoma renal | FH | cPcr2 ++ crCCl + crCondCol + Wilms + | Quistes | Leiomiomas cutáneos Leiomiomas uterinos Cistoadenoma ovárico | |
| Hiperparatiroidismo hereditario y tumor mandibular | HRPT2 | Wilms ++ (tardío) cPcr + | Carcinoma de paratiroides | Adenoma paratiroideo Fibroma osificante mandibular Alteraciones ginecológicas | |
| Tumor hamartomatoso asociado a PTEN | PTEN | crCCl ++ crCCr + cPcr + | Carcinoma tiroideo no medular Carcinoma de mama Carcinoma de endometrio Carcinoma de próstata | Triquilemomas Pápulas papilomatosas Queratosis acra y plantar Macrocefalia Enfermedad de Lhermitte-Duclos Hamartomas gastrointestinales | |
| Birt-Hogg-Dubé | FLCN | crCCr-oncocitoma +++ crCCr + crCCl + cPcr + | Oncocitoma | Fibrofoliculomas Acrocondromas Quistes pulmonares Neumotórax de repetición |
cPcr: carcinoma papilar de células renales; crCCl: carcinoma renal de células claras; crCCr: carcinoma renal de células cromófobas; crCondCol: carcinoma renal de los conductos colectores; FH: gen fumarate hidratase (fumarato hidratasa o fumarasa); FLCN: gen folliculin (foliculina); fPTC/PRN: gen familial papillary thyroid carcinoma with papillary renal neoplasm (carcinoma papilar de tiroides familiar con neoplasia papilar renal); HRPT2: gen hyperparathyroidism 2 (hiperparatiroidismo 2, también llamado CDC73); MET: gen mesenchymal epithelial transition (transición mesénquimo-epitelial); PTEN: gen phosphatase and tensin homolog (homólogo de la fosfatasa y la tensina).
La biopsia percutánea se ha mostrado en un reciente metaanálisis (aunque con evidencia moderada) como un procedimiento seguro, mejor que la punción aspirativa con aguja fina para discernir entre subtipos de CCR (92% de aciertos, algo menos en masas quísticas), más limitado para establecer el grado nuclear (62,5%)36. Ante un escenario con cada vez más matices pronósticos y terapéuticos, sus indicaciones se amplían continuamente (fig. 6). La decisión de realizarla o no ante un caso de sospecha de cPcr localizado o metastásico debe adoptarse de manera individualizada.
El cPcr en TC y PET-TCPara la caracterización de un CCR debe realizarse un estudio multifásico con contraste intravenoso, incluyendo fases basal, corticomedular (25-70 s tras la inyección), nefrográfica (70-120 s) y tardía (3-10min). Algunos autores aconsejan condicionar las fases a la detección automática del bolo de contraste.
La atenuación basal media del cPcr (35 UH, discretamente mayor que la del parénquima)29 es superior a la del crCCl e inferior a la del AML pobre en grasa11,14.
Los investigadores valoran el realce de diversos modos: cualitativamente, cuantificándolo en una o varias ROI (regions of interest), que se seleccionan según la impresión visual de realce o de forma estandarizada, o en la lesión completa empleando softwares específicos2,23,37.
El cPcr alcanza el pico de realce en fase nefrográfica, mientras que el crCCl lo hace en la corticomedular11,13,14,29,38. Hay resultados discrepantes respecto a crCCr, oncocitoma y AML.
Los valores medios de atenuación con contraste en áreas sólidas son significativamente menores que en el resto de lesiones en todas las fases, especialmente con respecto al crCCl y en la corticomedular2,11,13,14,21,37,38. Lo mismo ocurre con las ratios respecto al parénquima renal o la aorta13,14,23 y con el realce absoluto, es decir, restando la atenuación basal13,23,38. El contraste con el parénquima renal es mayor en fase nefrográfica, que será en la que se detecte más fácilmente (fig. 5). Un 14,8-21,5%, con realce absoluto menor de 15-20 UH29,39, no podrán diferenciarse de quistes densos sin realce o con seudorrealce (figs. 7 y 9).
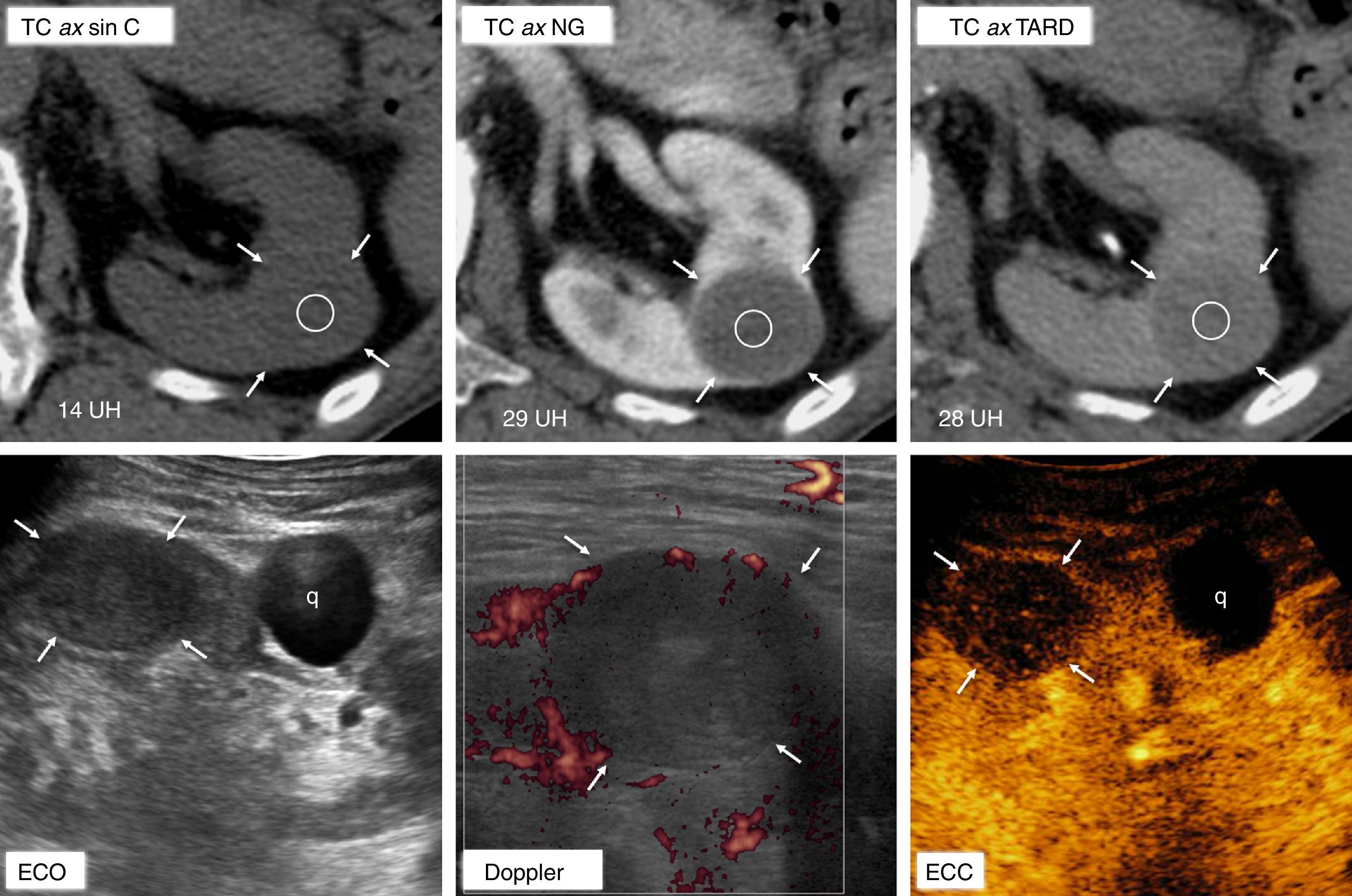
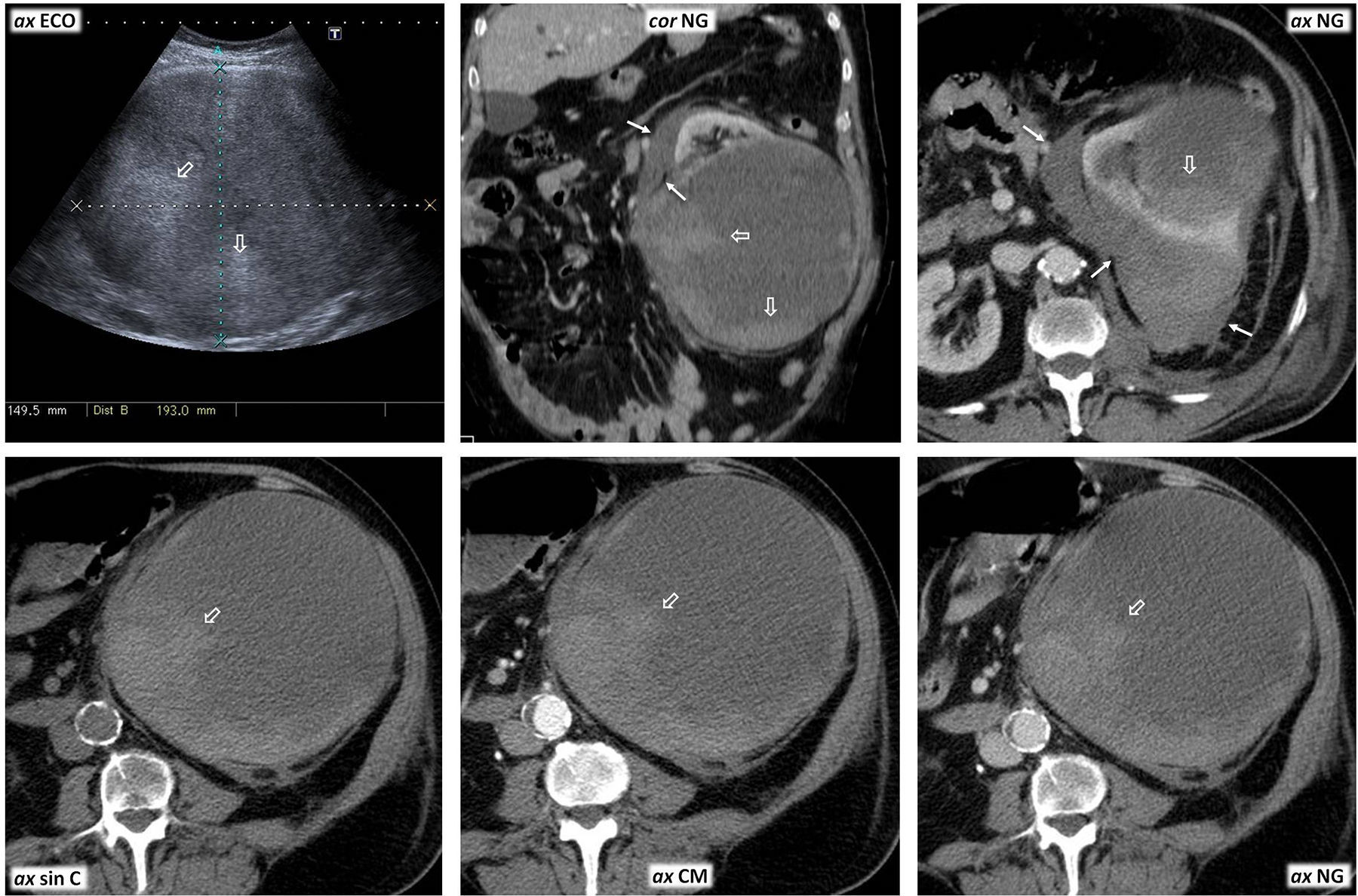
Carcinoma papilar de células renales tipo 1. Valor de la ecografía con contraste para demostrar realce en lesiones con comportamiento indefinido en tomografía computarizada (TC). Mujer de 66 años en estudio por colelitiasis. Hallazgo incidental de tumor renal izquierdo. En TC multifásica, la lesión (flechas) muestra un realce máximo de 15 UH, equívoco, en fase nefrográfica. En la ecografía (ECO) se muestra como una lesión discretamente hipoecogénica con respecto al parénquima renal, en contraste con un quiste (q) coexistente, anecogénico. El estudio Doppler no logra demostrar vascularización en la lesión ni siquiera optimizando los datos para la detección de flujos muy lentos. En la ecografía con contraste (ECC) se aprecia un “burbujeo” en el interior de la lesión una vez que el contraste la alcanza, a diferencia de lo que ocurre en el quiste, que no muestra realce alguno. Este efecto se valora mejor a tiempo real (vídeo web 1).
Pocos estudios ofrecen valores de umbral y datos de precisión diagnóstica. Su reproducibilidad sería además dudosa por la variabilidad técnica y metodológica. Algunos, a título orientativo, son una atenuación media al pico<70 UH14 o un realce absoluto en fase corticomedular < 55 UH13. En un trabajo, la precisión mayor en la diferenciación respecto al crCCl (85%) se logra con los datos del estudio multifásico13. En otro se alcanzan cifras mejores (88-90%) solo con la valoración cualitativa de la intensidad y la homogeneidad del realce14.
Un estudio de cuantificación de las lesiones completas muestra diferencias significativas, además de en la cantidad, en la distribución del realce (menores rango intercuartil y desviación estándar y mayores oblicuidad y curtosis que en crCCl)37 (fig. web 4).
La TC de doble energía, aunque no exenta de artefactos, ofrece una imagen virtual sin contraste y mapas de yodo que permiten mediciones más fidedignas, distinguiendo en algunos casos realces sutiles de seudorrealces. Con un umbral de [I] de 0,9mg/ml se diferencia cPcr de crCCl con una precisión del 95,3%40, con correlación con el grado tumoral también en cPcr.
Aunque se ha demostrado que los valores de volumen de sangre y flujo sanguíneo se correlacionan con la densidad vascular y son menores que en el crCCl, y el tiempo de tránsito medio mayor11,41, los estudios de perfusión por tomografía computarizada (TC) tienen actualmente escasa aplicabilidad en el cPcr.
La tomografía por emisión de positrones (PET)-TC es poco útil para la caracterización de los tumores renales por la variabilidad en la expresión del transportador-1 de glucosa, el enmascaramiento que ejerce el trazador excretado y la baja resolución espacial. Sin embargo, se ha demostrado un SUV máximo y una ratio entre el tumor y tejido normal mayores en crCCl que en un grupo de cPcr y crCCr en la fase inicial de estudios dinámicos42.
El cPcr en resonancia magnéticaMás allá de una mera alternativa a la TC, la RM supone una herramienta multiparamétrica o un biomarcador del fenotipo del CCR15,27,28,43.
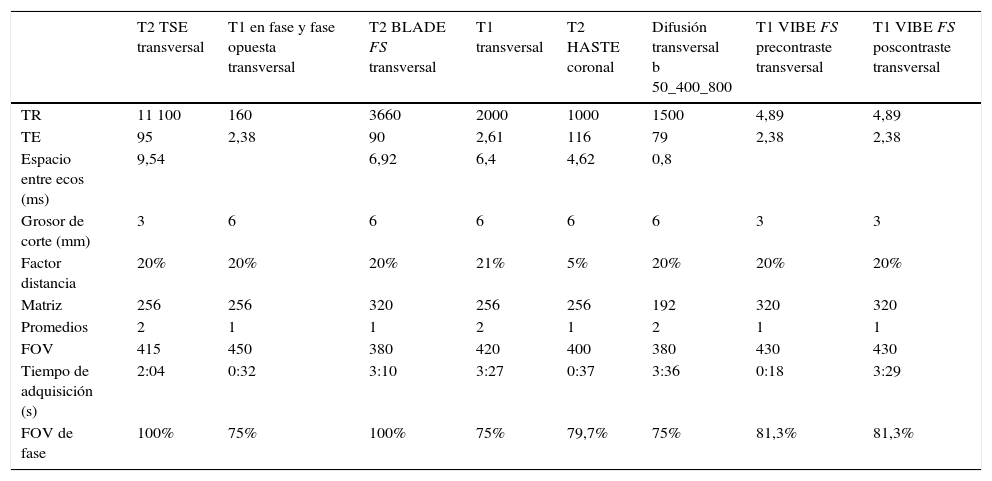
La tabla 2 recoge nuestro protocolo técnico de estudio para caracterizar los tumores renales. El cPcr puede comportarse morfológicamente de las tres formas que se describen en el apartado de factores generales que condicionan el comportamiento radiológico del cPcr.
Protocolo técnico de RM empleado en nuestro centro para la caracterización de tumores renales. Equipo: Magnetom Avanto 1,5T, Siemens Healthcare
| T2 TSE transversal | T1 en fase y fase opuesta transversal | T2 BLADE FS transversal | T1 transversal | T2 HASTE coronal | Difusión transversal b 50_400_800 | T1 VIBE FS precontraste transversal | T1 VIBE FS poscontraste transversal | |
|---|---|---|---|---|---|---|---|---|
| TR | 11 100 | 160 | 3660 | 2000 | 1000 | 1500 | 4,89 | 4,89 |
| TE | 95 | 2,38 | 90 | 2,61 | 116 | 79 | 2,38 | 2,38 |
| Espacio entre ecos (ms) | 9,54 | 6,92 | 6,4 | 4,62 | 0,8 | |||
| Grosor de corte (mm) | 3 | 6 | 6 | 6 | 6 | 6 | 3 | 3 |
| Factor distancia | 20% | 20% | 20% | 21% | 5% | 20% | 20% | 20% |
| Matriz | 256 | 256 | 320 | 256 | 256 | 192 | 320 | 320 |
| Promedios | 2 | 1 | 1 | 2 | 1 | 2 | 1 | 1 |
| FOV | 415 | 450 | 380 | 420 | 400 | 380 | 430 | 430 |
| Tiempo de adquisición (s) | 2:04 | 0:32 | 3:10 | 3:27 | 0:37 | 3:36 | 0:18 | 3:29 |
| FOV de fase | 100% | 75% | 100% | 75% | 79,7% | 75% | 81,3% | 81,3% |
BLADE: secuencia que emplea técnica de corrección del movimiento; FOV (field of view): campo de visión; FS (fat sat): saturación espectral de la grasa; HASTE (Half-Fourier Acquisition Single-shot Turbo spin-Echo): secuencia rápida; TR: tiempo de repetición; TE: tiempo de eco; VIBE (Volumetric Interpolated Breath-hold Examination): secuencia para la valoración de realce con contraste. Se realiza un estudio basal previo y posteriomente un estudio dinámico en el que adquieren 6 fases consecutivas tras la administración del mismo.
Las áreas sólidas habitualmente muestran hipointensidad en T2 con respecto a la corteza renal (por la arquitectura papilar o depósito de hemosiderina)2,11,15,27,28,44,45 (figs. 6 a 8), como el AML11,27 o algunos quistes hemorrágicos28 y a diferencia del resto de entidades. Esto puede constatarse visualmente o mejor calculando la ratio de la intensidad de señal (IS) respecto al córtex, con sensibilidad (S) de 96% y especificidad (E) de 86% en la diferenciación del crCCl para un umbral de 0,9325,42. Aproximadamente un 9% son hiperintensos en T229,46, por edema.
La IS en T1 de las áreas sólidas es variable e indistinguible de otros tumores29,45, aunque en lesiones quísticas es frecuente que sea alta por hemosiderina18,29,44,47. Suele presentar una mayor IS en FO que EF (figs. 6 y 7), lo que se atribuye a la susceptibilidad magnética de la hemosiderina y puede valorarse visualmente o, preferiblemente, cuantificando el porcentaje de cambio usando o no el parénquima renal o esplénico como referencia. Permite diferenciar de crCCl y AML pobre en grasa (cuya IS de señal en T2 es similar), generalmente con menor IS en FO, con diferentes sensibilidad, especificidad y área bajo la curva (ABC)11,15,29,44,48. Un 14,5-29% de cPcr, más heterogéneos y con mayor IS en T2, presentan también menor IS en FO, por contener células claras o histiocitos con grasa29,49.
En los estudios multifásicos con contraste paramagnético hay también mucha variabilidad. La sustracción de las imágenes basales ofrece mayor sensibilidad que la TC, especialmente en lesiones hiperintensas en T12,15,28,44 (fig. 7). Se recomienda una valoración cuantitativa estandarizada y con corregistro entre fases44,50–52, alcanzándose la menor variabilidad con ROI de lesión completa53. No es válido cuantificar la IS, sino el porcentaje en que aumenta o la relación entre este y el de la corteza renal. Como en TC, el realce es el más discreto de entre las neoplasias renales, mayor en fase nefrográfica (figs. 6 y 7). Hay diferencias significativas entre el cPcr y todos en fase corticomedular51. Dos estudios demostraron realce significativo (>15%) en todos los tumores con realce dudoso en TC29,39, con un promedio del 68% en fase corticomedular. Los umbrales son de nuevo difícilmente extrapolables por la variabilidad, con sensibilidad del 93% y 81% y especificidad del 96% y 87,5% para un 84% y 173% de realce en fase corticomedular, respectivamente, en estudios diferentes50. La valoración del histograma de la lesión completa demostró mejores acuerdo y precisión (94,6% para el 3.er cuartil del realce en fase corticomedular)52.
Aunque algunos estudios muestran una mayor frecuencia de márgenes indefinidos, calcificaciones y heterogeneidad en realce y T230,54 en cPcr2, otros autores concluyen que, dejando al margen un subgrupo de cPcr2 infiltrantes, no habría diferencias significativas15,27,28.
Los estudios de perfusión con RM, según un modelo farmacocinético bicompartimental, de susceptibilidad al contraste o de ASL (arterial spin labeling) sin contraste, han permitido mostrar las diferencias vasculares del cPcr respecto a otros tumores en varios trabajos15,28,43,55, pero actualmente con escaso interés clínico.
Los CCR presentan mayor restricción de la difusión del agua que el parénquima renal56,57 y que las lesiones benignas57,58, lo que confirman dos metaanálisis que, sin embargo, no pueden ofrecer valores umbral de coeficiente de difusión aparente (CDA)59,60. Pese a su mayor agresividad, hay menos restricción de la difusión en los CCR de células claras que en los que no lo son56,57,60,61. El cPcr presenta los valores de CDA menores entre los CCR11,28,56–58 (figs. 3, 6 a 8 y 10), lo que se atribuye a su hipovascularidad. Las diferencias técnicas y metodológicas de los estudios28,43,56–61 impiden recomendar un valor de corte. Por otro lado, el CDA puede solaparse con el del AML pobre en grasa28,57–59,61, quistes hemorrágicos, lesiones infecciosas, crCCr y crCCl de alto grado56. Hay estudios preliminares con técnica IVIM (intravoxel incoherent motion) que emplean múltiples valores bajos de B para discernir la contribución de la perfusión y de la difusividad tisular real al CDA, con el potencial de definir mejor el comportamiento del cPcr62,63. El estudio de difusión no es superior al dinámico con contraste, pero su adición mejora los resultados y además es una alternativa si el contraste está contraindicado15,28,58.
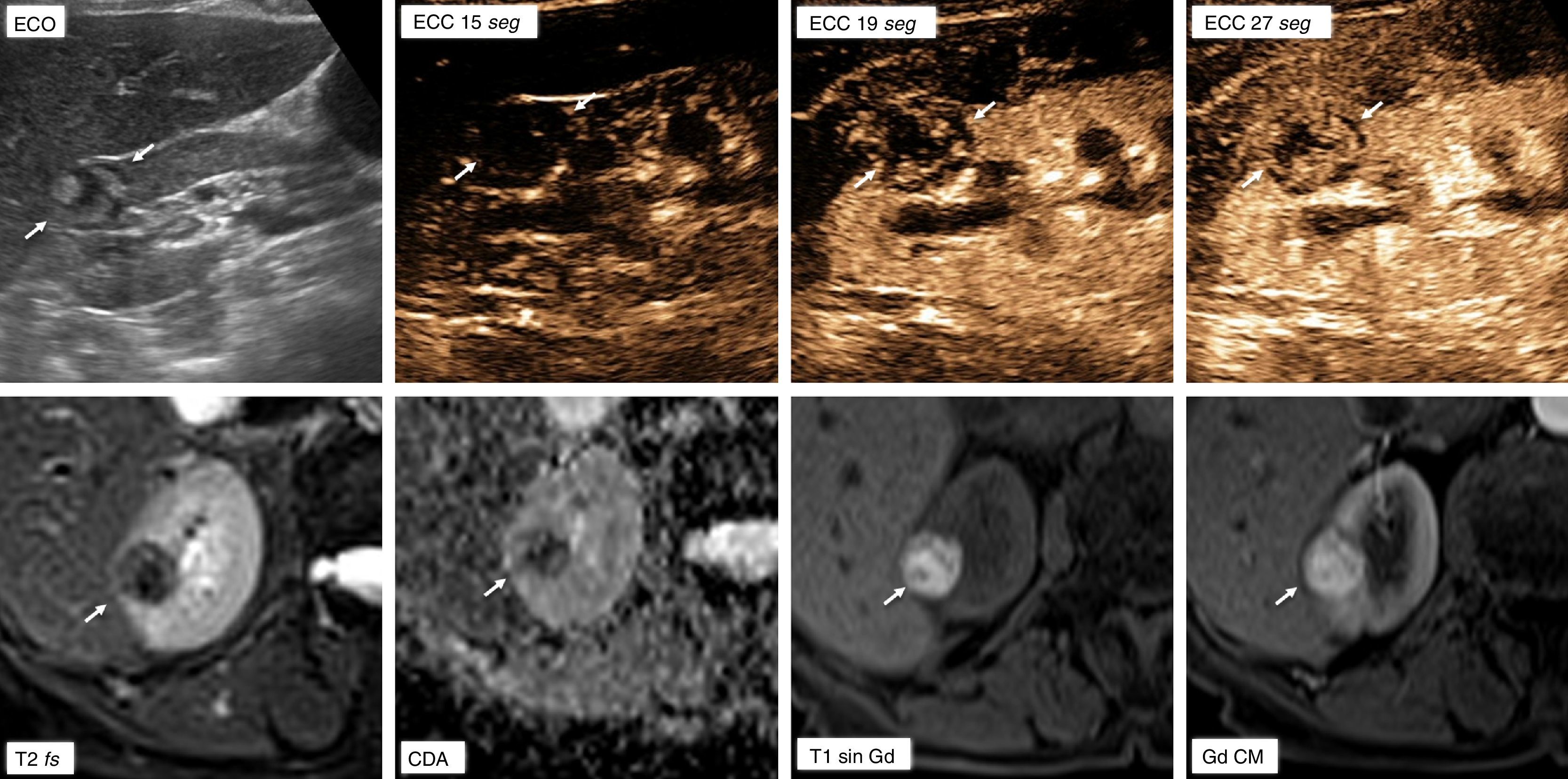
Carcinoma papilar de células renales tipo 2. La ecografía con contraste demuestra el realce en áreas papilares de una lesión quística, incluso con mayor sensibilidad que la resonancia magnética. Mujer de 66 años. Hallazgo incidental ecográfico (ECO) de una lesión renal derecha quística (flechas), con áreas papilares periféricas más ecogénicas. Se realiza “sobre la marcha” estudio de ecografía con contraste (ECC), que demuestra realce en estas áreas papilares, menor que el del parénquima renal. Se realizó también resonancia magnética (RM), donde la lesión presenta otros rasgos característicos del carcinoma papilar, como hipointensidad en T2 (T2 fs; con saturación espectral de la grasa), bajo valor de coeficiente de difusión aparente (CDA) e hiperintensidad en T1 por contenido hemorrágico. Sin embargo, no se logra demostrar realce en las áreas papilares, ni siquiera con sustracción de la imagen basal, aunque la paciente se había movido. La hiperintensidad en T1 puede limitar la detección del realce en resonancia magnética, especialmente si la sustracción de imágenes no puede realizarse de forma precisa, como en este caso.
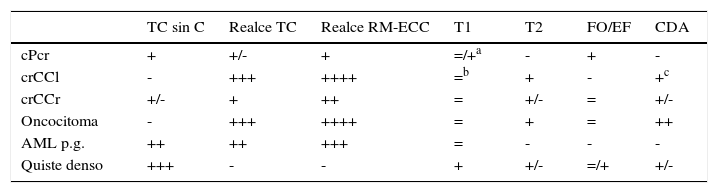
En la valoración global de parámetros diversos, la RM alcanza una sensibilidad del 60-80% y una especificidad del 94-100% en la diferenciación entre cPcr y otros tumores renales27,44. La tabla 3 y las figs. web 6 a 10 muestran el comportamiento radiológico habitual de otras lesiones renales corticales.
Comportamiento habitual en pruebas radiológicas del carcinoma papilar de células renales y de las lesiones renales corticales que con más frecuencia entran en su diagnóstico diferencial
| TC sin C | Realce TC | Realce RM-ECC | T1 | T2 | FO/EF | CDA | |
|---|---|---|---|---|---|---|---|
| cPcr | + | +/- | + | =/+a | - | + | - |
| crCCl | - | +++ | ++++ | =b | + | - | +c |
| crCCr | +/- | + | ++ | = | +/- | = | +/- |
| Oncocitoma | - | +++ | ++++ | = | + | = | ++ |
| AML p.g. | ++ | ++ | +++ | = | - | - | - |
| Quiste denso | +++ | - | - | + | +/- | =/+ | +/- |
AML p.g.: angiomiolipoma pobre en grasa; CDA: coeficiente de difusión aparente; cPcr: carcinoma papilar de células renales; crCCl: carcinoma renal de células claras; crCCr: carcinoma renal de células cromófobas; FO/FE: intensidad de señal en fase opuesta respecto a la señal en fase; realce RM-ECC: intensidad del realce máximo en RM y ecografía con contraste; realce TC: intensidad del realce máximo en TC; T1: intensidad de señal en T1 en relación al parénquima renal; T2: intensidad de señal en T2 en relación al parénquima renal; TC sin C: TC sin contraste.
El cPcr suele ser isointenso en T1 con respecto al parénquima renal en sus áreas sólidas, pero es habitual que las quísticas sean hiperintensas por depósito de hemosiderina.
Más de la mitad de los CCR se detectan incidentalmente por ecografía64, que no permite caracterizar el tumor2,64 más allá de rasgos como los focos necróticos, más frecuentes en el crCCl. El estudio Doppler no supera a la TC en la detección de macrovascularización (fig. 9).
Aunque no está entre las aplicaciones reconocidas de la ecografía con contraste (ECC) la caracterización de tumores sólidos renales, sí lo está la de quistes complejos64–66. Ha demostrado además mayor sensibilidad que la TC para detectar flujo en áreas hipovasculares, en lesiones indefinidas en TC2,65,67–70 (figs. 8 y 9; vídeo web 1) y para demostrar la presencia de focos sólidos en lesiones quísticas (fig. 10), comportamientos habituales de los cPcr. La ECC añade las ventajas de la ausencia de radiaciones ionizantes y de nefrotoxicidad por contraste, así como la posibilidad de realizarse en el mismo acto ecográfico de manera improvisada11,64.
Hay evidencias de que cualitativamente es posible distinguir de forma global el crCCl, con realce más intenso y heterogéneo, de otros tumores71 y específicamente del cPcr72. La presencia de seudocápsula es para unos autores característica del cPcr69,73 y para otros de todos los CCR65. Cada vez hay mayor disponibilidad de programas de cuantificación y corrección de movimientos respiratorios que permiten obtener curvas de intensidad/tiempo y extraer datos numéricos fidedignos. El cPcr tiene un realce más lento (con parámetros variables entre estudios), menos intenso, y un ABC menor65,69,72–75 (fig. 8) que otros tumores, sobre todo el crCCl. Los datos del lavado no son concluyentes69,71,75. Hay un amplio margen de investigación en este terreno, que se ampliaría si se consolidara el uso de nanoburbujas.
ConclusionesEl cPcr es el segundo CCR más frecuente y el de menor densidad vascular, lo que condiciona su apariencia en estudios de imagen, permitiendo generalmente su diferenciación de otras neoplasias sólidas renales. Un porcentaje significativo se presenta en TC como lesiones sin realce o con realce indeterminado, indistinguibles de quistes densos, por lo que es probable que se infradiagnostiquen. La RM y la ECC son más sensibles para demostrar su vascularización y aportan, especialmente la RM, otros datos importantes en la caracterización, especialmente la hipointensidad en T2, el bajo CDA y la tendencia a ganar IS en FO.
Pueden presentarse como tumores sólidos periféricos, homogéneos y bien definidos, tumores quísticos con componente hemorrágico, también bien delimitados, o tumores infiltrantes con tendencia a invadir grandes venas. Estos últimos presentan peor pronóstico y probablemente se corresponden con un subtipo recientemente descrito de cPcr tipo 2, con fenotipo CIMP, más frecuentes en mujeres jóvenes y en el síndrome de leiomiomatosis hereditaria y cáncer renal. El cPcr está implicado también en otros síndromes hereditarios y es el más frecuentemente bilateral y múltiple.
El resto de cPcr presentan en general mejor pronóstico que el crCCl, el más frecuente, aunque en estadios altos es peor por la ausencia de tratamientos eficaces.
El radiólogo tiene un importante papel en el manejo del cPcr.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsable de la integridad del estudio: MÁCC.
- 2.
Concepción del estudio: MÁCC.
- 3.
Diseño del estudio: MÁCC, JEI.
- 4.
Obtención de los datos: MÁCC, JEI, MRML, GCFP, DSÁB.
- 5.
Análisis e interpretación de los datos: MÁCC, JEI, MRML, GCFP, DSÁB.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: MÁCC, JEI.
- 8.
Redacción del trabajo: MÁCC.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JEI, MRML, GCFP, DSÁB.
- 10.
Aprobación de la versión final: MÁCC, JEI, MRML, GCFP, DSÁB.
Los autores declaran no tener ningún conflicto de intereses relacionados con este artículo.
Corresponde al mismo paciente de la figura 9. Fragmento del estudio con contraste ecográfico, entre los 53 y los 80 s de su administración (imagen sincrónica del estudio con contraste a la izquierda y en modo B a la derecha), en el que se comprueba visualmente y a tiempo real la existencia de “burbujeo”, que denota la vascularización que no demostraba la tomografía computarizada en el carcinoma papilar (a la izquierda) y su ausencia en el quiste renal (a la derecha).