A pesar de que los seudoquistes constituyen la mayor parte de las lesiones quísticas pancreáticas, es importante realizar un correcto diagnóstico diferencial con las verdaderas neoplasias quísticas, debido fundamentalmente a su potencial maligno. En ocasiones, no es posible establecer un diagnóstico definitivo únicamente mediante tomografía computarizada y resonancia magnética, por lo que se requieren otras pruebas de imagen, como la ecoendoscopia, que además de información morfológica permite, a través de la punción y aspiración del contenido, obtener un análisis citológico y bioquímico de la lesión. La combinación de todos estos hallazgos permite casi siempre una aproximación diagnóstica suficiente para adoptar el abordaje más adecuado en cada caso.
En este artículo se describen las características morfológicas específicas de cada una de las neoplasias quísticas pancreáticas, tanto con tomografía computarizada y resonancia magnética como con ecoendoscopia, y se revisan las guías de manejo de este tipo de lesiones.
Although most cystic pancreatic lesions are pseudocysts, it is important to do a thorough differential diagnosis with true cystic tumors because cystic tumors are potentially malignant. Sometimes computed tomography and magnetic resonance imaging cannot establish the definitive diagnosis, making it necessary to perform other imaging tests such as endoscopic ultrasound, which in addition to morphological information, can also enable cytologic and biochemical analysis of the lesion through puncture and aspiration of its contents. Combining all these findings nearly always provides enough diagnostic information to allow the appropriate approach in each case.
This article describes the specific morphological characteristics for each cystic pancreatic tumor on computed tomography, magnetic resonance imaging, and endoscopic ultrasound and reviews the guidelines for managing these types of lesions.
Los seudoquistes constituyen la mayor parte de las lesiones quísticas de páncreas y su diagnóstico diferencial con las verdaderas neoplasias quísticas es importante debido fundamentalmente al potencial de malignización de estas últimas. Además, algunas neoplasias sólidas, como los tumores neuroendocrinos, el adenocarcinoma o el tumor sólido seudopapilar, pueden presentar áreas de degeneración quística y simular una verdadera neoplasia quística por imagen. Debido a su diferente pronóstico y enfoque terapéutico, es importante el estudio pormenorizado de este grupo de lesiones y reconocer, mediante las técnicas de imagen disponibles, las claves diagnósticas de cada una de ellas. Los objetivos de este artículo son, por tanto, describir las características radiológicas de las neoplasias quísticas del páncreas (NQP) más frecuentes, tanto con tomografía computarizada (TC) como con resonancia magnética (RM) y ecoendoscopia, así como revisar sus guías de tratamiento.
Frecuencia y diagnósticoLas NQP constituyen un grupo heterogéneo de lesiones benignas, premalignas y malignas. Recientes estudios basados en TC y RM estiman una prevalencia que varía entre el 2,4% y el 14%1–3, con una frecuencia global similar en ambos sexos y una incidencia que aumenta con la edad, aunque se desconoce si este aumento refleja un riesgo real con la edad o es debido a la utilización cada vez más frecuente de estas técnicas de imagen en personas de edad más avanzada, debido al aumento de la esperanza de vida.
Por otra parte, los avances en técnicas quirúrgicas y cuidados perioperatorios han disminuido la mortalidad de la cirugía del páncreas, por lo que actualmente se reseca un mayor número de lesiones, lo que aumenta el conocimiento de estas4.
No existe una clasificación formal de las NQP, y en la mayoría de las revisiones se basan en las características de las células de su pared (a diferencia de los seudoquistes, que se definen precisamente por la ausencia de revestimiento epitelial) (tabla 1). Entre todas ellas, las más frecuentes son el cistoadenoma seroso, el tumor quístico mucinoso y la neoplasia papilar intraductal mucinosa (NPIM)5.
Clasificación de las lesiones quísticas pancreáticas según su pared
| Tumores quísticos mucinosos |
| Neoplasia quística mucinosa |
| Neoplasia papilar intraductal mucinosa |
| Quistes mucinosos no neoplásicos |
| Tumores quísticos serosos |
| Cistoadenoma seroso |
| Cistoadenocarcinoma seroso |
| Quistes pancreáticos asociados a la enfermedad de von Hippel-Lindau |
| Tumores quísticos con epitelio escamoso |
| Quistes linfoepiteliales |
| Quistes epidermoides |
| Quistes dermoides |
| Tumores quísticos de células acinares |
| Cistoadenoma de células acinares |
| Cistoadenocarcinoma de células acinares |
| Tumores quísticos endoteliales |
| Linfangioma |
| Tumores sólidos con fenómenos quísticos |
| Tumor sólido seudopapilar |
| Adenocarcinoma de páncreas |
| Tumores neuroendocrinos |
| Otros |
| Tomado de Volkan Adsay N, et al4. |
Tanto la TC como la RM son indispensables en el estudio de las NQP. La TC es la técnica de elección inicial para la detección, caracterización y valoración de la extensión extrapancreática de la lesión. La colangio-RM permite además determinar la relación de la lesión quística con el conducto pancreático (especialmente importante en la diferenciación de las NPIM)6–8. Pese a las expectativas iniciales, las secuencias potenciadas en difusión tienen limitaciones en el estudio de las NQP9.
Aunque existen hallazgos morfológicos característicos de cada una de las distintas neoplasias, en ocasiones no es posible establecer un diagnóstico definitivo únicamente mediante TC y RM, por lo que se requieren otras pruebas de imagen como la ecoendoscopia que, además de proporcionar información morfológica muy precisa, permite a través de la punción y aspiración del contenido obtener un análisis citológico y bioquímico de la lesión9. La combinación del análisis citológico, los marcadores bioquímicos y los marcadores tumorales permite establecer un diagnóstico y diferenciar lesiones mucinosas y no mucinosas para, de esta manera, prevenir resecciones injustificadas de lesiones benignas.
En cuanto a los marcadores tumorales en el líquido aspirado de la lesión relacionados con este tipo de tumores, el antígeno carcinoembrionario (CEA) se encuentra elevado en las lesiones mucinosas, generalmente por encima de 192ng/ml, de tal forma que un CEA menor de 5ng/ml excluye tumores mucinosos con una sensibilidad cercana al 100% y una especificidad del 86%10,11. El resto de marcadores tumorales (CA 19-9, CA 72-4 y CA 125) tienen un valor limitado, aunque recientes estudios concluyen que niveles elevados de CA 19.9 se asocian a las formas invasivas de la NPIM12. Respecto a los marcadores bioquímicos (también del líquido de la lesión), la amilasa se encuentra aumentada tanto en los seudoquistes como en la neoplasia mucinosa papilar intraductal11.
Características radiológicasNeoplasias quísticas serosasLa mayoría de las neoplasias quísticas serosas del páncreas son cistoadenomas serosos. Son tumores benignos que constituyen aproximadamente el 20% del total de las lesiones quísticas del páncreas13. Es más frecuente en mujeres y la media de edad de aparición es de 61,5 años14. Más del 80% se producen en el cuerpo y la cola pancreática y cursan generalmente de manera asintomática15.
Se trata de un tumor bien delimitado, formado por múltiples quistes de hasta 2cm de tamaño, conformando un patrón en “panal de abejas“16. Presenta unos contornos lobulados con paredes finas que realzan tras la administración de contraste. En la TC se ve en aproximadamente un 20-30% de los casos una cicatriz estrellada con calcificaciones centrales17, mientras que en RM se presenta como una masa constituida por pequeñas lesiones hiperintensas en T2, con septos y una cicatriz central que realza tras la administración de contraste. No comunica con el sistema ductal pancreático y no presenta dilatación de la vía biliar ni del Wirsung (fig. 1)18.
Cistoadenoma seroso. a y b) TCMD tras la administración de contraste intravenoso, planos sagitales, en una paciente de 59 años donde se observa una lesión en cabeza-cuerpo pancreático, formada por múltiples quistes milimétricos y con cicatriz y calcificación central (flechas blancas curvas). c y d) Paciente de 65 años en seguimiento por oncología por antecedentes de adenocarcinoma de recto. RM realizada para estudio de lesión hepática, en secuencia potenciada en T2 (c) y en secuencia potenciada en T1 con gadolinio (d), con hallazgo incidental de lesión quística pancreática, polilobulada, en proceso uncinado, formada por múltiples quistes milimétricos (flechas blancas rectas).
Existe una forma rara (menos del 10% del total) de cistoadenoma seroso con patrón oligomacroquístico, difícilmente distinguible por imagen del cistoadenoma mucinoso, si bien se han descrito hallazgos específicos indicativos de esta lesión: mayor edad de los pacientes, localización en la cabeza pancreática (cuerpo y cola en las lesiones mucinosas), contorno lobulado o ausencia de nódulos murales (fig. 2)19–21.
Cistoadenoma seroso, patrón macroquístico. a) TCMD tras la administración de contraste intravenoso. Lesión lobulada en cabeza pancreática, formada por varios quistes mayores de 2cm (flecha blanca recta). b) Ecoendoscopia del mismo paciente, donde se confirma la presencia de una lesión en cabeza pancreática con patrón macroquístico, difícilmente distinguible de un cistoadenoma mucinoso.
A diferencia de otras NQP, las características morfológicas en ecoendoscopia son altamente sugestivas de esta entidad. Se trata de una lesión constituida por múltiples formaciones anecoicas, bien delimitadas, de pequeño tamaño y con septos en su interior.
Tras la punción-aspiración y análisis del líquido de la lesión, las concentraciones tanto de amilasa como de CEA son indetectables22,23.
Se ha descrito la asociación de las lesiones quísticas serosas del páncreas con la enfermedad de Von Hippel-Lindau, indistinguibles anatomopatológicamente de las del cistoadenoma seroso, pero con una distribución más difusa en la glándula pancreática24.
Neoplasias quísticas mucinosasSe trata de lesiones con potencial maligno22. Presentan un estroma similar al ovárico (ovarian-like stroma)25 y están revestidas por células epiteliales secretoras de moco, con grado variable de atipia. Constituyen aproximadamente el 10% de las lesiones quísticas pancreáticas13, son casi exclusivas del sexo femenino y presentan una edad media de aparición de 47 años26. Cursan de manera asintomática o bien con dolor abdominal inespecífico, náuseas, pérdida de peso o dolor de espalda27.
Son tumores bien delimitados con quistes de más de 2cm (patrón oligoquístico) llenos de moco y tabiques, y cuya pared realza tras la administración de contraste. El 95% de los casos se localizan en cuerpo o cola de páncreas26. No comunican con el sistema ductal pancreático y en ocasiones producen dilatación de la vía biliar y del Wirsung por compresión28.
Aproximadamente, el 17,5% de las neoplasias quísticas mucinosas son malignas29. Los hallazgos de imagen que sugieren carácter maligno son: calcificaciones en “cáscara de huevo”, presencia de nódulos murales, un tamaño superior a los 6cm y engrosamiento o irregularidad de la pared del conducto pancreático principal30,31.
En ecoendoscopia se presentan en general como una lesión unilocular u oligoquística, con septos internos de grosor variable. Pueden presentar un contenido ecogénico debido a la producción de moco (figs. 3 y 4)28.
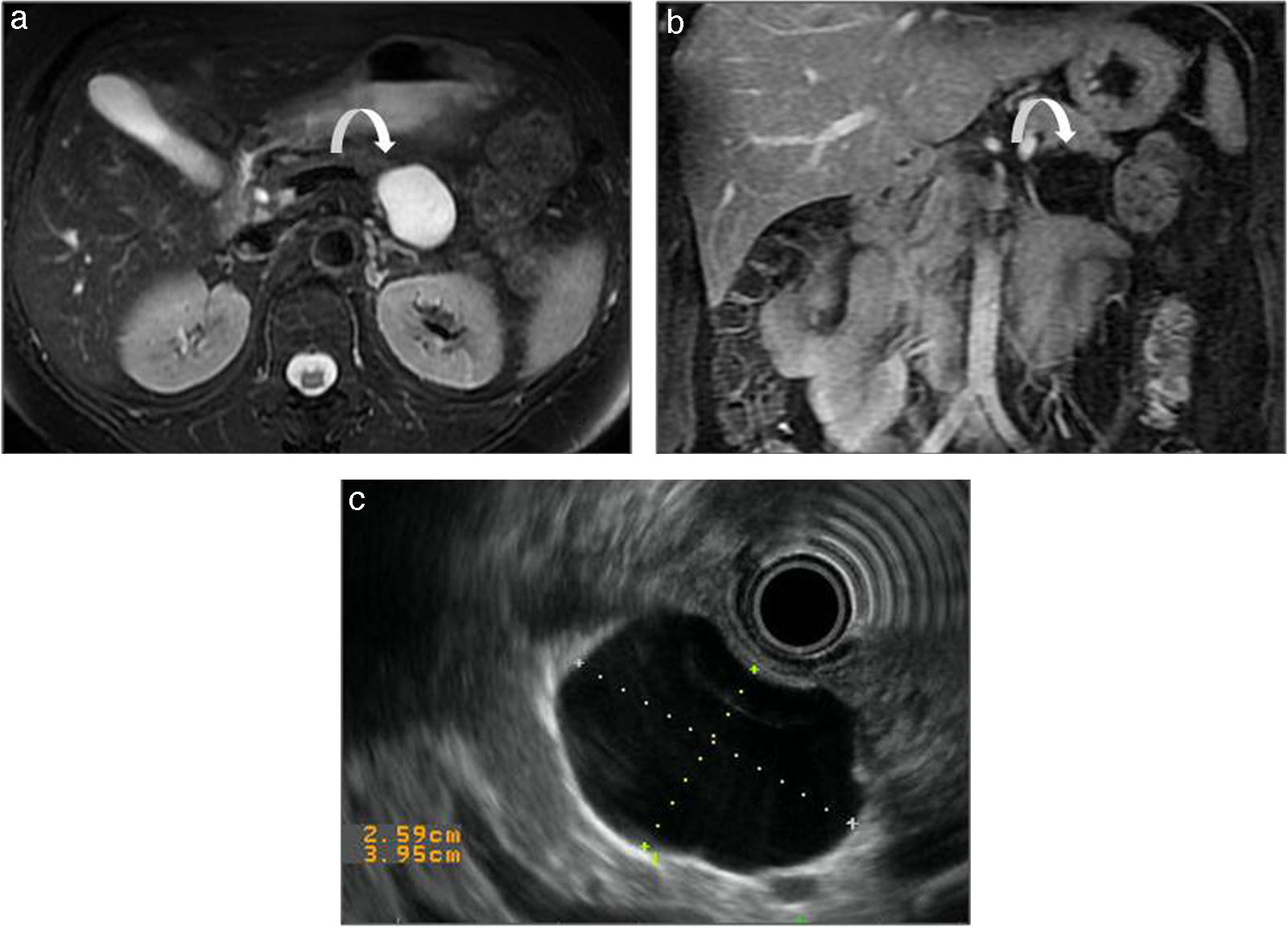
Cistoadenoma mucinoso. a y b) RM en secuencia potenciada en T2, plano axial (a) y secuencia potenciada en T1, plano coronal (b) tras la administración de contraste intravenoso, en una paciente de 56 años. Lesión unilocular, bien delimitada, de diámetro mayor de 2cm, hiperintensa en T2 e hipointensa en T1 (flechas blancas curvas). c) Ecoendoscopia del mismo paciente. Lesión unilocular, anecoica y bien delimitada en cola pancreática.
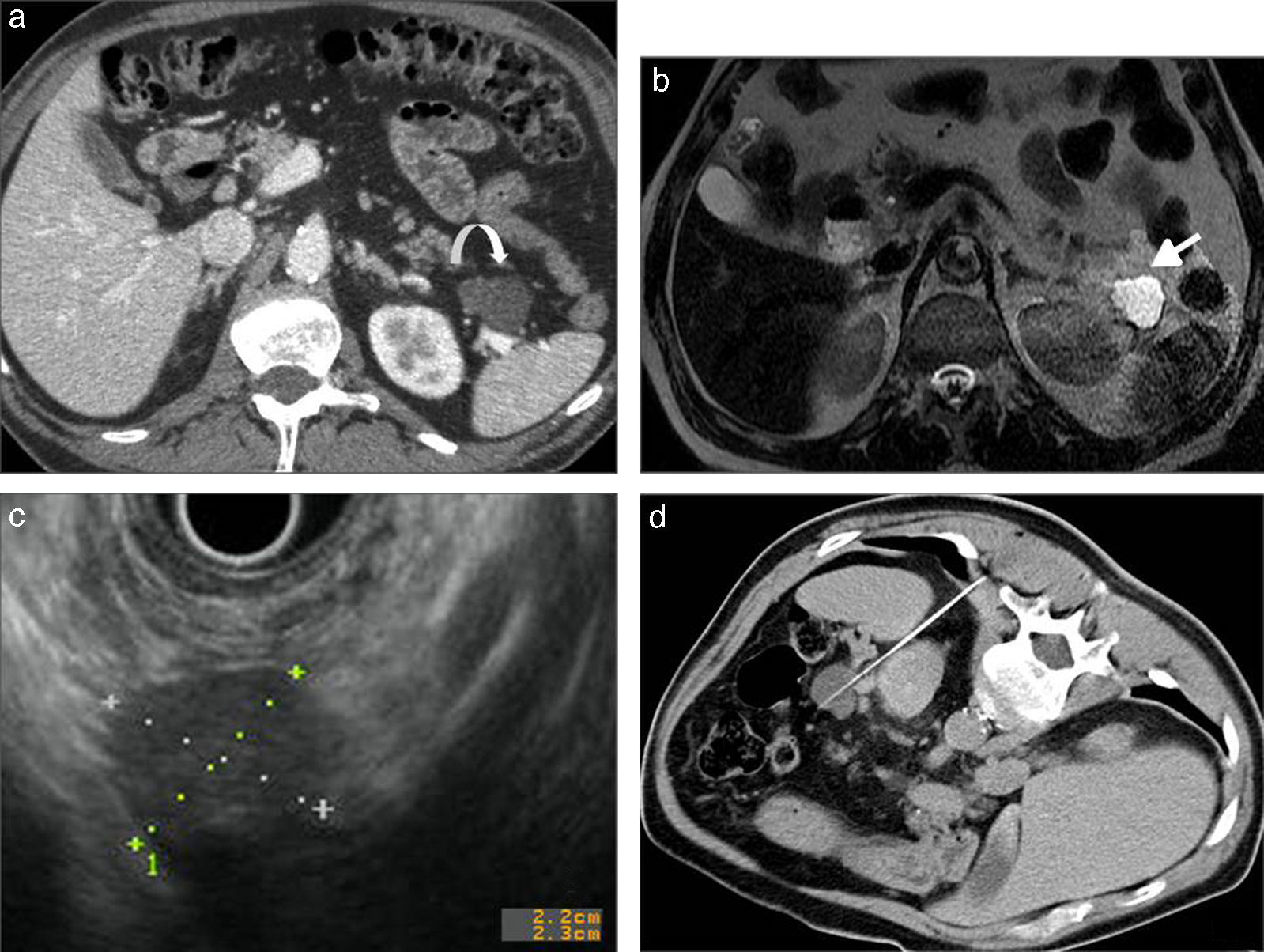
Cistoadenoma mucinoso. a) TCMD tras la administración de contraste intravenoso, plano axial. Lesión quística unilocular, bien delimitada, localizada en cola pancreática (flecha blanca curva). b) RM en secuencia potenciada en T2, plano axial, del mismo paciente. Lesión hiperintensa en cola pancreática, unilocular y sin tabicaciones internas (flecha blanca recta). c) Ecoendoscopia del mismo paciente. Lesión quística en cola pancreática con contenido ecogénico secundario a la presencia de mucina en su interior. d) Punción-aspiración del mismo paciente guiada mediante TC.
El líquido obtenido tras la punción-aspiración es viscoso por su contenido en moco y células columnares. Típicamente la concentración de CEA en el líquido aspirado se encuentra por encima de 192ng/ml y los niveles de amilasa son bajos22,32.
Neoplasia papilar intraductal mucinosaSe origina del epitelio ductal, lo que da lugar a secreciones mucosas y, por tanto, dilatación de los conductos pancreáticos33. Constituyen aproximadamente el 20% de las lesiones quísticas pancreáticas4 y existen tres formas: lesión del conducto principal, lesión de ramas laterales (benigna en la mayoría de las ocasiones) y lesión mixta34,35.
Presenta una frecuencia similar en mujeres y hombres y una media de edad de presentación de 65 años36. La mayoría de las lesiones se detectan de forma causal en estudios de imagen, aunque cuando son sintomáticos cursan con dolor abdominal, pérdida de peso, episodios de pancreatitis e insuficiencia pancreática37.
Tanto en la TC como en la RM, la variante del conducto principal se manifiesta como dilatación segmentaria o difusa del conducto pancreático principal. Es característica la presencia de pequeños nódulos intraductales y en ocasiones puede verse atrofia del parénquima pancreático38.
En ecoendoscopia se observa una ectasia del conducto pancreático junto con una dilatación quística de las ramas laterales por obstrucción secundaria a la producción de mucina38.
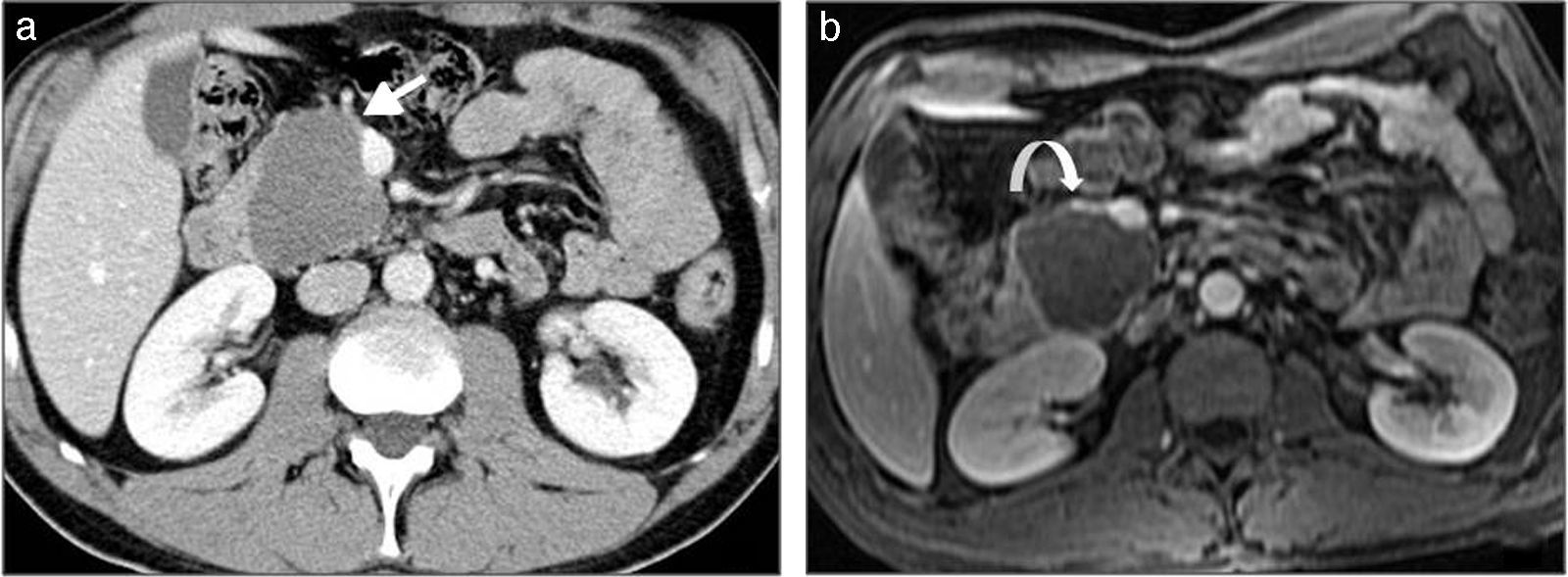
La variante de las ramas laterales tiene dos patrones distintos: macroquístico y microquístico. En la TC se observa una lesión hipocaptante, heterogénea, clásicamente localizada en el proceso uncinado, aunque puede presentarse en cualquier localización39. En RM se observa como pequeñas masas ovaladas hiperintensas en secuencias potenciadas en T2, a menudo comunicadas con el conducto pancreático principal y que pueden ser multifocales hasta en el 30% de los casos (figs. 5 y 6)34,40.
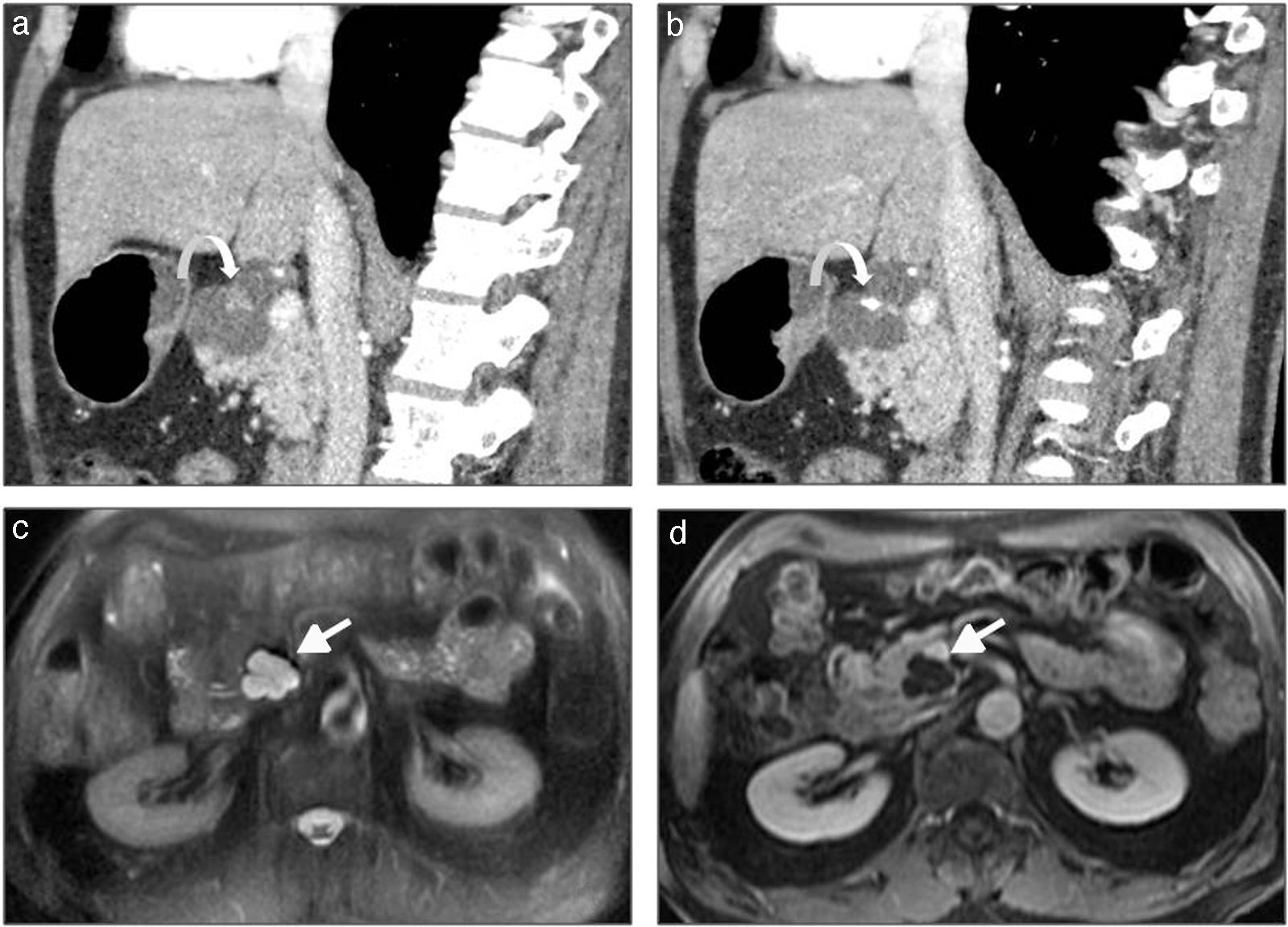
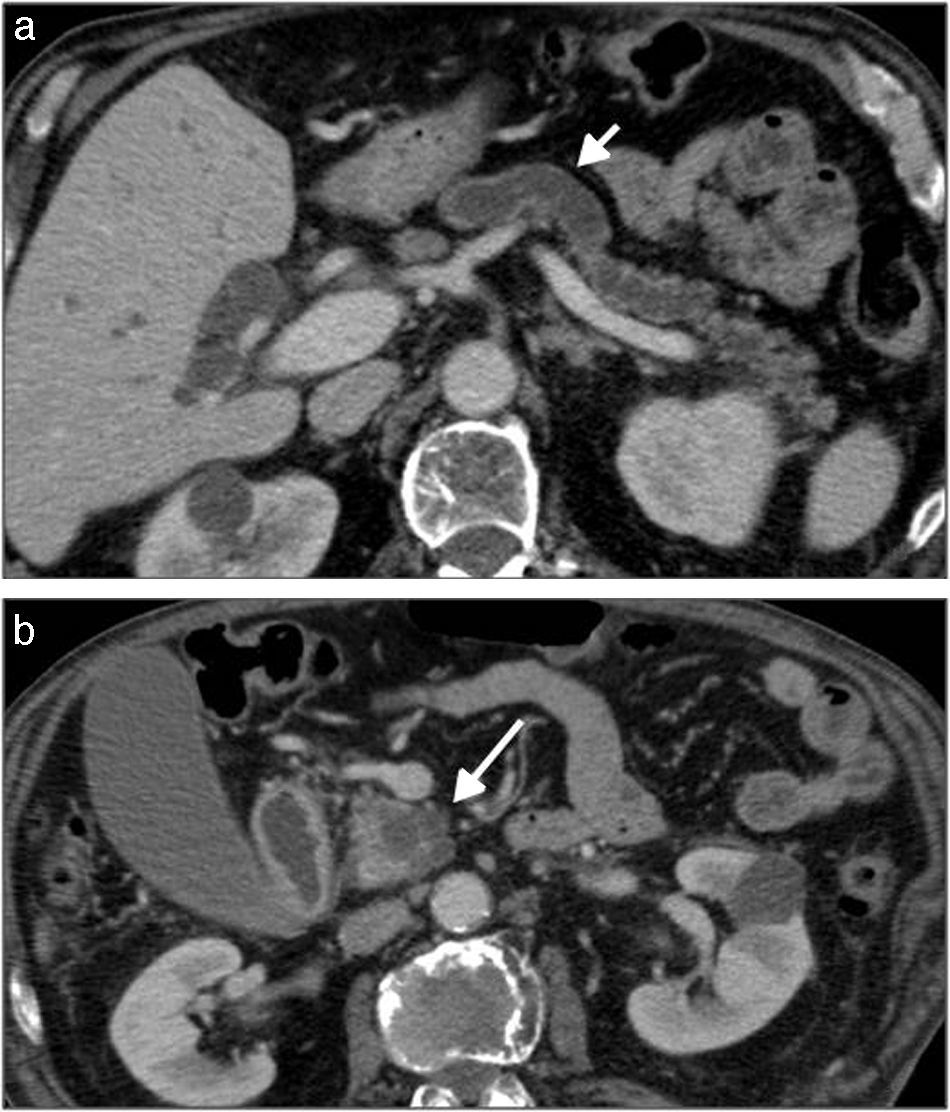
Neoplasia papilar intraductal mucinosa, variante del conducto principal. a y b) TCMD tras la administración de contraste intravenoso en un paciente de 67 años. Tumoración en cabeza pancreática, polilobulada, formada por múltiples quistes de unos 2cm de diámetro (flecha blanca larga), con dilatación del colédoco, de la vía biliar intrahepática y del conducto pancreático principal (flecha blanca corta).
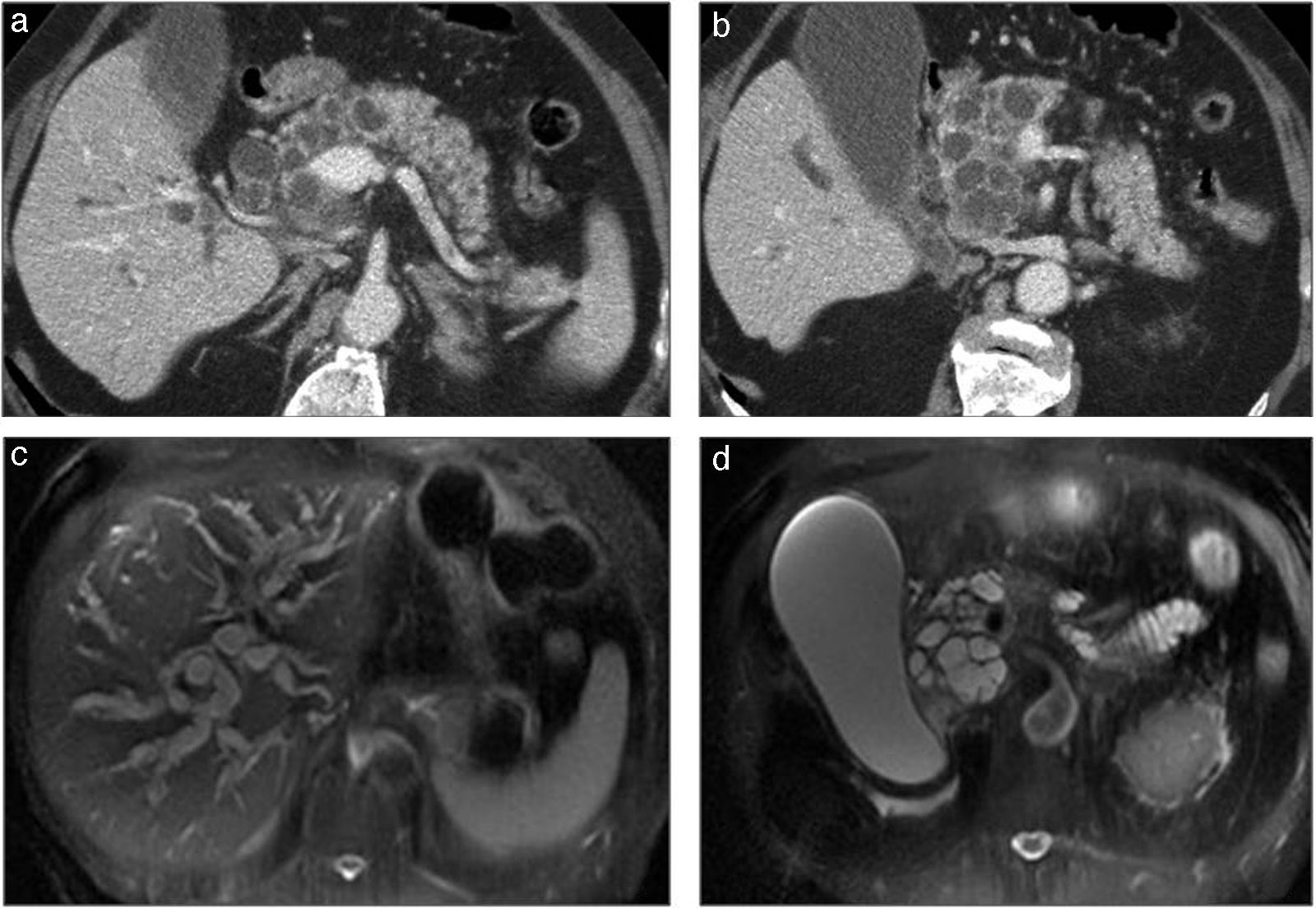
Neoplasia papilar intraductal mucinosa. a y b) TCMD tras la administración de contraste intravenoso, en un paciente de 74 años en estudio por ictericia obstructiva. Lesión focal en cabeza y cuerpo de páncreas, multiquística, con dilatación del colédoco y de la vía biliar intrahepática. c y d) RM del mismo paciente, en secuencias potenciadas en T2. Dilatación de la vía biliar intrahepática (c) y distensión vesicular (d) debido a la presencia de la lesión multiquística, hiperintensa, en cabeza y cuerpo de páncreas.
La morfología en ecoendoscopia varía desde formas uniloculares anecoicas a lesiones complejas multiquísticas. El calibre del conducto pancreático principal es normal y la comunicación entre la lesión y el conducto principal puede apreciarse mediante esta técnica7.
En el análisis del líquido de la lesión se encuentran valores elevados de CEA (por encima de 192ng/ml) y cifras normales o elevadas de amilasa22,32.
Según la Organización Mundial de la Salud, pueden ser benignos (sin displasia), borderline (displasia en grado medio-moderado) y malignos. Las formas malignas se encuentran en aproximadamente el 70% de los casos que afectan al conducto principal y en aproximadamente el 25% de los casos que afectan únicamente a las ramas laterales. Los criterios de malignidad son: nódulos murales, componente focal sólido, dilatación del conducto principal de más de 10mm o realce de la pared del conducto pancreático principal. Así mismo, un tamaño inferior a 3cm sin nódulos murales en la variante de las ramas laterales se asocia con bajo grado de malignidad41–44.
En secuencias de RM potenciadas en difusión, las formas no invasivas del NPIM se asocian con valores altos del coeficiente de difusión aparente (CDA) a lo largo del conducto pancreático afectado, debido a las características del líquido de su interior, al contrario de lo que ocurre en el cistoadenoma seroso y el tumor quístico mucinoso, en los que estas secuencias no sirven para diferenciar las variantes no neoplásicas45.
OtrosEl tumor neuroendocrino quístico representa únicamente el 17% del total de los tumores neuroendocrinos. Tiene una frecuencia similar en mujeres y hombres y una media de edad de presentación de 53 años. Sin embargo, suelen ser más grandes (49mm vs. 23,5mm), más frecuentemente sintomáticos (73% vs. 45%) y con mayor probabilidad de ser no funcionantes (80% vs. 50%) que los tumores neuroendocrinos sólidos. Los pacientes con tumores neuroendocrinos quísticos tienen mayor probabilidad (3,5 veces más) de presentar un síndrome MEN I que los pacientes con tumores neuroendocrinos sólidos. El riesgo de metástasis es igual para ambas variantes46.
Se localizan más a menudo en el cuerpo y la cola pancreática. Debido a la naturaleza hipervascular de los tumores neuroendocrinos, se caracterizan en los estudios de imagen como masas quísticas con septos en su interior y con un anillo hipervascular periférico (fig. 7)46. En la ecoendoscopia, sus hallazgos de imagen son inespecíficos: lesiones heterogéneas, bien delimitadas, completamente quísticas o sólidas con componentes quísticos. El líquido del quiste presenta niveles bajos de CEA y de amilasa22.
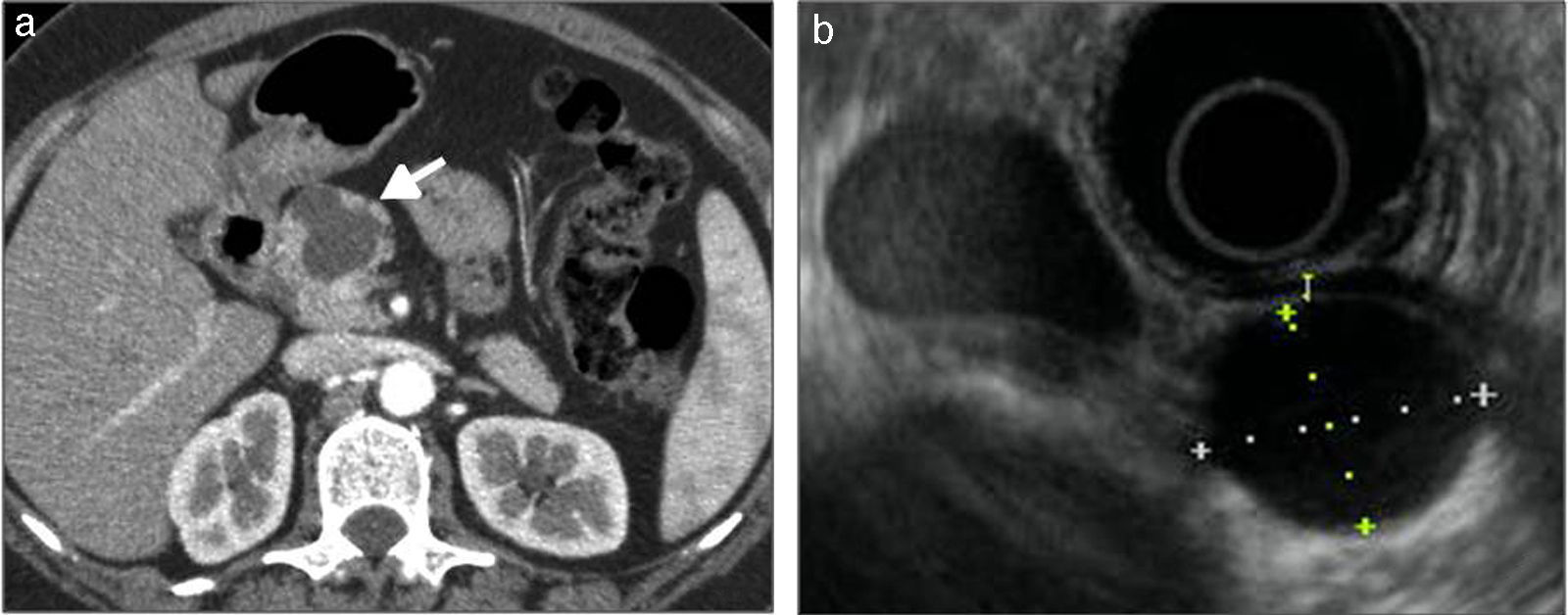
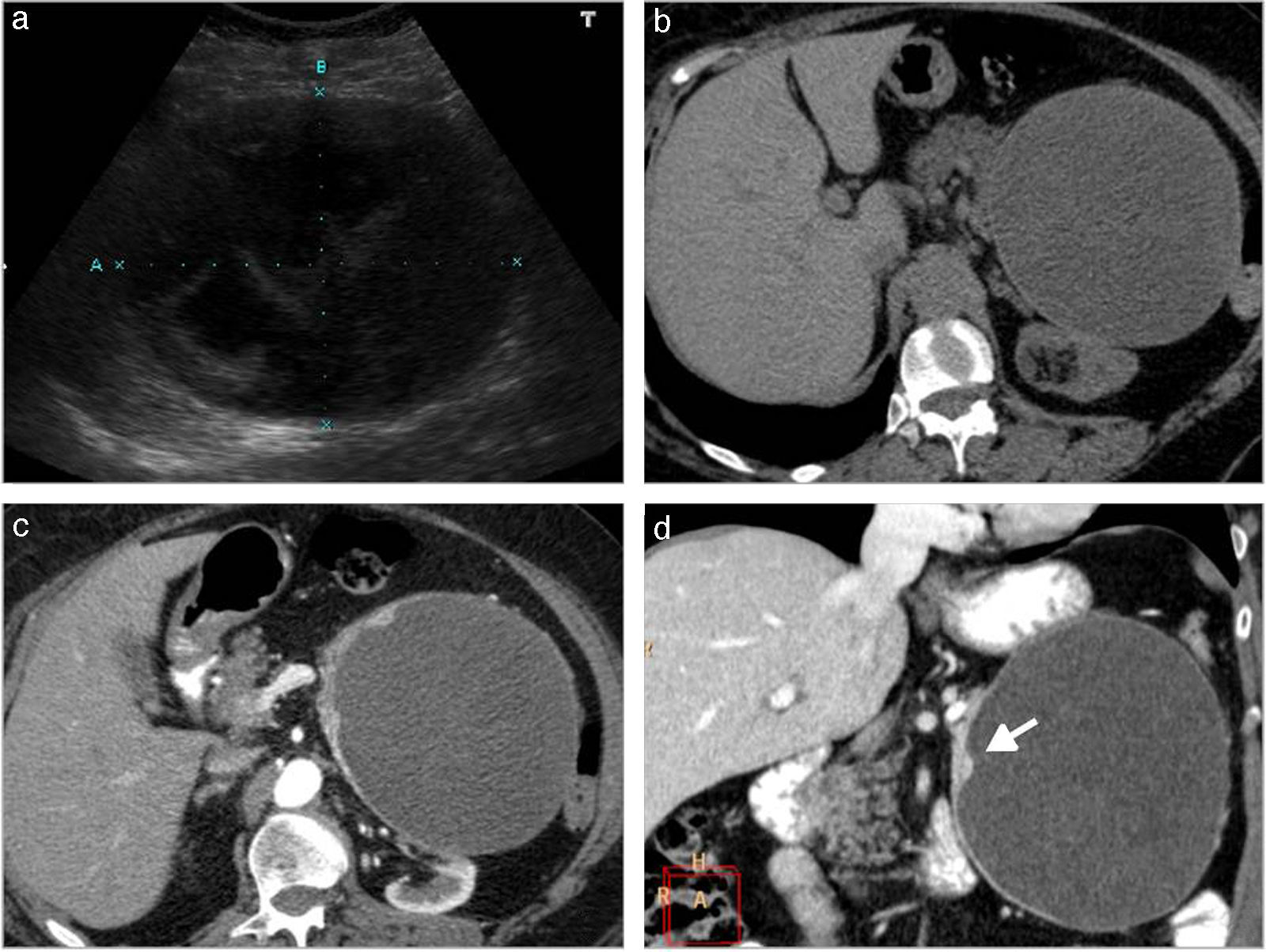
Tumor neuroendocrino con cambios quísticos. a) Ecografía abdominal en una paciente de 76 años. Se aprecia una masa bien delimitada localizada en la cola del páncreas, predominantemente quística aunque con material ecogénico y alguna tabicación en su interior. b-d) TCMD de la misma paciente, sin contraste (b) y tras la administración de contraste intravenoso, en fases arterial (c) y parenquimatosa portal (d). Voluminosa masa quística en cola de páncreas, con engrosamiento nodular parietal que realza tras la administración de contraste (flecha blanca recta).
El tumor sólido seudopapilar es un tumor raro con bajo riesgo de malignidad. Aproximadamente el 91% de estos tumores se desarrollan en mujeres, con una media de edad de presentación de 22 años. Clínicamente se manifiestan con dolor y masa palpable en la exploración. Puede presentarse en cualquier localización del páncreas, con una cierta predilección por la cola. Aproximadamente el 20% presentan metástasis al diagnóstico47.
Suelen ser tumores bien circunscritos, con áreas hiperintensas en secuencias potenciadas en T2 en relación con los componentes quísticos (fig. 8). También pueden existir áreas hiperintensas en T1 debido a procesos de degeneración hemorrágica. Las calcificaciones periféricas están presentes en aproximadamente el 31% de los casos48. En ecoendoscopia se presentan como masas heterogéneas, bien delimitadas, predominantemente sólidas con áreas quísticas en su interior. Los niveles de CEA del líquido de la lesión pueden ser variables y los de amilasa son bajos49,50.
Tumor sólido seudopapilar. a y b) Ecografía basal y con contraste en una paciente de 21 años con dolor abdominal leve. Se aprecia una masa sólida epigástrica discretamente ecogénica, que presenta áreas que no realzan tras la administración de contraste. c y d) RM de la misma paciente, en secuencia potenciada en T2 axial (c) y en T1 axial con contraste hepatoespecífico (por sospecha de lesión hepática en la ecografía), en fase portal (d). Lesión de bordes bien definidos localizada en cabeza pancreática (flecha blanca recta), sin comunicación con el conducto pancreático principal y con una cápsula fibrosa hipointensa en T1 y en T2. Presenta además áreas sólidas periféricas que captan contraste discretamente (flecha blanca curva).
El quiste linfoepitelial es una lesión quística benigna, más frecuente en varones entre la 5.ª y la 6.ª décadas de la vida. Pueden ser uni o multiloculares y su localización más frecuente es la cabeza pancreática. En RM se presentan como una masa homogéneamente hipointensa en T1, con un anillo de realce periférico tras la administración de gadolinio (fig. 9)51. En secuencias de fase-fuera de fase es característico observar una caída de la señal debido a la presencia de cristales de colesterol, hallazgo que según algunos autores permite diagnosticar esta entidad y diferenciarla de otras lesiones quísticas pancreáticas52.
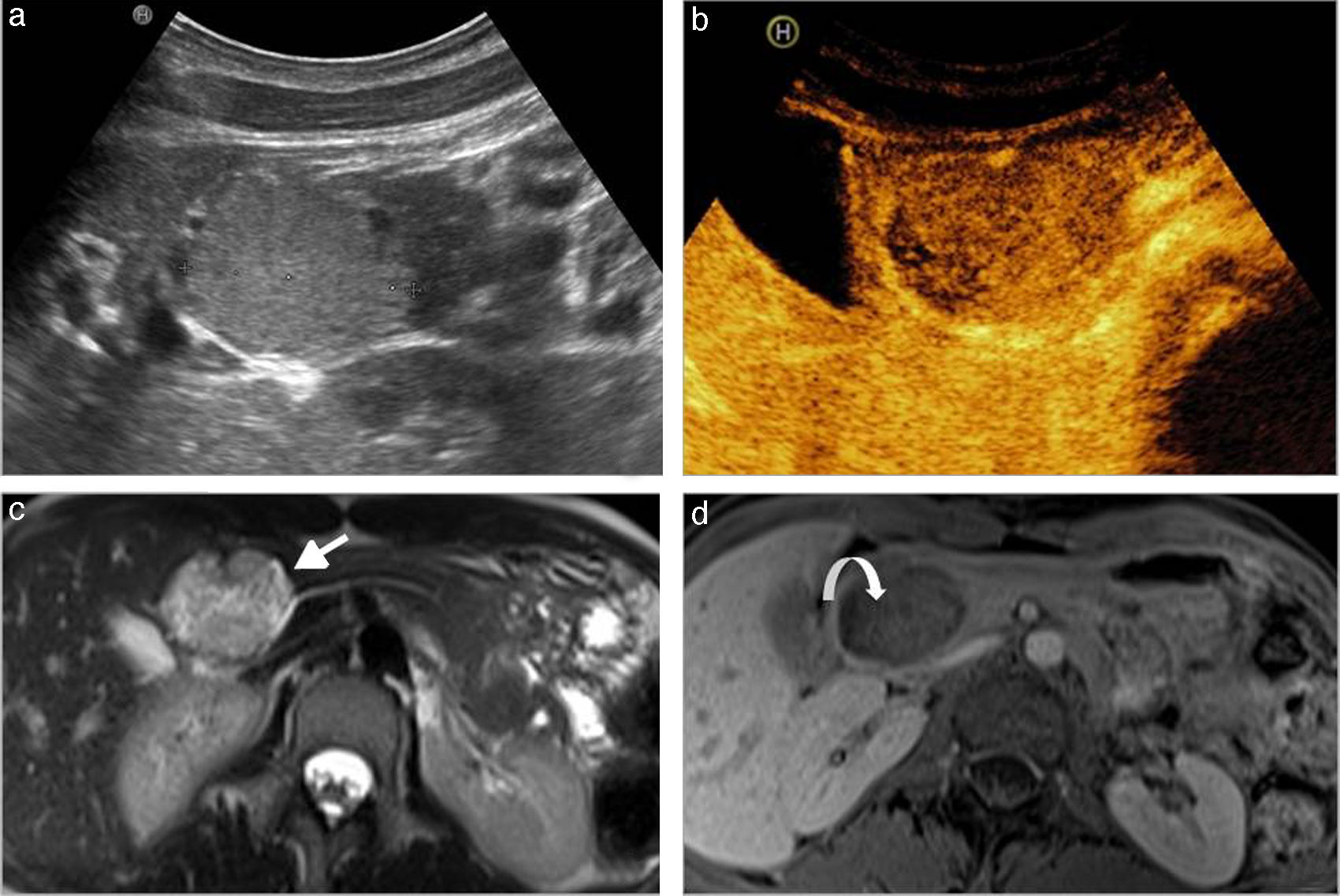
Quiste linfoepitelial. a) TCDM tras la administración de contraste intravenoso en un paciente de 55 años. Lesión hipocaptante, unilocular, en proceso uncinado (flecha blanca recta). b) RM del mismo paciente, en secuencia potenciada en T1 con contraste intravenoso. Lesión homogéneamente hipointensa, bien delimitada y con realce periférico (flecha blanca curva).
Ocasionalmente (entre el 1% y el 8% de los casos), el adenocarcinoma de páncreas puede presentar áreas quísticas en su interior debido sobre todo a fenómenos de necrosis, pero también por la presencia quistes de retención secundarios a la obstrucción del conducto pancreático o a seudoquistes tras procesos inflamatorios del páncreas53.
Por último, merece la pena mencionar el cistoadenoma de células acinares. Es una entidad benigna, generalmente multilocular y difícilmente distinguible de la variante del conducto principal de NPIM, aunque existen algunas peculiaridades que pueden ayudar a su correcto diagnóstico: se da en pacientes más jóvenes, está formado por al menos cinco quistes de distribución generalmente periférica y con calcificaciones. Además, no existe comunicación con el conducto pancreático principal54,55.
Tratamiento y seguimiento de los pacientesLa decisión del tratamiento quirúrgico se basa tanto en el potencial de malignidad como en la presencia de síntomas relacionados con la lesión. En general, toda NQP sintomática en un paciente operable debería ser valorada para tratamiento quirúrgico resectivo. En el caso de una NQP incidental y asintomática es fundamental aproximarse al máximo a la certidumbre diagnóstica para tomar la decisión más adecuada a cada paciente.
En el caso del cistoadenoma seroso, la transformación maligna es rara, por lo que la cirugía solo se recomienda en pacientes sintomáticos o cuando no se pueda establecer preoperatoriamente el diagnóstico diferencial con otras NQP. Algunos autores, ante la posible existencia de cistoadenocarcinomas serosos en lesiones de gran tamaño así como el riesgo de aparición de síntomas a corto plazo en lesiones mayores de 4cm, proponen la cirugía a partir de ese tamaño. Para los pacientes intervenidos y con márgenes quirúrgicos libres, no es necesario el seguimiento mediante pruebas de imagen56,57.
En cuanto al tumor quístico mucinoso, debido a su potencial maligno y a la edad típica de presentación, la cirugía está recomendada para pacientes sanos y con baja morbilidad. En caso contrario (pacientes con elevada morbilidad asociada o baja expectativa de vida) se puede optar por un control radiológico anual o semestral en lesiones mayores de 3cm, en las que parece existir mayor riesgo de malignidad58.
No hay riesgo de recurrencia después de la cirugía del cistoadenoma mucinoso benigno con márgenes negativos, por lo que el seguimiento mediante pruebas de imagen no es necesario. Sin embargo, en pacientes operados con anatomía patológica compatible con cistoadenocarcinoma, el seguimiento se realizará cada 6 meses debido al riesgo elevado de recurrencia58.
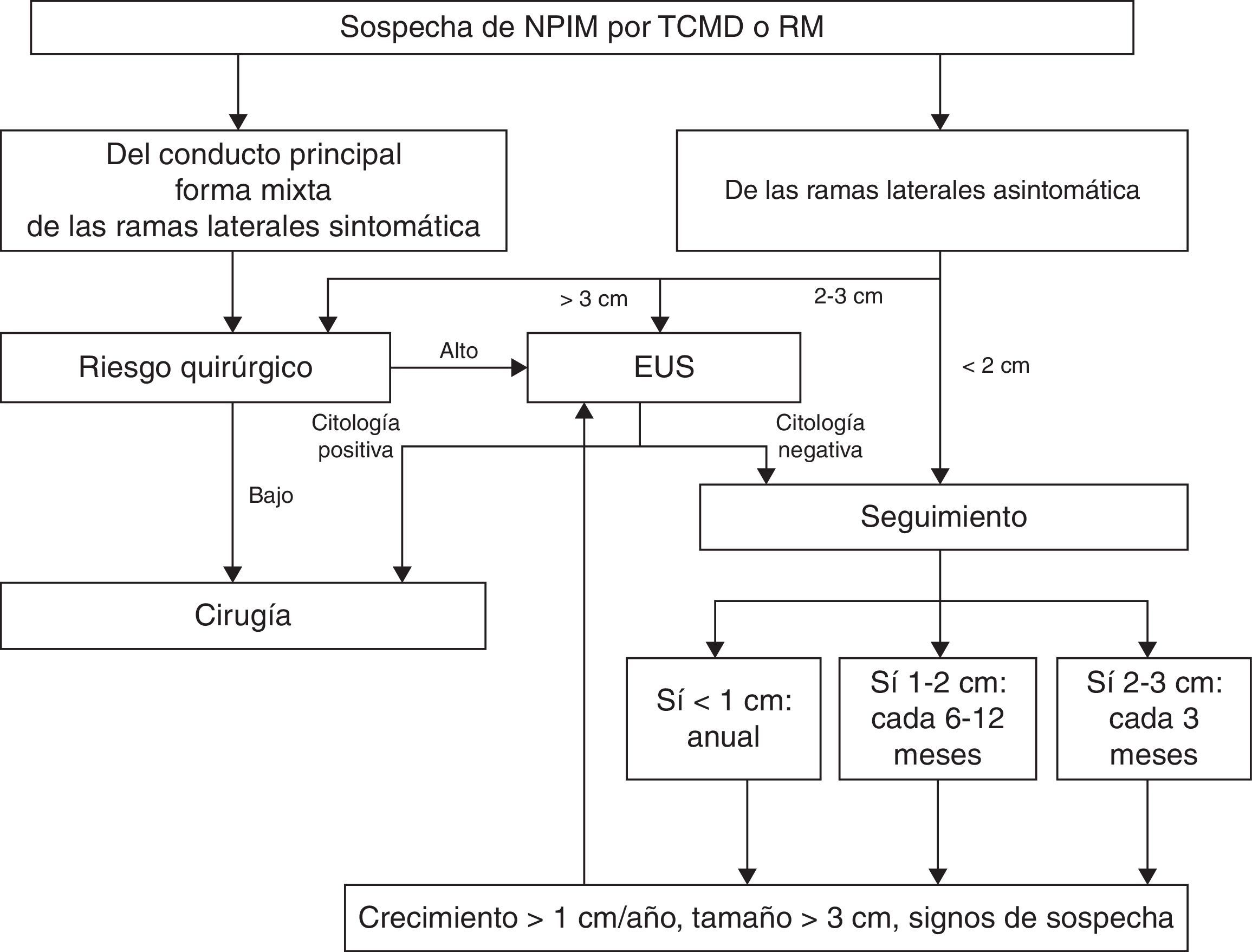
En la neoplasia papilar intraductal mucinosa, las guías de manejo recomiendan la cirugía para las variantes del conducto pancreático principal y las formas mixtas, independientemente de la existencia de síntomas. En cuanto a las variantes de las ramas laterales o secundarias, la indicación quirúrgica es todavía controvertida. Se consideran criterios quirúrgicos la presencia de síntomas, un tamaño mayor de 3cm, la existencia de nódulos o engrosamientos parietales, la elevación de los marcadores tumorales y la progresión del tamaño en el seguimiento59–61. En los pacientes en los que se opte por un seguimiento estricto, se recomienda una periodicidad de seguimiento en función del tamaño de la lesión, anual en tumores inferiores a 1cm, cada 6-12 meses en lesiones entre 1 y 2cm y control cada 3 meses en las lesiones mayores de 2cm (fig. 10).
Protocolo de actuación según las guías internacionales para la neoplasia papilar intraductal mucinosa.
Tomado de Sahani DV et al7.
Debido al riesgo de recurrencia, se recomienda seguimiento mediante pruebas de imagen después de la cirugía, cada 6 meses en caso de NPIM maligna y anual en NPIM benigna30.
Tanto en el tumor neuroendocrino quístico como en el tumor sólido seudopapilar, el tratamiento de elección es la cirugía. La buena circunscripción de este último permite normalmente su enucleación sin exéresis pancreática, lo que conlleva una tasa mucho menor de complicaciones postoperatorias46,47.
El tratamiento de elección actualmente considerado en el quiste linfoepitelial es la enucleación, siempre y cuando sea posible, aunque la pancreatectomía parcial deberá realizarse dependiendo de su localización51.
Por último, debido a su naturaleza todavía poco clara, es necesario realizar seguimiento del cistoadenoma de células acinares54.
ConclusionesLas neoplasias quísticas de páncreas constituyen un grupo heterogéneo de lesiones benignas, premalignas y malignas, cuyo diagnóstico y tipificación es muy importante, ya que implica un manejo terapéutico distinto. En ocasiones, no es posible establecer un diagnóstico definitivo únicamente mediante TC y RM, por lo que se requieren otras pruebas de imagen, como la ecoendoscopia, que además de información morfológica permite, a través de la punción y aspiración del contenido, obtener un análisis citológico y bioquímico de la lesión. El manejo óptimo de estas lesiones precisa de equipos multidisciplinares que garanticen un diagnóstico correcto y un tratamiento adecuado a cada paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsable de la integridad del estudio: CRT y RRL.
- 2.
Concepción del estudio: CRT y RRL.
- 3.
Diseño del estudio: CRT y RRL.
- 4.
Obtención de los datos: CRT y RRL.
- 5.
Análisis e interpretación de los datos: CRT y RRL.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: CRT y RRL.
- 8.
Redacción del trabajo: CRT y RRL.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CRT y RRL.
- 10.
Aprobación de la versión final: CRT y RRL.
Los autores declaran no tener ningún conflicto de intereses.
A los doctores Luis Sarría, Elena Martínez, Teresa Marcuello, M.ª Teresa Soria, Lara Luzón y Miguel Corral por su inestimable ayuda y en la búsqueda e iconografía de los casos.