Las fracturas vertebrales de baja energía suponen un reto diagnóstico para el radiólogo debido a su naturaleza, frecuentemente inadvertida, y a su semiología en imagen, a menudo sutil. Sin embargo, el diagnóstico de este tipo de fracturas puede resultar determinante, no solo por permitir realizar un tratamiento dirigido que evite complicaciones, sino también por la posibilidad de diagnosticar patologías sistémicas como la osteoporosis o la enfermedad metastásica. El tratamiento farmacológico en el primer caso ha demostrado evitar el desarrollo de otras fracturas y complicaciones, mientras que los tratamientos percutáneos y las diversas terapias oncológicas pueden ser una alternativa en el segundo caso. Por lo tanto, es preciso conocer la epidemiología y los hallazgos por imagen de este tipo de fracturas. El objetivo de este trabajo es revisar el diagnóstico por imagen de las fracturas de baja energía, con especial énfasis en las características que deben reseñarse en el informe radiológico para orientar a un diagnóstico específico que favorezca y optimice el tratamiento de los pacientes que padecen este tipo de fracturas.
Low-energy vertebral fractures pose a diagnostic challenge for the radiologist due to their often-inadvertent nature and often subtle imaging semiology. However, the diagnosis of this type of fractures can be decisive, not only because it allows targeted treatment to prevent complications, but also because of the possibility of diagnosing systemic pathologies such as osteoporosis or metastatic disease. Pharmacological treatment in the first case has been shown to prevent the development of other fractures and complications, while percutaneous treatments and various oncological therapies can be an alternative in the second case. Therefore, it is necessary to know the epidemiology and typical imaging findings of this type of fractures. The objective of this work is to review the imaging diagnosis of low-energy fractures, with special emphasis on the characteristics that should be outlined in the radiological report to guide a specific diagnosis that favours and optimizes the treatment of patients suffering of low energy fractures.
Las fracturas vertebrales secundarias a traumatismos de baja energía (FVBE) se definen como aquellas que tienen lugar sin un antecedente traumático conocido o son secundarias a caídas desde la propia altura del paciente. Las FVBE conllevan una significativa morbimortalidad que se incrementa de forma notable con la edad, representando una proporción elevada de los pacientes hospitalizados por traumatismo1,2. Con frecuencia, las FVBE ocurren en el contexto de una pérdida de la masa y de la arquitectura ósea normales (osteoporosis). La osteoporosis es la enfermad metabólica más común y afecta a más de 200 millones de personas en el mundo, estimándose que del 30 al 50% de las mujeres y del 20 al 30% de los hombres tendrán fracturas vertebrales por esta causa3. Estas fracturas pueden ser relativamente asintomáticas y detectarse en estudios radiológicos como hallazgo incidental. En otros casos pueden presentarse con dolor localizado después de una actividad cotidiana (levantarse, toser, etc.) o tras una caída desde la propia altura. Otra causa importante son las fracturas patológicas secundarias a tumores primarios o a metástasis. No obstante, se estima que hasta un tercio de las fracturas en pacientes oncológicos no son de causa tumoral, sino de causa osteoporótica4. De ahí la importancia de los métodos de imagen en su diagnóstico diferencial. En ambos casos, la semiología radiológica puede orientar adecuadamente el diagnóstico y la clasificación de las FVBE, condicionando un manejo óptimo del paciente5. Por lo tanto, es preciso conocer las características que permiten identificar y clasificar las FVBE en las distintas técnicas de imagen radiológicas, así como el papel de estas atendiendo al escenario clínico y al grado de sospecha.
El objetivo del presente trabajo es revisar los signos que permiten diagnosticar con diferentes técnicas de imagen las fracturas de baja energía de la columna vertebral y permiten diferenciar las fracturas por insuficiencia de las fracturas patológicas.
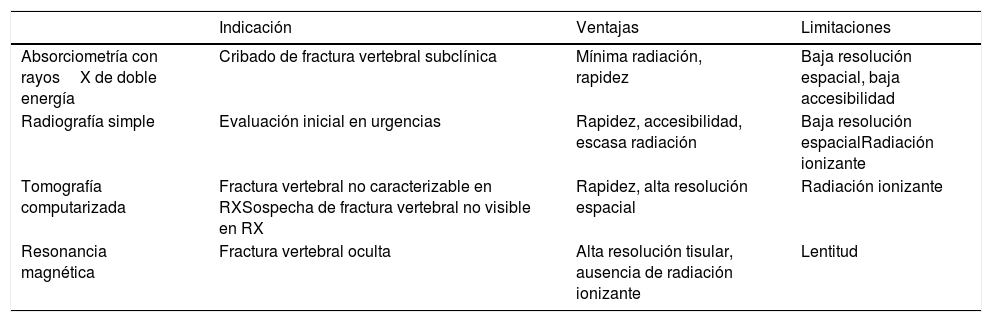
Diagnóstico por imagen de las FVBEDesde el punto de vista radiológico, las FVBE pueden detectarse y cuantificarse mediante distintas modalidades de imagen. Las más relevantes en la práctica clínica son la absorciometría con rayosX de doble energía (DXA), la radiografía simple, la tomografía computarizada (TC) y la resonancia magnética (RM). En la tabla 1 se describen las indicaciones y las principales ventajas y limitaciones de cada técnica.
Indicaciones, ventajas y limitaciones de las diferentes técnicas de imagen utilizadas en la evaluación de fracturas vertebrales de baja energía
| Indicación | Ventajas | Limitaciones | |
|---|---|---|---|
| Absorciometría con rayosX de doble energía | Cribado de fractura vertebral subclínica | Mínima radiación, rapidez | Baja resolución espacial, baja accesibilidad |
| Radiografía simple | Evaluación inicial en urgencias | Rapidez, accesibilidad, escasa radiación | Baja resolución espacialRadiación ionizante |
| Tomografía computarizada | Fractura vertebral no caracterizable en RXSospecha de fractura vertebral no visible en RX | Rapidez, alta resolución espacial | Radiación ionizante |
| Resonancia magnética | Fractura vertebral oculta | Alta resolución tisular, ausencia de radiación ionizante | Lentitud |
La radiografía simple es la primera técnica de elección para el diagnóstico de FVBE6. Sin embargo, su rendimiento diagnóstico es limitado. En el caso de las FVBE torácicas, los valores de sensibilidad en la detección de las fracturas oscilan entre el 40,07 y el 49,2%8, mientras que para las FVBE lumbares se ha estimado en torno al 57,8%5. En este sentido, es necesario recordar que los signos radiográficos de una FBVE pueden ser sutiles, y que los cambios morfológicos que identificamos en la radiografía pueden necesitar tiempo para desarrollarse. Por estos motivos, el hecho de no identificar con claridad signos de fractura vertebral mediante radiografía simple no excluye su presencia, siendo recomendable complementar el estudio con técnicas más sensibles en el caso de pacientes osteoporóticos con alta sospecha clínica9. Son muchos los métodos que se utilizan para clasificar y cuantificar la severidad de las fracturas osteoporóticas10, incluyendo métodos cuantitativos como los propuestos por Eastell et al.11 o McCloskey et al.12, cualitativos como el abordaje basado en algoritmo de Jiang et al.13 o el método de Sugita et al.14, o combinados o semicuantitativos, como los de Genant et al.15, Wáng et al.16, o el de la German Society for Orthopaedics and Trauma (DGOU)17. Sus ventajas e inconvenientes se han descrito en trabajos previos10,18, pero básicamente los métodos cuantitativos son los más objetivos al basarse en la medición de la altura vertebral, que puede hacerse manual o automáticamente, aunque pueden tener falsos positivos al diagnosticar como fracturas pérdidas de altura secundarias a otras causas y falsos negativos en fracturas sin pérdida de altura. Con respecto a los métodos cualitativos, el método ABQ (algorithm-based qualitative method) requiere evaluadores expertos para identificar las fracturas y diferenciarlas de deformidades vertebrales secundarias a otras causas (alteraciones del desarrollo, enfermedad de Scheuermann, escoliosis, etc.). Por último, los métodos semicuantitativos se usan en estudios epidemiológicos, por ejemplo el de Genant et al., pero también tienen aplicaciones en la práctica diaria para decidir el tipo de tratamiento, como el DGOU.
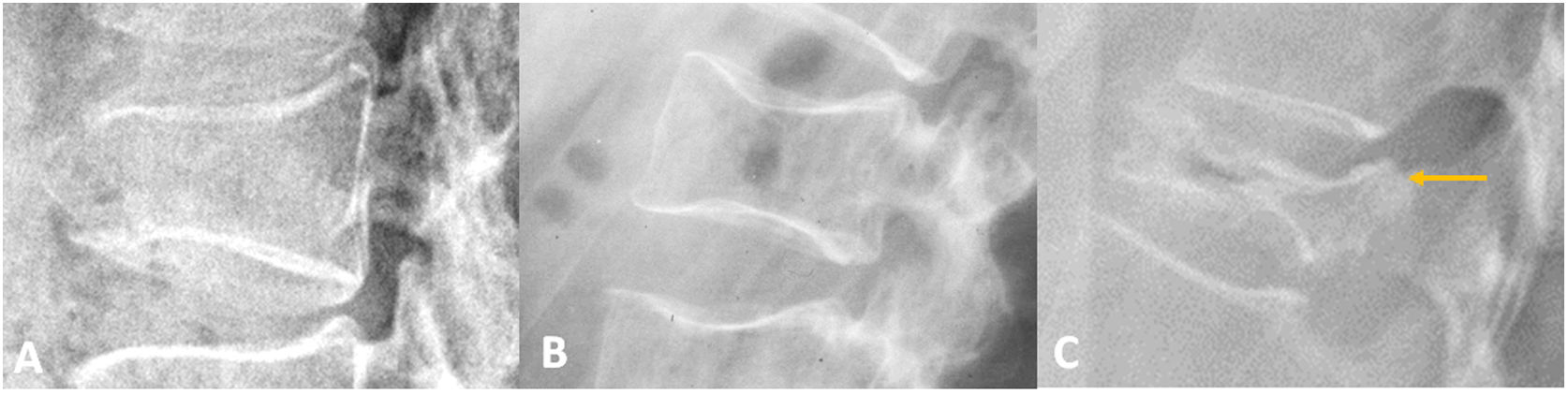
En cualquiera de los casos, los patrones morfológicos más frecuentes de las fracturas osteoporóticas son la deformidad en cuña anterior o posterior (esta última muy infrecuente), cóncava o bicóncava (en vértebra de pez o diábolo) y en estallido (fig. 1). En el caso de las fracturas en estallido puede existir retropulsión del margen posterosuperior o posteroinferior de la vértebra como signo que refuerza el diagnóstico de fractura no tumoral. La presencia de fenómenos de vacío intravertebral también se encuentra asociada con mayor frecuencia a fracturas no tumorales y se considera un signo de necrosis, falta de consolidación de las trabéculas óseas o inestabilidad intravertebral19,20.
Ejemplos de fractura vertebral según su patrón morfológico en radiografía simple. A)Fractura con deformidad en cuña anterior. B)Fractura con deformidad bicóncava, de pez o en diábolo. C)Fractura con deformidad en estallido. Nótese la retropulsión del margen posterosuperior de la vértebra (flecha).
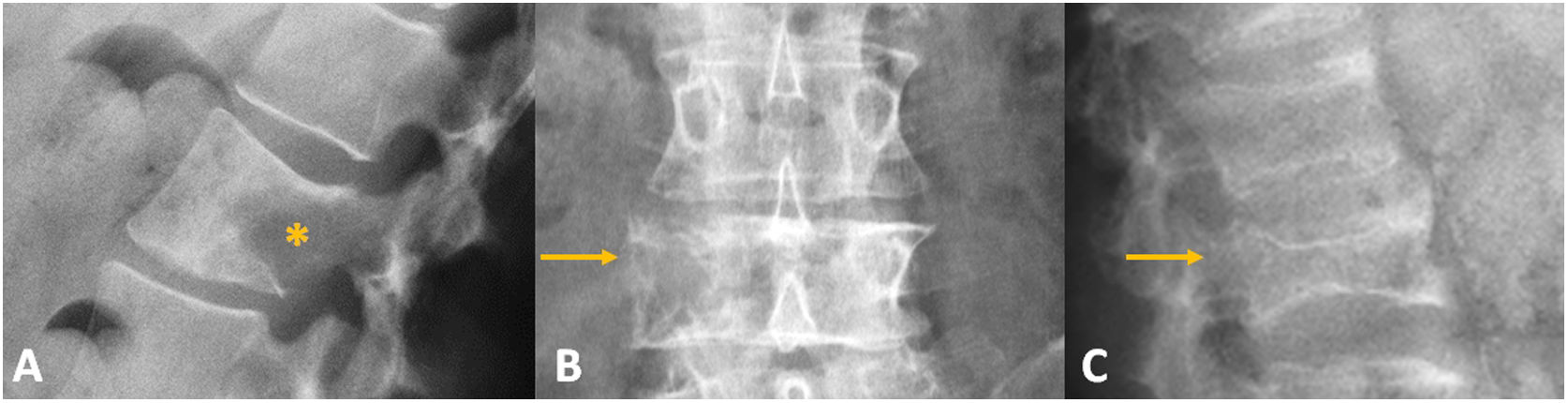
En el caso de sospecha de fractura patológica secundaria a neoplasia, la radiografía simple suele ser poco sensible a la destrucción o infiltración medular, requiriendo entre el 30 y el 50% de destrucción ósea para ser detectada21,22. La expansión del córtex vertebral debido al crecimiento del tumor dentro del cuerpo fracturado se manifiesta como una convexidad de las paredes vertebrales, mientras que la extensión del tumor al espacio paravertebral se puede detectar como una masa paravertebral. La osteólisis puede ser también evidente como destrucción de las paredes vertebrales y, cuando afecta al pedículo o pedículos, puede manifestarse con el signo de la vértebra tuerta o ciega, respectivamente23 (fig. 2). Del mismo modo, en el mieloma múltiple las fracturas y deformidades óseas pueden simular fracturas secundarias a osteoporosis, tanto en su morfología como en su localización. Estas fracturas pueden presentarse en el 50 al 70% de los pacientes con mieloma múltiple24,25. La resorción ósea excesiva es responsable de la apariencia radiolúcida de los huesos. En la radiografía convencional pueden presentarse, por separado o en asociación, la osteopenia y las lesiones líticas (fig. 2).
Ejemplos de fractura vertebral metastásica en radiografía simple. A)Fractura vertebral metastásica (asterisco) que condiciona una deformidad en cuña posterior. B)Signo de la vértebra tuerta por lisis del pedículo derecho (flecha). C)Fractura metastásica con morfología «en estallido» en mieloma múltiple (flecha). Nótese la alteración difusa de la radiolucencia normal del cuerpo vertebral fracturado, así como de las vértebras adyacentes debido a la infiltración tumoral.
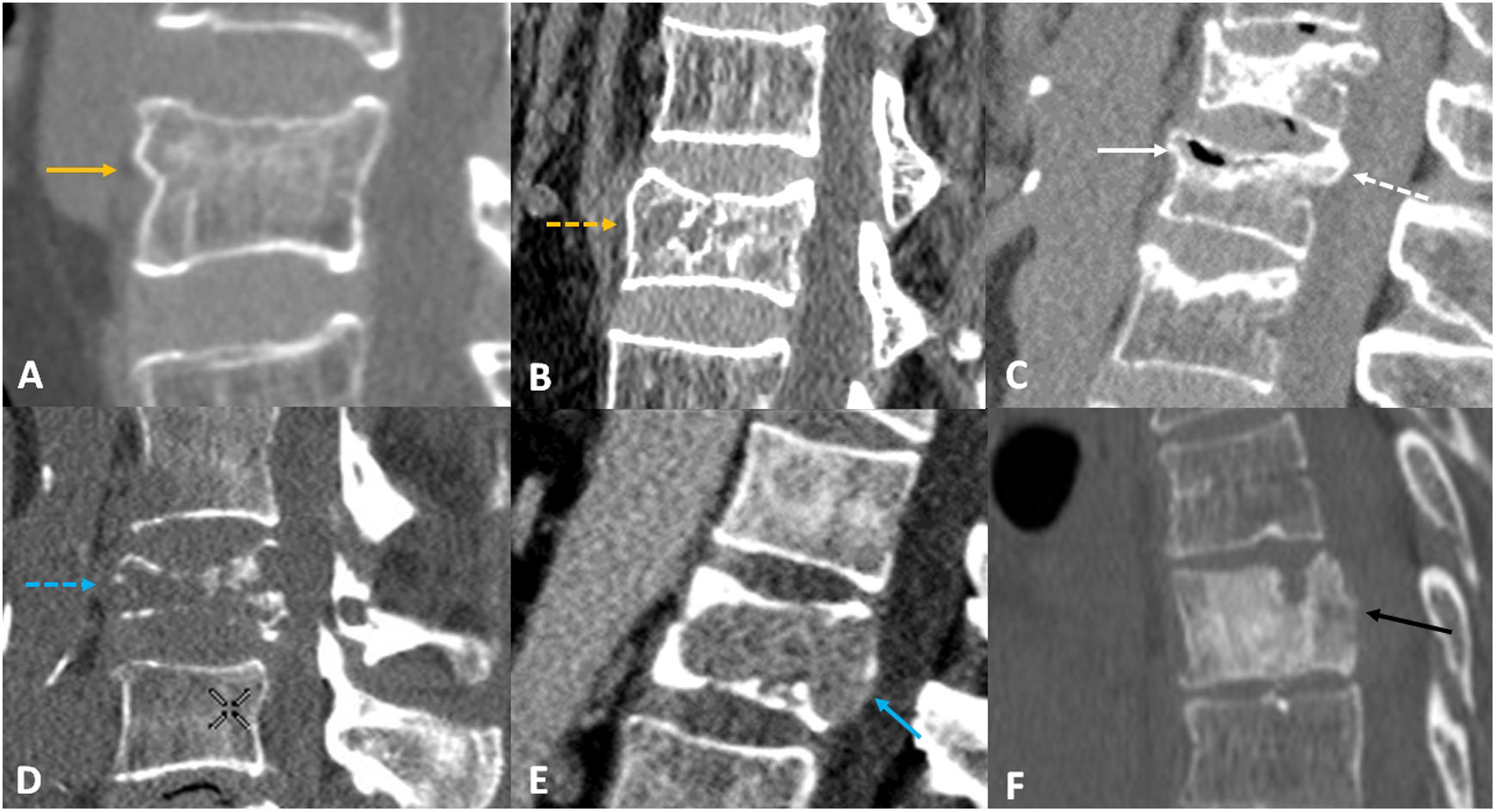
La TC es la prueba de elección cuando los hallazgos en la radiografía simple son equívocos, aunque algunos autores hacen especial énfasis en la necesidad de generar evidencia de calidad sobre su conveniencia como técnica de primera elección, considerando las limitaciones de la radiografía simple4. Es importante reseñar que siempre debe realizarse radiografía previamente, pues la TC implica dosis de radiación entre 13 y 55 veces mayor que la radiografía simple, en función del segmento de columna evaluado6-8. A pesar de su mayor capacidad, frente a la radiología simple, para detectar las lesiones o las fracturas corticales, en los pacientes osteoporóticos las líneas de fractura pueden ser muy sutiles y pasar desapercibidas para radiólogos poco expertos. Hay que prestar especial atención a las disrupciones corticales y al abombamiento o depresión de las plataformas o cortical de los cuerpos vertebrales. La compresión del hueso trabecular también puede dar lugar a imágenes lineales de aumento de densidad26 (fig. 3).
Ejemplos de fractura vertebral en tomografía computarizada. A)Fractura osteoporótica con abombamiento cortical anterior (flecha naranja). B)Fractura osteoporótica con discontinuidad cortical de la plataforma superior y quiste intravertebral (flecha naranja discontinua). C)Fractura osteoporótica con bandas de esclerosis y hendidura intravertebral con gas en su interior (fenómeno de vacío intrasomático, flecha blanca) y retropulsión del margen vertebral posterosuperior (flecha blanca discontinua). D)Fractura secundaria a metástasis lítica, con fenómenos de destrucción cortical y trabecular (flecha azul discontinua). E)Fractura patológica con lesión expansiva intrasomática que abomba la pared posterior (flecha azul). F)Fractura patológica en una metástasis osteoblástica.
La TC también permite identificar con más detalle que la radiografía simple los signos que se asocian a fracturas osteoporóticas, como el fenómeno de vacío intravertebral o la retropulsión de los márgenes vertebrales en el caso de fracturas en estallido. Igualmente, en el caso de fracturas patológicas, la TC es capaz de detectar con mayor sensibilidad las lesiones osteolíticas y las osteoblásticas, así como la convexidad de las paredes del cuerpo vertebral y la extensión a las partes blandas de la masa tumoral27 (fig. 3).
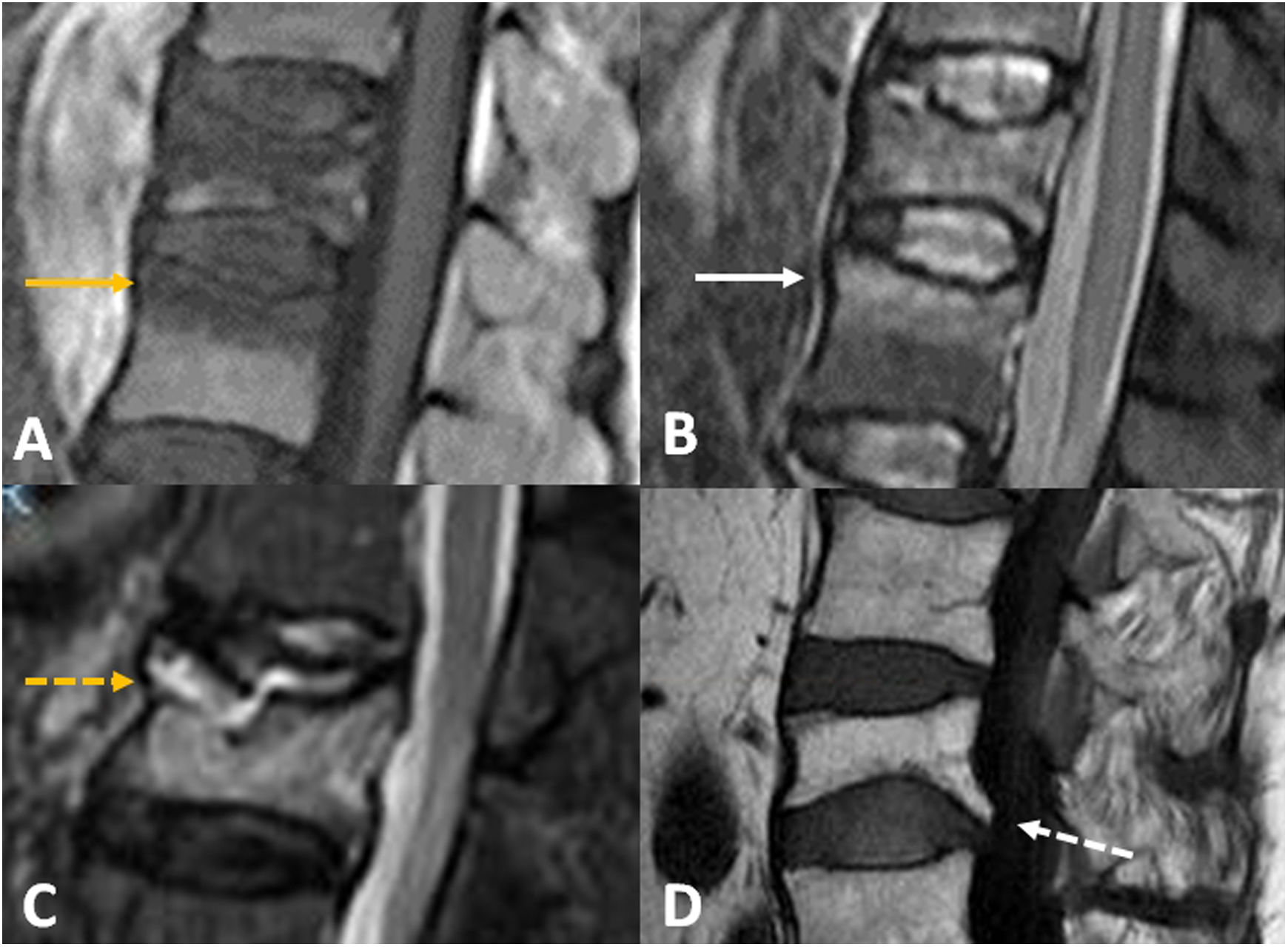
Resonancia magnética (RM)La RM es la técnica más sensible para detectar edema vertebral, signo que traduce una fractura aguda o inestable y puede evidenciarse aun en ausencia de los cambios morfológicos vertebrales descritos en los apartados previos9. Los hallazgos de imagen en relación con el edema vertebral son dinámicos en función de la cronología de la fractura. Así, las fracturas agudas osteoporóticas suelen mostrar un patrón de edema óseo en banda que recorre el trazo de fractura, muchas veces identificable, paralelo a las plataformas vertebrales y de localización subcondral, respetando la intensidad de señal del resto del cuerpo vertebral. El límite entre el hueso sano y el foco de edema por fractura suele ser regular y bien definido. Cuando la fractura se estabiliza, el edema suele desaparecer en un periodo inferior a tres semanas. Sin embargo, en el caso de fracturas inestables, el edema tiende a cronificarse y se suele asociar a cambios escleróticos y a alteraciones morfológicas del cuerpo vertebral, acuñamiento o pérdida de altura más marcados en bipedestación y reversibles en diferente grado en decúbito supino o prono. Por el contrario, la fractura crónica reparada se caracteriza por una recuperación de la intensidad de señal grasa normal del cuerpo vertebral, a pesar de que permanezca, también estable, la deformidad provocada por la fractura. La presencia de quistes de aire o de líquido en el interior del cuerpo vertebral suele indicar falta de consolidación de la fractura y su persistencia en el tiempo implica inestabilidad secundaria a la falta de consolidación del foco de fractura. Estos cleft o hendiduras son mucho más frecuentes en las FVBE osteoporóticas que en las fracturas metastásicas (fig. 4).
Ejemplos de fractura vertebral osteoporótica en resonancia magnética. A)Imagen T1 TSE sagital. Fractura aguda con bandas hipointensas paralelas a la plataforma vertebral superior. Puede identificarse la línea de fractura, de menor intensidad (flecha naranja). B)Imagen STIR sagital de la misma fractura, donde se evidencia el aumento de intensidad en banda correspondiente al edema perifractuario (flecha blanca). C)Imagen STIR sagital. Fractura con hendidura o cleft subcondral en la parte superior que traduce inestabilidad del foco de fractura (flecha naranja discontinua). D)Imagen T1 TSE sagital. Fractura crónica en estallido con retropulsión del margen vertebral posteroinferior en la que se ha recuperado la intensidad de señal grasa vertebral tras su consolidación (flecha blanca discontinua).
El diagnóstico diferencial más importante de la fractura vertebral osteoporótica son las fracturas patológicas secundarias a lesiones localizadas en las vértebras, ya sean malignas, como metástasis, mieloma, leucemia, linfoma, o bien tumores-pseudotumores primitivos de columna benignos o malignos, como el hemangioma (malformación vascular intraósea), el tumor de células gigantes, el quiste óseo aneurismático, el cordoma, etc. En este caso suele estar indicada la RM sin y con contraste28. Es sabido que las fracturas vertebrales osteoporóticas pueden presentarse hasta en un tercio de los pacientes oncológicos, por lo que las fracturas en estos pacientes no siempre son sinónimo de metástasis4,29.
Las fracturas patológicas metastásicas pueden mostrar la sustitución completa de la médula ósea normal del cuerpo vertebral por una intensidad de seña anómala, o, cuando la sustitución es incompleta, mostrar un patrón nodular o parcheado, o con un margen irregular entre las áreas de señal alterada y las de señal conservada. Los signos morfológicos son un borde vertebral convexo, debido a la expansión provocada por el crecimiento tumoral, y la presencia de masa paravertebral asimétrica o lobulada30 (fig. 5). Una causa de error puede ser la presencia de edema y/o hemorragia perivertebral en las fracturas vertebrales benignas, que se muestra como un engrosamiento de partes blandas más simétrico y liso que el aspecto de masa tumoral asimétrica de las fracturas malignas.
Ejemplos de fractura vertebral patológica en resonancia magnética. A,B)Imágenes T1 flair y T2 TSE sagitales en un paciente con cáncer de pulmón que muestran el borde convexo posterior del cuerpo vertebral (flecha). C)Imagen T1 flair sagital de fractura patológica con afectación difusa de la señal del cuerpo vertebral (flecha) en un paciente con linfoma. La vértebra inferior muestra una afectación parcheada. D)Imagen T2 TSE axial con supresión grasa de fractura patológica con afectación de ambos pedículos y extensión asimétrica a las partes blandas (flecha).
La afectación del pedículo puede verse tanto en fracturas metastásicas como en fracturas osteoporóticas y no es un criterio válido para su diferenciación. Sí es más indicativo de metástasis la afectación parcheada de otros elementos del arco posterior, como las apófisis espinosas o las láminas31.
Las fracturas vertebrales ocurren entre el 50 y el 70% de los pacientes con mieloma múltiple. Pueden dar lugar a compresión de la médula espinal hasta en el 15% de los casos24,25. En la RM el mieloma puede presentar varios patrones de afectación que abarcan desde una intensidad de señal normal de los cuerpos vertebrales (28%) hasta una alteración difusa de la señal (29%), una alteración focal (30%), una alteración combinada focal y difusa (11%) y, finalmente, un patrón moteado en sal y pimienta (3%)32,33. En casos típicos de mieloma múltiple las vértebras muestran múltiples lesiones líticas junto con un patrón parcheado e infiltrativo y las fracturas vertebrales pueden mostrar un componente de tejido blando (fig. 6).
Muchas fracturas por compresión vertebral en pacientes con mieloma múltiple parecen benignas en la RM. La distribución topográfica es similar a la de las fracturas vertebrales por compresión en pacientes con osteoporosis. Por eso, la apariencia del mieloma múltiple puede ser engañosa, simulando una fractura vertebral por compresión osteoporótica en aproximadamente el 67% de los casos, con presencia de fracturas en diferentes estadios de evolución. Hasta el 38% de los pacientes con mieloma pueden presentar solo fracturas de apariencia benigna34.
En la tabla 2 se resumen los criterios morfológicos y de señal que permiten diferenciar las fracturas benignas de las malignas, así como el comportamiento típico con contraste y en difusión.
Criterios de imagen para la diferenciación de las fracturas benignas y malignas
| Criterio | Fracturas benignas | Fracturas malignas |
|---|---|---|
| Morfología | Retropulsión del margen posteriorMasa paravertebral fina y simétrica | Borde convexoMasa paravertebral grande o asimétrica |
| Señal | Señal ósea normal en fase crónicaPatrón de edema en bandaHendidura o cleft vertebralÁreas de respeto de señalMargen definido entre edema y médula ósea normalMayor contenido graso | Afectación difusa de toda la médulaAfectación parcheada de la médulaMargen irregular entre edema y médula ósea normalMenor contenido o ausencia de grasa |
| Realce | Retorno a la señal medular normal de las vértebras adyacentes | Más intenso que las vértebras adyacentes |
| Difusión | Baja señal en difusiónAlta señal en mapa ADCADC entre 1,2 y 2×10−3 mm2/s | Alta señal en difusiónBaja señal en mapa ADCADC entre 0,7 y 1,3×10−3 mm2/s |
El papel del contraste en la diferenciación entre fracturas de etiología benigna y maligna también ha sido discutido en la literatura. A nivel intraóseo las fracturas benignas tendrán un realce equivalente a las vértebras normales adyacentes, desapareciendo la baja señal de la secuencia T1 sin contraste, mostrando la vértebra fracturada una intensidad de señal similar a las de las vértebras no fracturadas. El realce en las fracturas malignas suele ser más heterogéneo y más intenso que las vértebras normales adyacentes. No obstante, en fracturas agudas benignas con importante edema el realce puede ser tan intenso que puede simular malignidad30. En estos casos el dilema es plantear un control a corto plazo (1-2meses) para ver la disminución de los cambios inflamatorios en las fracturas benignas, o bien optar por la biopsia guiada por técnicas de imagen (fig. 7). En cuanto a los estudios de perfusión, son las curvas tipoIII aV las que suelen estar presentes en caso de afectación tumoral33, y los parámetros de perfusión suelen ser más elevados, aunque existe superposición tanto en el tipo de curva como en los parámetros de perfusión con las fracturas benignas agudas35,36.
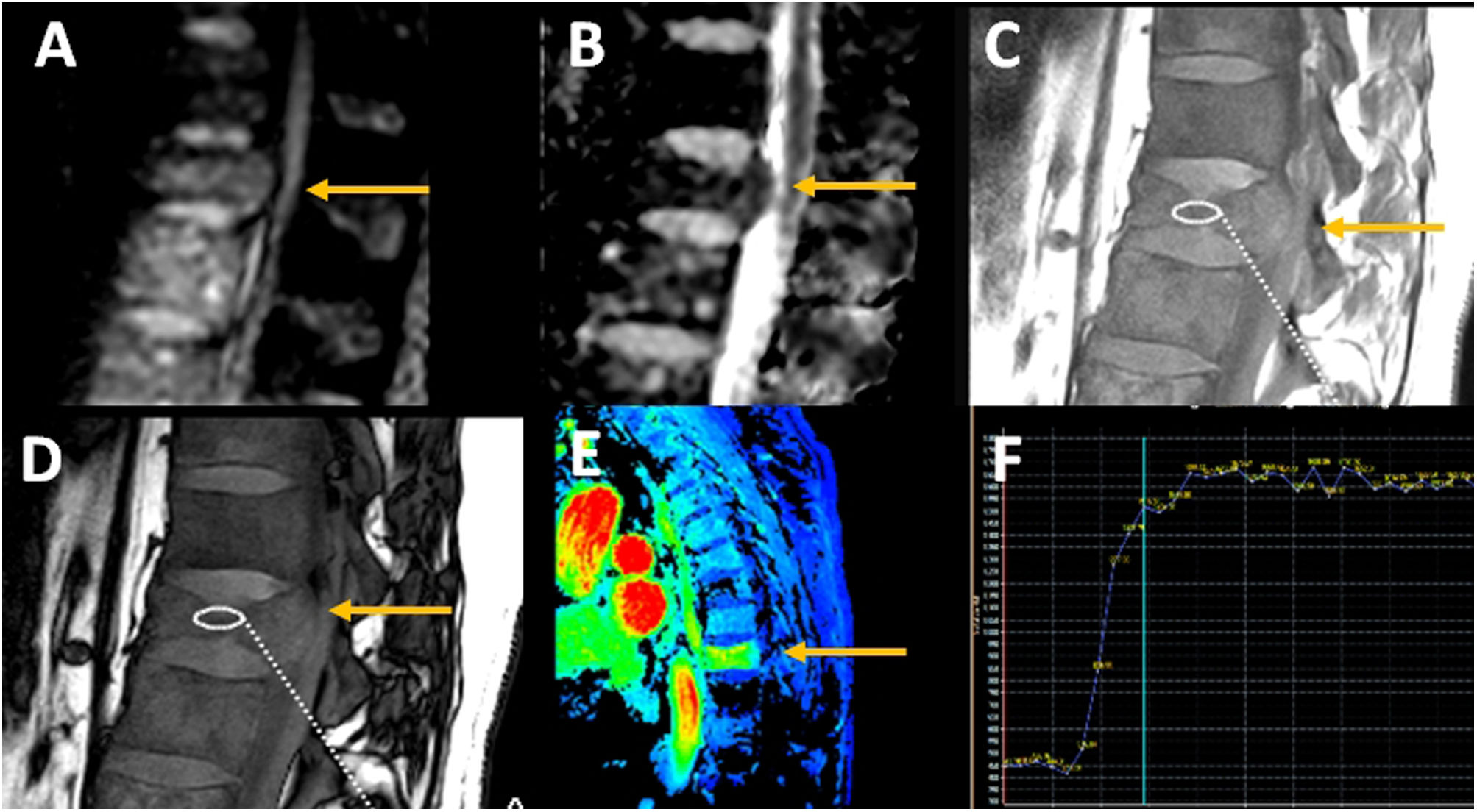
Diferenciación entre fracturas benignas y malignas por resonancia magnética mediante secuencias avanzadas. A)Imagen sagital potenciada en difusión y correspondiente al mapa ADC (B) en una fractura patológica por cáncer de próstata con restricción de la difusión (0,7×10−3 mm2/s) (flechas). C)Secuencia fase y fuera de fase (D) con cociente entre la intensidad de señal de 0,85. E)Secuencia Thrive dinámica tras contraste y curva tipoIII (F) en una fractura osteoporótica aguda.
También la imagen ponderada por difusión puede ser útil en la diferenciación entre las fracturas de causa benigna y maligna, mostrando restricción de la difusión en fracturas patológicas malignas. Esto ha sido atribuido a la alta celularidad y a la alta relación núcleo-citoplasma en células tumorales de división rápida. Producirán por tanto una señal elevada en difusión con una señal baja en el mapa ADC (apparent diffusion coefficient). En cambio, en las fracturas de causa osteoporótica la difusión es mayor debido al edema, por lo que producirán una imagen hipo o isointensa en difusión y señal más elevada en el mapa ADC (fig. 7)37.
En el adulto la médula ósea normal tiene mayor contenido de grasa que de agua y componente celular; por tanto, la médula ósea normal muestra baja señal en difusión y bajo valor ADC, que normalmente oscila entre 0,2 y 0,6×10−3 mm2/s. La presencia de células grasas limita la presencia de agua extracelular por su naturaleza hidrofóbica. Por el contrario, la médula ósea roja, más abundante en pacientes jóvenes y niños, muestra mayor intensidad de señal en difusión y mayores valores ADC. Esto es debido a su mayor celularidad y contenido de agua extracelular. Algunos autores han referido el punto de corte en el valor ADC que permite diferenciar la médula ósea normal de una vértebra afectada por lesión tumoral, oscilando entre 0,655 y 0,774×10−3 mm2/s37,38. Cifras superiores sugieren una lesión maligna, cuyos valores oscilan entre 0,7 y 1,3×10−3 mm2/s. En el caso de las fracturas osteoporóticas la presencia de edema hace que los valores ADC sean superiores a los de las fracturas malignas, oscilando entre 1,2 y 2×10−3 mm2/s. Las lesiones inflamatorias o infecciosas suelen mostrar un valor ADC intermedio entre las fracturas benignas y malignas: 1,2×10−3 mm2/s39. En cualquier caso, hay que recordar que los valores ADC se ven afectados por diversos factores, lo que dificulta la estandarización de unos valores de corte. Estos factores incluyen la fuerza del campo magnético, el tipo de imán, los diferentes tipos de secuencias de pulsos, el área de interés seleccionada o los parámetros de adquisición, incluyendo el valor deb, que pueden modificar la sensibilidad a otras causas de movimiento incoherente y afectar los valores ADC. En el caso de las fracturas vertebrales, factores derivados de la presencia de sangre (en sus distintos estadios evolutivos) o de gas pueden condicionar heterogeneidad local del campo magnético que deriva en artefactos por susceptibilidad magnética, provocando errores tanto en la interpretación de las imágenes de valorb alto como en la medida y la reproducibilidad de los valores de ADC40,41.
Las imágenes de desplazamiento químico de fase (señal agua +grasa) y fuera de fase (señal agua −grasa) también se han utilizado con este propósito diferencial. En las secuencias en fase el agua y la grasa contribuyen a la señal de la médula ósea. En la fase opuesta se resta la señal de la grasa de la señal del agua, lo que resulta en una disminución de señal mayor cuanto más contenido de grasa existe en la lesión. En caso de infiltración tumoral no se produce esta disminución de señal, al no haber contenido graso. Un cociente entre la señal fuera de fase con respecto a la señal en fase >0,9 permitió clasificar correctamente el 84,3% de los casos en benignos o malignos42. Es decir, con el menor contenido graso de la lesión aumenta la probabilidad de ser maligna. También se puede calcular la proporción de grasa relativa dividiendo la señal de la imagen de solo grasa por la señal de la imagen en fase (agua +grasa). Esta fracción de grasa será generalmente menor del 20% en las lesiones malignas43.
Inteligencia artificial e impresión 3D en las fracturas vertebrales de baja energíaEn los últimos años se están desarrollando sistemas de diagnóstico automatizado basados en inteligencia artificial con resultados prometedores. La inteligencia artificial es el conjunto de técnicas que posibilitan el desempeño de funciones propias de la inteligencia humana mediante sistemas automatizados. Las diferentes áreas y metodologías incluidas dentro de la misma escapan al objetivo del presente artículo, pero merece la pena reseñar que, en los últimos años, vienen desarrollándose sistemas de diagnóstico automatizado basados en inteligencia artificial con resultados prometedores. Por ejemplo, Petraikin et al.44 han desarrollado recientemente un modelo (Comprise-G) capaz de detectar fracturas vertebrales grado2 y3 en TC con una sensibilidad y especificidad del 83,2% y del 90% en el conjunto de datos de prueba. También se están explorando diferentes aproximaciones para ayudar en el diagnóstico diferencial entre fracturas osteoporóticas y metastásicas45. Sin embargo, el entrenamiento y la implementación de los modelos de inteligencia artificial requieren la resolución de diferentes limitaciones que se encuentran frecuentemente en este contexto, como la asimetría de los conjuntos de datos, las imágenes no etiquetadas, la heterogeneidad en la calidad de las imágenes o las dificultades a la hora de extrapolar a la práctica los resultados obtenidos en contextos de investigación46. A pesar de que aún existen importantes limitaciones en términos de validación externa, es probable que contemos con herramientas potentes para el diagnóstico automatizado de este tipo de fracturas en los próximos años, por lo que deben conocerse las posibilidades y el estado del arte de la inteligencia artificial.
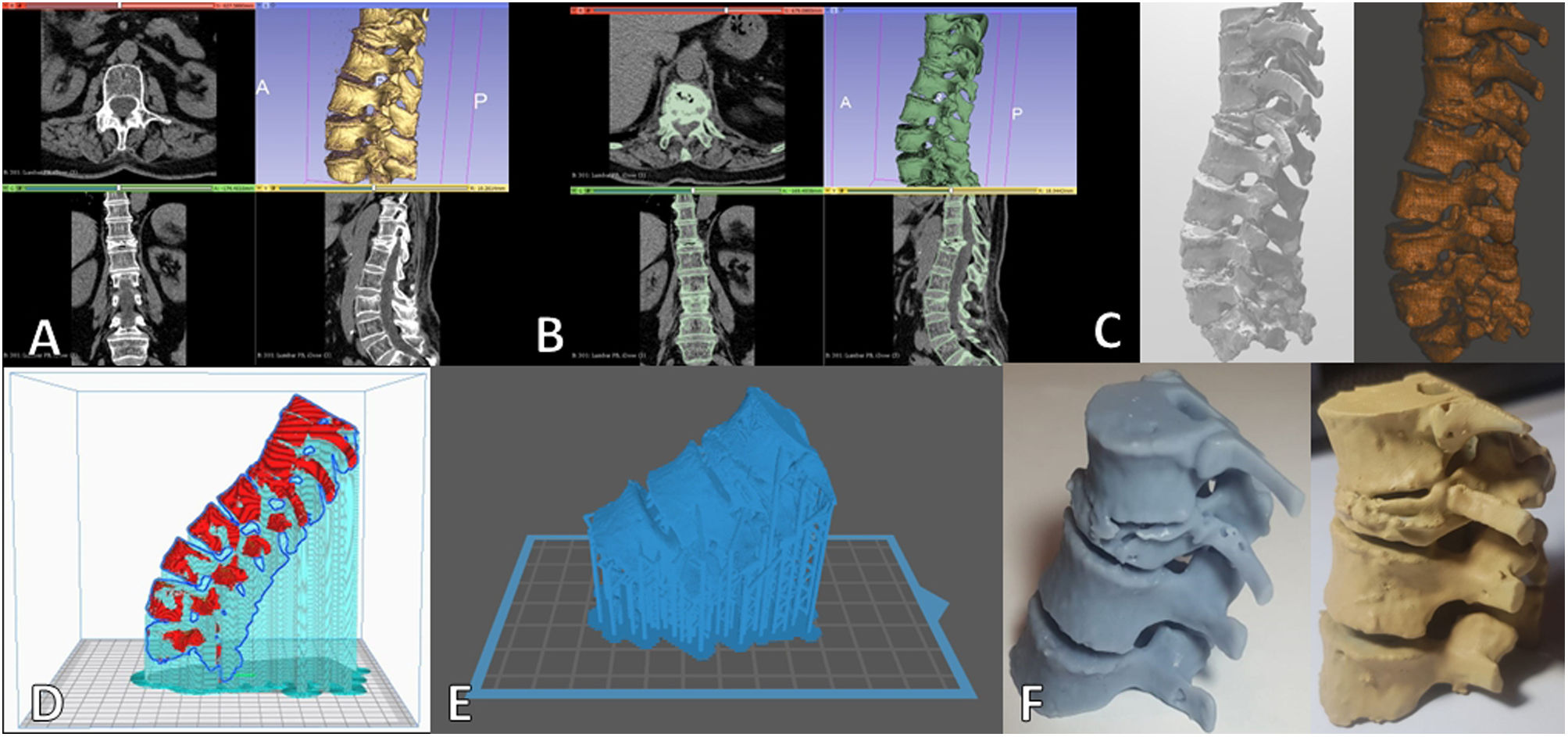
Por otra parte, las tecnologías de impresión 3D están implementándose de forma progresiva en diferentes instituciones, y ofrecen diversas posibilidades para una mejor comprensión y abordaje terapéutico de las fracturas vertebrales, permitiendo obtener réplicas fidedignas de la columna vertebral del paciente con fines diagnósticos, educativos y de gran utilidad para la planificación quirúrgica e intervencionista47,48. La principal desventaja es la necesidad de disponer de un espacio habilitado con adecuado equipamiento y de dominar diferentes etapas del proceso (conocimiento del hardware y del software), pero actualmente resulta sencillo generar modelos 3D impresos a partir de reconstrucciones volumétricas con programas como 3D Slicer49, MeshMixer50, Ultimaker Cura51 o ChituBox52 (figs. 8 y 9).
Generación de modelos de fractura vertebral impresos en 3D. A)Visualización del archivo DICOM en 3D Slicer®. B)Segmentación anatómica de la región de interés en 3D Slicer. C)Modelado 3D de la pieza segmentada con el software 3D Builder® (izquierda) y MeshMixer® (derecha). Nótese la malla tridimensional en esta última. D)Preparación para impresión 3D del modelo con soportes para equipos con tecnologías tipo FDM (fused deposition modeling) en Ultimaker Cura®. E)Preparación para impresión 3D del modelo con soportes para equipos con tecnologías de estereolitografía (SLA) en ChituBox®. F)Modelo impreso con tecnología SLA tras la retirada de soportes (izquierda) y pintura manual con aerógrafo (derecha).
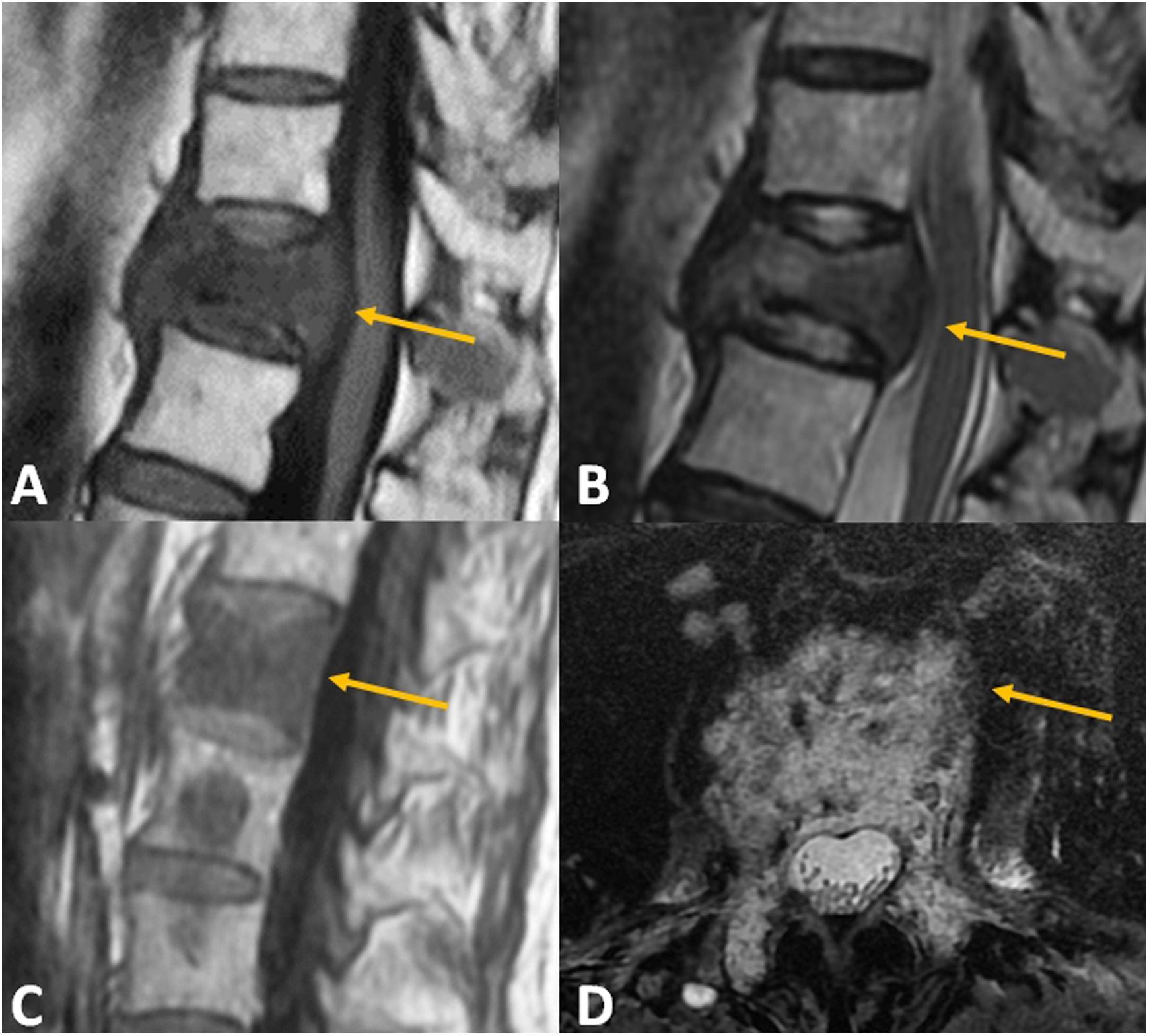
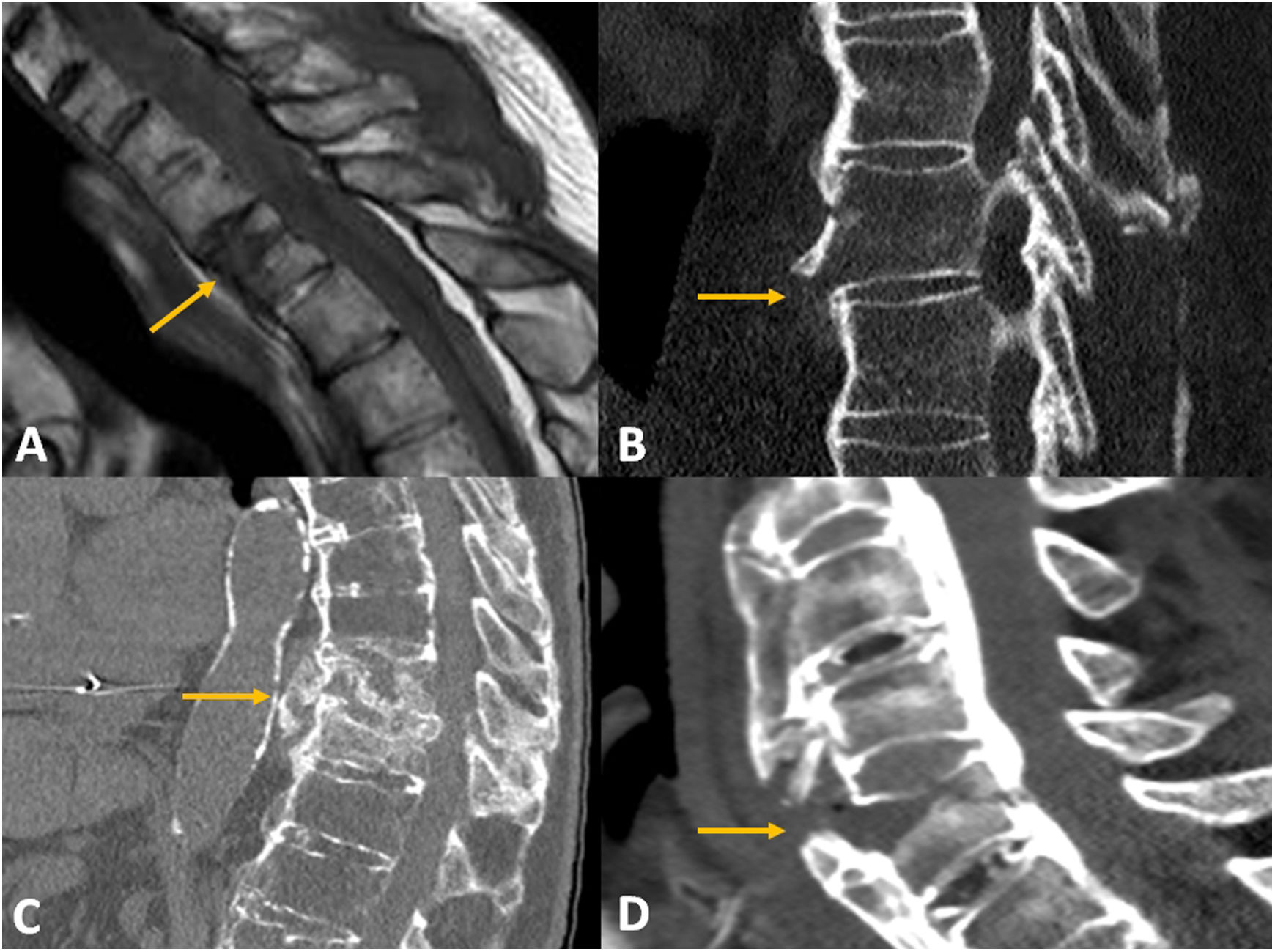
Fracturas vertebrales en pacientes con espondiloartropatía. A)Imagen T1 TSE sagital. Fractura de T1 en paciente con espondilitis anquilosante (flecha). B)TC de columna torácica, imagen sagital (algoritmo de reconstrucción ósea). Fractura aguda dorsal que afecta a la cortical anterior y al ligamento longitudinal anterior calcificado en paciente con espondilitis anquilosante (tipo B3 de la AO). C)TC de fractura torácica baja crónica con afectación transdiscal en paciente con espondilitis anquilosante. D)TC de fractura vertebral cervical baja en paciente con hiperostosis esquelética idiopática difusa.
Los pacientes con espondilitis anquilosante presentan un riesgo significativamente aumentado (hasta 4veces) de sufrir FVBE53. Desde el punto de vista clínico, existe un riesgo aumentado de pasar por alto las fracturas vertebrales en estos pacientes, debido a que suelen confundirlas con el dolor propio de su enfermedad de base54. Las fracturas de las vértebras pueden afectar a los puentes ligamentosos y se han descrito en el 6% de los pacientes con espondilitis anquilosante, especialmente en pacientes con enfermedad de larga duración55. La radiografía simple, la RM sin contraste intravenoso o la TC del área de la columna vertebral sin contraste intravenoso son técnicas apropiadas como imágenes iniciales para la sospecha de fractura en pacientes con anquilosis de la columna56. La radiografía puede ser la técnica inicial ante la sospecha de fractura, aunque factores como la osteoporosis o la localización anatómica (p. ej., cervicodorsal) pueden dificultar el diagnóstico57. Por tanto, si las radiografías son negativas, debe realizarse una técnica tomográfica, RM o TC. La sensibilidad de ambas técnicas es equivalente, siendo algunas mejor detectadas en RM y otras en TC, lo que sugiere que ambas aportan información complementaria. La TC se considera la técnica de referencia para valorar los detalles óseos en pacientes con espondilitis anquilosante y fractura vertebral. Los actuales equipos con capacidad multiplanar isotrópica permiten evaluar con gran detalle la anatomía ósea y obtener reconstrucciones volumétricas muy precisas, permitiendo visualizar la localización, la extensión y las características de las fracturas vertebrales58. Otra gran ventaja de esta técnica es la rapidez en la adquisición de imágenes. La TC permite visualizar el signo más típico de las fracturas transdiscales, que es el ensanchamiento del espacio intervertebral. Igualmente permite visualizar las líneas de baja densidad que recorren el cuerpo vertebral en las fracturas transvertebrales. La principal desventaja de la TC es la baja resolución tisular para evaluar las partes blandas, la médula y las raíces nerviosas. La RM presenta evidentes ventajas en este sentido, siendo la técnica de elección para detectar lesiones de partes blandas, discoligamentarias y edema óseo, y es una técnica excelente para evaluar estructuras nerviosas59.
Es importante diferenciar estas fracturas de las lesiones inflamatorias de los platillos vertebrales o lesiones de Anderson, que se tratan médicamente. Sin embargo, las fracturas vertebrales en estos pacientes son con frecuencia del tipo B3 de la clasificación de la Arbeitsgemeinschaft für Osteosynthesefragen (AO). Es decir, afectan a la banda de tensión o ligamento longitudinal anterior, dando lugar a pseudoartrosis que requerirán tratamiento quirúrgico60,61.
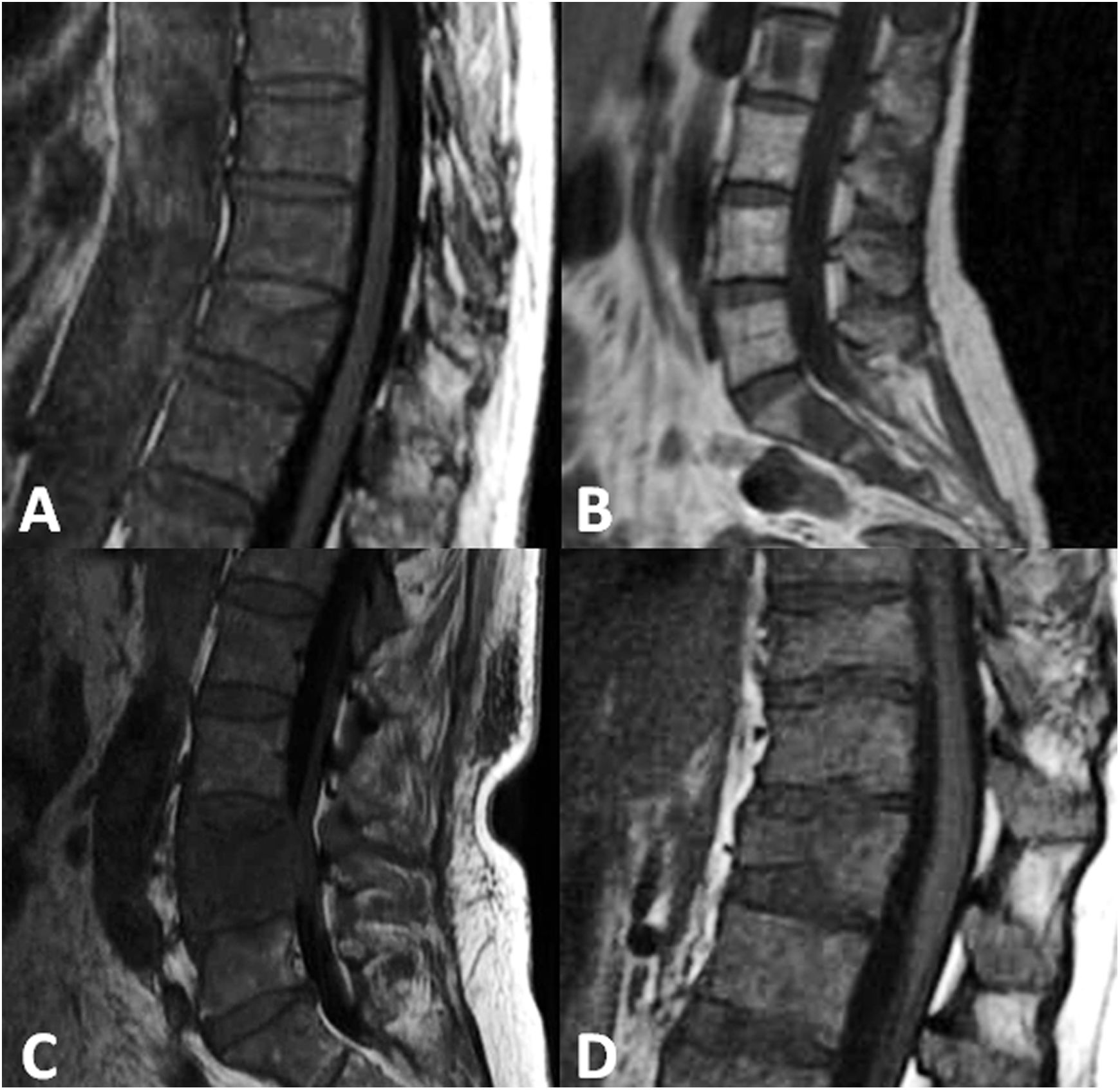
Hiperostosis esquelética idiopática difusa (HEID)La HEID, o enfermedad de Forestier-Rotes-Quirol, es una patología sistémica caracterizada por una osificación progresiva de los ligamentos y entesis, particularmente en el esqueleto axial (con clara predominancia de la columna torácica) y las articulaciones periféricas62. El diagnóstico de esta enfermedad se basa en la detección de puentes óseos osteofitarios en cuatro o más vértebras torácicas adyacentes63. Al igual que ocurre en el caso de la espondilitis anquilosante, los pacientes con HEID presentan un mayor riesgo de FVBE debido a la rigidez de la columna vertebral, que conlleva una disminución ostensible en la capacidad para absorber fuerzas de tracción64. Debido a este mecanismo fisiopatológico común, las fracturas vertebrales en pacientes con HEID presentan características similares a las descritas en pacientes con espondilitis anquilosante, aunque se ha encontrado que las fracturas vertebrales transvertebrales son más frecuentes que las transdiscales en la HEID (ocurre lo contrario en la espondilitis anquilosante) y que la mortalidad asociada a las fracturas vertebrales en la HEID es mayor que en pacientes con espondilitis anquilosante47. En estos pacientes la TC resulta de especial utilidad para identificar FVBE que afectan a los elementos posteriores65.
ConclusionesEl diagnóstico por imagen de las FVBE supone con frecuencia un reto para el radiólogo, siendo necesario un adecuado conocimiento del papel de la radiografía simple, de la TC y de la RM. En este trabajo se ha revisado el papel de las distintas pruebas de imagen, así como las características principales que deben evaluarse para realizar un diagnóstico preciso y útil de fractura vertebral. No debe olvidarse la importancia de las patologías previas del paciente (p.ej., antecedentes oncológicos, espondiloartropatías) y la orientación clínica, pues existe un riesgo no desdeñable de sobrediagnóstico si las pruebas de imagen se utilizan indiscriminadamente.
FinanciaciónNo se ha recibido ningún tipo de financiación para la realización de este trabajo.
Autoría- 1.
Responsables de la integridad del estudio: FRS, AJLRB.
- 2.
Concepción del estudio: FRS, AJLRB.
- 3.
Diseño del estudio: FRS, AJLRB.
- 4.
Obtención de los datos: todos los autores.
- 5.
Análisis e interpretación de los datos: todos los autores.
- 6.
Tratamiento estadístico: no aplicable.
- 7.
Búsqueda bibliográfica: todos los autores.
- 8.
Redacción del trabajo: FRS, AJLRB, DLZ.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: todos los autores.
- 10.
Aprobación de la versión final: todos los autores.
Los autores declaran no presentar conflictos de intereses.
Los autores agradecen la ayuda prestada por David López Cornejo y a 3D Translation S.L. por el asesoramiento en la preparación de los modelos impresos en 3D.