La diseminación perineural corresponde a una forma de extensión de algunos tipos de tumores de cabeza y cuello por las estructuras nerviosas. Su existencia repercute negativamente en el tratamiento porque requiere resecciones quirúrgicas más extensas y campos de irradiación mayores, está asociada con un incremento en las recurrencias locales y se considera un indicador pronóstico independiente en la clasificación TNM para estadificar el tumor. Sin embargo con frecuencia pasa desapercibida en los estudios de imagen. En esta actualización revisaremos el concepto, la patogenia y las principales vías y conexiones entre los nervios faciales, que son esenciales para comprender este proceso. Además, valoraremos la técnica apropiada para realizar un estudio correcto, presentaremos los signos de imagen típicos para reconocer esta entidad en la TC y RM y abordaremos los diagnósticos diferenciales.
Perineural spread is the dissemination of some types of head and neck tumors along nervous structures. Perineural spread has negative repercussions on treatment because it requires more extensive resection and larger fields of irradiation. Moreover, perineural spread is associated with increased local recurrence, and it is considered an independent indicator of poor prognosis in the TNM classification for tumor staging. However, perineural spread often goes undetected on imaging studies. In this update, we review the concept of perineural spread, its pathogenesis, and the main pathways and connections among the facial nerves, which are essential to understand this process. Furthermore, we discuss the appropriate techniques for imaging studies, and we describe and illustrate the typical imaging signs that help identify perineural spread on CT and MRI. Finally, we discuss the differential diagnosis with other entities.
La diseminación perineural es una forma de extenderse de algunos tipos tumorales de cabeza y cuello siguiendo las vainas nerviosas. Jean Cruveilheir fue el primero en hacer referencia a esta forma de extensión tumoral en 18351, por tanto, no se trata de una forma nueva de extensión de las neoplasias debido a un cambio en su comportamiento por los avances en el tratamiento. Sin embargo, con frecuencia pasa desapercibida, hasta tal punto de que lo habitual es que no aparezca en los informes radiológicos2.
Diseminación perineural, extensión perineural, invasión macroscópica perineural, invasión perineural, afectación perineural, afectación de nervio pequeño o afectación de nervio grande, son términos que se usan de manera intercambiable en la bibliografía pero que pueden reflejar procesos diferentes. La invasión perineural (IPN) o de nervio pequeño, se refiere a la afectación microscópica de los fascículos nerviosos, que se observa anatomopatológicamente en el lugar del tumor principal. La diseminación perineural (DPN) o de nervio grande es la forma macroscópica, que se puede ver en los estudios de imagen o detectar clínicamente, y que se localiza más allá de la lesión tumoral principal3–5.
El objetivo de este artículo es conocer este tipo de extensión tumoral, su significado, los patrones de extensión y las características radiológicas para entender la enfermedad y evitar falsos negativos en los informes radiológicos.
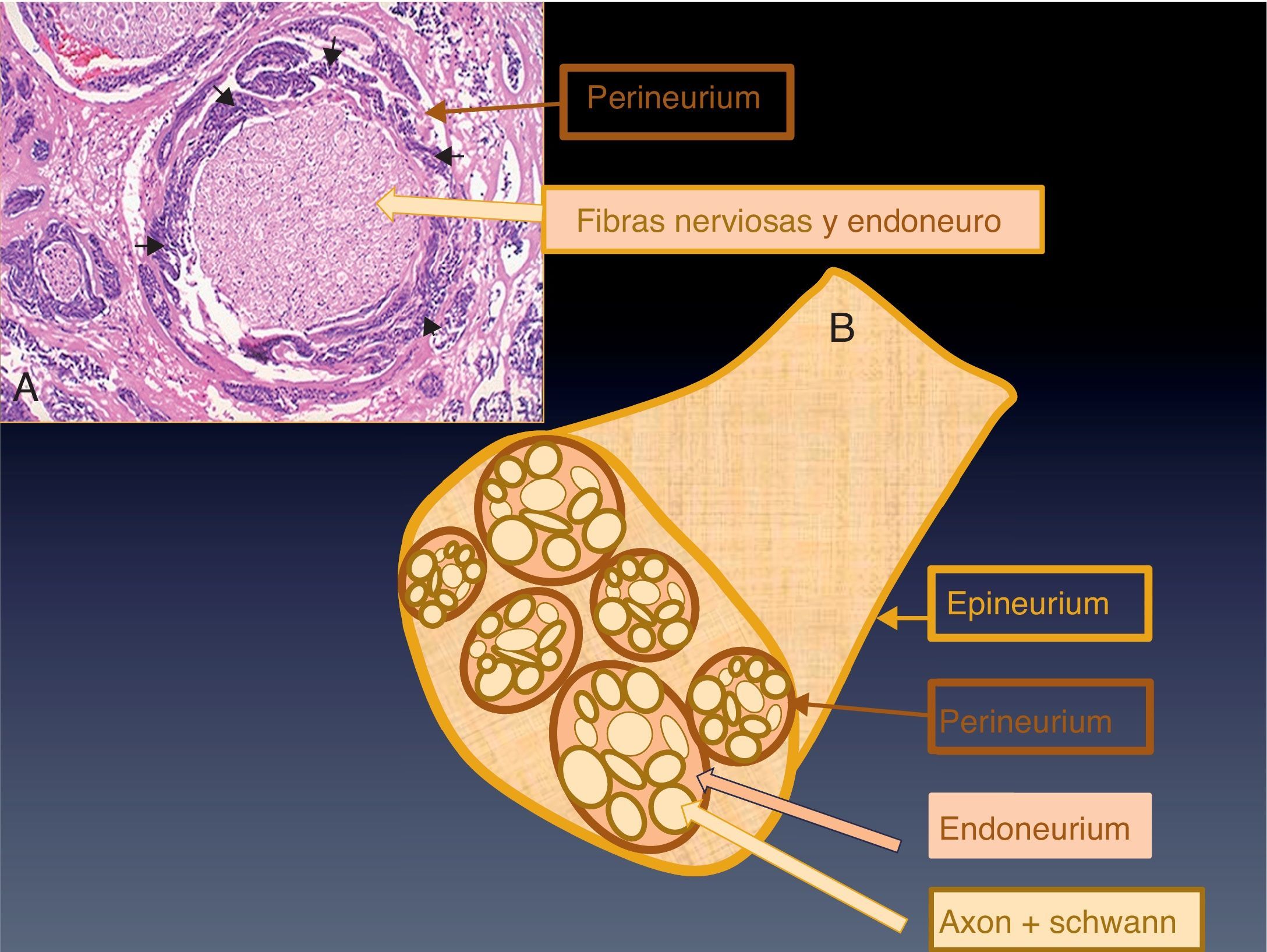
Conceptos anatómicos básicosLos nervios periféricos se componen de tres capas, denominadas, de fuera a dentro, epineuro, perineuro y endoneuro (fig. 1). En el epineuro está el componente más externo de los vasa nervorum y los canales linfáticos. El perineuro es la capa intermedia, una estructura multilaminada concéntrica de células endoteliales6. El endoneuro no es una capa estrictamente, sino el tejido conectivo vascular laxo que rodea al complejo axón-célula de Schwann que constituye la fibra nerviosa, o nervio pequeño. Varias fibras nerviosas y el endoneuro adyacente se agrupan y se rodean por el perineuro formando fascículos nerviosos. La agrupación de varios fascículos rodeados de epineuro es lo que constituye el nervio periférico, o nervio grande. El endoneuro está separado del compartimento extracelular por el perineuro, y de la circulación sanguínea por las fuertes uniones de las células endoteliales de los capilares endoneurales. Esto es lo que se denomina barrera hematoneural. La rotura de esta barrera permite la salida y acúmulo de contraste perineural, que en los pacientes con DPN es responsable del realce patológico del nervio en las pruebas de imagen.
A) Corte anatomopatológico. Fascículo nervioso compuesto por varias fibras nerviosas y el endoneuro, rodeados por el perineuro. En este caso existía una afectación perineural por células tumorales (puntas de flecha) que rodeaban completamente la circunferencia del nervio. B) Diagrama de un nervio periférico.
Existen controversias bibliográficas sobre esta forma de extensión tumoral por varias razones:
- A.
El uso de los diferentes términos no está estandarizado. En la mayoría de los casos cada publicación utiliza el término que considera y además no lo especifica claramente.
- B.
Ni siquiera entre los anatomopatólogos hay consenso claro de lo que significa concretamente la IPN. Algunos autores la definen como las células malignas en el espacio perineural con una afectación total o casi total de la circunferencia del nervio en los cortes anatomopatológicos tangenciales7. Otros, como la afectación tumoral de un tercio de la circunferencia del nervio o células tumorales en cualquiera de las capas que lo componen4.
- C.
La IPN, que según el American College of Pathologist debe aparecer en los informes de los anatomopatólogos8 (presente, ausente o indeterminada), está condicionada por los métodos de muestreo, teñido y por las técnicas del procesamiento inmunohistoquímico del tumor.
Los estudios muestran resultados contradictorios y variables según las características anatomopatológicas y la localización anatómica del tumor primario:
- -
La IPN se ha descrito en muchas estirpes tumorales pero es más frecuente en el carcinoma adenoide quístico (CAQ) (20-80%)9–11 y en el carcinoma escamoso (CE) (27-82%)12,13.
- -
La DPN es rara en los CE del suelo de la boca, amígdalas, laringe y faringe, y la recurrencia en el caso de que exista IPN en el tumor primario, también es rara según algunos autores5,14. Sin embargo, otros han descrito una menor supervivencia cuando la IPN se observa en tumores de la lengua15,16. En el CAQ parece no haber diferencias en la incidencia de DPN entre los que se localizan en las glándulas salivales mayores o en otras regiones. Además, su repercusión en la supervivencia global, o la capacidad del tumor de invadir estructuras adyacentes, no está clara11,14,17–20.
- -
La IPN en el carcinoma mucoepidermoide tiene peor pronóstico a pesar de no estar característicamente ligada con este tipo de tumor11,21,22.
A pesar de las contradicciones, lo que parece claro es que la DPN tiene un impacto negativo en el tratamiento (resección quirúrgica más extensa y campos de irradiación más amplios), el riesgo de recurrencia local es mayor y en la última clasificación TNM es un indicador pronóstico en los tumores malignos de la cavidad nasal y senos paranasales, nasofaringe, glándulas salivales mayores, melanoma mucoso y CE cutáneo23.
PatogeniaEl mecanismo biológico de la patogénesis no se comprende del todo. Teorías previas suponían que el tumor se extendía por canales linfáticos endoneurales pero los linfáticos se localizan en la capa externa del epineuro y no penetran en profundidad. Actualmente, y sobre todo considerando que determinados tipos tumorales asocian una DPN mientras que otros más agresivos no, incluso en estadios avanzados, la teoría más aceptada es la de las señales recíprocas entre el nervio y las células tumorales que activan vías de señalización14. Estas vías incluyen factores tróficos, quimiotácticos y proteínas de adhesión a la matriz extracelular. Se han descubiertos varios factores de crecimiento y moléculas de adhesión18,24–29. En el CAQ se ha descrito el receptor neurotrófico p7524. Durante el desarrollo del sistema nervioso este receptor se observa en las células de Schwann y su interacción con el factor de crecimiento puede estimular la migración de las células de Schwann a lo largo del nervio. Es posible que exista un mecanismo similar en la IPN. En el CE de orofaringe con IPN existe una sobreexpresión del factor de crecimiento nervioso y de su receptor, tirosina quinasa A que pueden potencialmente usarse como marcadores para predecir progresión tumoral25. Entre las moléculas de adhesión en los CAQ se expresa el N-CAM en el 93% de los pacientes con IPN18 y el ICAM-5 (telencefalina)26. En los CE de cabeza y cuello se expresa N-CAM entre el 50 y el 93% de los casos30,31.
La activación de estas vías puede atraer las células tumorales, estimular su crecimiento a lo largo de los nervios y promover la migración e invasión14. Además, recientemente se ha demostrado que también puede estimular la axonogénesis o agrandamiento de los nervios, el incremento de axones y la neurogénesis o incremento del número de neuronas, lo que incrementaría la densidad de nervios en y alrededor de los tumores neurotróficos32.
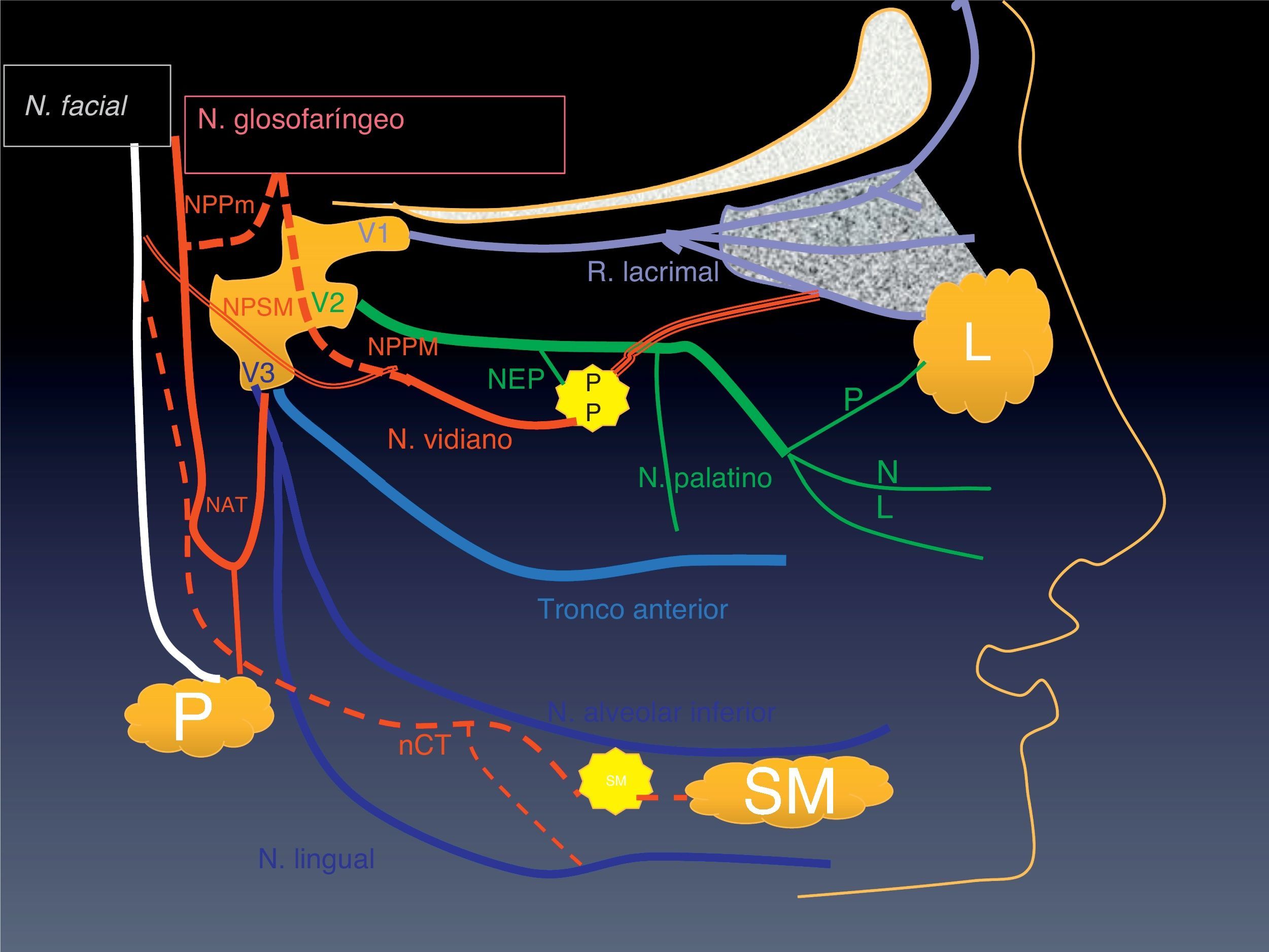
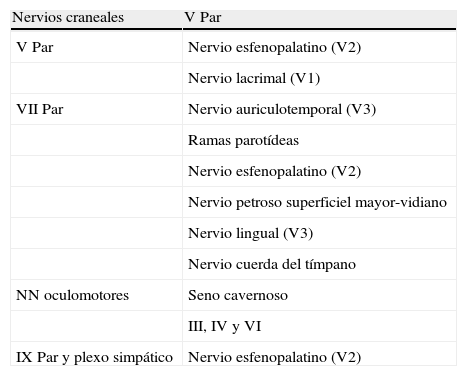
Anatomía de los nervios de la región facial y patrones de extensiónPara entender y definir los patrones de DPN hay que tener en cuenta la distribución anatómica de los nervios faciales y el sistema de clasificación zonal33–37. Los nervios más frecuentemente asociados con una DPN son el V y VII par craneales porque son los que tienen mayor extensión regional y una relación más estrecha con las áreas anatómicas en las que crecen los tumores cuyo tipo anatomopatológico se asocia con más frecuencia con la DPN (fig. 2). Pero en el macizo facial existe una red de anastomosis muy rica entre los pares craneales y con el plexo cervical, por lo que cualquier nervio puede estar potencialmente afectado (tablas 1 y 2).
Esquema de las ramas principales del V y VII par. Están representadas en rojo las anastomosis entre ambos pares (el color de esta figura solo puede apreciarse en la versión electrónica del artículo).
NPSM: nervio petroso superficial mayor. NPPM: nervio petroso profundo mmayor. NPPm: nervio petroso profundo menor. NAT: nervio auriculotemporal. nCT: nervio cuerda del tímpano. PP: ganglio pterigopalatino. NEP: nervio esfenopalatino. Anastomosis (línea triple) entre el NEP y la rama lacrimal de V1.
Conexiones del V par craneal
| Nervios craneales | V Par |
| V Par | Nervio esfenopalatino (V2) |
| Nervio lacrimal (V1) | |
| VII Par | Nervio auriculotemporal (V3) |
| Ramas parotídeas | |
| Nervio esfenopalatino (V2) | |
| Nervio petroso superficiel mayor-vidiano | |
| Nervio lingual (V3) | |
| Nervio cuerda del tímpano | |
| NN oculomotores | Seno cavernoso |
| III, IV y VI | |
| IX Par y plexo simpático | Nervio esfenopalatino (V2) |
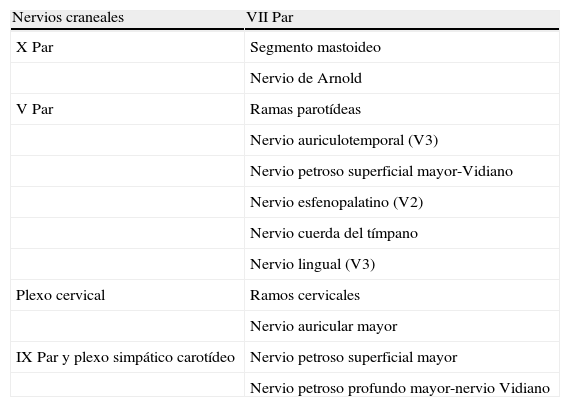
Conexiones del VII par craneal
| Nervios craneales | VII Par |
| X Par | Segmento mastoideo |
| Nervio de Arnold | |
| V Par | Ramas parotídeas |
| Nervio auriculotemporal (V3) | |
| Nervio petroso superficial mayor-Vidiano | |
| Nervio esfenopalatino (V2) | |
| Nervio cuerda del tímpano | |
| Nervio lingual (V3) | |
| Plexo cervical | Ramos cervicales |
| Nervio auricular mayor | |
| IX Par y plexo simpático carotídeo | Nervio petroso superficial mayor |
| Nervio petroso profundo mayor-nervio Vidiano |
En todos los nervios craneales se distinguen cinco regiones anatómicas: la nuclear, la fascicular, la cisternal, la de la base del cráneo y la periférica. Aunque la diseminación puede alcanzar todos los segmentos, los afectados con más frecuencia son el periférico y el de la base del cráneo.
En el V par craneal la región de la base del cráneo se extiende desde el cavum de Meckel, donde se aloja el ganglio de Gasser, hasta los agujeros de salida de sus tres ramas periféricas, los nervios oftálmico, maxilar y mandibular. Más allá de los orificios está la región periférica (figs. 3 y 4).
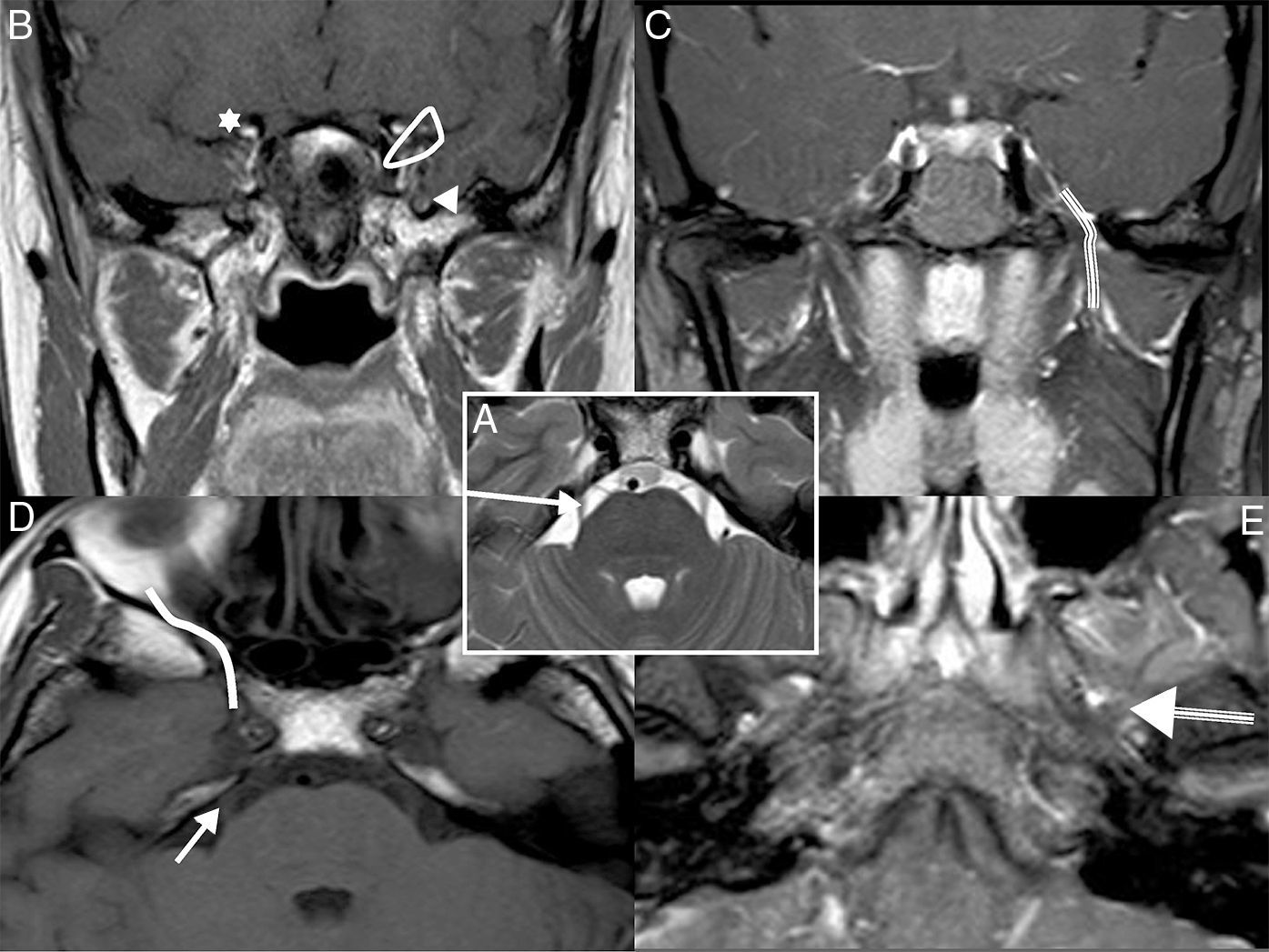
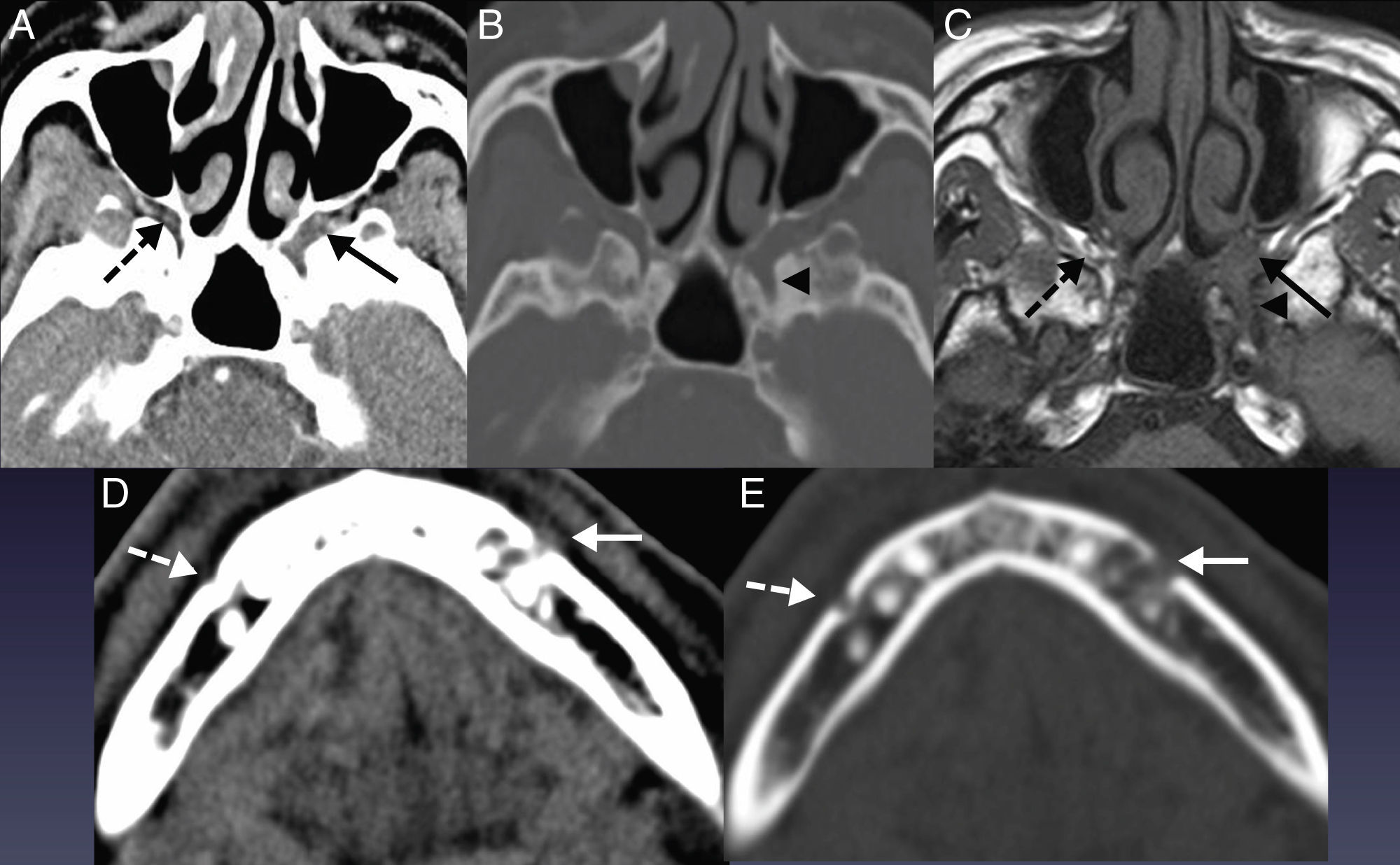
Anatomía del V par craneal. A) RM axial potenciada en T2. Región nuclear del V par craneal en la protuberancia. Por delante, en la cisterna prepontina, se localiza la región cisternal (flecha larga blanca). B) RM coronal potenciada en T1 tras inyectar gadolinio. C) RM coronal potenciada en T1 con saturación grasa tras inyectar gadolinio. D) RM axial potenciada en T1 tras inyectar gadolinio. E) RM axial potenciada en T1 con saturación grasa tras inyectar gadolinio. Se puede observar la rama V1, B), en la hendidura orbitaria superior (silueta blanca), lateral a la apófisis clinoides anterior (*); V2, B) y D), en el agujero redondo mayor (punta flecha blanca) con forma en bayoneta para alcanzar el canal del nervio infraorbitario (línea blanca); V3, C) y E), en el agujero oval (flecha triple blanca) y descendiendo para inervar los músculos del espacio masticador (línea triple).
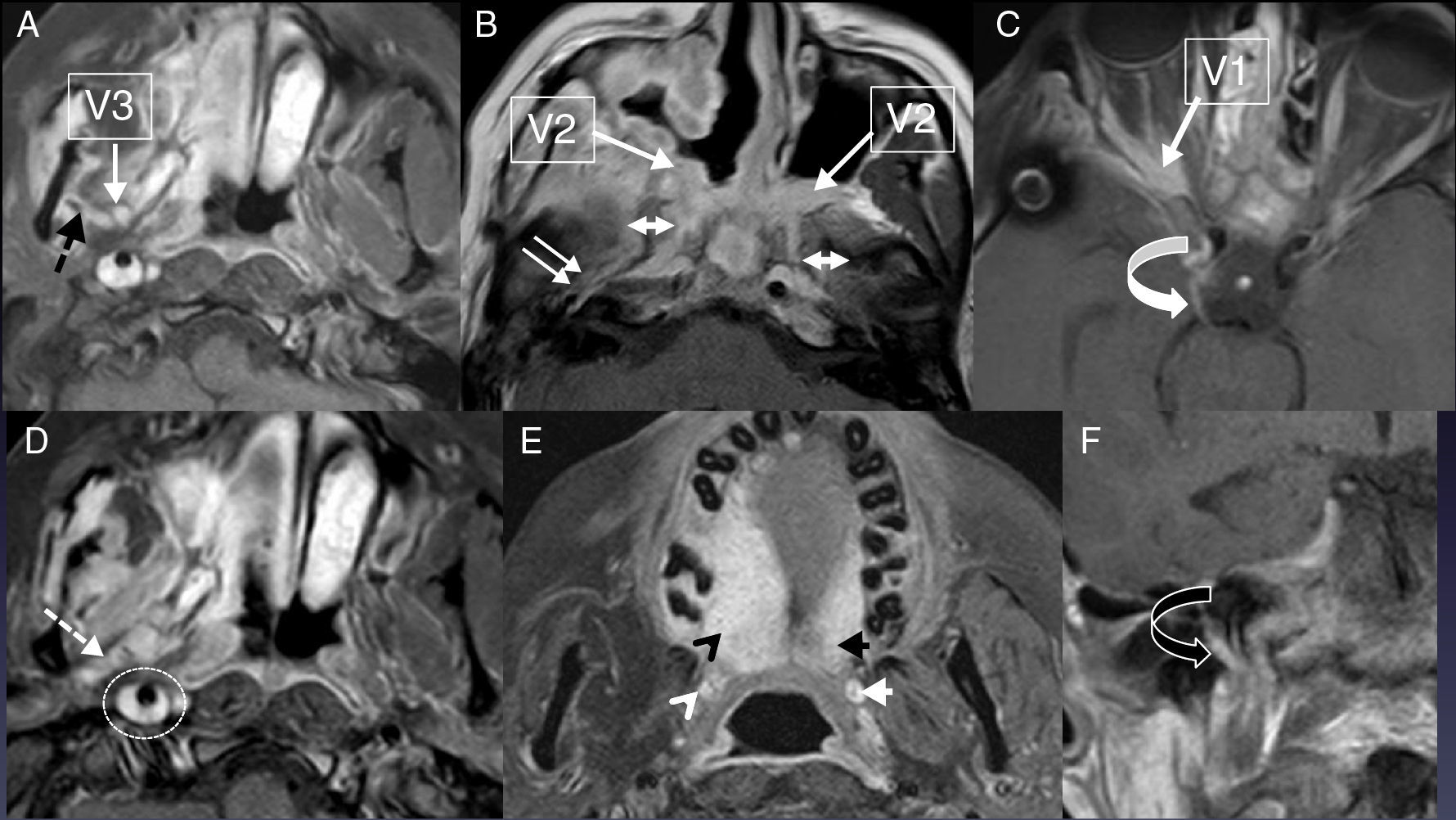
Diseminación perineural en las tres ramas del V par. A) y B) TC en planos axial y sagital. Diseminación por la rama V1 izquierda (flecha negra) en un paciente con carcinoma epidermoide cutáneo. C) y D) RM potenciada en T1 en planos axial y coronal tras inyectar gadolino en un paciente con diseminación perineural a lo largo de rama V2 derecha (flechas dobles blancas) por un melanoma nasal. El nervio está engrosado y realza con contraste pero nunca es tan hiperintenso como la grasa normal de la fosa pterigopalatina normal («evil gray») (puntas flecha blancas). Compárese con la rama V2 izquierda normal en el canal infraorbitario (flecha discontinua). E) y F) RM potenciada en T1 coronal y axial tras inyectar gadolinio, sin E) y con saturación grasa F) en un paciente con un cáncer de cavum. La rama V3 izquierda está aumentada y realza completamente con contraste (flecha doble blanca). Es evidente cuando la comparamos con el nervio derecho normal, que presenta solo el realce periférico del plexo venoso (flecha blanca redonda). La DPN alcanzaba el cavum de Meckel y por tanto la zona 2 (asterisco blanco) y se extendía también a lo largo de la rama V2 (puntas flechas blancas abiertas) y del nervio vidiano (punta flecha blanca).
El nervio oftálmico (V1) emerge de la región anterior y medial del ganglio de Gasser y continúa por la pared lateral del seno cavernoso hasta la hendidura orbitaria superior. Inmediatamente antes de entrar en ella se divide en tres ramas terminales, lacrimal, frontal y nasal.
El nervio maxilar (V2) se extiende desde el cavum de Meckel hacia delante, atraviesa el agujero redondo mayor y alcanza la fisura pterigopalatina. Posteriormente se dirige hacia fuera e inferiormente (esta doble angulación tiene forma de bayoneta en los cortes axiales) para llegar al canal del nervio infraorbitario. Finalmente en el extremo del canal emerge por el agujero infraorbitario donde se divide en sus tres ramas terminales. A lo largo de su recorrido da lugar a ramas colaterales de las que debemos recordar dos, los nervios esfenopalatino y palatino. El nervio esfenopalatino nace de V2 en la fosa pterigopalatina. Allí contacta con el ganglio pterigopalatino, situado enfrente del canal del nervio vidiano (al cual también está unido) (figs. 5 y 6). Lleva ramas simpáticas para inervar la mucosa bucofaríngea y la glándula lacrimal (esta última anastomosándose con el nervio lacrimal de V1). El nervio palatino nace también en la fosa pterigopalatina y se dirige por el canal palatino al paladar. Al llegar se divide en los nervios palatino mayor y menor que alcanzan la mucosa pasando por los agujeros palatinos mayor y menor (fig. 6).
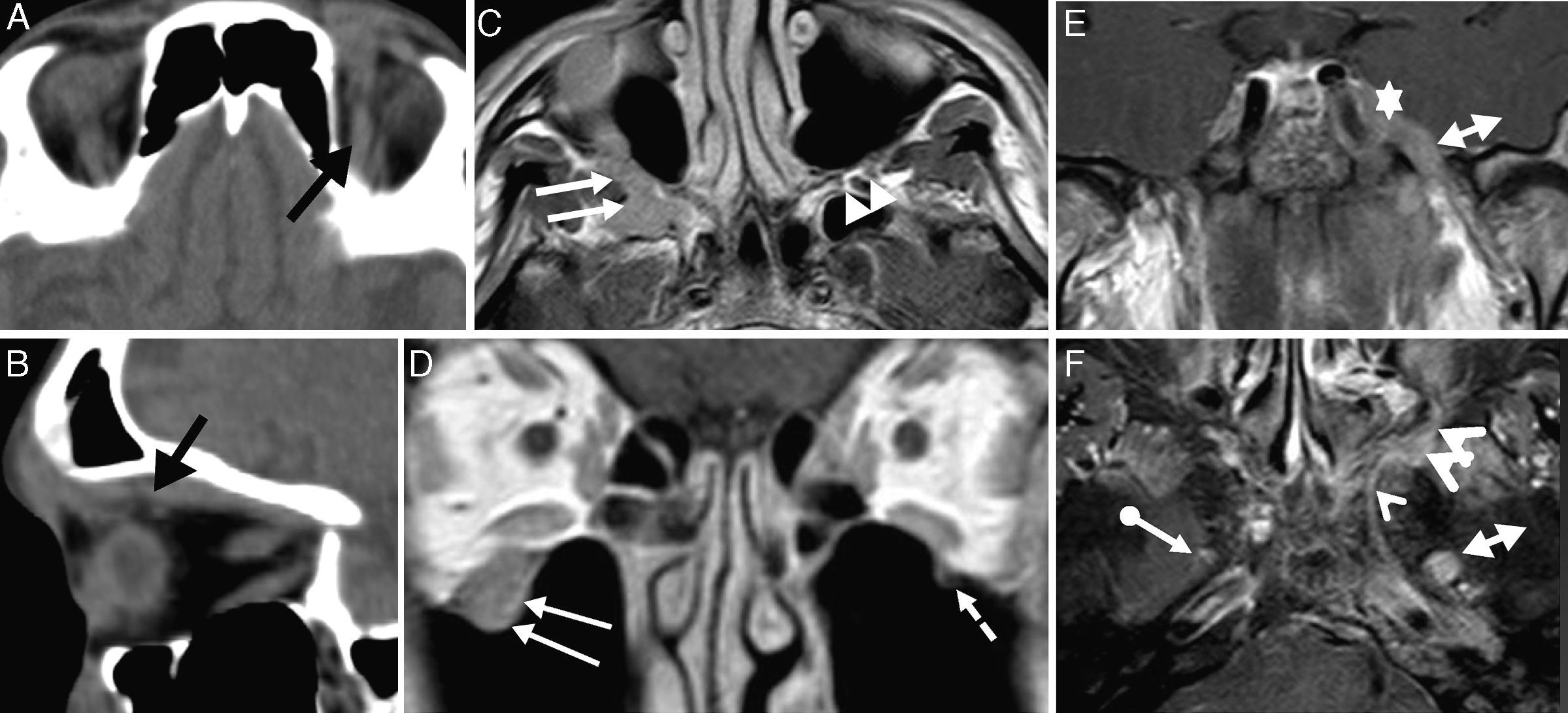
Obliteración de los paquetes grasos. A) y B) TC y C) RM axial potenciada en T1. Obliteración de la grasa de la fosa pterigopalatina izquierda (flechas negras largas) en un paciente con un cáncer de cavum (compárese con el lado derecho sano, flecha negra discontinua). Además, invasión del canal del nervio vidiano (punta de flecha negra). Aunque la obliteración grasa que se ve más es la de la fosa pterigopalatina, también se observa en otras localizaciones como en el paciente de la fila inferior. D) y E) TC con diseminación perineural por el nervio alveolar inferior izquierdo (flecha larga blanca) secundaria a un carcinoma adenoide quístico de la glándula submandibular izquierda. Compárese con la grasa normal del lado derecho (flecha blanca discontinúa).
Paciente intervenido por carcinoma adenoide quístico del seno maxilar derecho. RM axial potenciada en T1 con gadolinio, sin supresión B) y con supresión grasa A), C), D) y E), y RM coronal potenciada en T1 con gadolinio, sin supresión grasa, F). Diseminación perineural a lo largo de las ramas V1 derecha, V2 bilateral y V3 derecha, del nervio alveolar inferior derecho (flecha discontinua negra), nervios palatinos bilateralmente en el paladar (puntas flecha negras) y agujeros palatinos (puntas flechas blancas), del nervio auriculotemporal derecho (flecha blanca discontinua), nervio petroso superficial mayor derecho (flechas largas blancas) y nervio vidiano (flecha doble blanca). Afectación del nervio de Jacobson, IX par, (flecha curva negra) probablemente desde el nervio vidiano y luego del nervio petroso profundo mayor del plexo simpático carotídeo derecho (círculo discontinuo blanco). Afectación del III par (flecha curva blanca) por la conexión con la rama V1 en el seno cavernoso.
El nervio mandibular (V3) pasa inferior al ganglio de Gasser y sale del cráneo a través del agujero oval. Inmediatamente después da lugar a un pequeño tronco anterior, principalmente motor, y otro posterior, sobre todo sensitivo. El tronco motor inerva los músculos masticadores. El posterior se divide en tres ramas: nervio auriculotemporal, nervio lingual y nervio alveolar inferior (figs. 5 y 6). El nervio auriculotemporal38 se dirige a la glándula parótida por detrás del cóndilo mandibular. En la parótida se anastomosa con ramas del nervio facial (figs. 2 y 6). El nervio lingual se dirige inferiormente al espacio lingual. Conecta con la cuerda del tímpano, una rama nerviosa del nervio facial que lleva inervación parasimpática a las glándulas submandibular y sublingual (fig. 2).
Nervio facialEn este par craneal la región de la base del cráne se estructura en cuatro segmentos. El segmento canalicular que va desde el poro acústico, por el compartimento anterosuperior del conducto auditivo interno (CAI) hasta el fundus; el segmento laberíntico entre el fundus y el ganglio geniculado; el segmento timpánico se extiende, en un canal óseo en la pared medial de la caja timpánica, desde el ganglio geniculado, hasta el segundo codo; el último segmento o mastoideo, que va desde el segundo codo hasta el orificio estilomastoideo. La región periférica comienza en la salida del cráneo por el orificio estilomastoideo. Desde aquí atraviesa la glándula parótida y se divide en cinco ramas terminales responsables de la inervación motora de la musculatura facial.
A lo largo de su trayecto el nervio facial da dos ramas importantes: el nervio petroso superficial mayor (NPSM) (fig. 7) y la cuerda del tímpano. El NPSM39 emerge del ganglio geniculado, se dirige hacia delante, se anastomosa con el nervio petroso profundo mayor (NPPM) y forma el nervio vidiano, que alcanza el ganglio esfenopalatino y establece contacto con el nervio esfenopalatino (figs. 5 y 6). La cuerda del tímpano nace del VII par craneal justo antes de su salida por el agujero estilomastoideo y establece contacto con el nervio lingual.
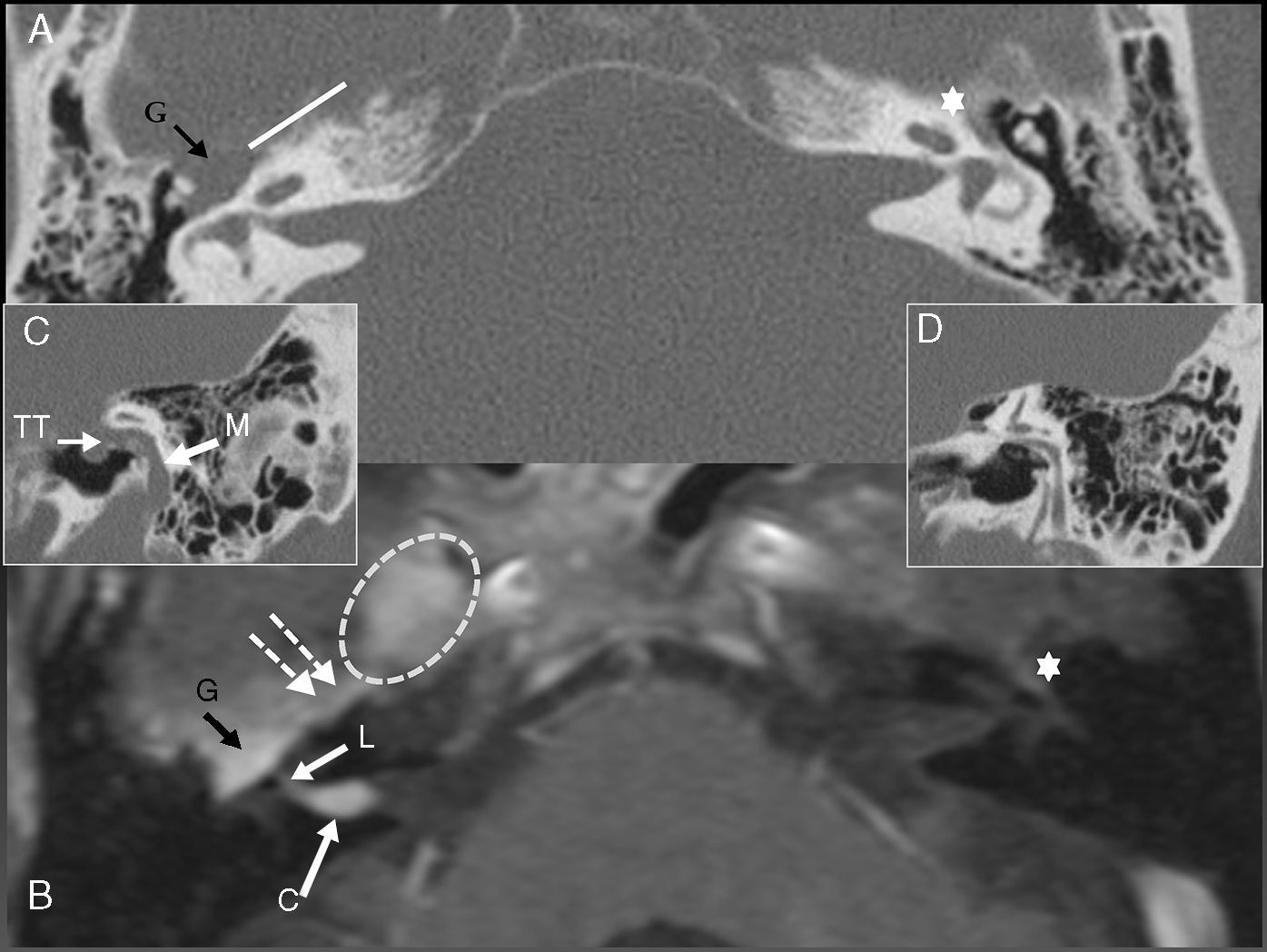
A) TC axial. C) y D) TC oblicua sagital. B) RM axial potenciada en T1 tras inyectar gadolinio. Paciente con carcinoma adenoide quístico del paladar. y diseminación perineural a lo largo del nervio petroso superficial mayor (flechas blancas discontínuas/barra blanca). Este nervio nace del ganglio geniculado (G) y se anastomosa con la rama V2. En este paciente se observa la afectación del V par en el agujero oval (círculo discontínuo). La diseminación perineural se extendía por todos los segmentos del VII par: canalicular C, laberíntico L, transtimpánico TT y mastoideo M. Compárese el ensanchamiento óseo y el realce intenso y asimétrico del ganglio geniculado y los diferentes segmentos del nervio facial con diseminación perineural en el lado derecho, comparado con el lado izquierdo sano (*).
El plexo cervical es una estructura formada por la división anterior de los cuatro primeros nervios cervicales40. Inerva la región postauricular (nervio auricular mayor)41 y anterosuperior del cuello, y da lugar a numerosas ramas para las estructuras musculares profundas, como el asa cervical y el nervio frénico. El asa cervical se anastomosa con el nervio hipogloso para inervar a los músculos prelaríngeos infrahioideos.
El nervio glosofaríngeo da lugar a una rama, el nervio timpánico de Jacobson. Este nervio, a través del canalículo timpánico, entra en la caja timpánica y forma un plexo sobre el promontorio coclear (fig. 6). Recibe ramas del plexo simpático carotídeo y forma el NPPM y el nervio petroso profundo menor (NPPm). El NPPM se anastomosa con el NPSM y forma el nervio vidiano (figs. 2–5, figs. 2–5, 7). El NPPm se une al NAT.
El nervio vago da lugar a una rama, el nervio de Arnold, localizada en un canal propio, que se anastomosa con el segmento mastoideo del nervio facial.
El nervio hipogloso en su región cisternal establece conexiones con los pares craneales IX y X.
Clasificación zonalPermite describir la extensión anatómica de la DPN en la RM por segmentos de afectación. Este sistema determina la extensión de la resección quirúrgica, subcraneal o de la base del cráneo42, y ha demostrado ser un predictor de la supervivencia global43. Se trata de tres zonas, 1-3, cuyos límites vienen definidos por el par craneal afectado (V o VII) y por las diferentes ramas del V par craneal (V1, V2 o V3) (tabla 3).
Clasificación zonal
| V1 | V2 | V3 | VII | |
| Zona 1 | Hasta la fisura orbitaria superior | Hasta la apertura externa del foramen redondo mayor | Hasta la apertura externa del foramen oval | Hasta la apertura externa del forman estilomastoideo |
| Zona 2 | Desde la zona 1 hasta el ganglio de Gasser | Desde la zona 1 al extremo lateral del CAI | Desde la zona 1 al extremo lateral del CAI | |
| Zona 3 | Todo el nervio desde el ganglio de Gasser o CAI hasta las cisternas o tronco del encéfalo |
CAI: conducto auditivo interno.
Hasta el 45% de los pacientes con DPN están asintomáticos incluso con una afectación extensa. Y hay pacientes con datos clínicos sugestivos de DPN sin alteraciones en los estudios de imagen44,45.
En general las manifestaciones clínicas de la DPN son tardías y se presentan de forma sutil e inespecífica46. Debe sospecharse cuando hay una afectación de pares craneales insidiosa, lentamente progresiva, recurrente o sin regreso a la función normal después de 6 meses de tratamiento, o cuando varios nervios craneales están afectados solo en un lado (síndrome de Garcin)46.
Técnicas de imagenLas técnicas de imagen usadas para diagnosticar esta entidad son la RM, la TC y la PET-TC. La RM es la de elección por su mayor resolución de contraste y su mayor sensibilidad para descartar afectación «segmentaria» del nervio. Sin embargo y aunque todavía no está extendida, la bibliografía reciente resalta que la PET-RM puede tener incluso más exactitud para diagnosticar la DPN47.
Resonancia magnéticaEs recomendable usar secuencias volumétricas isotrópicas de alta resolución espacial potenciadas en T1, con o sin saturación grasa48. Las técnicas con saturación grasa permiten delimitar las lesiones que realzan y que están próximas a espacios que contienen grasa como las órbitas, la fisura pterigopalatina y los agujeros neurovasculares33,36. Sin embargo otros autores prefieren las secuencias sin saturación grasa («fat is a friend»)49,50 porque permiten ver muy bien los paquetes grasos adyacentes a los agujeros y diferenciarlos de los que se obliteran de forma patológica por la infiltración tumoral, y porque, incluso después de inyectar gadolinio, el tumor nunca va a presentar la misma hiperintensidad que la grasa («evil gray») (fig. 4). Además, sin saturar la grasa se evitan los artefactos de susceptibilidad observados frecuentemente en las secuencias con saturación. El protocolo en nuestro centro consiste en secuencias T1 sin saturación grasa antes de inyectar el contraste, y luego secuencias T1 con saturación grasa tras inyectar gadolinio. Las secuencias T2 son necesarias cuando se afecta la zona 3, para estudiar el trayecto cisternal, fascicular y nuclear de los pares craneales. Además, la saturación grasa puede ser útil para valorar el componente inflamatorio asociado a esta entidad, sobre todo donde los nervios están relacionados con paquetes grasos.
Tomografía computarizadaLa TC valora muy bien la forma y tamaño de los agujeros y canales óseos de la base del cráneo. Permite diferenciar entre un proceso rápidamente destructivo, generalmente asociado a un patrón moteado o permeativo, y otro con un curso más lento e indolente que tiende a remodelar y expandir.
PET- TCEs muy útil en los cánceres de cabeza y cuello, en los que es superior a la TC y la RM para estudiar la afectación ganglionar y detectar tumor residual y recurrente51. Sin embargo, para la DPN no existen datos aceptados de su sensibilidad y especificidad. No obstante, cualquier foco lineal o curvilíneo de captación anormal de FDG en los territorios anatómicos de los pares craneales debe hacer sospechar una DPN y correlacionarlos con los signos de la RM para confirmar su diagnóstico52.
Hallazgos radiológicos- 1.
Primarios. Están relacionados con la afectación directa del nervio por el tumor.
- -
Realce completo o captación completa de toda la circunferencia del nervio en las secuencias T1 con gadolinio (por rotura de la barrera hematoneural) y engrosamiento o aumento del calibre normal del nervio36,53. Se debe diferenciar el realce completo del nervio patológico del realce periférico simétrico y de grosor variable del nervio normal (apariencia en diana) (figs. 3 y 4). El realce periférico se debe al plexo venoso perineural y se observa frecuentemente en los segmentos foraminales de las tres ramas del trigémino, en el ganglio geniculado, en el NPSM y en la parte proximal del segmento laberíntico del nervio facial35,54.
- -
Borramiento u obliteración de los paquetes grasos yuxtaforaminales55, como consecuencia del crecimiento del tumor y del componente inflamatorio asociado (fig. 5).
- -
Aumento del tamaño de los agujeros y canales óseos (figs. 5 y 7).
- -
Extensión al compartimento intracraneal. Se asocia a infiltración del seno cavernoso, abombamiento de su pared lateral, engrosamientos durales adyacentes a los segmentos nerviosos afectados y engrosamiento o realce de los segmentos cisternales y fasciculares de los pares craneales afectados (figs. 4E y 6C).
- -
- 2.
Secundarios. La afectación neural produce atrofia por denervación. Este hallazgo es más frecuente en los músculos masticadores (por la afectación de V3) y en la lengua (por afectación del músculo hipogloso) y menos común en los músculos de la expresión facial56. El proceso de denervación tiene tres fases con diferentes patrones de señal muscular en la RM. En la fase aguda (primer mes) los músculos son hiperintensos en las secuencias T2 y aumentan su tamaño y realce en las secuencias T1 con contraste. La hiperintensidad se debe al incremento del agua extracelular y una disminución de la intracelular; el T2 del agua extracelular es más largo que el de la intracelular. El realce se debe al incremento en la perfusión y acumulación del contraste en el espacio extracelular. En la fase subaguda (hasta los 20 meses) puede persistir la hiperintensidad en las secuencias T2 y se incrementa la señal en las secuencias T1 sin contraste debido al depósito graso, pero los músculos conservan su tamaño normal. En la fase crónica la atrofia es generalizada, disminuye el volumen muscular y la señal aumenta en la secuencia T1 sin contraste (fig. 8).
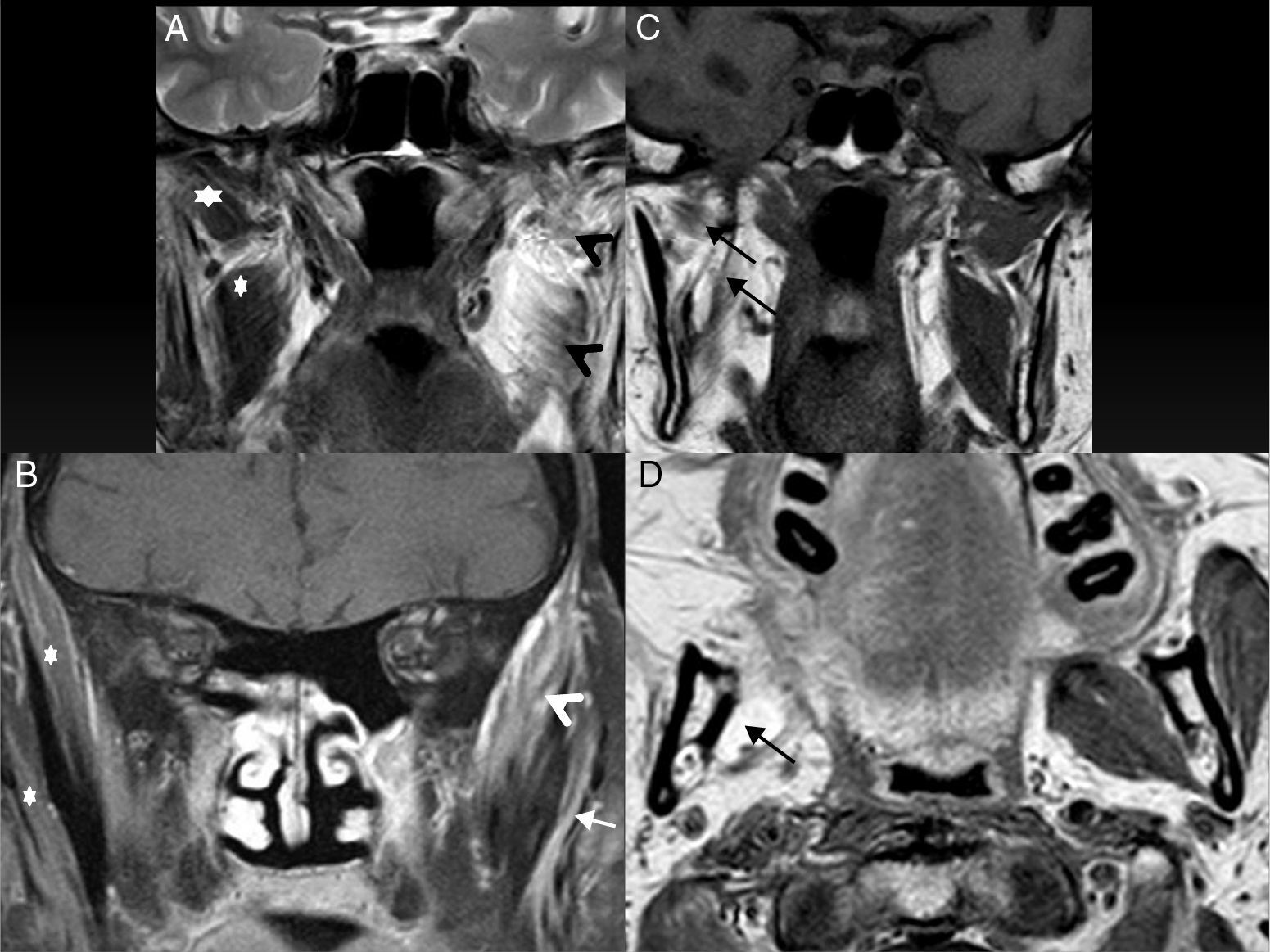
Figura 8.Hallazgos secundarios. A) RM coronal potenciada en T2 y B) RM coronal potenciada en T1, con saturación grasa y gadolinio. Paciente con diseminación perineural a lo largo de la rama V3 y denervación muscular en fase aguda. Hiperintensidad T2 y realce T1 con volumen conservado de los músculos pterigoideos (puntas de flecha negras), temporal (punta de flecha blanca) y masetero (flecha blanca) del lado izquierdo. Nótese la diferencia con el lado sano (*).RM potenciada en T1 coronal C) y axial D) de otro paciente con atrofia por denervación crónica. Hiperintensidad y pérdida de volumen de los músculos del espacio masticador derecho por la sustitución grasa.
(0.22MB).
No debe olvidarse que los signos de DPN pueden persistir indefinidamente a pesar de la mejoría clínica. Por tanto, hay que sospechar la recidiva cuando la lesión crezca o empeoren los síntomas50. Cuando se estadifique un tumor maligno de cabeza y cuello, en especial los más relacionados con la DPN, debe estudiarse completamente el recorrido de todos los nervios craneales. Debido a la extensa red de conexiones cualquier nervio puede estar potencialmente afectado (fig. 6). La alteración del nervio puede parecer discontinua en la imagen («skip metástasis») aunque anatomopatológicamente sea continua3,57–59. La discrepancia se debe a que la carga tumoral es variable a lo largo del nervio y que, donde es menor, puede no ser visible en los estudios radiológicos5.
Diagnóstico diferencialEl diagnóstico diferencial de esta entidad se establece con lesiones de origen tumoral, inflamatorio e infeccioso50.
La afectación de la zona 1 (fig. 4A-D), periférica, es propia de los tumores benignos de la vaina nerviosa como los schwanomas y neurofibromas. En estas lesiones la masa tumoral se localiza rodeando focalmente al nervio y, aunque su tamaño es variable, generalmente es muy segmentaria y no afecta a todo su trayecto. Los schwanomas son más frecuentes y se originan preferentemente en las uniones de células de Schwann-células gliales por lo que la localización habitual es en la zona 2. Aunque se pueden asociar a cualquier par craneal, el VIII y el V son los más frecuentes. Los neurofibromas suelen ser periféricos y aparecen aisladamente o en la neurofibromatosis tipo1.
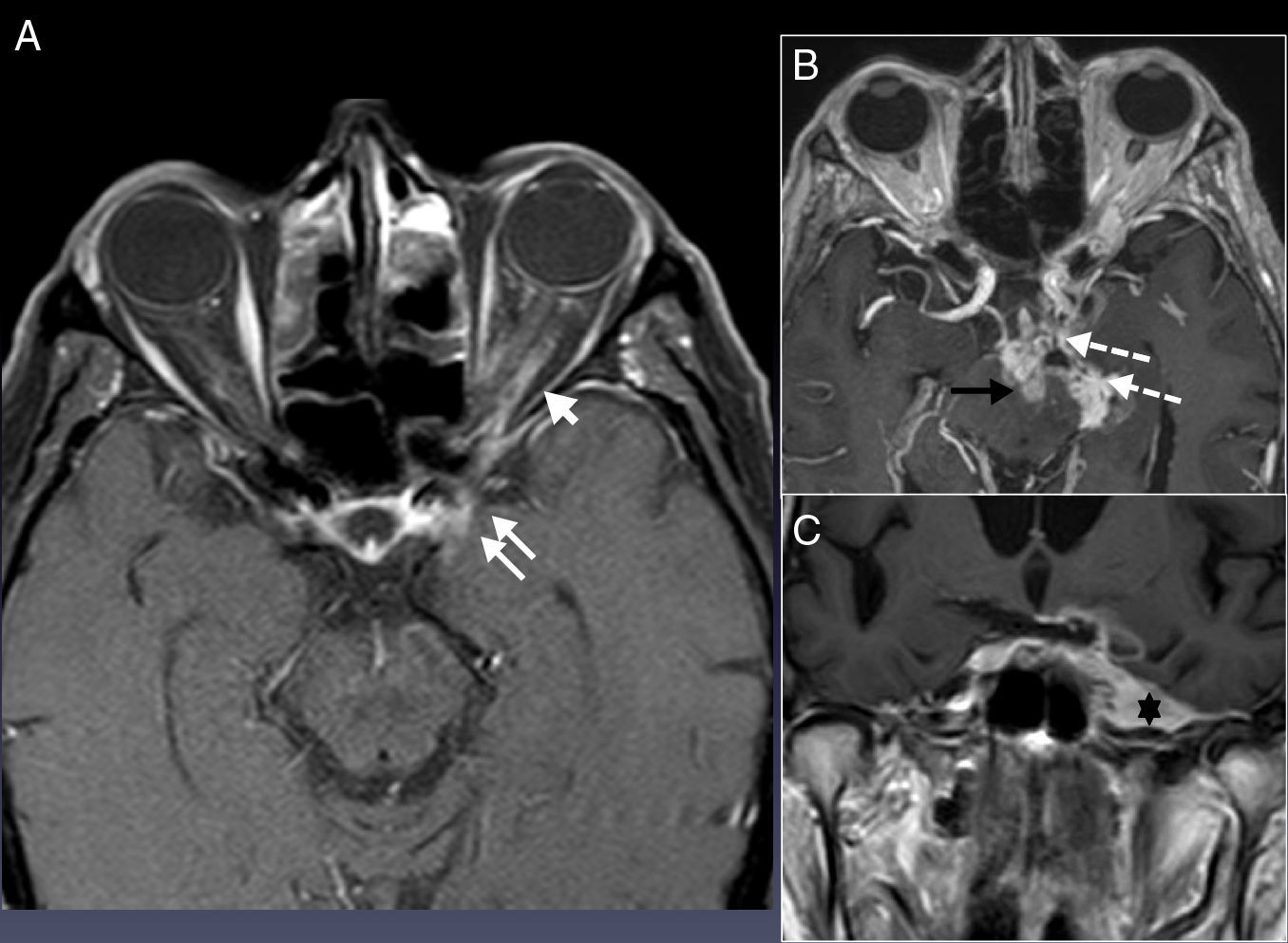
La afectación de la zona 2 (figs. 4E y 9) está representada preferentemente por la afectación del seno cavernoso60. Entre los tumores, los meningiomas, los schwanomas del V par y las metástasis son las lesiones más frecuentes. Entre las lesiones no tumorales están los pseudotumores inflamatorios61, las enfermedades granulomatosas62 y las infecciones. Las manifestaciones clínicas de la mayoría de estos procesos tienen que ver con la afectación de los pares oculomotores, sobre todo el VI par craneal. Sin embargo, en la DPN lo más habitual es la afectación del V par. Además, en la imagen hay datos que pueden ayudar, como la hiperostosis o erosión del hueso adyacente, que pueden orientarnos hacia meningiomas o procesos metastásicos respectivamente. La «cola dural» más característica de los meningiomas y de los procesos inflamatorios, y un proceso inflamatorio en el vértice orbitario, muy sugestivo del pseudotumor inflamatorio y de la extensión de un proceso sinusal infeccioso63–65, deben ser considerados con cautela y seguidos tras tratarlos (fig. 9).
Clasificación zonal 3. RM potenciada en T1 tras inyectar gadolinio. A) Imagen axial con saturación grasa, B) axial sin saturación grasa, y C) coronal sin saturación grasa. Paciente con antecedente de carcinoma epidermoide cutáneo frontal derecho extirpado 7 años atrás. Acudió tiempo después con un síndrome de Tolosa Hunt. A) Alteraciones inflamatorias en el vértice orbitario (punta de flecha blanca) y en el seno cavernoso (flechas blancas). Se trató con corticoides por sospecha de pseudotumor inflamatorio y el cuadro clínico remitió parcialmente. Sin embargo, en la RM de control (no mostrada) persistían alteraciones en el seno cavernoso. El paciente acudió de nuevo dos años más tarde con un síndrome de Garcin izquierdo. B) y C) La afectación del seno cavernoso y cavum de Meckel izquierdos era ahora mayor (asterisco) así como la extensión del proceso a las cisternas basales (flechas blancas discontinuas) e incluso a la protuberancia (flecha negra). La biopsia del nervio oftálmico también afecto (no mostrado) fue positiva para carcinoma epidermoide.
Cuando la lesión es continua, aunque de tamaño variable, desde la zona 1 a la 3, pocos procesos pueden incluirse. En estas situaciones se debe pensar en tumores de estirpe neural malignos66, meningiomas y, por supuesto, la DPN.
La afectación exclusiva de la zona 3 no es un hallazgo característico de DPN. Por tanto, cuando se observe debe pensarse en inflamaciones granulomatosas, como la sarcoidosis62, infecciones, como las neuritis de origen viral33,67,68 y tumorales, como la diseminación leptomeníngea del linfoma extracerebral.
ConclusiónLa diseminación perineural es una forma de diseminación metastásica, más prevalente en algunos tipos tumorales, que ocurre más frecuentemente en los tumores de cabeza y cuello. Es común que pase desapercibida en los estudios de imagen y, sin embargo, modifica los protocolos de tratamiento, se asocia a un índice de recurrencia local mayor y es un factor pronóstico independiente en la clasificación TNM de los tumores malignos. Conocer esta asociación, y la distribución anatómica de los pares craneales V y VII y sus ricas conexiones neurales, es esencial. La RM permite estudiar el trayecto neural desde la región periférica hasta la nuclear para detectar aumentos de grosor, realces completos y obliteración de planos grasos que son los hallazgos primarios característicos de este tipo de extensión tumoral.
Autoría- 1.
Responsable de la integridad del estudio: BBA
- 2.
Concepción del estudio: BBA
- 3.
Diseño del estudio: BBA, MTG
- 4.
Obtención de los datos: BBA, MTG
- 5.
Análisis e interpretación de los datos: BBA, MTG
- 6.
Tratamiento estadístico: BBA
- 7.
Búsqueda bibliográfica: BBA, MTG
- 8.
Redacción del trabajo: BBA, MTG
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: BBA
- 10.
Aprobación de la versión final: BBA, MTG
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.