La ecografía transfontanelar es una técnica diagnóstica ampliamente utilizada en el estudio de la neuroanatomía y patología propia del encéfalo neonatal gracias a sus múltiples ventajas, como la ausencia de radiaciones, disponibilidad, portabilidad y bajo coste. El desarrollo de equipos más potentes junto con la mejora de sondas microcurvadas y lineares de distintas frecuencias ha permitido una ostensible mejoría en la calidad de la imagen ecográfica del cerebro neonatal. Para obtener el máximo rendimiento de esta técnica es importante familiarizarse con la anatomía y patología neurológica de este grupo de edad. De hecho, es la primera técnica en el estudio de complicaciones a corto y medio plazo de los recién nacidos prematuros. En el neonato a término es muy útil para abordar múltiples situaciones clínicas, ya que permite seleccionar qué pacientes se beneficiarán de otras técnicas invasivas, más caras o que requieran sedación, como la resonancia magnética. Sus desventajas son ser operador dependiente y la necesidad de una adecuada ventana acústica. Tiene limitaciones en el estudio de la patología traumática obstétrica, la valoración de la patología malformativa compleja y el daño de la sustancia blanca. Con los conocimientos básicos de neurología neonatal, el equipamiento apropiado y una técnica cuidadosa que incluya el uso de distintas fontanelas, es un método fiable que permite el diagnóstico y seguimiento de patologías tanto congénitas como adquiridas en el neonato.
Transfontanellar ultrasound is widely used to study neonatal neuroanatomy and disease. This technique has many advantages, such as the absence of ionizing radiation and its wide availability, portability, and low cost. The development of more powerful ultrasound scanners and improved microcurved and linear probes of different frequencies have resulted in improved image quality. To take full advantage of this technique, it is important to know the normal and pathologic anatomy in neonates. Transfontanellar ultrasound is the first-line technique for studying short-term and mid-term complications in premature newborns. In full-term newborns, it is very useful in many clinical situations, making it possible to select which patients will benefit from other techniques that are more invasive or more expensive, or that require sedation, such as MRI. The disadvantages of the technique are that it is operator dependent and that an appropriate acoustic window is necessary. It also has limitations in the study of obstetric trauma, in the evaluation of complex malformations, and in the assessment of damage to white matter. With a basic understanding of neonatal neurology, the appropriate equipment, and a careful technique taking advantage of the different fontanels, transfontanellar ultrasound is a reliable method that makes it possible to diagnose and follow up both congenital and acquired conditions in neonates.
La ecografía transfontanelar (ETF) se ha convertido en una herramienta indispensable, tanto en las unidades de cuidados intensivos neonatales (UCIN) como en los servicios de radiología, para abordar la patología cerebral en los neonatos y lactantes, gracias a sus múltiples ventajas: amplia disponibilidad, portabilidad, contacto directo con el niño y sus padres (lo que permite la integración de la sintomatología durante su realización), no requerir sedación ni preparación previa y posibilidad de repetirla cuando sea conveniente al no emplear radiaciones ionizantes.
Consideraciones técnicas y prácticasEn los recién nacidos prematuros es importante tener en cuenta la asepsia, que implica el lavado de manos y del transductor, uso de guantes y geles estériles y, por otro lado, contar con la ayuda del personal de enfermería de la UCIN que permita un estudio seguro para el paciente. En los recién nacidos a término (RNT) y lactantes, la ayuda de los padres para calmar y sujetar al paciente es importante.
Ventanas acústicas y tipos de sondasLa ventana más empleada es la fontanela anterior por su mayor tamaño y mejor accesibilidad. A través de ella se obtienen las imágenes clásicas de anatomía cerebral, incluyendo de forma protocolizada planos estándar que representan las estructuras anatómicas clave.
El uso de ventanas acústicas alternativas es aconsejable para una ETF óptima, ya que la fontanela anterior es menos conveniente para la evaluación de la fosa posterior al encontrarse esta más lejos del transductor. La fontanela posterior nos permite una mejor valoración de los atrios de los ventrículos laterales y de la sustancia blanca parietooccipital. La ventana mastoidea permite obtener mejores imágenes de la fosa posterior, incluyendo el cerebelo, y la ventana lateral o temporal de las cisternas basales y el polígono de Willis1,2.
Es recomendable el empleo de transductores curvos, de frecuencia entre 7 y 9MHz y de pequeño tamaño, ya que se acoplan mejor a las fontanelas, aunque en los lactantes puede ser necesaria una sonda sectorial de mayor tamaño y menor frecuencia (5-8MHz). Los transductores lineales de alta frecuencia (10-18MHz) son mejores en la valoración del espacio extracerebral y del patrón de sulcación tanto cerebral como cerebeloso.
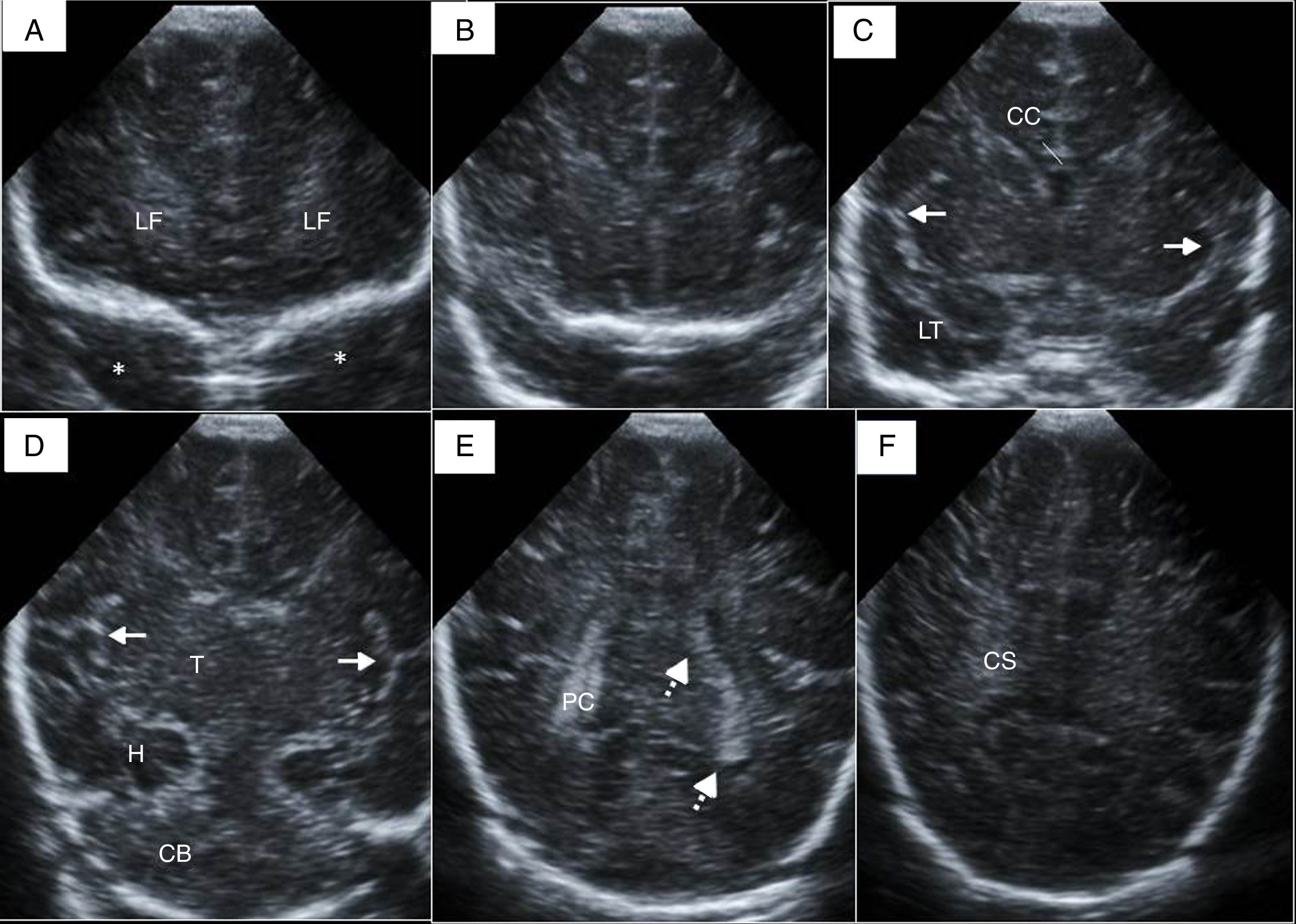
Estudio básico. Anatomía normalModo BLas estructuras anatómicas más relevantes deben quedar claramente representadas en dos planos3. Planos coronales: el transductor se coloca en el centro de la fontanela anterior realizando un barrido de delante hacia atrás (fig. 1). Planos sagitales: rotando el transductor 90° identificaremos la línea media y obtendremos cortes parasagitales de cada hemisferio (fig. 2).
Cortes coronales ecográficos de un recién nacido a término. A) Plano a través de los lóbulos frontales (LF) y techo de las órbitas (*). B) Segundo plano, que identifica las alas de los esfenoides y los polos temporales. C) Plano en el que se visualiza el cuerpo calloso (CC), ambas cisuras de Silvio (flechas) y los lóbulos temporales (LT). D) Cisuras de Silvio con su forma característica “en tridente” (flechas). Tálamos (T), hipocampos (H) y cerebelo en la fosa posterior. E) Plano de los ventrículos laterales (flechas discontinuas) y los plexos coroideos (PC). F) Centros semiovales (CS).
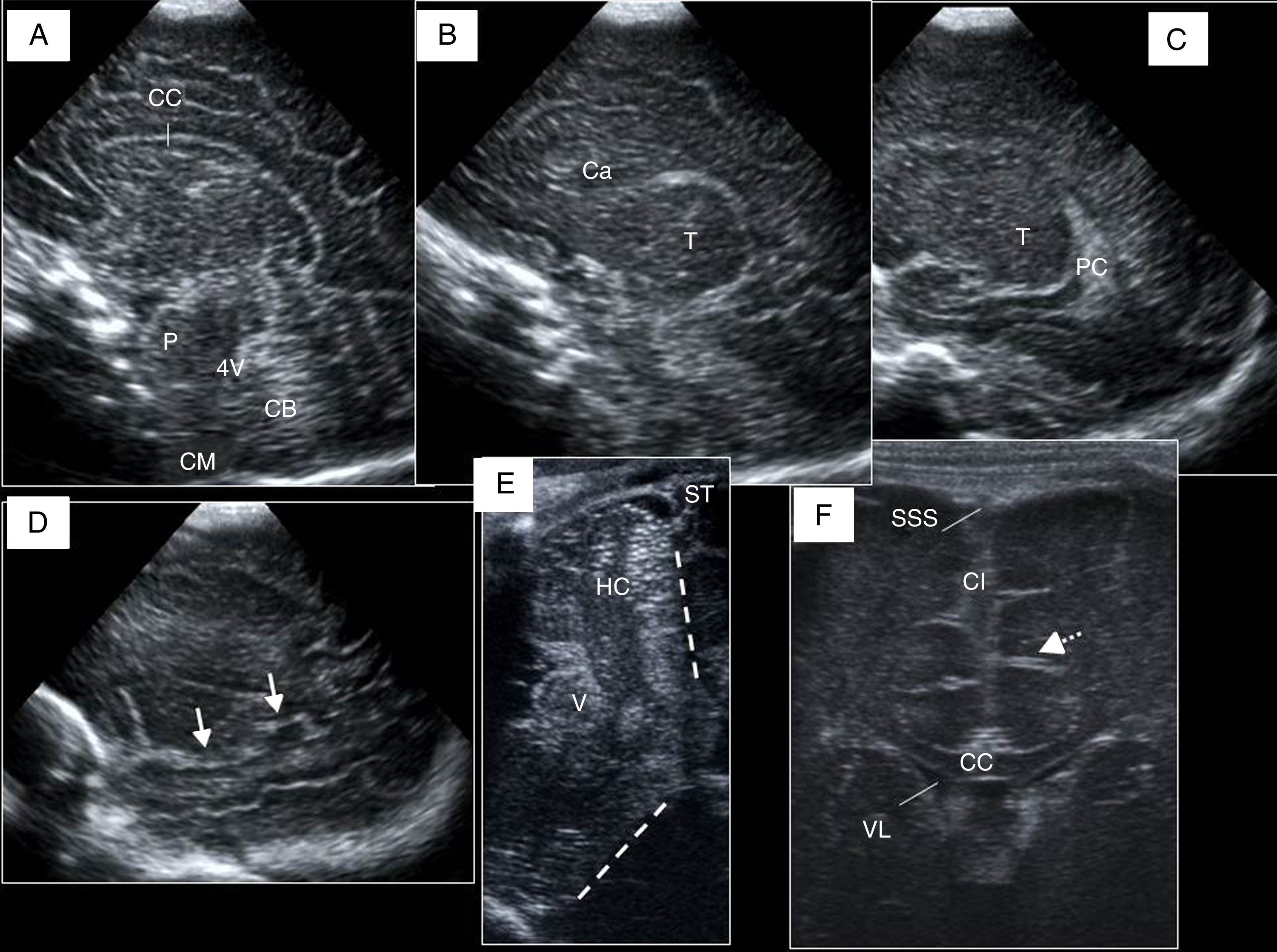
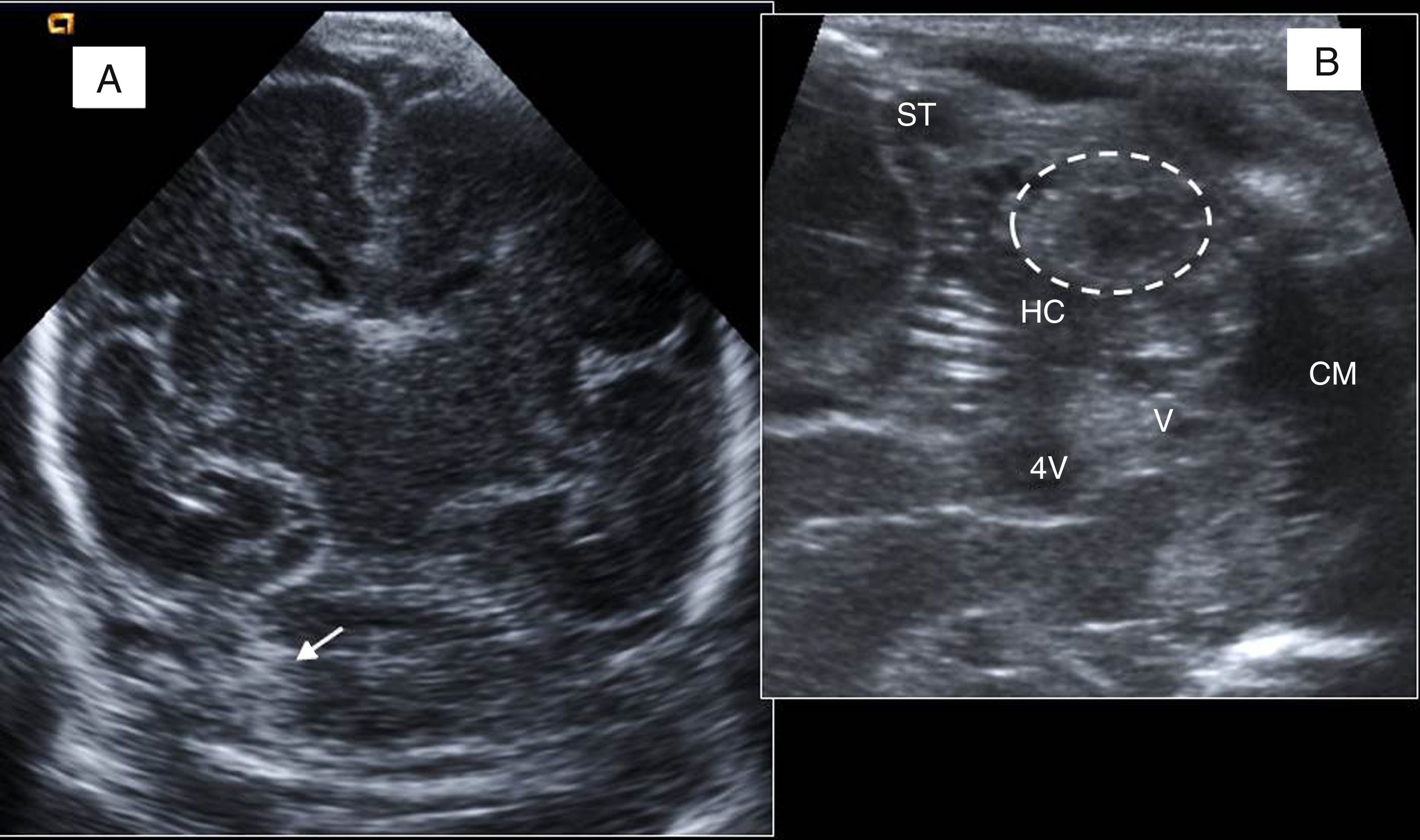
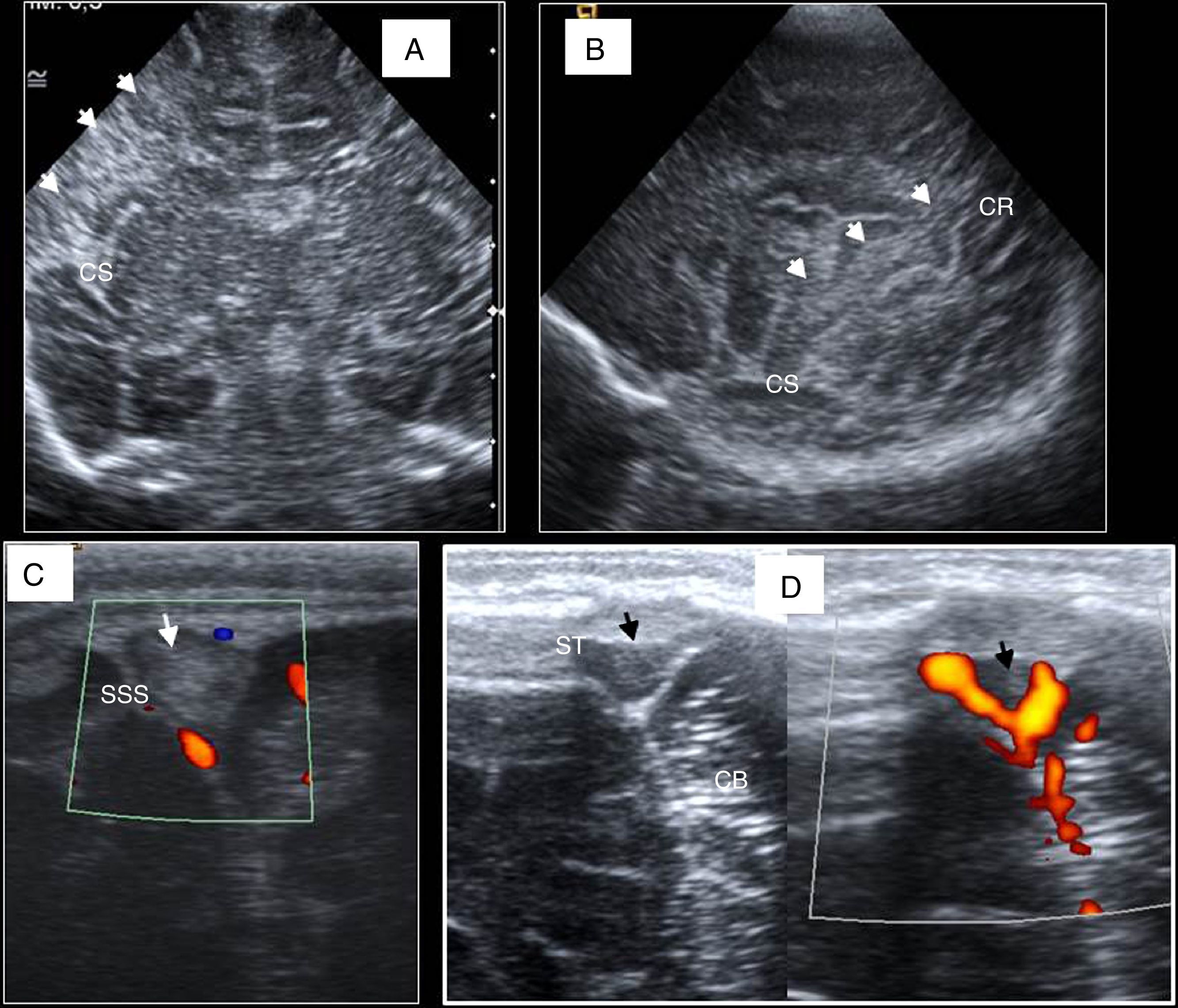
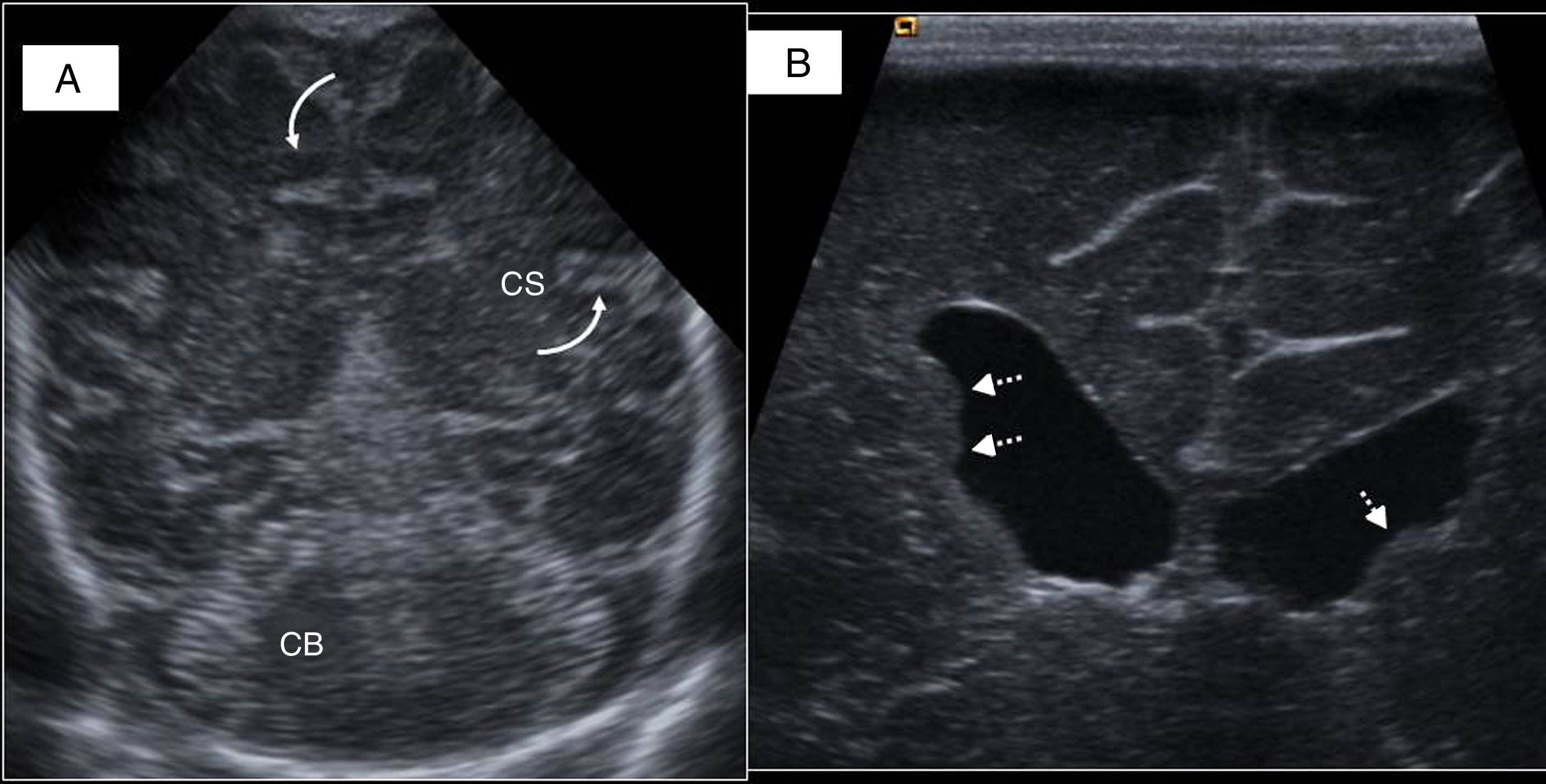
Línea media y cortes parasagitales. A) Cuerpo calloso (CC), cerebelo (CB), protuberancia (P), cuarto ventrículo (4V) y cisterna magna (CM). B) Primer plano parasagital derecho: surco caudotalámico entre caudado (Ca) y tálamo (T). C) Visión más lateral del atrio ventricular con el plexo coroideo (PC). D) Último corte: ínsula, cisuras de Silvio (flechas) y de Rolando o central. E) Visión de la fosa posterior a través de la fontanela mastoidea utilizando sonda lineal: hemisferio cerebeloso (HC), vermis (V), tentorio (líneas discontinuas) y seno transverso (ST). F) Visión coronal con sonda lineal por la fontanela anterior: seno sagital superior (SSS), cisura interhemisférica (CI), cuerpo calloso (CC), ventrículo lateral (VL) y surcos cerebrales (flecha).
El estudio mediante Doppler color y pulsado permite evaluar la permeabilidad de los vasos intracraneales y los cambios hemodinámicos del cerebro neonatal.
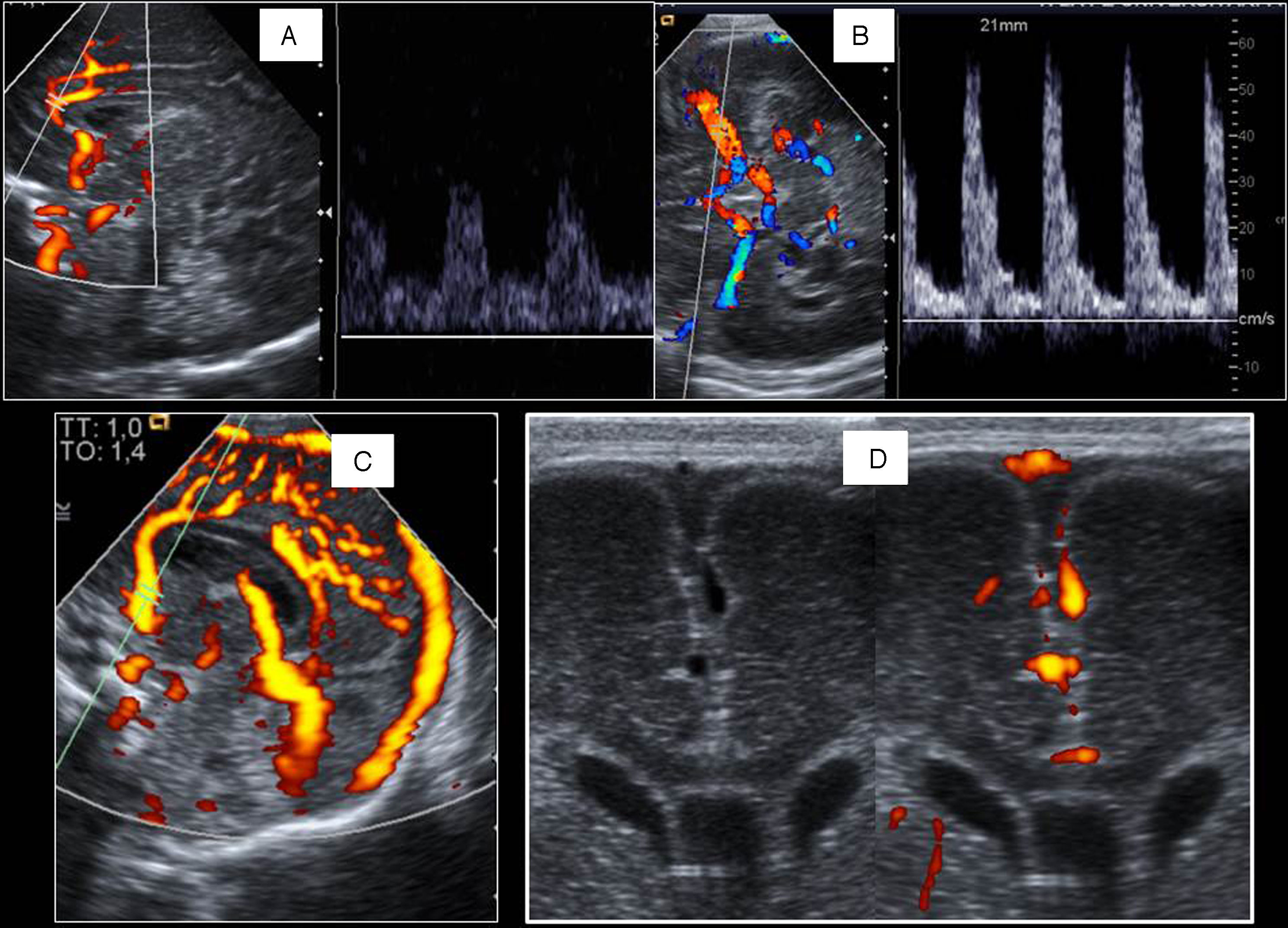
Generalmente se obtiene el registro Doppler de la arteria cerebral anterior o sus ramas como la pericallosa por su proximidad a la fontanela anterior. Para el estudio de cerebrales medias y el polígono de Willis se aconseja la ventana lateral o temporal (fig. 3).
Estudio Doppler cerebral. A) Línea media con la arteria cerebral anterior y curva en un recién nacido a término normal. B) Polígono de Willis. Curva normal de la arteria cerebral media de un prematuro con índices de resistencia altos. C) Power Doppler. Senos venosos principales en el plano sagital. D) Seno sagital superior en modo B y Doppler con sonda lineal.
El objetivo será analizar la morfología de la curva y calcular el índice de resistencia (IR). Normalmente los prematuros presentan curvas de alta resistencia, con IR entre 0,8 y 0,9, y los RNT sanos resistencias más bajas (IR de 0,6-0,8).
Los senos venosos principales pueden estudiarse a través de la fontanela anterior con una sonda curva, pero ante la sospecha de trombosis se aconseja el empleo de sonda lineal (fig. 3).
Por último, hay que saber reconocer las variantes anatómicas más frecuentes, como el cavum septi pellucidi, cavum vergae y cavum veli interpositi, que no deben considerarse como parte del sistema ventricular ni confundirse con otras patologías4.
Patología del prematuroHemorragia de la matriz germinal (HMG). Hemorragia intraventricular (HIV). Hemorragia cerebelosaLa HMG es una de las complicaciones más frecuentes en los prematuros nacidos antes de las 32 semanas y de menos de 1500g de peso al nacimiento, por lo que es aconsejable realizar la ETF por protocolo en los primeros 3 días de vida.
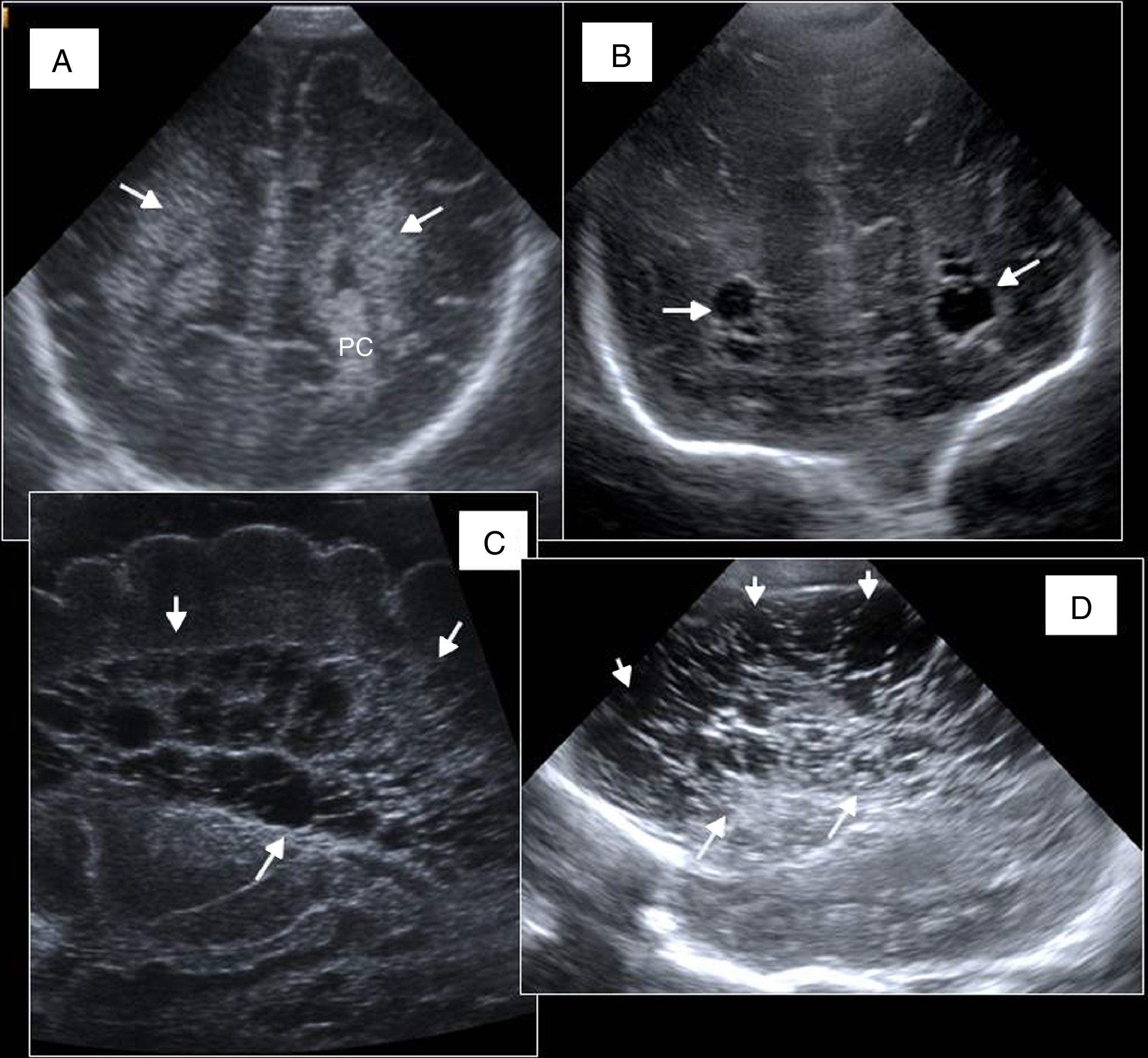
Las hemorragias intracraneales relacionadas con la prematuridad han sido clasificadas durante tiempo en cuatro grados según Papile. Actualmente, es más aceptada la clasificación propuesta por Volpe5 (fig. 4):
- •
HMG o grado I, limitada en el surco caudotalámico.
- •
HIV grado II: se extiende a la luz ventricular, sin dilatar su tamaño.
- •
HIV grado III: presenta dilatación ventricular desde el inicio.
- •
La clásica hemorragia de grado IV traduce afectación parenquimatosa asociada en forma de infarto venoso, que puede ir asociado a cualquiera de los tres tipos descritos e implica siempre peor pronóstico neurológico.
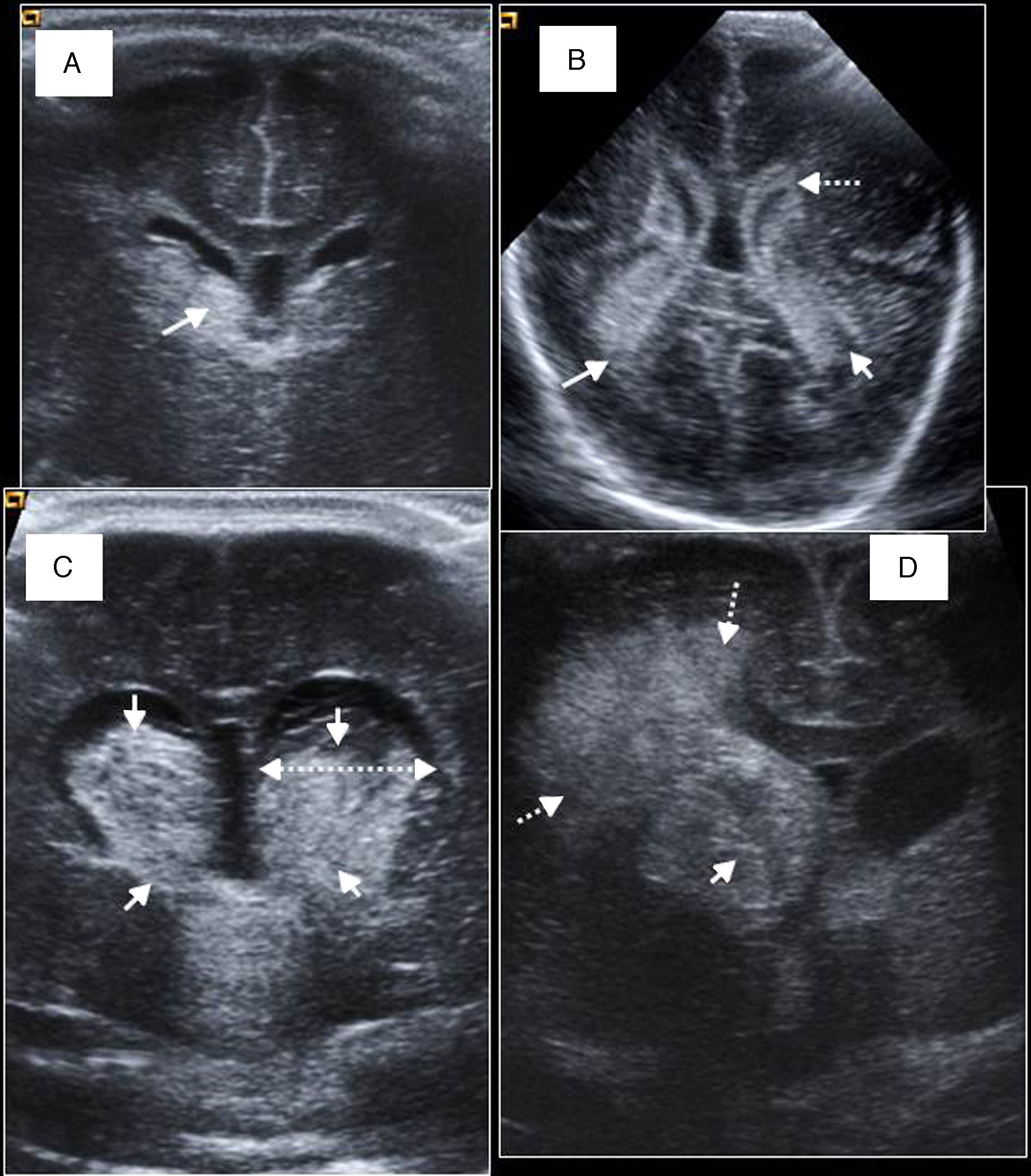
Grados de hemorragia del prematuro. A) Hemorragia de grado I o hemorragia de la matriz germinal (HMG) derecha (flecha). B) Hemorragia intraventricular bilateral (flechas) con refuerzo reactivo ecogénico del epéndimo de los ventrículos laterales (VL) (flecha discontinua). C) Hemorragia de grado III bilateral (flechas). Dilatación ventricular significativa de tercero y ambos VL (flecha doble). D) Infarto parenquimatoso derecho asociado (flechas discontinuas) a HMG derecha importante (flecha).
La hemorragia cerebelosa es relativamente frecuente en los más prematuros y su aparición empeora el pronóstico neurológico. Se diagnostican a través de la fontanela anterior cuando son de volumen considerable, pero es más adecuado utilizar la ventana mastoidea por su mayor sensibilidad2 (fig. 5).
Hemorragia cerebelosa del prematuro. A) Foco ecogénico en hemisferio cerebeloso derecho (flecha). B) Visión mastoidea con sonda lineal: alteración de la ecoestructura en el hemisferio cerebeloso derecho (círculo) por infarto/hemorragia cerebelosa. Seno transverso (ST), vermis (V), cisterna magna (CM), cuarto ventrículo (4V).
La HPH es la más frecuente en los prematuros como complicación de la HIV6. La ETF es clave en su diagnóstico y manejo así como en el seguimiento mientras las fontanelas sigan abiertas. El papel del radiólogo será:
- •
Identificar los ventrículos dilatados y los restos hemáticos intraventriculares (cantidad, distribución).
- •
Cuantificar el grado de dilatación utilizando medidas objetivas (fig. 6A y B):
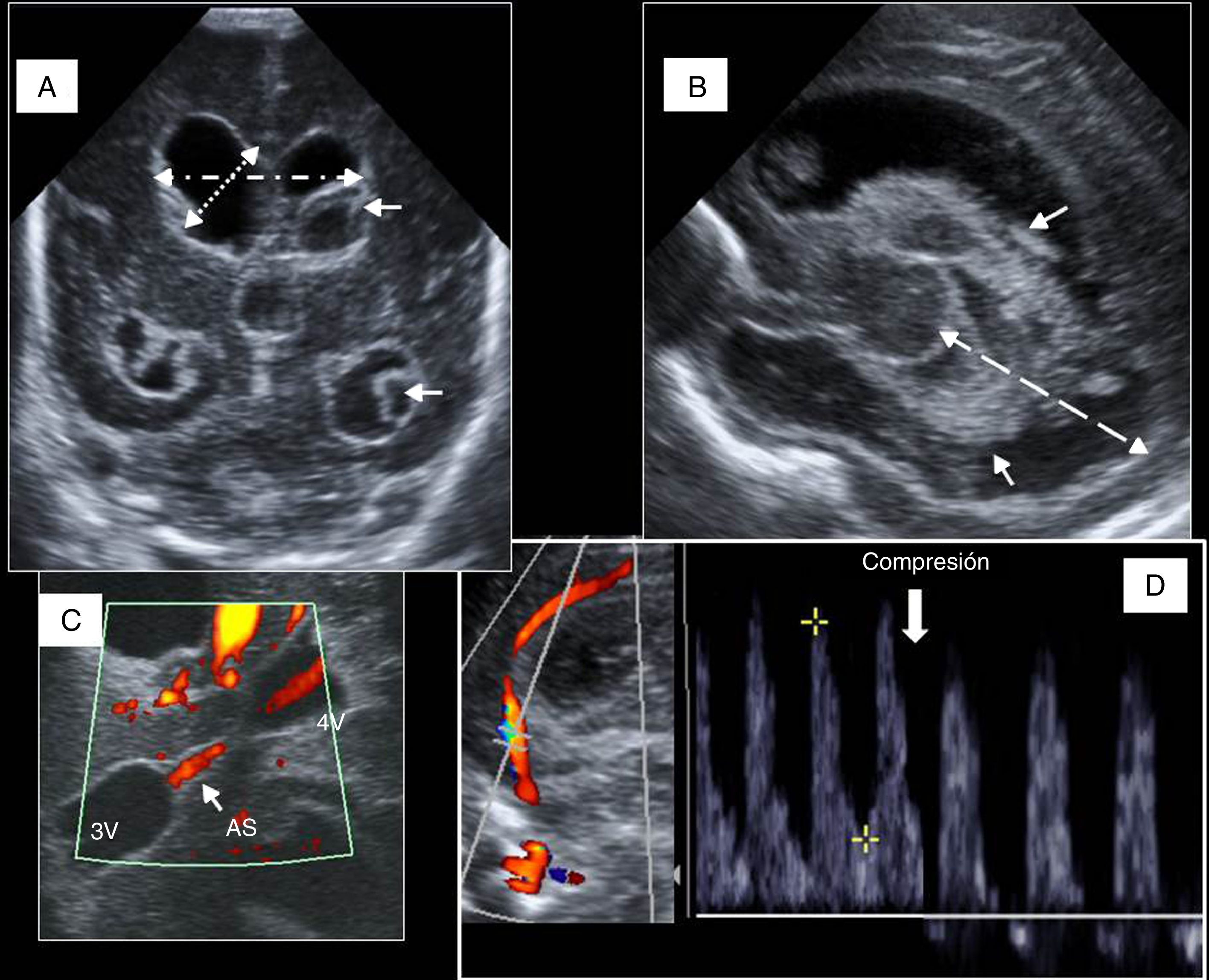
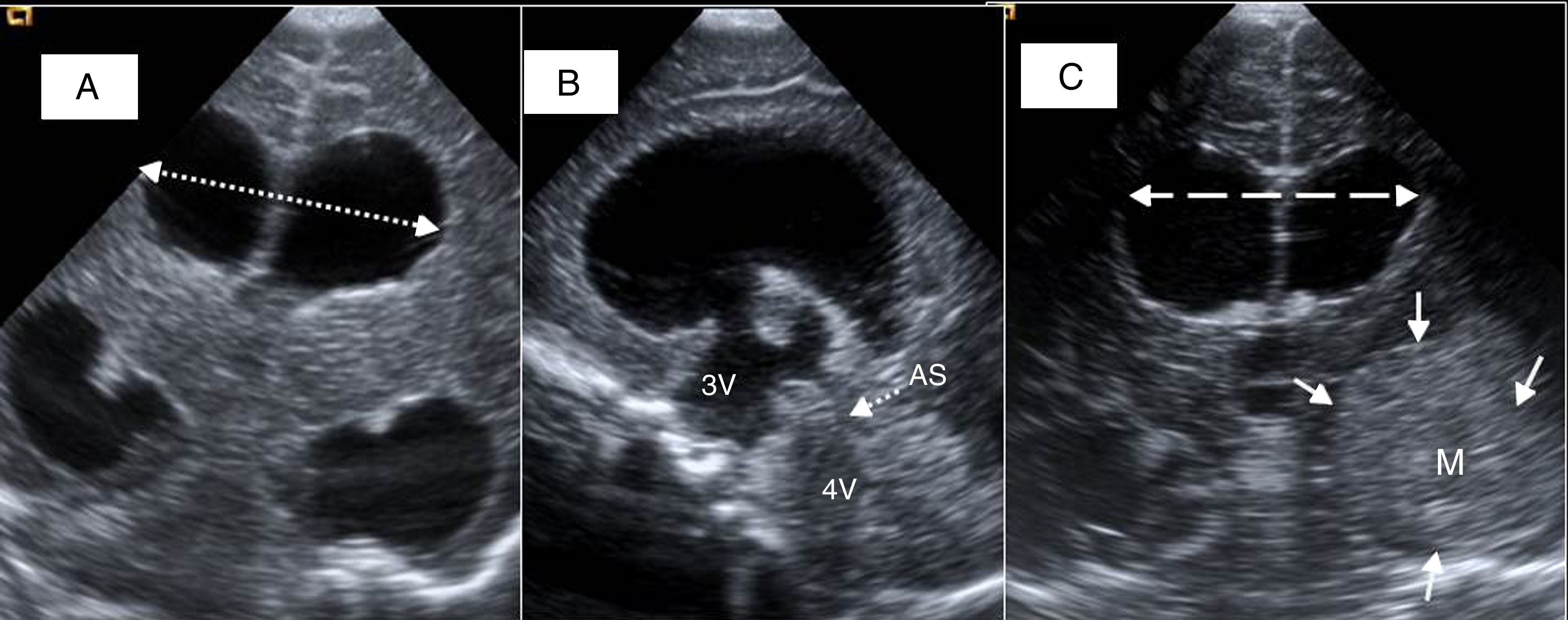
Figura 6.Hidrocefalia posthemorrágica del prematuro. A) Plano coronal con dilatación triventricular, restos hemáticos intraventriculares (flechas), medida para cálculo de índice de Levene (flecha con rayas y puntos), anchura de asta frontal derecha (flecha de puntos). B) Visión parasagital de ventrículo lateral con restos hemáticos (flechas). Distancia tálamo-occipital (línea discontinua). C) Visión del acueducto de Silvio (AS) por ventana temporal, entre tercer ventrículo (3V) y 4.° V. Artefacto de flujo en su interior que indica permeabilidad (flecha). D) Curva espectral de arteria cerebral anterior con inversión diastólica tras compresión de la fontanela anterior (flecha).
(0.46MB).
- –
Índice ventricular de Levene: mide la distancia entre la hoz interhemisférica y el borde externo del ventrículo lateral en un corte coronal a través de la fontanela anterior, a la altura del agujero de Monro. Cuando la distancia está 4mm por encima del percentil 97 se considera el tratamiento de la hidrocefalia.
- –
Anchura del asta frontal: normal si es menor de 3mm Cuando se dilata, expresa la dilatación o balonización de los ventrículos laterales: es leve entre 3 y 5mm, moderada entre 6 y 9mm, e importante con más de 10mm
- –
Distancia tálamo-occipital: hay dilatación cuando es mayor de 24mm
- •
Valorar el aumento progresivo del espacio extracerebral y monitorizar la talla ventricular en los casos tratados con derivación.
- •
Detectar complicaciones como el atrapamiento del cuarto ventrículo o la afectación parenquimatosa asociada.
- •
Mediante el Doppler se pretende (fig. 6):
- –
Valorar la permeabilidad del acueducto de Silvio.
- –
Detectar niños con alteración grave de la complianza intracraneal y en riesgo de desarrollar hipertensión intracraneal, los cuales presentarán disminución significativa del flujo diastólico cerebral demostrado mediante el test de la compresión progresiva de la fontanela anterior.
La afectación de la sustancia blanca es frecuente en los prematuros y repercute en su pronóstico neurológico a largo plazo. La realización seriada de ETF de forma protocolizada permite su detección, especialmente de la forma quística que suele aparecer a las 2-3 semanas de vida. Su papel es limitado en las lesiones no quísticas7. Hay que tener en cuenta que:
- •
De forma fisiológica los prematuros presentan una ecogenicidad periventricular discretamente aumentada los primeros 7-10 días de vida.
- •
Si la hiperecogenicidad es persistente, superior a la ecogenicidad de los plexos, heterogénea o marcadamente difusa, se considera patológica.
- •
Si se detectan quistes en la sustancia blanca, hay que definir su extensión (corticosubcortical, solo paraventricular) y localización. Estos quistes desaparecen en los primeros meses para dar resultado a una ventriculomegalia característica de la LPV.
- •
La LPV puede clasificarse en 4 grados (fig. 7). A mayor grado los pacientes tendrán peor pronóstico neurológico a largo plazo:
Figura 7.Clasificación de la leucomalacia periventricular. A) Grado I o hiperecogenicidad persistente. B) Grado II o quistes de sustancia blanca frontales bilaterales pequeños. C) Grado III o extensos quistes en sustancia blanca periventricular. D) Grado IV o afectación multiquística difusa incluyendo regiones subcorticales.
(0.43MB).
- –
Grado I o hiperecogenicidad periventricular persistente.
- –
Grado II: quistes localizados junto a los ventrículos laterales.
- –
Grado III: quistes extensos en sustancia blanca frontoparietal y occipital.
- –
Grado IV: cuando hay quistes extensos con extensión subcortical difusa.
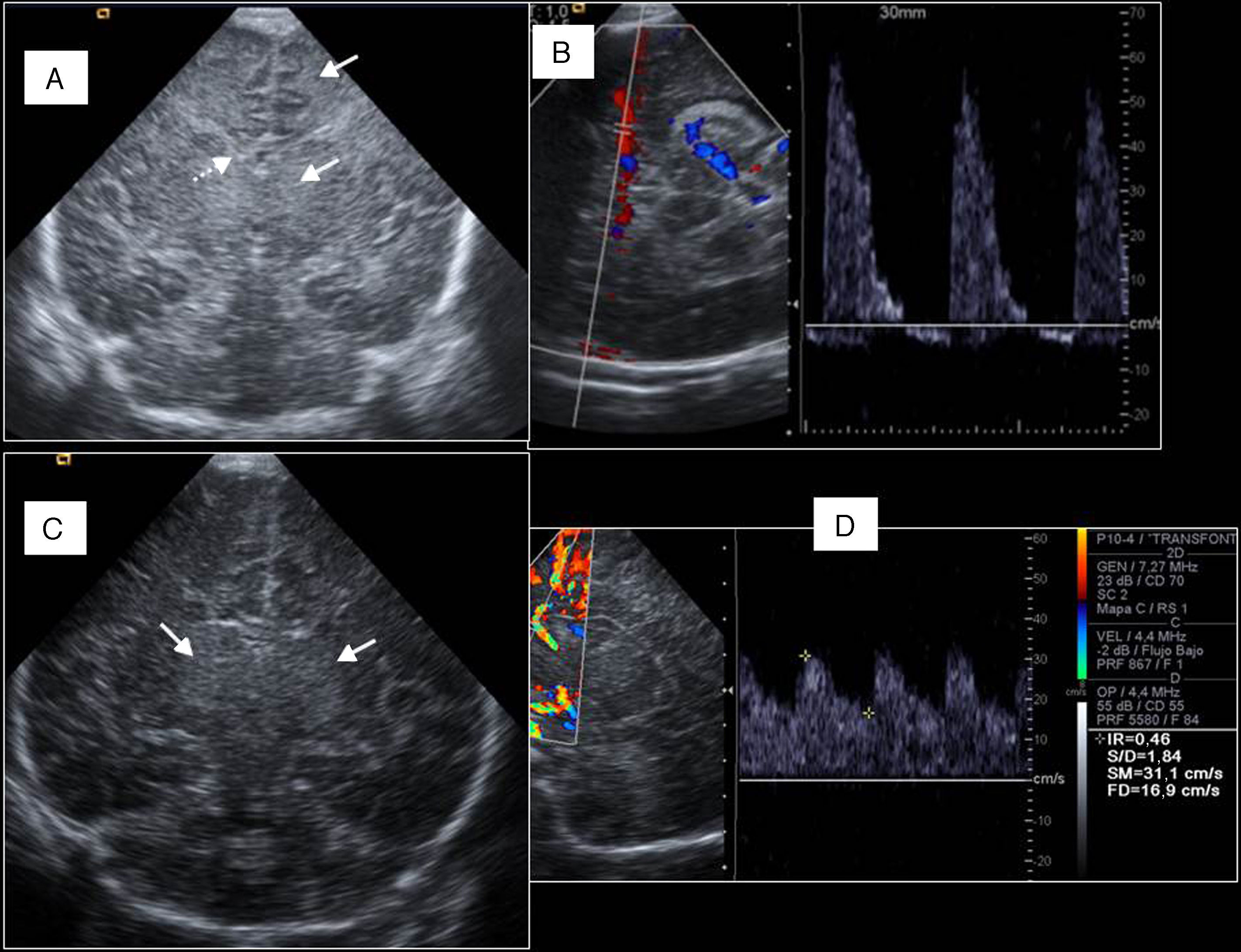
Ante un RNT con sospecha clínica de EHI, la primera prueba de neuroimagen debe ser la ETF. Si es tratado con hipotermia, realizaremos ETF cada 24h durante los 3 días del tratamiento8. El papel de la ETF es (fig. 8):
- •
Detectar signos de daño cerebral prenatal o patología que haya pasado desapercibida en las ecografías fetales.
- •
Valorar qué patrón predomina:
- –
Periférico: hiperecogenicidad periventricular focal o difusa.
- –
Central: afectación gangliotalámica, de peor pronóstico.
- •
El Doppler cerebral aporta información sobre el flujo sanguíneo cerebral y distingue:
- –
Curvas con inversión diastólica: pueden traducir muerte encefálica. Hay que asegurar la ausencia de cortocircuito izquierda-derecha como conducto arterioso persistente.
- –
Curvas de baja resistencia (IR<0,55): traducen vasodilatación cerebral y se han relacionado con mal pronóstico neurológico.
- –
Flujo alternante o bifásico cuando hay pérdida de la autorregulación del flujo sanguíneo cerebral.
Encefalopatía hipóxico-isquémica neonatal. A) Recién nacido a término (RNT) tras rotura uterina. Plano coronal que muestra edema cerebral difuso tanto central como periférico (flechas) con colapso ventricular (flecha discontinua). B) Espectro de cerebral media con inversión diastólica, como signo de mal pronóstico (presentaba EEG plano y falleció horas más tarde). C) RNT tras desprendimiento de placenta. Patrón central (hiperecogenicidad talámica bilateral, flechas). D) Doppler de cerebral anterior mostrando vasodilatación cerebral con elevación de diástoles e IR<0,55.
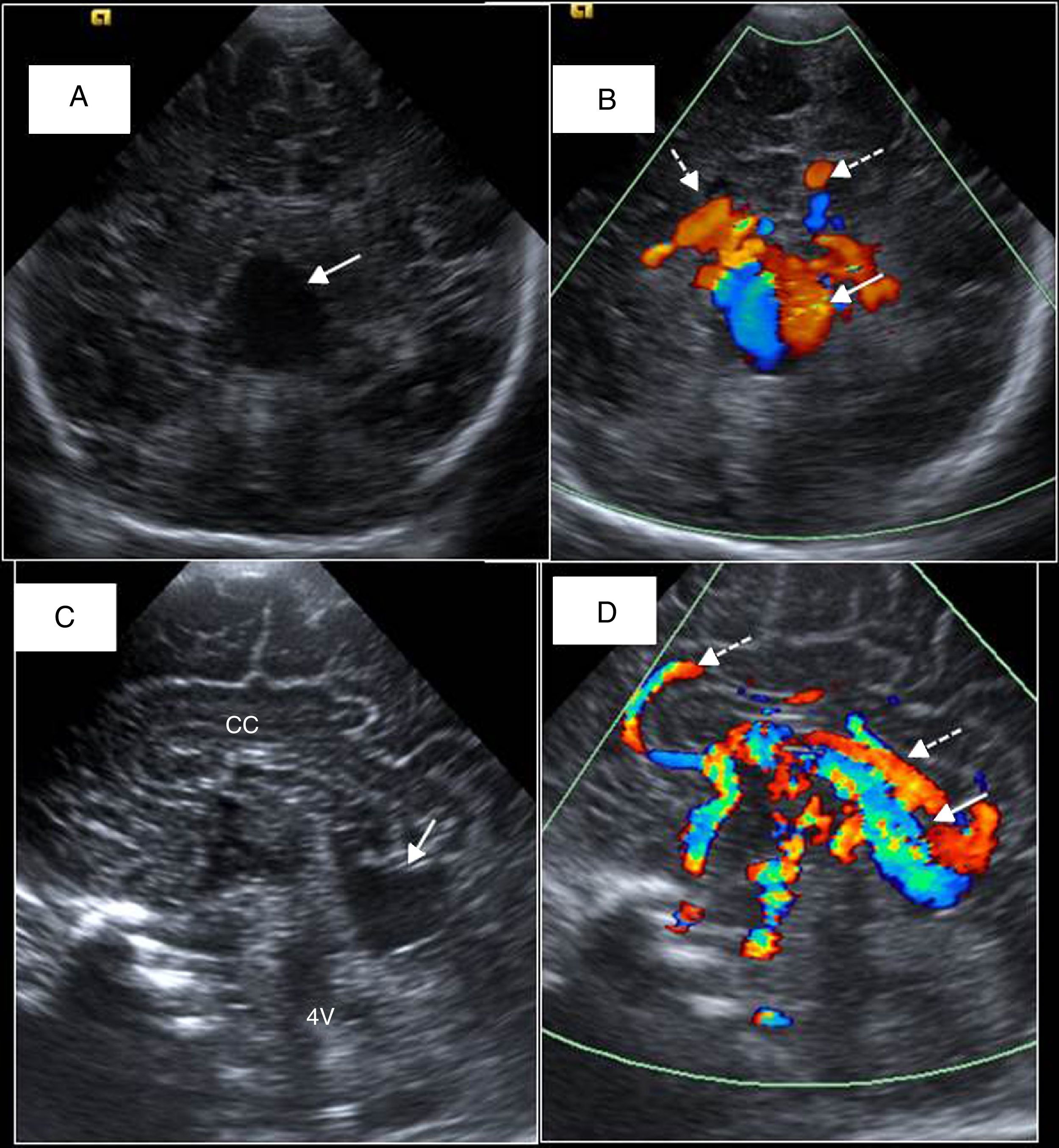
Cuando un neonato convulsiona y existe sospecha de un ictus neonatal, la ETF debe realizarse previa a la realización de la resonancia magnética (RM) para descartar patología intracraneal. Los signos ecográficos son sutiles durante las primeras 12-24h, y se hacen más evidentes durante la primera semana, con la pérdida de diferenciación entre sustancia gris-blanca en forma de hiperecogenicidad corticosubcortical y borramiento de surcos (fig. 9). Según el territorio afectado, intuiremos el vaso responsable. Con el tiempo, estos cambios suelen traducirse en una cavidad porencefálica7.
Recién nacido a término con convulsiones. A) Plano coronal. Hiperecogenicidad corticosubcortical y borrosidad de surcos en relación con infarto en territorio de cerebral media derecha (flechas). B) Visión parasagital del mismo infarto suprasilviano y perirrolándico. Cisura de Silvio (CS) y de Rolando (CR). C) Trombosis de seno sagital superior (SSS). D) Trombosis de seno transverso derecho con signo ecográfico Doppler del “delta vacío”. ST: seno transverso; CB: cerebelo.
El Doppler permite valorar la permeabilidad de los vasos principales (polígono de Willis) y detectar flujos anómalos. En los casos de infarto de la arteria cerebral media es frecuente detectar un aumento de la diástole.
En un RNT se debe sospechar una trombosis venosa cuando se observe afectación focal de la sustancia blanca periventricular o de la convexidad, una hemorragia intraventricular o talámica. Con la ETF se exploran los senos venosos intracraneales principales, y es diagnóstico de trombosis la ocupación de la luz del seno por material ecogénico y la ausencia de señal Doppler color (fig. 9). La ETF será la técnica idónea para el seguimiento de la involución del trombo venoso intracraneal durante el tratamiento.
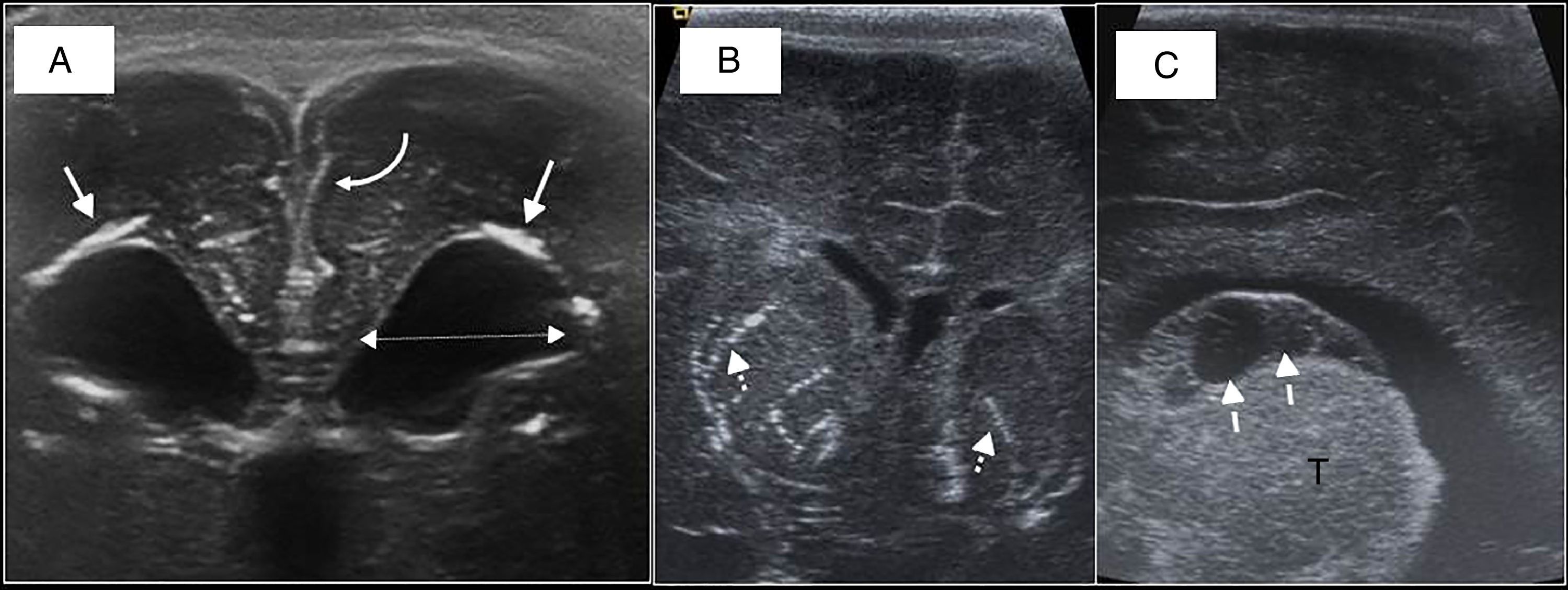
Patología malformativa. Agenesia del cuerpo calloso (ACC) y otras.La ecografía fetal, realizada de forma protocolizada durante el embarazo, es capaz de detectar malformaciones cerebrales en la época prenatal, de tal forma que la ETF posnatal tiene como función confirmar los hallazgos prenatales. La ACC es una de las malformaciones más frecuentes y, por tanto, sus hallazgos de imagen deben ser conocidos por los radiólogos. Estos incluyen:
- •
La morfología en astas de toro o en lágrima de las astas frontales de los ventrículos laterales.
- •
La ausencia de cavum septi pellucidi y comunicación del tercer ventrículo con la cisura interhemisférica.
- •
Colpocefalia bilateral con disposición paralela de ambos ventrículos laterales.
- •
La ausencia de cuerpo calloso y surco cingulado en el plano sagital (fig. 10).
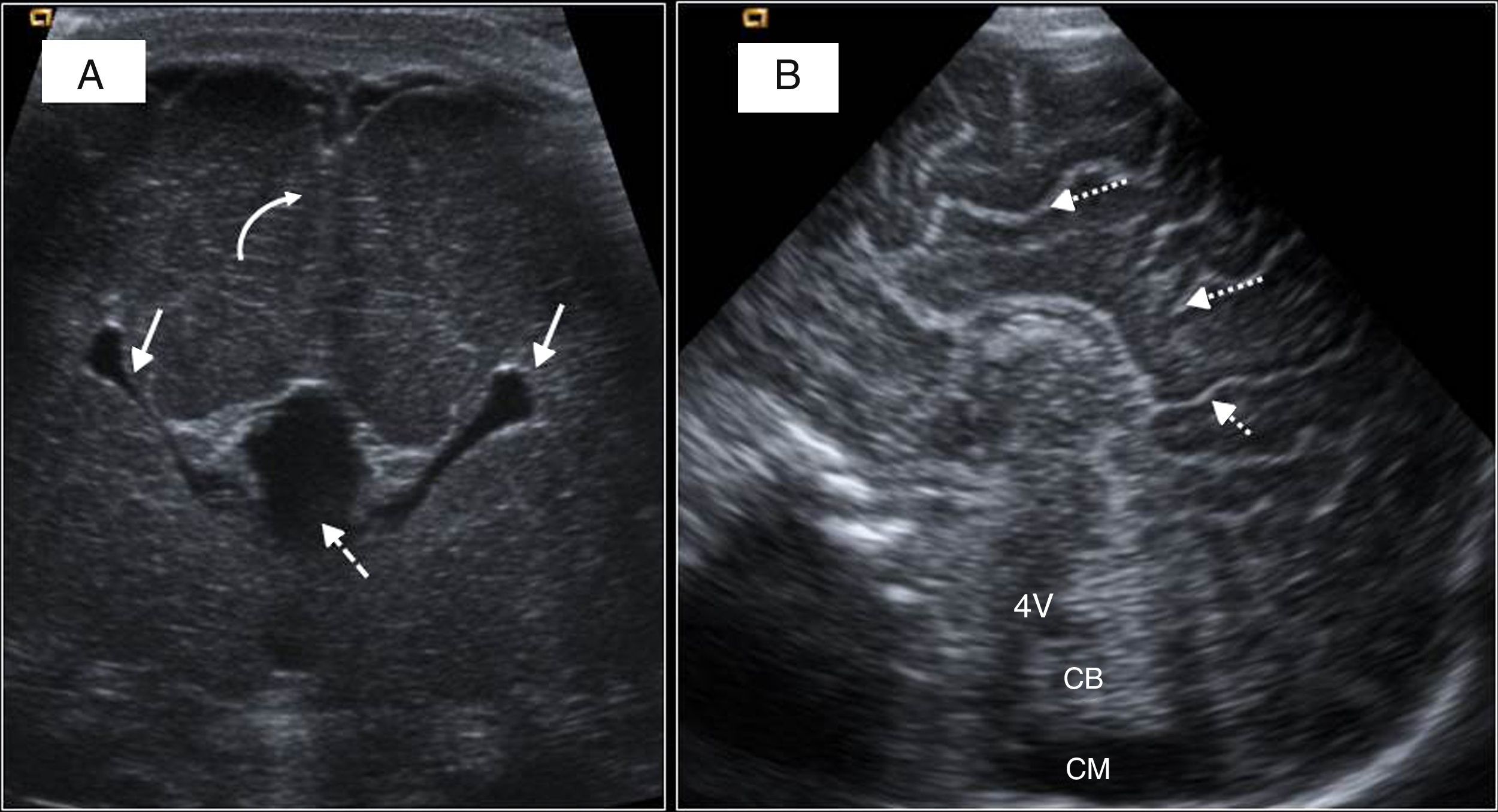
Figura 10.Agenesia de cuerpo calloso. A) Recién nacido a término (RNT) con signos de agenesia del cuerpo calloso (ACC) completa: VL en astas de toro (flechas), ausencia de cuerpo calloso (CC) (flecha discontinua). Surcos patológicos, escasos y poco profundos (flecha curva). B) RNT con diagnóstico prenatal de ACC. Visión de línea media con ausencia del CC, surcos radiales (flechas discontinuas) y ausencia de cíngulo. 4V: cuarto ventrículo; CB: cerebelo; CM: cisterna magna.
(0.25MB).
La presencia de malformaciones corticales puede sospecharse por ecografía. En los casos de polimicrogiria, las cisuras de Silvio están engrosadas y las heterotopias se ven como nódulos subependimarios en los ventrículos laterales (fig. 11).
Malformaciones corticales. A) Recién nacido a término (RNT) con hipotonía y convulsiones. Surcos gruesos y poco profundos (flechas curvas) en relación con microlisencefalia. Cisura de Silvio (CS) gruesa, patológica. B) Nódulos hipoecoicos (flechas) en RNT con heterotopias nodulares subependimarias múltiples en ambos ventrículos laterales. CB: cerebelo.
En la valoración de las malformaciones de la fosa posterior como Chiari II o Dandy-Walker, la ETF se emplea como primera aproximación diagnóstica para descartar ventriculomegalia u otras anomalías asociadas.
Macrocefalia del lactante. Hidrocefalia.Cuando un lactante presenta un crecimiento anormal del perímetro cefálico, la ETF está indicada para descartar:
- •
Causas obstructivas, como la estenosis congénita del acueducto de Silvio (fig. 12), lesiones ocupantes de espacio o malformaciones complejas cerebrales.
Figura 12.Hidrocefalia. A) y B) Recién nacido a término con estenosis del acueducto de Silvio vista en dos planos, con importante dilatación de tercer (3V) y ambos ventrículos laterales. Acueducto de Silvio inapreciable. Cuarto ventrículo normal (4V).C) Hidrocefalia (flechas discontinuas) secundaria a papiloma de plexos (M, entre flechas) en asta temporal de VL izquierdo.
(0.27MB). - •
Hipersecreción de líquido cefalorraquídeo como en el papiloma de plexos coroideos (fig. 12).
- •
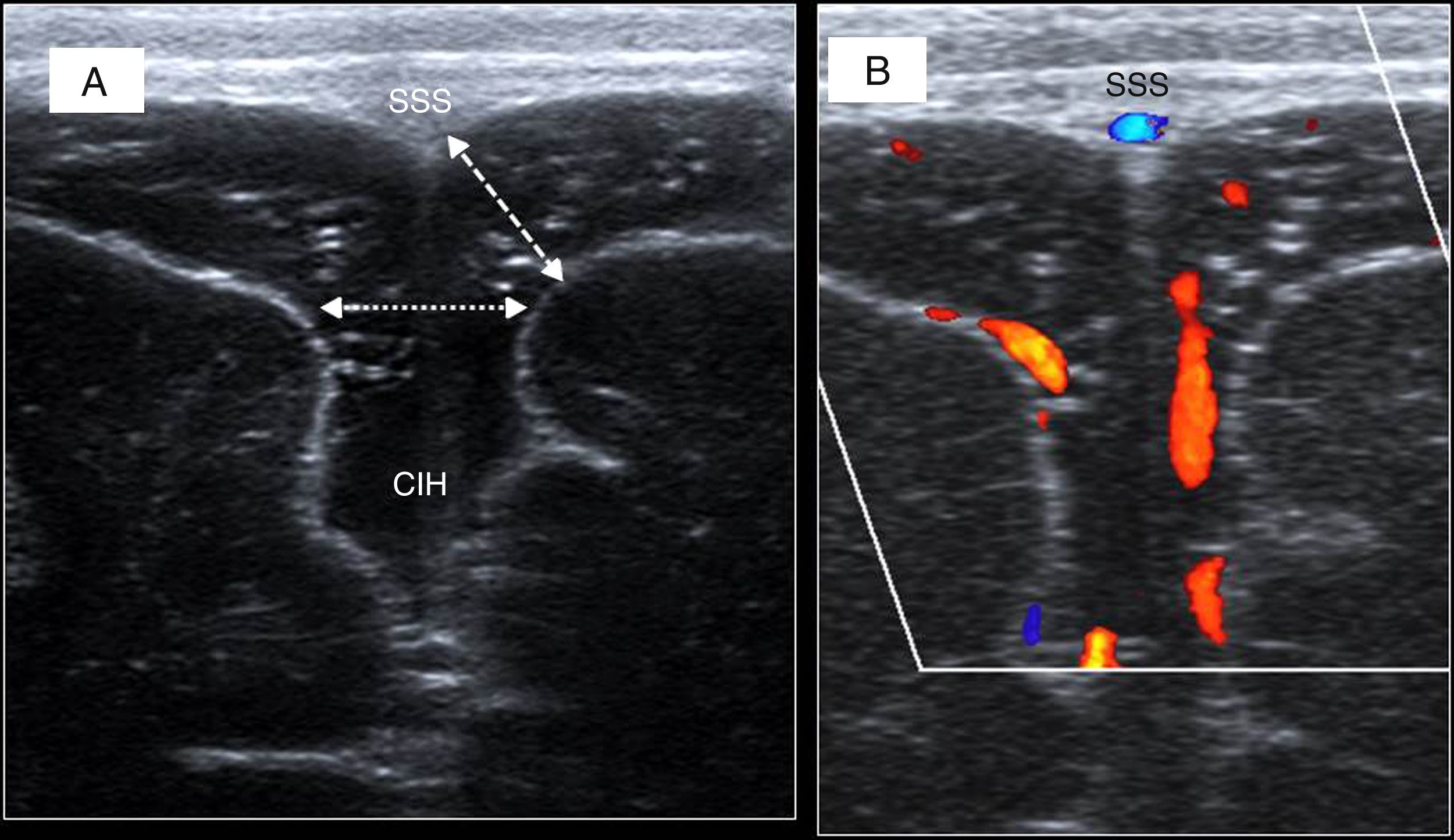
Macrocefalia por aumento del espacio extracerebral, antiguamente conocida como hidrocefalia benigna externa, caracterizada por un aumento de los espacios subaracnoideos, fundamentalmente frontales, con una talla ventricular conservada o discretamente aumentada pero sin apenas repercusión clínica y, en general, autolimitada9 (fig. 13).
Figura 13.Espacio extracerebral prominente (hidrocefalia externa benigna). A) Visión coronal con sonda lineal. Distancia corticocortical (flechas con puntos) superior a 10mm, y sinocortical (flecha discontinua) superior a 10mm Seno sagital superior (SSS); cisura interhemisférica (CIH). B) Visión con Doppler: vasos que cruzan confirmando que se trata de espacio subaracnoideo y no hay higroma o colecciones subdurales.
(0.28MB).
La malformación aneurismática de la vena de Galeno es la más frecuente. Se presenta como una estructura anecoica, redondeada en el plano coronal y tubular en el plano sagital, localizada en la línea media posterior, cuya naturaleza vascular y múltiples aferencias vasculares se demuestran por Doppler (fig. 14).
Recién nacido a término con insuficiencia cardiaca y cardiomegalia. A) Visión coronal que muestra imagen aneoica sin refuerzo, redondeada en línea media posterior (flecha). B) Plano con Doppler donde se aprecia relleno de la lesión y de múltiples vasos circundantes dilatados (flechas discontinuas) en relación con malformación aneurismática de la vena de Galeno. C) Plano sagital con dilatación sacular posterior. CC: cuerpo calloso. 4V: cuarto ventrículo. D) Visión sagital de línea media y Doppler con múltiples vasos dilatados (flechas) y flujos turbulentos hacia la malformación vascular.
El objetivo de la ETF será identificar hallazgos que orienten a una infección congénita. En caso de afectación por citomegalovirus, uno de los más frecuentes (fig. 15.), se debe valorar la presencia de:
- •
Calcificaciones periventriculares.
- •
Quistes paraventriculares temporales o germinolíticos en el surco caudotalámico.
- •
Vasculopatía estriada.
- •
Alteraciones de la sulcación cerebral como microlisencefalia o polimicrogiria, etc.
Infección por citomegalovirus (CMV) en distintos neonatos. A) Visión coronal de un recién nacido a término con microcefalia e hipotonía. Múltiples calcificaciones periventriculares (flechas), ventriculomegalia (flecha discontinua) y surcos cerebrales poco profundos (flecha curva). B) Vasculopatía estriada (flechas) bilateral, hallazgo inespecífico pero frecuente en CMV. C) Quiste germinolítico en surco caudotalámico, otro hallazgo frecuente no específico en estos pacientes.
Por otro lado, ante la sospecha de meningitis neonatal, la ETF debe descartar complicaciones intracraneales como la ventriculitis, la hidrocefalia postinfecciosa, infartos, trombosis venosas o abscesos.
Traumatismo craneoencefálico (TCE): obstétrico y accidentalEl TCE neonatal suele estar relacionado con partos distócicos, instrumentación con fórceps o cesáreas urgentes. La ETF es capaz de detectar colecciones hemáticas intracraneales significativas, pero puede infravalorar el daño cerebral asociado y/o los hematomas epidurales o subdurales localizados en las convexidades o en la fosa posterior. Por tanto, se recomienda el uso de la tomografía computarizada si se desea descartar patología que requiera una actitud terapéutica urgente.
ConclusionesLa ETF es la primera prueba de imagen diagnóstica en la patología cerebral neonatal y del lactante. Tiene un alto rendimiento diagnóstico siempre que se emplee una técnica correcta, múltiples ventanas acústicas y equipos modernos.
Su realización de forma seriada en los prematuros permite identificar complicaciones a corto y medio plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.