El análisis de las causas que han provocado un cambio de tendencia en la incidencia y la mortalidad del cáncer de mama en las últimas décadas genera revelaciones importantes sobre el papel del cribado mamográfico, el empleo regular de terapias adyuvantes y la alteración de los factores de riesgo. Los beneficios de la detección precoz se han acompañado de ciertos efectos adversos, incluso en forma de un excesivo número de mastectomías profilácticas. Recientemente se han publicado diversas actualizaciones internacionales sobre las recomendaciones en cribado del cáncer de mama. Por otra parte, los avances en genómica han permitido establecer una nueva clasificación molecular del cáncer de mama. Nuestro objetivo es presentar una visión actualizada de la situación epidemiológica del cáncer de mama y de algunas cuestiones relevantes desde el punto de vista del diagnóstico, como son la clasificación molecular y las diferentes estrategias de cribado, poblacional y oportunista.
The analysis of the causes that have given rise to a change in tendency in the incidence and mortality rates of breast cancer in the last few decades generates important revelations regarding the role of breast screening, the regular application of adjuvant therapies and the change of risk factors. The benefits of early detection have been accompanied by certain adverse effects, even in terms of an excessive number of prophylactic mastectomies. Recently, several updates have been published on the recommendations in breast cancer screening at an international level. On the other hand, the advances in genomics have made it possible to establish a new molecular classification of breast cancer. Our aim is to present an updated overview of the epidemiological situation of breast cancer, as well as some relevant issues from the point of view of diagnosis, such as molecular classification and different strategies for both population-based and opportunistic screening.
Numerosos aspectos relacionados con el diagnóstico precoz y el tratamiento del cáncer de mama han centrado la atención de una parte considerable de las investigaciones científicas en las últimas décadas, un hecho que, trasladado a la práctica diaria, ha supuesto una revolución en el manejo de esta enfermedad. Entre lo más destacado se encuentran la evolución tecnológica de los métodos de detección (mamografía digital, sistemas de lectura asistida por ordenador y tomosíntesis), el desarrollo de un sistema estandarizado para la interpretación de las pruebas de imagen, la incorporación de técnicas quirúrgicas menos invasivas, la mejora de los tratamientos sistémicos y los recientes avances en el campo de la genómica. Al mismo tiempo, han aumentado la conciencia social y la aceptación del cáncer de mama, y sus altas tasas de incidencia y mortalidad han llevado a los gobiernos de muchos países desarrollados a destinar ingentes recursos económicos para introducir estrategias de detección precoz.
Sin embargo, el cáncer de mama sigue siendo la primera causa de muerte por cáncer en la mujer, y las supuestas cotas de progreso alcanzadas se han acompañado de la aparición de nuevos riesgos y efectos adversos que, aunque difíciles de cuantificar con precisión, han servido para poner en duda el auténtico beneficio del cribado mamográfico1.
Nuestro objetivo es presentar una visión actualizada de la situación epidemiológica del cáncer de mama y de algunas cuestiones relevantes desde el punto de vista del diagnóstico, como son la clasificación molecular y las diferentes estrategias de cribado, poblacional y oportunista.
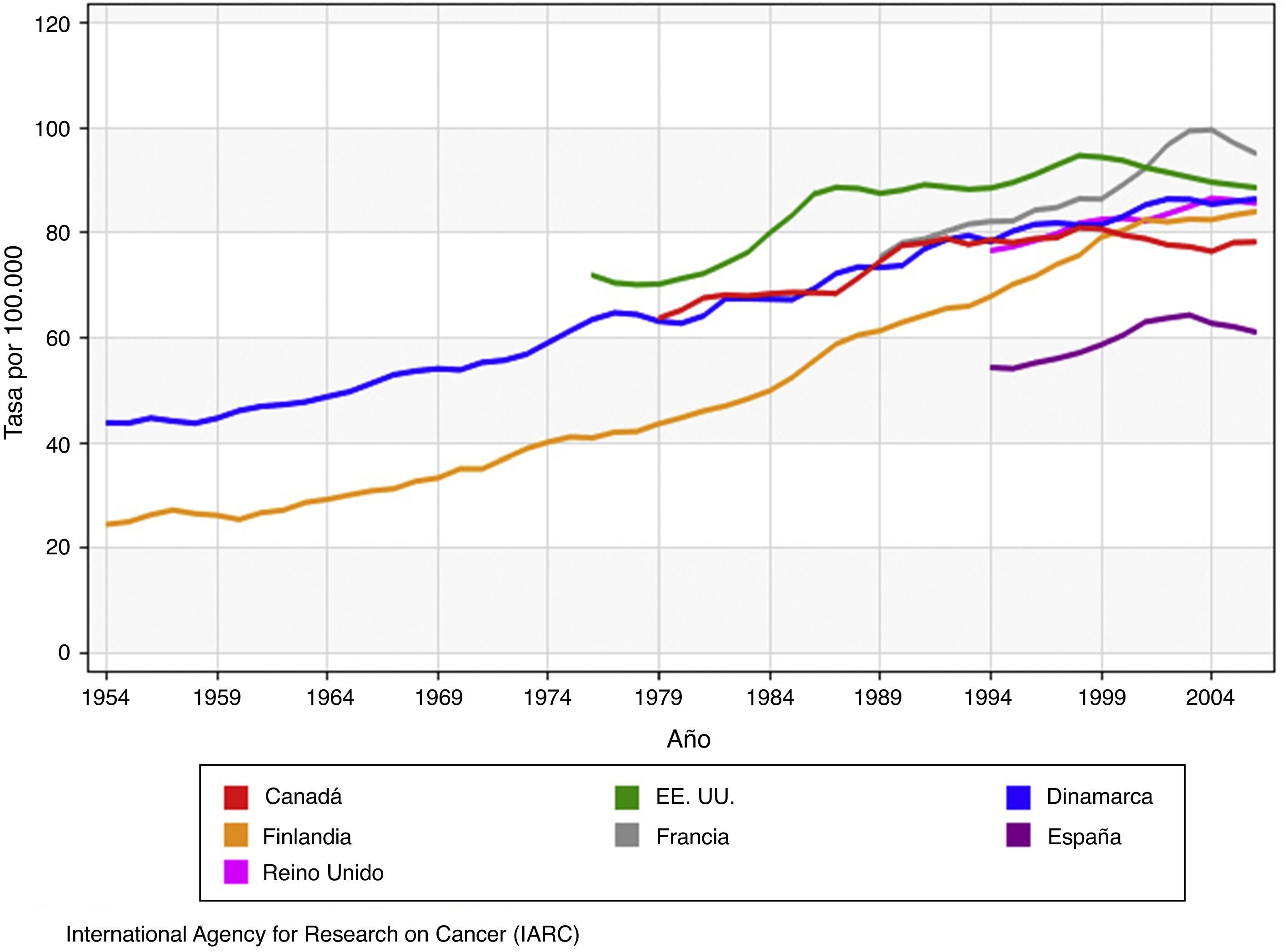
Epidemiología del cáncer de mamaDatos epidemiológicosIncidenciaDesde los primeros registros disponibles, de 19402, se evidencia una tendencia ascendente en la incidencia del cáncer de mama3 (fig. 1), con incrementos anuales del 1-4%4, tanto en los países desarrollados como en aquellos en vías de desarrollo. Esa tendencia ha sido más acentuada entre finales de la década de 1980 e inicios del siglo XXI5, sobre todo para los tumores in situ e invasivos en estado precoz. Desde entonces, se ha producido una estabilización o un descenso de las tasas de incidencia en gran parte de Europa, los Estados Unidos y Canadá. En España, datos oficiales del periodo 1980-2004 revelan que, a partir de 2001, la incidencia de cáncer de mama comenzó a descender al 2,4% anual en las mujeres de 45-64 años de edad, mientras que en el grupo de 64 años o más se incrementó hasta 1995 con una tasa anual del 3,3% y, posteriormente, se ha estabilizado6.
Tasas de incidencia de cáncer de mama ajustadas por edad en países con cribado mamográfico. (Adaptada del original de la IARC3).
A pesar de lo anterior, el cáncer de mama continúa siendo la neoplasia más frecuente en la mujer. La probabilidad de padecerlo aumenta con la edad, si bien el riesgo es heterogéneo entre la población femenina y depende, entre otros, de factores no modificables como la raza, la demostración en una biopsia de ciertas lesiones proliferativas (hiperplasia atípica, carcinoma lobulillar in situ), los antecedentes personales y familiares de cáncer de mama, o de mutaciones genéticas heredadas (BRCA1, BRCA2). En el año 2012, representó el 25% de los cánceres femeninos en todo el mundo, solo superado por el carcinoma de pulmón al considerar ambos sexos en conjunto, lo que se traduce en 25.215 casos nuevos en España y 458.718 en Europa7. Por grupos de edad, alrededor del 19% de los cánceres de mama se diagnostican a los 30-49 años, el 37% a los 50-64 años y el 44% en mujeres de al menos 65 años de edad8.
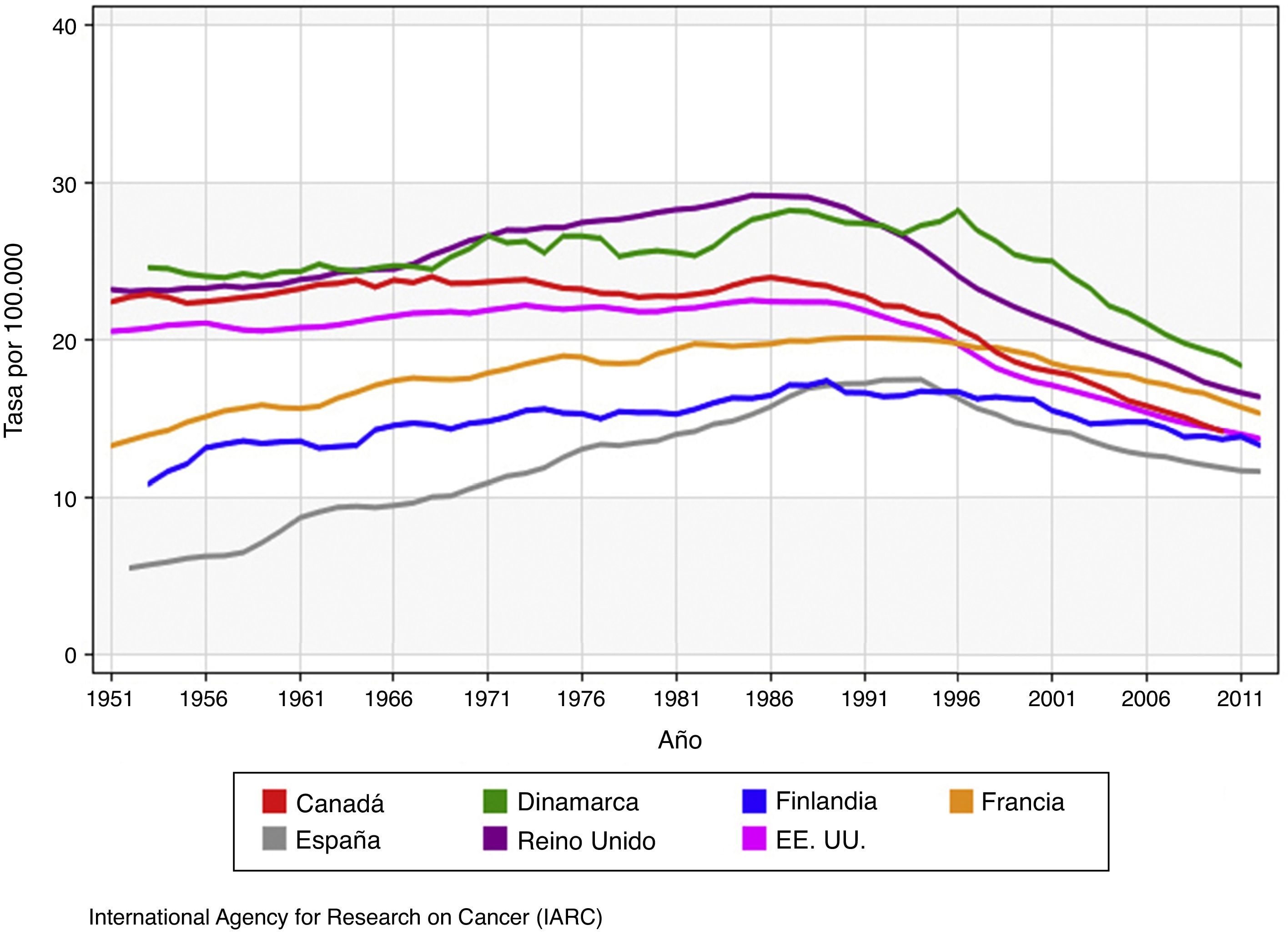
MortalidadRespecto a la mortalidad por cáncer de mama9 (fig. 2), experimentó un largo periodo de crecimiento durante casi todo el siglo xx, que tuvo su punto de inflexión al comienzo de los años 1990, cuando empezó a invertirse la tendencia en muchos países desarrollados, a un ritmo anual del 0,6-5,0%5, y se evidenció un incremento significativo de la supervivencia. Según las estimaciones del grupo EUROCARE-5, basándose en el análisis de pacientes diagnosticadas de cáncer de mama en 29 países europeos en 2000-2007, la tasa relativa de supervivencia a los 5 años se ha incrementado en Europa a lo largo del tiempo, presenta una media del 81,8% (76-86%), alcanza su pico máximo en el grupo de 45-54 años de edad y disminuye progresivamente a partir de esa edad10.
Tasas de mortalidad por cáncer de mama ajustadas por edad en países con cribado mamográfico. (Adaptada del original de la IARC9).
Sin embargo, el cáncer de mama es la principal causa de muerte en las mujeres de 35-54 años de edad. En 2012 dio lugar a 521.907 muertes en el mundo y 131.347 en Europa7. En España, donde los tumores son la segunda causa de muerte tras las enfermedades del sistema circulatorio, es la primera causa de mortalidad por cáncer en la mujer y la tercera en general, por detrás del carcinoma de pulmón y el cáncer colorrectal. En el año 2014 murieron 6231 mujeres españolas por cáncer de mama11, lo que supone un descenso del 3,8% respecto a 2013. En el ámbito europeo, España tiene la tasa de mortalidad más baja y una supervivencia superior a la media.
Justificación de la tendencia históricaAlteración de los factores de riesgoAunque la mayoría de los cánceres de mama son esporádicos y no es posible su prevención, su creciente incidencia durante el siglo xx se ha relacionado con la alteración en sentido adverso de los factores de riesgo conocidos12, como la exposición prolongada de la mujer a los estrógenos endógenos (menarquia precoz, menopausia tardía, nuliparidad o edad tardía del primer embarazo a término), el envejecimiento de la población, el sedentarismo, el consumo de alcohol, la obesidad, la exposición a la radiación ionizante y la terapia hormonal sustitutiva, en especial la combinación de estrógenos y progestágenos13. El abandono de la terapia hormonal sustitutiva, poco empleada en España respecto a otros países europeos14, cuyo efecto como factor de riesgo aumenta con la duración del tratamiento y se considera extinguido por completo a los 5 años de cesarlo15, explicaría en parte el descenso de la incidencia.
Papel del cribado mamográficoLa implantación, en muchos países desarrollados, de programas de cribado desde finales de la década de 1980 contribuyó a incrementar de forma exponencial la incidencia de cáncer de mama en la población diana, no solo por la detección precoz en una fase preclínica de la enfermedad, sino también debido al diagnóstico de tumores de pequeño tamaño y biología indolente que, en ausencia de cribado, nunca hubieran sido diagnosticados clínicamente16, lo que se ha relacionado con el sobrediagnóstico. Años más tarde, un efecto de saturación del cribado habría participado inicialmente en la inversión de dicha tendencia.
Mucho más controvertido ha resultado tratar de definir con certeza el impacto del cribado mamográfico en la evolución de la mortalidad por cáncer de mama, a pesar de que, tras más de 20 años de funcionamiento de los primeros programas poblacionales, el descenso de las tasas de mortalidad concuerda con lo pronosticado en los metaanálisis de los ensayos aleatorizados controlados llevados a cabo en Europa y Norteamérica entre 1963 y 1982. A este respecto, la International Agency for Research on Cancer (IARC) comunicó en el año 2015 que, según la mejor evidencia disponible, el cribado con mamografía disminuye el riesgo de morir por cáncer de mama en un 23% en las mujeres de 50-69 años de edad invitadas al programa, y que ese porcentaje asciende al 40% en la población realmente participante17; asimismo, defiende su eficacia a los 40-49 años de edad, aunque de menor magnitud y apoyada en una evidencia limitada.
Sin embargo, para algunos autores, el efecto del cribado organizado con mamografía sobre la mortalidad es más modesto18, por dos motivos fundamentales: 1) si bien es cierto que el cribado ha elevado el número de cánceres de mama detectados en estadio precoz, la reducción de casos con metástasis a distancia ha sido muy pobre en determinadas áreas geográficas19,20; y 2) aunque el impacto de la detección precoz sobre la mortalidad por esta causa debería haberse manifestado 7-10 años después de la introducción de los programas de cribado, es decir, a principios del siglo XXI, en aquellos países que iniciaron esta práctica en primer lugar, el rápido incremento de la supervivencia a partir de 1990 sugiere que el uso periódico de la mamografía no ha sido el único elemento implicado en este cambio de tendencia16. Por tanto, afirman que el papel del cribado se ha sobreestimado, y que se desconoce con exactitud en qué grado han influido otros factores como la mejora de las terapias sistémicas, la detección precoz de tumores palpables (por la propia mujer o en una exploración clínica), el manejo protocolizado del cáncer de mama, los avances tecnológicos en mamografía, la estadificación más precisa o la mayor facilidad para acceder a las pruebas de diagnóstico y a los tratamientos.
Una cuestión relevante a favor del cribado mamográfico es que, con independencia de la edad de la mujer y de los rasgos biológicos intrínsecos del tumor, el estadio tumoral sigue teniendo en la actualidad un impacto significativo en la supervivencia global. Así lo evidencia el trabajo de Saadatmand et al.21, en el que tras evaluar pacientes con cáncer de mama diagnosticadas en Dinamarca en los periodos 1999-2005 y 2006-2012 se concluye que, en ambos grupos, la mortalidad aumentaba a medida que lo hacían la afectación axilar y el tamaño tumoral, a pesar del tratamiento quirúrgico apropiado y de que el uso de terapias sistémicas adyuvantes y neoadyuvantes fue más frecuente en 2006-2012. En consecuencia, un estadio precoz en el momento del diagnóstico del cáncer de mama permanece como un objetivo irrenunciable.
Tratamiento del cáncer de mamaLas terapias sistémicas han sido, junto con el cribado mamográfico, el otro factor clave implicado en el descenso de la mortalidad por cáncer de mama22. El beneficio sobre la mortalidad de la quimioterapia y la hormonoterapia adyuvante, en las pacientes sin metástasis a distancia, tiene un carácter persistente desde el comienzo del tratamiento y alcanza su mayor intensidad a los 5-15 años23. Puesto que su utilización se incrementó y se hizo sistemática en muchos países desarrollados a partir de la década de 198024, el descenso de la mortalidad observado en la primera mitad de los años 1990, previo al inicio de los programas poblacionales o durante su implantación gradual, se ha atribuido, por encima de todo, al efecto de la terapia adyuvante. En ese sentido, un metaanálisis de numerosos ensayos aleatorizados estableció que tales tratamientos, según los datos recopilados hasta el año 2000, reducen el riesgo de recidiva a los 5 años y la tasa anual de mortalidad por cáncer de mama a los 15 años; esta última en un 38% para las mujeres menores de 50 años y en un 20% para las de 50-69 años de edad23. Otro estudio señala, además, que la contribución relativa de dichos tratamientos en la mejora de la mortalidad es superior a la del cribado en los tumores con receptores hormonales positivos, mientras que, en ausencia de receptores hormonales, el beneficio de ambos elementos es semejante25.
Por otro lado, se han producido nuevos avances en este campo en los primeros años del siglo XXI, cuyo impacto sobre la mortalidad por cáncer de mama será visible en un futuro cercano, como la inclusión de la quimioterapia neoadyuvante en los protocolos de tratamiento, la creación de regímenes de quimioterapia más efectivos y el desarrollo de fármacos biológicos adyuvantes, entre ellos el trastuzumab, que mejora significativamente el intervalo libre de enfermedad y la supervivencia en las pacientes con receptores HER-2 positivos26.
Respecto al tratamiento quirúrgico, se han impuesto como técnicas de elección la cirugía conservadora de la mama frente a la mastectomía, seguida de radioterapia adyuvante, y la biopsia selectiva del ganglio centinela sobre el vaciamiento axilar, ya que presentan menor iatrogenia y tasas de supervivencia equivalentes27,28. De forma adicional, la introducción de técnicas de cirugía oncoplástica, en las que se combina la resección de un volumen de tejido mayor con unos mejores resultados cosméticos, ha ampliado las posibilidades de tratamiento quirúrgico con conservación de la mama. Sin embargo, a pesar de encontrarnos en la era de la detección precoz de tumores no palpables, en las dos últimas décadas se ha producido un aumento paradójico de la tasa de mastectomías unilaterales y bilaterales, más pronunciado en pacientes jóvenes candidatas a cirugía conservadora29, cuyo riesgo de desarrollar una neoplasia contralateral a lo largo de la vida es del 2-11%30. Así, el uso de la mastectomía contralateral profiláctica creció más del triple durante el periodo 2002-2012 en las pacientes estadounidenses diagnosticadas de carcinoma de mama unilateral en estadio I-III, aunque dicha práctica asocia mayor morbilidad y no conllevó ningún beneficio sobre la supervivencia31. Con el fin de invertir esta tendencia, la American Society of Breast Surgeons ha elaborado recientemente un documento de consenso en el que recomienda aconsejar la cirugía conservadora siempre que sea posible, junto con neoadyuvancia sistémica o técnicas oncoplásticas si es necesario, y desaconseja la mastectomía contralateral profiláctica en las mujeres de riesgo medio que presentan cáncer de mama unilateral32.
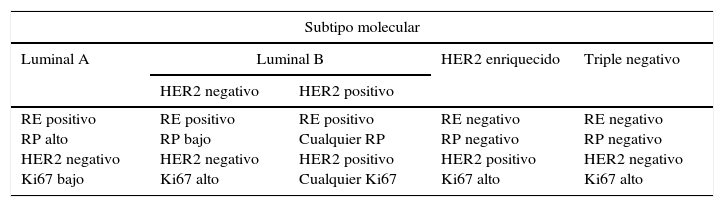
Clasificación molecular del cáncer de mamaPronóstico del cáncer de mamaCon la experiencia acumulada a lo largo de los años se ha evidenciado que no todos los cánceres de mama tienen un comportamiento biológico similar, ya que las pacientes tienden a presentar respuestas diversas frente a los tratamientos y resultados clínicos variables, a pesar de ser diagnosticadas en idéntico estadio tumoral. A comienzos del siglo XXI, las novedosas técnicas de genómica disponibles han confirmado que existe una asociación entre la evolución natural del cáncer de mama en cada mujer y el perfil de expresión genética del tumor33,34. A raíz de ello, se ha establecido una nueva clasificación molecular en subtipos que es más eficaz que los criterios anatómicos (sistema TNM) para fijar el pronóstico y planificar el tratamiento de forma individualizada35. En la práctica, los datos necesarios para identificar el subtipo molecular se obtienen antes de la cirugía, mediante el análisis inmunohistoquímico de la muestra histológica obtenida en la biopsia percutánea36 (tabla 1).
Clasificación molecular del cáncer de mama por inmunohistoquímica
| Subtipo molecular | ||||
|---|---|---|---|---|
| Luminal A | Luminal B | HER2 enriquecido | Triple negativo | |
| HER2 negativo | HER2 positivo | |||
| RE positivo RP alto HER2 negativo Ki67 bajo | RE positivo RP bajo HER2 negativo Ki67 alto | RE positivo Cualquier RP HER2 positivo Cualquier Ki67 | RE negativo RP negativo HER2 positivo Ki67 alto | RE negativo RP negativo HER2 negativo Ki67 alto |
HER2: receptor 2 de factor de crecimiento epidérmico humano; Ki67: valor más habitual del índice proliferativo Ki-67; RE: receptores de estrógenos; RP: receptores de progesterona.
Asimismo, la determinación del genotipo tumoral resulta de gran utilidad en las pacientes con cáncer de mama infiltrante en estadio precoz. Proporciona información sobre la probabilidad de recidiva y, por tanto, sobre la conveniencia o no de recibir quimioterapia adyuvante. Para llevar a cabo este procedimiento, que se incluye entre las recomendaciones de las guías oncológicas más influyentes37, existen distintas pruebas genómicas, como Oncotype DX® Recurrence Score®, Mammaprint®, Endopredict® y Prosigna®, que analizan grupos de genes y su actividad. Aunque inicialmente había que aportar muestras quirúrgicas frescas del tumor para su estudio, hoy es posible conocer el perfil genético del cáncer de mama con la muestra de la biopsia percutánea; esto ha sido corroborado por López Ruiz et al.38 para la plataforma Mammaprint®, con la que tuvieron una tasa de éxito del 84,62% en las masas visibles en la ecografía, empleando bloques de parafina de la punción diagnóstica, tras obtener 3-4 muestras con agujas de calibre 12G.
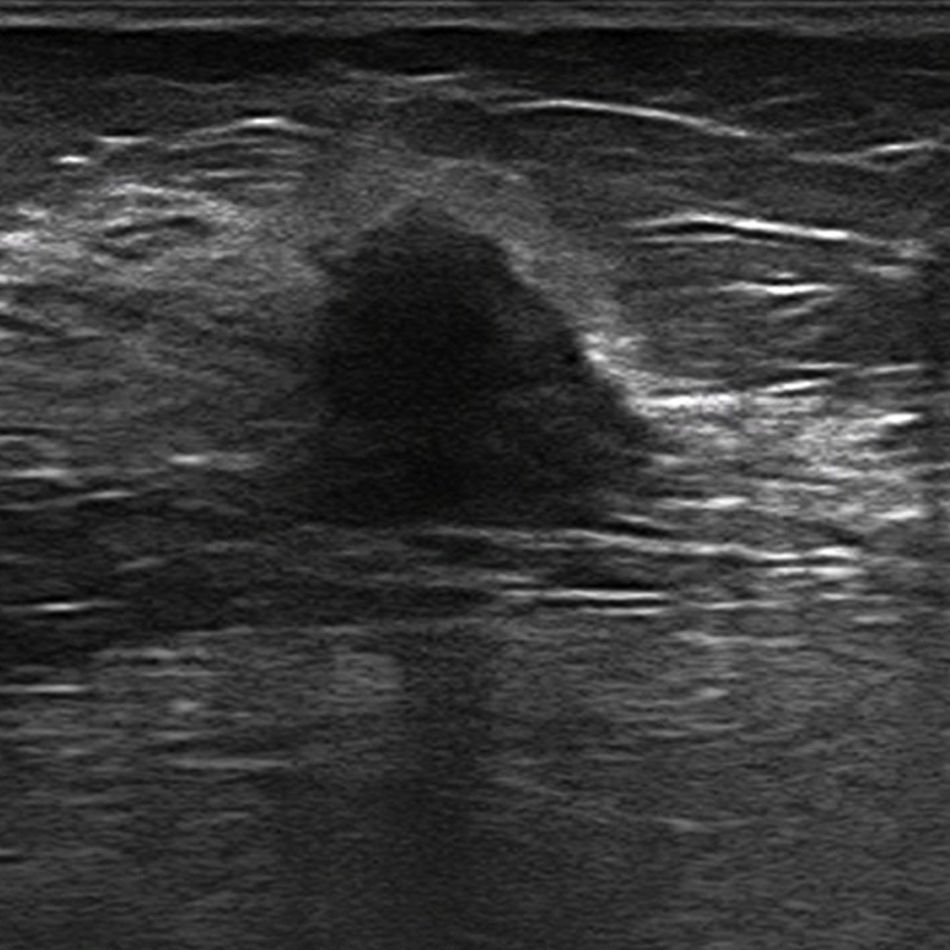
Subtipos moleculares: características biológicas y en la imagenLuminal ARepresenta más del 50% de los cánceres de mama39, suele ser de grado histológico bajo y su pronóstico es el más favorable de todos, con una supervivencia a los 5 años mayor del 80%35. El porcentaje de tumores multifocales y multicéntricos es del 30-44% y el 9-37%, respectivamente40,41. Las metástasis tienden a afectar al hueso42.
El hallazgo mamográfico más frecuente es el de una lesión tipo masa (45%); otros patrones menos habituales son las microcalcificaciones, con o sin componente sólido, y las asimetrías focales43. En la ecografía se observa, en la mayoría de los casos, como una lesión hipoecogénica irregular, de márgenes microlobulados o angulares, sin hallazgos acústicos posteriores y con una interfase abrupta43 (fig. 3). En la resonancia magnética (RM) normalmente se trata de una lesión de morfología irregular, aunque puede ser redondeada u ovalada, que presenta unos márgenes irregulares, hipointensidad o isointensidad en las secuencias potenciadas en T2, realce interno heterogéneo y un comportamiento dinámico en meseta o con lavado40,44.
Luminal BSu incidencia media es del 15%39. Inicialmente se describían tasas de supervivencia a los 5 años del 40%35. Sus rasgos en la imagen no difieren de los descritos para las neoplasias de tipo luminal A.
HER2 enriquecidoSupone el 15-30% del total45 y corresponde a tumores de grado histológico intermedio o alto, con tendencia a la multifocalidad44,46. Su supervivencia a los 5 años era del 31% antes de la introducción del trastuzumab35. Las metástasis tienen predilección por el hueso, el cerebro, el hígado y el pulmón.
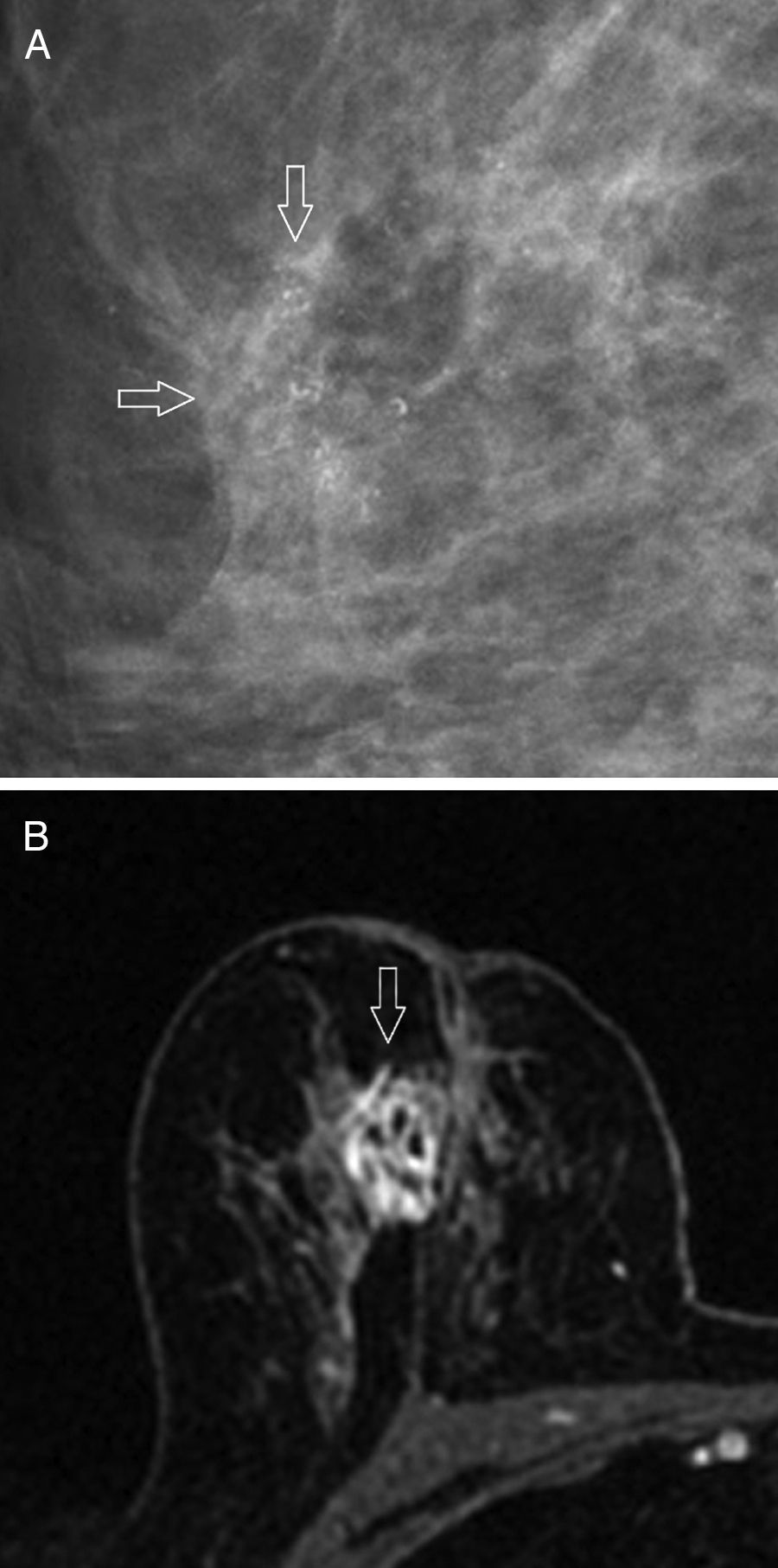
El hallazgo mamográfico más típico (61-80%) son las microcalcificaciones pleomórficas45 o lineales finas ramificadas46, que en la mayoría de los casos asocian una masa de márgenes espiculados43,45 (fig. 4 A). El aspecto habitual en la ecografía es el de una masa hipoecogénica irregular45, de márgenes microlobulados o angulares, con una interfase abrupta43 y refuerzo acústico posterior46; por otro lado, se manifiesta como una lesión sin masa ecográfica detectable con más frecuencia que el resto de los subtipos. En la RM suele observarse una masa de morfología irregular, con márgenes espiculados o irregulares, hipointensa o isointensa en T2, y con realce interno heterogéneo44 (fig. 4 B); en el estudio dinámico con contraste, destaca un realce inicial rápido con lavado posterior41,46.
Triple negativoRepresenta solo el 12-17% de los cánceres de mama47, pero a él se debe una alta proporción de las muertes por esta causa, debido a su agresividad48. Su incidencia es mayor en mujeres jóvenes, afroamericanas y portadoras de una mutación en el gen BRCA1. En general, son neoplasias unifocales49 que al diagnosticarse alcanzan un mayor tamaño, con metástasis axilares frecuentes, grado histológico alto y sin una relación directa entre el tamaño tumoral y la supervivencia50 o la probabilidad de infiltración axilar49. El riesgo de recidiva es mayor en los primeros 1-4 años de seguimiento, sobre todo en el pulmón y el cerebro47, si bien a partir de los 10 años disminuye a un nivel inferior al de las pacientes con tumores que expresan receptores de estrógenos51. A diferencia del resto, su sensibilidad a la quimioterapia neoadyuvante es mayor, y el pronóstico mejora tras una respuesta completa52. Muchos cánceres de intervalo corresponden a este subtipo53, la mayoría de los cuales se detectan clínicamente, lo que se ha relacionado con un crecimiento tumoral rápido y la alta densidad mamaria en la mamografía, más frecuente en edades jóvenes.
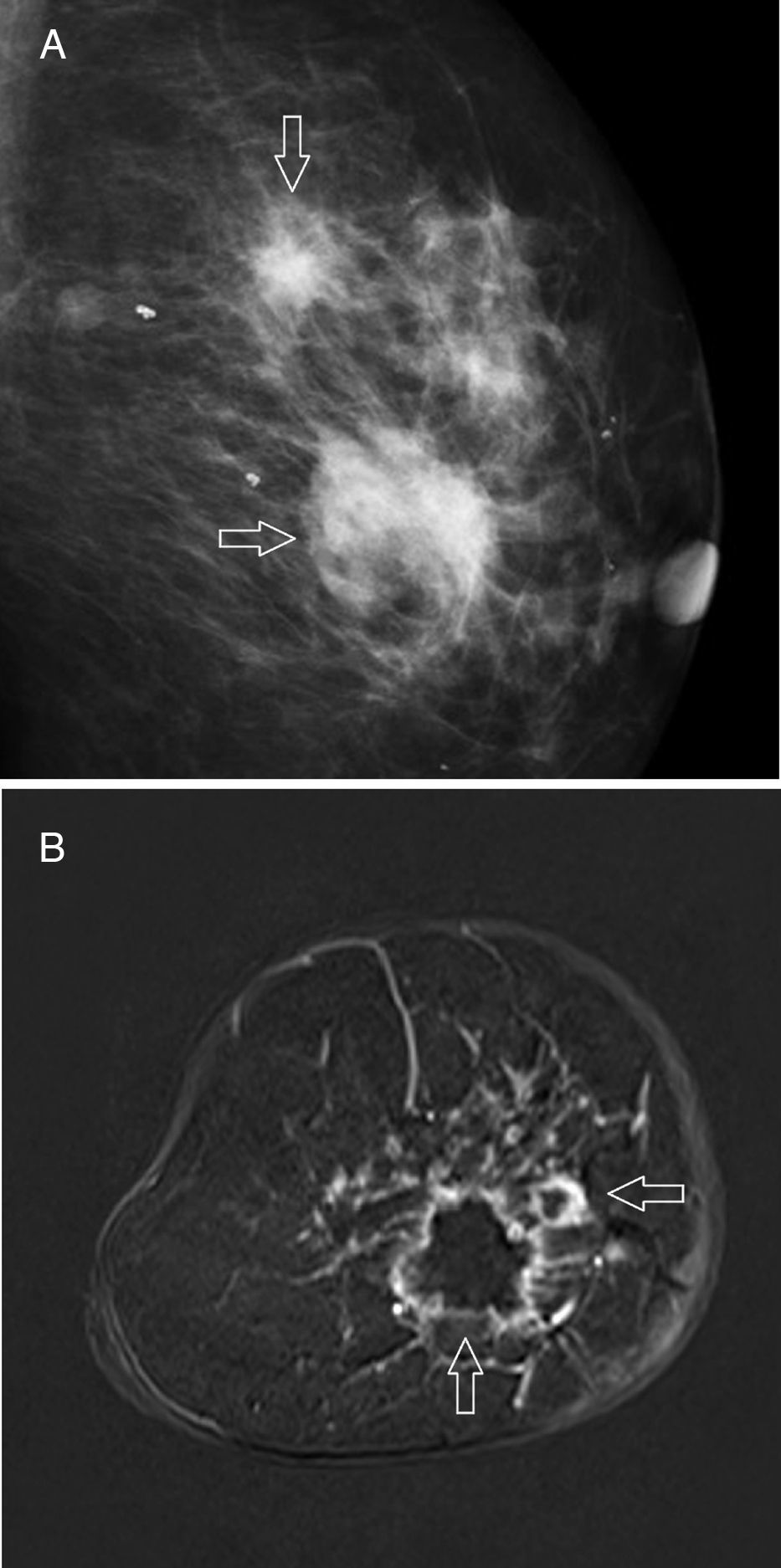
En la mamografía, el patrón más característico es una masa ovalada, lobulada o redondeada, de márgenes mal definidos y sin microcalcificaciones asociadas45,54 (fig. 5 A); con menor frecuencia tiene una forma irregular y márgenes espiculados53. Lo más habitual en la ecografía es una masa hipoecogénica e irregular de estructura heterogénea43; sin embargo, en un 15-20% de las pacientes su aspecto puede orientar inicialmente a benignidad55, ya que tiene una forma redondeada u ovalada, márgenes bien delimitados45,53 y refuerzo acústico posterior43. Los hallazgos más frecuentes en la RM40,41,44,55,56 son una masa redondeada u ovalada de márgenes bien definidos (39-71%), que muestra hiperintensidad intratumoral en las secuencias T2 debido a la existencia de necrosis intratumoral (46-66%), con un patrón de realce en anillo en el 46-80% de los casos (fig. 5 B), y que exhibe un comportamiento cinético en meseta o con lavado.
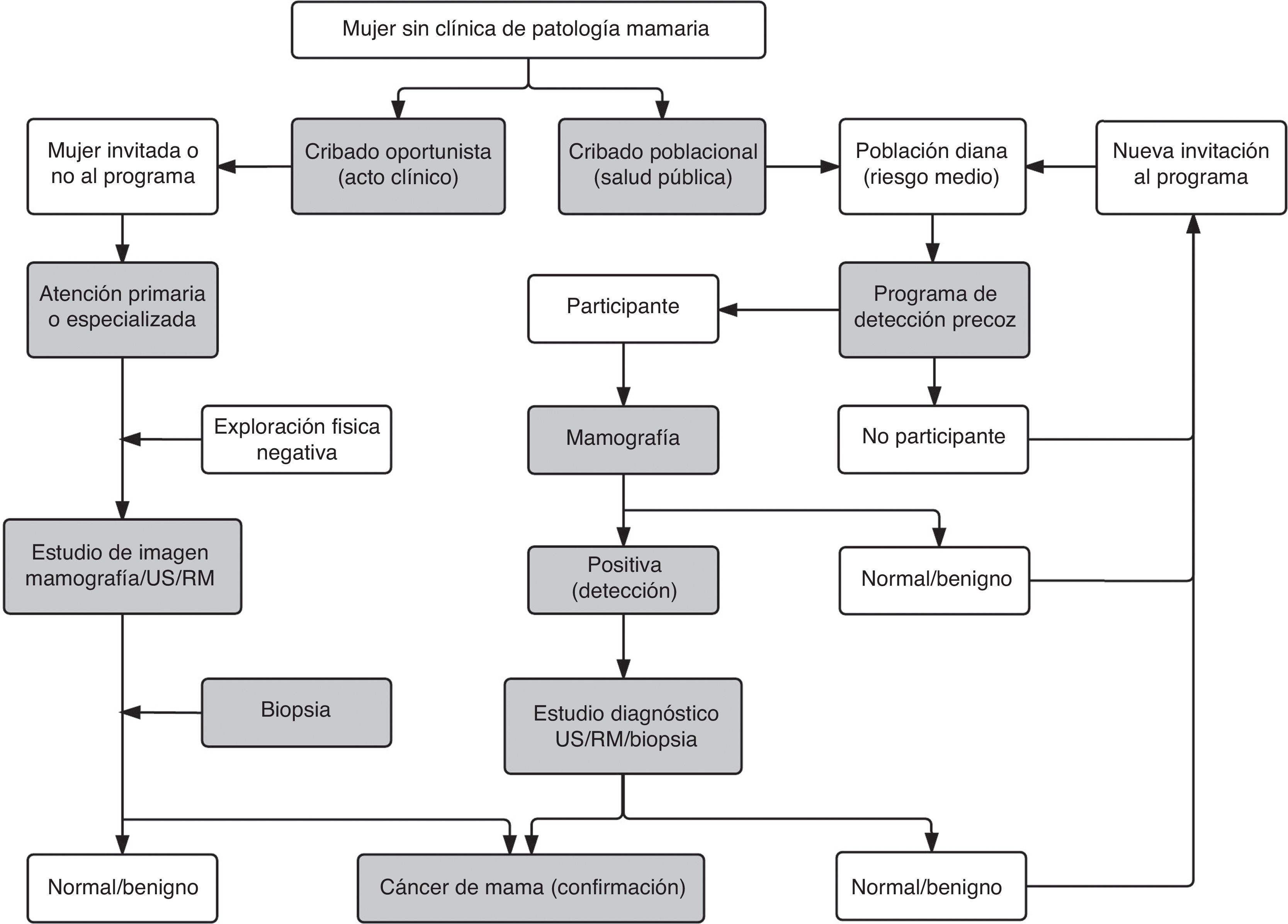
Cribado mamográfico del cáncer de mamaEstrategias de cribado: poblacional y oportunistaEl concepto de cribado comprende la aplicación de técnicas de selección a personas aparentemente sanas para detectar aquellas que pueden sufrir la enfermedad en una fase preclínica, y que precisarán pruebas complementarias para confirmar o descartar el diagnóstico57. Se distinguen dos estrategias de cribado del cáncer de mama: poblacional y oportunista. La tabla 2 recoge sus principales aspectos diferenciales, y las actividades que conforman sus respectivos procesos se muestran en la figura 6.
Principales características del cribado poblacional y del cribado oportunista del cáncer de mama
| Cribado poblacional | Cribado oportunista | |
|---|---|---|
| Contexto | Medida de salud pública | Acto clínico médico-paciente |
| Objetivo principal | Disminuir la mortalidad en la población | Mejorar el pronóstico individual |
| Diana | Grupo poblacional específico | Cualquier mujer |
| Nivel de riesgo de cáncer de mama | Mujeres de riesgo medio (<15%) | Cualquier nivel de riesgo |
| Antecedente de cáncer de mama | No | Indiferente |
| Prueba de cribado | Mamografía | No definido |
| Intervalo de cribado | Establecido | No definido |
| Forma de participación | Invitación activa | Pasiva |
| Control de calidad | Sí | No |
| Evaluación de resultados | Sí | No |
En la mayoría de los países europeos coexisten ambas modalidades. A diferencia del cribado poblacional, que ha sido objeto de innumerables estudios, el cribado oportunista se sustenta en una evidencia reducida. Concretamente, en Suiza se han realizado diversas investigaciones sobre el cribado oportunista con mamografía que han concluido que, aunque la efectividad de ambas estrategias es similar cuando se practican de manera simultánea en la misma región geográfica, los resultados no son tan favorables donde únicamente se dispone de cribado oportunista58. Así, en esta última circunstancia, Bordoni et al.59 observaron que no se cumplían los indicadores exigidos a los programas de cribado, como una proporción determinada de cánceres in situ y de cánceres invasivos ≤10mm de tamaño, sin metástasis axilares o en estadio ≥II. De Gelder et al.60 aportaron datos de que, en dicho país, cada año de vida ganado frente al cáncer de mama mediante cribado oportunista supone el doble de coste económico al comparar con el poblacional. En una comunidad autónoma española, un estudio demostró que en 2003-2006 el cribado oportunista supuso casi la mitad de la demanda en la unidad de mama donde se desarrollaba el cribado poblacional, un tercio de la actividad realizada y un alto coste respecto al anterior, pero solo detectó un 6,3% de los cánceres diagnosticados61. Vanier et al.62 comunicaron que, en las mujeres francesas de 50-74 años de edad pertenecientes a una región concreta, los cánceres de mama diagnosticados mediante cribado oportunista presentaban estadios más precoces que los detectados clínicamente. Por otra parte, se ha publicado que la sensibilidad de la mamografía es mayor cuando se realiza en un contexto de cribado poblacional63. Un hecho esencial a favor de los programas de cribado es que garantizan la igualdad de acceso a la mamografía, al tiempo que consiguen mayores tasas de participación, sobre todo entre las mujeres con menor nivel socioeconómico64,65.
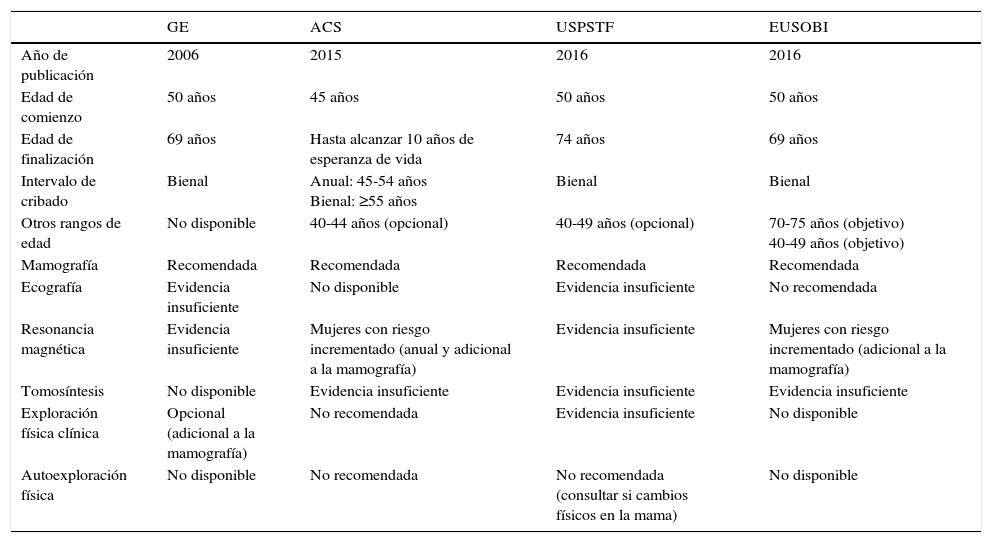
Programas de cribado: recomendaciones internacionalesA la cuarta edición de la Guía Europea de Garantía de Calidad en Cribado Mamográfico66, que fue publicada en el año 2006 y constituye la referencia para esta práctica en nuestro entorno, se han sumado recientemente las actualizaciones de las guías clínicas del U.S. Preventive Services Task Force67 y de la American Cancer Society68, y el documento de posicionamiento de la European Society of Breast Imaging69. Sus recomendaciones persiguen maximizar el beneficio del cribado, sobre todo en términos de reducción de la mortalidad y años de vida ganados, y minimizar al mismo tiempo sus riesgos y efectos adversos, entre los cuales destaca el sobrediagnóstico, que se ha estimado en un 6,5% de media (1-10%) en las mujeres europeas de 50-79 años de edad que participan en diez rondas70,71. Todos los documentos anteriormente citados coinciden en que la mamografía es la única modalidad de imagen recomendada en el cribado de las mujeres de riesgo medio, incluyen el rango de 50-69 años de edad en la población diana y desaconsejan la exploración física, ya sea realizada por personal sanitario o por la propia mujer (tabla 3). Por otro lado, difieren en la edad de inicio y finalización, así como en el intervalo de cribado, si bien la mayoría se decanta por el bienal. Aunque se considera que el pronóstico de una paciente diagnosticada de cáncer de mama en un programa poblacional es más favorable y sus probabilidades de morir por esta causa son un 50% menores respecto al diagnóstico de la misma en una fase clínica72, las mujeres invitadas al programa deben disponer de información suficiente para poder adoptar una decisión fundamentada sobre su participación.
Recomendaciones internacionales sobre el cribado poblacional del cáncer de mama
| GE | ACS | USPSTF | EUSOBI | |
|---|---|---|---|---|
| Año de publicación | 2006 | 2015 | 2016 | 2016 |
| Edad de comienzo | 50 años | 45 años | 50 años | 50 años |
| Edad de finalización | 69 años | Hasta alcanzar 10 años de esperanza de vida | 74 años | 69 años |
| Intervalo de cribado | Bienal | Anual: 45-54 años Bienal: ≥55 años | Bienal | Bienal |
| Otros rangos de edad | No disponible | 40-44 años (opcional) | 40-49 años (opcional) | 70-75 años (objetivo) 40-49 años (objetivo) |
| Mamografía | Recomendada | Recomendada | Recomendada | Recomendada |
| Ecografía | Evidencia insuficiente | No disponible | Evidencia insuficiente | No recomendada |
| Resonancia magnética | Evidencia insuficiente | Mujeres con riesgo incrementado (anual y adicional a la mamografía) | Evidencia insuficiente | Mujeres con riesgo incrementado (adicional a la mamografía) |
| Tomosíntesis | No disponible | Evidencia insuficiente | Evidencia insuficiente | Evidencia insuficiente |
| Exploración física clínica | Opcional (adicional a la mamografía) | No recomendada | Evidencia insuficiente | No disponible |
| Autoexploración física | No disponible | No recomendada | No recomendada (consultar si cambios físicos en la mama) | No disponible |
En el año 2013 se publicó la quinta edición de BI-RADS® (Breast Imaging Reporting And Data System)73, que ha estandarizado el lenguaje del informe radiológico y permite asignar una categoría de sospecha de carcinoma a un hallazgo, con una recomendación de actuación asociada. Para reducir la variabilidad intraobservador e interobservador, inherente a cualquier sistema que depende de la percepción individual74 y que provoca un solapamiento de las lesiones asignadas a cada categoría75, en la edición vigente se ha revisado el léxico específico de la mamografía, la ecografía y la RM, y se han incorporado un mayor número de recursos gráficos y dos apartados sobre seguimiento y monitorización de los resultados.
ConclusiónLa acción combinada de la detección precoz con mamografía y el empleo regular de terapias adyuvantes han sido determinantes en la evolución más favorable de la mortalidad por cáncer de mama en las últimas décadas. Se ha demostrado también que el pronóstico en cada mujer está íntimamente relacionado con el perfil genético del tumor y que, aunque los hallazgos en las pruebas de imagen son inespecíficos, hay casos en los que pueden identificarse rasgos característicos que orientan a un subtipo molecular concreto. En el futuro, se espera que nuevas evidencias hagan posible seguir progresando en el manejo de esta enfermedad.
Autoría- 1.
Responsable de la integridad del estudio: JAMB.
- 2.
Concepción del estudio: JAMB, MTT y LHRM.
- 3.
Diseño del estudio: JAMB y MTT.
- 4.
Obtención de los datos: no procede.
- 5.
Análisis e interpretación de los datos: no procede.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: JAMB.
- 8.
Redacción del trabajo: JAMB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MTT y LHRM.
- 10.
Aprobación de la versión final: todos los autores han leído y aprueban la versión final del artículo.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Javier Barbero Fernández, por su ayuda en la edición de las imágenes de este trabajo.