Congreso Nacional SERAM Málaga 2022: Informe radiológico: ¿qué y cómo?
Más datosLa RM es la técnica de imagen más precisa para valorar de manera no invasiva la respuesta a la terapia primaria sistémica. Su precisión diagnóstica mejora combinando información morfológica y funcional (curvas de relación de intensidad de señal/tiempo y difusión). El informe de RM de estadificación y de respuesta a neoadyuvancia debe incluir información clínica, anatomopatológica y radiológica para optimizar la interpretación de los hallazgos, la predicción de la respuesta y la planificación quirúrgica. Un informe estructurado de RM en contexto neoadyuvante permite utilizar un léxico común y comparar de forma conjunta los resultados entre los diferentes profesionales, abriendo un horizonte hacia la inteligencia artificial.
MRI is the most accurate imaging technique for the noninvasive assessment of the response to primary systemic therapy. Its diagnostic accuracy improves when morphological and functional (signal-intensity/time curves and diffusion) information are combined. The MRI reports for staging and for monitoring the response to neoadjuvant therapy must include information from clinical, histological, and radiological studies to optimize the interpretation of the findings, prediction of the response to treatment, and planning of the surgical intervention. In the context of neoadjuvant therapy, a structured MRI report makes it possible to use a common lexicon and to compare the results in conjunction with different professionals, opening a horizon toward artificial intelligence.
El desarrollo de la terapia primaria sistémica (TPS) ha conseguido grandes avances en el manejo del cáncer de mama (CM), ya que permite evaluar in vivo la quimiosensibilidad tumoral y aplicar esquemas terapéuticos más eficaces e individualizados, considerando una respuesta completa patológica como marcador subrogado de supervivencia libre de enfermedad.
El examen clínico y las técnicas de imagen convencionales (mamografía y ecografía) son métodos reconocidos para cuantificar la respuesta tumoral. Sin embargo, la RM se perfila como la técnica de imagen más precisa para monitorizar la respuesta, debido a su alta resolución espacial y su capacidad para diferenciar entre fibrosis y tumor residual1.
Es importante que los radiólogos dedicados a la enfermedad mamaria utilicemos un informe estructurado en la RM, ya que nos va a facilitar una atención multidisciplinar e individualizada de cada paciente.
El informe estructurado no solo unifica la descripción de los hallazgos morfológicos y funcionales según el léxico ACR BI-RADS® 5.ª ed., sino que además nos abre el camino al empleo de la inteligencia artificial.
Informe estructuradoEl informe estructurado de la RM de estadificación y de respuesta a la neoadyuvancia debe recoger la información clínica, anatomopatológica y radiológica de forma sistemática para el manejo oncológico de las pacientes:
Se recomienda incluir los siguientes parámetros.
Datos clínicos- –
Antecedentes personales y familiares.
- –
Subtipo histológico.
- –
Perfil inmunohistoquímico (IHQ).
- –
Terapia recibida.
- a.
Los antecedentes personales y familiares de CM condicionan el riesgo individual de CM y, en función de estos, los radiólogos establecen las técnicas de imagen más adecuadas para el proceso de cribado y de diagnóstico de cada paciente.
- b.
El radiólogo necesita conocer el tipo histológico tumoral para optimizar la descripción de los hallazgos2. Cada subtipo asocia unas características radiológicas específicas, destaca el comportamiento de los tumores lobulillares, que suelen presentar realces tipo no masa, componente in situ y respuestas morfológicas tipo fragmentación, características radiológicas que difieren del carcinoma ductal infiltrante3.
- c.
El perfil IHQ tumoral determina el tratamiento de las pacientes. Es imprescindible que el radiólogo conozca el subtipo tumoral en la valoración de la respuesta radiológica. En casos de mala respuesta a la TPS, es recomendable revaluar el perfil IHQ debido a que la biopsia inicial representa solo parte de la heterogeneidad tumoral y se han descrito variaciones secundarias al tratamiento neoadyuvante. En los casos en los que se confirme variación inmunohistoquímica, la reorientación de la terapia puede mejorar la respuesta tumoral4,5.
El CM luminal constituye el subtipo de mejor pronóstico por sus características favorables: tamaño tumoral pequeño, diferenciación tumoral con bajo-moderado grado histológico, bajos índices de proliferación, ganglios axilares negativos y estadio precoz en el momento del diagnóstico. Los tumores luminales asocian una baja respuesta a la quimioterapia.
El subtipo luminal A presenta mayor supervivencia y menor riesgo de recaída respecto al luminal B6.
El subtipo HER2+dispone de terapias específicas dirigidas a receptores HER2 (anticuerpos monoclonales), por lo que presenta con frecuencia respuestas completas.
El subtipo triple negativo presenta un comportamiento agresivo que condiciona mal pronóstico; sin embargo, asocia elevadas tasas de respuestas completas por su alta sensibilidad a la quimioterapia7.
d. Terapia recibida: es importante reseñar los tratamientos previos recibidos (antecedentes quirúrgicos, radioterapia, tipo de TPS, etc.) para facilitar la interpretación de los hallazgos radiológicos.
RM de estadificaciónEn el informe radiológico por RM previo a iniciar la TPS se recomienda describir:
- –
Protocolo de adquisición de imagen por RM.
- –
Datos asociados al contraste por vía intravenosa (tipo de contraste, dosis y velocidad de inyección).
- –
Obtención de consentimiento informado.
- –
Parámetros radiológicos según categorización ACR BI-RADS® 5.ª ed. en RM.
- –
Categoría TNM basada en hallazgos radiológicos.
El protocolo básico de RM debe incluir las secuencias que permitan una correcta resolución temporal y espacial para valorar las características morfológicas y funcionales, y para calcular la diferencia de los volúmenes tumorales entre los estudios pre y post-TPS.
En la RM mamaria las pacientes se posicionan en decúbito prono para minimizar los artefactos respiratorios utilizando una antena de superficie específica. El protocolo estándar incluye:
- 1.
Secuencia potenciada en T2 con o sin supresión grasa pre contraste. La secuencia óptima es la fast spin-echo (FSE).
- 2.
Estudio dinámico DCE-RM (dynamic contrast-enhanced-RM): 3D eco de gradiente con supresión grasa:
- a.
Secuencia potenciada en T1 basal.
- b.
Seis secuencias tras administrar contraste, con una cadencia aproximada de minuto por secuencia: dosis de 0,1-0,2 mmol/kg de Gd-DTPA a través de una vía intravenosa, a una velocidad de 2,5-3ml/s, seguido de un bolo de suero salino de 20ml.
- 3.
Secuencia difusión-DWI (diffusion weighted imaging), que se puede obtener con diferentes valores de difusión b=500, 600 y 1.000.
Posteriormente, se realiza el posprocesado en la estación de trabajo, que incluye:
- 1.
Imágenes en sustracción: obtenidas restando las secuencias poscontraste de la secuencia sin contraste. Permite valorar únicamente los realces.
- 2.
Proyecciones de máxima intensidad (MIP).
- 3.
Reconstrucción multiplanar: importante para obtener imágenes tridimensionales siguiendo la arquitectura del lóbulo mamario.
- 4.
Curvas funcionales o de relación de intensidad de señal en el tiempo: aportan información cuantitativa (pico al flujo) y cualitativa de la variación en el tiempo de la intensidad de realce de las lesiones (curva ascendente, meseta o en lavado).
- 5.
Cálculo del coeficiente de difusión aparente (CDA) y del porcentaje de restricción a la difusión8.
Se valoran criterios morfológicos y funcionales de acuerdo con la clasificación BI-RADS® 5.ª ed. (https://www.acr.org/-/media/ACR/Files/RADS/BI-RADS/BIRADS-Reference Card.pdf).
RM posneoadyuvanciaEl empleo de la RM en la monitorización de la respuesta radiológica a la TPS está bien establecido y documentado, siendo superior a las técnicas de diagnóstico convencional. Dentro de las recomendaciones para el uso de RM mamaria de la Sociedad Europea de especialistas en CM (EUSOMA), la valoración de la respuesta a la TPS constituye una de las indicaciones más aceptadas, con un nivel de evidencia tipo 1 y un grado de recomendación A9,10.
Una valoración exacta de la respuesta al tratamiento neoadyuvante y de la extensión tumoral post-TPS es esencial para planificar el tratamiento más adecuado, aumentado el porcentaje de pacientes que pueden beneficiarse de una cirugía conservadora.
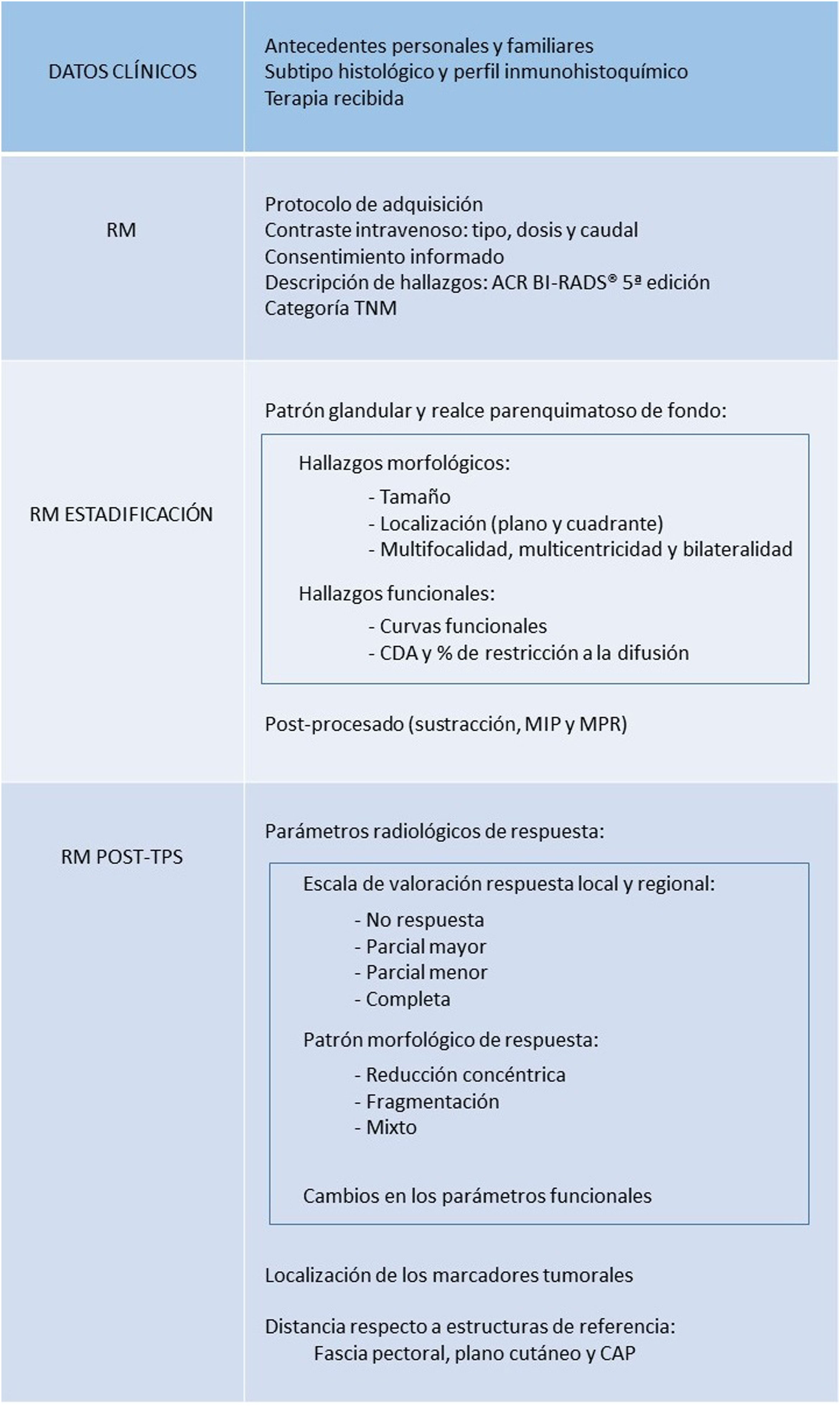
En el informe radiológico de la RM tras finalizar la TPS deben constar:
- 1.
Protocolo de adquisición de imagen por RM.
- 2.
Datos asociados al contraste por vía intravenosa (tipo de contraste, dosis y velocidad de inyección).
- 3.
Obtención de consentimiento informado.
- 4.
Parámetros radiológicos de respuesta en la RM:
- a.
Escala de valoración de la respuesta local y regional.
- b.
Patrón morfológico de respuesta.
- c.
Cambios en los parámetros dinámicos: curvas funcionales y CDA.
- d.
Localización de los marcadores tumorales.
Para valorar la respuesta radiológica a la TPS se calcula la diferencia del diámetro mayor tumoral en las imágenes 3D MIP del estudio pre-TPS realizado para la estadificación locorregional, con el estudio post-TPS realizado tras 10-15 días de haber finalizado la terapia sistémica. En el caso de tumores multifocales o multicéntricos, se consideran los cambios en el diámetro mayor tumoral de la lesión de mayor tamaño. El informe de la RM post-TPS debe incluir los diámetros tumorales en los 3ejes del espacio, la distancia de los focos tumorales adicionales respecto a la lesión principal y la distancia desde el tumor residual hasta las estructuras de referencia (complejo aréola-pezón, músculo pectoral y plano cutáneo).
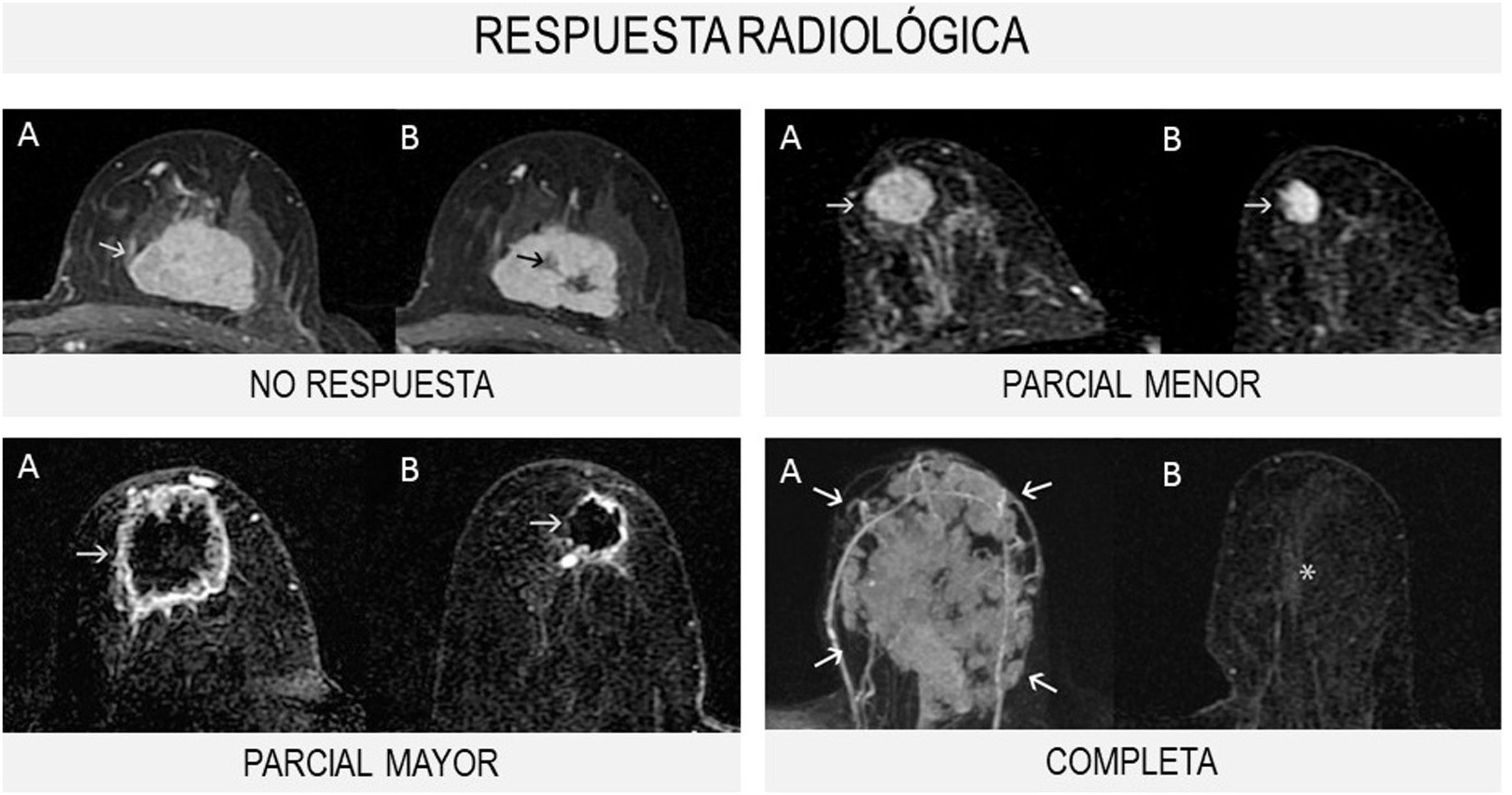
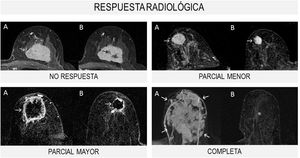
Se distinguen 4tipos de respuesta radiológica según la Unión Internacional de Control del Cáncer (UICC) (fig. 1):
- 1.
No respuesta: sin cambios en el tamaño tumoral.
- 2.
Respuesta parcial menor: el tamaño tumoral disminuye menos del 50% del diámetro mayor.
- 3.
Respuesta parcial mayor: el tamaño tumoral disminuye más del 50% del diámetro mayor.
- 4.
Respuesta completa: desaparición de las lesiones y ausencia de áreas de realce patológicas.
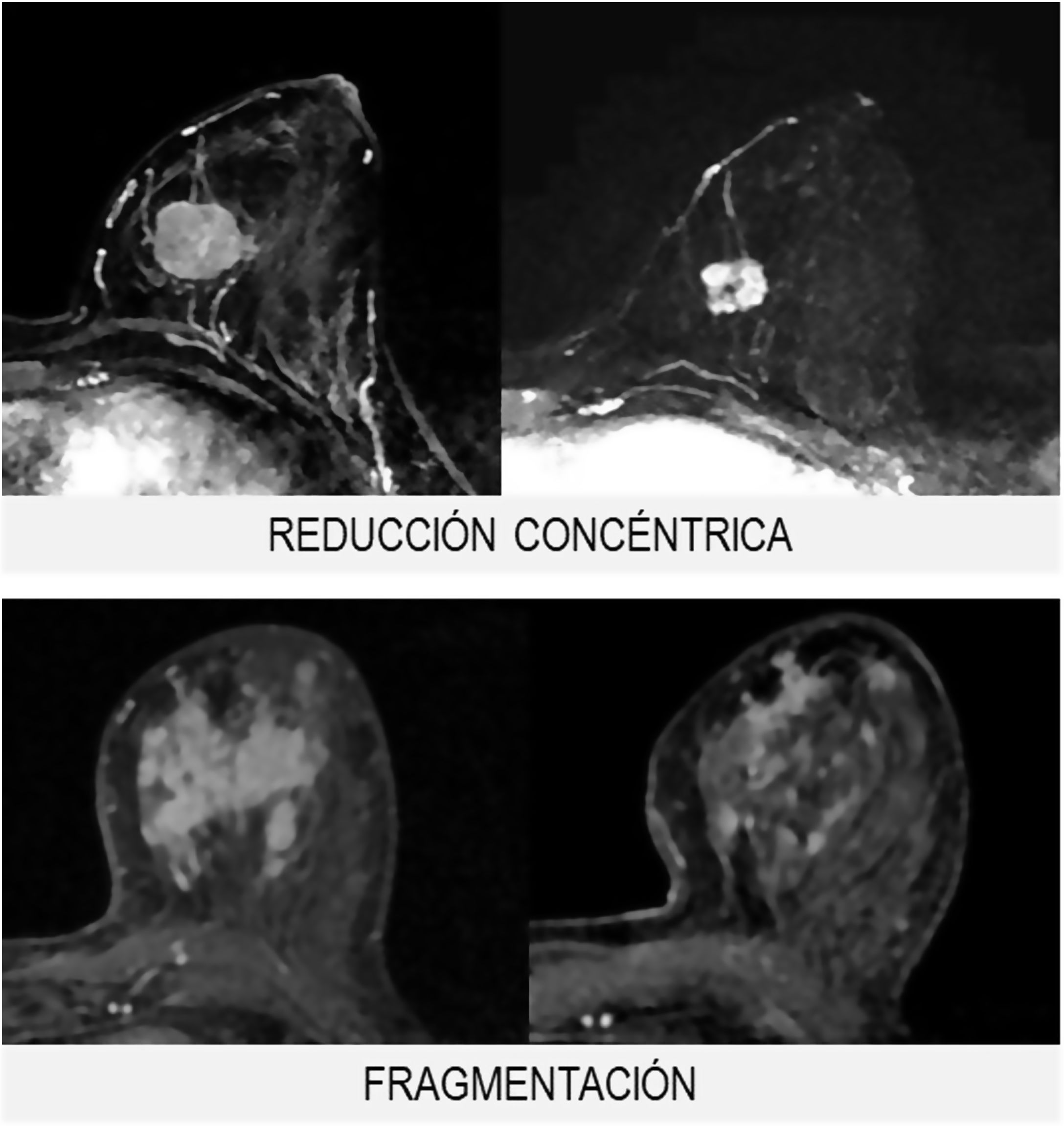
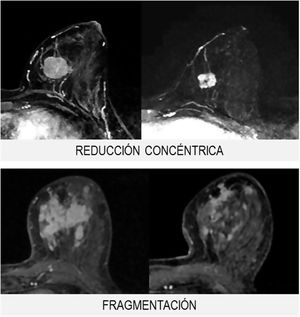
Morfológicamente, la respuesta se clasifica en 3grupos (fig. 2):
- 1.
Tipo reducción concéntrica: la disminución del tamaño tumoral es circunferencial (el tumor disminuye de la periferia hacia el centro).
- 2.
Tipo fragmentación: la tumoración presenta rotura o segmentación interna, sin variación del tamaño tumoral.
- 3.
Tipo mixto: se observan ambos patrones de respuesta.
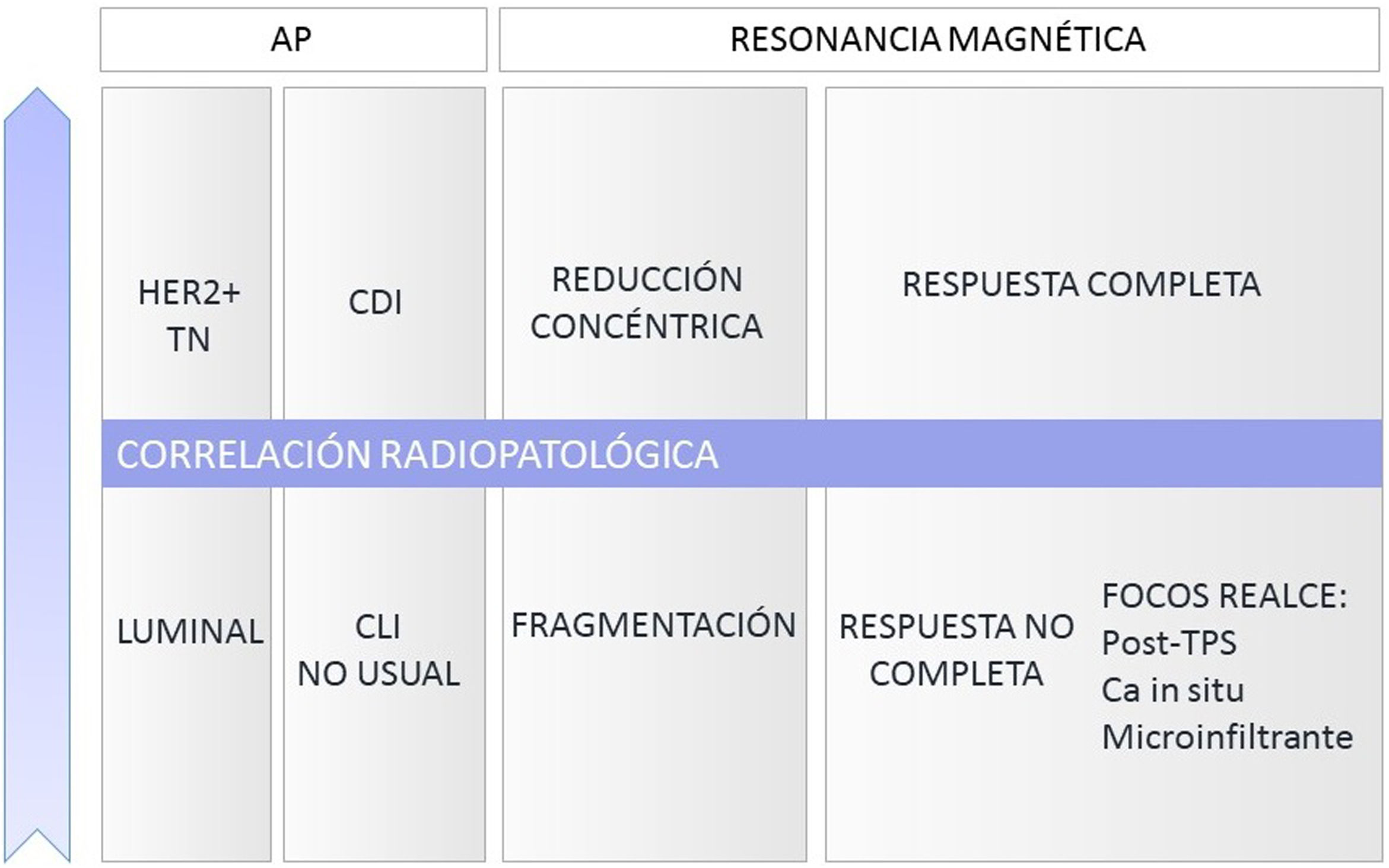
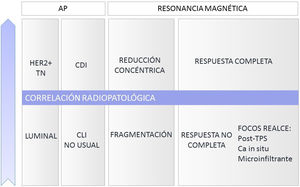
El tipo reducción concéntrica lo observamos con mayor frecuencia en los carcinomas de estirpe ductal, mientras que el tipo fragmentación en los de estirpe lobulillar.
La figura 3 muestra un esquema resumen con los parámetros que se recomienda incluir en el informe estructurado de RM pre y post-TPS.
En el contexto neoadyuvante es importante valorar las secuencias tardías poscontraste ya que la disminución de la celularidad invasiva, así como los cambios en la angiogénesis tumoral, pueden condicionar realces tenues en las secuencias dinámicas tardías. Es recomendable encontrar un equilibrio entre sensibilidad y especificidad puesto que las secuencias muy precoces pueden infraestimar la respuesta y las secuencias muy tardías la pueden sobrestimar. La ausencia de realce en fases tardías presenta alta correlación con respuesta patológica completa11.
La técnica de difusión en RM abre un horizonte en el estudio biológico y funcional del CM. Permite caracterizar y obtener información acerca de sus características histológicas (densidad celular, necrosis y mitosis). La secuencia de difusión es un método no invasivo de gran utilidad para monitorizar la respuesta a la TPS y para evaluar la masa tumoral residual de forma precoz sin administrar contraste por vía intravenosa.
El CDA permite cuantificar el grado de restricción a la difusión. Variaciones en el CDA ayudan a cuantificar la respuesta a la TPS por su efecto citolítico sobre las células tumorales, observando un aumento del CDA en los casos con buena respuesta. En casos de mala respuesta, la estabilidad del CDA constituye un parámetro adicional a favor de un cambio en la línea de tratamiento.
Diferentes estudios demuestran que los cambios funcionales preceden a los cambios morfológicos y sirven para predecir la respuesta al tratamiento. El aumento del CDA tras los primeros ciclos de TPS y los cambios en las curvas funcionales (retardo en alcanzar el pico al flujo y aplanamiento de la curva) constituyen factores pronósticos por asociar respuestas completas patológicas12.
La RM presenta una elevada precisión diagnóstica en la valoración de la respuesta tumoral a la TPS con una excelente correlación radiopatológica.
Sin embargo, presenta las siguientes limitaciones13,14:
Infraestimación de la respuestaLa presencia de componente intraductal y los cambios post-TPS estromales (fibrohialinosis) o epiteliales (ectasia y adenosis) pueden asociar un realce tardío tipo foco o tipo no masa en el lecho tumoral, que en el informe radiológico se describa como respuesta parcial mayor y en el informe de anatomía patológica sea una respuesta completa15,16.
El empleo de fármacos antiangiogénicos o de taxanos en neoadyuvancia puede condicionar una infraestimación de la respuesta al asociar una disminución del realce17.
Sobrestimación de la respuestaLa presencia de focos milimétricos de carcinoma invasivo y los carcinomas de estirpe lobulillar muy fragmentados o carcinomas de estirpe no usual, como los mucinosos (lagos de mucina con celularidad infiltrante), pueden no asociar realce en el lecho tumoral. En estos casos el radiólogo informaría la RM posneoadyuvancia de respuesta completa que no se correlacionaría con una respuesta completa patológica G5 de la escala de Miller y Payne (fig. 4).
La sobrestimación de la respuesta puede conllevar resecciones incompletas con márgenes quirúrgicos positivos y un aumento de la tasa de reintervenciones18.
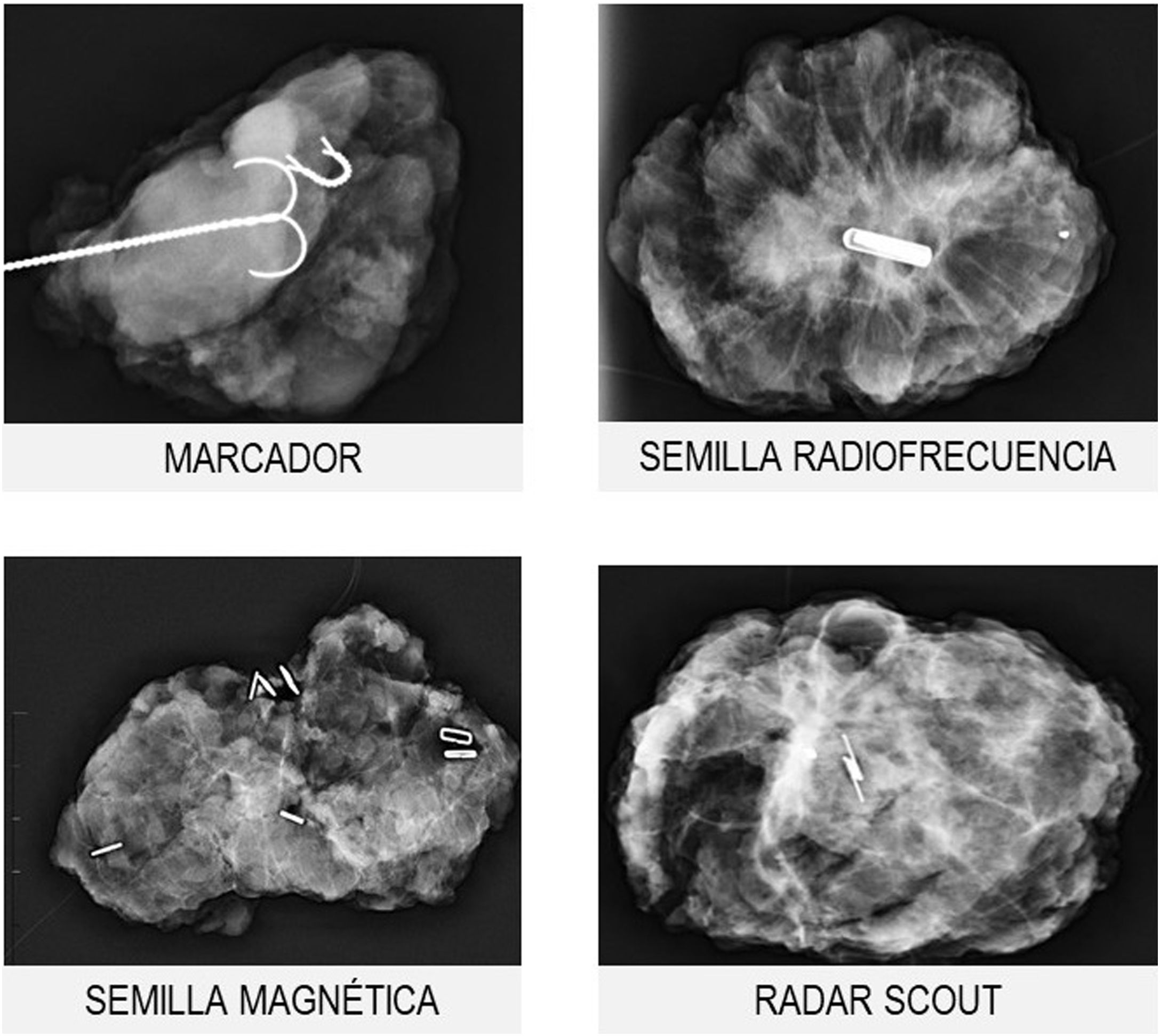
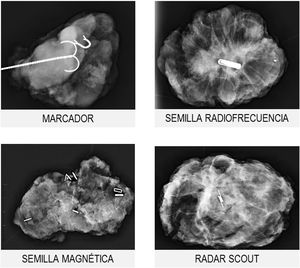
Marcadores metálicosLos marcadores metálicos constituyen el sistema de localización más conocido y generalizado; sin embargo, durante los últimos años han aparecido nuevos sistemas localizadores, como las semillas magnéticas, de radiofrecuencia o el radar scout19 (fig. 5).
Su uso es fundamental en el contexto del tratamiento neoadyuvante porque una buena respuesta a la TPS dificulta la identificación del tumor residual en el momento de la cirugía.
La colocación de los marcadores suele realizarse antes de iniciar el tratamiento neoadyuvante, con guía ecográfica o mediante estereotaxia (cuando no sea visible ecográficamente). El número de marcadores necesarios dependerá de la extensión de la lesión y de la presencia de multifocalidad o multicentricidad.
Los sistemas de localización permiten mejorar las tasas de cirugía conservadora con márgenes libres y los resultados estéticos. Además, el riesgo de recaída local disminuye cuando se realiza marcaje tumoral.
En el caso de los marcadores metálicos, tanto su localización prequirúrgica (mediante arpón) como la comprobación de su inclusión en la pieza se realizan en la sala de radiología mamaria. Para el resto de los sistemas, se utilizan sondas específicas en el propio quirófano ahorrando el paso de la paciente y de la pieza quirúrgica por el Servicio de Radiología, optimizando los tiempos quirúrgicos.
Comité de Patología MamariaLa existencia de un comité de Patología Mamaria permite un manejo individualizado de las pacientes y la toma de decisiones mediante consenso multidisciplinar. Las pacientes son evaluadas en 3 puntos del proceso:
- –
Inicialmente para planificación terapéutica atendiendo a la estadificación locorregional, estudio de extensión y perfil IHQ que determinará la línea del TPS.
- –
Tras finalizar la TPS se revalúa a las pacientes para valorar la respuesta tumoral y planificar la técnica quirúrgica.
- –
Finalmente, tras ser operadas y analizar la pieza quirúrgica en Anatomía Patológica, se revisa el caso para establecer la correlación radiopatológica, decidir el tratamiento adyuvante y el plan de seguimiento individualizado.
Múltiples estudios han demostrado una alta correlación radiopatológica de la RM en la valoración de la respuesta a la TPS, variable en función de parámetros radiológicos y anatomopatológicos (fig. 6).
La respuesta patológica completa ha demostrado asociar buenas tasas de supervivencia a largo plazo y fue aceptada en 2012 por la Food and Drug Administration como un referente válido para la aprobación acelerada de fármacos en neoadyuvancia.
Para medir la respuesta patológica debe utilizarse un sistema estandarizado que indique el tamaño tumoral residual y el porcentaje de celularidad tumoral invasiva en la pieza quirúrgica.
Existen múltiples clasificaciones publicadas, entre las que destacan el sistema de Miller y Payne (fig. 4) y el de la carga tumoral residual (residual breast cancer burden).
En la práctica clínica se utiliza con mayor frecuencia la escala Miller y Payne, que valora por separado la respuesta patológica local o glandular de la regional o ganglionar. A nivel local distingue 5 grados de respuesta en función de la reducción de la celularidad tumoral invasiva (fig. 4) y 4 grupos sobre el estado ganglionar20.
La clasificación del sistema de carga tumoral residual se desarrolló en 2007 por el MD Anderson Cancer Center (http://www3.mdanderson.org/app/medcalc/index.cfm?pagename=jsconvert3).
Valora de manera cuantitativa la respuesta mediante una fórmula disponible en la red, que mide de manera conjunta la carga tumoral residual local y ganglionar. Se obtiene un resultado numérico que se extrapola a una escala cualitativa de 4 categorías de respuesta.
ConclusionesLa RM es la técnica de imagen más precisa para valorar de manera no invasiva la respuesta a la TPS. Su precisión diagnóstica mejora combinando información morfológica y funcional (curvas de relación de intensidad de señal/tiempo y difusión).
El informe de la RM de estadificación y de respuesta a la neoadyuvancia debe incluir información clínica, anatomopatológica y radiológica para optimizar la interpretación de los hallazgos, la predicción de la respuesta y la planificación quirúrgica.
Un informe estructurado de la RM en el contexto neoadyuvante permite utilizar un léxico común y comparar de forma conjunta los resultados entre los diferentes profesionales, abriendo un horizonte hacia la inteligencia artificial.
FinanciaciónNo ha habido ningún apoyo financiero para este trabajo.
Autoría- 1.
Responsable de la integridad del estudio:
- 2.
Concepción del estudio: CGM, SCC, AIGB
- 3.
Diseño del estudio: CGM, SCC, AIGB
- 4.
Obtención de los datos:, SCC
- 5.
Análisis e interpretación de los datos:
- 6.
Tratamiento estadístico:
- 7.
Búsqueda bibliográfica: CGM, AIGB
- 8.
Redacción del trabajo: CGM, SCC
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CGM, AIGB
- 10.
Aprobación de la versión final: CGM, AIGB, SCC.
Los autores declaran no tener ningún conflicto de intereses.