Evaluar la modificación de los valores en la elastografía hepática tipo ARFI tras el tratamiento antiviral en pacientes con trasplante hepático e infección por el virus de la hepatitis C (VHC) con recidiva durante el postrasplante.
Material y métodosSe han estudiado 15 pacientes receptores de trasplante hepático con infección por el VHC y recidiva sobre el injerto durante el primer año tras el trasplante que fueron tratados con antivirales de acción directa. A todos ellos se les realizó ecografía basal, Doppler y elastografía hepática tipo ARFI en los 3 meses anteriores al inicio del tratamiento y durante los 3 meses posteriores a su finalización. En la misma semana de la elastografía se realizó analítica con perfil hepático y determinación de la carga viral (ARN-VHC) en sangre periférica mediante técnica de reacción en cadena de la polimerasa. Se ha estudiado el cambio en las velocidades de cizallamiento de la elastografía antes y después del tratamiento. El análisis estadístico se ha efectuado mediante el test de Wilcoxon para datos apareados.
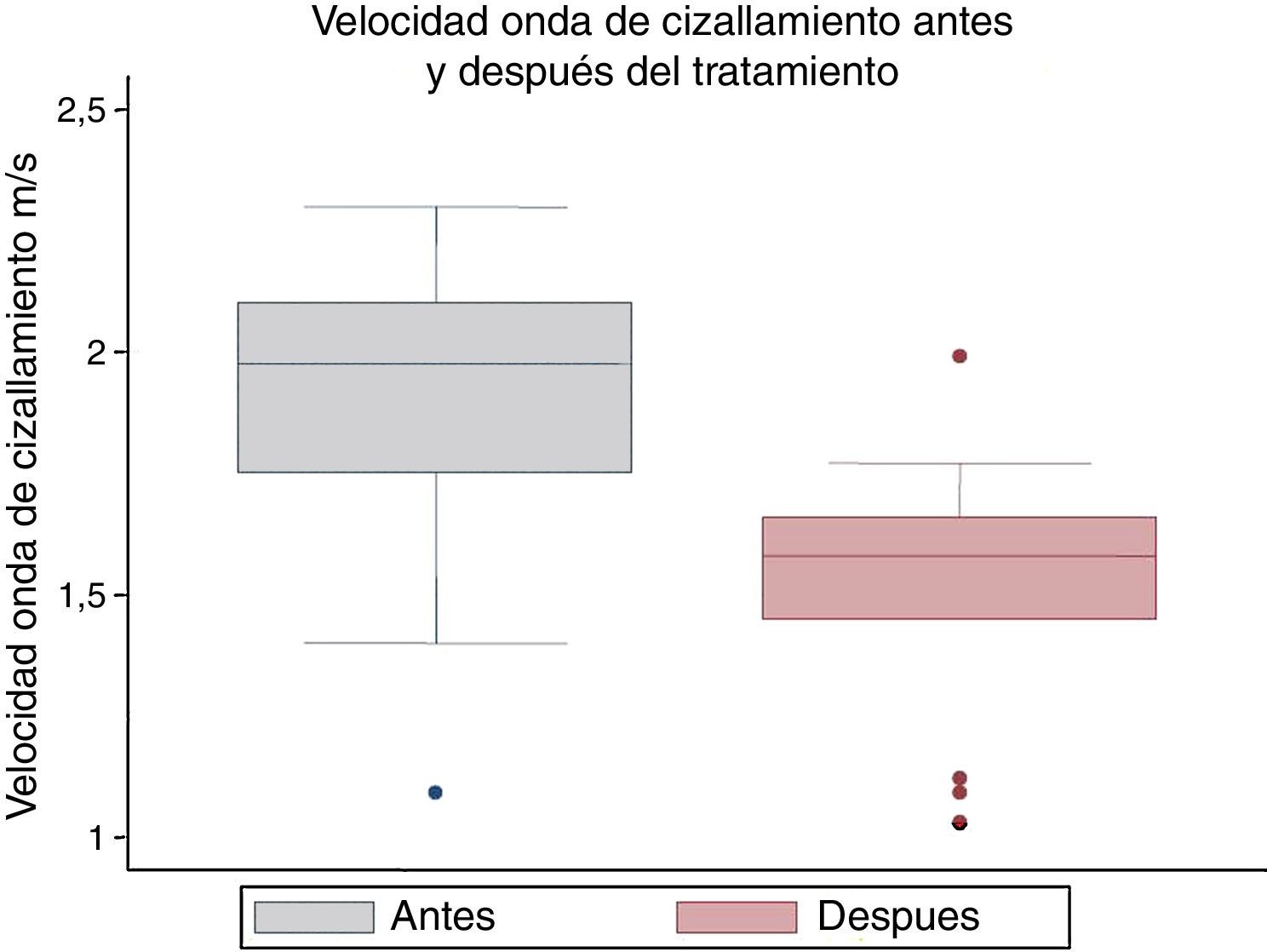
ResultadosTodos los pacientes alcanzaron una respuesta viral mantenida a los 3 meses de finalizar el tratamiento. Se han encontrado diferencias estadísticamente significativas en las velocidades de la elastografía, con disminución de estas tras finalizar el tratamiento (la mediana de los valores de la onda de cizallamiento previos al tratamiento fue de 1,97m/s, y tras finalizarlo fue de 1,58m/s; p=0,001).
ConclusiónLa velocidad de la onda de cizallamiento disminuye de manera significativa tras el tratamiento antiviral en los pacientes receptores de trasplante hepático con recidiva de la infección por VHC.
To evaluate the changes in the values obtained in acoustic radiation force impulse (ARFI) elastography of the liver after antiviral treatment in patients with liver transplants and hepatitis C virus (HVC) infection recurring after transplantation.
Material and methodsWe studied 15 patients infected with HVC who had received liver transplants where an HVC infection recurring in the graft within one year after the transplant was treated with direct-acting antivirals. All patients underwent ultrasonography including Doppler and ARFI elastography in the three months before starting treatment with direct-acting antivirals (baseline study) and again in the three months after finishing the treatment. In the same week when the elastography study was done, liver function tests were done and the viral load (HCV RNA) was determined in peripheral blood with the polymerase chain reaction method. We used the Wilcoxon test for paired samples to compare the changes in the shear wave velocities before and after treatment.
ResultsAll patients achieved a virologic response that was sustained at 3 months after the end of treatment. On elastography, median shear wave velocities decreased after treatment (1.97m/s before treatment vs. 1.58m/s after treatment; p=0.001).
ConclusionThe shear wave velocity decreased significantly after antiviral treatment in patients who had relapsed HVC infection after liver transplantation.
El trasplante hepático es el tratamiento de elección para la enfermedad crónica avanzada por el virus de la hepatitis C (VHC) con insuficiencia hepatocelular grave y para casos seleccionados de pacientes con hepatocarcinoma no subsidiarios de resección quirúrgica1; muchos de estos últimos son pacientes con VHC. Tras el trasplante hepático, la recidiva de la infección por VHC es la norma en los pacientes virémicos en el momento del trasplante2, lo que condiciona una disminución significativa en la supervivencia si son comparados con los receptores de trasplante hepático VHC negativo. De hecho, la recidiva por VHC sobre el injerto es la principal causa de pérdida de este en los pacientes a quienes se realiza un trasplante hepático por cirrosis debida al VHC3.
El diagnóstico definitivo de la recidiva de la hepatitis sobre el injerto se realiza mediante criterios histológicos, y su gravedad es variable.
Desde el punto de vista histológico existen dos patrones diferentes de recidiva del VHC sobre el injerto:
- •
Patrón de hepatitis crónica C, similar al observado en pacientes sin trasplante, pero con una progresión más acelerada de la fibrosis y con desarrollo de cirrosis mucho antes (a los 9-12 años), respecto a los pacientes inmunocompetentes (a los 20-50 años)4.
- •
Patrón de hepatitis colestásica fibrosante, poco frecuente (<10%), pero muy grave. Se caracteriza por ictericia intensa, colestasis bioquímica, valores muy altos de viremia y hallazgos histológicos específicos5.
Con independencia del tipo de recidiva, aproximadamente el 20-54% de los pacientes desarrollan cirrosis sobre el injerto a los 5 años postrasplante6,7. La evolución natural de la cirrosis es más agresiva que en los pacientes inmunocompetentes, con un primer episodio de descompensación tras una media de 8 meses desde el diagnóstico6.
Los eventos más importantes que influyen en la gravedad de la recidiva del VHC tienen lugar durante el primer año tras el trasplante, por lo que es fundamental identificar a los pacientes con fibrosis, inflamación significativa o hipertensión portal, ya que son estos los que presentan mayor probabilidad de descompensación o de pérdida del injerto8.
En la actualidad han surgido nuevos tratamientos antivirales de acción directa sobre la replicación viral de segunda generación, que incluyen inhibidores de la polimerasa NS5B (sofosbuvir)9, inhibidores de la proteasa de segunda generación (simeprevir)10 e inhibidores de la NS5A (daclatasvir y ledipasvir), que han modificado el panorama del tratamiento de los pacientes con VHC, incluso de aquellos con hepatitis colestásica fibrosante11, ya que se trata de fármacos más efectivos y mejor tolerados2,12, que logran una respuesta viral mantenida en el 90% de los casos13.
En los pacientes con trasplante hepático, la exploración ecográfica, tanto Doppler como basal, es fundamental porque se trata de la técnica de imagen de elección para realizar su seguimiento14.
En el caso de los pacientes con recidiva del VHC postrasplante, cuando se produce una elevación de las transaminasas hay que descartar diferentes complicaciones, como otras infecciones virales (en especial por citomegalovirus), presencia de rechazo y patología vascular o biliar. El estudio ecográfico basal y Doppler permite valorar las estructuras vasculares y biliares, y descartar sus complicaciones15. En la ecografía basal hepática se realiza el estudio morfológico, habitualmente mediante abordaje intercostal por la mala ventana acústica en relación con los cambios posquirúrgicos. Se valoran ambos lóbulos hepáticos, la vía biliar intrahepática y extrahepática, la presencia o no de colecciones posquirúrgicas y si hay hematoma en el lecho quirúrgico. En el estudio Doppler se demuestra la permeabilidad o no de la vena porta extrahepática e intrahepática (ramas derecha e izquierda), de las venas suprahepáticas, de la vena cava inferior y de la arteria hepática, tanto hiliar como intrahepática. Se realiza, además, un estudio Doppler pulsado para analizar la onda espectral, la velocidad y la dirección del flujo, y en el caso de la arteria, el índice de resistencia. También se explora la vena esplénica (permeabilidad y dirección de flujo). La exploración se completa con un estudio abdominal morfológico del páncreas, el bazo y ambos riñones, y se valora la presencia o no de líquido libre intraabdominal.
La elastografía hepática tipo ARFI (Acoustic Radiation Force Impulse) es una técnica ultrasonográfica que estima la rigidez del parénquima hepático mediante la medición de la velocidad de la onda de cizallamiento inducida tras la aplicación de un impulso acústico16. El transductor genera un tren de pulsos cortos de alta energía y baja frecuencia de repetición mediante fuerzas de transmisión acústica, que produce un desplazamiento longitudinal y genera ondas de cizallamiento (shear wave) que se propagan en el tejido de forma transversa, perpendicular al eje acústico. La velocidad de propagación de la onda de cizallamiento se expresa en metros por segundo (m/s)17. A mayor velocidad, mayor rigidez del tejido estudiado. La rigidez se relaciona con la fibrosis hepática, pero también aumenta en caso de congestión, colestasis o inflamación. Es una técnica validada para estimar el grado de fibrosis en pacientes con infección crónica por el VHC18, y se está demostrando su utilidad para medir el grado de fibrosis en pacientes con recidiva de la infección por VHC postrasplante19.
En la actualidad no se han publicado estudios que evalúen el cambio de las velocidades de la onda de cizallamiento en pacientes con trasplante hepático con recidiva por VHC que hayan recibido tratamiento con antivirales de acción directa. Nuestro objetivo es evaluar la modificación de los valores de la elastografía hepática tipo ARFI tras el tratamiento antiviral en pacientes con trasplante hepático e infección por el VHC con recidiva en el postrasplante.
Material y métodosPacientesEste es un estudio prospectivo longitudinal que se realizó desde septiembre de 2012 hasta febrero de 2016. El comité ético del hospital consideró que los planteamientos eran correctos y dio su aprobación para realizarlo.
Se ha estudiado una cohorte de 60 pacientes (45 varones y 15 mujeres) con edades comprendidas entre los 20 y los 67 años, durante el primer año tras ser sometidos a un trasplante ortotópico de cadáver.
De los 60 pacientes receptores de trasplante incluidos se han seleccionado los 15 con recidiva del VHC sobre el injerto (en ocho la indicación del trasplante fue la presencia de hepatocarcinoma y en siete fue hepatopatía evolucionada por VHC con insuficiencia hepatocelular grave) y que iniciaron tratamiento con antivirales de acción directa tras la recidiva.
Todos los pacientes fueron informados y firmaron el documento de consentimiento informado.
La recidiva de la infección por VHC postrasplante se definió mediante detección de viremia (ARN-VHC) en sangre periférica mediante técnica de reacción en cadena de la polimerasa. La recidiva de la enfermedad por VHC sobre el injerto se definió mediante criterios bioquímicos (elevación de las transaminasas, de la bilirrubina y de las enzimas de colestasis no atribuibles a otras causas) e histológicos en 11 de los 15 pacientes. Todos los pacientes fueron diagnosticados de recidiva por VHC durante el primer año después del trasplante y todos tenían recidiva por VHC en el momento en que se inició este estudio.
No se realizó biopsia en todos los pacientes, ya que al tratarse de una técnica no exenta de complicaciones, la tendencia en nuestro centro es intentar realizarla solo en casos imprescindibles. Aparte de las alteraciones analíticas descritas, se realizó una ecografía en la que se descartaban complicaciones vasculares, biliares y colecciones. Se descartaron también otras posibles infecciones y se comprobó que las concentraciones de inmunosupresores eran adecuadas. Se realizó un seguimiento estrecho tras el inicio del tratamiento antiviral y se comprobó una mejoría de los parámetros analíticos. En caso de no mejorar o empeorar, se planteaba el uso de otras pruebas diagnósticas, incluida la biopsia hepática.
Uno de los pacientes fue excluido del análisis porque durante el seguimiento presentó una complicación grave (síndrome de Budd-Chiari por trombosis de las venas suprahepáticas).
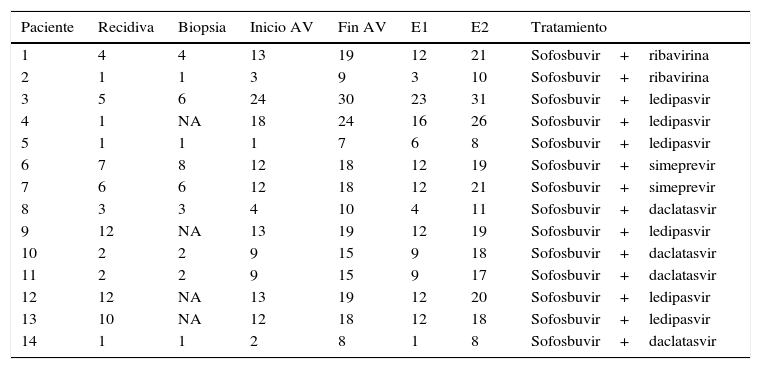
En la tabla 1 se muestra un cronograma en el que se indica cuándo se realizaron las exploraciones, las biopsias, las mediciones de elastografía, el tratamiento antiviral y el régimen terapéutico. En algunos pacientes hubo una demora de varios meses entre el diagnóstico y el inicio del tratamiento antiviral; la causa es que los nuevos antivirales no fueron autorizados hasta 2015, por lo que en los primeros pacientes del estudio se autorizaron como uso compasivo, proceso que requirió varios meses.
Cronología del estudio en meses con respecto a la fecha del trasplante (tiempo 0). Por ejemplo: el paciente 1 presentó recidiva a los 4 meses, se realizó biopsia a los 4 meses, inició tratamiento antiviral (AV) a los 13 meses y lo finalizó a los 19 meses; la elastografía pretratamiento (E1) se realizó a los 12 meses y la postratamiento (E2) a los 21 meses
| Paciente | Recidiva | Biopsia | Inicio AV | Fin AV | E1 | E2 | Tratamiento |
|---|---|---|---|---|---|---|---|
| 1 | 4 | 4 | 13 | 19 | 12 | 21 | Sofosbuvir+ribavirina |
| 2 | 1 | 1 | 3 | 9 | 3 | 10 | Sofosbuvir+ribavirina |
| 3 | 5 | 6 | 24 | 30 | 23 | 31 | Sofosbuvir+ledipasvir |
| 4 | 1 | NA | 18 | 24 | 16 | 26 | Sofosbuvir+ledipasvir |
| 5 | 1 | 1 | 1 | 7 | 6 | 8 | Sofosbuvir+ledipasvir |
| 6 | 7 | 8 | 12 | 18 | 12 | 19 | Sofosbuvir+simeprevir |
| 7 | 6 | 6 | 12 | 18 | 12 | 21 | Sofosbuvir+simeprevir |
| 8 | 3 | 3 | 4 | 10 | 4 | 11 | Sofosbuvir+daclatasvir |
| 9 | 12 | NA | 13 | 19 | 12 | 19 | Sofosbuvir+ledipasvir |
| 10 | 2 | 2 | 9 | 15 | 9 | 18 | Sofosbuvir+daclatasvir |
| 11 | 2 | 2 | 9 | 15 | 9 | 17 | Sofosbuvir+daclatasvir |
| 12 | 12 | NA | 13 | 19 | 12 | 20 | Sofosbuvir+ledipasvir |
| 13 | 10 | NA | 12 | 18 | 12 | 18 | Sofosbuvir+ledipasvir |
| 14 | 1 | 1 | 2 | 8 | 1 | 8 | Sofosbuvir+daclatasvir |
NA:
En nuestro hospital, por protocolo, tras el trasplante hepático se realizan exploraciones ecográficas con el siguiente cronograma: primeras 48 horas, 7 días, 1 mes, 3 meses, 6 meses, 9 meses y 12 meses. Aparte de este cronograma se realizan todas las exploraciones que se consideren necesarias en caso de presentarse complicaciones
A los 15 pacientes incluidos en el estudio se les realizó ecografía basal abdominal, Doppler de trasplante hepático y elastografía hepática cuantitativa tipo ARFI en los 3 meses anteriores a iniciar el tratamiento antiviral y en los 3 meses posteriores a su finalización. El régimen de tratamiento varió en función del genotipo del virus, y en todos los casos la duración del tratamiento fue de 24 semanas. En las mismas semanas en que se realizaron las exploraciones ecográficas se hizo una analítica completa con perfil hepático y determinación de la carga viral del VHC.
Se realizó biopsia a 11 de los 15 pacientes, y se recogieron los datos anatomopatológicos. Se empleó la clasificación METAVIR para valorar semicuantitativamente el grado de actividad necroinflamatoria y el grado de fibrosis. La actividad necroinflamatoria se clasificó en: A0, sin actividad necroinflamatoria; A1, escasa; A2, moderada; y A3, importante. La fibrosis se estratificó en una escala de 0 a 4: F0, sin fibrosis; F1, fibrosis portal sin septos; F2, fibrosis portal con algunos septos; F3, numerosos septos sin fibrosis; y F4, cirrosis. Se definió fibrosis significativa como un grado mayor o igual a F2.
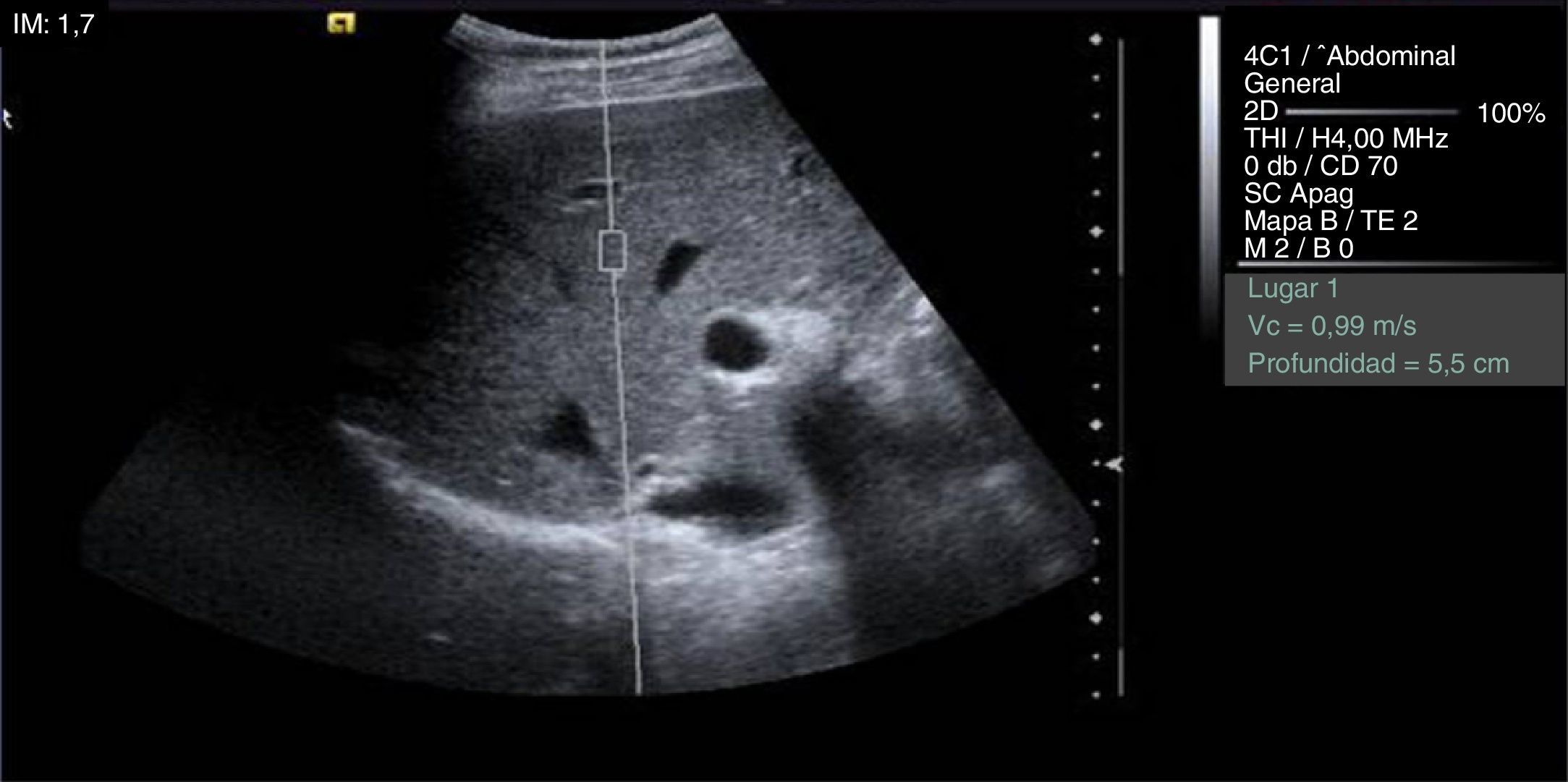
El estudio ecográfico y de elastografía se realizó con un ecógrafo Acuson S2000 (Siemens Medical Solutions Mountainview, California). Se empleó el transductor de 4MHz (4C1) y mediante el Software Virtual Touch Tissue Quantification (Siemens Medical Solutions) se midió la velocidad de las ondas de cizallamiento en diferentes regiones de interés (ROI) del lóbulo derecho hepático, habitualmente en los segmentos V y VIII, ya que son los más accesibles durante la exploración.
La exploración la realizaron siempre los mismos dos radiólogos con más de 8 años de experiencia en elastografía con técnica ARFI.
La técnica se realizó mediante abordaje intercostal, sin aplicar presión. La ROI se colocó a una profundidad mayor de 2cm desde la superficie hepática y menor de 8cm de la superficie cutánea (fig. 1). Se evitaron las estructuras biliares y vasculares que habrían alterado la medición. La exploración se realizó en ayunas de al menos 4 horas y en apnea sin inspiración máxima. Se realizaron 10 determinaciones en el lóbulo hepático derecho, y la salida de datos que proporciona el software del ecógrafo en forma de tabla para el análisis posterior es su media y su desviación estándar.
Análisis estadísticoLa descriptiva de la muestra se ha realizado mediante frecuencias absolutas y relativas en las variables categóricas, y con la mediana y los percentiles 25 y 75 en las numéricas. Para estimar diferencias entre los parámetros medidos antes y después del tratamiento se han realizado el test de Wilcoxon para datos apareados y la prueba t de Student apareada, después de comprobar mediante el test de Shapiro-Wilk el cumplimiento de la asunción de normalidad en los datos.
El nivel de significación se estableció en 0,05. El software empleado fue Stata/IC v 14.1 (StataCorp. 2015. Stata Statistical Software: Release 14. College Station, TX: StataCorp LP).
ResultadosDe los 14 pacientes seleccionados con recidiva del VHC postrasplante, todos tenían genotipo 1 (diez pacientes 1b y cuatro pacientes 1a). Diez pacientes eran varones y cuatro eran mujeres, con una edad media de 52,8 años (desviación estándar de 8,2 años; mínimo 36 años y máximo 65 años). Todos los pacientes alcanzaron respuesta viral al finalizar el tratamiento y respuesta viral mantenida a los 3 meses postratamiento.
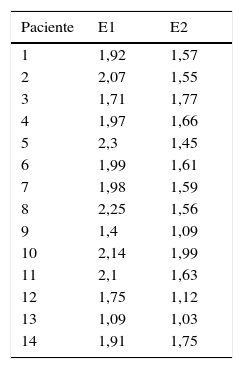
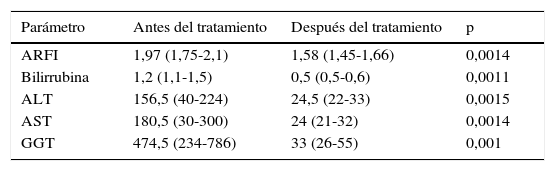
Los valores obtenidos en las dos determinaciones de elastografía realizadas a cada paciente se muestran en la tabla 2. Los valores de los parámetros medidos antes y después del tratamiento se muestran en la tabla 3. Tras evaluar la normalidad de las variables, no pudo establecerse el cumplimiento de la asunción y se realizaron pruebas no paramétricas. La mediana de los valores de la velocidad de cizallamiento previos al tratamiento antiviral fue de 1,97m/s (rango intercuartílico [RIC]: 1,75-2,1), y tras finalizar el tratamiento fue de 1,58m/s (RIC: 1,45-1,66), mostrando una diferencia estadísticamente significativa (fig. 2). El porcentaje promedio en la disminución de la velocidad fue del 19% (intervalo de confianza del 95%: 74-88%).
Velocidades (m/s) de la onda de cizallamiento en cada paciente antes (E1) y después (E2) del tratamiento antiviral
| Paciente | E1 | E2 |
|---|---|---|
| 1 | 1,92 | 1,57 |
| 2 | 2,07 | 1,55 |
| 3 | 1,71 | 1,77 |
| 4 | 1,97 | 1,66 |
| 5 | 2,3 | 1,45 |
| 6 | 1,99 | 1,61 |
| 7 | 1,98 | 1,59 |
| 8 | 2,25 | 1,56 |
| 9 | 1,4 | 1,09 |
| 10 | 2,14 | 1,99 |
| 11 | 2,1 | 1,63 |
| 12 | 1,75 | 1,12 |
| 13 | 1,09 | 1,03 |
| 14 | 1,91 | 1,75 |
Valores de los distintos parámetros estudiados, como mediana (P25-P75), de los pacientes con recidiva de la infección por virus de la hepatitis C antes y después de recibir tratamiento antiviral
| Parámetro | Antes del tratamiento | Después del tratamiento | p |
|---|---|---|---|
| ARFI | 1,97 (1,75-2,1) | 1,58 (1,45-1,66) | 0,0014 |
| Bilirrubina | 1,2 (1,1-1,5) | 0,5 (0,5-0,6) | 0,0011 |
| ALT | 156,5 (40-224) | 24,5 (22-33) | 0,0015 |
| AST | 180,5 (30-300) | 24 (21-32) | 0,0014 |
| GGT | 474,5 (234-786) | 33 (26-55) | 0,001 |
ALT: alanina aminotransferasa; ARFI: Acoustic Radiation Force Impulse; AST: aspartato aminotransferasa; GGT: gamma glutamil transpeptidasa.
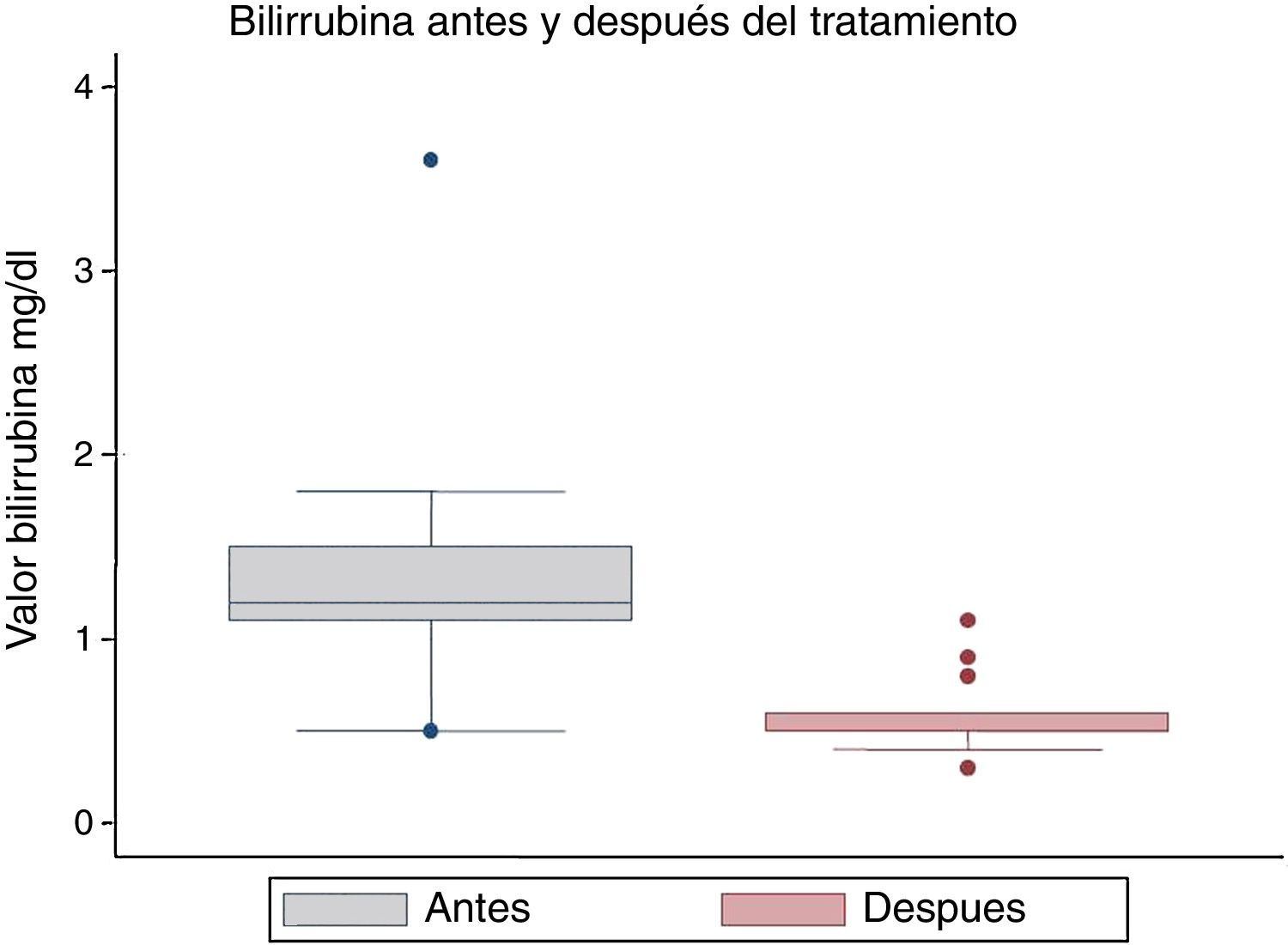
La mediana de los valores de la bilirrubina antes del tratamiento fue de 1,5mg/dl, y después fue de 0,5mg/dl, mostrando también una diferencia estadísticamente significativa (p=0,001) (fig. 3).
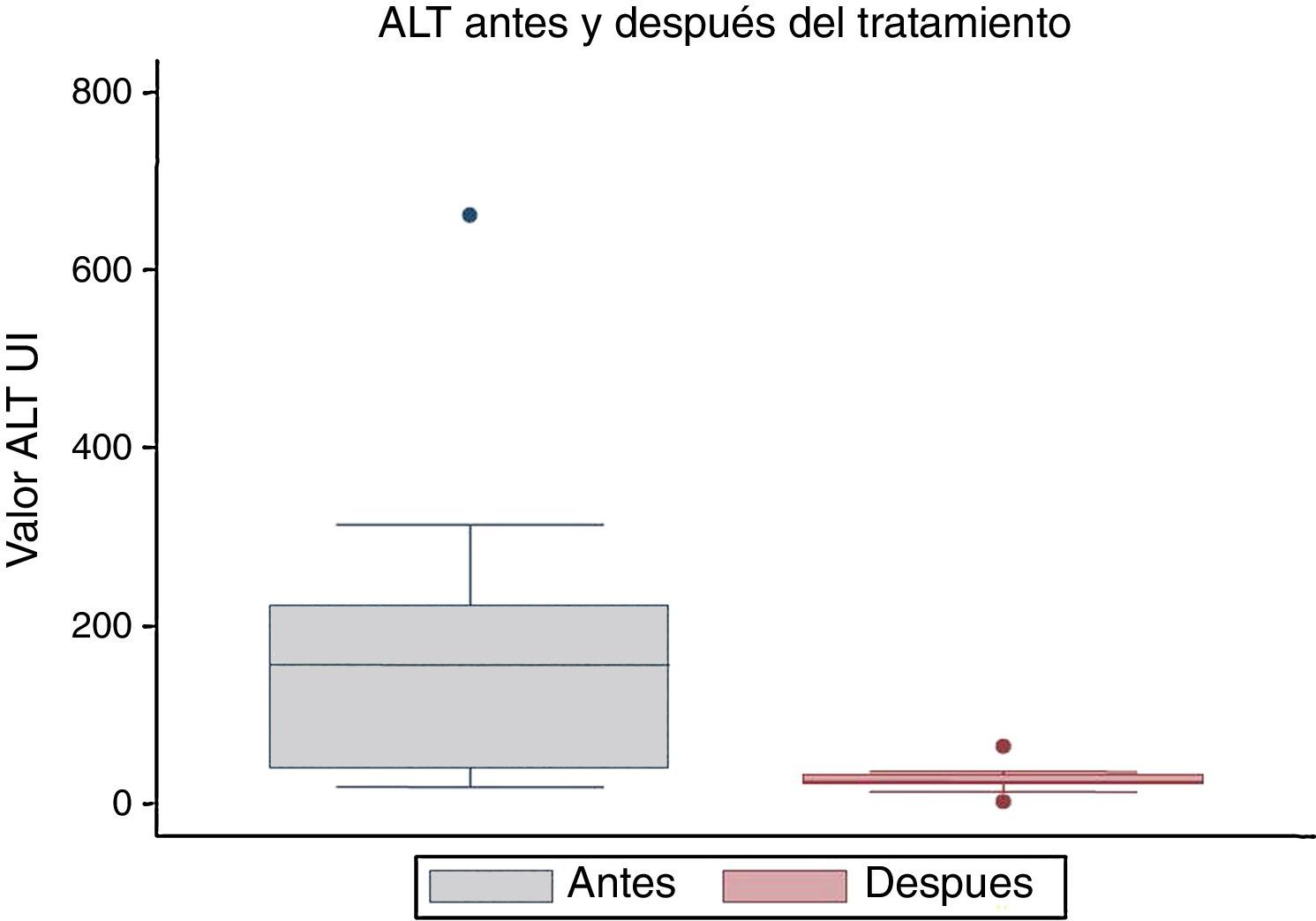
La mediana de los valores de la alanina aminotransferasa fue de 156,5 UI/l, y en la segunda determinación fue de 24,5 UI/l, con una diferencia estadísticamente significativa (p=0,001) (fig. 4).
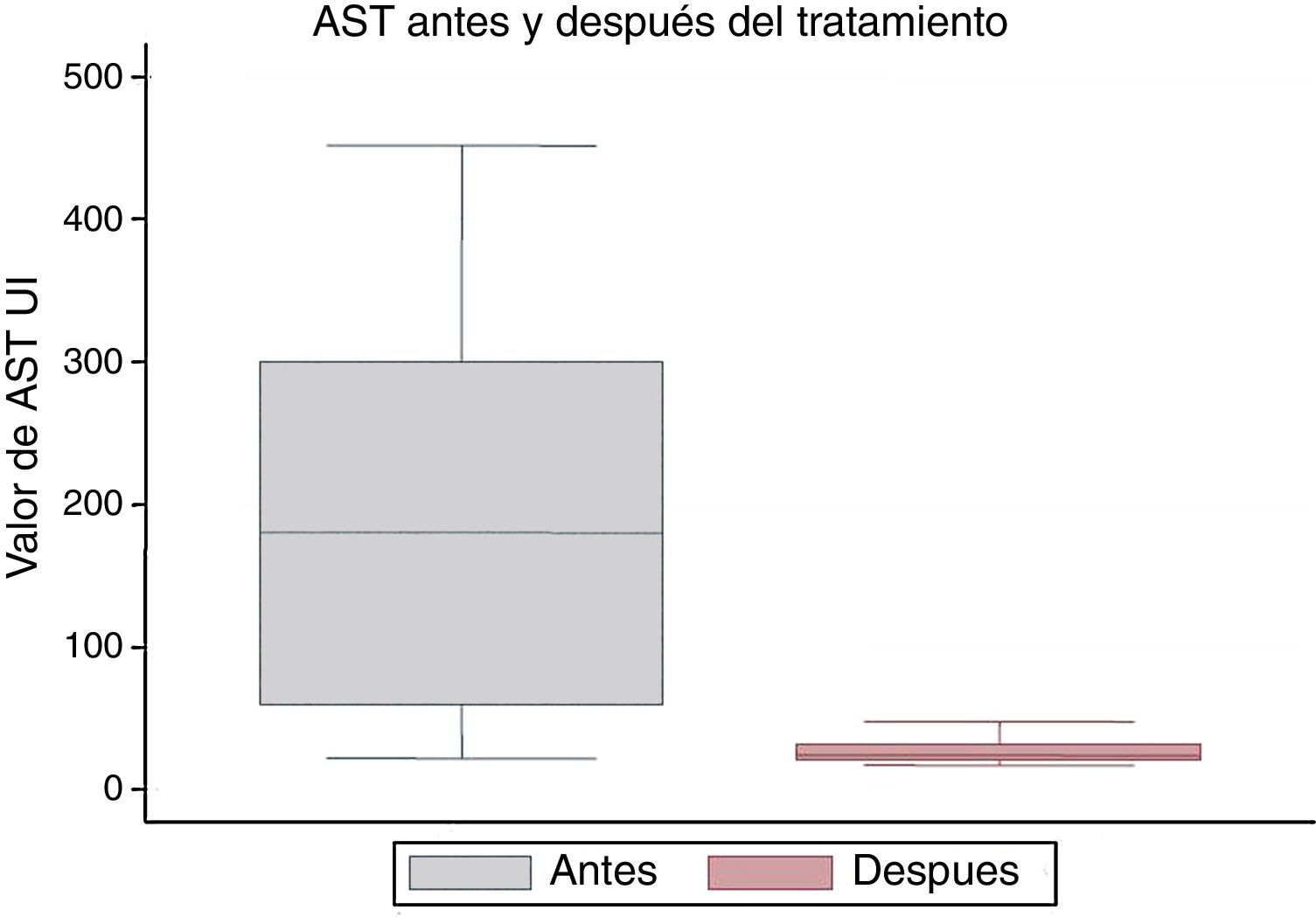
La mediana de los valores de la aspartato aminotransferasa inicial fue de 180 UI/l, y la posterior fue de 24 UI/l, con una diferencia estadísticamente significativa (p=0,001) (fig. 5).
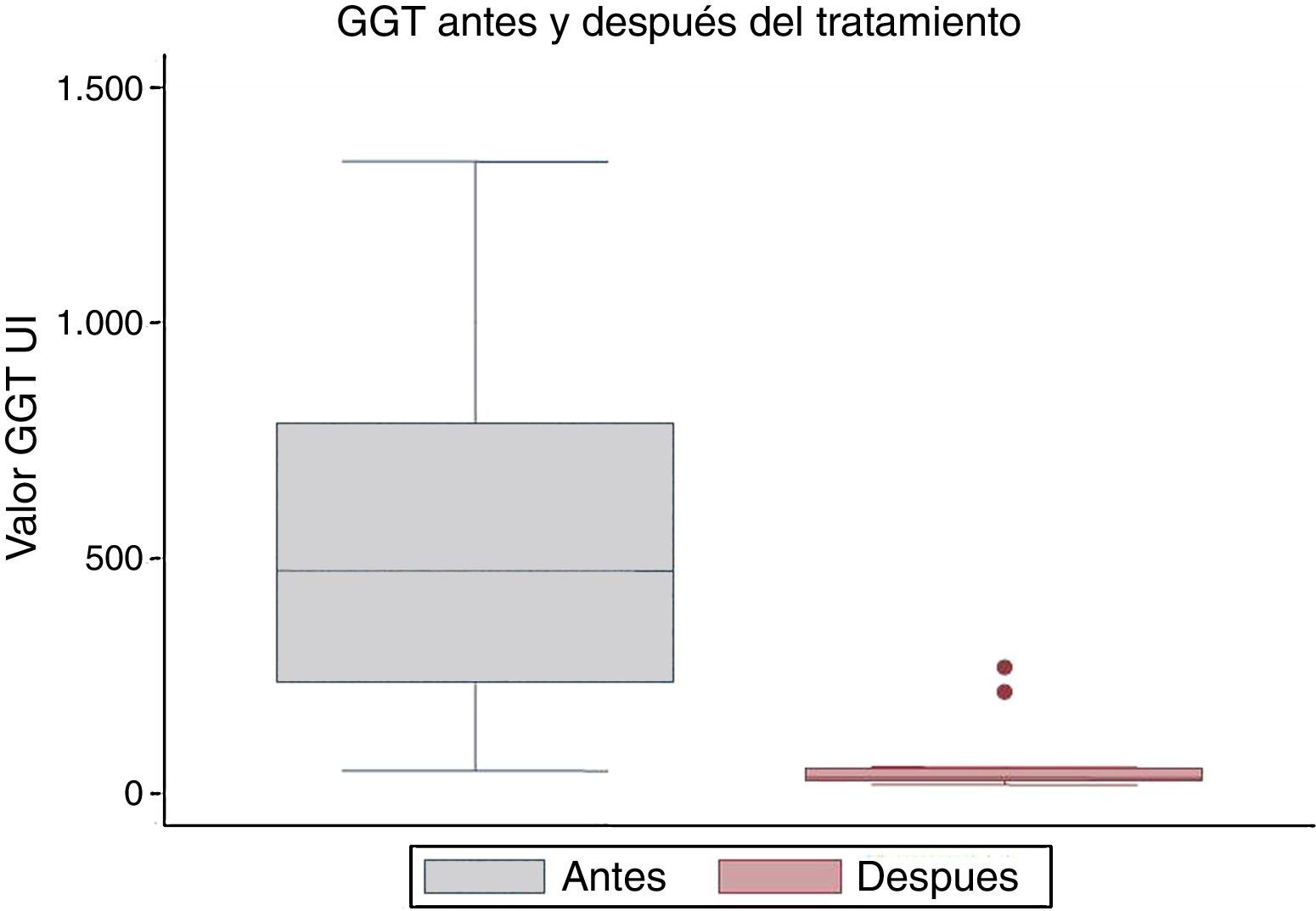
La mediana de los valores de la gamma glutamil transpeptidasa en la primera determinación fue de 474,5 UI/l, y posteriormente fue de 33 UI/L, con una diferencia estadísticamente significativa (p=0,001) (fig. 6).
Se realizó biopsia a 10 de los 14 pacientes. En dos casos se documentó hepatitis colestásica fibrosante, en siete pacientes se hallaron datos de hepatitis portal o lobulillar o ambas (A2, F0 en escala METAVIR), y tan solo en uno se evidenció, además de los signos de hepatitis, la presencia de una muy discreta fibrosis (A2, F1 escala METAVIR).
DiscusiónLa elastografía cuantitativa tipo ARFI es una técnica ya validada para el estudio y la gradación de la fibrosis en la hepatopatía crónica por VHC2. La novedad de nuestro estudio es que se trata de pacientes con recidiva del VHC sobre un injerto sano en los que se realiza un diagnóstico precoz.
La relación entre la elevación de las transaminasas y los valores de rigidez aumentados mediante elastografía ha sido publicada en la literatura20. De hecho, se considera un factor de confusión para estimar la fibrosis hepática mediante elastografía de transición (Fibroscan), y por ello se recomienda realizar Fibroscan para esta aplicación cuando los valores de las transaminasas se han normalizado. También se ha comunicado la relación entre la elevación de las transaminasas y la elevación de la velocidad de cizallamiento medida mediante técnica ARFI21.
En el seguimiento mediante elastografía del injerto hepático durante los primeros meses de la recidiva viral, el objetivo no es estimar el grado de fibrosis y, por ello, la elevación de las transaminasas en este caso no puede considerarse un factor de confusión. Es de suponer que, si se estudiaran a lo largo del tiempo pacientes receptores de trasplante con recidiva viral no tratada y se quisiera estimar la fibrosis hepática, la elevación de las transaminasas como traducción de inflamación asociada sí sería un factor de confusión para cualquier técnica elastográfica. Sin embargo, dada la reciente implantación de los nuevos fármacos antivirales, en nuestro medio resultará difícil estudiar esta cuestión, ya que la gran mayoría de los pacientes serán tratados.
Hasta la fecha no se ha publicado ningún estudio que determine la evolución de la velocidad de la onda de cizallamiento con el tratamiento con fármacos antivirales de acción directa en pacientes con trasplante hepático. Se han publicado algunos artículos que valoran la detección de fibrosis en pacientes con VHC y recidiva del mismo en el postrasplante mediante elastografía de transición, con buenos resultados18. También se ha publicado un estudio que compara la evolución de la rigidez hepática medida con elastografía de transición en pacientes receptores de trasplante hepáticos con recidiva por VHC tras tratamiento antiviral y sin él, evidenciando una disminución de los valores en los pacientes que recibieron tratamiento, pero se trata de un estudio con muy pocos pacientes y el tratamiento no fue con antivirales de acción directa3. La elastografía, tanto la de tipo ARFI como la de transición, ha mostrado valores más bajos en los pacientes tratados con antivirales y con respuesta viral mantenida22,23. Nuestros resultados son preliminares, ya que se basan en una muestra pequeña de pacientes; es necesario estudiar la evolución de la velocidad de cizallamiento en muestras más grandes.
En nuestra muestra fue significativo el descenso de la velocidad de cizallamiento en todos los pacientes tras el tratamiento, excepto en el paciente que desarrolló síndrome de Budd-Chiari y que, a pesar de negativizar el RNA del VHC, mantuvo unos valores de la velocidad de cizallamiento elevados. En la biopsia de este paciente se evidenciaron leves cambios fibroinflamatorios inespecíficos (F1 A1 escala METAVIR).
La velocidad de cizallamiento aumentada en la elastografía, al igual que los datos analíticos, no es específica de afectación hepática por recidiva viral, pero ofrece una información adicional con un fundamento distinto al de la analítica: un fundamento físico, más que funcional. La justificación del empleo de la elastografía en el manejo clínico de los pacientes receptores de trasplante con recidiva viral es disponer de una información adicional cuantitativa que puede servir como indicador de la afectación hepática. La medición de la velocidad de la onda de cizallamiento con la técnica ARFI es sencilla, reproducible y puede realizarse en las exploraciones ecográficas de control que se realizan por protocolo o ante alguna incidencia en el seguimiento habitual de estos pacientes, por lo que no complica ni añade pruebas o más visitas al hospital. Se trata de un dato a tener en cuenta como un parámetro más para ayudar al clínico a controlar la evolución, que puede alertar de alguna complicación que podría estar pasando desapercibida o apoyar la sospecha clínica para tomar decisiones e indicar otras pruebas más complejas o agresivas. Se han publicado estudios que plantean la utilidad de la elastografía en el seguimiento del trasplante hepático24,25.
Nuestro estudio está limitado por tener un número pequeño de pacientes y no disponer de biopsia de todos ellos, pero si se tienen en cuenta lo precoz de las alteraciones, su reversibilidad (tanto los valores analíticos como las velocidades en la elastografía) y los datos de las biopsias disponibles, puede deducirse que en el momento de las mediciones de la velocidad de la onda de cizallamiento lo que se está valorando se debe a inflamación y no a fibrosis.
En resumen, se trata de un estudio exploratorio en pacientes receptores de trasplante hepático con recidiva viral en el cual, a pesar de tener una muestra pequeña, se ha demostrado que el valor de la velocidad de la onda de cizallamiento disminuye significativamente tras el tratamiento antiviral. Esto sugiere que la elastografía cuantitativa tipo ARFI podría ser una herramienta útil en el seguimiento de la respuesta al tratamiento con antivirales de acción directa en los pacientes con recidiva del VHC sobre el injerto hepático.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Autoría- 1.
Responsables de la integridad del estudio: MAZ y MTFE.
- 2.
Concepción del estudio: MAZ y MTFE.
- 3.
Diseño del estudio: MAZ, MTFE, IPG y MCGH.
- 4.
Obtención de los datos: MAZ, MTFE e IPG.
- 5.
Análisis e interpretación de los datos: MAZ, MTFE, ARV, AMD y RMRP.
- 6.
Tratamiento estadístico: MAZ, MTFE y ARV.
- 7.
Búsqueda bibliográfica: MAZ, MTFE, AMD y RMRP.
- 8.
Redacción del trabajo: MAZ, MTFE, AMD, ARV, IPG y RMRP.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MAZ, MTFE, MCGH, ARV y AMD.
- 10.
Aprobación de la versión final: MAZ, MTFE, MCGH, IPG, RMRP, AMD y ARV.
Los autores declaran no tener ningún conflicto de intereses.