Las coinfecciones pulmonares fúngicas asociadas a la COVID-19 pueden ocurrir en pacientes gravemente enfermos o con comorbilidades subyacentes e inmunosupresión. Las infecciones fúngicas invasivas más comunes son causadas por aspergilosis, mucormicosis, y las debidas a Pneumocystis, criptococo y cándida. Los radiólogos integran las características clínicas de la enfermedad con el enfoque basado en patrones de TAC y desempeñan un papel crucial en la identificación de estas coinfecciones en la COVID-19 para ayudar a los médicos a realizar un diagnóstico seguro, iniciar el tratamiento y prevenir complicaciones.
Fungal lung co-infections associated with COVID-19 may occur in severely ill patients or those with underlying co-morbidities, and immunosuppression. The most common invasive fungal infections are caused by aspergillosis, mucormycosis, pneumocystis, cryptococcus, and candida. Radiologists integrate the clinical disease features with the CT pattern-based approach and play a crucial role in identifying these co-infections in COVID-19 to assist clinicians to make a confident diagnosis, initiate treatment and prevent complications.
- •
Las coinfecciones fúngicas en COVID-19 son del tipo saprófito, comúnmente asociadas con el estado inmunodeprimido.
- •
El tratamiento de inmunosupresión prolongado y las comorbilidades subyacentes predisponen a los pacientes con COVID-19 a la infección pulmonar por hongos.
- •
La presentación clínica de la enfermedad y el reconocimiento de patrones mediante TAC pueden ayudar a identificar y diferenciar las infecciones pulmonares fúngicas oportunistas en un contexto de neumonía subyacente por COVID-19.
La pandemia de COVID-19 causada por el coronavirus del síndrome respiratorio agudo grave 2 (SARS-CoV-2) ha tenido importantes repercusiones clínicas, sociales y económicas en todo el mundo1,2. La infección viral se acompaña de una respuesta inmunológica agresiva e hipercitocinemia, que resulta en una reacción inflamatoria excesiva3. Se ha recomendado el tratamiento inmunosupresor, incluido el uso de esteroides, en pacientes graves y críticamente enfermos para prevenir la morbimortalidad asociada con la COVID-194. En algunos casos, el uso indiscriminado de medicamentos inmunosupresores o esteroides en la COVID-19ha provocado complicaciones que incluían infecciones oportunistas. La inmunosupresión relacionada con el tratamiento de la COVID-19, la comorbilidad subyacente relacionada con neoplasias malignas, diabetes mellitus, virus de inmunodeficiencia humana, prótesis permanentes, quemaduras y neutropenia, etc., ha dado lugar a coinfecciones fúngicas con mayor morbimortalidad. Las coinfecciones fúngicas son difíciles de diagnosticar en un contexto de enfermedad pulmonar parenquimatosa grave por neumonía por COVID-195,6. Los signos radiológicos asociados con infecciones fúngicas, como el signo del halo y el signo del halo invertido, también se observan en la neumonía por COVID-197–10.
Los radiólogos pueden ser los primeros en plantear la sospecha de infecciones fúngicas al revisar tomografías computarizadas (TAC) de pacientes en tratamiento agudo para COVID-19 o en el seguimiento posterior a la COVID-19. En este ensayo gráfico presentamos de forma sistemática las características más comunes y el diagnóstico diferencial relacionado con las coinfecciones fúngicas en la TAC de tórax de pacientes con COVID-19.
Las infecciones fúngicas y la inmunidad del huéspedExiste un amplio espectro de infecciones bacterianas y fúngicas que pueden desarrollarse en un paciente con infección por COVID-19 debido a comorbilidades subyacentes, infecciones nosocomiales o neumonía asociada al respirador. Las coinfecciones pulmonares fúngicas relacionadas con la COVID-19 se han atribuido a procesos fisiopatológicos de: a) patrones moleculares asociados al peligro desencadenados por la infección por SARS-CoV-2 a través de una respuesta inmunológica alterada que culmina en una lesión pulmonar aguda11–13; b) activación de la inmunidad antiviral que crea un entorno permisivo para la proliferación de organismos fúngicos14, y c) síndrome de dificultad respiratoria aguda (SDRA) grave con un lecho de edema intersticial y alveolar que sirve como ambiente para que se desarrolle una infección pulmonar oportunista15.
Clasificación de las infecciones fúngicas pulmonaresLa infección fúngica que afecta a los pulmones se puede clasificar en 2 tipos, ya sea saprófita, que infecta predominantemente a personas inmunodeprimidas (Pneumocystis jirovecii [P. jirovecii], candidiasis, aspergilosis, mucormicosis, criptococo) o patógena, que infecta predominantemente a personas inmunocompetentes (coccidioidiomicosis, blastomicosis, histoplasmosis)16.
Infecciones pulmonares fúngicas en la COVID-19Las infecciones pulmonares fúngicas que ocurren en la COVID-19 son del tipo saprófito que infectan a personas inmunodeprimidas. Estos pacientes suelen ser sintomáticos, el cuadro clínico a menudo es confuso y es difícil determinar la presencia de una infección fúngica en un contexto de COVID-19. La incidencia notificada de coinfecciones asociadas con COVID-19 varía del 4 al 35% para pacientes ingresados en la Unidad de Cuidados Intensivos con SDRA. Las infecciones más comunes son aspergilosis pulmonar invasiva, mucormicosis, las infecciones por P. jirovecii, criptococo y cándida17–23. El espectro de infecciones causado por estos organismos oportunistas varía de indolente a agresivo y también depende de las comorbilidades subyacentes (tabla 1).
Factores predisponentes asociados con infecciones pulmonares fúngicas
| Organismo | Condiciones asociadas predisponentes |
|---|---|
| CAPAAspergilosis invasiva de las vías respiratorias | Diabetes mellitus |
| Aspergilosis angioinvasiva | Diabetes mellitus, neutropenia, aloinjertos de TCMH o trasplantes de órganos sólidos, neoplasias hematológicas, esteroides prolongados |
| CAM | Diabetes mellitus, neoplasias hematológicas, trasplantes de órganos sólidos, enfermedades respiratorias crónicas, quemaduras o traumatismos locales |
| Pneumocystis jirovecii | VIH, pacientes con linfopenia, trasplantes de órganos sólidos, neoplasias hematológicas |
| Cryptococcus neoformans | Heces de aves |
| Cándida (hongo blanco) | Hospitalización, catéter venoso permanente, neoplasia hematológica, diálisis peritoneal, poscirugía torácica |
CAM: mucormicosis asociada al SARS-COV-2; CAPA: aspergilosis pulmonar asociada al SARS-CoV-2; TCMH: trasplante de células madre hematopoyéticas; VIH: virus de inmunodeficiencia humana.
Las infecciones por hongos saprófitos tienen un amplio espectro de patrones de enfermedad en la TAC de tórax, que incluyen opacidades en vidrio esmerilado (GGO), consolidación, nódulos, quistes y cavitaciones24 (fig. 1). Pueden presentarse características auxiliares de engrosamiento de la pared traqueobronquial, linfadenopatía mediastínica y derrame pleural. Un alto índice de sospecha y el conocimiento de los patrones característicos y superpuestos pueden ayudar a determinar la presencia de coinfecciones fúngicas. A menudo, es el radiólogo informador quien plantea la posibilidad de una coinfección fúngica oportunista en función de los hallazgos de la TAC de tórax. La detección temprana y la integración clínica pueden permitir el inicio de un tratamiento específico y mejorar la atención.
Neumonía por COVID-19 con características de imagen típicas. Imágenes axiales de TAC de tórax (ventana de pulmón) en un hombre de 49 años (a y b) con resultado de PCR en tiempo real positiva para SARS-CoV-2, que muestra áreas bilaterales de consolidaciones multifocales (flecha) en una distribución periférica.
Los hallazgos informados más comunes de la infección pulmonar por la COVID-19 incluyen GGO, consolidación, patrón en empedrado, anomalías pulmonares bilaterales, predilección por los lóbulos inferiores y posteriores, e ingurgitación vascular25–27 (fig. 2). El patrón de anormalidad cambia con el tiempo dependiendo de la etapa del proceso de la enfermedad27. En la etapa temprana, la opacidad en vidrio esmerilado es la manifestación predominante, el patrón en empedrado, en la etapa progresiva y la consolidación, en la etapa máxima; la consolidación puede ser completamente absorbida o reemplazada por cambios fibróticos en la etapa de recuperación27. En un escenario clínico sospechoso, con una prueba positiva o en una región con COVID-19 endémica, la presencia de estos hallazgos debe despertar la sospecha de COVID-19.
Hallazgos de la TAC de tórax en coinfecciones fúngicas con COVID-19Aspergillus fumigatusAspergillus fumigatus infecta a personas inmunocompetentes e inmunodeprimidas. La aspergilosis pulmonar asociada al SARS-CoV-2 (CAPA) ha sido una de las infecciones fúngicas predominantes en pacientes con COVID-19 con SDRA20,21. La CAPA se manifiesta como aspergilosis invasiva de las vías respiratorias (AIA) o aspergilosis angioinvasiva (ANIA). La incidencia informada de CAPA puede variar según el tratamiento realizado para pacientes graves o en estado crítico con COVID-19, especialmente con corticoides y antiinterleucina 6 (IL-6), como tocilizumab22,23. La CAPA es difícil de diagnosticar cuando los hallazgos radiológicos relacionados con la aspergilosis se asemejan a manifestaciones pulmonares graves de COVID-1924,28. Se ha notificado que la CAPA, en pacientes críticamente enfermos o intubados, tiene una tasa de mortalidad que alcanza hasta el 40%17,23,24,29,30.
- a.
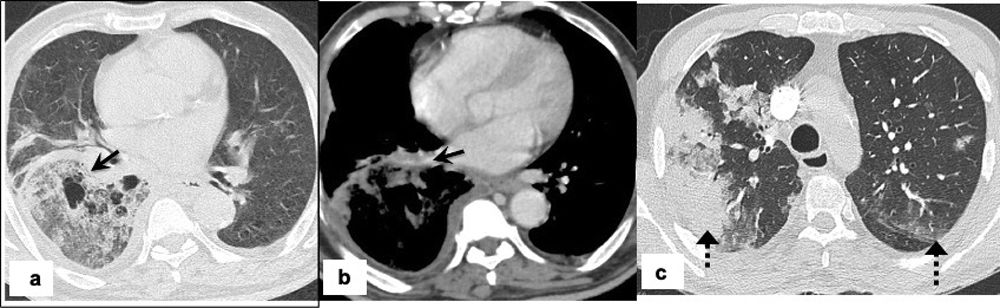
La ANIA ocurre exclusivamente en pacientes inmunodeprimidos (fig. 3). El organismo invade las arterias de tamaño pequeño a mediano y da lugar a nódulos necróticos y hemorrágicos solitarios o múltiples, o infartos. La TAC de tórax muestra nódulos y masas pulmonares únicos o múltiples. El halo de hemorragia puede verse como un área de opacidad de vidrio esmerilado que rodea el nódulo y recibe el nombre de signo del halo. También se puede encontrar un signo de halo invertido (definido como una opacidad central en vidrio esmerilado rodeada por una consolidación más densa en forma de media luna o circunferencia). La angiografía por TAC puede demostrar invasión vascular31. No suele haber agrandamiento de los ganglios linfáticos ni derrame pleural. Puede ser difícil llegar a un diagnóstico certero porque el signo del halo y el signo del halo invertido también se observan habitualmente en la neumonía por COVID-19. La presencia de una invasión vascular obvia haría que el radiólogo sospechara una coinfección por ANIA en un contexto de COVID-19.
Figura 3.Aspergilosis angioinvasiva en un hombre de 69 años con neumonía por COVID-19 que requirió ventilación no invasiva e ingreso en la UCI. TAC de tórax en el día 10 desde el inicio de los síntomas que muestra en el lóbulo inferior izquierdo una consolidación periférica en forma de cuña con una opacidad en vidrio esmerilado circundante acorde con un infarto pulmonar y un signo de halo circundante debido a una hemorragia pulmonar (flecha) (a); imagen axial que presenta consolidaciones multifocales subpleurales periféricas bilaterales (flecha discontinua) compatibles con neumonía subyacente por COVID-19 (b).
(0.07MB). - b.
En la AIA, las manifestaciones dependen del punto de afectación dentro de las vías respiratorias. Puede presentarse como traqueobronquitis, bronquiolitis o bronconeumonía. Los hallazgos de la TAC de tórax en la traqueobronquitis incluyen engrosamiento de la pared traqueal y bronquial; por su parte, los hallazgos de la bronquiolitis incluyen nódulos centrilobulares con «patrón de árbol en gemación», mientras que el tipo de afectación de la bronconeumonía se observa como una consolidación lobular o perihiliar32. Cuando hay coinfección por AIA en la COVID-19, el tipo de afectación de traqueobronquitis y bronquiolitis puede identificarse claramente a partir del patrón de neumonía de la COVID-19, mientras que el tipo de bronconeumonía podría estar enmascarado en la COVID-19 grave o crítica, lo que dificulta el diagnóstico.
- c.
La CAPA es difícil de diagnosticar en imágenes de rutina en pacientes en estado crítico con COVID-19, ya que las características de las imágenes no son específicas y rara vez se observan las características típicas, como el signo del halo o la cavitación33. Los análisis de sangre pueden ser negativos para AIA en el paciente no neutropénico34. El lavado broncoalveolar rara vez se realiza debido al riesgo de transmisión35. La detección estándar de infecciones fúngicas con galactomanano sérico tiene una sensibilidad baja, de tan solo el 21% para la detección de CAPA9.
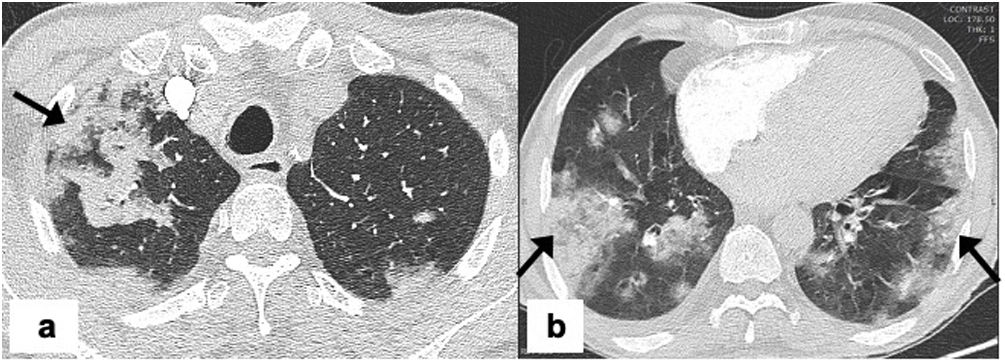
La mucormicosis también se conoce como «hongo negro» en la bibliografía no especializada y es causada por la inhalación de esporas de hongos que están presentes en el aire, el suelo, el compost, las pilas de desechos, la materia orgánica en descomposición, las frutas o las verduras. Los senos paranasales y los pulmones son los puntos más afectados36. La diabetes mellitus es el factor de riesgo más frecuente, seguido de la inmunosupresión, las neoplasias hematológicas, las células madre y el trasplante de órganos37. Los hallazgos de la TAC de tórax son inespecíficos, incluida la presencia de nódulos, consolidación o GGO38. También puede observarse el signo del halo invertido, linfadenopatía o derrame pleural. Las áreas de consolidación pueden mostrar cavitación en las imágenes de seguimiento39. En raras ocasiones, la mucormicosis puede estar asociada con la invasión de la arteria pulmonar, la vena cava superior u otros vasos del cuello39,40 (figs. 4 y 5). El signo de nido de pájaro se refiere a la apariencia creada por un signo de halo invertido con zonas asociadas irregulares y de intersección de líneas irregulares dentro de la zona de la opacidad de vidrio esmerilado41,42. Cuando se observa el signo del nido de pájaro en el contexto de la infección por COVID-19, debe despertar sospechas de infección por mucormicosis asociada a COVID-19 (CAM). En la práctica, diferenciar la CAM de la CAPA es difícil debido al solapamiento de las características de las imágenes. La presencia del signo del nido de pájaro, más de 10 nódulos pulmonares, derrame pleural e infecciones sinusales concurrentes tiende a la mucormicosis antes que a la aspergilosis pulmonar invasiva4. El signo del nido de pájaro no es específico de la CAM y se ha asociado con neumonía organizada criptogénica, neumonía bacteriana, sarcoidosis, granulomatosis de Wegener, paracoccidioidomicosis e infarto pulmonar42.
Mucormicosis pulmonar en un hombre de 45 años con antecedentes médicos de diabetes mellitus, diagnosticado y tratado por COVID-19 en otro centro con un tratamiento sintomático y esteroides orales hace 2 semanas. Los pacientes ahora presentan fiebre persistente y disnea. TAC de tórax al ingreso: imagen axial que muestra GGO multifocales subpleurales periféricas bilaterales (flecha negra discontinua) compatibles con neumonía subyacente por COVID-19 (a) e imagen axial que muestra una gran cavitación central en el lóbulo superior izquierdo asociada con líneas entrecruzadas irregulares dentro de un área de consolidación y vidrio esmerilado marginal consistente con el signo del nido de pájaro (flecha blanca) (b).
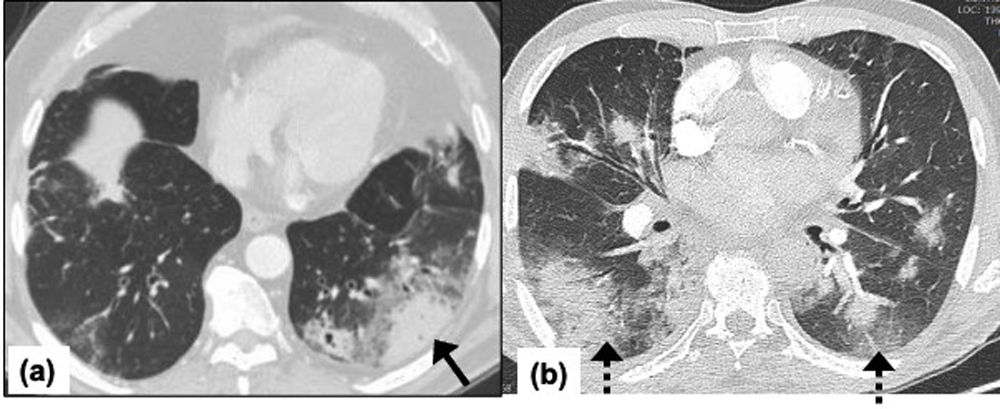
Mucormicosis pulmonar en hombre de 64 años con antecedentes de diabetes mellitus y que presenta fiebre, tos y disnea desde hace 4 días. La PCR en tiempo real fue positiva para COVID-19. El paciente tenía una neumonía grave por COVID-19 que requirió ingreso en la UCI y ventilación no invasiva. TAC de tórax al ingreso: imagen axial que muestra una gran consolidación del espacio aéreo con atenuación en vidrio esmerilado en el lóbulo inferior derecho con áreas de cavitación (flecha) (a); imagen axial posterior al contraste que muestra irregularidad en la pared del vaso y estrechamiento luminal de la vena pulmonar inferior derecha que sugiere invasión vascular (flecha) (b), e imagen axial que muestra consolidación subpleural periférica en el lóbulo superior derecho y opacidades irregulares en vidrio esmerilado en los lóbulos superiores izquierdos (flecha discontinua) compatibles con neumonía subyacente por COVID-19 (c).
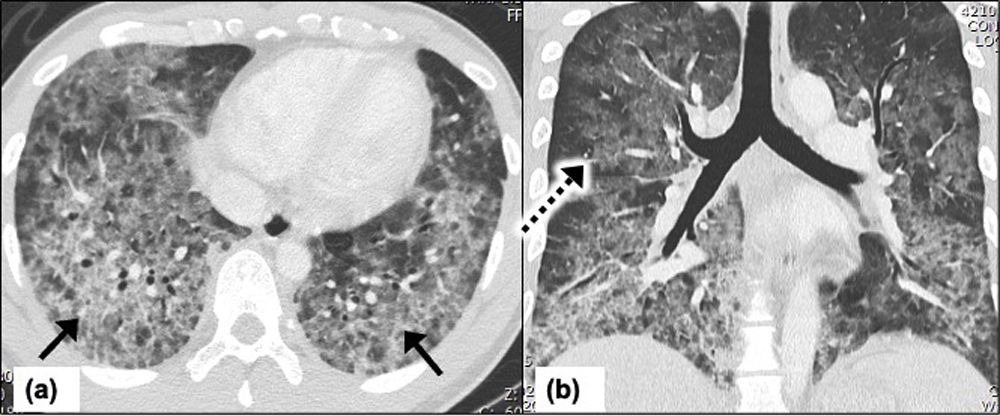
P. jirovecii se asocia al síndrome de inmunodeficiencia adquirida, a los receptores de trasplantes de órganos y a los pacientes en tratamiento inmunosupresor con quimioterapia o esteroides. El riesgo de neumonía por P. jirovecii (PJP) aumenta significativamente con la linfocitopenia CD4+(< 200 cél./μl)43,44. La infección por SARS-CoV-2 en un paciente ya inmunodeprimido conduce a una mayor inmunodepresión funcional que predispone al paciente a la PJP43. Debido a las características radiológicas superpuestas del SARS-CoV-2 con la PJP, la presencia de coinfección de PJP con SARS-CoV-2 puede ser difícil de diagnosticar en imágenes. Los radiólogos deben abordar la TAC con sospecha de coinfección por PJP en un paciente inmunodeprimido con linfocitopenia CD4+. Los hallazgos típicos de la TAC incluyen opacidad en vidrio esmerilado en parches o geográfica con predilección perihiliar predominante o en la zona media5. Con menos frecuencia, puede haber un engrosamiento septal interlobular liso con un patrón en empedrado. El predominio de la zona superior se puede ver en pacientes con terapia profiláctica. La preservación periférica se describe en el 40% de los pacientes con apariencia de alas de murciélago45 (fig. 6). Los derrames pleurales son poco comunes con esta infección y la presencia de derrame debe hacer sospechar otra enfermedad o infección46. Durante la fase crónica, las áreas de los pulmones afectadas por patrones en empedrado pueden ser reemplazadas por quistes pulmonares irregulares, lo que aumenta el riesgo de neumotórax en tales casos. Los hallazgos menos comunes encontrados incluyen la consolidación pulmonar y los nódulos centrilobulares46. En pacientes con linfocitopenia CD4+y características de imagen sospechosas de coinfección con PJP, se recomienda indicar pruebas con beta-D-glucano sérico47 o reacción en cadena de la polimerasa (PCR) cuantitativa para PJP48.
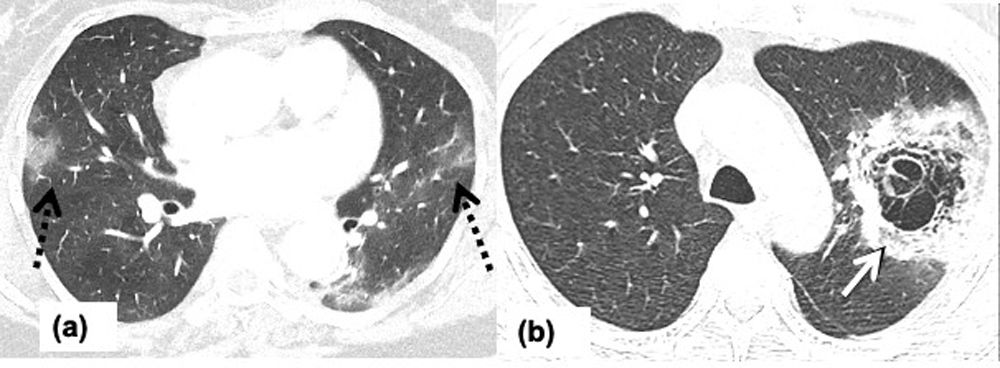
Neumonía aguda por Pneumocystis jirovecii en un hombre de 29 años con VIH y recuento bajo de CD4+(< 200 cél./μl). El paciente se presenta en urgencias con síntomas graves de COVID-19 el día 6. TAC de tórax en el día 10: imagen axial que muestra opacidades difusas en vidrio esmerilado e infiltrados confluentes en los lóbulos inferiores bilaterales con engrosamiento de la línea septal que indica empedrado (flechas negras) y llega hasta los campos pulmonares periféricos, lo que concuerda con neumonía por COVID-19 (a); imagen coronal del tórax que muestra opacidades difusas en vidrio esmerilado con engrosamiento septal que afecta a los pulmones bilaterales con preservación periférica relativa (flecha discontinua) en los campos pulmonares superior y medio, lo que sugiere una apariencia de «ala de murciélago» (b). Existe un solapamiento considerable entre la infección por SARS-COV-2 y la neumonía por Pneumocystis jirovecii, lo que dificulta el diagnóstico.
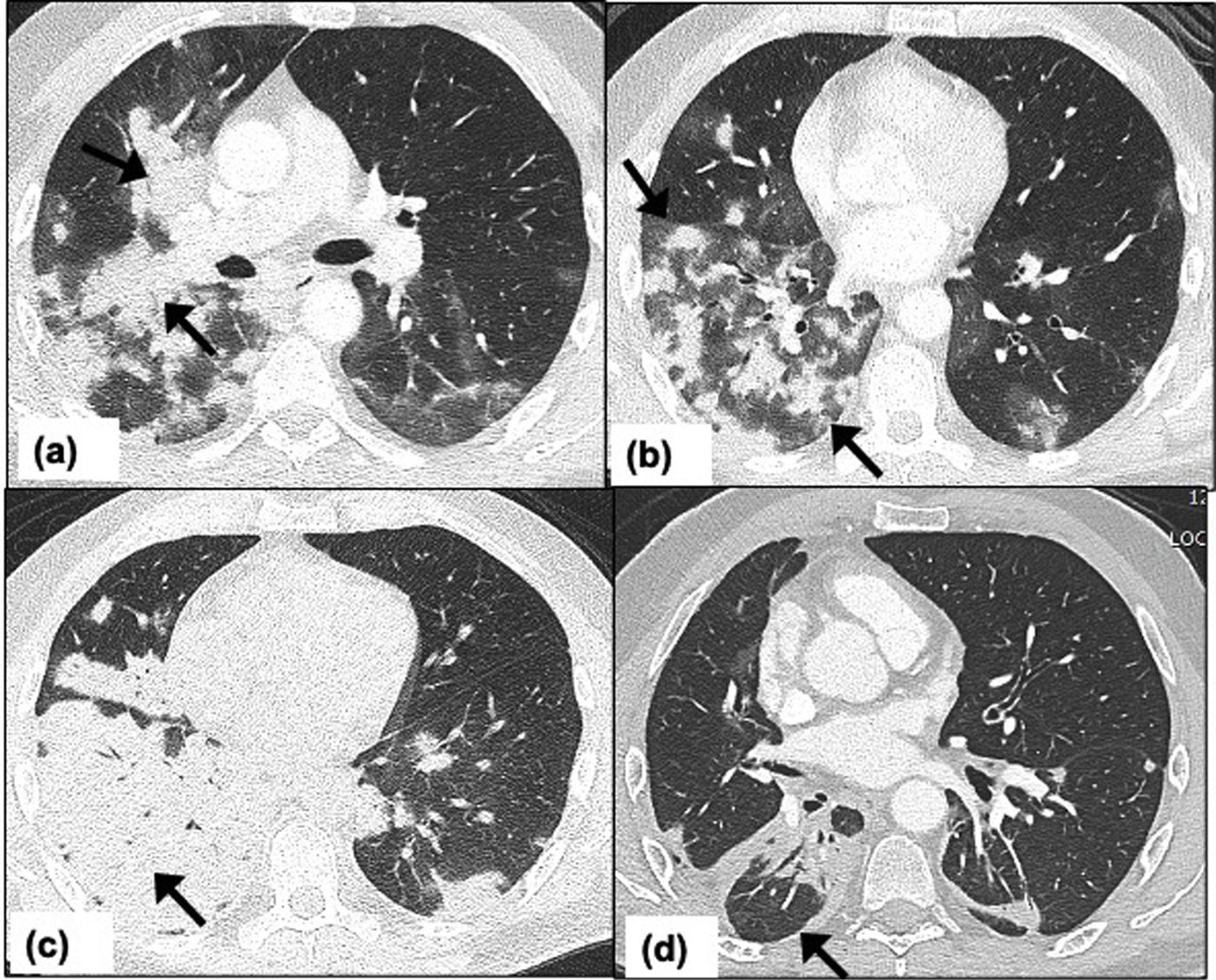
Se encuentran normalmente en el suelo o en los excrementos de pájaros. Los pacientes con VIH con infección por SARS-CoV-2 acompañada de linfocitopenia CD4+(< 200 cél./μl), o los pacientes con trasplantes de células madre, son susceptibles de presentar criptococosis invasiva49. La TAC de tórax muestra múltiples nódulos pulmonares de tamaño variable (0,5 a 4cm), patrón miliar o áreas de consolidación (fig. 7). La cavitación puede ocurrir dentro de los nódulos en pacientes inmunodeprimidos50. También se puede observar derrame pleural o linfadenopatía. La presentación clínica con meningoencefalitis51 y los hallazgos de la TAC de tórax pueden ser el primer indicio de coinfección por criptococosis invasiva.
Criptococosis pulmonar en un hombre de 54 años que recibe tratamiento inmunosupresor por antecedentes médicos de enfermedad inflamatoria intestinal. El paciente se presenta en urgencias con síntomas moderados de COVID-19. TAC de tórax en el día 10: imagen de TAC axial a nivel de la carina que muestra nódulos confluentes que forman una consolidación peribronquial con opacidades en vidrio esmerilado circundantes (flechas) (a); imagen de TAC axial que muestra múltiples nódulos con halo en vidrio esmerilado en los lóbulos inferiores bilaterales (flechas) (b); imagen de TAC axial tomada 2 semanas después que muestra una consolidación lobular completa en el lóbulo inferior derecho, lo cual sugiere una progresión significativa en este intervalo (flecha) (c), e imagen de TAC axial del tórax 2 meses después del inicio de los síntomas que muestra una mejoría significativa en este intervalo con consolidación peribronquial residual en el lóbulo inferior derecho (flecha) (d).
La cándida, también conocida como el «hongo blanco», es un organismo que forma parte de la flora microbiana humana normal en la cavidad bucal52. La mayoría de los pacientes con candidiasis pulmonar tienden a tener una afectación sistémica generalizada. Se demostró que la candidiasis invasiva ocurre con mayor frecuencia en pacientes que recibieron antibióticos de amplio espectro, nutrición parenteral, neutropenia prolongada y otro factor de deterioro inmunitario51. La afectación pulmonar con neumonía por cándida no es específica y en las imágenes se atribuye comúnmente a otras infecciones oportunistas o a la neumonía por COVID-19. Los hallazgos de la TAC de tórax pueden incluir múltiples nódulos sólidos sin halo en vidrio esmerilado, opacidad en vidrio esmerilado, nódulos miliares, consolidación multifocal o pequeños abscesos pulmonares53.
Vigilancia de las infecciones fúngicas oportunistas en COVID-19Los patrones de imagen típicos asociados con las infecciones fúngicas se superponen con la neumonía por COVID-19 y otras infecciones virales, bacterianas e incluso neoplasias malignas. En algunos pacientes, las manifestaciones radiológicas pueden retrasarse o estar ausentes. El radiólogo tiene un papel en la integración de las características clínicas de alto riesgo, señalando los hallazgos de la TAC de tórax como el signo del halo, el signo del nido de pájaro, las cavitaciones, la afectación bronquial o peribroncovascular asociada a las coinfecciones fúngicas y recomendando la confirmación analítica o la toma de muestras histopatológicas54. Para confirmar el diagnóstico, se pueden realizar análisis de esputo, paneles moleculares sindrómicos con PCR cuantitativa o cultivos para detectar aspergilosis, mucormicosis o P. jirovecii en muestras respiratorias. Dependiendo de la positividad, sería necesario realizar más pruebas de confirmación con biomarcadores sanguíneos usando galactomanano sérico, beta-D-glucano sérico, antígeno criptocócico o PCR cuantitativa en sangre para mucormicosis y aspergilosis4,55. Los biomarcadores para el diagnóstico de la aspergilosis invasiva, como el galactomanano y el beta-D-glucano, son negativos en los pacientes con mucormicosis, lo que permite al equipo clínico afinar el diagnóstico con la presencia de antecedentes contribuyentes o la sospecha radiológica.
ConclusiónLos pacientes con COVID-19 en estado inmunodeprimido y comorbilidades subyacentes son propensos a desarrollar coinfecciones fúngicas. En un contexto de COVID-19, los radiólogos deben abordar la TAC de tórax con un alto índice de sospecha de CAPA cuando hay antecedentes de terapia con esteroides e IL-6, de CAM en diabetes mellitus, de PJP en pacientes con VIH con linfocitopenia CD4+y de criptococosis cuando hay neoplasias malignas preexistentes o inmunosupresión asociada con la presentación clínica de meningoencefalitis. La mayoría de las coinfecciones pulmonares fúngicas en un entorno de COVID-19 son invasivas, con propensión al deterioro rápido. Es importante que los radiólogos estén familiarizados con el patrón de enfermedad típico y atípico de la coinfección fúngica en la TAC de tórax en pacientes con neumonía por COVID-19, de modo que se puedan realizar más estudios que incluyan serología y tomas de muestras de tejido para confirmar el diagnóstico y avanzar en la atención al paciente.
AutoríaGarante de la integridad del artículo, concepto y diseño del artículo, redacción y revisión del artículo para el contenido intelectual importante: AN. La versión final del artículo está aprobada por todos los autores. Búsqueda de bibliografía, imágenes de TAC y leyendas, y edición del artículo por parte de todos los autores.
FinanciaciónLos autores no han recibido financiación para este artículo.
Conflicto de interesesLos autores no tener ningún conflicto de intereses.