Suplemento “Patología Intersticial Pulmonar”
Más datosLa fibrosis pulmonar idiopática (FPI) es la enfermedad pulmonar fibrosante más frecuente y se asocia con un pronóstico muy pobre, existiendo actualmente tratamientos para retardar su progresión, lo que hace fundamental su diagnóstico temprano. Los radiólogos tienen un papel fundamental en la evaluación y el diagnóstico preciso de la FPI. La identificación de los patrones radiológicos en la tomografía computarizada de alta resolución (TCAR) es clave en el proceso de diagnóstico multidisciplinar y, con frecuencia, obvia la necesidad de una biopsia pulmonar quirúrgica. En esta revisión, describimos las características clínicas y de imagen de la FPI en el contexto de las guías internacionales más recientes, así como el diagnóstico diferencial, el papel de la TCAR en el seguimiento y las complicaciones.
Idiopathic pulmonary fibrosis (IPF) is the most common fibrosing lung disease. It is associated with a very poor prognosis. Treatments can delay the progression of IPF, so early diagnosis is fundamental. Radiologists play a fundamental role in the evaluation and accurate diagnosis of IPF. Identifying the characteristic patterns of IPF on high-resolution computed tomography (HRCT) is key in the process of multidisciplinary diagnosis, often obviating the need for surgical lung biopsies. This review describes and illustrates the clinical and imaging findings in IPF in the context of the most recent international guidelines, as well as the differential diagnosis and the role of HRCT in follow-up and assessment of complications.
La fibrosis pulmonar idiopática (FPI) es una neumonía intersticial fibrosante crónica y progresiva de causa desconocida que se asocia con las características radiológicas e histológicas de la neumonía intersticial usual (NIU)1. Forma parte del grupo de las neumonías intersticiales idiopáticas fibrosantes crónicas, junto con la neumonía intersticial no específica (NINE), de la clasificación de consenso de la American Thoracic Society-European Respiratory Society (ATS-ERS) del año 20132.
La FPI es una enfermedad que afecta principalmente a adultos mayores, generalmente en la sexta y séptima décadas de vida y es 2 veces más común en individuos masculinos. Los factores de riesgo incluyen una edad avanzada, antecedentes familiares, tabaquismo, reflujo gastroesofágico y algunas exposiciones ambientales3–5. El pronóstico de la FPI es pobre, con una supervivencia promedio después del diagnóstico de 3 a 4 años. No obstante, la evolución de la FPI puede ser variable, mientras que la mayoría de los pacientes progresan rápidamente, otros presentan estabilidad o progresan más lentamente, con tiempos de supervivencia prolongados de más de una década3,4.
Las manifestaciones clínicas típicas son inespecíficas e incluyen disnea crónica progresiva, tos seca, fatiga, crepitantes inspiratorios secos en las bases pulmonares en el examen físico y acropaquias1,3. Las pruebas de función respiratoria generalmente muestran restricción con una disminución de la capacidad vital forzada, volúmenes pulmonares disminuidos y reducción de la capacidad de difusión del CO3–5.
El diagnóstico de la FPI, como en otras enfermedades pulmonares infiltrativas difusas (EPID), se basa en la valoración multidisciplinar de los datos clínicos, radiológicos e histológicos. Para ello, existen guías multidisciplinares de práctica clínica. La primera guía ATS-ERS sobre FPI publicada data del año 20006, aunque es en la actualización del año 2011 de la guía de la ATS, la ERS, la Japanese Respiratory Society y la Latin American Thoracic Association (ATS/ERS/JRS/ALAT)1 cuando el diagnóstico por tomografía computarizada de alta resolución (TCAR) adquiere mayor relevancia y los radiólogos pasan a tener un papel clave en el diagnóstico y el manejo de esta enfermedad. Esta guía de la ATS/ERS/JRS/ALAT fue actualizada en el año 20183, el mismo año en que se publicó el White Paper de la Sociedad Fleischner4 sobre los criterios diagnósticos de la FPI, y ha sido actualizada de nuevo, muy recientemente, en mayo del 2022, incluyendo además el nuevo concepto de «fibrosis pulmonar progresiva»7.
La TCAR desempeña un papel fundamental en el diagnóstico de esta patología, y en ocasiones permite prescindir de la histología en el algoritmo diagnóstico, al identificar el patrón de NIU o de probable NIU en una neumopatía intersticial fibrosante. El diagnóstico precoz de la FPI es especialmente importante debido al mal pronóstico de la enfermedad, permitiendo iniciar precozmente el tratamiento antifibrótico que puede reducir el deterioro de la función pulmonar3,4,8,9.
En el presente artículo revisaremos el papel de la radiología, especialmente de la TCAR, en el manejo de la FPI.
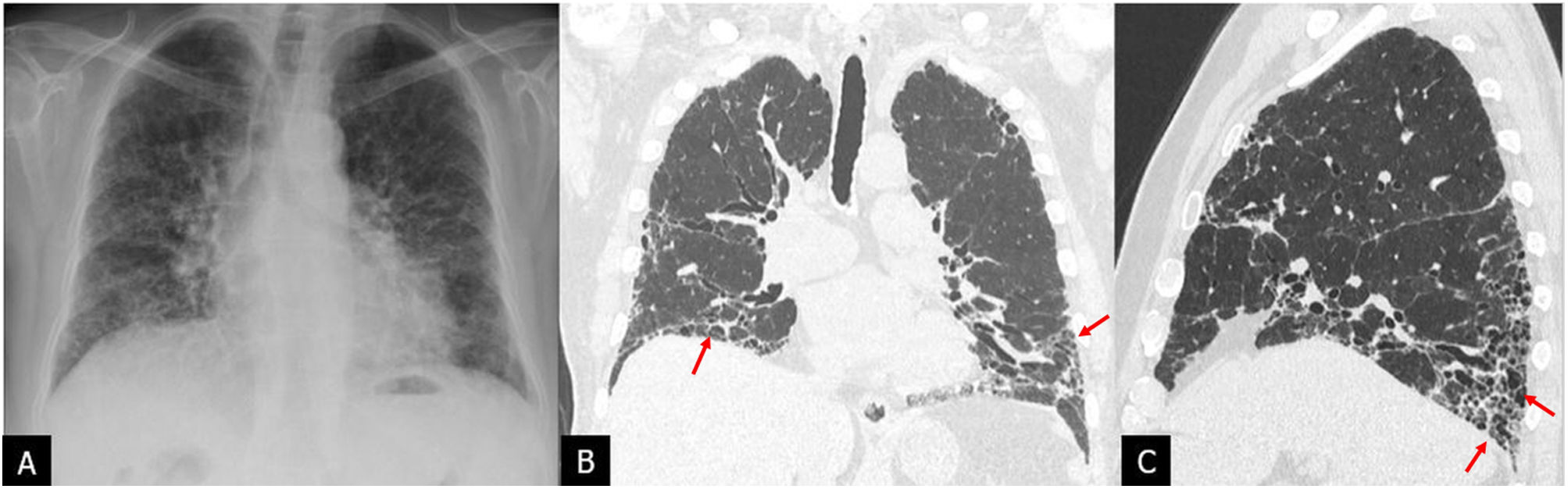
Hallazgos radiológicos en la FPILa radiografía de tórax es, en muchas ocasiones, la prueba inicial que se realiza ante una sospecha clínica de EPID. Los hallazgos en la radiografía de tórax son inespecíficos y no permiten una correcta caracterización de la neumopatía intersticial. La fibrosis pulmonar en la radiografía de tórax se manifiesta como reticulación y opacidades lineales de predominio basal, frecuentemente con pérdida de volumen pulmonar en casos de fibrosis avanzada10 (fig. 1A). El papel actual de la radiografía de tórax en las EPID es básicamente indicar una TCAR ante una imagen sospechosa de afectación intersticial para el diagnóstico precoz de la FPI. La TCAR con adquisición volumétrica (fig. 1B y C) es la técnica de elección para la valoración radiológica de la FPI y constituye el primer paso en el diagnóstico de la misma. La TCAR volumétrica con TC multidetector proporciona información de todo el pulmón, con imágenes de gran calidad y resolución similar a los cortes de las piezas anatomopatológicas macroscópicas. Es fundamental la adquisición con la técnica adecuada de alta resolución, en decúbito supino, inspiración profunda y sin contraste por vía intravenosa. La adquisición en espiración para demostrar el atrapamiento aéreo es opcional, así como la adquisición en decúbito prono para valorar la afectación intersticial periférica dudosa en áreas dependientes del pulmón3,4,11,12. Ambas adquisiciones adicionales pueden realizarse de forma secuencial y con baja dosis13.
Radiografía de tórax (A) y tomografía computarizada de alta resolución (TCAR) con adquisición volumétrica en plano coronal (B) y sagital (C) en un paciente con fibrosis pulmonar idiopática. La radiografía de tórax presenta opacidades reticulares periféricas de predominio basal indicativas de una neumopatía intersticial, sin caracterización del patrón. La TCAR muestra un patrón de neumonía intersticial usual con bronquiolectasias de tracción e imágenes de panal subpleural de predominio basal (flechas).
Los hallazgos radiológicos presentes en la FPI y que caracterizan los patrones de NIU están definidos por la distribución subpleural y predominantemente basal de los mismos: panal, bronquiectasias de tracción, opacidades reticulares y vidrio deslustrado. Estos hallazgos han sido descritos en un capítulo previo del suplemento y solo resaltaremos algunos puntos.
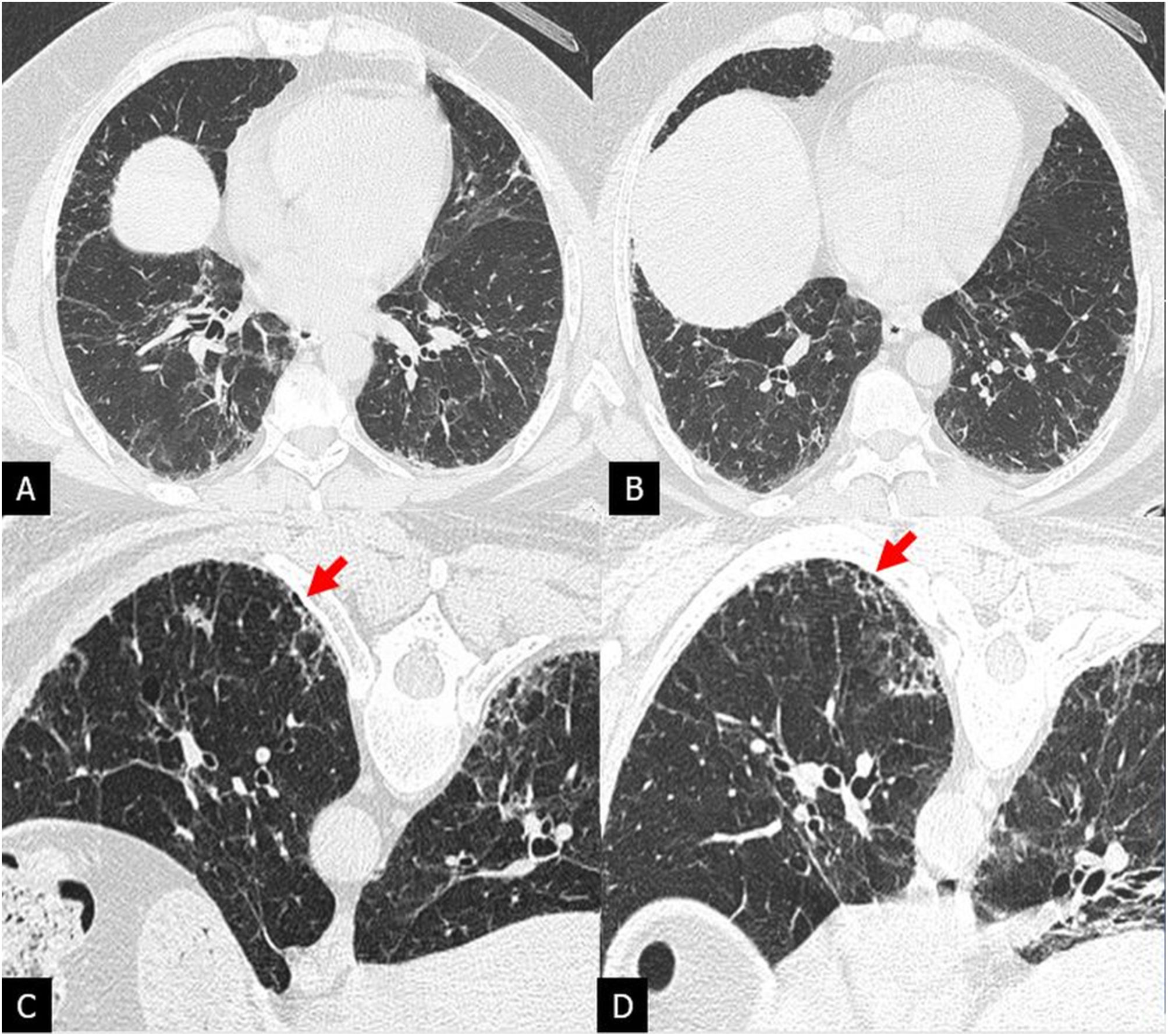
Panal: su identificación es clave e indispensable para el diagnóstico del patrón de NIU típico. Aunque el panal típicamente consiste en quistes aéreos usualmente subpleurales, entre 3-10mm de diámetro y ocasionalmente hasta 2,5cm, agrupados y formando capas14, una sola capa subpleural de 2 o 3 quistes contiguos es suficiente para el diagnóstico de panal15. La identificación del panal puede ser dificultosa cuando los quistes subpleurales son pequeños y escasos, siendo a veces necesaria la adquisición adicional de TC en decúbito prono12 (fig. 2). Los 2 hallazgos diferenciales más típicos que imitan al panal son el enfisema paraseptal y las bronquiolectasias de tracción. Dada la dificultad en la interpretación del panal, la variabilidad interobservador es moderada16,17.
Patrón de neumonía intersticial usual en un paciente con fibrosis pulmonar idiopática. Las imágenes de tomografía computarizada de alta resolución (TCAR) en inspiración en el plano axial (A y B) muestran dudosas imágenes de panal subpleural posterobasal. La adquisición adicional de TCAR en decúbito prono (C y D) confirma la presencia de panal (flechas).
Bronquiectasias/bronquiolectasias de tracción: representan la dilatación irregular de bronquios y bronquiolos causada por la fibrosis retráctil adyacente14. Son un hallazgo clave en el diagnóstico de la fibrosis pulmonar y del patrón de probable NIU, además de un importante marcador pronóstico en el patrón de NIU18. En el patrón de NIU son típicamente de localización periférica, lo que las diferencia de la NINE, en donde tienden a tener una distribución más central. En la NIU son de apariencia varicosa y coexisten con el panal, la reticulación y el vidrio deslustrado. Diferenciarlas del panal requiere a menudo de la ayuda de reconstrucciones multiplanares y de reconstrucciones adicionales como la de mínima intensidad de proyección, que faciliten la identificación de la comunicación con las estructuras bronquiales16.
Opacidades reticulares: se caracterizan por una red de finas líneas debido al engrosamiento irregular de los septos interlobulillares e intralobulillares4.
Opacidades en vidrio deslustrado: si bien el vidrio deslustrado no es característico del patrón de NIU, puede coexistir con las bronquiectasias de tracción, la reticulación y el panal, formando parte del proceso de fibrosis19. Cuando el patrón en vidrio deslustrado constituye el hallazgo predominante o está presente en áreas sin afectación fibrótica, debe sospecharse una exacerbación aguda (EA) o infección0,3,4,20.
Otros hallazgos presentes en la FPICalcificaciones: pueden verse pequeños focos de calcificaciones nodulares en las áreas de fibrosis como resultado de una osificación pulmonar (osificación pulmonar dendriforme)21, siendo la prevalencia de estas calcificaciones significativamente mayor en pacientes con NIU (28,5%) que en aquellos con otras EPID fibrosantes (8,3%, p <0,001)22. Recientemente este hallazgo ha sido incluido en el patrón de NIU de las guías de la ATS del 2022.
Adenopatías mediastínicas: los ganglios linfáticos mediastínicos aumentados de tamaño son frecuentes en las EPID y están presentes hasta en un 70% de los pacientes con patrón de NIU23. Se ha descrito una mayor prevalencia de adenopatías en el grupo de pacientes con FPI cuando se compara con el grupo que presentaba otras EPID. Asimismo, se ha demostrado que los pacientes con EPID y ganglios mediastínicos de tamaño mayor de 10mm presentaban mayor mortalidad, peor función pulmonar y mayor riesgo de hospitalización que los pacientes sin ganglios aumentados de tamaño24.
Patrones de NIU por TCARMediante la valoración de los hallazgos de TCAR se tiene que asignar una de las 4 categorías del patrón de NIU recogidas en las guías de diagnóstico de la FPI. Las principales guías para el radiólogo son la de la Sociedad Fleischner4 y las guías de la ATS/ERS/JRS/ALAT 2018 y 20223,7 (tabla 1).
Comparación de las categorías de patrones de NIU por TCAR de las guías de consenso de la Sociedad Fleischner del 2018 y de la guía ATS/ERS/JRS/ALAT del 2022
| Patrón TCAR | White paper Sociedad Fleischner 2018 | Guía ATS/ERS/JRS/ALAT 2022 | ||
|---|---|---|---|---|
| Distribución | Características | Distribución | Características | |
| NIU o típico de NIU | Predominio basal y subpleural, con frecuencia heterogénea, puede ser difusa | Panal. Reticulación, con bronquiectasias o bronquiolectasias de tracciónAusencia de hallazgos indicativos de otro diagnóstico | Predominio basal y subpleural, con frecuencia heterogéneaPuede ser difusa y asimétrica | Panal con o sin bronquiectasias/bronquiolectasias de tracciónEngrosamiento irregular de septos interlobulillaresGeneralmente con patrón reticular superpuesto, leve vidrio deslustradoPuede tener osificación pulmonar |
| Probable NIU | Predominio basal y subpleural, con frecuencia heterogénea | Reticulación, con bronquiectasias o bronquiolectasias de tracciónAusencia de panalAusencia de hallazgos indicativos de otro diagnóstico | Predominio basal y subpleural, con frecuencia heterogénea | Reticulación con bronquiectasias/bronquiolectasias de tracciónPuede tener leve vidrio deslustradoNo están respetadas las zonas subpleurales |
| Indeterminado para NIU | Variable o difusa(sin predominio subpleural o basal) | Reticulación con algunos discretos hallazgos que indican un patrón no NIU | Distribución difusa sin predominio subpleural | Características de fibrosis pulmonar que no indican ninguna etiología específica |
| Inconsistente con diagnóstico de FPI o indicativo de diagnóstico alternativo | Predominio pulmón superior-medioPredominio peribroncovascular con respeto subpleural | Consolidación predominanteExtenso vidrio deslustradoExtensa atenuación en mosaico con atrapamiento aéreo en espiraciónNódulos o quistes difusos | Predominio peribroncovascular con respeto subpleural (NINE)Distribución perilinfática (sarcoidosis)Pulmón superior o medio (NH fibrótica, colagenopatías, sarcoidosis)Respecto subpleural (NINE o EPI asociada al tabaco) | Quistes (LAM, HPCL, NIL, ND)Atenuación en mosaico o patrón de 3 densidades (NH)Vidrio deslustrado predominante (NH, EPI asociada al tabaco, toxicidad a fármacos, exacerbación aguda)Micronódulos centrolobulillares (NH o EPI asociada al tabaco)Nódulos (sarcoidosis)Consolidación (NO)Placas pleuralesDilatación esofágica |
EPI: enfermedad pulmonar intersticial; HPCL: histiocitosis pulmonar de células de Langerhans; LAM: linfangioleiomiomatosis; ND: neumonía descamativa; NINE: neumonía intersticial no específica; NH: neumonitis por hipersensibilidad; NIL: neumonía intersticial linfocítica; NIU: neumonía intersticial usual; NO: neumonía organizada.
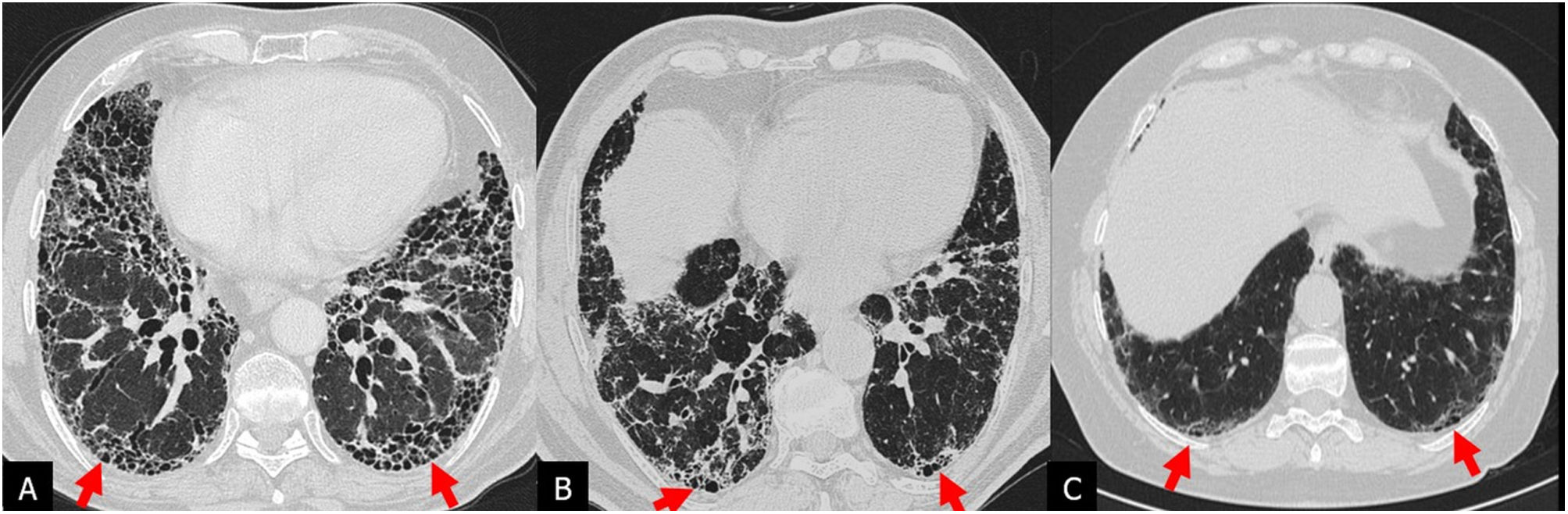
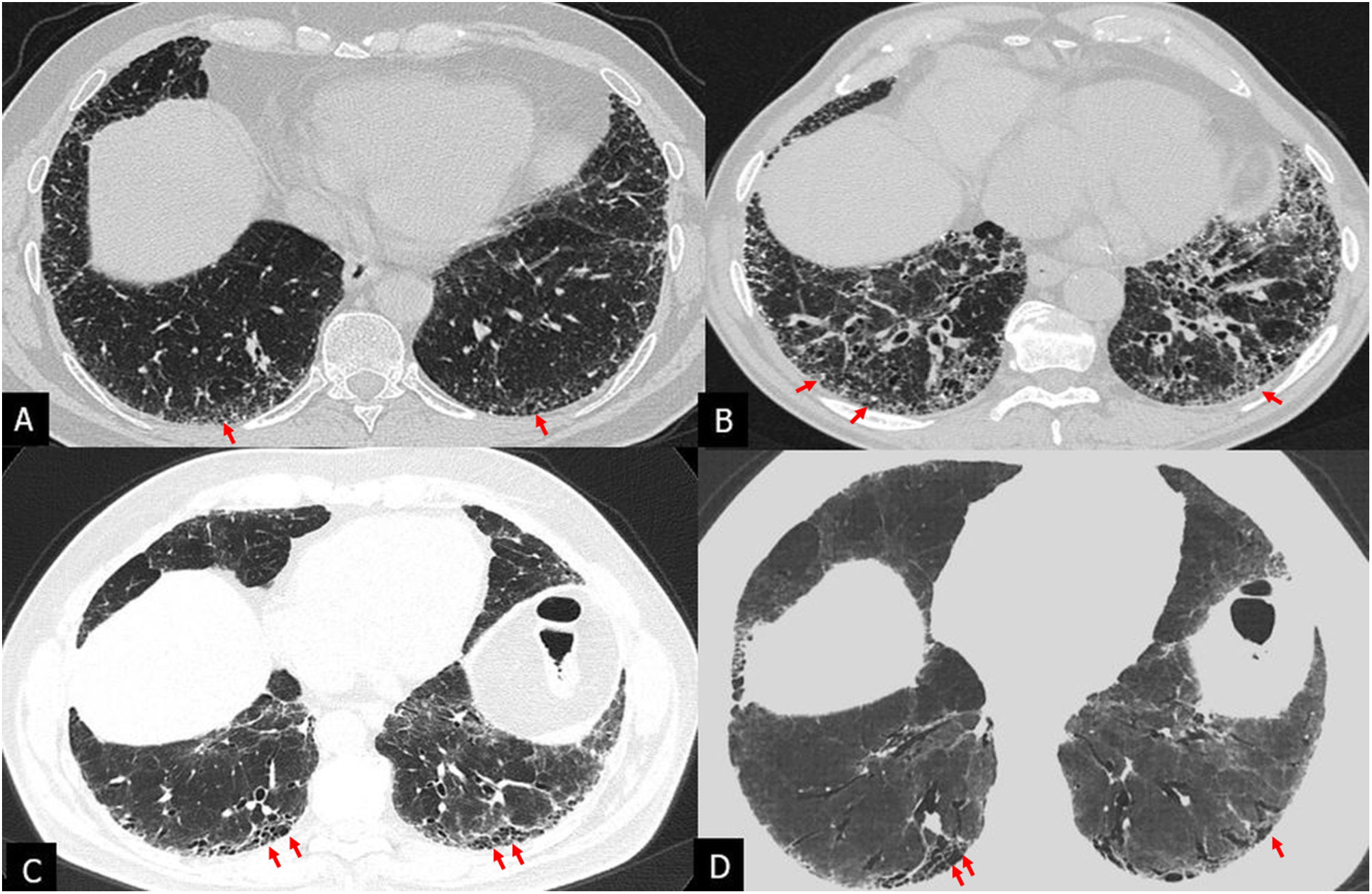
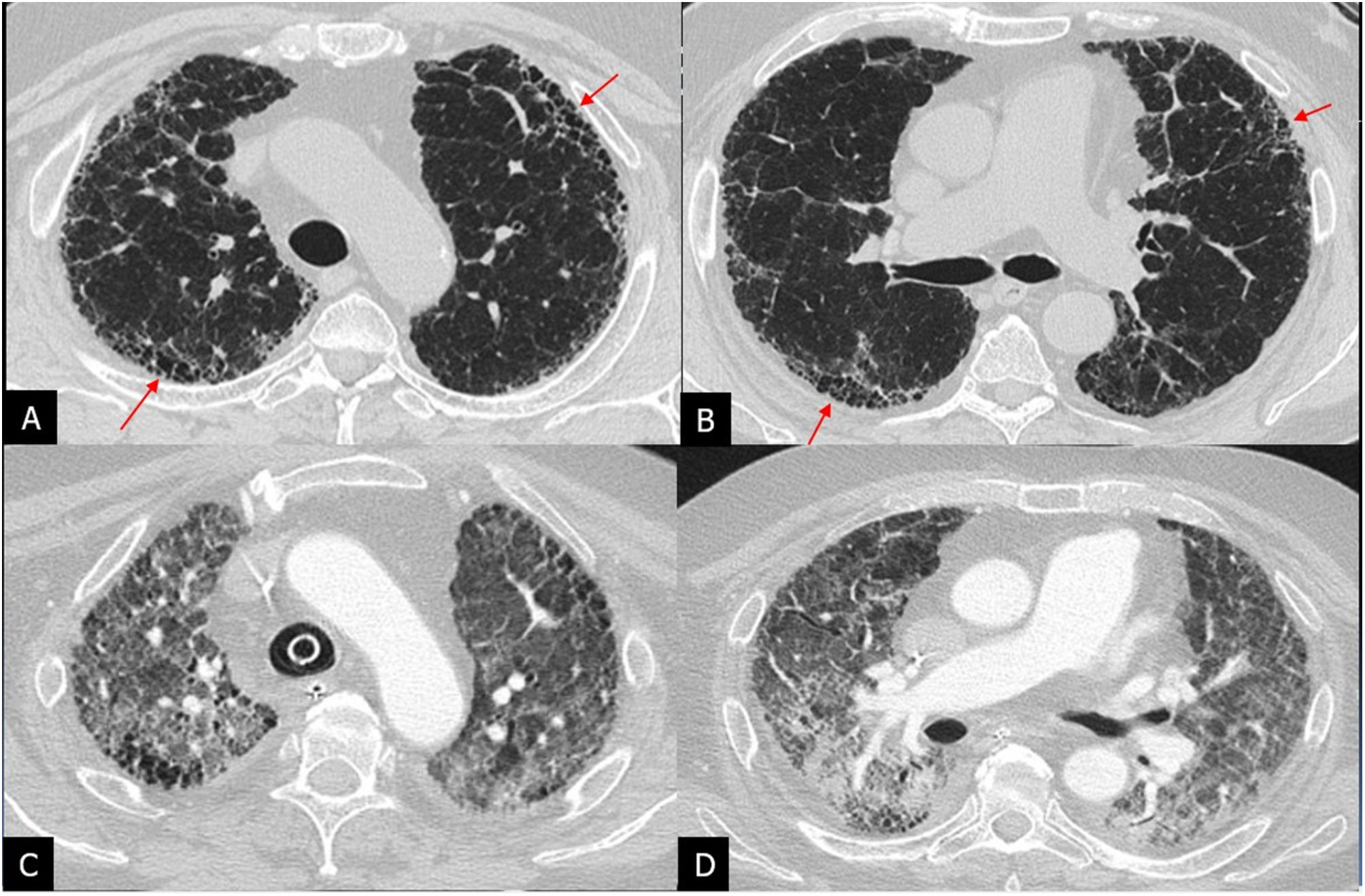
Patrón de NIU o típico de NIU: opacidades reticulares y quistes de panal, con bronquiectasias de tracción y distribución periférica subpleural, de predominio basal; no deben existir otros hallazgos indicativos de un diagnóstico alternativo (fig. 3).
Patrón de neumonía intersticial usual en tomografía computarizada de alta resolución (TCAR) de 3 pacientes con diagnóstico de fibrosis pulmonar idiopática (A-C). TCAR en el plano axial con quistes de panal (flechas) de localización basal, siendo más prominentes en el paciente A y escasas en el paciente C.
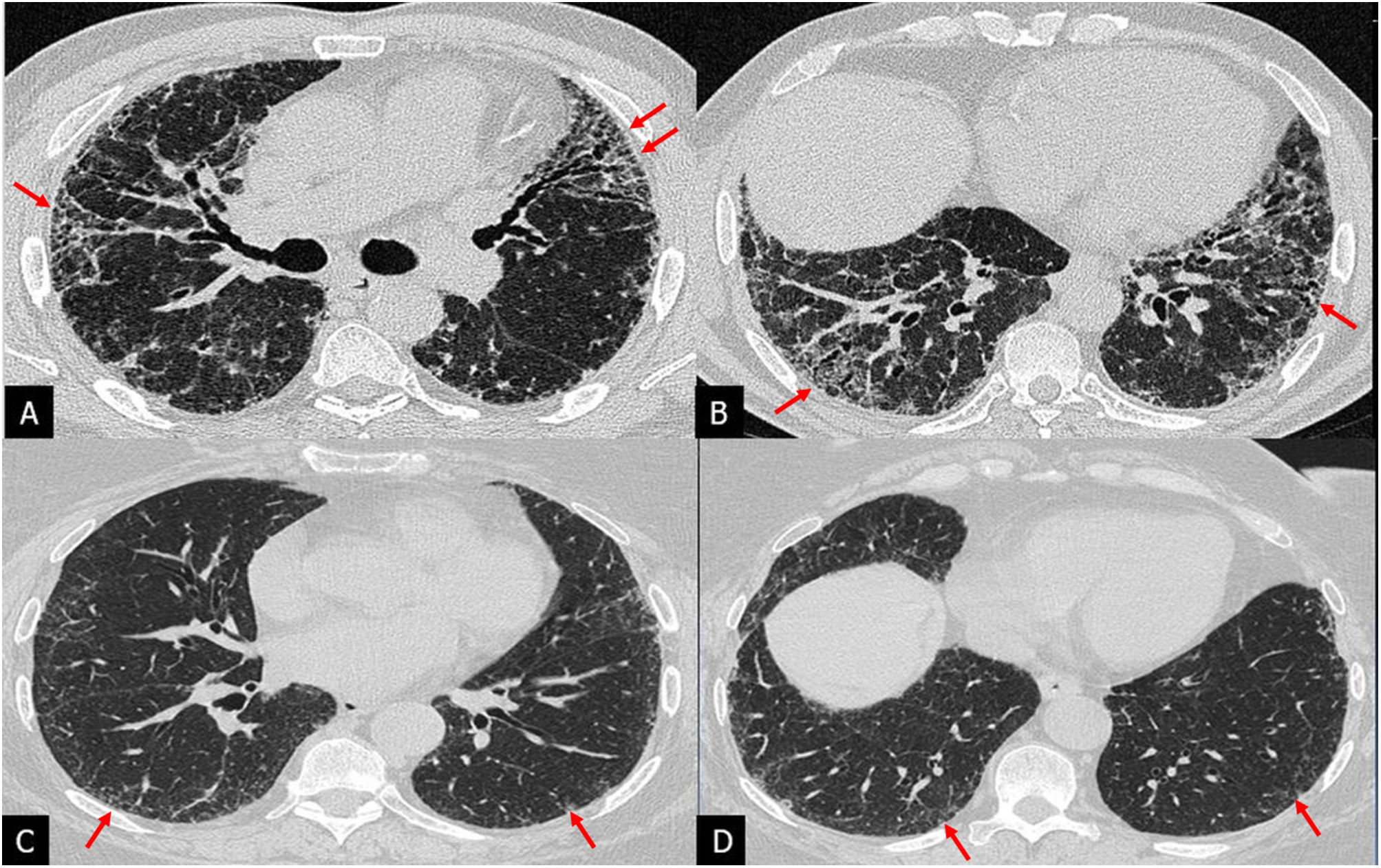
Patrón de probable NIU: incluye los mismos hallazgos que el patrón de NIU, excepto la panalización. Se han descrito los hallazgos precisos en la TCAR que debe presentar este patrón: predominio basal de la reticulación, distribución heterogénea (parcheada, alternando con zonas no afectadas, en relación con la heterogeneidad temporal y espacial del patrón de NIU histológico) y no segmentaria (sin respetar las cisuras), distorsión lobulillar y presencia de bronquiectasias y bronquioloectasias de tracción (fig. 4).
Patrón de probable neumonía intersticial usual (NIU) en 3 pacientes con fibrosis pulmonar idiopática. A) Tomografía computarizada de alta resolución (TCAR) en el plano axial que muestra bronquiolectasias de tracción con opacidades reticulares subpleurales de predominio basal (flechas). No se identifica panal. B) TCAR en plano axial con patrón de probable NIU con calcificaciones periféricas indicativas de osificación pulmonar dendriforme (flechas). C y D) Patrón de probable NIU en TCAR y en reconstrucción de mínima intensidad de proyección (minIP) que visualiza mejor las bronquiectasias y bronquiolectasias de tracción (flechas).
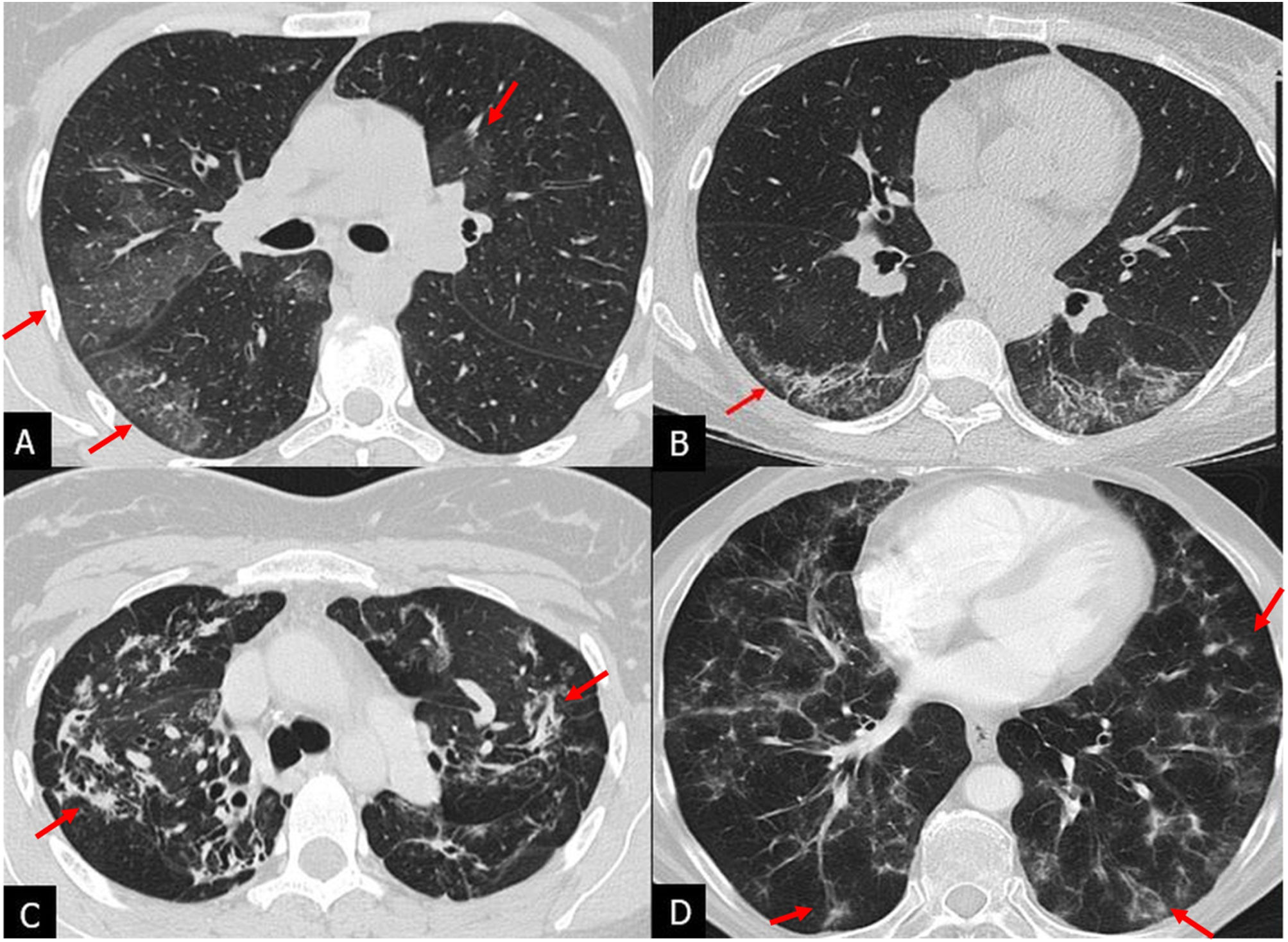
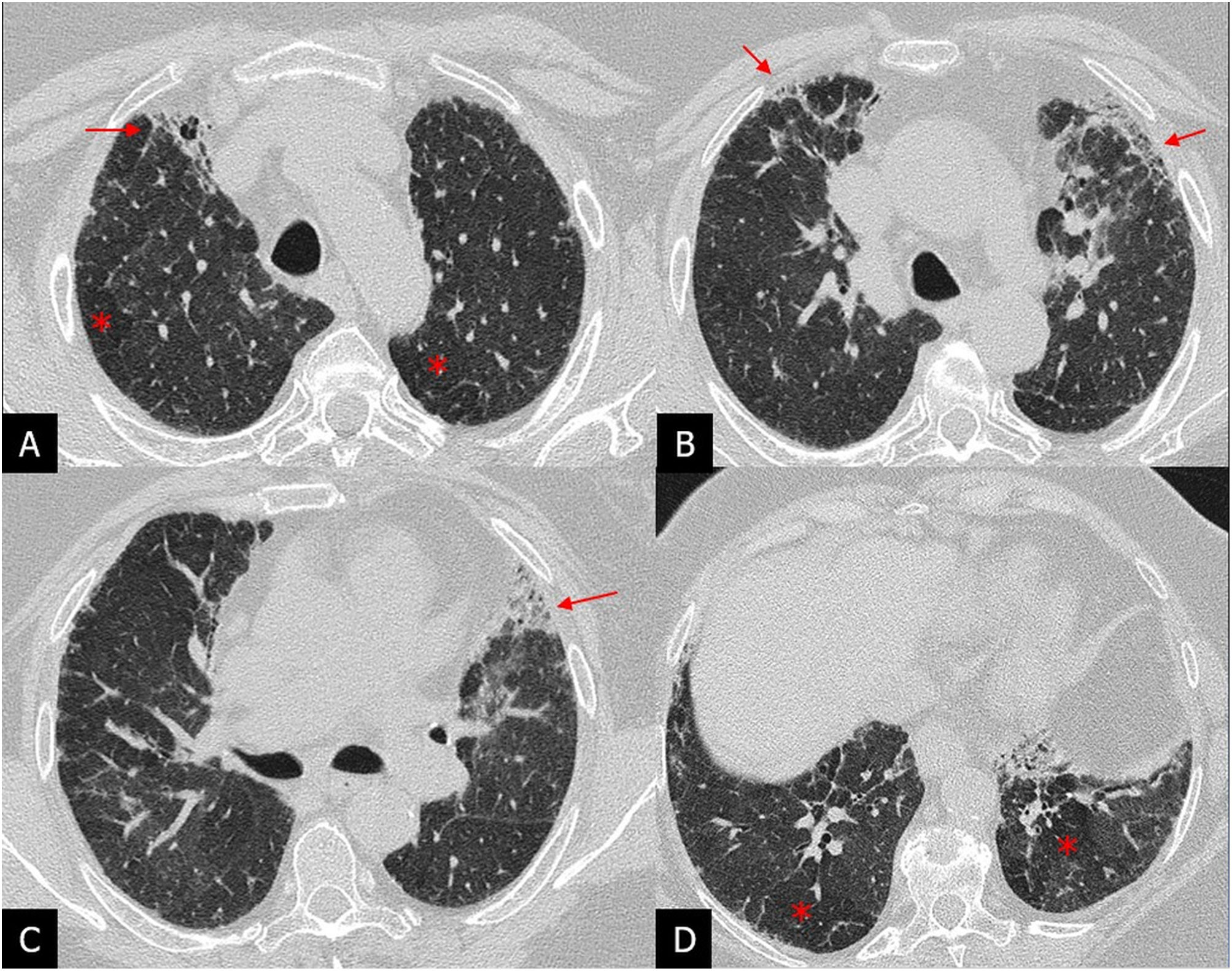
Patrón indeterminado para NIU: aparece cuando la fibrosis no tiene distribución predominante periférica subpleural o basal o cuando coexiste con otros hallazgos, como consolidaciones, extenso vidrio deslustrado, nódulos, quistes no de panal o áreas de atrapamiento aéreo. Este patrón presenta características que plantean su diagnóstico diferencial con otras enfermedades fibrosantes, fundamentalmente la neumonitis por hipersensibilidad fibrótica y la NINE. En este patrón se incluía la NIU incipiente o early UIP en la guía ATS/ERS/JRS/ALAT del 20183 (fig. 5).
Patrón indeterminado de neumonía intersticial usual en 2 pacientes con diagnóstico de fibrosis pulmonar idiopática diagnosticada mediante biopsia pulmonar. A y B) Tomografía computarizada de alta resolución (TCAR) en el plano axial que muestra extensas opacidades en vidrio deslustrado y reticulares peribroncovasculares asociadas a bronquiectasias de tracción con menor afectación posterobasal (flechas). C y D) TCAR en plano axial con tenues opacidades reticulares subpleurales de predominio basal (flechas) sin bronquiectasias de tracción.
Patrón de diagnóstico alternativo o con características inconsistentes con el diagnóstico de FPI: en estos casos los hallazgos radiológicos y su distribución orientan hacia otro tipo de fibrosis; por ejemplo, fibrosis con distribución peribroncovascular de predominio en los campos superiores, con presencia de vidrio deslustrado (en ausencia de agudización) asociada a atrapamiento aéreo en zonas no fibróticas, sugiere neumonitis por hipersensibilidad fibrótica (fig. 6).
Patrón indicativo de diagnóstico alternativo a fibrosis pulmonar idiopática. Imágenes de tomografía computarizada de alta resolución en el plano axial de 4 pacientes. A) Opacidades en vidrio deslustrado de distribución periférica en un paciente con neumonía eosinófila (flechas). B) Opacidades en vidrio deslustrado y reticulares periféricas y bronquiolectasias de tracción bibasales que respetan la zona subpleural (flechas) en un paciente con patrón de neumonía intersticial no específica. C) Bronquiectasias de tracción con marcada distorsión parenquimatosa peribroncovascular en campos superiores (flechas) en un paciente con sarcoidosis fibrótica. D) Focos parcheados en vidrio deslustrado peribroncovasculares (flechas) en un paciente con neumonía organizada.
Cada uno de estos patrones tiene un valor predictivo positivo (VPP) para la NIU histológica7. Es mayor del 90% en el patrón de NIU y si no hay causa conocida de fibrosis permite realizar el diagnóstico de FPI sin necesidad de biopsia pulmonar. El VPP en el patrón de probable NIU es aproximadamente del 80% y en un contexto clínico adecuado, y sin causas conocidas de fibrosis, permite realizar el diagnóstico de NIU sin necesidad de biopsia pulmonar. El patrón indeterminado para NIU tiene un VPP de aproximadamente el 50% y el patrón de diagnóstico alternativo inferior al 50%; por tanto, para diagnosticar una FPI en estos 2 últimos grupos de pacientes será necesario realizar una biopsia pulmonar y el diagnóstico final dependerá de la combinación de los hallazgos radiopatológicos7.
La última actualización de la guía ATS/ERS/JRS/ALAT, de mayo del 20227, presenta algunos cambios menores en los patrones radiológicos de NIU respecto a la del 20183. En la tabla 1 se muestran las principales características de los patrones de TCAR y las diferencias entre las guías Fleischner4 y ATS/ERS/JRS/ALAT del 2022.
En todo informe radiológico de valoración de una posible FPI tendría que figurar el patrón de NIU y el posible diagnóstico diferencial si el patrón es indeterminado o no indicativo de FPI.
Diagnóstico diferencial del patrón de NIU y de la FPIEl patrón de NIU, si bien es característico, no es exclusivo de la FPI, y podemos verlo en otras neumopatías intersticiales, principalmente en la NINE fibrótica, neumonitis por hipersensibilidad fibrótica (NHF), enfermedades del colágeno (especialmente la artritis reumatoide) y la neumonía intersticial con características autoinmunes (IPAF), la asbestosis, la sarcoidosis en estadio IV y las enfermedades por exposición y por fármacos25. El diagnóstico diferencial más importante y común es con la NINE fibrótica, con la NHF y con las enfermedades del colágeno. El reconocimiento de otros hallazgos adicionales al patrón de NIU en la TCAR puede orientarnos a un diagnóstico alternativo de FPI25,26 (tabla 2).
Hallazgos adicionales en TCAR asociados al patrón de NIU que indican un diagnóstico alternativo a la FPI
| Hallazgos adicionales | Diagnóstico probable |
|---|---|
| Nódulos centrolobulillares | Neumonitis por hipersensibilidad fibrótica |
| Patrón de atenuación en mosaico-atrapamiento aéreo (especialmente en áreas sin fibrosis) | |
| Fibrosis que respeta relativamente las bases pulmonares | |
| Placas pleurales calcificadas | Asbestosis |
| Panal exuberante | EPI asociada a colagenopatías |
| Distribución atípica del patrón de NIU: | |
| «Signo del lóbulo anterior y superior» | |
| «Signo del borde recto» | |
| Derrame pleural. Engrosamiento pleural | |
| Dilatación esofágica | |
| Adenopatías calcificadas | Silicosis-sarcoidosis |
| Nódulos pulmonares de distribución perilinfática | |
| Enfisema c/s vidrio deslustrado | EPI asociada al tabaco. CFPE |
| Engrosamientos pleuroparenquimatosos apicales | FEPP |
| Erosión clavicular distal | EPI asociada a AR |
| Hiperatenuación del parénquima hepático | Toxicidad a amiodarona |
AR: artritis reumatoide; CFPE: combinación fibrosis pulmonar y enfisema; EPI: enfermedad pulmonar intersticial; FEPP: fibroelastosis pleuroparenquimatosa; FPI: fibrosis pulmonar idiopática; NIU: neumonía intersticial usual; TCAR: tomografía computarizada de alta resolución.
En la NINE puede haber panal, aunque es leve y no es el hallazgo predominante, como lo son las opacidades en vidrio deslustrado asociadas a las bronquiectasias de tracción. Si bien los hallazgos coinciden con los de la FPI en que la localización basal es la más frecuente, las opacidades en vidrio deslustrado suelen respetar el espacio subpleural y las bronquiectasias de tracción tienen una distribución parcheada y más peribroncovascular que subpleural, como en el caso de la NIU5. Cuando la NINE presenta progresión fibrótica, los hallazgos de fibrosis asumen una disposición similar al patrón de NIU, por lo que es importante tener acceso a exploraciones previas para valorar la evolución27.
Neumopatía intersticial asociada a colagenopatíasLas enfermedades del colágeno y la IPAF se van a manifestar más frecuentemente con un patrón de NINE o de neumonía organizada o una combinación de ambas. En el caso de que se presenten con un patrón de NIU se han descrito 3 signos radiológicos que son más frecuentes en estas entidades que en la FPI; estos son el signo del panal exuberante, el signo del borde recto y el signo del lóbulo superior y anterior (fig. 7). El panal exuberante se refiere a la fibrosis pulmonar casi en forma exclusiva de panal, constituyendo una panalización extensa que afecta a más del 70% de las zonas fibróticas del pulmón; el signo del lóbulo superior y anterior es la fibrosis predominante en las regiones anteriores de los lóbulos superiores con afectación concomitante de los lóbulos inferiores, y el signo del borde recto es la delimitación de un borde nítido que separa las áreas de fibrosis del pulmón sano en el plano craneocaudal28.
Signo del panal exuberante y signo del borde recto en un paciente con enfermedad mixta del tejido conectivo. Tomografía computarizada de alta resolución (TCAR) en el plano axial que muestra extensa panalización (flechas) de predominio basal (A) e imagen de TCAR en el plano coronal con delimitación nítida del panal respecto al parénquima pulmonar sano (flechas).
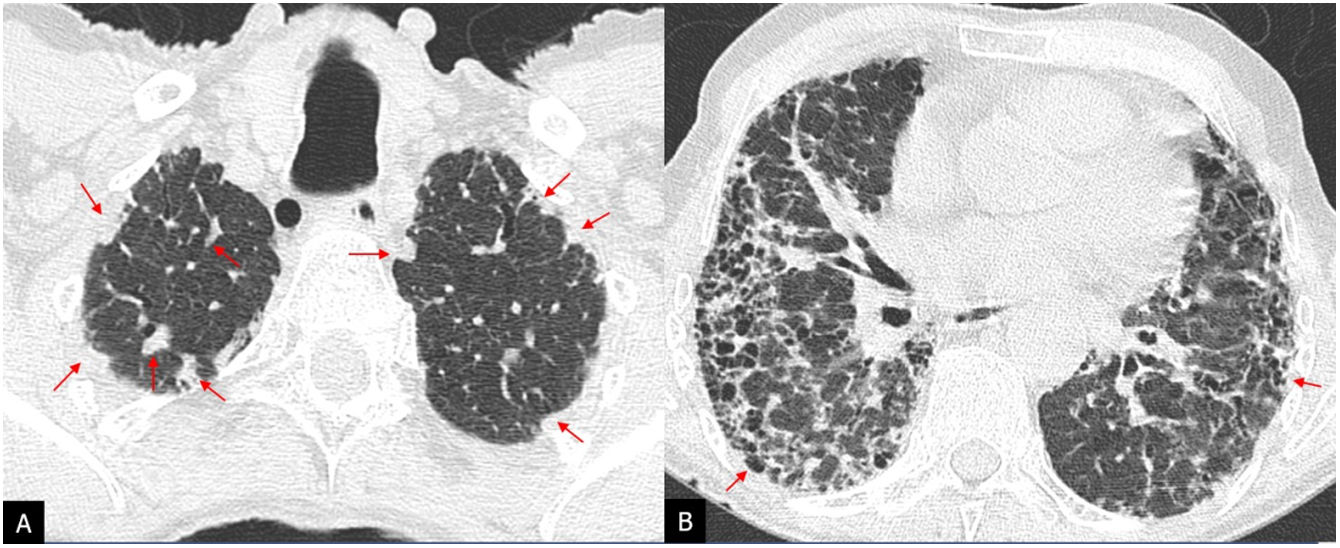
Aunque clásicamente se ha considerado que la fibrosis en la NHF predomina en campos pulmonares superiores, siendo una característica distintiva de la FPI29, se ha visto que la fibrosis asociada a la NHF afecta a los campos pulmonares inferiores en más del 50% de los casos. El panal puede estar presente y ser extenso en las formas graves y ser indistinguible del de una FPI30. El patrón de NIU ha sido incluido en la guía multidisciplinar de diagnóstico de la NH de la ATS/JRS/ALAT del 2020 en la categoría de TCAR compatible con NHF31. Los hallazgos adicionales que deben hacer sospechar una NHF en un patrón de NIU son la presencia de afectación de la pequeña vía aérea en forma de nódulos centrolobulillares mal definidos o el patrón de atenuación en mosaico de morfología lobulillar o el patrón de 3 densidades, altamente específico de NHF, o el atrapamiento aéreo en espiración, especialmente si está presente en las áreas sin fibrosis31,32 (fig. 8).
Paciente con neumonitis por hipersensibilidad fibrótica diagnosticada mediante biopsia pulmonar. A-D) Imágenes en el plano axial de tomografía computarizada de alta resolución que muestran signos de fibrosis parcheada con bronquiolectasias de tracción y pequeños quistes de panal (flechas) y patrón de atenuación en mosaico con áreas de hipoatenuación (asteriscos) indicativo de atrapamiento aéreo.
En ocasiones se va a requerir una biopsia pulmonar para realizar el diagnóstico de FPI cuando la historia clínica y la radiología no son suficientes.
La obtención de parénquima pulmonar para el diagnóstico en las EPID puede realizarse por biopsia transbronquial con pinza convencional o con la técnica de criobiopsia, así como mediante cirugía videoasistida. La información de la imagen y de la histología son la base para que el comité multidisciplinar pueda llegar al diagnóstico en todos los pacientes con sospecha de FPI.
Desde el año 2011, del mismo modo que ocurre en el ámbito de la radiología, el diagnóstico se realiza con grados de probabilidad, en relación con la presencia de todas las características de la NIU o solo alguna de ellas, siguiendo los criterios definidos en la literatura que fueron consensuados en 20183. Los conceptos para que el patólogo defina una determinada biopsia como de patrón de NIU, probable NIU, indeterminado para NIU y diagnósticos alternativos, se indican en la tabla 3. Una biopsia puede tener todos los criterios de NIU, pero si además muestra algún dato histológico contrario, como pueden ser granulomas o membranas hialinas, deja de ser un patrón de NIU.
Clasificación de los hallazgos patológicos de NIU
| Patrón NIU | Probable NIU | Indeterminado para NIU | Diagnósticos alternativos |
|---|---|---|---|
| Fibrosis densa con distorsión arquitectural, de predominio subpleural o paraseptal | Alguna de las características de la columna 1 | Fibrosis con o sin distorsión arquitectural con datos que indiquen enfermedad no-NIU o bien NIU secundariaa | Características de otros tipos de Neumonía intersticial no usual |
| Afectación fibrótica heterogénea | Además de: ausencia de datos que indiquen un diagnóstico alternativo | Presencia de algún dato de la columna 1, junto a datos que indiquen un diagnóstico alternativob | Datos histológicos de otras enfermedades: NH, LAM,HPCL |
| Presencia de focos fibroblásticos | O bien únicamente: panalización | ||
| Ausencia de datos que indiquen un diagnóstico alternativo |
HPCL: histiocitosis pulmonar de células de Langerhans; NH: neumonitis por hipersensibilidad; NIU: neumonía intersticial usual; LAM: linfangioleiomiomatosis.
Granulomas, membranas hialinas, lesiones centradas en la vía aérea, agregados inflamatorios sin fibrosis, inflamación pleural, neumonía organizada.
Denso infiltrado linfocitario en zonas sin panalización, hiperplasia linfoide con centros germinales, distribución bronquiolocéntrica de las lesiones.
Modificado de Raghu et al.3.
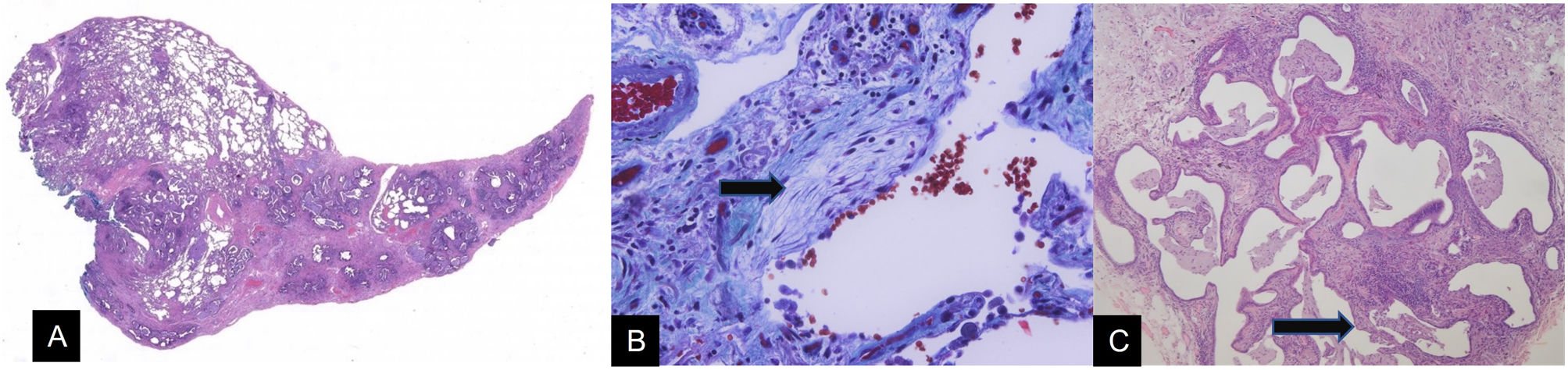
El patrón de NIU se basa en la distribución heterogénea de las lesiones del parénquima pulmonar, de forma que simultáneamente se aprecian lesiones con mayor o menor grado de afectación, incluso mezcladas con áreas de parénquima sano. Estas lesiones heterogéneas se hallan constituidas por fibrosis en el intersticio, que provoca distorsión de la arquitectura pulmonar. Se aprecia siempre una tendencia microscópica al predominio de la afectación subpleural o paraseptal, que es de mayor gravedad que en las zonas centrales del lobulillo secundario (fig. 9A). El tejido fibroso tiene clara tendencia al depósito de fibras colágenas, si bien se asocia también a focos de proliferación celular con matriz amorfa y sin fibras colágenas, que se denominan focos fibroblásticos (fig. 9B). Estos focos se han convertido en las últimas clasificaciones en un punto fundamental para el diagnóstico del patron de NIU. La máxima alteración del parénquima pulmonar consiste en el desarrollo de zonas del denominado panal de abeja, término este que refleja una situación de espacios aéreos grandes, seudoquísticos con paredes rígidas (fig. 9C). Esta panalización corresponde al momento final de alteración de la arquitectura que se aprecia en las neumonías intersticiales. Histológicamente los espacios aéreos anómalos son grandes y se encuentran tapizados por epitelio bronquiolar. En estos espacios aéreos se va acumulando material de secreción mucoide, procedente de las células del revestimiento epitelial. La imagen resultante es de ocupación variable de los espacios por el material mucoide retenido, con mezcla de espacios aéreos ventilados, libres y espacios ocupados por secreciones acumuladas. El último componente es el infiltrado inflamatorio de tipo mononuclear de distribución irregular, sin formar agregados significativos. Este último aspecto es relevante, ya que la presencia de agregados linfocitarios con centros germinales abre diversas opciones de diagnóstico diferencial entre las que destacan la asociación de EPID con enfermedades autoinmunes sistémicas, como la artritis reumatoide.
A) Imagen histológica a pequeño aumento de un patrón de neumonía intersticial usual (NIU). Se aprecia distorsión arquitectural de predominio subpleural, con afectación heterogénea del parénquima pulmonar (H&E 10×). B) Imagen a gran aumento de una zona de parénquima pulmonar con inflamación y fibrosis, apreciándose un foco fibroblástico (flecha), que se identifica por la palidez de su matriz. Tricrómico de Mallory 400×. C) Imagen de aproximación a una zona de panalización pulmonar (flecha) correspondiente a un patrón de NIU. En este pulmón destaca la heterogeneidad del componente inflamatorio y fibrosante, con preservación focal de algunos septos (H&E 40×).
La valoración multidisciplinar de un paciente con una neumopatía intersticial fibrosante es básica para establecer el diagnóstico, determinando la necesidad de biopsia u otras pruebas diagnósticas. Para la valoración de los patrones de TCAR y la necesidad de biopsia es imprescindible incluir el contexto clínico adecuado de FPI, la ausencia de una exposición ambiental o medicamentosa y la exclusión de enfermedades del colágeno3,4.
La guía Fleischner introduce el concepto de working diagnosis o diagnóstico de trabajo/provisional de FPI en aquellos casos en que no pueda obtenerse biopsia en una neumopatía intersticial fibrosante sin patrón característico por TCAR y en ausencia de un diagnóstico alternativo. Este diagnóstico de trabajo debe revisarse a intervalos regulares, para confirmar la FPI o cambiar el diagnóstico a otra neumopatía fibrosante.
La guía de la ATS/ERS/JRS/ALAT del 2018 define combinaciones específicas de patrones de TCAR y de patrones histopatológicos en pacientes con biopsia pulmonar. En la última guía del año 2022, además, se considera la importancia de la criobiopsia transbronquial, siendo menos invasiva y costosa que la biopsia quirúrgica, incluyéndola en el algoritmo diagnóstico como alternativa a la biopsia quirúrgica en centros con experiencia en el procedimiento e interpretación de las muestras7, coincidiendo con lo publicado previamente en España33.
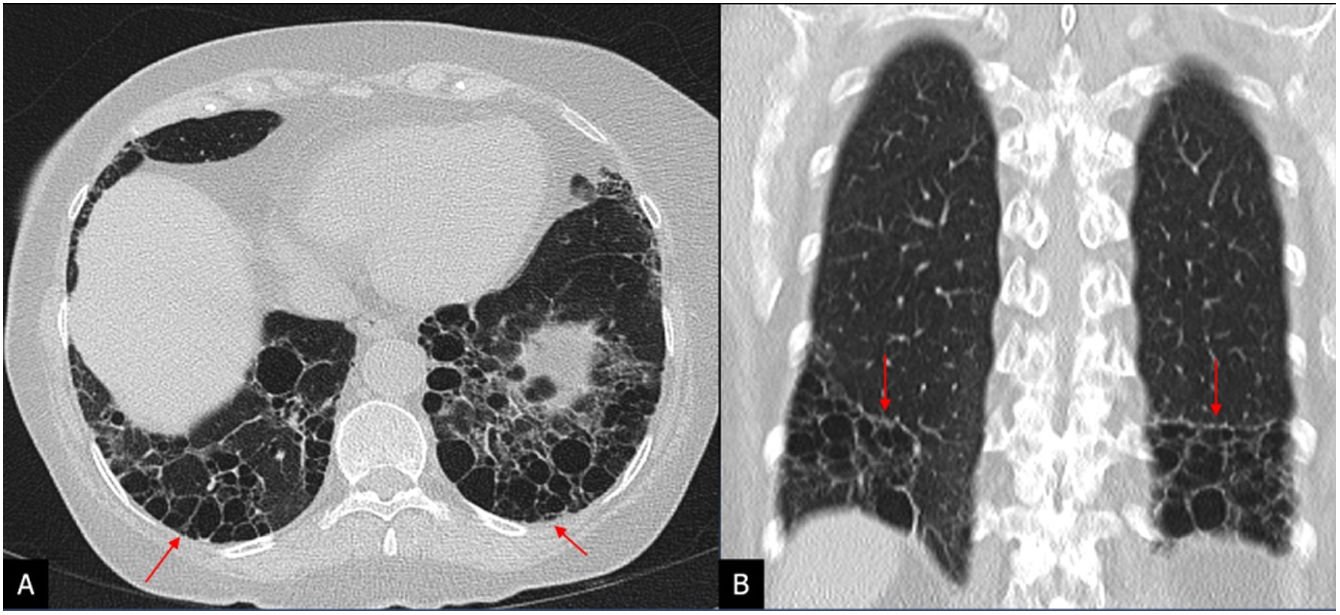
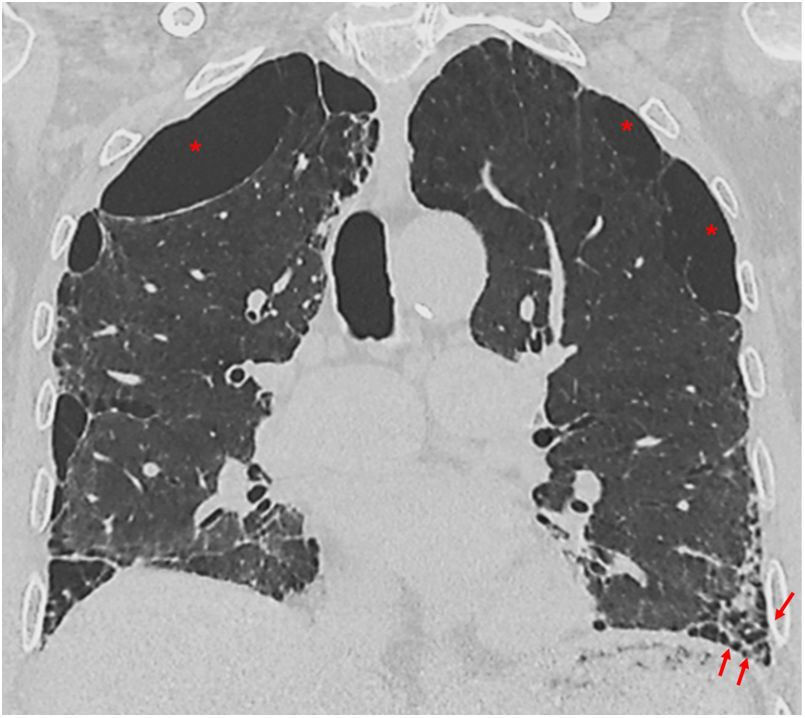
Entidades patológicas asociadas a la FPIFibroelastosis pleuroparenquimatosaLos pacientes con patrón de NIU pueden tener asociadas características de la fibroelastosis pleuroparenquimatosa (FEPP) con los típicos engrosamientos pleuroparenquimatosos de predominio en los lóbulos superiores, densas consolidaciones subpleurales con bronquiectasias de tracción y pérdida de volumen. La FEPP se asocia a FPI en un 6-10% y se ha descrito en estos pacientes una peor función pulmonar y un peor pronóstico en comparación con los pacientes sin FEPP34. Los pacientes que cumplan criterios de FPI deben ser considerados como tal a pesar de que tengan la asociación del patrón de NIU y FEPP, dado que esta superposición aún no ha sido considerada como entidad independiente3,4 (fig. 10).
Fibroelastosis pleuroparenquimatosa asociada a un patrón de neumonía intersticial usual (NIU) en un paciente con fibrosis pulmonar idiopática. Tomografía computarizada de alta resolución en el plano axial que muestra engrosamientos pleuroparenquimatosos apicales en A (flechas) con patrón de NIU de predominio basal con quistes de panal en B (flechas).
Muchos pacientes con FPI son fumadores o exfumadores y pueden presentar enfermedad pulmonar asociada al tabaco juntamente con la fibrosis. Aproximadamente un tercio de los pacientes con FPI tienen enfisema35. La entidad de la combinación de fibrosis pulmonar y enfisema (CFPE) clásicamente corresponde a la coexistencia de enfisema en lóbulos superiores con un patrón de NIU de predominio basal (fig. 11). El concepto de CFPE ha sido recientemente revisado en un documento multidisciplinar publicado por la ATS/ERS/JRS/ALAT y propone ampliar la entidad a diferentes patrones de fibrosis pulmonar (reticulación o vidrio deslustrado, panal o bronquiectasias de tracción) definidos por TCAR o anatomía patológica (NINE fibrótica, NH fibrótica, etc.)36. Los pacientes con CFPE tienden a tener un curso clínico y radiológico diferente en comparación con los que presentan solo FPI o enfisema, con mayor incidencia de comorbilidades como la hipertensión pulmonar (HTP) y el cáncer de pulmón, por lo que es importante reconocer esta entidad en la TCAR, ya que puede cambiar el pronóstico y el tratamiento del paciente36.
Seguimiento por TCAR. Complicaciones de la FPILa utilización de la TCAR en la práctica clínica para el seguimiento rutinario de los pacientes con FPI es controvertido y no recomendado en pacientes estables. La progresión radiológica es un factor pronóstico negativo de supervivencia. La realización de un seguimiento anual puede servir de marcador pronóstico y para identificar complicaciones como el cáncer de pulmón. Está indicado realizar TCAR en el seguimiento de estos pacientes cuando presenten un deterioro clínico/funcional inesperado, para valorar complicaciones como la EA, cuando exista un diagnóstico radiopatológico o radiológico no definitivo de NIU, un diagnóstico provisional, y se espera a la evolución para confirmar el diagnóstico4,37.
Exacerbación agudaLa definición actual de la EA es un deterioro respiratorio clínicamente significativo, agudo, típicamente en menos de un mes, y caracterizado por la aparición de nuevas opacidades alveolares38. Histopatológicamente el patrón característico es el daño alveolar difuso. Es un cuadro no exclusivo de la FPI y puede ocurrir en cualquier neumopatía intersticial crónica. En la TCAR veremos opacidades en vidrio deslustrado o consolidaciones bilaterales, sobre un pulmón fibrótico subyacente. Hay que valorar correctamente el cuadro clínico y radiológico para no informar la TC como «más sugestivo de un diagnóstico no FPI o de diagnóstico alternativo» dada la presencia de vidrio deslustrado y consolidación, y valorarlo como EA de una neumopatía intersticial fibrosante previa5. En ausencia de una TCAR previa, las opacidades en vidrio deslustrado bilaterales o consolidaciones bilaterales en un patrón de NIU son altamente indicativas de una EA (fig. 12).
Exacerbación aguda en paciente con fibrosis pulmonar idiopática en tratamiento antifibrótico. A y B) Tomografía computarizada de alta resolución en el plano axial adquirida previa al episodio de exacerbación aguda que muestra un patrón de neumonía intersticial usual con quistes de panal subpleural (flechas). C y D) Angio-TC pulmonar para descartar tromboembolia pulmonar con aparición de extensas opacidades en vidrio deslustrado superpuestas al patrón intersticial indicativas de una exacerbación aguda.
La FPI se asocia con una mayor incidencia de cáncer de pulmón, especialmente en fumadores y exfumadores. El cáncer de pulmón ocurre en alrededor de un 10% de los pacientes con FPI y empeora de forma importante el pronóstico de la enfermedad39. Parece más frecuente el carcinoma escamoso y suele tratarse de lesiones periféricas de predominio en los lóbulos inferiores, en las zonas de fibrosis, a diferencia de lo que ocurre en la población general, en la que predomina en los lóbulos superiores40. Debido a que los cánceres en la FPI tienen una propensión a originarse en áreas adyacentes a la fibrosis o en las regiones de fibrosis con distorsión de la arquitectura pulmonar, el retraso en el diagnóstico es frecuente41. Ante la sospecha de cáncer en un paciente con FPI, lo aconsejable es recomendar TC de seguimiento precoz o tomografía por emisión de positrones-TC.
Otras complicaciones en estos pacientes son las infecciones por micobacterias o Aspergillus, el neumotórax o el neumomediastino, la tromboembolia pulmonar (TEP) y la HTP. El neumotórax y el neumomediastino espontáneos que ocurren en estos pacientes se consideran eventos de mal pronóstico42,43. Si bien la HTP en la FPI no suele ser grave, la demostración de un cociente entre el diámetro de la arteria pulmonar y el de la aorta mayor de 1 (AP/Ao> 1) se asocia a una peor evolución en pacientes con FPI44.
Dado que la TEP y la EA deben descartarse ante un empeoramiento agudo de la disnea en un paciente con FPI conocida, se recomienda adquirir una angio-TC pulmonar sola o en combinación con TCAR para la valoración del parénquima pulmonar3.
ConclusionesEl radiólogo desempeña un papel fundamental en el diagnóstico de la FPI. La TCAR es la herramienta fundamental y tenemos que conocer los diferentes patrones radiológicos de la FPI en su clasificación más actual y su diagnóstico diferencial con otras neumopatías intersticiales fibrosantes. Los patrones típico y probable de NIU en el contexto clínico adecuado obvian la biopsia quirúrgica. Los patrones indeterminado y no indicativo de FPI, y cualquier patrón radiológico fuera del contexto clínico de FPI, van a precisar de una discusión multidisciplinar y la valoración de biopsia pulmonar para su diagnóstico. El diagnóstico temprano es importante para la instauración del tratamiento necesario. La TC de seguimiento no está claramente indicada, aunque puede ofrecer información pronóstica o ser necesaria para alcanzar un diagnóstico basado en la evolución en pacientes no tributarios de biopsia.
AutoríaTodos los autores han hecho contribuciones sustanciales en los siguientes aspectos: 1) la concepción y el diseño del estudio, o la adquisición de datos, o el análisis y la interpretación de los datos; 2) el borrador del artículo o la revisión crítica del contenido intelectual, Y 3) la aprobación definitiva de la versión que se presenta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.